Method Article
Création anatomique précise et reproductible intracrânienne xénogreffes de tumeurs cérébrales humaines
Dans cet article
Résumé
Le cerveau est un site unique avec des qualités qui ne sont pas bien représentés par des analyses in vitro ou extra-utérines. Des modèles de souris orthotopique avec l'emplacement et les caractéristiques de croissance et reproductibles peuvent être créés de manière fiable avec des injections intracrâniennes en utilisant un instrument stéréotaxique de fixation et d'une pompe à seringue à basse pression.
Résumé
Des modèles de tumeur orthotopique sont actuellement la meilleure façon d'étudier les caractéristiques d'un type de tumeur, avec ou sans intervention, dans le cadre d'un animal vivant - en particulier dans les sites avec des qualités physiologiques et architecturaux uniques tels que le cerveau in vitro et des modèles ectopiques peuvent pas. tenir compte des caractéristiques telles que le système vasculaire, barrière hémato-encéphalique, le métabolisme, l'administration de médicaments et de toxicité, et une foule d'autres facteurs pertinents. Modèles orthotopiques ont leurs limites aussi, mais avec les cellules tumorales appropriées technique d'intérêt peuvent être greffées dans le tissu avec précision qui imite le plus étroitement des conditions dans le cerveau humain. En employant des méthodes qui fournissent des volumes mesurés précisément à définir avec précision les lieux à un taux constant et la pression, des modèles murins de tumeurs cérébrales humaines avec des taux de croissance prévisibles peuvent être créés de façon reproductible et sont appropriés pour une analyse fiable des diverses interventions. Le protocole décrit ici met l'accent sur la techniques détails de la conception et de la préparation d'une injection intracrânienne, d'effectuer la chirurgie, et d'assurer la croissance tumorale efficace et reproductible et offre des points de départ pour une variété de conditions qui peuvent être personnalisés pour une gamme de modèles de tumeurs cérébrales différentes.
Introduction
Des études in vitro de cellules tumorales du cerveau sont précieux pour disséquer les mécanismes moléculaires croissance, la survie, la migration et l'invasion des cellules cancéreuses d'entraînement; expériences sur des cellules en culture peuvent définir des voies de signalisation, de proposer des cibles thérapeutiques potentielles, et de caractériser la réponse cellulaire à un traitement médicamenteux. Mais systèmes in vitro sont beaucoup trop simpliste pour prédire la réponse organismal aux produits pharmaceutiques; ils n'ont pas les réactions physiologiques, les réponses immunitaires, microenvironnement cellulaire, et l'hétérogénéité globale des systèmes d'animaux vivants. Génétiquement modifiés modèles peuvent être très précieux, lorsqu'ils sont disponibles, mais les différences moléculaires exister entre les espèces et les cellules murines peut pas récapituler les événements dans les processus humains, ce qui entraîne des différences significatives lorsque l'on compare les modèles animaux à des observations cliniques 1. Des modèles de xénogreffes de souris portant sous-cutanée (SQ) injection de lignées de cellules tumorales du cerveau humain sous la peau du flanc sont faciles à réaliseret mesurer; ils peuvent être utilisés pour étudier les effets de la modification du gène et l'administration du médicament / distribution, le métabolisme et la toxicité. Inconvénients importants, cependant, limitent l'utilité des modèles de la SQ. Le microenvironnement récapituler ne pas celle d'une tumeur du cerveau d'origine naturelle: les interactions entre les différents types de tissus et de cellules; la vascularisation locale, et une myriade d'autres facteurs propres à le cerveau ne peuvent pas être répliquées. Pour reproduire plus fidèlement le milieu unique d'une tumeur au cerveau naturel et de tester les effets des interventions pharmaceutiques, un modèle orthotopique de la souris doit être utilisé. En outre, les techniques orthotopiques peuvent être utilisés dans le cadre d'une approche transgénique dans lequel les cellules non-cancéreuses humaines primaires (différenciées ou progénitrices) sont génétiquement modifiés et injecté dans le site approprié de la souris, avec ou sans cellules de stroma humaines, ce qui entraîne dans la tumorigenèse similaire à celle observée chez l'homme 1.
Cet article décritune méthode pour créer de manière précise et reproductible des tumeurs du cerveau chez les souris. En utilisant cette technique, l'utilisateur peut injecter avec précision une petite aliquote de cellules en suspension dans un emplacement déterminé de la région fronto-pariéto-temporales du cortex cérébral de souris. Mortalité de la souris est extrêmement faible; dans nos mains, pas de souris sont mortes de complications chirurgicales après 185 procédures. Les caractéristiques de la tumeur résultante peut être comparée avec celle des tumeurs cliniques humains typiques; par exemple: la rapidité de la croissance, degré de nécrose, l'étendue de l'invasion, l'hétérogénéité de type cellulaire, la présence de cellules en mitose, les marqueurs de prolifération et de l'apoptose, etc lignées cellulaires ou des échantillons ventilées de tissus ou tumeurs humaines peuvent être évalués en fonction de leur capacité à simuler la présentation clinique actuelle. Pharmaceuticals, sélectionnés en fonction de leur performance en culture cellulaire, peut être testé dans le cadre d'un métabolisme de fonctionnement, le système circulatoire, et barrière hémato-encéphalique, telles qu'elles existent dans un esprit animal chargéha tumeur, le tout dans un contexte architectural pertinent. En outre, les cellules choisies pour injection peuvent être génétiquement modifiés pour étudier l'impact de passes rabattues spécifiques, suppressions, knock-in, mutations, etc sur la croissance tumorale et la survie.
Un certain nombre de publications de documenter les études de tumeurs en utilisant une variété de techniques intracrâniennes. Yamada et al. Fait une étude détaillée de l'injection de colorant et de cellules U87 et a constaté que le taux de minimiser le volume et l'injection a produit le meilleur tumeur 2. . Brooks et al ont trouvé une reproductibilité supérieure et l'efficacité au moyen d'un injecteur commandé par microprocesseur plutôt que d'un procédé manuel pour fournir les vecteurs viraux; leurs conclusions sur les paramètres d'injection optimales sont applicables à la prestation de la cellule 3. Shankavaram et al. Ont montré que le glioblastome multiforme (GBM) lignées de cellules injectées orthotopique (en utilisant une méthode manuelle) dans le cerveau a récapitulé le profil d'expression génique de la cltumeurs inical plus étroitement que ce soit dans les xénogreffes in vitro ou la SQ, en soutenant l'utilisation de modèles intracrâniennes pour les études précliniques 4. Giannini et al. Cellules à partir de spécimens chirurgicaux humains qui avaient été subies dans les flancs de souris nude par passage en série dans le cerveau de souris supplémentaires injecté, et a montré que cette approche conservé patients altérations du gène de la tumeur dans le modèle 5. Des résultats similaires ont été rapportés par Yi et al 6. En utilisant une configuration stéréotaxique, site d'injection soigneusement défini, et une vitesse d'injection lente et régulière, ils ont obtenu des tumeurs cérébrales reproductibles avec des taux de croissance élevé et uniforme (100%) le taux de prise de greffe. La validité de cette technique a donc été bien établie; une recherche de la littérature suggère que les applications de cette technique sont nombreux. Carty et al. Utilisé injections intracrâniennes à mener à bien des vecteurs viraux exprimant des gènes thérapeutiques dans le cortex frontal de transgenic modèle de la maladie d'Alzheimer 7. Thaci et al. Décrit l'utilisation d'injections intracrâniennes à fournir un adenovirus oncolytiques thérapeutique dans un support à base neurale des cellules souches dans des souris nude portant des tumeurs de glioblastome orthotopique déjà injectées 8. De toute évidence, les injections intra-crâniennes sont un outil polyvalent et efficace pour la recherche préclinique. Publications antérieures dans The Journal of Experiments visualisées décrivent approches fondamentales 9-11, mais nous prenons le concept de l'injection de tumeur intracrânienne et la modélisation orthotopique à un niveau supérieur de précision utilisant la technologie facile à maîtriser.
Protocole
Toutes les procédures décrites ont été examinés et approuvés par notre comité de protection des animaux et l'utilisation institutionnelle.
1 plan de l'Expérience
- Choisir les cellules à injecter. Les cellules provenant de différentes sources sont des candidats pour l'injection: les lignes de culture de cellules adhérentes, les clones génétiquement modifiées, les cellules de neurosphères, de cultures primaires ou de tumeurs ventilées. Le type de modèle désiré définir l'emplacement le plus approprié de l'injection.
- Déterminer le nombre de cellules pour injection. Le nombre de cellules nécessaires pour former des tumeurs varie en fonction de la lignée cellulaire et doit être déterminée de manière empirique; le taux de croissance tumorale dépend fortement du type de cellule, le nombre de cellules et la culture de tissus nombre de passage. Les nombres de cellules allant de 1 x 10 4 à 2 x 10 5 ou plus par injection ont produit des tumeurs de différents taux de croissance.
- Limiter le volume pour injection. Les cellules doivent être suspendus dans le plus petit volume de milieu sans sérum ou un tampon de phosphate dealine (PBS) qui permet de lisse, passage facile à travers une aiguille 26 G. Plus le volume effectivement administré dans le cerveau, plus précis et défini de la tumeur résultante; les meilleurs résultats sont obtenus en injectant des volumes variant entre 3 et 6 ul. Plan de préparer un volume total final d'au moins 50 pi de cellules en suspension, quel que soit le nombre d'injections prévues, afin de permettre une mesure précise, le mélange et l'échantillonnage.
- Choisissez souris approprié pour le modèle. Les modèles murins de tumeurs humaines utilisent généralement les jeunes souris immunodéprimées pour éviter le rejet du greffon immunitaire à médiation. Il n'est pas nécessaire pour le travail de prendre place dans une enceinte de sécurité biologique si des précautions appropriées soient prises, y compris la décontamination, la désinfection et la stérilisation des matériels et équipements. Le travail présenté ici a été fait chez la souris nude athymiques, hommes et femmes, entre 6 et 12 semaines d'âge. Les souris qui pèsent moins de 20 g peut être difficile à positionner en tant quecadre tereotaxic et peut-être plus sensibles à l'hypothermie.
2 Montez l'équipement
- Obtenir et décontaminer une souris cadre stéréotaxique, console d'alignement, et support de tête de l'anesthésie au gaz de la souris, pompe à microseringue, pad thermique, l'appareil d'anesthésie, lampe de travail de la fibre optique, et forage rotatif à vitesse variable. Nettoyer et désinfecter tout le matériel.
- Programmer les paramètres d'injection (dont le volume d'injection, le débit, les unités de débit, le type de seringue d'écoulement) et d'autres variables nécessaires pour le fonctionnement de la pompe à seringue. Optimiser les réglages pour chaque modèle particulier.
NOTE: Dans ces injections étaient les réglages 3.000 échantillons nl à un taux de 400 nl / min (unités de débit "M") en utilisant un 25 pi seringue (Device Type "E") mode dans le non-groupés ("N"). - Nettoyer une micro-précision avec 26 aiguille G avec plusieurs rinçages d'eau déminéralisée stérile (diH 2 O) et 70% d'éthanol (EtOH), faire un ri finalense avec diH 2 O. Certains, mais pas tous les modèles sont conçus pour être à l'autoclave. Assurez-vous que le mouvement du piston est lisse et libre.
- Obtenir de l'équipement de livraison anesthésie. L'isoflurane est l'anesthésique préféré car il est facile de régler la profondeur et la durée de l'anesthésie. S'assurer que l'appareil de stéréotaxie est équipé d'une fixation de gaz d'anesthésie et de la souris que les tubes et raccords nécessaires sont en place pour délivrer le mélange de gaz de l'appareil d'anesthésie de la souris.
- Outils chirurgicaux autoclave, y compris les ciseaux fine pointe, deux pinces hémostatiques / (avec les dents) pour les sutures, ciseaux, pince à épiler de taille moyenne à moyen et à pointe fine, et au moins deux dentaires forets de 1 mm. Gardez instruments propres au cours de la procédure avec EtOH à 70%, du désinfectant ou un stérilisateur à billes.
- Obtenir l'isoflurane, analgésique, pommade ophtalmique / lubrifiant, un onguent antibiotique, une solution saline, 30% de peroxyde d'hydrogène (H 2 O 2), un antiseptique, et de la cire d'os (si désiré) à partir d'unproduits vétérinaires ou médicaux. Préparation stérile diH 2 O et 70% d'EtOH. Jetables tels que des tampons de gaze, des pansements stériles, sutures, des tampons d'éthanol, coton écouvillons, des gants chirurgicaux stériles, lames chirurgicales et plus sont détaillés dans la liste des matériaux. Un marqueur permanent pointe fine pour marquer le crâne doit être décontaminé et destiné à un usage chirurgical.
3 Préparer les cellules pour injection
- Dans les expériences présentées ici, sélectionnez une lignée de cellules humaines immortalisées GBM. Déterminer le nombre de cellules (2 x 10 5) et le volume de la suspension à injecter (3 pi) de façon empirique; les détails peuvent varier avec le type de cellule. Utiliser un volume d'au moins 50 pi pour faciliter précis de mesure, le mélange et l'injection.
- Traitement à la trypsine et remettre en suspension dans les médias ou PBS. Effectuez les étapes suivantes juste avant l'injection de cellules:
- Retirez le support de cellules par aspiration et rincer avec 10 ml de PBS par plaque de 100 mm; enlever PBS.
- Annonced 1 ml de trypsine à chaque plaque de 100 mm et incuber à température ambiante juste assez longtemps pour obtenir une suspension cellulaire unique.
- Arrêter l'activité de la trypsine avec 5 ml de milieu Eagle modifié de Dulbecco (DMEM) + 10% de sérum bovin fœtal (FBS) par plaque de 100 mm.
- cellules de pellets par centrifugation à 450 xg et remettre en suspension dans ~ 5 ml DMEM dépourvu de sérum (SF-DMEM) par plaque de 100 mm.
- Compter les cellules viables en utilisant un hématimètre ou un compteur de cellules automatisé.
- Ajuster la densité de cellules vivantes à 2 x 10 5 cellules / pl 3 (ou comme déterminé par expérimentation) par la granulation des cellules et remise en suspension dans du milieu DMEM SF-.
- Maintenir les cellules dans de la glace ou un pack de froid (ne pas laisser les cellules de gel). Mélanger doucement en tapotant du doigt.
4. Anesthetize et préparer souris pour la chirurgie
- Induire une anesthésie à l'aide ~ 5% d'isoflurane (oxygène flux ~ 2 L / min) ou comme dirigé par un vétérinaire. Induction devrait prendre 2 à 3 min. Maintenir la souris à une profondeur suffisantede l'anesthésie avec ~ 3% d'isoflurane.
- Contrôler la profondeur de l'anesthésie par pincement de l'orteil, ajuster l'isoflurane si indiqué et continuer à surveiller la respiration et des orteils réaction au pincement tout au long de la procédure. Couvrir la souris avec des tampons de gaze pour plus de chaleur et de surveiller régulièrement la souris tout au long de la procédure, qui peut prendre 45 min à 1 h, en fonction de la vitesse d'injection.
- Placez la souris dans un cadre stéréotaxique avec soin en glissant la barre de palais sur la langue et dans la bouche. Accrocher les incisives dans le trou de la dent. Utilisez barres d'oreilles à stabiliser la tête, avec la surface oreille à l'œil le plus près horizontale que possible. Ne forcez pas les bars dans le conduit auditif. Il est essentiel de positionner la tête en toute sécurité: vérifier mouvement d'un côté à l'autre et va-et-vient du bout des doigts. Utilisez les commandes réglables de l'appareil de stéréotaxie pour optimiser ajustement.
- Lubrifier les yeux avec pommade ophtalmique. Nettoyer la peau entre les oreilles et les yeux deux fois avec les applications alternées d'une povidone-iodine antiseptique et 70% d'EtOH.
- Injecter par voie sous cutanée analgésique choisi (SQ) dans le flanc (ou selon les directives).
5 Effectuez injection
- Déterminer le point d'injection. Le site d'injection peut varier en fonction de la taille et de la souche de la souris et du type de cellule. Cellules injectées trop près des ventricules peuvent conduire à cranio-spinale propagation de la maladie. Cellules injectées trop peu profonde peuvent se développer à travers le trajet de l'aiguille.
REMARQUE: Dans les expériences présentées ici, la cible est définie comme la région frontale du cortex cérébral d'un site de 2,5 mm latéral (à droite), à 1,5 mm en avant, et de 3,5 mm ventral par rapport au bregma a été choisie (figure 1), la production d' une tumeur du cerveau moyen chez les souris allant de 20 à 30 g. - Faire une petite incision (~ 8 mm de longueur) en utilisant une technique stérile à travers la peau de la tête pour exposer le bregma et le site d'injection. Une coupe en diagonale, à partir d'un point situé entre l'axe de la ligne médiane et l'œil droit vers l'oreille droite ( La figure 2) permet d'accéder à la fois au bregma et le site d'injection.
- Rétracter la peau et utiliser un coton-tige stérile pour sécher la surface du crâne. Éponger l'os avec un autre coton-tige imbibé d'H 2 O 2 pour visualiser bregma. L'H 2 O 2 se produire des bulles d'oxygène, en laissant de minces lignes de mousse blanche le long des sutures coronale et sagittale qui se coupent au bregma.
- Verrouiller une seringue vide avec une aiguille sur la micro-pompe et manœuvrer la pointe de l'aiguille directement sur le bregma; les coordonnées de l'ensemble console d'alignement à 0,0 mm latéral, 0,0 mm antérieur / postérieur, et 0,0 mm ventral / dorsal.
- Déplacer l'aiguille de 2,5 mm latéral (à droite) et 1,5 mm en avant par rapport au bregma (ou emplacement désiré) en utilisant les boutons de commande de l'appareil de stéréotaxie. Soulevez légèrement la seringue et marquer l'emplacement exact sur le crâne avec un stylo-feutre dédié. Si la surface externe du crâne se trouve pas sur un plan de niveau avec bregma (i.e., la dorsale / ventrale coordonner plus lit zéro), réinitialiser le ventral / dorsal sur 0,0 à veiller à ce que la profondeur de l'injection n'est pas déplacé.
- Percez un petit trou dans le crâne avec un forage rotatif portatif équipé d'une pointe dentaire stérile sur le site approprié marqué avec le stylo dans l'étape 5.5. Tenir la perceuse à un angle par rapport au crâne et toucher très doucement la pointe de l'os. Répéter au besoin. Perçage presque, mais pas complètement à travers l'os, en laissant l'aiguille à pénétrer effectivement cette couche du crâne, des résultats de l'injection propre.
- Enlevez la poussière d'os avec un coton-tige imbibé dans du PBS ou une solution saline. Retour à la seringue de la pompe et abaisser l'aiguille vers le bas dans le trou de trépan pour confirmer l'emplacement. Si le trou de trépan n'est pas centré avec l'aiguille, utiliser la perceuse pour agrandir l'ouverture.
- Mélanger délicatement la suspension de cellules et d'en tirer les cellules dans la seringue en utilisant le contrôleur de pompe. Éviter les bulles et les touffes et essuyez l'esprit de l'aiguilleh d'un tampon imbibé d'alcool pour éliminer les cellules contaminantes sur la surface extérieure. Si la seringue / aiguille est bouché ou gelé, retirez rapidement et propre avec de l'eau stérile et EtOH à 70%.
- Abaissez l'aiguille au niveau de la surface du crâne (0.0 mm ventral / dorsal). Puis lentement (environ 1 min) abaisser l'aiguille pour percer à travers toute l'épaisseur du crâne et du cerveau pénétrer à une profondeur de 4 mm ventrall. Retirer l'aiguille lentement à 3,5 mm ventral. Si la tête de la souris est maintenu en l'unité stéréotaxique, il devrait y avoir presque aucun mouvement du crâne.
- Assurez-vous que les paramètres corrects sont entrés dans le contrôleur de pompe (section 2.2) et appuyez sur "RUN / STOP" (ou comme dirigé par le manuel du produit) à autoinject cellules. Surveiller la souris et ajuster l'isoflurane si indiqué. Voir la seringue et faire en sorte que le piston se déplace dans le canon. Mouvement gelé ou obstrué peut entraîner un penchant / piston cassé.
- Attendre 1 à 2 minutes avec l'aiguille dans le bpluie, alors très lentement (plus de 3 à 4 minutes) retirer l'aiguille du tissu. Le temps total pour retirer l'aiguille après l'injection est terminée est de 5 min. Utilisez un coton-tige pour effacer la zone autour du trou de trépan; laisser les bords de la peau ouverte pour permettre à l'os de sécher.
- Retirez la seringue de la pompe et rincer rapidement 3x avec H 2 O stérile, 3x avec 70% EtOH, et 3x avec H 2 O stérile (ou comme dirigé par machine). Essuyez aiguille avec de l'EtOH et mettre de côté.
- Appliquez la cire d'os stérile (équivalent à 1 ou 2 pi) au trou de trépan et utiliser le bout de bois d'un coton-tige stérile de tasser la cire sur et dans l'os. Si la surface est séchée correctement, il devrait s'en tenir.
- Étaler champ stérile sur la souris et les objets environnants et suturer l'incision; trois points devraient suffire. En variante, l'adhésif chirurgical peut être utilisé. Appliquer un antibiotique topique.
- Réduire l'isoflurane à 0% et de supprimer la souris de l'unité stéréotaxique, étant careful à protéger les dents. Vérifiez les oreilles, la bouche et la langue.
- Surveiller la souris en suivant de près l'injection. Placez la souris sur un coussin chauffant pendant 5 à 10 min; puis transfert à cage (sur le pavé de la chaleur) et d'observer jusqu'à ce que la souris se réveille et est ambulatoire. Ne laissez pas la souris sans surveillance tant qu'il a retrouvé assez de conscience pour maintenir la position couchée sternale. Ne pas retourner la souris pour la compagnie d'autres animaux jusqu'à guérison complète. Envisager l'utilisation d'analgésique supplémentaire si des signes de douleur sont remarqués.
6 Terminer et surveiller le rétablissement et le développement de tumeurs
- Nettoyer tous les instruments et les équipements utilisant EtOH à 70%, un stérilisateur à bille ou un désinfectant entre les souris.
- Surveiller les souris injectées pendant deux jours après la procédure de signes de douleur, infection ou d'autres complications. Injecter analgésique à 24 et 48 h (ou comme indiqué) après l'intervention. Retirer les sutures à 7 à 10 jours, si nécessaire.
- Évaluer la souris pour les signes cliniques de la maladie, paralysis, diminution de l'activité, la perte de poids, des convulsions ou une maladie générale.
- Suivre l'évolution de la tumeur par la méthode appropriée [imagerie par résonance magnétique (IRM), in vivo Imaging Systems (IVIS), etc].
Résultats
Xénogreffes intracrâniennes fiables peuvent être créés avec cette technique décrite. Identifier les structures critiques du crâne de la souris (figure 1) va permettre la reconnaissance de la bregma et guider le chercheur à un endroit précis de l'injection et reproductible. Dans ces études, la lignée parentale U251, cellules U251 transfectées avec la luciférase (U251-Luc), ou U87 immortalisé des cellules de culture de tissus GBM humains ont été suspendues en 4 à 6 pi de SF-DMEM et injecté 2,5 mm latéral (à droite), 1,5 mm en avant , et 3,5 mm ventral par rapport à bregma (figure 2).
Les tumeurs qui en résultent peuvent être visualisées et analysées par imagerie par résonance magnétique (IRM, Figure 3), in vivo luminescent imagerie (IVIS, figure 4), ou des techniques de pathologie clinique de routine (coloration H & E, Figure 5). Une attention particulière doit être prise et l'optimisation effectuée pour déterminer la appropriée.Boîtecellules te et l'emplacement de l'injection pour représenter moment, le rythme de croissance, et le modèle de tumeur souhaité.

Figure 1: Crâne anatomie. Les caractéristiques anatomiques de la tête de la souris et du crâne sont illustrés. Le bregma, qui se trouve sur l'axe de la ligne médiane entre les yeux et les oreilles à l'intersection de la coronaire et les fils de suture sagittale, est utilisé pour localiser de manière reproductible les coordonnées d'injection.
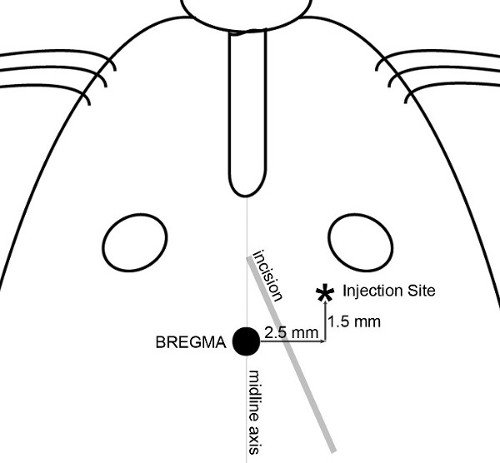
Figure 2: L'incision et le plan d'injection. Les caractéristiques utilisées pour déterminer incision de la peau et localiser précisément le site d'injection sont illustrés. Une incision est faite en diagonale afin de permettre l'accès à la fois bregma et le site d'injection. Application de 30% de H 2 O 2à la surface du crâne permet de visualiser des sutures crâniennes. Placez une seringue avec une aiguille sur la micro-pompe et manœuvrer la pointe de l'aiguille directement sur le bregma. Ensemble coordonnées sur la console d'alignement à zéro; toutes les mesures du crâne sont ensuite reproductible faites à l'égard de bregma.
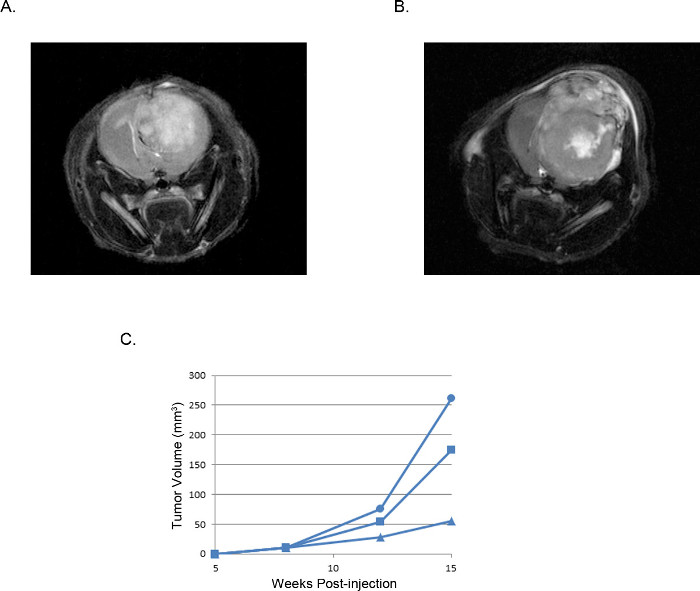
Figure 3 représentatifs des tumeurs de xénogreffes intracrâniennes: images IRM IRM pondérées T2 images d'une tumeur dérivée de (A) 2 x 10 5 cellules U87 par rapport à un dérivé de la tumeur (B) de 2 x 10 5 cellules U251.. les volumes (C) de la tumeur calculés à partir des images IRM de trois souris individuelles injectées avec des cellules U251 tracés dans le temps reproductible montre une fenêtre de développement et la croissance de la tumeur qui est constante dans toutes les expériences.
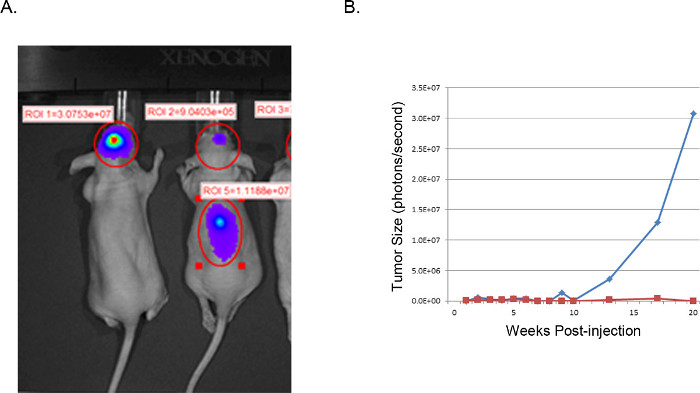
Figure 4: Représentant des tumeurs de xénogreffe: images IVIS. L'image de SIIV U251-luciférase transduction des cellules de glioblastome intracrânien injectés dans des souris nude (A). La souris de gauche a été injecté avec succès comme décrit avec des cellules U251-Luc et montre une très forte signaux focalisés (photons / sec) à l'endroit désiré. La souris sur la droite montre un résultat négatif de l'endroit d'injection inadéquat. H & E examen de la colonne vertébrale a révélé la croissance des cellules tumorales dans la colonne vertébrale résultant de l'injection trop près de la ligne médiane de la diffusion du ventricule. (B) La taille des tumeurs est estimé à partir de l'activité luciférase (photons / seconde) dans la région du cerveau d'intérêt, tracé au fil du temps. La ligne bleue correspond à la souris avec une injection intracrânienne de succès, tandis que la ligne rouge correspond à la souris avec des cellules tumorales pour le déplacement de la colonne vertébrale.
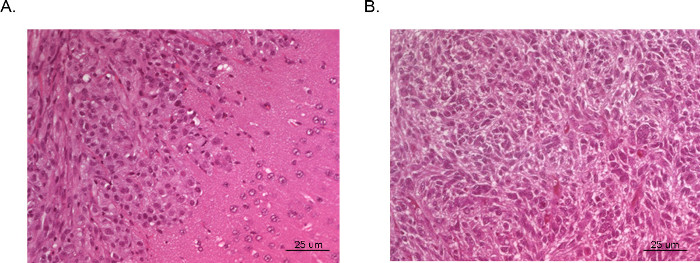
Figure 5 H & E des tumeurs intracrâniennes xénogreffes. Des cerveaux entiers ont été recueillies à partir de souris affichent sacrifice et fixés au formol, monté dans de la paraffine, sectionnés et colorés avec H & E. Tumeur (A) a été dérivée à partir de cellules de glioblastome U87 et illustre une zone de végétation dense de la tumeur (coin supérieur gauche) et le tissu cérébral normal adjacent avec envahissement microscopique des cellules malignes (à droite coin inférieur). Tumeur (B) a été prise à partir d'une section de centre d'une tumeur dérivée de cellules de glioblastome U251. La section reprend de très près l'histopathologie bizarre avec des cellules malignes multinucléées vu dans le GBM humain typique.
Discussion
Des modèles de souris orthotopique de cancer du cerveau humain peut être un excellent outil pour évaluer l'efficacité des thérapies cliniques, mais des précautions doivent être prises pour optimiser le placement des cellules dans les tissus du cerveau. Des études ont montré que le volume des aliquotes excessives, la technique d'injection sous-optimale et des débits d'injection précipités peuvent conduire à une perméabilité et l'apparition de cellules tumorales dans des endroits indésirables (ventricules, de la moelle épinière, les régions extradurales, etc.) Et une forte variation de la taille de la tumeur 2 (observations personnelles ). Une analyse de la distribution par micro-échantillons de non cellulaires ont trouvé que l'utilisation d'une micro-pompe produit une exécution plus focalisée, moins reflux de l'échantillon et moins de variabilité que les méthodes manuelles de l'injection, attribués à la livraison lisse, uniforme et à des pressions compatibles 3. Bien qu'il puisse être difficile de condenser le nombre nécessaire de cellules dans un volume de seulement 2 ou 4 pi, l'utilisation d'un instrument et d'une console d'alignement eq stéréotaxiqueuipped avec une micro-pompe programmable peut produire des tumeurs fiables et reproductibles avec des taux de croissance similaires. Un modèle de xénogreffe ne peut jamais vraiment dupliquer le micro, l'initiation et le développement d'une tumeur d'origine naturelle, en particulier avec les hôtes immuno-déficients, mais un modèle orthotopique bien conçu et mis en œuvre est la meilleure alternative et est de loin supérieure à un modèle extra-utérine.
L'avantage principal de ce protocole est la mise en place de tumeur détectable dans un délai compatible. Le moment d'apparition de la tumeur est dépendante du type de cellule et le nombre de cellules injectées, mais est assez prévisible, et la plupart des tumeurs sont établies à l'intérieur d'une étroite fenêtre de temps par rapport à la durée de la croissance tumorale (par exemple, le temps jusqu'à ce point final). Cela permet au chercheur d'identifier les points de temps pour la collecte de données (comme l'IRM ou SIIV) ou intervention (tels que traitement de la toxicomanie). Les taux de croissance de la tumeur varient selon le type de cellule, le nombre de cellules injectées, et from souris à (comme ils le font chez les patients humains), mais sont cohérentes d'une expérience à l'.
Bien que ce protocole utilise une technique qui peut nécessiter plus instrumentation et de temps que moins des méthodes manuelles exactes de l'injection et peuvent ne pas être applicables à des enquêtes à grande échelle, les techniques pour les injections intracrâniennes qui permettent de débit d'un grand nombre d'animaux (tel que décrit par Iwami et al. 12), par définition, implique l'injection rapide, haute pression et impliquent souvent des instruments à main et mesure manuelle, qui sont soumises à l'instabilité et à l'incertitude. Ces facteurs peuvent être associés à des fuites et hors cible livraison 2,3. La précision, la reproductibilité et la faible mortalité de cette procédure permettra à l'enquêteur de concevoir des expériences de traitement utilisant moins de souris pour obtenir des résultats statistiquement significatifs - des économies nettes.
Une étape est essentielle pour lale succès de l'implantation de la tumeur: l'emplacement précis de l'injection. Cellules injectées trop près des ventricules peuvent conduire à CSF propagation de la maladie à travers le système ventriculaire ou dans des régions extra-crâniennes. Cellules injectées trop peu profonde peuvent se développer à travers le trajet de l'aiguille. Coordonnées prédéterminées sont de peu de valeur si le placement de l'aiguille est bâclée. Prenez le temps de positionner la tête de la souris en toute sécurité dans l'unité stéréotaxique. Utilisez les options de réglage stéréotaxiques et les barres d'oreilles pour s'adapter à l'équipement de la souris, et veiller à ce que la tête est positionnée de manière stable et ne sera pas le rock ou torsion au cours de la procédure. Les changements ou les variations si le site d'injection peuvent affecter les caractéristiques tumorales, y compris prise de la tumeur, la croissance, le potentiel invasif, et l'accès à l'administration de médicaments et l'approvisionnement en oxygène.
D'autres paramètres qui ont un impact profond sur la tumeur résultant comprennent le taux d'injection, le nombre et le volume cellulaire; tout doit être déterminée de manière empirique. Minimiser le volume de la number de cellules requises pour la croissance de la tumeur; utiliser la vitesse d'injection plus lente pratique. Le nombre de cellules et le nombre de passage ont également des effets majeurs sur la prise de la tumeur et le taux de croissance. L'équipement spécialisé utilisé ici offrent un contrôle supérieur, mais les concepts de volume minimal, un ciblage précis, le taux d'injection minimale et constante, et le retrait de l'aiguille lente peut être appliquée à une variété de techniques, y compris par injection (manuel) et une variété d'instruments.
Cette procédure est ouverte à une variété de modifications: le site d'injection peut être personnalisé pour récapituler certains types de tumeurs. Les cellules adhérentes de la culture de tissus, des clones génétiquement modifiés, les neurosphères, des tumeurs de souris ventilées, ou des fragments de tissus humains peuvent être greffées dans un cerveau de souris. Cette technique peut même être adapté pour les études non cellulaires, y compris le transfert de gène viral 3. Une fois que le procédé pour produire de manière fiable des tumeurs des caractéristiques désirées est établie, des expériences comparant l'efficacité des thérapies, traitements médicamenteux et les combinaisons, et d'autres options telles que le transfert de gène peut être réalisée.
Déclarations de divulgation
Les auteurs n'ont rien à divulguer.
Remerciements
Dr Keating est financé par CA100335 de subvention DOD et est Boursier de la Fondation de la Saint-Baldrick.
matériels
| Name | Company | Catalog Number | Comments |
| Name of Reagent/ Equipment | Company | Catalog Number | Comments/Description |
| Equipment | |||
| Small Animal Stereotaxic Instrument with Digital Display Console. | Kopf | Model 940 | |
| Mouse Gas Anesthesia Head Holder | Kopf | Model 923-B | |
| Mouse Ear Bars | Kopf | Medel 922 | |
| Fiber Optic Illuminator | Fisher | 12-562-36 | |
| UltraMicroPump III | WPI | UMP3 | |
| Micro4 microprocessor | WPI | UMC4 | |
| Variable speed hand-held rotary drill | Dremel | Model 300 | |
| Dental drill bit, 1.0 mm | Spoelting | 514554 | |
| Adaptor for dental drill bit: 3/32 inch collet | Dremel | 481 | |
| Heating pad | for mice | ||
| Isoflurane vaporizer system | for mice | ||
| Medical tubing and connectors | to connect isoflurane vaporizer with stereotaxic frame | ||
| Instruments | |||
| Precision 25 ul micro syringe | Hamilton | 7636-01 | Model 702, without needle |
| Microsyringe needles, 26s gauge | Hamilton | 7804-04 | RN, 25 mm point style 2 |
| Fine-tipped scissors (straight, sharp/sharp) | |||
| Medium-sized standard scissors | |||
| Standard serrated forceps | |||
| Serrated hemostats (2) | |||
| Fine-tipped forceps | |||
| Supplies | |||
| Sutures 5-0 vicryl P-3 13 mm (Ethicon) | MWI | J463G | |
| Surgical blades #10, stainless (Feather) | Fisher | 296#10 | |
| Isoflurane (Fluriso) | VetOne | NDC 13985-528-60 | Item #502017. Liquid inhalation anesthetic. federal law restricts this drug to use by or on the order of a licensed veterinarian. |
| Carprofen (Rimadyl Injectable 50 mg/mL) | Pfizer | NDC 61106-8507-01 | dilute in saline |
| Ophthalmic ointment (artificial tears) | Rugby | NDC 0536-6550-91 | |
| Topical antibiotic (AK-Poly-Bac ) | Akorn | NDC 17478-238-35 | |
| Povidone-iodine topical antiseptic, 10% (Betadine) | Betadine | NDC 67618-150-04 | |
| Hydrogen Peroxide, 30% | Fisher | H325-100 | for visualizing skull landmarks |
| Sterile saline | VetOne | NDC 13985-807-25 | for diluting solutions, cleaning tissue |
| Bone wax | WPI | Item #501771 | |
| Sterile drapes | McKesson | 25-517 | |
| Sterile surgical gloves | McKesson | (to fit) | |
| Sterile gauze pads, 2 x 2 | Fisherbrand | 22028556 | |
| Sterile gauze pads, 4 x 4 | Fisherbrand | 22-415-469 | |
| Alcohol prep pads (medium) | PDI | B603 | |
| Sterile cotton-tipped applicators | Fisherbrand | 23-400-114 | |
| Sterile 0.5 ml screw cap tube with caps for cells | USA Scientific | 1405-4700 | for cells |
| Individually wrapped sterile dispo pipettes | Fisher | BD 357575 | for needle cleaning solutions |
| BD insulin syringes with needles | Fisher | 329461 | for analgesic |
| 70% ethanol | for cleaning | ||
| Sterile di H2O | for cleaning | ||
| Microfuge tubes for cleaning solutions | for needle cleaning solutions | ||
| Felt tip pen (dedicated) | for marking skull |
Références
- Heyer, J., Kwong, L. N., Lowe, S. W., Chin, L. Non-germline genetically engineered mouse models for translational cancer research. Nature reviews. Cancer. 10, 470-480 (2010).
- Yamada, S., et al. A method to accurately inject tumor cells into the caudate/putamen nuclei of the mouse brain. The Tokai journal of experimental and clinical medicine. 29, 167-173 (2004).
- Brooks, A. I., et al. Reproducible and efficient murine CNS gene delivery using a microprocessor-controlled injector. Journal of neuroscience. 80, 137-147 (1998).
- Shankavaram, U. T., et al. Molecular profiling indicates orthotopic xenograft of glioma cell lines simulate a subclass of human glioblastoma. Journal of cellular and molecular medicine. 16, 545-554 (2012).
- Giannini, C., et al. Patient tumor EGFR and PDGFRA gene amplifications retained in an invasive intracranial xenograft model of glioblastoma multiforme. Neuro-oncology. 7, 164-176 (2005).
- Yi, D., Hua, T. X., Lin, H. Y. EGFR gene overexpression retained in an invasive xenograft model by solid orthotopic transplantation of human glioblastoma multiforme into nude mice. Cancer investigation. 29, 229-239 (2011).
- Carty, N., et al. Intracranial injection of AAV expressing NEP but not IDE reduces amyloid pathology in APP+PS1 transgenic mice. PLos ONE. 8, e59626 (2013).
- Thaci, B., et al. Pharmacokinetic study of neural stem cell-based cell carrier for oncolytic virotherapy: targeted delivery of the therapeutic payload in an orthotopic brain tumor model. Cancer gene therapy. 19, 431-442 (2012).
- Ozawa, T., James, C. D. Establishing intracranial brain tumor xenografts with subsequent analysis of tumor growth and response to therapy using bioluminescence imaging. J. Vis. Exp. (41), (2010).
- Valadez, J. G., Sarangi, A., Lundberg, C. J., Cooper, M. K. Primary orthotopic glioma xenografts recapitulate infiltrative growth and isocitrate dehydrogenase I mutation. J. Vis. Exp. (83), (2014).
- Baumann, B. C., Dorsey, J. F., Benci, J. L., Joh, D. Y., Kao, G. D. Stereotactic intracranial implantation and in vivo bioluminescent imaging of tumor xenografts in a mouse model system of glioblastoma multiforme. J. Vis. Exp. (67), (2012).
- Iwami, K., et al. A novel method of intracranial injection via the postglenoid foramen for brain tumor mouse models. Journal of neurosurgery. 116, 630-635 (2012).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon