Method Article
解剖学的に正確な作成と人間の脳の腫瘍の再現性頭蓋内異種移植片
要約
脳はよくインビトロまたは異所性の分析によって示されていない資質を持つユニークなサイトです。再現性のある場所および成長特性を有する同所性マウスモデルを確実に定位固定装置及び低圧シリンジポンプを用いて頭蓋内の注射を使用して作成することができる。
要約
特に脳のようなユニークな生理学的および建築資質を持つサイトにインビトロおよび異所性モデルができない-同所腫瘍モデルは、生きた動物のコンテキストで、現在で介入することなく、腫瘍の種類の特性を研究するための最良の方法です。そのような血管系、血液脳関門、代謝、薬物送達および毒性、およびその他の関連要因のホストなどの機能を占めている。同所性モデルもそれらの限界を持っているが、関心のある適切な手法腫瘍細胞を正確にはヒトの脳において最も密接に模倣する条件組織に移植することができる。一貫性の速度および圧力で正確に測定された容積を正確に定義するための場所を提供する方法を採用することにより、予測可能な成長速度を有するヒト脳腫瘍のマウスモデルが再現可能に作成され、さまざまな介入の信頼できる分析のために適切であることができる。ここに記載されているプロトコルは、TEに焦点を当てて設計および頭蓋内注射の準備、手術を行うと、成功したと再現性の腫瘍の成長を確保し、異なる脳の腫瘍モデルの範囲に合わせてカスタマイズすることができ、さまざまな条件のための出発点を提供するchnical詳細。
概要
脳腫瘍細胞のインビトロ研究は、増殖、生存、遊走、および癌細胞の浸潤を駆動する分子メカニズムを解剖するための非常に貴重である。培養細胞実験は、シグナル伝達経路を定義する潜在的な治療標的が示唆され、薬物治療に対する細胞応答を特徴付けることができる。しかし、in vitroでのシステムは、医薬品への生物の応答を予測するのはあまりにも単純化している。それらは生理的反応、免疫応答、細胞微小環境、および動物生体系の全体的な不均一性を欠いている。臨床観察を1に動物モデルを比較する際の重要な相違をもたらし、人間のプロセス内のイベントを再現しないことが可能な場合、遺伝子操作さのモデルは、非常に貴重なことができますが、分子の違いは種とマウス細胞の間に存在する。脇腹の皮下にヒト脳腫瘍細胞株の皮下(SQ)注射を含むマウス異種移植片モデルは、実行が容易であるおよび測定;彼らは、遺伝子改変および薬物投与/送達、代謝および毒性の影響に対処するために使用することができる。重大な欠点は、しかし、SQモデルの有用性を制限する。微小環境は、天然に存在する脳腫瘍の再現しない:さまざまな細胞型および組織の相互作用を;脳に特有のローカルな血管系、および無数の他の要因は複製することはできません。より正確に、天然に存在する脳腫瘍のユニークな環境を再現し、医薬品介入の効果をテストするには、マウス同所モデルが利用されるべきである。また、同所技術が人間の主要な非癌性細胞(分化した細胞または前駆)遺伝子操作されたアプローチの一部として使用することができる遺伝的に腫瘍形成が生じる、またはヒト間質細胞なしで、マウスの該当部位に変形して注入されるヒトの1に見られるものと同様。
この記事では説明して正確かつ再現性マウスにおいて脳腫瘍を作成するための方法論。この技術を使用して、ユーザは正確にマウス大脳皮質の前頭側頭頂側頭部の指定した場所に懸濁された細胞の小アリコートを注入することができます。マウスの死亡率は極めて低い。私たちの手の中に、全くマウスは185の手順の後に外科的合併症で死亡していない。得られた腫瘍の特性は、典型的なヒト臨床腫瘍のそれと比較することができる。例えば:などの成長速度、壊死の程度、浸潤の程度は、細胞型の異質性、有糸分裂細胞の存在、増殖およびアポトーシスのマーカー、細胞株または脱凝集ヒト組織または腫瘍サンプルは、次にそれらの能力に基づいて評価することができる実際の臨床プレゼンテーションをシミュレートします。それらは動物負担ウィット内に存在するように、細胞培養におけるそれらの性能に基づいて選択された医薬品は、代謝機能、循環系、および血液脳関門の文脈において試験することができるhaの腫瘍、関連する建築のコンテキスト内のすべての。さらに、注射用に選択された細胞は、遺伝的に腫瘍の増殖および生存に対する等の特定のノックダウン、欠失、ノックイン、突然変異の影響を調査するために修飾することができる。
多くの刊行物は、頭蓋内のさまざまな技術を用いて腫瘍の研究を文書化する。 Yamada らは、染料およびU87細胞の注射の詳細な研究を行なったし、最小化する量と噴射率が最高の腫瘍2を生成したことがわかった。 ブルックスらは、マイクロプロセッサ制御式のインジェクタではなく、ウイルスベクターを送達するための手動の方法を使用して、優れた再現性と効率性を発見した。最適噴射パラメータに関する彼らの結論は、細胞送達3にも適用可能である。 Shankavaram らは、多形性膠芽腫(GBM)細胞株を脳内に(手動による方法を使用して)同所注射したことを示したCLの遺伝子発現プロファイルを再現したinical腫瘍がより密接によりインビトロまたはSQ異種移植片において 、前臨床試験4のために頭蓋モデルの使用をサポートする。ジャンニーニらは、追加のマウスの脳内に連続継代によりヌードマウスの脇腹に維持されていた人間の手術標本から細胞を注入し、このアプローチは、モデル5で患者の腫瘍遺伝子変化を保っていることを示した。同様の結果は、李ら 6で報告された。定位セットアップ、慎重に定義注射部位、およびゆっくりと着実な注入速度を使用すると、彼らは一貫性のある成長率と高い(100%)の生着率で再現性の脳腫瘍を得た。この技術の有効性は、したがって、十分に確立されている。文献検索は、この技術の用途は広範囲であることを示唆している。カーティーらは、正常transgeniの前頭皮質中に治療遺伝子を発現するウイルスベクターを送達するための頭蓋内注射を使用アルツハイマー病7のCモデル。サチらは既に同所注入さGBM腫瘍8を担持するヌードマウスに神経幹細胞ベースの担体中に治療的腫瘍溶解性アデノウイルスを送達するための頭蓋内注射の使用を記載している。明らかに、頭蓋内注射は、前臨床研究のための汎用性と効果的なツールです。可視化実験のジャーナル以前の出版物は、基本的なアプローチ9-11を説明し、私たちは簡単にマスター技術を使用して、精度の高いレベルに頭蓋内腫瘍注射と同所モデリングの概念を取る。
プロトコル
すべての記載された手順を見直し、当社の制度的動物管理使用委員会によって承認された。
1実験を計画
- 噴射すべきセルを選択してください。接着細胞培養株、遺伝的に改変されたクローン、神経前駆細胞、初代培養、または脱凝集性腫瘍:さまざまなソースからの細胞を注入するための候補である。希望モデルのタイプは、注射の最も適切なサイトを定義します。
- 注射のための細胞数を決定します。腫瘍を形成するのに必要な細胞数は、細胞株に応じて変化し、経験的に決定されなければならない。腫瘍増殖速度は、細胞型、細胞数および組織培養継代回数に大きく依存する。 1×10 4〜2×10 5以上の注射ごとに複数に及ぶ細胞数を変化させ、成長率の腫瘍を作り出した。
- 注射のためのボリュームを制限します。細胞は、無血清培地またはリン酸緩衝sの最小の容積に懸濁されるべきである26 G針を滑らかで、容易な通過を可能にアリーン(PBS)が挙げられる。小さい体積は、実際に、脳内に送達より正確で得られた腫瘍を定義し;最適な結果は、3〜6μlの範囲の容積を注入することによって得られる。混合サンプリング、正確な測定を可能にするために関係なく、計画された注入回数を、懸濁した細胞の少なくとも50μlの最終全体積を準備することを計画。
- モデルに適したマウスを選択してください。ヒト腫瘍のマウスモデルは、典型的には、免疫媒介性移植片拒絶を回避するために、若い免疫不全マウスを利用する。適切な予防措置が除染、消毒、および資機材の殺菌を含め、取得された場合、作業は生物学的安全キャビネットの中で場所を取る必要はありません。ここに示されている作業は、生後6〜12週の間、雄と雌の無胸腺ヌードマウスで行われている。 20g未満の重量を量るマウスは、として位置決めすることが困難な場合がtereotaxicフレームおよび低体温の影響をより受けやすいかもしれません。
2機器を組み立て
- 入手し、マウスを定位フレーム、アライメントコンソール、およびマウスガス麻酔ヘッドホルダー、マイクロシリンジポンプ、熱パッド、麻酔器、光ファイバ作業ランプ、可変速度回転ドリルを除染。清掃し、すべての機器を除染。
- シリンジポンプの動作に必要な他の変数(注入容量、流量、速度単位、注射器型を含む)プログラム注入パラメータ。各特定のモデルの設定を最適化します。
注:これらの注射での設定は(デバイスタイプ「E」)25μlの注射器を用いて400 NL /分の速度(レートの単位「M」)で3000 NLサンプルであった非グループ化(「N」)モードで。 - 最後の里をやって、滅菌脱イオン水を数回のすすぎで26 G針で精密マイクロシリンジ(のdiH 2 O)および70%エタノール(エタノール)を清掃してくださいのdiH 2 OでNSE一部を除くすべてのモデルは、オートクレーブ処理するように設計されていません。プランジャーの動きが滑らかで、自由であることを確認してください。
- 麻酔引き渡し装備を入手します。それは、麻酔の深さと持続時間を調節することが容易であるイソフルランは、好ましい麻酔薬である。定位ユニットは、マウスの麻酔ガスアタッチメントで、必要なチューブとコネクタは、マウスに麻酔器からガス混合物を提供するために用意されていることを装備していることを確認します。
- 細い先端(歯)はさみ、ピンセット2 /止血、縫合のために、中規模のはさみ、中·先の細いピンセット、および少なくとも2つの1ミリメートル歯科用ドリルビットを含むオートクレーブ手術器具、。 70%エタノール、消毒剤、またはビーズ滅菌器で手術中にきれいな楽器にしてください。
- (所望の場合)から、イソフルラン、鎮痛剤、眼軟膏剤/潤滑剤、抗生物質軟膏、生理食塩水、30%過酸化水素(H 2 O 2)、防腐剤、および骨ろうを得る獣医や医療の供給。無菌のdiH 2 Oおよび70%エタノールを調製します。そのようなガーゼパッド、無菌包帯、縫合糸、エタノール綿棒、コットン先端スワブ、無菌手術用手袋、手術用ブレードなど多くの使い捨ては、材料リストに項目ごとに表示されます。頭蓋骨をマークする先端の細い油性マジックを除染し、外科的使用のために専用にする必要があります。
3注射用の細胞を調製
- ここに示した実験では、不死化ヒトGBM細胞株を選択します。セルの数(2×10 5)を、経験的に注入される懸濁液の体積(3μl)を決定します。詳細には、細胞型によって変化し得る。正確な測定、混合、および注入を容易にするために、少なくとも50μlの容量を使用してください。
- メディアまたはPBS中の細胞を再懸濁をトリプシン処理。細胞注入の直前に、次の手順を実行します。
- 吸引により細胞から培地を除去し、100mmプレート当たり10 mlのPBSですすぎ; PBSを除去します。
- 広告各100mmプレートにd 1とmlのトリプシンとは、単一細胞懸濁液を得るためにちょうど十分な長さRTでインキュベートする。
- 100mmプレートあたり5ミリリットルダルベッコ改変イーグル培地(DMEM)+10%ウシ胎児血清(FBS)をトリプシン活性を停止します。
- 100mmプレートあたり〜5ミリリットルの無血清DMEM(SF-DMEM)中で450×gで遠心分離し、再懸濁することにより細胞をペレット化。
- 血球計または自動細胞カウンターを用いて生細胞を数える。
- 2×10 5細胞/3μlのに生細胞密度を調整(または実験によって決定される)細胞をペレット化し、SF-DMEM中に再懸濁することにより。
- 氷や冷却パック(細胞が凍結することはできません)で冷却した細胞を保管してください。指のフリックにより穏やかに混合します。
4。手術のために、マウスを麻酔し、準備する
- 〜5%のイソフルラン(酸素流量〜2リットル/分)を使用して麻酔を誘導または獣医師の指示として。誘導は、2から3分かかります。十分な深さでマウスを維持〜3%イソフルランで麻酔の。
- つま先のピンチによって麻酔の深さを確認し、必要であればイソフルランを調整し、作業中は呼吸や足指のピンチ応答を監視し続ける。暖かさのためのガーゼパッドとマウスを覆い、注入速度に応じて、1時間に45分かかる場合があります手順、全体で定期的にマウスを監視します。
- 丁寧に舌の上や口の中に口蓋バーをスライドさせることにより、定位フレーム内にマウスを置きます。歯の穴に正面切歯フック。できるだけ水平に近いように耳 - 目の表面と、頭を安定させるために耳のバーを使用してください。外耳道に棒を強制しないでください。これは、安全にヘッドを位置決めすることが重要です。指先で軽くサイド側へと上下の動きをチェックしてください。フィット感を最適化するために、定位ユニットの調整可能なコントロールを使用します。
- 眼軟膏で目を注油。ポビドン - iodinの交互の用途で二回目と耳の間の皮膚をきれいに電子防腐70%エタノール。
- フランク(または監督など)に選ばれた鎮痛剤の皮下(SQ)を注入する。
5。噴射を行う
- 注射部位を決定します。注射部位は、大きさやマウスの菌株及び細胞の種類によって変化し得る。脳室に近づきすぎて注入された細胞は、疾患の頭蓋脊髄普及につながる可能性があります。浅すぎる注入された細胞は、針トラックを通って成長することがあります。
注:ここに示した実験では、ターゲットは大脳皮質の前頭領域として定義されたサイトは、2.5ミリメートル(右)、1.5mmの前方、及びブレグマに対して3.5ミリメートル腹が選択された横方向( 図1)、生産20〜30グラムの範囲の、マウスにおける脳の腫瘍。 - ブレグマと注射部位を露出させるために頭部の皮膚を通して無菌技術を用いて、小さな切開(〜8ミリメートル、長)を作成します。正中軸と右耳(に向かって、右眼との間の点から斜めカット、 図2)は、ブレグマと注射部位の両方にアクセスすることができます。
- 皮膚を撤回し、頭蓋骨の表面を乾燥させるために滅菌綿棒を使用しています。ブレグマを可視化するためにH 2 O 2で湿らせた綿棒で他の骨ブロット。 H 2 O 2は、ブレグマで交差冠状および矢状縫合糸に沿って白色の泡状の細い線を残し、酸素の泡を生成する。
- マイクロポンプに針の付いた空の注射器をロックし、前頂の上に直接、針の先端を操縦;セットには、0.0ミリメートル、横0.0ミリメートル前方/後方、及び0.0ミリメートル腹側/背側に整列コンソール上の座標。
- 定位固定ユニットのコントロール·ノブを使用して、横2.5ミリメートル(右)とブレグマ(または希望の場所)に対する1.5mmの前方に針を移動します。少しシリンジを上げ、専用のサインペンで頭蓋骨上の正確な位置をマーク。頭蓋骨の外表面は、ブレグマと水平面上にない場合は、(i。E。、背側/腹側はもはやゼロを読み取って座標なし)、注入の深さがずれていないことを確実にするために0.0に読んで腹側/背側をリセットします。
- ステップ5.5のペンでマーク適切なサイトに無菌歯科先端装備、手持ち回転式ドリルで頭蓋骨に小さな穴を開けます。頭蓋骨の角度でドリルを持ち、非常に静かに骨に先端をタッチします。必要に応じて繰り返します。実際に頭蓋骨のこの層を貫通する針を残して、骨をほぼ完全ではないドリル、最もクリーン注射をもたらす。
- PBSまたは生理食塩水で湿らせた綿棒で骨のほこりを取り除きます。ポンプにシリンジを返すと場所を確認するためにまっすぐにバーホールに針を下ろします。バーホールを針でセンタリングされていない場合は、開口部を拡大するためのドリルを使用しています。
- 静かに細胞懸濁液を混合し、ポンプコントローラを使用してシリンジ内にセルを描画。気泡や塊を避け、針のウィットを拭く外部表面上の汚染細胞を除去する時間アルコール綿棒。注射器/注射針が詰まったり凍結されている場合は、削除し、すぐに滅菌水できれいにし、70%エタノール。
- 頭蓋骨の表面の高さ(0.0ミリメートル腹側/背側)に針を下ろします。そして、ゆっくりと(より約1分)頭蓋骨の全厚さを貫通し、4mmのventrallの深さに脳を貫通する針を下ろします。腹側3.5ミリメートルにゆっくり針を撤回。マウスヘッドが定位ユニットにしっかりと保持されている場合、頭蓋骨のほとんど動きがあってはならない。
- 正しいパラメータが細胞をautoinjectするポンプ制御装置(2.2節)を押して「RUN / STOP」(または製品マニュアルの指示など)を締結していることを確認します。マウスを監視し、必要であれば、イソフルランを調整します。注射器を見て、プランジャーがバレルに移動していることを確認してください。冷凍または詰まっ動きが曲がっ/壊れたプランジャーになることがあります。
- B中の針を1から2分待ち雨は、その後非常にゆっくりと(3から4分かけて)組織から針を引き抜く。注入が完了した後、針を除去するための合計時間は5分である。バーホール周辺を覆い隠すために綿棒を使用してください。骨を乾燥させるために開いている皮膚のエッジを残す。
- ポンプから注射器を取り出し、すぐに70%エタノールで滅菌H 2 Oで3回3回すすぎ、および滅菌H 2 Oで3倍(またはメーカの指示どおりに)。 EtOHで針を拭き、脇に置きます。
- バーホールに(1または2μLに相当)を滅菌骨ろうを適用し、上におよび骨の中にワックスを固めるために滅菌綿棒の木の先端を使用。表面が十分に乾燥している場合は、固執する必要があります。
- マウスと周囲の作業領域の上に、滅菌ドレープを広げ、切開を縫合。 3ステッチで十分です。あるいは、外科用接着剤を使用することができる。局所抗生物質を適用します。
- 0%にイソフルランを削減し、定位ユニットからマウスを取り外し、Cであること歯を保護するためにareful。耳、口や舌をチェックしてください。
- 密接に注射後のマウスを監視します。 5から10分間の熱パッドの上に置いてマウス;その後(熱パッドの上に)ケージに転送され、マウスが覚醒し、歩行可能になるまで観察します。それは胸骨横臥を維持するために十分な意識を取り戻したまでマウスを無人のままにしないでください。完全に回復するまで、他の動物の会社にマウスを返さないでください。痛みの兆候が認めている場合、追加の鎮痛剤の使用を考えてみましょう。
6。完了し、モニター回収·腫瘍の開発
- 70%エタノール、マウスの間のビーズ滅菌器や消毒剤を使用して、すべての楽器や機器を清掃してください。
- 痛み、感染症や他の合併症の兆候が、処置後2日間注射したマウスを監視します。処置後24および48時間(または指示など)で鎮痛を注入。必要に応じて、7〜10日で縫合糸を取り除きます。
- 疾患の臨床徴候についてマウスを評価、paralysisは、体重減少、発作、または一般的な病気の活性を減少させた。
- [ ビボイメージングシステム(IVIS) は 、磁気共鳴イメージング(MRI)など]の適切な方法によって腫瘍の発達を監視する。
結果
信頼性の高い頭蓋内異種移植片は、この記載された技術を使用して作成することができます。マウスの頭蓋骨( 図1)の重要な構造を識別することはブレグマの認識を可能にし、正確で再現性の注入場所に調査員を案内します。これらの研究ではU251親系統は、ルシフェラーゼ(U251-Luc)、ノまたはU87でトランスフェクトしたU251細胞は、ヒトGBM組織培養細胞はSF-DMEMの4〜6μlの懸濁した不死化し、2.5ミリメートル(右)側方、1.5mmの前方に注入ブレグマに対して、3.5mmと腹側( 図2)。
得られた腫瘍は視覚化及び磁気共鳴イメージング(MRI、 図3)、 インビボでの発光イメージング(IVIS、 図4)、またはルーチン肉眼的病理技術(H&E染色、 図5)により分析することができる。 appropriaを決定するために特に注意を払わなければならないと最適化を実施テ細胞および注入の位置は、所望のタイミング、成長率、および腫瘍モデルを表現する。

図1スカル解剖マウスヘッドと頭蓋骨の解剖学的特徴が示されている。目や冠状および矢状縫合の交差点で耳の間の正中線軸上にあるブレグマは、再現可能に注入座標の位置を特定するために使用されている。
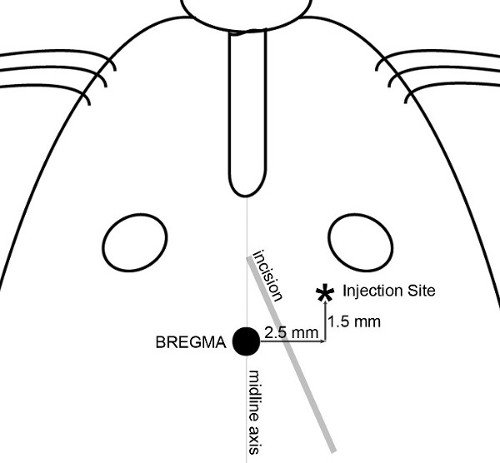
図2切開し、噴射マップ 。 注射部位の皮膚切開を決定し、正確に検索するために使用される特徴が示されている。斜めの切開をブレグマおよび注射部位の両方へのアクセスを許可するように構成されている。 30%H 2 O 2の応用頭蓋骨の表面に頭蓋骨の縫合糸を視覚化するのに役立ちます。マイクロポンプへの針付き注射器を置き、前頂の上に直接、針の先端を操縦。セットをゼロに合わせコンソール上の座標;すべての頭蓋骨測定はその後再現性ブレグマに対して行われる。
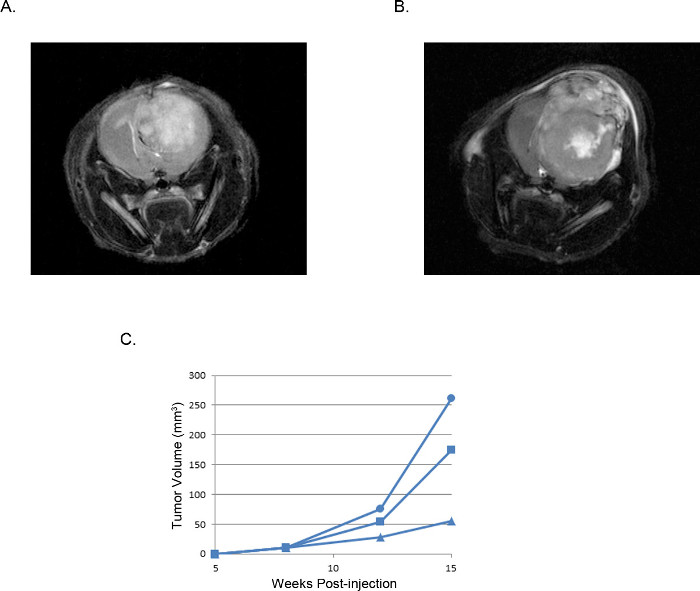
図3。代表頭蓋内異種移植腫瘍を:MRI画像(B)2×10 5 U251細胞由来の腫瘍と比較して、(A)2×10 5 U87細胞に由来する腫瘍のMRI T2強調画像。経時的にプロットU251細胞を注射した3の個別のマウスのMRI画像から計算された(C)腫瘍体積は、すべての実験において一貫している腫瘍の発生と成長の再現可能なウィンドウを示しています。
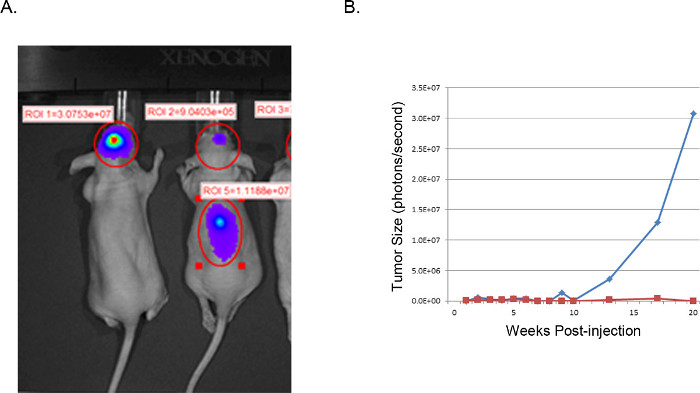
図4。代表的な異種移植腫瘍:IVISイメージ 。 U251-ルシフェラーゼのIVISイメージはヌードマウス(A)に注入された頭蓋内GBM細胞を形質導入。左のマウスは正常U251-Luc細胞で説明したように注入し、所望の位置に非常に強い合焦点信号(光子/秒)を示した。右のマウスは、不適切な噴射位置から失敗した結果を示しています。脊椎のH&E試験は、心室普及して正中線にはあまりに近い注入に起因する脊柱における腫瘍細胞増殖を明らかにした。 (B)腫瘍の大きさは、関心のある脳領域にルシフェラーゼ活性(光子/秒)から推定され、経時的にプロット。赤い線は、背骨への腫瘍細胞の変位とマウスに対応している青い線は、成功した頭蓋内注射でマウスに対応している。
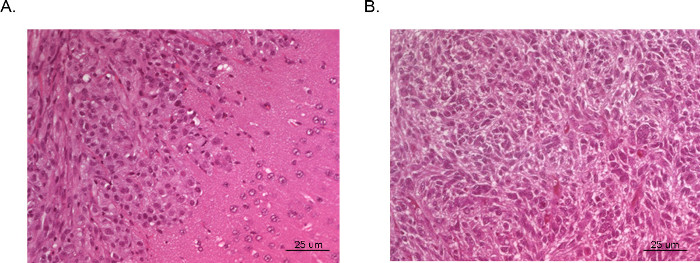
頭蓋内異種移植腫瘍の図5のH&E。全体の脳は、マウスは犠牲をポストから回収し、ホルマリンで固定し、パラフィンに取り付けられ、切片化し、H&Eで染色した。腫瘍(A)は、U87 GBM細胞由来の緻密な腫瘍増殖(左上)および悪性細胞(右下隅)の顕微鏡浸潤隣接する正常な脳組織の領域を示した。腫瘍(B)は、U251 GBM細胞由来の腫瘍の中央部から採取した。セクションには、非常に密接に典型的な人間のGBMで見られる多核悪性細胞との奇妙な組織病理を複製します。
ディスカッション
ヒト脳癌の同所性マウスモデルは、臨床治療の有効性を評価するための優れたツールであるが、脳組織内の細胞の配置を最適化するために注意しなければならないことができる。腫瘍の大きさの研究過度のアリコート量、準最適な注入技術及び性急な注入速度が漏出し、望ましくない場所での腫瘍細胞の出現をもたらし得ることが示されている(脳室、脊髄、硬膜外の領域など )と高変動2(個人的な観察)。非細胞サンプルのマイクロプロセッサ駆動型配信の分析は滑らかで均一な配信と一貫性のある圧力3に起因する、マイクロポンプの使用がより合焦点配達、より少ないサンプル逆流と注入の手動方法よりも変動を生じたことを発見した。それは、わずか2または4μlの容量で定位固定装置とアライメントコンソール当量の使用を必要とされる細胞の数を凝縮させるために挑戦することができるがプログラム可能なマイクロポンプでuipped同様の増殖率と再現性と信頼性の高い腫瘍をもたらすことができる。異種移植モデルは、本当に、特に免疫不全のホストと、天然に存在する腫瘍の微小環境、開始と発展を複製ことはできませんが、よく設計され、実装同所モデルが最善の選択肢であると異所性モデルよりはるかに優れています。
このプロトコルの主な利点は、一貫性のある時間枠内で検出可能な腫瘍の確立である。腫瘍出現のタイミングは、細胞型および注入された細胞の数に依存するが、かなり予測可能であり、ほとんどの腫瘍は、腫瘍増殖( すなわち、エンドポイントまでの時間)の持続時間に対する時間の狭いウィンドウ内で確立される。これは、データ収集(例えばMRIまたはIVIS)または(例えば、薬物治療など)介入のための時間ポイントを識別するために研究を可能にする。腫瘍増殖速度は、細胞型、注入した細胞の数、及びfrのに伴って変化のOM(これらはヒト患者においてそうであるように多くの)マウスにマウスが、実験と実験から一貫している。
このプロトコルは、注入の少ない正確なマニュアルの方法よりも計装と時間を必要とする場合があり、そのような石見によって記載されているような多数の動物のスループットを可能に頭蓋内注射のための技術(大規模な調査には適用できない場合があり技術を用いているがら 12)定義上は、急速な、高圧注入を伴い、しばしば不安定や不確実性の対象となるハンドヘルド計測および手動測定を伴う。これらの要因は、漏出およびオフターゲット送出2,3に関連付けることができる。ネット貯蓄 - 精度、再現性、およびこの手順の低死亡率は、研究者が統計的に有意な結果を得るために、より少ないマウスを用いた治療実験を設計することができるようになります。
1つのステップは非常に重要です腫瘍移植の成功:注射の正確な位置。脳室に近づきすぎて注入された細胞は、脳室系を介して、または頭蓋外の領域に病気のCSFの広がりにつながる可能性があります。浅すぎる注入された細胞は、針トラックを通って成長することがあります。針の配置がずさんであれば所定の座標はほとんど価値がない。定位ユニットにしっかりとマウスのヘッドを位置決めするために時間をかけてください。マウスへの機材に合わせて、ヘッドを安定に配置され、手術中に揺するか、ねじったりしないようにするために、定位の調整オプションや耳のバーを使用してください。変更や変化は注射部位は、腫瘍テイク、成長、侵襲能力、および薬物送達および酸素供給へのアクセスを含む、腫瘍の特性に影響を与える可能性がある場合。
得られた腫瘍に多大な影響を与える他のパラメータは、噴射率、細胞数及び容積を含み;すべての経験的に決定されなければならない。 numbeの音量を最小にし腫瘍の増殖に必要な細胞のR;実用的な最も遅い注入速度を使用しています。細胞数および継代数はまた、腫瘍テイクと成長速度に大きな影響を与える。ここで使用される特殊な装置は、優れたコントロールを提供していますが、最小限のボリューム、正確なターゲティング、ミニマルかつ一貫性の注入速度、スローニードル離脱の概念は、(手動注入を含む)のさまざまな技術や機器の多様に適用することができる。
この手順は、さまざまな修飾に開放さ:注射部位は、腫瘍の特定のタイプを再現するようにカスタマイズすることができる。接着性組織培養細胞、遺伝的に改変されたクローンは、ニューロスフェア、脱凝集マウス腫瘍、又はヒト組織断片は、マウスの脳に移植することができる。この技術はさらに、ウイルス遺伝子移入3を含む非細胞研究のために適合させることができる。確実に所望の特性の腫瘍を製造する方法が確立されると、実験はEFFIを比較するそのような遺伝子導入などの治療、薬物治療との組み合わせ、およびその他のオプションのアドボカシーを行ってもよい。
開示事項
著者らは、開示することは何もない。
謝辞
博士はキーティングは、DODのグラントCA100335によって資金を供給し、聖剣帯の財団奨学生です。
資料
| Name | Company | Catalog Number | Comments |
| Name of Reagent/ Equipment | Company | Catalog Number | Comments/Description |
| Equipment | |||
| Small Animal Stereotaxic Instrument with Digital Display Console. | Kopf | Model 940 | |
| Mouse Gas Anesthesia Head Holder | Kopf | Model 923-B | |
| Mouse Ear Bars | Kopf | Medel 922 | |
| Fiber Optic Illuminator | Fisher | 12-562-36 | |
| UltraMicroPump III | WPI | UMP3 | |
| Micro4 microprocessor | WPI | UMC4 | |
| Variable speed hand-held rotary drill | Dremel | Model 300 | |
| Dental drill bit, 1.0 mm | Spoelting | 514554 | |
| Adaptor for dental drill bit: 3/32 inch collet | Dremel | 481 | |
| Heating pad | for mice | ||
| Isoflurane vaporizer system | for mice | ||
| Medical tubing and connectors | to connect isoflurane vaporizer with stereotaxic frame | ||
| Instruments | |||
| Precision 25 ul micro syringe | Hamilton | 7636-01 | Model 702, without needle |
| Microsyringe needles, 26s gauge | Hamilton | 7804-04 | RN, 25 mm point style 2 |
| Fine-tipped scissors (straight, sharp/sharp) | |||
| Medium-sized standard scissors | |||
| Standard serrated forceps | |||
| Serrated hemostats (2) | |||
| Fine-tipped forceps | |||
| Supplies | |||
| Sutures 5-0 vicryl P-3 13 mm (Ethicon) | MWI | J463G | |
| Surgical blades #10, stainless (Feather) | Fisher | 296#10 | |
| Isoflurane (Fluriso) | VetOne | NDC 13985-528-60 | Item #502017. Liquid inhalation anesthetic. federal law restricts this drug to use by or on the order of a licensed veterinarian. |
| Carprofen (Rimadyl Injectable 50 mg/mL) | Pfizer | NDC 61106-8507-01 | dilute in saline |
| Ophthalmic ointment (artificial tears) | Rugby | NDC 0536-6550-91 | |
| Topical antibiotic (AK-Poly-Bac ) | Akorn | NDC 17478-238-35 | |
| Povidone-iodine topical antiseptic, 10% (Betadine) | Betadine | NDC 67618-150-04 | |
| Hydrogen Peroxide, 30% | Fisher | H325-100 | for visualizing skull landmarks |
| Sterile saline | VetOne | NDC 13985-807-25 | for diluting solutions, cleaning tissue |
| Bone wax | WPI | Item #501771 | |
| Sterile drapes | McKesson | 25-517 | |
| Sterile surgical gloves | McKesson | (to fit) | |
| Sterile gauze pads, 2 x 2 | Fisherbrand | 22028556 | |
| Sterile gauze pads, 4 x 4 | Fisherbrand | 22-415-469 | |
| Alcohol prep pads (medium) | PDI | B603 | |
| Sterile cotton-tipped applicators | Fisherbrand | 23-400-114 | |
| Sterile 0.5 ml screw cap tube with caps for cells | USA Scientific | 1405-4700 | for cells |
| Individually wrapped sterile dispo pipettes | Fisher | BD 357575 | for needle cleaning solutions |
| BD insulin syringes with needles | Fisher | 329461 | for analgesic |
| 70% ethanol | for cleaning | ||
| Sterile di H2O | for cleaning | ||
| Microfuge tubes for cleaning solutions | for needle cleaning solutions | ||
| Felt tip pen (dedicated) | for marking skull |
参考文献
- Heyer, J., Kwong, L. N., Lowe, S. W., Chin, L. Non-germline genetically engineered mouse models for translational cancer research. Nature reviews. Cancer. 10, 470-480 (2010).
- Yamada, S., et al. A method to accurately inject tumor cells into the caudate/putamen nuclei of the mouse brain. The Tokai journal of experimental and clinical medicine. 29, 167-173 (2004).
- Brooks, A. I., et al. Reproducible and efficient murine CNS gene delivery using a microprocessor-controlled injector. Journal of neuroscience. 80, 137-147 (1998).
- Shankavaram, U. T., et al. Molecular profiling indicates orthotopic xenograft of glioma cell lines simulate a subclass of human glioblastoma. Journal of cellular and molecular medicine. 16, 545-554 (2012).
- Giannini, C., et al. Patient tumor EGFR and PDGFRA gene amplifications retained in an invasive intracranial xenograft model of glioblastoma multiforme. Neuro-oncology. 7, 164-176 (2005).
- Yi, D., Hua, T. X., Lin, H. Y. EGFR gene overexpression retained in an invasive xenograft model by solid orthotopic transplantation of human glioblastoma multiforme into nude mice. Cancer investigation. 29, 229-239 (2011).
- Carty, N., et al. Intracranial injection of AAV expressing NEP but not IDE reduces amyloid pathology in APP+PS1 transgenic mice. PLos ONE. 8, e59626 (2013).
- Thaci, B., et al. Pharmacokinetic study of neural stem cell-based cell carrier for oncolytic virotherapy: targeted delivery of the therapeutic payload in an orthotopic brain tumor model. Cancer gene therapy. 19, 431-442 (2012).
- Ozawa, T., James, C. D. Establishing intracranial brain tumor xenografts with subsequent analysis of tumor growth and response to therapy using bioluminescence imaging. J. Vis. Exp. (41), (2010).
- Valadez, J. G., Sarangi, A., Lundberg, C. J., Cooper, M. K. Primary orthotopic glioma xenografts recapitulate infiltrative growth and isocitrate dehydrogenase I mutation. J. Vis. Exp. (83), (2014).
- Baumann, B. C., Dorsey, J. F., Benci, J. L., Joh, D. Y., Kao, G. D. Stereotactic intracranial implantation and in vivo bioluminescent imaging of tumor xenografts in a mouse model system of glioblastoma multiforme. J. Vis. Exp. (67), (2012).
- Iwami, K., et al. A novel method of intracranial injection via the postglenoid foramen for brain tumor mouse models. Journal of neurosurgery. 116, 630-635 (2012).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved