Method Article
יצירה אנטומית מדויק והשחזור תוך גולגולת xenografts של גידולים במוח אדם
In This Article
Summary
המוח הוא אתר ייחודי עם איכויות שאינם מיוצגות היטב על ידי במבחנה או ניתוחים מחוץ לרחם. מודלים עכבר orthotopic עם מאפייני מיקום וצמיחה לשחזור ניתן ליצור באופן אמין עם זריקות תוך גולגולתי באמצעות מכשיר קיבוע stereotaxic ומשאבת מזרק בלחץ נמוך.
Abstract
מודלים גידול Orthotopic כרגע הדרך הטובה ביותר ללמוד את המאפיינים של סוג גידול, עם ובלי התערבות, בהקשר של בעלי חיים חיים - במיוחד באתרים עם איכויות פיסיולוגיות ואדריכליות ייחודיות כגון המוח במבחנה ומודלים מחוץ לרחם לא יכולים. דין וחשבון על תכונות כגון כלי דם, מחסום דם מוח, חילוף חומרים, אספקת סמים ורעילות, וכן שורה של גורמים רלוונטיים אחרים. דגמי Orthotopic המגבלות שלהם מדי, אבל עם תאי גידול טכניקה נכונים של עניין יכולים להיות engrafted במדויק לרקמה שרוב מקרוב תנאים מחקה במוח האנושי. על ידי שימוש באמצעים המספקים כמויות נמדדו בדיוק למקומות מוגדרים באופן מדויק בקצב עקבי ולחץ, מודלים עכבר של גידולים במוח אנושיים עם שיעורי צמיחה צפויים ניתן ליצור reproducibly ומתאימים לניתוח אמין של התערבויות שונות. הפרוטוקול המתואר כאן מתמקד בteפרטי chnical של תכנון והכנה להזרקה תוך גולגולתי, ביצוע הניתוח, ולהבטיח את צמיחת גידול מוצלחת ושחזור ומספקים מתחילים נקודות עבור מגוון רחב של תנאים הניתנים להתאמה למגוון רחב של דגמי גידול במוח שונים.
Introduction
ניסויים במבחנה של תאי גידול במוח הם לא יסולא בפז עבור לנתח מנגנונים מולקולריים המשפיעים על צמיחה, הישרדות, נדידה, ופלישה של תאים סרטניים; ניסויי תאים בתרבית יכולים להגדיר מסלולי איתות, מציעים מטרות טיפוליות אפשריות, ולאפיין את התגובה תאית לטיפול תרופתי. אבל במבחנה מערכות הן הרבה יותר מדי פשטניות לנבא תגובת האורגניזם לתרופות; הם חסרים את התגובות הפיזיולוגיות, תגובות חיסוניות, microenvironment תא, וההטרוגניות כוללת של מערכות חי בעלי חיים. מבחינה גנטית מודלים מהונדסים יכולים להיות יקר, כאשר זמינים, אך הבדלים מולקולריים קיימים בין מינים ותאים עכבריים לא יכול לשחזר אירועים בתהליכים אנושיים, וכתוצאה מכך פערים משמעותיים כאשר משווים מודלים של בעלי חיים לתצפיות קליניות 1. המודלים xenograft עכבר מעורבים הזרקה תת עורית (SQ) של שורות תאי גידול במוח אנושיות מתחת לעור של האגף הם קלים לביצועולמדוד; הם יכולים לשמש כדי לטפל בהשפעות של שינוי גנטי ומתן תרופות / מסירה, חילוף חומרים ורעיל. חסרונות משמעותיים, עם זאת, להגביל את השירות של דגמי SQ. Microenvironment לא לסכם זה של גידול במוח באופן טבעי: האינטראקציות של סוגי תאים שונים ורקמות; כלי הדם המקומיים, וגורמים אחרים מספר עצום ייחודיים למוח לא יכולים להיות משוכפלים. ליותר לשחזר במדויק את הסביבה הייחודית של גידול במוח באופן טבעי ולבדוק את ההשפעות של התערבויות תרופתיות, יש לנצל מודל orthotopic עכבר. יתר על כן, טכניקות orthotopic עשויות לשמש כחלק מגישה מהונדסת גנטי שבו תאים שאינם סרטניים אנושיים עיקריים (הבדיל או אב) הם מהונדסים גנטיים והוחדרו לתוך האתר הרלוונטי של עכבר, עם או בלי תאי סטרומה אנושיים, וכתוצאה מכך יצירת גידולים דומה לזו שנצפתה בבני האדם 1.
מאמר זה מתארמתודולוגיה מדויקת וreproducibly ליצור גידולים במוח בעכברים. שימוש בטכניקה זו, המשתמש יכול במדויק להזריק aliquot קטן של תאים מושעים למיקום שצוין באזור fronto-parieto-הזמנית של עכבר קליפת המוח. תמותת העכבר היא נמוכה ביותר; בידיים שלנו, לא עכברים מתו מסיבוכים ניתוחיים לאחר 185 נהלים. מאפיינים של הגידול כתוצאה ניתן להשוות לזה של גידולים קליניים בבני אדם טיפוסיים; לדוגמא: מהירות של צמיחה, תואר של נמק, של פלישת מידה, ההטרוגניות של סוג התא, נוכחות של תאי mitotic, סמנים של שגשוג ואפופטוזיס, וכו 'קווים סלולריים או דגימות רקמה או גידול אנושיות מפוצלות אז יכולים להיות מוערכים על סמך היכולת שלהם כדי לדמות מצגת קלינית בפועל. תרופות, שנבחרו על בסיס ביצועיהם בתרבית תאים, ניתן לבדוק בהקשר של חילוף חומרים תפקוד, מערכת דם, ומחסום דם מוח כפי שהם קיימים בשנינות בבעלי חיים עמוסותחה גידול, כל זאת בהקשר אדריכלי רלוונטי. יתר על כן, התאים שנבחרו להזרקה ניתן מהונדסים גנטי כדי לחקור את ההשפעה של knockdowns הספציפי, מחיקות, לדפוק תוספות, מוטציות, וכו 'על צמיחת גידול ולהישרדות.
מספר הפרסומים לתעד מחקרי גידולים תוך שימוש במגוון רחב של טכניקות תוך גולגולתי. Yamada et al. עשה מחקר מפורט של ההזרקה של צבע ושל תאי U87 ומצא כי צמצום שיעור נפח והזרקה מיוצר הגידול הטוב ביותר 2. . ברוקס et al מצא שחזור מעולה וחיסכון בשימוש במזרק שבשליטת המיקרו ולא בשיטה ידנית כדי לספק וקטורים ויראליים; את מסקנותיהם לגבי פרמטרים הזרקה אופטימליים חלות על תא משלוח 3. Shankavaram et al. הראה כי multiforme גליובלסטומה שורות תאים (GBM) הוזרקו orthotopically (באמצעות שיטה ידנית) לתוך המוח סכם את פרופיל ביטוי גנים של CLגידולי inical באופן הדוק יותר מאשר כל אחד בxenografts מבחנה או SQ, התומך בשימוש במודלים תוך גולגולתי למחקרים פרה 4. אל ג'יאניני et. הזריק תאים מדגימות כירורגית אדם שספגו בצלעות של עכברים בעירום על ידי passaging סדרתי לתוך מוחם של עכברים נוספים, והראה כי גישה זו נשמרה שינויים גנטי גידול מטופל במודל 5. תוצאות דומות דווחו על ידי אל יי et 6. באמצעות התקנת stereotaxic, אתר הזרקה מוגדר בקפידה, ושיעור הזרקה איטי ויציב, הם השיגו גידולים במוח לשחזור עם שיעורי צמיחה עקביים ו( 100%) שיעור גבוה engraftment. תוקפה של טכניקה זו ולכן הוקם גם; חיפוש בספרות מצביע על כך שהיישומים של טכניקה זו הם נרחבים. Carty et al. משמש זריקות תוך גולגולתי, כדי לספק בהצלחה וקטורים ויראליים לבטא גנים טיפוליים לקליפת המוח הקדמית של transgeniמודל ג למחלת אלצהיימר 7. Thaci et al. תאר את השימוש בזריקות תוך גולגולתי, כדי לספק אדנווירוס oncolytic הטיפולי במנשא בתאי גזע עצבי המבוסס לעכברים בעירום כבר נושאים גידולי GBM הזריקו orthotopically 8. ברור, זריקות תוך גולגולתי הן כלי תכליתי ויעיל למחקר פרה קליני. פרסומים קודמים בכתב העת של ניסויים דמיינו לתאר גישות בסיסיות 9-11, אבל אנחנו לוקחים את הרעיון של הזרקת גידול תוך גולגולתי ודוגמנות orthotopic לרמה גבוהה יותר של דיוק תוך שימוש בטכנולוגיה קל להורים.
Protocol
כל ההליכים המתוארים היו נבדקו ואושרו על ידי ועדת הטיפול בבעלי החיים ושימוש המוסדית שלנו.
.1 תכנית הניסוי
- בחר תאים להיות מוזרק. תאים ממגוון רחב של מקורות הם מועמדים להזרקה: קווי תרבית תאים חסיד, שיבוטים מהונדסים גנטי, תאי neurosphere, תרבויות עיקריות, או גידולים מפוצלים. הסוג של המודל הרצוי יגדיר את האתר המתאים ביותר להזרקה.
- לקבוע מספר תא להזרקה. מספר התאים הדרושים ליצירת של גידולים משתנה עם שורת תאים, ויש לקבוע באופן אמפירי; שיעור צמיחת גידול תלוי במידה רבה בסוג התא, מספר תא ומספר קטע תרבית רקמה. מספרי תא הנעים בין 1 x 04-02 אוקטובר x 10 5 או יותר לכל זריקה יצרו גידולים של שיעורי צמיחה שונים.
- להגביל את עוצמת הקול להזרקה. התאים צריכים להיות מושעים בנפח הקטן ביותר של תקשורת חופשית בסרום או של פוספט שנאגרואלין (PBS) המאפשר למעבר חלק, קל באמצעות מחט 26 G. הקטן יותר בנפח אכן נמסר למוח, יותר מדויקים ומוגדר הגידול וכתוצאה מכך; תוצאות אופטימליות מתקבלות על ידי הזרקת כמויות הנעות מ -3 עד 6 μl. מתכנן להכין נפח כולל סופי של לפחות 50 μl של תאים תלויים, ללא קשר למספר הזריקות המתוכננות, על מנת לאפשר מדידה מדויקת, ערבוב ודגימה.
- בחר עכברים מתאימים למודל. מודלים עכבריים של גידולים אנושיים בדרך כלל לנצל עכברים שנפרצו חיסוניים צעירים, כדי למנוע דחיית שתל בתיווך חיסונית. אין זה הכרחי לעבודה שתתקיים בארון בטיחות ביולוגי, אם אמצעי זהירות מתאימה נלקח, כולל טיהור, חיטוי, ועיקור של חומרים וציוד. העבודה שמוצגת כאן שנעשתה בעכברים בעירום athymic, זכר ונקבה, בין 6 ל 12 שבועות של גיל. עכברים ששוקלים פחות מ -20 גרם יכול להיות קשה והמיקום כבהמסגרת וtereotaxic עשויה להיות רגישה יותר להיפותרמיה.
.2 להרכיב את הציוד
- להשיג ולטהר עכבר מסגרת stereotaxic, קונסולת יישור, ובעל ראש ההרדמה גז עכבר, משאבת microsyringe, כרית חום, מכונת הרדמה, מנורת עבודת סיבים אופטית, ותרגיל סיבובי מהירות משתנה. לנקות ולטהר את כל הציוד.
- לתכנת את הפרמטרים ההזרקה (כולל נפח הזרקה, קצב זרימה, יחידות שיעור, סוג מזרק) ומשתנים אחרים הדרושים להפעלת משאבת המזרק. לייעל את ההגדרות עבור כל דגם מסוים.
הערה: בזריקות אלה ההגדרות היו 3,000 דגימות NL בשיעור של 400 / min NL (יחידות שיעור "M") באמצעות 25 מזרק μl (סוג התקן "E") בללא מקובצים ("N") מצב. - נקה microsyringe דיוק עם 26 מחט G עם כמה שטיפות של מים ללא יונים סטרילי (diH 2 O) ו70% אתנול (EtOH), עושה רי סופיNSE עם diH 2 O. אבל כמה שלא כל הדגמים מעוצבים להיות autoclaved. ודא שתנועת הבוכנה היא חלק וללא תשלום.
- להשיג ציוד מסירת הרדמה. Isoflurane היא ההרדמה המועדפת כפי שהוא קל לווסת את העומק ומשך זמן של הרדמה. ודא שיחידת stereotaxic מצוידת בקובץ מצורף גז הרדמה עכבר וכי צינורות ומחברים הדרושים נמצאים במקום כדי לספק את תערובת הגז ממכונת ההרדמה לעכבר.
- כלים החיטוי כירורגית, כוללים מספריים קצה קנס, שני מלקחיים / hemostats (עם שיניים) לתפירה, מספריים בגודל בינוניים, פינצטה בינונית וקנס שקצהו, ולפחות שני מקדחי שיניים 1 מ"מ. שמור מכשירים נקיים במהלך ההליך עם EtOH 70%, חומר חיטוי, או מעקרים את חרוז.
- להשיג isoflurane, משכך כאבים, משחה / חומר סיכה עיניים, משחה אנטיביוטית, מלוחים, 30% מי חמצן (H 2 O 2), חיטוי, ושעוות עצם (אם רוצה) מאספקת וטרינרית או רפואית. הכן O סטרילי diH 2 וEtOH 70%. חד פעמים כגון פדה גזה, תחבושות סטריליות, תפרים, מטליות אתנול, צמר גפן הטה, כפפות מנתחים סטרילית, סכין כירורגית ועוד מפורטות ברשימת החומרים. סמן קבע קצה קנס לסימון הגולגולת יש לחטא והקדיש לשימוש כירורגית.
.3 הכינו תאים להזרקה
- בניסויים המוצגים כאן, בחר שורת תאי GBM הונצחה אנושית. לקבוע את מספר התאים (2 x 10 5) והנפח של השעיה להיות מוזרקים (3 μl) באופן אמפירי; פרטים עשויים להשתנות עם סוג התא. השתמש בנפח של לפחות 50 μl כדי להקל על מדידה, ערבוב, וזריקה מדויקות.
- Trypsinize תאים וגלולים בתקשורת או PBS. בצע את השלבים הבאים רק לפני הזרקת תאים:
- הסר את המדיה מהתאים על ידי שאיפה ולשטוף עם 10 מ"ל PBS לכל 100 צלחת מ"מ; להסיר PBS.
- מודעהד טריפסין 1 מ"ל לכל צלחת מ"מ 100 ולדגור על RT בדיוק מספיק זמן כדי להניב השעיה תא בודדת.
- להפסיק את פעילות טריפסין עם 5 מ"ל הנשר בינוני השתנה Dulbecco (DMEM) + 10% בסרום שור עוברי (FBS) לכל 100 צלחת מ"מ.
- תאים גלולה על ידי צנטריפוגה ב450 XG וגלול ב~ 5 מ"ל DMEM החופשי (SF-DMEM) בסרום לכל 100 צלחת מ"מ.
- ספירת תאי קיימא באמצעות hemacytometer או נגד תא אוטומטי.
- התאם את צפיפות התא החי ל2 x 10 5 תאים / 3 μl (או כפי שנקבע על ידי ניסויים) על ידי pelleting התאים וresuspending בSF-DMEM.
- שמור את התאים מקוררים בקרח או חבילת צינה (לא לאפשר לתאים להקפיא). מערבבים בעדינות על ידי מצליף אצבע.
.4 הרדימי והכן עכבר לכירורגיה
- לגרום להרדמה באמצעות ~ 5 isoflurane% (זרימה ~ 2 ליטר / דקת חמצן) או על פי הנחיות וטרינר. אינדוקציה צריכה לקחת 2 עד 3 דקות. לשמור על עכבר בעומק מתאיםהרדמה עם isoflurane 3% ~.
- בדוק עומק ההרדמה על ידי קמצוץ הבוהן, להתאים isoflurane אם הצביע ותמשיך לעקוב אחר נשימה ובוהן תגובת קמצוץ לאורך כל ההליך. כסה עכבר עם פדה גזה לחום ולפקח על העכבר באופן קבוע לאורך כל ההליך, אשר עשוי להימשך 45 דקות לשעה 1, תלוי בקצב של הזרקה.
- מקם את העכבר במסגרת stereotaxic ידי הזזה בר החיך בזהירות מעל הלשון ולתוך הפה. הוק החותכות הקדמיות לתוך חור השן. השתמש בארים אוזן על מנת לייצב את הראש, עם משטח אוזן לעין כליד אופקי ככל האפשר. אל תכריחו את הסורגים לתוך תעלת אוזן. זה קריטי כדי למקם את הראש בצורה מאובטחת: לבדוק תנועה מצד לצד ומעלה ומטה בעדינות בקץ אצבעות. השתמש בפקדים להתאמה של יחידת stereotaxic כדי לייעל את הכושר.
- לשמן את העיניים עם משחת עיניים. נקה את העור בין אוזניים ועיניים פעמיים עם יישומים לסירוגין של povidone-iodinדואר חיטוי וEtOH 70%.
- הזרק תת עורי נבחר משכך כאבים (SQ) לאגף (או כפי שהורה).
.5 בצע הזרקה
- קבע את אתר ההזרקה. אתר ההזרקה עשוי להשתנות עם הגודל והזן של עכבר והסוג של תא. תאים המוזרקים קרוב מדי לחדרי הלב עלולים להוביל להתפשטות קרניו-השדרה של מחלה. תאים המוזרקים רדוד מדי עשויים לגדול באמצעות מסלול המחט.
הערה: בניסויים המוצגים כאן, היעד הוגדר כאזור הקדמי של קליפת המוח אתר 2.5 מ"מ לרוחב (מימין), 1.5 מ"מ קדמי, ו3.5 מ"מ הגחון ביחס לגבחת נבחר (איור 1), בהפקת גידול המוח התיכון בעכברים הנעים 20-30 גרם. - לעשות חתך קטן (באורך 8 מ"מ ~) באמצעות טכניקה סטרילית דרך העור של הראש כדי לחשוף את גבחת ואתר הזרקה. חתך אלכסוני, מנקודה בין ציר קו האמצע ועין ימין לכיוון אוזן ימין ( איור 2) מאפשר גישה לשני גבחת ואתר ההזרקה.
- לחזור בו העור ולהשתמש במטלית כותנה סטרילי לייבש את פני השטח של הגולגולת. למחוק את העצם עם ספוגית אחרת טבולה בH 2 O 2 לדמיין גבחת. H 2 O 2 יפיקו בועות חמצן, ומשאירים קווים דקים של קצף לבן לאורך תפרי העטרה וsagittal שמצטלבים בגבחת.
- לנעול מזרק ריק עם מחט על micropump ולתמרן את קצה המחט ישירות על גבחת; סט קואורדינטות על קונסולת היישור ל0.0 מ"מ, קדמי / אחורי לרוחב 0.0 מ"מ, ו0.0 מ"מ הגחון / גב.
- להזיז את המחט ל2.5 מ"מ לרוחב (מימין) ומ"מ קדמי 1.5 ביחס לגבחת (או מיקום רצוי) באמצעות כפתורי שליטה על יחידת stereotaxic. הרם את המזרק מעט ולסמן את המיקום המדויק על הגולגולת עם בטוש ייעודי. אם פני השטח החיצוניים של הגולגולת הוא לא על מטוס ברמה עם גבחת (i.דואר., גב / הגחון לתאם כבר לא קורא אפס), לאפס את הגחון / גב קוראים ל0.0 כדי להבטיח שהעומק של ההזרקה לא השתנה.
- לקדוח חור קטן בגולגולת עם מקדח סיבובי כף יד לבוש עם קצה שיניים סטרילי באתר המתאים מסומן בעט בשלב 5.5. החזק את התרגיל בזווית לגולגולת ומאוד לגעת בעדינות את הקצה עד לשד העצמות. חזור על פי צורך. קידוח כמעט אבל לא לגמרי דרך העצם, עוזב את המחט למעשה לחדור שכבה זו של הגולגולת, תוצאות בהזרקה הנקיה.
- להסיר אבק עצם עם מקלון צמר גפן טבולה בPBS או תמיסת מלח. להחזיר את המזרק למשאבה ולהוריד את המחט ישר למטה לחור בר כדי לוודא את המיקום. אם החור בר לא מרוכז עם המחט, להשתמש בתרגיל להגדלת הפתיחה.
- בעדינות מערבב את ההשעיה התא ולצייר את התאים לתוך המזרק באמצעות בקר המשאבה. למנוע בועות וגושים ולנגב את שנינות המחטh ספוגית אלכוהול כדי להסיר תאי זיהום על פני השטח החיצוניים. אם המזרק / המחט סתומה או קפוא, להסיר ומהירות נקייה עם מים סטריליים וEtOH 70%.
- מנמיכים את המחט לרמה של פני השטח הגולגולת (0.0 מ"מ הגחון / גב). אז לאט לאט (מעל כ 1 דק ') להוריד את המחט לחדור מבעד העובי המלא של הגולגולת ולחדור למוח לעומק של ventrall 4 מ"מ. למשוך את המחט לאט ל3.5 מ"מ הגחון. אם ראש העכבר מוחזק באופן מאובטח ביחידת stereotaxic, לא אמור להיות כמעט שום תנועה של הגולגולת.
- ודא שהפרמטרים הנכונים הם נכנסו לתוך בקר המשאבה (סעיף 2.2) ולחץ על "Run / STOP" (או כפי שהורה במדריך מוצר) לautoinject תאים. לפקח על העכבר ולהתאים isoflurane אם צוין. צפה במזרק ולוודא כי הבוכנה נעה בחבית. תנועה קפוא או סתום יכולה לגרום לנטיית בוכנה שבורה /.
- חכה 1 עד 2 דקות עם המחט בבגשם, אז לאט לאט (מעל 3 עד 4 דקות) לסגת מחט מהרקמה. סה"כ זמן כדי להסיר את המחט לאחר ההזרקה היא מלאה הוא 5 דקות. השתמש במטלית כותנה למחוק סביב החור בר האזור; להשאיר את הקצוות של העור הפתוח על מנת לאפשר את העצם לייבוש.
- הסר מזרק מהמשאבה ולשטוף במהירות 3x עם סטרילי H 2 O, 3x עם EtOH 70%, ופי 3 עם סטרילי H 2 O (או על פי הנחיות יצרן). נגב מחט עם EtOH ומניח בצד.
- החל שעוות עצם סטרילי (שווה ערך ל μl 1 או 2) לחור בר ולהשתמש בסופו של הדבר מעץ של מקלון צמר גפן סטרילי כדי לסתום את השעווה על ולתוך העצם. אם פני השטח מיובש כראוי, זה צריך להישאר.
- מורחים וילון סטרילי מעל אזור עבודת העכבר ומקיף ותפר את החתך; שלושה תפרים צריכים להיות מספיק. לחלופין, ניתן להשתמש בדבק כירורגים. החל אנטיביוטי מקומית.
- להפחית isoflurane ל -0% ולהסיר את העכבר מיחידת stereotaxic, להיות גareful כדי להגן על שיניים. בדוק אוזניים, פה ולשון.
- לפקח על העכבר לאחר ההזרקה באופן הדוק. מקום עכבר על משטח חום במשך 5 עד 10 דקות; לאחר מכן להעביר לכלוב (על כרית חום) ולבחון עד עכבר מתעורר והוא אמבולטורי. אל תשאיר ללא השגחה העכבר עד שהוא חזר מספיק תודעה כדי לשמור recumbence sternal. אל תחזרו עכבר לחברתם של בעלי חיים אחרים, עד שהתאושש באופן מלא. קחו למשל את השימוש במשככי כאבים נוספים, אם סימנים של כאב הם הבחינו.
.6 סיום ושחזור צג והתפתחות גידולים
- יש לנקות את כל הכלים והציוד באמצעות 70% EtOH, מעקר את חרוז או חומר חיטוי בין עכברים.
- לפקח על העכברים שהוזרקו במשך יומיים לאחר ההליך לסימנים של כאב, זיהום או סיבוכים אחרים. הזרק במשככי כאבים ב24 ו48 שעה (או שצוין כ) לאחר הליך. הסר תפרים ב7 עד 10 ימים, במידת צורך.
- להעריך את העכברים לסימנים קליניים של המחלה, paralysiים, ירידה בפעילות, ירידה במשקל, התקפים, או מחלה כללית.
- לפקח על התפתחות גידולים בשיטה המתאימה [הדמיית תהודה מגנטית (MRI), במערכות ההדמיה Vivo (IVIS), וכו '].
תוצאות
ניתן ליצור xenografts תוך גולגולתי אמין עם טכניקה מתוארת זה. זיהוי המבנים הקריטיים של גולגולת העכבר (איור 1) יאפשר להכרה בגבחת ולהנחות את החוקר למיקום מדויק ושחזור הזרקה. במחקרים אלה את הקו של הורי U251, תאי U251 transfected עם לוציפראז (U251 לוק), או U87 הונצחו תאי תרבות אנושיים GBM רקמות הושעו ב4 עד 6 μl של SF-DMEM והזריקו 2.5 מ"מ קדמי לרוחב (מימין), 1.5 מ"מ , ו3.5 מ"מ הגחון ביחס לגבחת (איור 2).
יכולים להיות דמיינו גידולים וכתוצאה מכך ונותחו על ידי הדמיה בתהודה מגנטית (MRI, איור 3), in vivo זורח הדמיה (IVIS, איור 4), או טכניקות פתולוגיה ברוטו שגרתיות (צביעת H & E, איור 5). טיפול מסוים יש לנקוט ואופטימיזציה שבוצעה כדי לקבוע את appropriaתאים ומיקום של הזרקת te לייצג תזמון, קצב צמיחה, ומודל גידול רצוי.

.1 גולגולת איור האנטומיה. התכונות האנטומי של ראש העכבר והגולגולת מומחשת. גבחת, אשר על ציר קו האמצע בין העיניים והאוזניים בצומת של העטרה ותפרי sagittal, משמשת לאיתור reproducibly קואורדינטות ההזרקה.
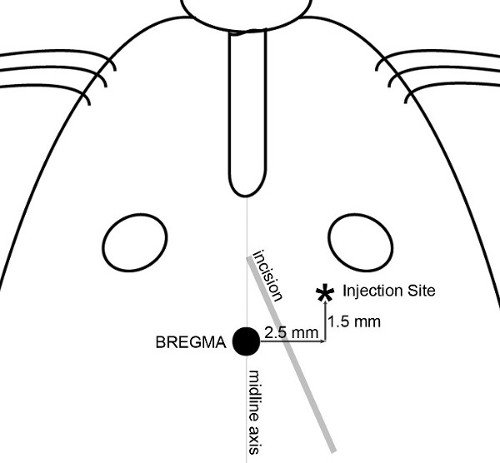
איור 2 חתך ומפת ההזרקה. התכונות המשמשות לקביעת חתך בעור ודווקא לאתר את אתר ההזרקה מומחשות. חתך אלכסוני עשוי לאפשר גישה לשני גבחת ואתר ההזרקה. יישום של H 30% 2 O 2 על פני השטח של הגולגולת עוזר לדמיין תפרי גולגולת. מקם מזרק עם מחט על micropump ולתמרן את קצה המחט ישירות על גבחת. סט קואורדינטות על קונסולת היישור לאפס; אז כל מדידות הגולגולת עשויות reproducibly ביחס לגבחת.
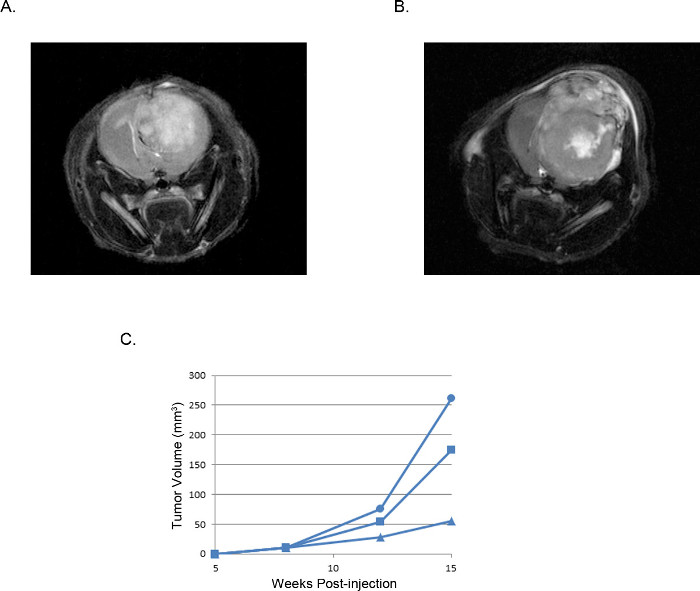
איור 3 גידולי xenograft תוך גולגולתי נציג: תמונות MRI MRI T2 תמונות משוקללת של גידול נובע מ2 x 10 5 תאים () U87 לעומת גידול נובע מ( ב) 2 x 10 5 U251 תאים.. כרכי גידול (C) מחושבים מתמונות MRI של שלושה עכברים בודדים הוזרקו תאי U251 זממו לאורך הזמן מציג חלון לשחזור של התפתחות גידול וצמיחה שעולות בקנה אחד בכל הניסויים.
e = "תמיד"> 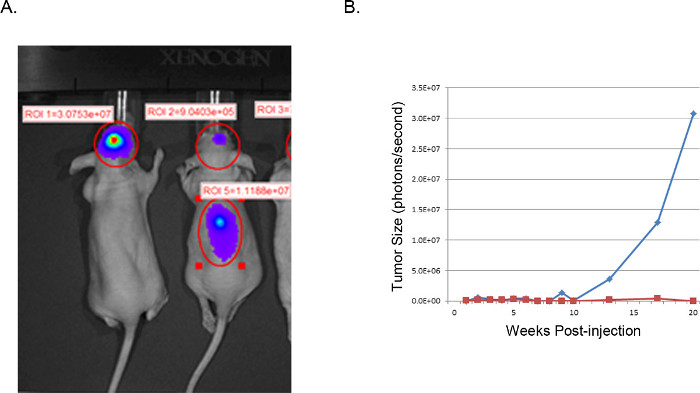
.4 גידולי איור נציג xenograft: תמונות IVIS. תמונת IVIS של U251-לוציפראז- transduced תאי GBM הזריקו intracranially לעכברים בעירום (). העכבר בצד השמאל היה בהצלחה הזריק כפי שתואר בתאי U251 לוק ומראה אות focalized (פוטונים / sec) חזק מאוד במיקום הרצוי. העכבר מהימין מדגים תוצאה לא מוצלחת ממיקום הזרקה לא תקין. בדיקת H & E של עמוד השדרה גילתה צמיחת תאים סרטנית בעמוד השדרה כתוצאה מהזרקה קרובה מדי לקו אמצע עם הפצה של חדר. גודל (ב) גידול מוערך מפעילות בלוציפראז (פוטונים / שני) באזור במוח של עניין, זממו לאורך זמן. הקו הכחול מתאים לעכבר עם הזרקה תוך גולגולתי מוצלחת, ואילו הקו האדום מתאים לעכבר עם עקירת תאים סרטניים בעמוד השדרה.
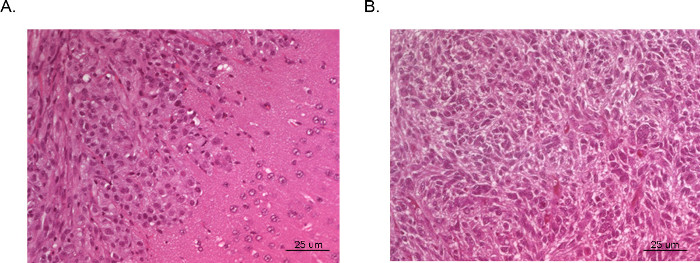
איור 5 H & E של גידולי xenograft תוך גולגולתי. המוח כולו נאסף מעכברים לפרסם הקרבה וקבוע בפורמלין, רכוב בפרפין, מחולק ומוכתם עם H & E. גידול () נגזר מתאי U87 GBM ומדגים על שטח של צמיחה הצפופה של גידול (בפינה עליונה משמאל) ורקמת מוח נורמלית סמוכה עם פלישה מיקרוסקופית של תאים ממאירים (מימין בפינה תחתונה). גידול (B) נלקח מסעיף של מרכז גידול שמקורם בתאי U251 GBM. הסעיף משכפל מאוד הדוק היסטופתולוגיה המוזרה עם תאים ממאירים multinucleated ראו בGBM האנושי הטיפוסי.
Discussion
מודלים עכבר orthotopic של סרטן המוח אנושי יכולים להיות כלי מצוין להערכת היעילות של טיפולים קליניים, אך יש להקפיד כדי לייעל את המיקום של תאים ברקמת המוח. מחקרים הראו כי כמויות מופרזות aliquot, טכניקת הזרקה תת אופטימלית ושיעורי זריקה חפוזים עלולות לגרום לדליפות וההופעה של תאים סרטניים במקומות לא רצויים (חדרי לב, עמוד השדרה, אזורי extradural, וכו '.) וגבוהה וריאציה בגודל גידול 2 (תצפיות אישיות ). ניתוח של אספקה המונע על ידי מעבד זעיר של דגימות noncellular מצא כי השימוש בmicropump מיוצר משלוח focalized יותר, ריפלוקס מדגם פחות ופחות השתנות מאשר שיטות ידניות של הזרקה, שיוחסו למשלוח החלק, אחיד ועקביים לחצים 3. למרות שזה עשוי להיות מאתגר כדי לעבות את המספר הדרוש של תאים בנפח של רק 2 או 4 μl, השימוש בטכניקת מכשיר וקונסולת יישור stereotaxicuipped עם מיקרו משאבה לתכנות יכול להניב גידולים לשחזור ואמינים עם שיעורי צמיחה דומים. מודל xenograft לא יכול באמת לשכפל את microenvironment, הייזום ופיתוח של גידול טבעי, במיוחד עם מארחים חסרים חיסוניים, אבל מודל orthotopic מתוכנן היטב ומיושם הוא החלופה הטובה ביותר, והוא עדיף בהרבה על מודל מחוץ לרחם.
היתרון העיקרי של פרוטוקול זה הוא הקמתה של גידולים לזיהוי במסגרת זמן עולה בקנה אחד. התזמון של הופעת גידול תלוי בסוג התא ואת מספר התאים המוזרקים, אבל הוא צפוי למדי, ורוב הגידולים מוקמים בתוך חלון צר, יחסית לתקופת צמיחת גידול (כלומר, הזמן עד נקודת סיום). זה מאפשר לחוקר לזהות נקודות זמן לאיסוף נתונים (כגון MRI או IVIS) או התערבות (כגון טיפול תרופתי). שיעורי צמיחת גידול משתנים עם סוג תא, מספר התאים מוזרקים, וfrעכבר אום לעכבר (כמה שהם עושים בחולים אנושיים), אך עולים בקנה אחד מניסוי לניסוי.
ייתכן שבעוד פרוטוקול זה מעסיק טכניקה שדורש יותר מכשור וזמן מאשר שיטות ידניות מדויקות פחות מהזרקה ולא יכול להיות ישים לחקירות בקנה מידה גדולות, טכניקות לזריקות תוך גולגולתי, המאפשרות לתפוקה של מספר רב של בעלי חיים (כגון זה שתואר על ידי איוואמי et al. 12) על ידי הגדרה כרוכה בהזרקה מהירה, בלחץ גבוה, ולעתים קרובות כרוך במכשור שנערך ביד ומדידה ידנית, אשר כפופים לחוסר יציבות וחוסר ודאות. גורמים אלה עשויים להיות קשורים לדליפה ומחוץ יעד משלוח 2,3. הדיוק, שחזור, והתמותה נמוכה של הליך זה יאפשר לחוקר לתכנן את ניסויים של טיפול באמצעות פחות עכברים כדי להשיג תוצאות משמעותיות מבחינה סטטיסטית - חיסכון נקי.
צעד אחד הוא קריטי להצלחה של השתלת גידול: המיקום המדויק של ההזרקה. תאים המוזרקים קרוב מדי לחדרי הלב עלולים להוביל לCSF התפשטות המחלה דרך מערכת חדרים או לאזורי extracranial. תאים המוזרקים רדוד מדי עשויים לגדול באמצעות מסלול המחט. קואורדינטות שנקבעו מראש הן בעלי ערך מועט, אם מיקום מחט הוא מרושל. קח את הזמן כדי למקם את ראש העכבר מאובטח ביחידת stereotaxic. השתמש באפשרויות התאמת stereotaxic וברי האוזן כדי להתאים את הציוד לעכבר, ולוודא שהראש ממוקם ביציבות ולא רוק או טוויסט במהלך ההליך. שינויים או וריאציה אם אתר ההזרקה עלול להשפיע על מאפייני גידול, כוללים לקחת גידול, צמיחה, פוטנציאל פולשני, וגישה לאספקת סמים ואספקת חמצן.
פרמטרים נוספים שיש להם השפעה עמוקה על הגידול וכתוצאה מכך כוללים את שיעור ההזרקה, מספר תאים ונפח; כולם חייבים להיקבע באופן אמפירי. למזער את עוצמת הקול עבור number של תאים הנדרשים לצמיחת גידול; להשתמש בשיעור ההזרקה האיטי ביותר המעשי. מספר תא ומספר הקטע יש גם השפעות משמעותיות על לקחת גידול וצמיחה. הציוד מיוחד המשמש כאן מציע שליטה מעולה, אבל המושגים של נפח מינימאלי, מיקוד מדויק, שיעור הזרקה מינימאלי ועולה בקנה אחד, ונסיגת מחט איטית ניתן ליישם במגוון רחב של טכניקות (כולל הזרקה ידנית) ומגוון רחב של מכשירים.
הליך זה פתוח למגוון של שינויים: אתר ההזרקה עלול להיות מותאם אישית כדי לשחזר סוגים מסוימים של גידולים. תאים חסיד תרבית רקמה, שיבוטים מהונדסים גנטי, neurospheres, גידולי עכבר מפוצלים, או שברי רקמה אנושיים ניתן engrafted לתוך מוח עכבר. טכניקה זו יכולה אפילו להיות מותאמת ללימודי noncellular, כוללים גנטית נגיפי העברה 3. ברגע ששיטה אמינה לייצור גידולים של המאפיינים הרצוי הוקמה, ניסויי השוואת אפיcacy של טיפולים, טיפולים תרופתיים ושילובים, ואפשרויות אחרות כגון העברת גנים ניתן לבצע.
Disclosures
יש לי המחברים אין לחשוף.
Acknowledgements
ד"ר קיטינג ממומן על ידי מענק CA100335 DOD והוא הקרן Scholar של סנט Baldrick.
Materials
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| Small Animal Stereotaxic Instrument with Digital Display Console | Kopf | Model 940 | |
| Mouse Gas Anesthesia Head Holder | Kopf | Model 923-B | |
| Mouse Ear Bars | Kopf | Medel 922 | |
| Fiber Optic Illuminator | Fisher | 12-562-36 | |
| UltraMicroPump III | WPI | UMP3 | |
| Micro4 microprocessor | WPI | UMC4 | |
| Variable speed hand-held rotary drill | Dremel | Model 300 | |
| Dental drill bit, 1.0 mm | Spoelting | 514554 | |
| Adaptor for dental drill bit: 3/32 inch collet | Dremel | 481 | |
| Heating pad | for mice | ||
| Isoflurane vaporizer system | for mice | ||
| Medical tubing and connectors | to connect isoflurane vaporizer with stereotaxic frame | ||
| Instruments | |||
| Precision 25 μl microsyringe | Hamilton | 7636-01 | Model 702, without needle |
| Microsyringe needles, 26s G | Hamilton | 7804-04 | RN, 25 mm point style 2 |
| Fine-tipped scissors (straight, sharp/sharp) | |||
| Medium-sized standard scissors | |||
| Standard serrated forceps | |||
| Serrated hemostats (2) | |||
| Fine-tipped forceps | |||
| Supplies | |||
| Sutures 5-0 vicryl P-3 13 mm (Ethicon) | MWI | J463G | |
| Surgical blades #10, stainless (Feather) | Fisher | 296#10 | |
| Isoflurane (Fluriso) | VetOne | NDC 13985-528-60 | Item #502017. Liquid inhalation anesthetic. federal law restricts this drug to use by or on the order of a licensed veterinarian. |
| Carprofen (Rimadyl Injectable 50 mg/ml) | Pfizer | NDC 61106-8507-01 | dilute in saline |
| Ophthalmic ointment (artificial tears) | Rugby | NDC 0536-6550-91 | |
| Topical antibiotic (AK-Poly-Bac ) | Akorn | NDC 17478-238-35 | |
| Povidone-iodine topical antiseptic, 10% (Betadine) | Betadine | NDC 67618-150-04 | |
| Hydrogen peroxide, 30% | Fisher | H325-100 | for visualizing skull landmarks |
| Sterile saline | VetOne | NDC 13985-807-25 | for diluting solutions, cleaning tissue |
| Bone wax | WPI | Item #501771 | |
| Sterile drapes | McKesson | 25-517 | |
| Sterile surgical gloves | McKesson | (to fit) | |
| Sterile gauze pads, 2 x 2 | Fisherbrand | 22028556 | |
| Sterile gauze pads, 4 x 4 | Fisherbrand | 22-415-469 | |
| Alcohol prep pads (medium) | PDI | B603 | |
| Sterile cotton-tipped applicators | Fisherbrand | 23-400-114 | |
| Sterile 0.5 ml screw cap tube with caps for cells | USA Scientific | 1405-4700 | for cells |
| Individually wrapped sterile dispo pipettes | Fisher | BD 357575 | for needle cleaning solutions |
| BD insulin syringes with needles | Fisher | 329461 | for analgesic |
| 70% Ethanol | for cleaning | ||
| Sterile diH2O | for cleaning | ||
| Microfuge tubes for cleaning solutions | for needle cleaning solutions | ||
| Felt tip pen (dedicated) | for marking skull | ||
References
- Heyer, J., Kwong, L. N., Lowe, S. W., Chin, L. Non-germline genetically engineered mouse models for translational cancer research. Nature reviews. Cancer. 10, 470-480 (2010).
- Yamada, S., et al. A method to accurately inject tumor cells into the caudate/putamen nuclei of the mouse brain. The Tokai journal of experimental and clinical medicine. 29, 167-173 (2004).
- Brooks, A. I., et al. Reproducible and efficient murine CNS gene delivery using a microprocessor-controlled injector. Journal of neuroscience. 80, 137-147 (1998).
- Shankavaram, U. T., et al. Molecular profiling indicates orthotopic xenograft of glioma cell lines simulate a subclass of human glioblastoma. Journal of cellular and molecular medicine. 16, 545-554 (2012).
- Giannini, C., et al. Patient tumor EGFR and PDGFRA gene amplifications retained in an invasive intracranial xenograft model of glioblastoma multiforme. Neuro-oncology. 7, 164-176 (2005).
- Yi, D., Hua, T. X., Lin, H. Y. EGFR gene overexpression retained in an invasive xenograft model by solid orthotopic transplantation of human glioblastoma multiforme into nude mice. Cancer investigation. 29, 229-239 (2011).
- Carty, N., et al. Intracranial injection of AAV expressing NEP but not IDE reduces amyloid pathology in APP+PS1 transgenic mice. PLos ONE. 8, e59626 (2013).
- Thaci, B., et al. Pharmacokinetic study of neural stem cell-based cell carrier for oncolytic virotherapy: targeted delivery of the therapeutic payload in an orthotopic brain tumor model. Cancer gene therapy. 19, 431-442 (2012).
- Ozawa, T., James, C. D. Establishing intracranial brain tumor xenografts with subsequent analysis of tumor growth and response to therapy using bioluminescence imaging. J. Vis. Exp. (41), (2010).
- Valadez, J. G., Sarangi, A., Lundberg, C. J., Cooper, M. K. Primary orthotopic glioma xenografts recapitulate infiltrative growth and isocitrate dehydrogenase I mutation. J. Vis. Exp. (83), (2014).
- Baumann, B. C., Dorsey, J. F., Benci, J. L., Joh, D. Y., Kao, G. D. Stereotactic intracranial implantation and in vivo bioluminescent imaging of tumor xenografts in a mouse model system of glioblastoma multiforme. J. Vis. Exp. (67), (2012).
- Iwami, K., et al. A novel method of intracranial injection via the postglenoid foramen for brain tumor mouse models. Journal of neurosurgery. 116, 630-635 (2012).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved
We use cookies to enhance your experience on our website.
By continuing to use our website or clicking “Continue”, you are agreeing to accept our cookies.
