Method Article
Crear anatómicamente exactos y reproducibles intracraneal xenoinjertos de tumores cerebrales humanos
En este artículo
Resumen
El cerebro es un sitio único con cualidades que no están bien representados por los análisis in vitro o ectópicos. Modelos ortotópico de ratón con la ubicación y características de crecimiento reproducibles se pueden crear de forma fiable con inyecciones intracraneales utilizando un instrumento de fijación estereotáxica y una bomba de inyección de baja presión.
Resumen
Modelos de tumores ortotópico Actualmente la mejor manera de estudiar las características de un tipo de tumor, con o sin la intervención, en el contexto de un animal vivo - sobre todo en lugares con cualidades fisiológicas y arquitectónicos únicos, como el cerebro in vitro y modelos ectópicos no pueden. dar cuenta de las características tales como la vasculatura, la barrera de sangre del cerebro, el metabolismo, la administración de fármacos y toxicidad, y una serie de otros factores pertinentes. Ortotópico modelos tienen sus limitaciones también, pero con células tumorales técnica apropiada de interés pueden ser injertados con precisión en el tejido que más estrechamente imita las condiciones en el cerebro humano. Por métodos que proporcionan volúmenes medidos con precisión a definido con precisión lugares a una velocidad y presión constante, modelos de ratón de tumores cerebrales humanos con tasas de crecimiento predecibles se pueden crear de forma reproducible y son adecuados para el análisis fiable de las diversas intervenciones empleando. El protocolo aquí descrito se centra en el TEdetalles chnical de diseño y preparación para una inyección intracraneal, la realización de la cirugía, y garantizar el crecimiento tumoral exitosa y reproducible y proporciona puntos de partida para una variedad de condiciones que se pueden personalizar para una gama de diferentes modelos de tumor cerebral.
Introducción
Estudios in vitro de células tumorales cerebrales son de incalculable valor para la disección de los mecanismos moleculares que impulsan el crecimiento, la supervivencia, la migración y la invasión de las células cancerosas; experimentos de células cultivadas pueden definir las vías de señalización, sugerir posibles dianas terapéuticas, y caracterizar la respuesta celular al tratamiento farmacológico. Pero in vitro sistemas son demasiado simplistas para predecir la respuesta del organismo a los productos farmacéuticos; que carecen de las reacciones fisiológicas, respuestas inmunes, microambiente celular, y heterogeneidad general de los sistemas de animal vivo. Genéticamente modelos de ingeniería puede ser muy valiosa, cuando esté disponible, pero existen diferencias moleculares entre las especies y de las células murinas pueden no recapitular los acontecimientos en los procesos humanos, dando lugar a discrepancias significativas al comparar los modelos animales a observación clínica 1. Modelos de xenoinjertos en ratones consistente (SQ) inyección subcutánea de líneas celulares de tumores cerebrales humanos bajo la piel del flanco son fáciles de realizary medir; que se pueden usar para abordar los efectos de la modificación genética y la administración del fármaco / entrega, el metabolismo y la toxicidad. Inconvenientes significativos, sin embargo, limitan la utilidad de los modelos SQ. El microambiente no recapitula la de un tumor cerebral de origen natural: las interacciones de los diversos tipos de células y tejidos; la vasculatura local y otros innumerables factores única para el cerebro no se pueden replicar. Para reproducir con mayor precisión el medio único de un tumor cerebral de origen natural y probar los efectos de las intervenciones farmacéuticas, un modelo ortotópico de ratón debe ser utilizado. Además, las técnicas ortotópico se pueden utilizar como parte de un enfoque de ingeniería genética en el que las células no cancerosas humanas primarias (diferenciado o progenitor) son modificadas genéticamente y se inyecta en el sitio correspondiente de un ratón, con o sin células del estroma humanos, lo que resulta en la tumorigénesis similar a la observada en los seres humanos 1.
En este artículo se describeuna metodología para crear con precisión y de manera reproducible tumores cerebrales en ratones. Usando esta técnica, el usuario puede inyectar con precisión una pequeña alícuota de células suspendidas en una ubicación especificada de la región fronto-parieto-temporal de la corteza cerebral de ratón. Mortalidad Mouse es extremadamente baja; en nuestras manos, no hay ratones han muerto a causa de complicaciones quirúrgicas después de 185 procedimientos. Características del tumor resultante se pueden comparar con la de los tumores clínicos humanos típicos; por ejemplo: la rapidez de crecimiento, grado de necrosis, extensión de la invasión, la heterogeneidad del tipo de células, la presencia de células mitóticas, marcadores de proliferación y apoptosis, etc líneas celulares o muestras de tejido o desagregados tumorales humanas pueden ser evaluados en base a su capacidad para simular presentación clínica real. Pharmaceuticals, seleccionados en base a su rendimiento en el cultivo de células, se puede probar en el contexto de un metabolismo funcionamiento, el sistema circulatorio, y la barrera sangre-cerebro, tal como existen en un ingenio de los animales cargadosha tumor, todo en un contexto arquitectónico relevante. Además, las células elegidas para inyección se pueden modificar genéticamente para investigar el impacto de caídas específicas, deleciones, knock-ins, mutaciones, etc, sobre el crecimiento del tumor y la supervivencia.
Un número de publicaciones de documentos de estudios de tumores utilizando una variedad de técnicas intracraneales. Yamada et al. Hizo un estudio detallado de la inyección de colorante y de las células U87 y se encontró que la minimización del volumen y la tasa de inyección produce la mejor tumor 2. . Brooks et al encontró superior reproducibilidad y la eficiencia utilizando un inyector controlado por microprocesador en lugar de un método manual para entregar vectores virales; sus conclusiones con respecto a los parámetros óptimos de inyección son aplicables a la entrega de 3 celdas. Shankavaram et al. Demostraron que con glioblastoma multiforme (GBM) líneas de células inyectadas ortotópicamente (usando un método manual) en el cerebro recapituló el perfil de expresión génica de la cltumores inical más estrechamente que sea en xenoinjertos in vitro o SQ, que apoya el uso de modelos intracraneales para estudios preclínicos 4. Giannini et al. Células de especímenes quirúrgicos humanos que habían sido sostenidas en los flancos de ratones desnudos por pases seriados en los cerebros de los ratones inyectados adicionales, y demostró que este enfoque conserva pacientes alteraciones genéticas del tumor en el modelo 5. Resultados similares fueron reportados por Yi et al 6. Uso de una configuración estereotáxica, sitio de la inyección cuidadosamente definido, y una velocidad de inyección lenta y constante, se obtuvieron tumores cerebrales reproducibles con tasas de crecimiento consistente y de alta (100%) Tasa de injerto. La validez de esta técnica, por lo tanto ha sido bien establecida; una búsqueda en la literatura sugiere que las aplicaciones de esta técnica son extensas. Carty et al. Utiliza inyecciones intracraneales para entregar con éxito vectores virales que expresan genes terapéuticos en la corteza frontal de transgenic modelo de la enfermedad de Alzheimer 7. Thaci et al. Describe el uso de inyecciones intracraneales para entregar adenovirus oncolítico terapéutico en un vehículo basado en células madre neuronales en ratones desnudos que llevan ya ortotópicamente tumores inyectados GBM 8. Claramente, las inyecciones intracraneales son una herramienta versátil y eficaz para la investigación preclínica. Publicaciones anteriores en el Diario de los experimentos visualizados describen enfoques fundamentales 9-11, pero tomamos el concepto de la inyección del tumor intracraneal y modelado ortotópico a un nivel más alto de precisión usando tecnología fácil de dominar.
Protocolo
Todos los procedimientos descritos fueron revisados y aprobados por nuestro comité de cuidado de los animales y el uso institucional.
1. plan del experimento
- Elija células a inyectar. Las células procedentes de una variedad de fuentes son candidatos para la inyección: líneas de cultivo de células adherentes, clones modificados genéticamente, células de neuroesferas, cultivos primarios o tumores desagregados. El tipo de modelo deseado definirá el sitio más apropiado de la inyección.
- Determinar el número de células por inyección. El número de células requerido para formar tumores varía con la línea celular y debe ser determinada empíricamente; tasa de crecimiento del tumor depende en gran medida del tipo de célula, el número de células y el número de pases en cultivo de tejido. El número de células que van desde 1 × 10 4 2 x 10 5 o más por inyección han producido tumores de tasas de crecimiento diferentes.
- Limitar el volumen de inyección. Las células deben ser suspendidos en el volumen pequeño de medio libre de suero o de fosfato tamponada saline (PBS) que permite el paso fácil liso, a través de una aguja de 26 g. Cuanto menor sea el volumen efectivamente entregado en el cerebro, el más preciso y definido el tumor resultante; resultados óptimos se obtienen mediante la inyección de volúmenes que van del 3 al 6 l. Plan para preparar un volumen total final de al menos 50 l de células suspendidas, sin importar el número de inyecciones previstas, para permitir la medición exacta, la mezcla y de muestreo.
- Elija ratones apropiado para el modelo. Los modelos murinos de tumores humanos utilizan típicamente ratones inmunocomprometidos jóvenes para evitar el rechazo del injerto inmune mediada. No es necesario que el trabajo se lleve a cabo en un gabinete de seguridad biológica, si se toman las precauciones adecuadas, incluyendo la descontaminación, desinfección y esterilización de materiales y equipos. El trabajo que se muestra aquí se ha hecho en ratones atímicos, hombres y mujeres, de entre 6 y 12 semanas de edad. Los ratones que pesan menos de 20 g puede ser difícil de posición sobre comotereotaxic marco y pueden ser más susceptibles a la hipotermia.
2. Monte el Equipo
- Obtener y descontaminar un ratón marco estereotáxico, consola de alineación, y soporte del cabezal de la anestesia de gas del ratón, bomba microjeringa, almohadilla de calor, máquina de anestesia, lámpara de trabajo de fibra óptica, y un taladro rotativo de velocidad variable. Limpie y desinfecte todo el equipo.
- Programar los parámetros de inyección (incluyendo el volumen de inyección, la tasa, las unidades de tasa, tipo jeringa de flujo) y otras variables necesarias para el funcionamiento de la bomba de jeringa. Optimizar los ajustes para cada modelo en particular.
NOTA: En estas inyecciones los ajustes eran 3.000 muestras nl a un ritmo de 400 nl / min (unidades de gasto "M") usando una jeringa de 25 l (Tipo de dispositivo "E") en el modo de no agrupados ("N"). - Limpie una microjeringa precisión con 26 T aguja con varios enjuagues de agua desionizada estéril (diH 2 O) y 70% de etanol (EtOH), haciendo un ri definitivanse con diH 2 O. Algunos, pero no todos los modelos están diseñados para ser esterilizado en autoclave. Asegúrese de que el movimiento del émbolo es suave y libre.
- Obtener el equipo de administración de anestesia. El isoflurano es el anestésico preferido ya que es fácil de regular la profundidad y duración de la anestesia. Asegúrese de que la unidad estereotáxica está equipado con un accesorio de gas anestesia ratón y que el tubo y conectores necesarios están en su lugar para suministrar la mezcla de gas de la máquina de anestesia para el ratón.
- Herramientas quirúrgicas Autoclave, incluyendo tijeras de punta fina, dos pinzas / hemostáticos (con dientes) para la sutura, tijeras, pinzas de tamaño medio a medio y punta fina, y al menos dos de 1 mm brocas dentales. Mantener limpias instrumentos durante el procedimiento con 70% de EtOH, desinfectante, o un esterilizador de cuentas.
- Obtener isoflurano, analgésico, oftálmica ungüento / lubricante, ungüento antibiótico, solución salina, el peróxido de hidrógeno al 30% (H 2 O 2), antiséptico, y cera de hueso (si se desea) a partir de unasuministro de veterinaria o médica. Preparar estéril diH 2 O y el 70% de EtOH. Desechables tales como gasas, apósitos estériles, suturas, hisopos de etanol, hisopos de algodón con punta, guantes quirúrgicos estériles, hojas quirúrgicas y más están detallados en la lista de materiales. Un marcador permanente de punta fina para marcar el cráneo debe ser descontaminado y dedicada para uso quirúrgico.
3. preparar células para inyección
- En los experimentos que se muestran aquí, seleccione una línea celular humana inmortalizada GBM. Determinar el número de células (2 x 10 5) y el volumen de suspensión que se inyecta (3 l) empíricamente; detalles pueden variar con el tipo de célula. Utilizar un volumen de al menos 50 l para facilitar la exacta medición, mezcla, y la inyección.
- Trypsinize células y resuspender en medios de comunicación o PBS. Lleve a cabo los siguientes pasos justo antes de la inyección de células:
- Retire el medio de las células mediante aspiración y enjuague con 10 ml de PBS por placa de 100 mm; eliminar PBS.
- Add 1 ml de tripsina a cada placa de 100 mm y se incuba a RT el tiempo suficiente para producir una única suspensión celular.
- Detener la actividad de la tripsina con 5 ml Medio Eagle Modificado de Dulbecco (DMEM) + 10% de suero fetal bovino (FBS) por placa de 100 mm.
- Precipitar las células por centrifugación a 450 xg y resuspender en ~ 5 ml de suero libre de DMEM (SF-DMEM) por placa de 100 mm.
- Recuento de células viables utilizando un hemocitómetro o un contador de células automatizado.
- Ajuste la densidad de células vivas a 2 x 10 5 células / 3 l (o según lo determinado por la experimentación) sedimentando las células y resuspensión en SF-DMEM.
- Mantenga células refrigerados en hielo o una compresa frío (no permita que las células se congelen). Mezclar suavemente con un movimiento rápido del dedo.
4. Anestesiar y Preparar ratón para Cirugía
- Inducir la anestesia utilizando ~ 5% de isoflurano (oxígeno flujo ~ 2 L / min) o como lo indique el veterinario. La inducción debe tomar de 2 a 3 min. Mantener ratón en una profundidad adecuadade la anestesia con ~ 3% de isoflurano.
- Comprobar la profundidad de la anestesia por pellizco dedo del pie, si está indicado ajustar isoflurano y continuar vigilando la respiración y la puntera respuesta pellizco durante todo el procedimiento. Cubra ratón con gasas para el calor y el ratón del monitor con regularidad durante todo el procedimiento, que puede tardar de 45 minutos a 1 hora, dependiendo de la velocidad de inyección.
- Coloque el ratón en el marco estereotáxico deslizando cuidadosamente la barra paladar sobre la lengua y en la boca. Enganche los incisivos delanteros en el agujero del diente. Utilice barras de oído para estabilizar la cabeza, con la superficie de oreja a ojo lo más cerca horizontal posible. No fuerce las barras en el canal auditivo. Es fundamental para posicionar la cabeza de forma segura: comprobar el movimiento de lado a lado y de arriba a abajo suavemente con los dedos. Utilice los controles ajustables de la unidad estereotáxica para optimizar en forma.
- Lubricar los ojos con un ungüento oftálmico. Limpie la piel entre las orejas y los ojos dos veces con alternancia de aplicaciones de povidona-yodoe antiséptico y 70% de EtOH.
- Inyectar por vía subcutánea analgésico elegido (SQ) en el flanco (o según las indicaciones).
5. Realizar Inyección
- Determinar el sitio de la inyección. El sitio de inyección puede variar con el tamaño y la cepa de ratón y el tipo de célula. Las células inyectadas demasiado cerca de los ventrículos pueden conducir a cráneo-vertebral propagación de la enfermedad. Las células inyectadas demasiado superficial pueden crecer a través del trayecto de la aguja.
NOTA: En los experimentos que se muestran aquí, el objetivo se define como la región frontal de la corteza cerebral un sitio de 2,5 mm lateral (derecha), se eligió 1,5 mm anterior y 3,5 mm ventral con respecto a la bregma (Figura 1), produciendo un tumor del cerebro medio en los ratones que van desde 20 a 30 g. - Hacer una pequeña incisión (~ 8 mm de largo) utilizando una técnica estéril a través de la piel de la cabeza para exponer el bregma y el sitio de la inyección. Un corte diagonal, desde un punto entre el eje de la línea media y el ojo derecho hacia el oído derecho ( Figura 2) permite el acceso tanto a la bregma y el sitio de inyección.
- Retirar la piel y utilizar un hisopo de algodón estéril para secar la superficie del cráneo. Seque el hueso con otro hisopo humedecido con H 2 O 2 para visualizar bregma. El H 2 O 2 se producen burbujas de oxígeno, dejando las líneas finas de espuma blanca a lo largo de las suturas coronal y sagital que se cruzan en bregma.
- Bloqueo de una jeringa vacía con la aguja en la microbomba y maniobrar la punta de la aguja directamente sobre el bregma; conjunto coordina en la consola de alineación a 0,0 mm lateral, 0.0 mm anterior / posterior y 0,0 mm ventral / dorsal.
- Mueva la aguja a 2,5 mm lateral (derecha) y 1,5 mm anterior con respecto al bregma (o ubicación deseada) utilizando los botones de control en la unidad estereotáxica. Levante ligeramente la jeringa y marcar la ubicación exacta en el cráneo con un rotulador dedicado. Si la superficie externa del cráneo no está en un plano nivelado con bregma (i.e., el dorsal / ventral de coordenadas ya no lee cero), restablezca el ventral / dorsal lectura a 0,0 para asegurar que la profundidad de la inyección no se desplaza.
- Perforar un pequeño agujero en el cráneo con un taladro rotatorio de mano equipado con una punta dental estéril en el sitio apropiado marcado con la pluma en el paso 5.5. Mantenga la broca en un ángulo en el cráneo y tocar muy suavemente la punta hasta el hueso. Repita según sea necesario. La perforación casi pero no completamente a través del hueso, dejando la aguja para penetrar realmente esta capa del cráneo, los resultados en la inyección limpio.
- Quite el polvo de hueso con un bastoncillo de algodón humedecido en PBS o solución salina. Devuelva la jeringa a la bomba y bajar la aguja directamente hacia el agujero de trépano para confirmar la ubicación. Si el orificio de trepanación no está centrada con la aguja, utilice el taladro para agrandar la abertura.
- Mezclar suavemente la suspensión celular y extraer las células dentro de la jeringa utilizando el controlador de la bomba. Evite las burbujas y las matas y limpiar el ingenio agujah una gasa con alcohol para eliminar las células contaminantes en la superficie exterior. Si la jeringa / aguja está obstruido o congelado, quitar y limpiar rápidamente con agua estéril y 70% de EtOH.
- Bajar la aguja hasta el nivel de la superficie del cráneo (0,0 mm ventral / dorsal). Luego, lentamente (durante aproximadamente 1 min) bajar la aguja para perforar a través de todo el espesor del cráneo y de penetrar en el cerebro a una profundidad de 4 mm ventrall. Retire la aguja lentamente a 3,5 mm ventral. Si la cabeza del ratón se mantiene firmemente en la unidad estereotáxica, no debería ser casi ningún movimiento del cráneo.
- Confirme que los parámetros correctos se introducen en el controlador de la bomba (sección 2.2) y presione "RUN / STOP" (o como lo indique el manual del producto) a autoinject células. Monitorear el ratón y ajuste isoflurano si está indicado. Ver la jeringa y asegúrese de que el émbolo se mueve en el barril. Movimiento congelado u obstruido puede dar lugar a una inclinación / émbolo roto.
- Espere 1 a 2 min con la aguja en la blluvia, a continuación, muy lentamente (más de 3 a 4 min) retirar la aguja del tejido. Tiempo total para retirar la aguja después de se haya completado la inyección es de 5 min. Use un hisopo de algodón para secar la zona alrededor del orificio de trepanación; dejar los bordes de la piel abierta para permitir que el hueso se seque.
- Retire la jeringa de la bomba y enjuagar rápidamente 3 veces con H2O estéril, 3 veces con EtOH al 70%, y 3 veces con H2O estéril (o como lo indique el fabricante). Limpie la aguja con EtOH y reservar.
- Aplicar cera de hueso estéril (equivalente a 1 o 2 l) para el orificio de trepanación y utilizar el extremo de madera de una torunda de algodón estéril para apisonar la cera sobre y dentro del hueso. Si la superficie se seca adecuadamente, se debe pegarse.
- Spread paño estéril sobre el área de trabajo del ratón y de los alrededores y suturar la incisión; tres puntos de sutura deben ser suficientes. Alternativamente, adhesivo quirúrgico puede ser utilizado. Aplique un antibiótico tópico.
- Reducir isoflurano al 0% y eliminar el ratón de la unidad estereotáxica, siendo careful para proteger los dientes. Revise las orejas, la boca y la lengua.
- Vigilar estrechamente el ratón después de la inyección. Coloque el ratón sobre una almohadilla de calor para 5 a 10 minutos; luego traslado a la jaula (en el cojín de calor) y observar hasta que el ratón se despierta y es ambulatoria. No deje el ratón sin atención hasta que se haya recuperado lo suficiente conciencia para mantener la posición decúbito esternal. No devuelva el ratón para la compañía de otros animales hasta que se recupere completamente. Considere el uso de analgesia adicional si se notan signos de dolor.
6. Finalizar y seguimiento de la recuperación y el desarrollo de tumores
- Limpie todos los instrumentos y equipos que utilizan el 70% de EtOH, un esterilizador de cuentas o desinfectante entre los ratones.
- Monitorear los ratones inyectados durante dos días después del procedimiento para detectar signos de dolor, infección u otras complicaciones. Inyectar analgésico a las 24 y 48 horas (o indicación en contrario) después del procedimiento. Retire las suturas a los 7 a 10 días, si es necesario.
- Evaluar los ratones en busca de signos clínicos de enfermedad, paralysis, disminución de la actividad, pérdida de peso, convulsiones, o enfermedad general.
- Supervisar el desarrollo del tumor mediante el método adecuado [resonancia magnética (MRI), En Vivo Imaging Systems (IVIS), etc].
Resultados
Xenoinjertos intracraneales confiables pueden ser creados con esta técnica se describe. La identificación de las estructuras críticas del cráneo de ratón (Figura 1) permitirá el reconocimiento de la bregma y guiar al investigador a una ubicación precisa y reproducible de la inyección. En estos estudios la línea parental U251, las células U251 transfectadas con luciferasa (Luc-U251), o U87 inmortalizado las células de cultivo de tejidos humanos GBM se suspendieron en 4 a 6 l de SF-DMEM y se inyecta 2,5 mm lateral (derecha), 1,5 mm anterior , y 3,5 mm ventral con respecto al bregma (Figura 2).
Los tumores resultantes pueden ser visualizados y analizados por resonancia magnética (MRI, Figura 3), in vivo luminiscente imágenes (IVIS, Figura 4), o técnicas de patología general de rutina (tinción H & E, Figura 5). Especial cuidado se debe tomar y optimización realiza para determinar la apropiacióncélulas TE y la ubicación de la inyección para representar el tiempo, tasa de crecimiento, y el modelo de tumor deseado.

Figura 1 Anatomía del cráneo. Las características anatómicas de la cabeza del ratón y el cráneo se ilustran. El bregma, que es en el eje de la línea media entre los ojos y los oídos en la intersección de la coronal y las suturas sagital, se utiliza para localizar las coordenadas de inyección reproducible.
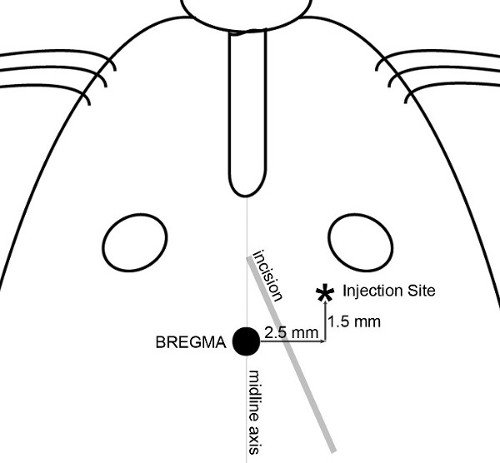
Figura 2. Incisión y mapa de inyección. Los elementos utilizados para determinar la incisión cutánea y precisa localizar el lugar de la inyección se ilustran. Una incisión diagonal se hace para permitir el acceso tanto a bregma y el sitio de inyección. Aplicación del 30% de H 2 O 2a la superficie del cráneo ayuda a visualizar suturas del cráneo. Coloque una jeringa con aguja en la microbomba y maniobrar la punta de la aguja directamente sobre el bregma. Set coordina en la consola de alineación a cero; todas las medidas del cráneo son entonces reproducible hacen con respecto a bregma.
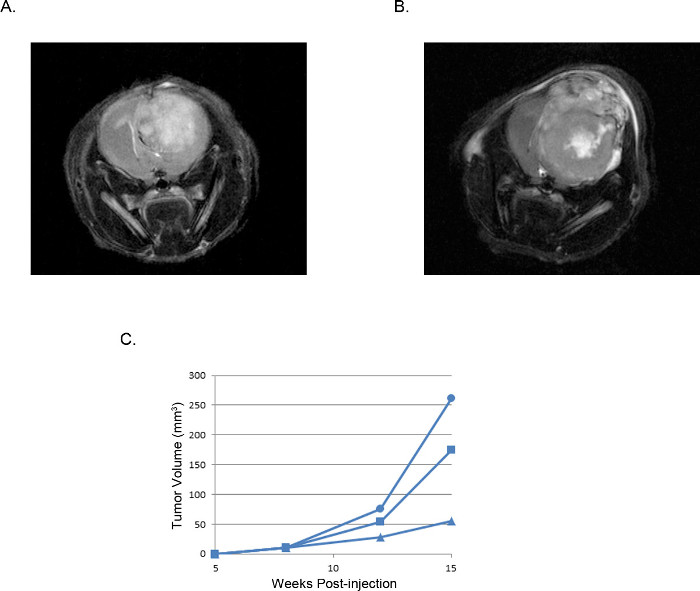
Figura 3. xenoinjertos de tumores intracraneales representativos: las imágenes de resonancia magnética MRI T2 ponderado imágenes de un tumor derivado de (A) 2 x 10 5 células U87 en comparación con un tumor derivado de (B) 2 x 10 5 células U251.. volúmenes (C) Tumor calculados a partir de imágenes de resonancia magnética de tres ratones individuales inyectados con células U251 trazados a través del tiempo muestra una ventana reproducible de desarrollo de tumores y el crecimiento que es consistente en todos los experimentos.
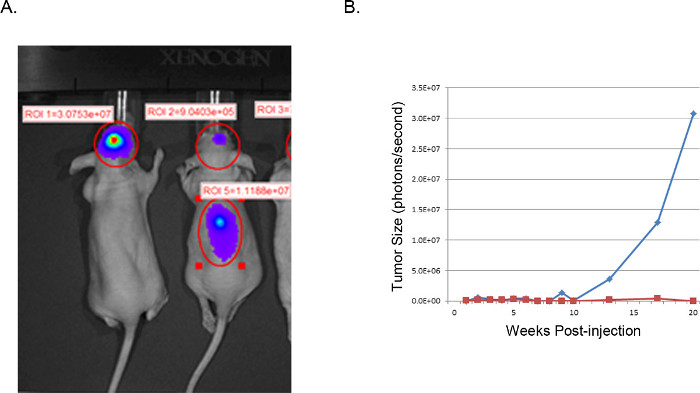
Figura 4. representativos xenoinjertos de tumores: imágenes IVIS. IVIS imagen de U251-luciferasa transduce células GBM inyectados por vía intracraneal en ratones desnudos (A). El ratón de la izquierda se inyectó con éxito como se describe con células U251-Luc y muestra una muy fuerte señal focalizada (fotones / s) en el lugar deseado. El ratón a la derecha demuestra un resultado infructuoso de un lugar de inyección inadecuada. H & E examen de la columna vertebral reveló el crecimiento de células tumorales en la columna vertebral consecuencia de la inyección demasiado cerca de la línea media con difusión ventricular. (B) El tamaño del tumor se estimó a partir de la actividad de luciferasa (fotones / segundo) en la región cerebral de interés, trazan con el tiempo. La línea azul corresponde al ratón con una inyección intracraneal éxito, mientras que la línea roja corresponde a la del ratón con el desplazamiento de las células tumorales a la columna vertebral.
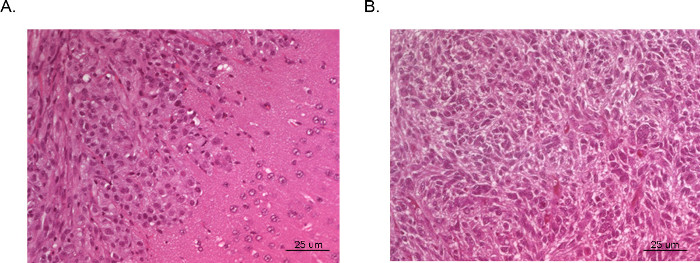
Figura 5. H & E de xenoinjertos de tumores intracraneales. Cerebros completos se obtuvieron de ratones publicar sacrificio y fijadas en formol, montado en parafina, seccionadas y teñidas con H & E. Tumor (A) se deriva de las células U87 GBM e ilustra un área de crecimiento tumoral densa (esquina superior izquierda) y el tejido cerebral normal adyacente con invasión microscópica de las células malignas (esquina inferior derecha). Tumor (B) fue tomada de una sección del centro de un tumor derivado de las células U251 GBM. La sección se replica muy de cerca la histopatología extraño con células malignas multinucleadas visto en GBM humano típico.
Discusión
Modelos ortotópico de ratón de cáncer del cerebro humano puede ser una excelente herramienta para evaluar la eficacia de las terapias clínicas, pero se debe tener cuidado para optimizar la colocación de las células en el tejido cerebral. Los estudios han demostrado que los volúmenes alícuotas excesivas, técnica de inyección subóptima y las tasas de inyección precipitadas pueden conducir a la permeabilidad y la aparición de células tumorales en lugares no deseados (ventrículos, la médula espinal, las regiones extradural, etc.) Y alta variación en el tamaño del tumor 2 (observaciones personales ). Un análisis de entrega basado en microprocesadores de muestras no celulares encontró que el uso de una microbomba produce una entrega más focalizada, menos de reflujo de la muestra y menos variabilidad que los métodos manuales de inyección, atribuidas a la entrega lisa, uniforme y presiones consistentes 3. Si bien puede ser un reto para condensar el número necesario de las células en un volumen de sólo 2 o 4 l, el uso de un instrumento y la consola de alineación eq estereotáxicouipped con una micro-bomba programable puede producir tumores reproducibles y fiables con tasas de crecimiento similares. Un modelo de xenoinjerto nunca puede realmente duplicar el microambiente, la iniciación y el desarrollo de un tumor de origen natural, en particular con los anfitriones inmunodeficientes, sino un modelo ortotópico bien diseñado e implementado es la mejor alternativa y es muy superior a un modelo ectópico.
La principal ventaja de este protocolo es el establecimiento de los tumores detectables dentro de un marco de tiempo consistente. El momento de la aparición del tumor depende del tipo de célula y el número de células inyectadas, pero es bastante predecible, y la mayoría de los tumores se establecen dentro de una estrecha ventana de tiempo en relación con la duración del crecimiento del tumor (es decir, el tiempo hasta el punto final). Esto permite al investigador para identificar los puntos de tiempo para la recolección de datos (como la resonancia magnética o IVIS) o la intervención (como el tratamiento de drogas). Las tasas de crecimiento del tumor varían con el tipo de células, el número de células inyectadas, y from ratón para ratón (tanto como lo hacen en pacientes humanos), pero son consistentes de experimento a experimento.
Mientras que este protocolo emplea una técnica que puede requerir más tiempo que la instrumentación y métodos manuales menos exactas de la inyección y pueden no ser aplicables a las investigaciones a gran escala, las técnicas para inyecciones intracraneales que permiten el rendimiento de un gran número de animales (tales como el descrito por Iwami et al., 12), por definición, implica una rápida inyección de alta presión y con frecuencia implican la instrumentación de mano y la medición manual, que están sujetos a la inestabilidad y la incertidumbre. Estos factores pueden estar asociados con fugas y fuera de la diana de entrega 2,3. La precisión, la reproducibilidad y la baja mortalidad de este procedimiento permitirá al investigador a diseñar experimentos de tratamiento utilizando un menor número de ratones para obtener resultados estadísticamente significativos - un ahorro neto.
Un paso es crítica para eléxito de la implantación del tumor: la ubicación precisa de la inyección. Células inyectadas demasiado cerca de los ventrículos pueden conducir a CSF propagación de la enfermedad a través del sistema ventricular o en regiones extracraneales. Las células inyectadas demasiado superficial pueden crecer a través del trayecto de la aguja. Coordenadas predeterminadas son de poco valor si la colocación de la aguja es descuidado. Tómese el tiempo para colocar la cabeza del ratón de forma segura en la unidad estereotáxica. Utilice las opciones de ajuste estereotáxica y las barras de oído para adaptarse al equipo para el ratón, y asegurar que el cabezal se posiciona de forma estable y no el rock o el giro durante el procedimiento. Los cambios o variación si el sitio de la inyección pueden afectar las características del tumor, incluyendo toma tumoral, crecimiento, el potencial invasivo, y el acceso a la administración de fármacos y el suministro de oxígeno.
Otros parámetros que tienen un profundo impacto en el tumor resultante incluyen la velocidad de inyección, el número de células y el volumen; todo debe ser determinada empíricamente. Reduzca al mínimo el volumen de la number de las células necesarias para el crecimiento del tumor; utilizar la velocidad de inyección más lenta práctico. El número de células y el número de pasaje también tienen efectos importantes sobre la toma del tumor y la tasa de crecimiento. El equipo especializado que se utiliza aquí ofrecen un control superior, pero los conceptos de volumen mínimo, la orientación precisa, la tasa de inyección mínima y constante, y retirada de la aguja lenta se puede aplicar a una variedad de técnicas de inyección (incluyendo manual) y una variedad de instrumentos.
Este procedimiento está abierto a una variedad de modificaciones: el sitio de inyección puede ser personalizado para recapitular determinados tipos de tumores. Adherente células de cultivo de tejidos, clones modificados genéticamente, neuroesferas, tumores desagregados ratón, o fragmentos de tejido humano pueden ser implantadas en un cerebro de ratón. Esta técnica puede incluso ser adaptado para estudios no celulares, incluyendo la transferencia génica viral 3. Una vez que se estableció un método para producir de forma fiable los tumores de las características deseadas, los experimentos comparando la eficacia de las terapias, los tratamientos con fármacos y combinaciones, y otras opciones como la transferencia de genes puede llevar a cabo.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Dr. Keating es financiado por CA100335 subvención del Departamento de Defensa y es una de St. Baldrick becario de la Fundación.
Materiales
| Name | Company | Catalog Number | Comments |
| Name of Reagent/ Equipment | Company | Catalog Number | Comments/Description |
| Equipment | |||
| Small Animal Stereotaxic Instrument with Digital Display Console. | Kopf | Model 940 | |
| Mouse Gas Anesthesia Head Holder | Kopf | Model 923-B | |
| Mouse Ear Bars | Kopf | Medel 922 | |
| Fiber Optic Illuminator | Fisher | 12-562-36 | |
| UltraMicroPump III | WPI | UMP3 | |
| Micro4 microprocessor | WPI | UMC4 | |
| Variable speed hand-held rotary drill | Dremel | Model 300 | |
| Dental drill bit, 1.0 mm | Spoelting | 514554 | |
| Adaptor for dental drill bit: 3/32 inch collet | Dremel | 481 | |
| Heating pad | for mice | ||
| Isoflurane vaporizer system | for mice | ||
| Medical tubing and connectors | to connect isoflurane vaporizer with stereotaxic frame | ||
| Instruments | |||
| Precision 25 ul micro syringe | Hamilton | 7636-01 | Model 702, without needle |
| Microsyringe needles, 26s gauge | Hamilton | 7804-04 | RN, 25 mm point style 2 |
| Fine-tipped scissors (straight, sharp/sharp) | |||
| Medium-sized standard scissors | |||
| Standard serrated forceps | |||
| Serrated hemostats (2) | |||
| Fine-tipped forceps | |||
| Supplies | |||
| Sutures 5-0 vicryl P-3 13 mm (Ethicon) | MWI | J463G | |
| Surgical blades #10, stainless (Feather) | Fisher | 296#10 | |
| Isoflurane (Fluriso) | VetOne | NDC 13985-528-60 | Item #502017. Liquid inhalation anesthetic. federal law restricts this drug to use by or on the order of a licensed veterinarian. |
| Carprofen (Rimadyl Injectable 50 mg/mL) | Pfizer | NDC 61106-8507-01 | dilute in saline |
| Ophthalmic ointment (artificial tears) | Rugby | NDC 0536-6550-91 | |
| Topical antibiotic (AK-Poly-Bac ) | Akorn | NDC 17478-238-35 | |
| Povidone-iodine topical antiseptic, 10% (Betadine) | Betadine | NDC 67618-150-04 | |
| Hydrogen Peroxide, 30% | Fisher | H325-100 | for visualizing skull landmarks |
| Sterile saline | VetOne | NDC 13985-807-25 | for diluting solutions, cleaning tissue |
| Bone wax | WPI | Item #501771 | |
| Sterile drapes | McKesson | 25-517 | |
| Sterile surgical gloves | McKesson | (to fit) | |
| Sterile gauze pads, 2 x 2 | Fisherbrand | 22028556 | |
| Sterile gauze pads, 4 x 4 | Fisherbrand | 22-415-469 | |
| Alcohol prep pads (medium) | PDI | B603 | |
| Sterile cotton-tipped applicators | Fisherbrand | 23-400-114 | |
| Sterile 0.5 ml screw cap tube with caps for cells | USA Scientific | 1405-4700 | for cells |
| Individually wrapped sterile dispo pipettes | Fisher | BD 357575 | for needle cleaning solutions |
| BD insulin syringes with needles | Fisher | 329461 | for analgesic |
| 70% ethanol | for cleaning | ||
| Sterile di H2O | for cleaning | ||
| Microfuge tubes for cleaning solutions | for needle cleaning solutions | ||
| Felt tip pen (dedicated) | for marking skull |
Referencias
- Heyer, J., Kwong, L. N., Lowe, S. W., Chin, L. Non-germline genetically engineered mouse models for translational cancer research. Nature reviews. Cancer. 10, 470-480 (2010).
- Yamada, S., et al. A method to accurately inject tumor cells into the caudate/putamen nuclei of the mouse brain. The Tokai journal of experimental and clinical medicine. 29, 167-173 (2004).
- Brooks, A. I., et al. Reproducible and efficient murine CNS gene delivery using a microprocessor-controlled injector. Journal of neuroscience. 80, 137-147 (1998).
- Shankavaram, U. T., et al. Molecular profiling indicates orthotopic xenograft of glioma cell lines simulate a subclass of human glioblastoma. Journal of cellular and molecular medicine. 16, 545-554 (2012).
- Giannini, C., et al. Patient tumor EGFR and PDGFRA gene amplifications retained in an invasive intracranial xenograft model of glioblastoma multiforme. Neuro-oncology. 7, 164-176 (2005).
- Yi, D., Hua, T. X., Lin, H. Y. EGFR gene overexpression retained in an invasive xenograft model by solid orthotopic transplantation of human glioblastoma multiforme into nude mice. Cancer investigation. 29, 229-239 (2011).
- Carty, N., et al. Intracranial injection of AAV expressing NEP but not IDE reduces amyloid pathology in APP+PS1 transgenic mice. PLos ONE. 8, e59626 (2013).
- Thaci, B., et al. Pharmacokinetic study of neural stem cell-based cell carrier for oncolytic virotherapy: targeted delivery of the therapeutic payload in an orthotopic brain tumor model. Cancer gene therapy. 19, 431-442 (2012).
- Ozawa, T., James, C. D. Establishing intracranial brain tumor xenografts with subsequent analysis of tumor growth and response to therapy using bioluminescence imaging. J. Vis. Exp. (41), (2010).
- Valadez, J. G., Sarangi, A., Lundberg, C. J., Cooper, M. K. Primary orthotopic glioma xenografts recapitulate infiltrative growth and isocitrate dehydrogenase I mutation. J. Vis. Exp. (83), (2014).
- Baumann, B. C., Dorsey, J. F., Benci, J. L., Joh, D. Y., Kao, G. D. Stereotactic intracranial implantation and in vivo bioluminescent imaging of tumor xenografts in a mouse model system of glioblastoma multiforme. J. Vis. Exp. (67), (2012).
- Iwami, K., et al. A novel method of intracranial injection via the postglenoid foramen for brain tumor mouse models. Journal of neurosurgery. 116, 630-635 (2012).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados