Method Article
Creazione anatomicamente accurati e riproducibili intracranica xenotrapianti di tumori cerebrali umani
In questo articolo
Riepilogo
Il cervello è un sito unico con qualità che non sono ben rappresentati da in vitro o analisi ectopiche. Modelli di mouse ortotopico con caratteristiche di localizzazione e di crescita riproducibili possono essere attendibilmente creati con iniezioni intracraniche utilizzando uno strumento di fissazione stereotassico e una pompa a siringa a bassa pressione.
Abstract
Modelli di tumore ortotopico sono attualmente il modo migliore per studiare le caratteristiche di un tipo di tumore, con e senza l'intervento, nel contesto di un animale vivo - in particolare in siti con caratteristiche uniche fisiologici e architettonici come il cervello in vitro e modelli ectopiche non possono. tenere conto di caratteristiche quali vasi, il sangue barriera del cervello, il metabolismo, somministrazione di farmaci e la tossicità, e una miriade di altri fattori rilevanti. Modelli ortotopico hanno i loro limiti troppo, ma con adeguate cellule tumorali tecnica di interesse possono essere innestate con esattezza in tessuto che più strettamente imita le condizioni nel cervello umano. Utilizzando metodi che forniscono i volumi misurati con precisione a definire con precisione posizioni ad una velocità costante e pressione, modelli murini di tumori cerebrali umani con tassi di crescita prevedibili possono essere riproducibile creati e sono adatti per un'analisi attendibile dei vari interventi. Il protocollo qui descritto si concentra sul tedettagli chnical di progettazione e preparazione per l'iniezione intracranica, eseguire l'intervento chirurgico, e garantire la crescita del tumore e di successo riproducibile e fornisce i punti di partenza per una serie di condizioni che possono essere personalizzati per una vasta gamma di diversi modelli di tumore al cervello.
Introduzione
Studi in vitro su cellule tumorali del cervello sono di valore inestimabile per sezionare i meccanismi molecolari che guidano la crescita, la sopravvivenza, la migrazione e l'invasione delle cellule tumorali; esperimenti sulle cellule in coltura possono definire vie di segnalazione, suggerire potenziali bersagli terapeutici, e caratterizzare la risposta cellulare al trattamento farmacologico. Ma in vitro sistemi sono troppo semplicistico per predire la risposta ai farmaci organismal; mancano le reazioni fisiologiche, le risposte immunitarie, microambiente cellulare, e eterogeneità complessiva dei sistemi viventi animali. Geneticamente modelli di ingegneria può essere prezioso, quando disponibile, ma esistono differenze molecolari tra le specie e le cellule murine non può ricapitolare gli eventi in processi umani, con conseguente discrepanze significative quando si confrontano modelli animali di osservazioni cliniche 1. Modelli di xenotrapianto topi, che comporta sottocutanea (SQ) iniezione di linee cellulari tumorali del cervello umano sotto la pelle del fianco sono facili da eseguiree misurare; essi possono essere usati per affrontare gli effetti di modificazione genica e la somministrazione del farmaco / consegna, metabolismo e tossicità. Inconvenienti di rilievo, tuttavia, limitano l'utilità dei modelli SQ. Il microambiente non ricapitolare quello di un tumore cerebrale naturale: le interazioni dei vari tipi di cellule e tessuti; la vascolarizzazione locale, e una miriade di altri fattori unica per il cervello non possono essere replicati. Per riprodurre in modo più accurato l'ambiente unico di un tumore al cervello naturale e testare gli effetti degli interventi farmaceutiche, un modello ortotopico mouse dovrebbe essere utilizzato. Inoltre, le tecniche di ortotopici può essere utilizzato come parte di un approccio geneticamente in cui le cellule non cancerose umane primarie (differenziate o progenitore) sono geneticamente modificati e iniettato nel sito in questione di un mouse, con o senza cellule dello stroma umane, con conseguente tumorigenesi simile a quello osservato negli esseri umani 1.
Questo articolo descriveuna metodologia per creare con precisione e riproducibile tumori cerebrali nei topi. Usando questa tecnica, l'utente può iniettare con precisione una piccola aliquota di cellule sospese in una posizione specificata della regione fronto-parieto-temporale del mouse corteccia cerebrale. Mortalità del mouse è estremamente basso; nelle nostre mani, non i topi sono morti per complicazioni chirurgiche dopo 185 procedure. Caratteristiche del tumore risultante può essere confrontato con quello dei tumori clinici tipici; per esempio: rapidità di crescita, il grado di necrosi, estensione dell'invasione, eterogeneità di tipo cellulare, la presenza di cellule mitotiche, marcatori di proliferazione e apoptosi, ecc linee cellulari e campioni di tessuto o disaggregati tumorali umane possono quindi essere valutati in base alla loro capacità di per simulare la presentazione clinica reale. Pharmaceuticals, selezionati in base alle loro performance in coltura cellulare, possono essere testati nel contesto di un metabolismo funzionante, sistema circolatorio, e la barriera emato-encefalica, come esistono in un animale gravato witah tumore, il tutto in un contesto architettonico rilevante. Inoltre, le cellule scelti per l'iniezione possono essere geneticamente modificati per studiare l'impatto di atterramenti specifiche, delezioni, knock-in, le mutazioni, ecc sulla crescita del tumore e la sopravvivenza.
Un certo numero di pubblicazioni documentano tumori studi che utilizzano una varietà di tecniche intracraniche. Yamada et al. Ha fatto uno studio dettagliato della iniezione di colorante e di cellule U87 e ha scoperto che riducendo al minimo il volume di iniezione e la tariffa prodotto il migliore tumore 2. . Brooks et al trovato riproducibilità superiore e l'efficienza mediante un iniettore controllato da microprocessore piuttosto che un metodo manuale per fornire vettori virali; le loro conclusioni in materia di parametri di iniezione ottimali sono applicabili alla consegna delle cellule 3. Shankavaram et al. Hanno dimostrato che glioblastoma multiforme (GBM) linee di cellule iniettate ortotopicamente (utilizzando un metodo manuale) nel cervello ricapitolato il profilo di espressione genica del cltumori inical più strettamente che sia in xenotrapianti vitro o SQ, sostenendo l'utilizzo di modelli intracranici per gli studi preclinici 4. Giannini et al. Cellule da campioni chirurgici umani che erano stati sostenuti nei fianchi di topi nudi da passaging seriale nel cervello di topi ulteriori iniettato, e ha dimostrato che questo approccio conservato paziente alterazioni del gene del tumore nel modello 5. Risultati simili sono stati riportati da Yi et al 6. Utilizzando una configurazione stereotassico, sito di iniezione ben definita, e una velocità di iniezione lento e costante, ottennero tumori cerebrali riproducibili con tassi di crescita costanti e alto (100%), tasso di attecchimento. La validità di questa tecnica è stato quindi ben definito; una ricerca di letteratura suggerisce che le applicazioni di questa tecnica sono ampie. Carty et al. Usato iniezioni intracraniche di consegnare con successo vettori virali esprimenti geni terapeutici nella corteccia frontale di transgenic modello della malattia di Alzheimer 7. Thaci et al. Ha descritto l'uso di iniezioni intracraniche di consegnare terapeutico adenovirus oncolitici in un supporto a base neurale delle cellule staminali in topi nudi già trasportano ortotopicamente iniettati tumori GBM 8. Chiaramente, le iniezioni intracraniche sono uno strumento versatile ed efficace per la ricerca preclinica. Pubblicazioni precedenti in The Journal of Experiments Visualizzato descrivono approcci fondamentali 9-11, ma prendiamo il concetto di iniezione intracranica del tumore e la modellazione ortotopico a un livello superiore di precisione utilizzando la tecnologia facile da padrone.
Protocollo
Tutte le procedure descritte sono stati esaminati e approvati dal nostro cura degli animali e l'uso comitato istituzionale.
1 Piano Experiment
- Scegli le cellule da iniettare. Le cellule provenienti da una varietà di fonti sono candidati per l'iniezione: aderenti linee di coltura cellulare, cloni geneticamente modificati, cellule neurosfere, colture primarie, o tumori disaggregati. Il tipo di modello desiderato definirà la sede più idonea di iniezione.
- Determinare il numero di cellule per l'iniezione. Il numero di cellule necessario per formare tumori varia con la linea cellulare e deve essere determinato empiricamente; tasso di crescita tumorale dipende fortemente dal tipo di cellulare, numero di cellulare e numero di colture di tessuti passaggio. Numeri di cellulari che vanno da 1 x Ottobre 04-2 x 10 5 o più per iniezione hanno prodotto tumori di varie tassi di crescita.
- Limitare il volume per l'iniezione. Le cellule devono essere sospese nel più piccolo volume di siero media liberi o fosfato tamponata sAline (PBS) che permette di regolare, facile passaggio attraverso un ago 26 G. Il più piccolo il volume effettivamente consegnato nel cervello, il più preciso e definito il tumore risultante; Risultati ottimali si ottengono iniettando volumi che variano da 3 a 6 microlitri. Piano di preparare un volume totale finale di almeno 50 ml di cellule in sospensione, indipendentemente dal numero di iniezioni pianificate, per consentire misurazioni accurate, miscelazione e campionamento.
- Scegli topi appropriato per il modello. Modelli murini di tumori umani in genere utilizzano giovani topi immuno-compromessi per evitare rigetto immunitario mediata. Non è necessario per il lavoro che si terrà in una cappa di sicurezza biologica se vengono prese precauzioni appropriate, compresa la decontaminazione, disinfezione e sterilizzazione di materiali e attrezzature. Il lavoro qui mostrato è stato fatto in topi nudi atimici, maschi e femmine, tra i 6 e 12 settimane di età. I topi che pesano meno di 20 g può essere difficile da posizionare cometelaio tereotaxic e può essere più suscettibile di ipotermia.
2 Montare l'apparecchiatura
- Ottenere e decontaminare un mouse telaio stereotassico, console di allineamento, e porta la testa anestesia gas del mouse, pompa microsiringa, rilievo di calore, macchina per anestesia, lampada da lavoro in fibra ottica, e trapano rotante a velocità variabile. Pulire e decontaminare tutte le attrezzature.
- Programmare i parametri di iniezione (tra cui il volume di iniezione, la portata, unità di tasso, tipo siringa) e altre variabili necessarie per il funzionamento della pompa a siringa. Ottimizzare le impostazioni per ogni modello particolare.
NOTA: In queste iniezioni le impostazioni erano 3.000 campioni nl ad una velocità di 400 nl / min (unità di tasso "M") utilizzando una siringa da 25 ml (Device Type "E"), modalità nel Non-raggruppati ("N"). - Pulire una microsiringa di precisione con il 26 ago G con diversi risciacqui di acqua deionizzata sterile (diH 2 O) e il 70% di etanolo (EtOH), facendo un ri finalense con diH 2 O. Alcuni, ma non tutti i modelli sono progettati per essere sterilizzati in autoclave. Accertarsi che il movimento del pistone è liscia e libera.
- Ottenere apparecchiature per anestesia. Isoflurano è l'anestetico preferito in quanto è facile da regolare la profondità e la durata dell'anestesia. Assicurarsi che l'unità stereotassica è dotata di un attacco di gas per anestesia del mouse e che il tubo e connettori necessari sono in atto per fornire la miscela di gas dalla macchina per anestesia al mouse.
- Strumenti chirurgici Autoclave, tra cui forbici a punta fine, due pinze / pinze emostatiche (con denti) per sutura, forbici di medie dimensioni, pinzette medio e punta fine, e almeno due punte dentali 1 mm. Mantenere gli strumenti puliti durante la procedura con il 70% EtOH, disinfettante, o uno sterilizzatore tallone.
- Ottenere isoflurano, analgesico, unguento oftalmico / lubrificante, pomata antibiotica, soluzione salina, il 30% di perossido di idrogeno (H 2 O 2), antisettico, e cera ossea (se desiderato) da unfornitura veterinario o medico. Preparare sterile diH 2 O e il 70% EtOH. Usa e getta, come garze, medicazioni sterili, suture, tamponi di cotone, etanolo punta tamponi, guanti chirurgici sterili, lame chirurgiche e più sono dettagliate nella lista dei materiali. Un bel pennarello indelebile punta per la marcatura del cranio deve essere decontaminata e dedicato per uso chirurgico.
3 Preparare Celle per iniezione
- Negli esperimenti qui riportati, selezionare una linea di cellule GBM umano immortalato. Determinare il numero di cellule (2 x 10 5) e il volume di sospensione da iniettare (3 ml) empiricamente; dettagli possono variare con il tipo di cellule. Usare un volume di almeno 50 ml di facilitare misurazione accurata, miscelazione e iniezione.
- Trypsinize cellule e risospendere in media o PBS. Effettuare le seguenti operazioni appena prima dell'iniezione di cellule:
- Rimuovere i supporti dalle cellule mediante aspirazione e lavare con 10 ml di PBS per mm piastra 100; rimuovi PBS.
- Annunciod 1 ml di tripsina per ogni piastra mm 100 e incubare a RT giusto il tempo di produrre una sospensione di cellule singole.
- Interrompere l'attività di tripsina con 5 ml di coltura di Dulbecco modificato (DMEM) + 10% di siero fetale bovino (FBS) per mm piastra 100.
- Cellule pellet per centrifugazione a 450 xg e risospendere in ~ 5 ml di siero DMEM libero (SF-DMEM) per mm piastra 100.
- Contare cellule vitali mediante un emocitometro o un contatore di cellule automatizzato.
- Regolare la densità delle cellule dal vivo per 2 x 10 5 cellule / 3 ml (o come determinato da sperimentazione) di pellet e risospendere le cellule in SF-DMEM.
- Mantenere le cellule refrigerate su ghiaccio o una confezione freddo (non consentono alle cellule di congelare). Mescolare delicatamente schioccare le dita.
4. Anestetizzare e Preparare il mouse per Chirurgia
- Indurre l'anestesia utilizzando ~ 5% isoflurano (ossigeno flusso ~ 2 L / min) o come indicato dal veterinario. Induzione dovrebbe prendere 2 a 3 min. Mantenere il mouse ad una profondità adeguatadi anestesia con ~ 3% isoflurano.
- Controllare la profondità di anestesia pizzico punta, regolare isoflurano se indicato e continuare a monitorare la respirazione e la punta risposta pizzico tutta la procedura. Coprire mouse con garze per calore e controllare il mouse regolarmente durante tutta la procedura, che può richiedere 45 minuti a 1 ora, a seconda del tasso di iniezione.
- Posizionare il mouse nel telaio stereotassico trascinando con attenzione la barra palato sulla lingua e nella bocca. Agganciare gli incisivi anteriori nel foro del dente. Utilizzare barre orecchio per stabilizzare la testa, con la superficie orecchio-a-occhio il più vicino possibile orizzontale. Non forzare bar nel condotto uditivo. E 'fondamentale per posizionare la testina in modo sicuro: controllare il movimento da lato a lato e su-e-giù delicatamente con i polpastrelli. Utilizzare i controlli di regolazione dell'unità stereotassico per ottimizzare vestibilità.
- Lubrificare gli occhi con pomata oftalmica. Pulire la pelle tra le orecchie e gli occhi due volte con alternanza di applicazioni di un povidone-iodine antisettico e il 70% EtOH.
- Iniettare per via sottocutanea analgesico scelto (SQ) in fianco (o come indicato).
5 Eseguire iniezione
- Determinare il sito di iniezione. Il sito di iniezione può variare con le dimensioni e la tensione del mouse e il tipo di cellula. Cellule iniettate troppo vicino ai ventricoli possono portare alla diffusione cranio-spinale della malattia. Cellule iniettate troppo superficiale possono crescere attraverso il percorso dell'ago.
NOTA: Negli esperimenti qui riportati, l'obiettivo è stato definito come la regione frontale della corteccia cerebrale un sito 2,5 millimetri laterale (destra) 1,5 mm anteriormente e 3,5 mm ventrale rispetto al bregma è stato scelto (Figura 1), producendo un tumore mesencefalo nei topi che vanno da 20 a 30 g. - Fai una piccola incisione (~ lunga 8 mm) con tecnica sterile attraverso la pelle della testa per esporre il bregma e il sito di iniezione. Un taglio diagonale, da un punto tra l'asse mediana e l'occhio destro verso l'orecchio destro ( Figura 2) consente l'accesso sia al bregma e il sito di iniezione.
- Ritrarre la pelle e utilizzare un tampone di cotone sterile per asciugare la superficie del cranio. Tamponare l'osso con un altro tampone inumidito con H 2 O 2 per visualizzare bregma. L'H 2 O 2 produrrà bolle di ossigeno, lasciando le linee sottili di schiuma bianca lungo le suture coronali e sagittali che si intersecano al bregma.
- Bloccare una siringa vuota con ago sulla micropompa e manovrare la punta dell'ago direttamente sopra il bregma; set di coordinate sulla console di allineamento a 0,0 mm lateralmente, 0,0 millimetri anteriore / posteriore e 0,0 millimetri ventrale / dorsale.
- Spostare l'ago a 2,5 mm lateralmente (destra) ea 1,5 mm anteriormente rispetto al bregma (o posizione desiderata) utilizzando le manopole di controllo sull'unità stereotassico. Sollevare la siringa leggermente e segnare la posizione esatta sul cranio con un pennarello apposito. Se la superficie esterna del cranio non è in piano con bregma (i.e., la dorsale / ventrale coordinate non più legge zero), ripristinare il ventrale / dorsale a leggere per 0,0 al fine di garantire che la profondità della iniezione non viene spostato.
- Praticare un piccolo foro nel cranio con un trapano rotativo portatile dotato di una punta sterile dentale presso il sito appropriato contrassegnati con la penna al punto 5.5. Tenere il trapano in un angolo al cranio e toccare molto delicatamente la punta all'osso. Ripetere se necessario. Foratura quasi ma non completamente attraverso l'osso, lasciando l'ago per penetrare effettivamente questo strato del cranio, comporta l'iniezione pulito.
- Rimuovere la polvere di osso con un batuffolo di cotone inumidito in PBS o soluzione salina. Ritorna la siringa alla pompa e abbassare l'ago verso il basso per il buco bava per confermare la posizione. Se il buco bava non è centrato con l'ago, usare il trapano per allargare l'apertura.
- Mescolare delicatamente la sospensione cellulare e disegnare le celle nella siringa utilizzando il controller della pompa. Evitare bolle e grumi e pulire l'arguzia agoh un tampone imbevuto di alcool per rimuovere le cellule contaminanti sulla superficie esterna. Se la siringa / ago è ostruito o congelato, rimuovere e pulire subito con acqua sterile e il 70% EtOH.
- Abbassare l'ago al livello della superficie del cranio (0,0 millimetri ventrale / dorsali). Poi, lentamente (in circa 1 min) abbassare l'ago per perforare attraverso l'intero spessore del cranio e penetrare il cervello ad una profondità di quattro millimetri ventrall. Estrarre l'ago lentamente a 3,5 mm ventrale. Se la testa del mouse viene tenuto saldamente nell'unità stereotassico, ci dovrebbe essere quasi nessun movimento del cranio.
- Verificare che i parametri corretti nel controller della pompa (sezione 2.2) e premere il tasto "RUN / STOP" (o come indicato dal manuale del prodotto) per autoinject cellule. Monitorare il mouse e regolare isoflurano se indicato. Guarda la siringa e verificare che il pistone si muove in canna. Movimento congelato o intasato può risultare in un piegato / pistone rotto.
- Attendere da 1 a 2 min con l'ago in bpioggia, poi molto lentamente (più di 3 a 4 min) ritirare l'ago dal tessuto. Tempo totale per rimuovere l'ago dopo l'iniezione è completa si trova a 5 min. Usare un tampone di cotone per asciugare la zona intorno al foro bava; lasciare i bordi della pelle aperta per consentire l'osso asciugare.
- Togliere la siringa dalla pompa e sciacquare rapidamente 3x con H 2 O sterile, 3x con il 70% EtOH, e 3 volte con H 2 O sterile (o come indicato dal produttore). Pulire ago con EtOH e mettere da parte.
- Applicare la cera ossea sterile (equivalente a 1 o 2 ml) al foro bava e utilizzare l'estremità di legno di un tampone di cotone sterile per tamp la cera sopra e nell'osso. Se la superficie viene essiccato adeguatamente, dovrebbe attaccare.
- Stendere telo sterile su tutta l'area di lavoro del mouse e dintorni e suturare l'incisione; tre punti dovrebbero essere sufficienti. In alternativa, è possibile utilizzare l'adesivo chirurgico. Applicare un antibiotico topico.
- Ridurre isoflurano al 0% e rimuovere il mouse dall'unità stereotassico, essendo careful per proteggere i denti. Controllare le orecchie, la bocca e la lingua.
- Monitorare il mouse vicino dopo l'iniezione. Posizionare il mouse su un rilievo di calore per 5 a 10 minuti; poi il trasferimento a gabbia (il rilievo di calore) e osservare il mouse fino a quando si sveglia ed è ambulatoriale. Non lasciare incustodito il mouse fino a quando non ha ripreso coscienza sufficiente per mantenere prona sternale. Non restituire mouse per la compagnia di altri animali fino alla completa guarigione. Considerare l'uso di analgesici supplementari se i segni di dolore sono notati.
6 Fine e Monitor Recovery e lo sviluppo del tumore
- Pulire tutti gli strumenti e le attrezzature che utilizzano il 70% EtOH, uno sterilizzatore perlina o disinfettante tra i topi.
- Monitorare i topi iniettati per due giorni dopo la procedura per i segni di dolore, infezioni o altre complicazioni. Iniettare analgesico a 24 e 48 ore (o come indicato) dopo la procedura. Rimuovere suture a 7 a 10 giorni, se necessario.
- Valutare i topi per i segni clinici della malattia, paralysis, diminuzione dell'attività, perdita di peso, convulsioni, o malattia generale.
- Monitorare lo sviluppo del tumore con i mezzi adeguati [risonanza magnetica (MRI), in vivo Imaging Systems (IVIS), ecc].
Risultati
Xenotrapianti intracranica affidabili possono essere creati con questa tecnica descritta. Identificare le strutture critiche del cranio del mouse (Figura 1), consentirà il riconoscimento del bregma e guidare il ricercatore in una posizione di iniezione precisa e riproducibile. In questi studi la linea parentale U251, U251 cellule trasfettate con luciferasi (U251-Luc), o U87 immortalato cellule di coltura di tessuti GBM umani sono stati sospesi a 4-6 ml di SF-DMEM e iniettato 2,5 millimetri laterale (a destra), 1,5 millimetri anteriore , e 3,5 ventrale mm rispetto al bregma (Figura 2).
I tumori risultanti possono essere visualizzati e analizzati mediante risonanza magnetica (MRI, figura 3), in vivo luminescenti di imaging (IVIS, Figura 4), o tecniche di patologia lorde di routine (colorazione H & E, Figura 5). Particolare cura deve essere presa e ottimizzazione eseguita per determinare il appropriacellule te e la posizione di iniezione per rappresentare i tempi, il tasso di crescita, e il modello del tumore desiderato.

Figura 1 Skull anatomia. Le caratteristiche anatomiche della testa del mouse e del cranio sono illustrati. Il bregma, che si trova sull'asse della linea mediana fra gli occhi e le orecchie all'intersezione della coronale e le suture sagittali, viene utilizzata per individuare riproducibile coordinate iniezione.
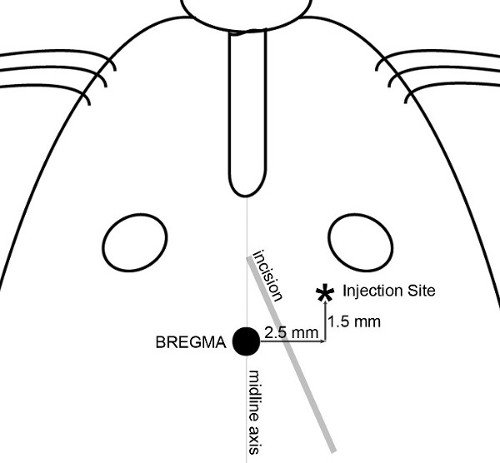
Figura 2 Incisione e mappa d'iniezione. Le funzioni utilizzate per determinare incisione cutanea e precisamente individuare il sito di iniezione sono illustrati. Un'incisione diagonale è fatto per consentire l'accesso sia bregma e il sito di iniezione. Applicazione del 30% H 2 O 2alla superficie del cranio aiuta a visualizzare suture del cranio. Posizionare una siringa con ago sulla micropompa e manovrare la punta dell'ago direttamente sopra il bregma. Impostare le coordinate sulla console di allineamento a zero; tutte le misurazioni del cranio vengono poi riproducibile realizzati rispetto al bregma.
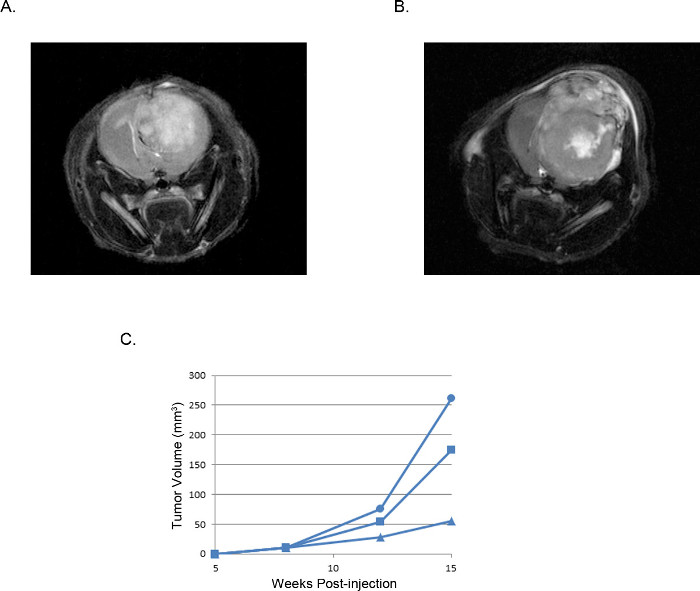
Figura 3. Rappresentante tumori intracranici xenotrapianto: immagini di risonanza magnetica MRI T2 pesate di un tumore derivato da (A) 2 x 10 5 cellule U87 rispetto ad un tumore derivato da (B) 2 x 10 5 cellule U251.. volumi (C) Tumore calcolati da immagini MRI di tre topi iniettati con singole cellule U251 tracciate nel corso del tempo mostra una finestra riproducibile di sviluppo del tumore e di crescita che sia coerente in tutti gli esperimenti.
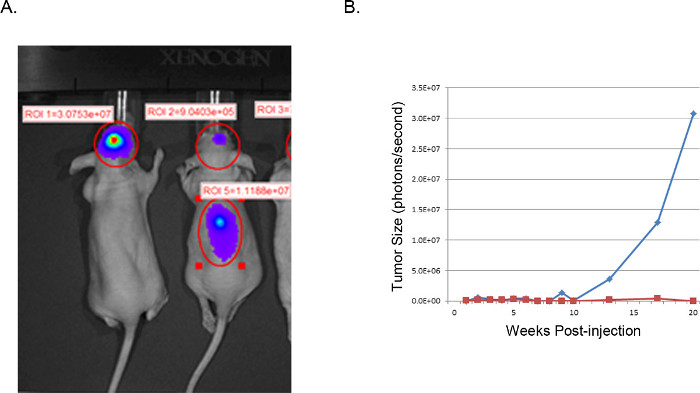
Figura 4. Rappresentante dei tumori xenotrapianto: immagini IVIS. IVIS immagine di U251-luciferasi trasduzione cellule GBM iniettate intracranially in topi nudi (A). Il mouse a sinistra è stato iniettato con successo come descritto con cellule U251-Luc e mostra un segnale molto forte focalizzato (fotoni / sec) nella posizione desiderata. Il mouse a destra mostra un risultato infruttuoso da impropria posizione di iniezione. H & E l'esame della colonna vertebrale ha rivelato crescita delle cellule tumorali nella colonna vertebrale derivante da iniezione troppo vicino alla linea mediana con ventricolare diffusione. (B) Le dimensioni del tumore è stimato da attività di luciferasi (fotoni / secondo) nella regione del cervello di interesse, tracciati nel corso del tempo. La linea blu corrisponde al mouse con un'iniezione intracranica successo, mentre la linea rossa corrisponde al mouse con spostamento delle cellule tumorali alla colonna vertebrale.
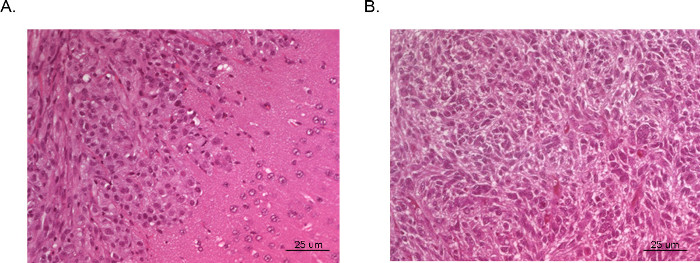
Figura 5 H & E di tumori intracranici xenotrapianto. Cervelli interi sono stati raccolti da topi inviare sacrificio e fissati in formalina, montato in paraffina, sezionati e colorati con H & E. Tumore (A) è stato derivato da cellule U87 GBM e illustra un'area di crescita densa del tumore (angolo in alto a sinistra) e il tessuto cerebrale adiacente normale con l'invasione microscopica delle cellule maligne (angolo in basso a destra). Tumor (B) è stato preso da una sezione del centro di un tumore derivato da cellule U251 GBM. La sezione replica molto da vicino l'istopatologia bizzarro con cellule maligne multinucleate visto in tipico GBM umano.
Discussione
Modelli di mouse ortotopico di cancro al cervello umano può essere un ottimo strumento per valutare l'efficacia delle terapie cliniche, ma la cura deve essere presa per ottimizzare il posizionamento delle cellule nel tessuto cerebrale. Studi hanno dimostrato che eccessivi volumi aliquote, tecnica di iniezione ottimale e tassi di iniezione affrettate possono portare a mancanza di tenuta e la comparsa di cellule tumorali in luoghi indesiderati (ventricoli, midollo spinale, regioni extradurali, ecc.) E alta variabilità delle dimensioni del tumore 2 (osservazioni personali ). Un'analisi di consegna microprocessore basata su campioni non cellulari trovato che l'uso di una micropompa prodotta consegna più focalizzato, meno reflusso campione e minore variabilità rispetto ai metodi manuali di iniezione, attribuiti al liscio, consegna uniforme e pressioni costanti 3. Mentre può essere difficile per condensare il numero necessario di cellule in un volume di soli 2 o 4 microlitri, l'uso di uno strumento e console allineamento stereotassico equipped con una micro-pompa programmabile può produrre tumori riproducibili e affidabili, con tassi di crescita simili. Un modello di xenotrapianto può mai veramente duplicare il microambiente, avvio e lo sviluppo di un tumore presente in natura, in particolare con gli host deficit immunitari, ma un modello ortotopico ben progettato e realizzato è la migliore alternativa ed è di gran lunga superiore a un modello ectopica.
Il principale vantaggio di questo protocollo è l'istituzione dei tumori rilevabili entro un lasso di tempo consistente. I tempi di comparsa del tumore dipende dal tipo di cellula e il numero di cellule iniettate, ma è abbastanza prevedibile, e la maggior parte dei tumori sono stabiliti entro una stretta finestra di tempo relativo alla durata della crescita tumorale (cioè, il tempo fino al punto finale). Ciò consente al ricercatore di individuare punti di tempo per la raccolta dei dati (ad esempio MRI o IVIS) o di intervento (ad esempio trattamento farmacologico). Tassi di crescita del tumore variano con il tipo di cellule, il numero di cellule iniettate, e from mouse per mouse (molto come fanno in pazienti umani), ma sono coerenti da esperimento a esperimento.
Mentre questo protocollo utilizza una tecnica che può richiedere più tempo rispetto strumentazione e meno metodi esatti manuali di iniezione e potrebbe non essere applicabile alle indagini su larga scala, tecniche per le iniezioni intracraniche che consentono il throughput di un gran numero di animali (come quella descritta da Iwami et al. 12) per definizione comporta una rapida, iniezione ad alta pressione e spesso coinvolgono strumentazione portatile e misura manuale, che sono soggetti a instabilità e incertezza. Questi fattori possono essere associati a perdite e off-obiettivo di recapito 2,3. La precisione, la riproducibilità, e la bassa mortalità di questa procedura permetterà al ricercatore di progettare esperimenti di trattamento utilizzando un minor numero di topi per ottenere risultati statisticamente significativi - un risparmio netto.
Un passo è fondamentale per ilsuccesso di tumore impianto: la posizione precisa dell'iniezione. Cellule iniettate troppo vicino ai ventricoli possono portare alla diffusione di malattie CSF attraverso il sistema ventricolare o in regioni extracraniche. Cellule iniettate troppo superficiale possono crescere attraverso il percorso dell'ago. Coordinate predeterminate sono di poco valore se il posizionamento dell'ago è sciatta. Prendetevi il tempo per posizionare la testina del mouse saldamente nell'unità stereotassico. Utilizzare le opzioni di regolazione stereotassica e le barre orecchio per adattare l'attrezzatura per il mouse, e assicurarsi che la testa è stabilmente posizionata e non oscillare o torsione durante la procedura. Modifiche o variazioni se il sito di iniezione possono influenzare le caratteristiche del tumore, tra cui prendere tumore, la crescita, il potenziale invasivo, e l'accesso alla somministrazione di farmaci e la fornitura di ossigeno.
Altri parametri che hanno un profondo impatto sul tumore risultante includono la velocità di iniezione, numero di cellulare e il volume; tutto deve essere determinato empiricamente. Ridurre al minimo il volume del number di cellule necessarie per la crescita tumorale; utilizzare il tasso di iniezione lenta pratico. Numero di cellulare e il numero di passaggio hanno anche importanti effetti sulla presa del tumore e tasso di crescita. L'equipaggiamento specializzato utilizzato qui offrire un controllo superiore, ma i concetti di volume minimo, targeting preciso, velocità di iniezione minimale e coerente, e il ritiro lento ago può essere applicato a una varietà di tecniche (inclusa l'iniezione manuale) e una varietà di strumenti.
Questa procedura è aperta a una varietà di modifiche: il sito di iniezione può essere personalizzato per ricapitolare particolari tipi di tumori. Cellule aderenti coltura di tessuti, cloni geneticamente modificati, neurosfere, tumori disaggregati del mouse, o frammenti di tessuti umani possono essere innestate in un cervello di topo. Questa tecnica può anche essere adattato per gli studi non cellulari, tra cui il trasferimento di geni virali 3. Una volta stabilito un metodo per produrre in modo affidabile tumori delle caratteristiche desiderate, esperimenti confrontando l'efficacia delle terapie, trattamenti farmacologici e combinazioni, e altre opzioni come il trasferimento genico può essere eseguita.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Il dottor Keating è finanziato da DOD CA100335 concessione ed è un San Baldrick Foundation Scholar.
Materiali
| Name | Company | Catalog Number | Comments |
| Name of Reagent/ Equipment | Company | Catalog Number | Comments/Description |
| Equipment | |||
| Small Animal Stereotaxic Instrument with Digital Display Console. | Kopf | Model 940 | |
| Mouse Gas Anesthesia Head Holder | Kopf | Model 923-B | |
| Mouse Ear Bars | Kopf | Medel 922 | |
| Fiber Optic Illuminator | Fisher | 12-562-36 | |
| UltraMicroPump III | WPI | UMP3 | |
| Micro4 microprocessor | WPI | UMC4 | |
| Variable speed hand-held rotary drill | Dremel | Model 300 | |
| Dental drill bit, 1.0 mm | Spoelting | 514554 | |
| Adaptor for dental drill bit: 3/32 inch collet | Dremel | 481 | |
| Heating pad | for mice | ||
| Isoflurane vaporizer system | for mice | ||
| Medical tubing and connectors | to connect isoflurane vaporizer with stereotaxic frame | ||
| Instruments | |||
| Precision 25 ul micro syringe | Hamilton | 7636-01 | Model 702, without needle |
| Microsyringe needles, 26s gauge | Hamilton | 7804-04 | RN, 25 mm point style 2 |
| Fine-tipped scissors (straight, sharp/sharp) | |||
| Medium-sized standard scissors | |||
| Standard serrated forceps | |||
| Serrated hemostats (2) | |||
| Fine-tipped forceps | |||
| Supplies | |||
| Sutures 5-0 vicryl P-3 13 mm (Ethicon) | MWI | J463G | |
| Surgical blades #10, stainless (Feather) | Fisher | 296#10 | |
| Isoflurane (Fluriso) | VetOne | NDC 13985-528-60 | Item #502017. Liquid inhalation anesthetic. federal law restricts this drug to use by or on the order of a licensed veterinarian. |
| Carprofen (Rimadyl Injectable 50 mg/mL) | Pfizer | NDC 61106-8507-01 | dilute in saline |
| Ophthalmic ointment (artificial tears) | Rugby | NDC 0536-6550-91 | |
| Topical antibiotic (AK-Poly-Bac ) | Akorn | NDC 17478-238-35 | |
| Povidone-iodine topical antiseptic, 10% (Betadine) | Betadine | NDC 67618-150-04 | |
| Hydrogen Peroxide, 30% | Fisher | H325-100 | for visualizing skull landmarks |
| Sterile saline | VetOne | NDC 13985-807-25 | for diluting solutions, cleaning tissue |
| Bone wax | WPI | Item #501771 | |
| Sterile drapes | McKesson | 25-517 | |
| Sterile surgical gloves | McKesson | (to fit) | |
| Sterile gauze pads, 2 x 2 | Fisherbrand | 22028556 | |
| Sterile gauze pads, 4 x 4 | Fisherbrand | 22-415-469 | |
| Alcohol prep pads (medium) | PDI | B603 | |
| Sterile cotton-tipped applicators | Fisherbrand | 23-400-114 | |
| Sterile 0.5 ml screw cap tube with caps for cells | USA Scientific | 1405-4700 | for cells |
| Individually wrapped sterile dispo pipettes | Fisher | BD 357575 | for needle cleaning solutions |
| BD insulin syringes with needles | Fisher | 329461 | for analgesic |
| 70% ethanol | for cleaning | ||
| Sterile di H2O | for cleaning | ||
| Microfuge tubes for cleaning solutions | for needle cleaning solutions | ||
| Felt tip pen (dedicated) | for marking skull |
Riferimenti
- Heyer, J., Kwong, L. N., Lowe, S. W., Chin, L. Non-germline genetically engineered mouse models for translational cancer research. Nature reviews. Cancer. 10, 470-480 (2010).
- Yamada, S., et al. A method to accurately inject tumor cells into the caudate/putamen nuclei of the mouse brain. The Tokai journal of experimental and clinical medicine. 29, 167-173 (2004).
- Brooks, A. I., et al. Reproducible and efficient murine CNS gene delivery using a microprocessor-controlled injector. Journal of neuroscience. 80, 137-147 (1998).
- Shankavaram, U. T., et al. Molecular profiling indicates orthotopic xenograft of glioma cell lines simulate a subclass of human glioblastoma. Journal of cellular and molecular medicine. 16, 545-554 (2012).
- Giannini, C., et al. Patient tumor EGFR and PDGFRA gene amplifications retained in an invasive intracranial xenograft model of glioblastoma multiforme. Neuro-oncology. 7, 164-176 (2005).
- Yi, D., Hua, T. X., Lin, H. Y. EGFR gene overexpression retained in an invasive xenograft model by solid orthotopic transplantation of human glioblastoma multiforme into nude mice. Cancer investigation. 29, 229-239 (2011).
- Carty, N., et al. Intracranial injection of AAV expressing NEP but not IDE reduces amyloid pathology in APP+PS1 transgenic mice. PLos ONE. 8, e59626 (2013).
- Thaci, B., et al. Pharmacokinetic study of neural stem cell-based cell carrier for oncolytic virotherapy: targeted delivery of the therapeutic payload in an orthotopic brain tumor model. Cancer gene therapy. 19, 431-442 (2012).
- Ozawa, T., James, C. D. Establishing intracranial brain tumor xenografts with subsequent analysis of tumor growth and response to therapy using bioluminescence imaging. J. Vis. Exp. (41), (2010).
- Valadez, J. G., Sarangi, A., Lundberg, C. J., Cooper, M. K. Primary orthotopic glioma xenografts recapitulate infiltrative growth and isocitrate dehydrogenase I mutation. J. Vis. Exp. (83), (2014).
- Baumann, B. C., Dorsey, J. F., Benci, J. L., Joh, D. Y., Kao, G. D. Stereotactic intracranial implantation and in vivo bioluminescent imaging of tumor xenografts in a mouse model system of glioblastoma multiforme. J. Vis. Exp. (67), (2012).
- Iwami, K., et al. A novel method of intracranial injection via the postglenoid foramen for brain tumor mouse models. Journal of neurosurgery. 116, 630-635 (2012).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon