Method Article
Имплантация фибрина гель на Мышь легких для изучения легких специфическую ангиогенеза
В этой статье
Резюме
Recapitulation of the organ-specific microenvironment, which stimulates local angiogenesis, is indispensable for successful regeneration of damaged tissues. This report demonstrates a novel method to implant fibrin gels on the lung surface of living mouse in order to explore how the lung-specific microenvironment modulates angiogenesis and alveolar regeneration in adult mouse.
Аннотация
Последние значительные успехи в технике исследования стволовых клеток и биоинженерных сделали большой шаг вперед в использовании биоматериалов для регенерации и устранения повреждений в простых тканей в ортопедических и пародонта полей. Однако попытки восстановить структуры и функции более сложных трехмерных (3D) органов, таких как легкие были не очень успешными, потому что биологические процессы регенерации органов не были хорошо изучены. Становится ясно, что ангиогенез, образование новых кровеносных сосудов, играет ключевую роль в регенерации органов. Вновь образованные vasculatures не только доставляют кислород, питательные вещества и различные компоненты клеток, которые необходимы для регенерации органов, но также обеспечивают инструктивные сигналы регенерирующей местных тканей. Поэтому, чтобы успешно восстановить легкие у взрослого, необходимо повторять легких конкретных микросреды, в котором ангиогенез дисков регенерацию местных тканей легких. Хотя соnventional в естественных условиях ангиогенеза анализы, такие как подкожной имплантации внеклеточного матрикса (ЕСМ), обогащенный гидрогели (например, фибрин или коллагеновые гели или Matrigel - ECM смеси белков, выделяемый Engelbreth-Холм-рой мыши клеток саркомы), широко используемой для изучения Общие механизмы ангиогенеза, легких конкретных ангиогенез не были хорошо охарактеризованы, потому что методы ортотопической имплантации биоматериалов в легких не установлены. Цель этого протокола является внедрение уникальный метод имплантации фибрина гель на поверхности легких живой взрослой мыши, что позволяет для успешного рекапитуляции хозяина легких, полученных ангиогенеза внутри геля. Такой подход позволяет исследователям изучить механизмы, посредством которых легких конкретных микросреда контролирует ангиогенез и альвеолярной регенерации в нормальных, так и патологических состояний. Так, имплантированных биоматериалов выпуска и обеспечивать физических и химических сигналов в соседней лUNG ткани, имплантация этих биоматериалов на больного легкого может потенциально нормализовать соседние больные ткани, что позволяет исследователям разработать новые терапевтические подходы для различных видов заболеваний легких.
Введение
Общая цель этого протокола является введение метод имплантации фибрина гель на поверхности легких у взрослых мышей, что позволяет исследователям характеризовать молекулярные механизмы легких сосудистой и альвеолярной развития, а также возможность использовать эти знания для того, чтобы развивать биомиметических материалов, способных из обобщал физиологической сосудистой легких и альвеол образование для лечения различных заболеваний легких.
Более 35 миллионов американцев страдают от хронических заболеваний легких, включая хроническое обструктивное заболевание легких и фиброз легких. Эти пациенты имеют долгосрочные хронические респираторные симптомы, такие как затрудненное дыхание, стеснение в груди, нытье кашель и усталость, которые существенно снижают их повседневную жизнь 1-3. Несмотря на большое количество усилий, чтобы разработать эффективные методы лечения этих заболеваний легких, в настоящее время нет никакого лечения; Поэтому, качество жизни этих больных бедных и экономической и человеческие затраты приветGH 4-7. В настоящее время трансплантация легких является единственным способом спасти пациентов с терминальной стадией хронических заболеваний легких. Тем не менее, из-за нехватки трансплантатов доноров, высокая стоимость, серьезные осложнения, и низкая выживаемость 8-11, трансплантация не оптимальный подход. Последние быстрый прогресс в инженерии тканей позволил ученым биоинженер имплантируемый легких путем заселения decellularized всего легкого с различными типами клеток-предшественников или индуцированных плюрипотентных стволовых (плюрипотентных) клеток 12,13. Тем не менее, эти легкие биоинженерии функциональным в животных-хозяев только в течение нескольких часов после имплантации 12,14,15. Использование биоматериалов для регенерации сложные структуры и функции легких также было довольно неудачным. Это может быть потому, что ключевые биологические процессы, которые управляют взрослых регенерации легких не были хорошо изучены. В легких, формирование сосудистой системы является одним из самых ранних и самых важных событий Дуриразвитие нг и регенерация 16-21. Вновь созданная vasculatures в легких не только доставляют кислород, питательные вещества и различные клеточные компоненты, необходимые для формирования органов, но и представляют собой поучительные регуляторные сигналы для окружающих клеток 22-25. Таким образом, ангиогенез играет ключевую роль в регенеративной alveolarization у взрослых легкие 24,26,27. Кроме того, дерегулирование ангиогенез способствует хронических заболеваний легких, таких как хроническая обструктивная болезнь легких (ХОБЛ) 28, бронхолегочной дисплазии (БЛД) 21-23 и фиброз легких 29. Таким образом, для разработки более эффективных стратегий для инженерных легкие или лечения хронических заболеваний легких, необходимо понять основные механизмы легких конкретных ангиогенеза.
Каждый орган отображает уникальные механические и химические свойства, которые могут отличаться от физиологических и патологических условиях 30-33. Это органо-специфическое microenvironменты регулируют эндотелиальные поведения клеток и организовать формирование сосудистой сети в органе-специфическим образом 24,34-36. Таким образом, для разработки более эффективных стратегий для регенерации легких, механизм, лежащий в основе легких конкретных ангиогенез нужно понимать. В то время как обычные в естественных условиях ангиогенеза анализы, такие как подкожной гидрогеля имплантации широко используются для ангиогенеза исследований 37-39, эти методы не воспроизводят специфические для органа ангиогенез. В последнее время, новый способ имплантировать Матригель в упругом плесени на легкого мыши был разработан и было показано, успешно набирать кровеносные сосуды и легкие эпителиальные клетки в гелях 22. Этот уникальный подход позволит исследователям изучить механизм легких конкретных ангиогенеза, а также взаимодействия между кровеносными сосудами и не-сосудистых клеток легких в физиологических и патологических условиях. С 1) Matrigel не подходит для клинического применения; 2) еLastic Используемая форма для отливки гель может повлиять на взаимодействие между гидрогелей и хозяин легочной ткани и 3) упругой плесень на легких потенциально приводит к нарушению функции легких и боли при дыхании, как более клинически значимого подхода, 3D матрица фибрина, содержащий ангиогенные факторы (сосудистый эндотелиальный фактор роста (VEGF) / основной фактор роста фибробластов (bFGF)) был имплантирован на легких мыши без заливки в пресс-форму упругого и успешно воспроизводятся хоста легких, полученных ангиогенез. Фибрина гель, полимерные волокна, полученные из расщепленного тромбином фибриногена, как известно, ловушки различные ангиогенных факторов, таких как bFGF и VEGF, чтобы ускорить ангиогенеза в естественных условиях 40,41. Из-за своей восстановительной способности и биоразлагаемого характера 42, фибрина гель широко используется в области тканевой инженерии.
Эта статья представляет собой новый и уникальный подход к имплантации фибрина гель на поверхности легких живого ADULт мыши и демонстрирует, что хозяин легких, полученных ангиогенез воспроизводятся внутри гелей в естественных условиях. Это метод, который позволяет исследователям изучать легких конкретных ангиогенез, вероятно, приведет к разработке новых терапевтических подходов для различных видов заболеваний легких и значительно продвинет вперед усилия, чтобы успешно восстанавливают взрослых легкое.
протокол
ПРИМЕЧАНИЕ: в естественных условиях исследование на животных было проведено в строгом соответствии с рекомендациями, приведенными в руководстве по уходу и использованию лабораторных животных Национальных институтов здравоохранения. Протокол был рассмотрен и одобрен уходу и использованию комитета животных больницы Бостона детей (номера протоколов: 13-10-2526R, 14-02-2568R) по. Все препараты, используемые в настоящем Протоколе фармацевтического класса, и эти препараты готовят в стерильных условиях.
1. фибрина гель Подготовка
- Подготовка фибрина гель, который содержит VEGF и bFGF.
- Оттаивания исходные растворы фибриногена и тромбина, которые хранили при -80 ° С до комнатной температуры (25 ° C).
- Добавить тромбина (конечная концентрация: 2,5 Ед / мл), CaCl 2 (конечная концентрация: 45 мМ), VEGF (конечная концентрация: 0-100 нг / мл) и bFGF (конечная концентрация: 0-100 нг / мл) в фибриногена Раствор (конечная концентрация: 12,5 мг / мл в 0,9% sodiuм раствор хлорида 43-45) в 1,5 мл пробирку.
- Осторожно перемешать с помощью пипетки.
- Аккуратно пипетки 200 мкл смеси на стерильной пластиковой чашке в каплям с помощью p200 пипетки.
- Инкубируйте капель при 37 ° С в течение 30-60 мин, пока они не затвердевают.
Примечание: затвердевший гель можно хранить в герметичной пластиковой чашке при комнатной температуре (25 ° С) в течение нескольких часов перед имплантацией (фиг.1а).
- Обрезать фибрина гель в примерно 3 х 3 х 3 мм кубов с использованием малых хирургических ножниц перед имплантацией.
2. Подготовка мышь
- Обезболить взрослой мыши (8-12 недель) путем внутрибрюшинного (IP) инъекции кетамина (100 мг / кг) и ксилазина (10 мг / кг) и подтвердить, что мыши в достаточной анестезии, зажимая палец мыши.
- Используйте ветеринар мазь на глазах мыши, чтобы предотвратить сухость во время эксперимента.
- Бритье фуR над левой стороны грудной клетки мыши.
- Выполните эндотрахеальной интубации мыши.
- Поместите мышь на интубации стоять под углом в 70 ° и удерживайте мышь на месте, зацепив его верхние резцы на небольшой резиновой полосы, расположенной в верхней части подставки.
- Аккуратно уберите язык, чтобы с одной стороны тупыми щипцами.
- Представьте гортань с помощью волоконно-оптических гусиная шея микроскопа осветителя.
- Вставка эндотрахеальной эластичный катетер (21 г) в трахею.
- Убедитесь, что мышь спонтанного дыхания гладким образом (обычная 100-150 вдохов / мин, не парадоксально или мелкой дыхание).
- Наведите в положении лежа под микроскопом рассечение.
- Механически проветрить мышь с помощью вентилятора для грызунов (150 вдохов / мин и 7 мл / кг дыхательный объем).
- Граф ребра, чтобы найти межреберье между 4-м и 5-го ребра.
- Создать стерильное поле над областью Ьу тщательно вытирая с алкоголем и повидон-йода. Обложка операционного поля адекватно стерильный хирургический драпировкой.
3. Мышь хирургии
- После инъекции местного 0,25% бупивакаина (200 мкл) в коже, сделать поперечный разрез кожи (примерно 1 см длины) над межреберье, используя рассекает ножницы.
- После введения 0,25% бупивакаина (200 мкл) в межреберных мышцах, сделать мышцы разрез между 4-й и 5-го ребра, используя тонкие маленькие ножницы.
- Вставьте рассекает втягивающим между ребрами в полной мере представить себе левое легкое.
- Очистите небольшую площадь (1 х 1 мм квадрат) висцеральной плевры центра левого легкого с использованием тонких щипцов.
- Слегка надавливайте на область с помощью стерильного ватного тампона, пока кровотечение и утечки воздуха полностью не контролируется.
- Положите небольшое количество свежей смеси фибриногена / тромбина (фибринового клея) (шаг 1.1.2. 20 и #181; L) по площади с использованием P200 пипетки.
- Аккуратно поместите один фибрина гель (шаг 1.2) с помощью небольших щипцов по области (рис 1b).
- Убедитесь, что гель и фиксируется на области в течение дыхательных движений легких.
- Убедитесь в том, что нет ни массивные утечки воздуха, ни кровотечения из легких.
- Закрыть разрезы (мышечные и кожные слои) с рассасывающиеся нити, которые не должны быть удалены.
- Аспирируйте грудной полости с использованием 27 г иглу и шприц емкостью 1 мл для предотвращения пневмоторакса.
- Завершить механическую вентиляцию.
4. Мышь Recovery
- Убедитесь, что мышь спонтанного дыхания гладким образом (обычная 100-150 вдохов / мин, не парадоксально или мелкой дыхания).
- IP придать 1 мл подогретого 0,9% NaCl, чтобы предотвратить обезвоживание.
- Разрешить мыши, чтобы оправиться от циркулирующей теплой водяной подушки.
- Снимите endotracheаль трубка после подтверждения, что мышь имеет стабильную дыхание.
- Вводите мелоксикам (5 мг / кг, подкожно (SC), в течение 3 дней, как послеоперационный анальгетика.
- Следить за передвижениями мыши тщательно минимум в 15-минутными интервалами, пока он не грудины (в состоянии свернуть на живот и оставаться в вертикальном положении) и в сознании.
- После выздоровления вернуть указатель мыши в новую клетку, выделенных из мышей без хирургического вмешательства.
- Мониторинг операционного поля на наличие признаков инфекции (покраснение, отек, разрядов), основными функциями биологических животного (пищи и воды потребления, мочеиспускание, дефекация, увеличение веса тела), а также клинических признаков неблагополучия (пилоэрекции, снижение локомоции) в день после хирургическая процедура.
5. Сбор легких
- От 7 до 30 дней после имплантации, усыпить мышь с помощью CO 2 с помощью источника сжатого газа.
- Сделать надрез между кончиком xyphoid процесса и грудиныметки (средний стернотомия) и урожай весь легких с имплантированным геля для гистологического и биохимического анализа путем разрезания трахеи и рассекает все подключения к сердце, легкие, и трахеи.
- Исправить имплантированного гель с легкого с 4% раствором параформальдегида в течение ночи при 4 ° С, встраиваемые в октябре соединения, и принимать последовательные ступенчатые участки 30 мкм толщины.
- Выполните гистологические (гематоксилином и эозином) и иммуногистохимических анализов (эндотелия маркер: CD31, эпителиальных маркер: аквапорин (AQP) 5 и поверхностно-активное вещество белка (SP) -B) с помощью конфокальной микроскопии 22,37,40.
- Составьте стеки оптических срезов (30 мкм) с образованием трехмерных изображений легочной эндотелиальной и эпителиальные клетки, используя программное обеспечение для анализа 3D изображения 37.
- Количественная прогнозируемых области новообразованных сосудов с использованием программного обеспечения 46 анализа изображений.
Результаты
Чтобы исследовать, будет ли хост воспроизводятся легких, полученных сосудистой образование внутри биоматериалов имплантированных на легких, фибрина гели с добавлением основного ангиогенных факторов VEGF и bFGF (0, 10 и 100 нг / мл каждого) были имплантированы на поверхности живых легких мышей, как сообщили об использовании Матригель 22. Фибрина гели 47, которые содержат эти ангиогенные факторы роста были изготовлены, как показано на фиг.1а. После торакотомии, небольшой участок левого легкого поверхности была соскабливают с помощью щипцов и изготовлены фибрина гель был имплантирован на легком взрослых мышей с использованием небольшого количества фибринового клея, который одобрен FDA и широко используется в качестве эффективного герметика, чтобы остановить утечки воздуха и уменьшить кровотечение в легочной хирургии 48,49 (рис 1б). Большинство мышей восстановлены без острых респираторных симптомов (например, пневмоторакс, дыхательная недостаточность). Через семь дней после имплантации мышей умерщвляли и легкие были ХарвSTED. Имплантированных фибрина гель был включен в принимающей легких 7 дней после имплантации (рис 1в). 3D реконструкции конфокальных изображений флуоресценции показал, что хост-получены CD31-положительных эндотелиальные клетки сосудов, образованных в сети гелей 7 дней после имплантации в VEGF / bFGF дозозависимым образом (2а, с). Тип I (Аквапорин 5 положительный) и тип II (SP-B положительный) эпителиальные клетки легких были набраны по новообразованных сосудов внутри гелей, которые были дополнены более высоких концентраций VEGF и bFGF (каждый 100 нг / мл) (фиг.2А) , Н & Е окрашивание гистологических срезов показали, что другие типы клеток-хозяев и мигрировали в гель 7 дней после имплантации (рис 2b). Эти данные свидетельствуют о том, что хост легких, полученных регенеративные сосудистых сетей успешно построены внутри фибриновых гелей, которые дополнены ангиогенных факторов и имплантированных на поверхности взрослого муSE легких.
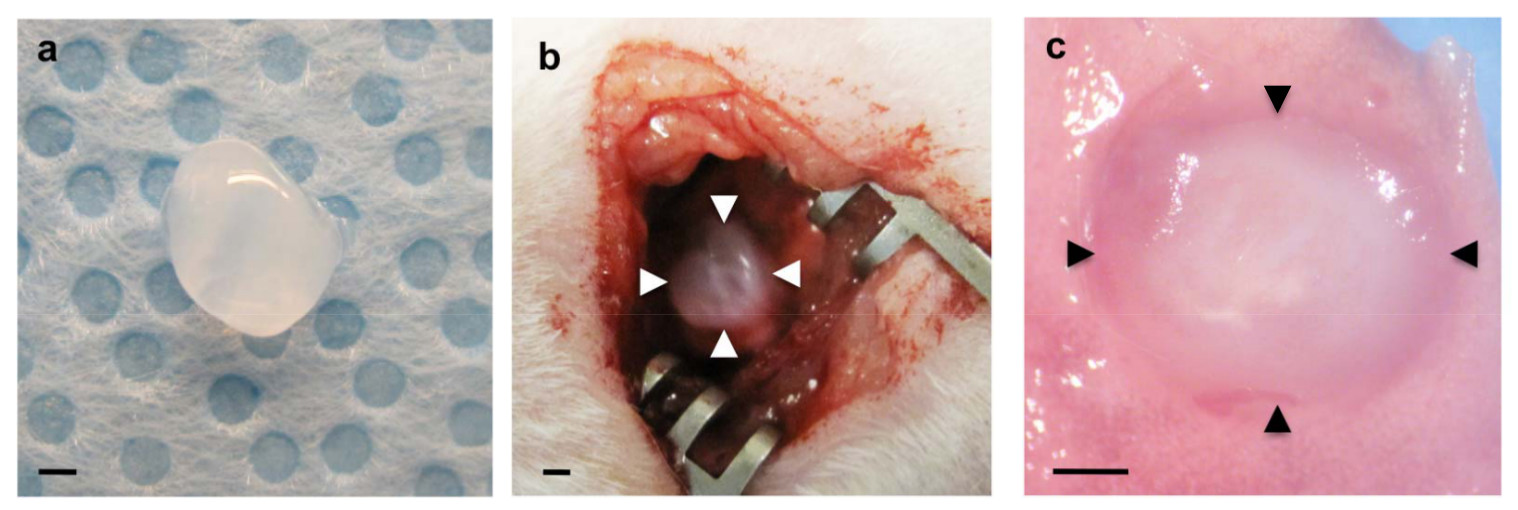
Рисунок 1:. (А) фибрина гель подготовили перед имплантацией (б) фибрина гель имплантируют на шнековом висцеральной плевры левого легкого (стрелки) (с), имплантированных фибрина гель (стрелки) включены в принимающей легких через 7 дней после имплантации.. Масштабные линейки 1 мм.
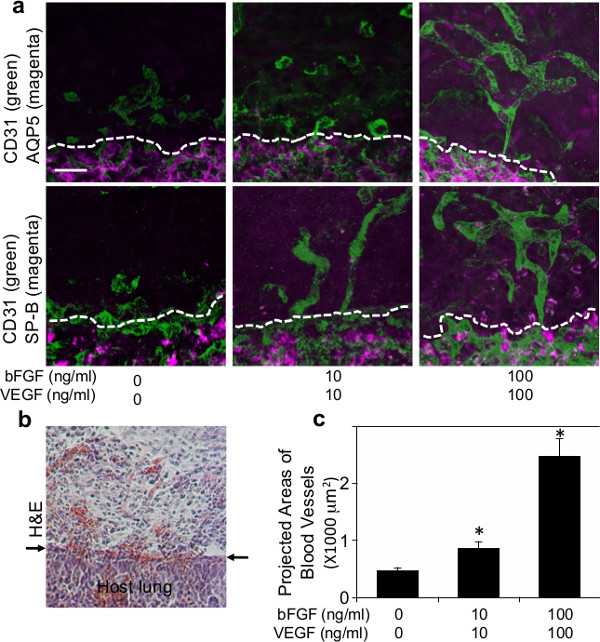
Рисунок 2: (а) Флуоресцентные микрофотографии, показывающие формирование сосудистых сетей (CD31 положительным; зеленый) и набранных типа I (Аквапорин 5-положительных; пурпурный) или типа II (SP-B положительно; пурпурный) эпителиальные клетки легких внутри фибринового геля с добавлением различные концентрации VEGF и bFGF (0, 10 и 100 нг / мл каждого) через 7 дней после имплантации. Пунктирные линии показывают взаимодействие между имплантированного фибрина гель и принимающей легких. Шкала бар:. 20 мкм (б) свет микрофотография H & E окрашивания показывает проникновение клеток-хозяев в фибрина гель 7 дней после имплантации. Стрелки указывают интерфейс между гелем и принимающей легких. Шкала бар: 20 мкм (с) график, показывающий прогнозируемые участки вновь образованных кровеносных сосудов в фибриновых гелей, которые с добавлением различных концентраций VEGF и bFGF (0, 10 и 100 нг / мл каждого) через 7 дней после имплантации..
Обсуждение
Эта статья вводит новый способ имплантировать биоматериалов на поверхности легких жизни взрослой мыши. С помощью этой системы, принимающей легких, полученных ангиогенез успешно воспроизводятся внутри материала. Эта система позволяет исследователи, чтобы исследовать перекрестные помехи между эндотелиальными клетками, другие клетки (например, эпителиальные клетки, мезенхимные клетки, клетки иммунной) и различные компоненты ECM, которые необходимы для местного ангиогенеза 50-53 и альвеолярного регенерации 24,54. Хотя принято в естественных условиях подкожной гидрогель имплантации широко используется для ангиогенеза исследований 37-39, эти методы не воспроизводят специфические для органа ангиогенез. Эта система, в которой гидрогель имплантируется непосредственно на поверхности легких, позволит исследователям изучить роль легких конкретных микросреды в ангиогенеза и альвеолярного регенерации во взрослом легких мышей. Эти гели могут быть изготовлены из различных ECM богатых biomateриалов (например, коллагены, fibrins), которые могут быть дополнены различными химическими факторами (например, факторов ангиогенеза, факторов роста) 55,56, клеток-предшественников и / или плюрипотентных клеток. В дополнение к химических факторов, механические силы и контролировать ангиогенез 23,37. Жесткость изменений фибрина гель в фибриногена зависимым от концентрации образом 57 и манипулирования концентрацию фибриногена может повлиять на ангиогенез не только с помощью химических сигналов, но также с помощью физических сигналов 58,59. Таким образом, физико-химические свойства гелей фибрина возможно, должны быть оптимизированы тщательно резюмировать физиологического органа конкретной ангиогенез в будущем. Заживление ран после выскабливания висцеральной плевры также производит эндогенный сгусток фибрина, который включает в себя различные типы клеток-хозяев и способствует процессу заживления и регенерации тканей. Этот природный сгусток может взаимодействовать с имплантированным экзогенно фибрина гель, и, следовательно, контролировать ангиогенезис в имплантированного геля. Флуоресцентно меченных фибриногена может позволить исследователям провести разграничение между естественной фибринового сгустка и имплантированным фибрина гель и исследовать эти механизмы. Хотя это мощный метод для характеристики ангиогенез у взрослых легких мышей, применение к изучению развития легких и заболеваний у новорожденных мышей, скорее всего, нынешние технические проблемы.
Конечная цель данного исследования заключается в наборе функциональных кровеносных сосудов в фибрин гели имплантированных на больные легкие и использовать матрицу как медицинский прибор для восстановления функциональной структуры легких. Возможные связи между клетками-хозяевами и сосудов и альвеолярных структур внутри гелей, а также функциональные возможности этих структур должны быть изучены в будущих экспериментов. Поскольку уровень VEGF в легких уменьшается у пациентов с пограничным расстройством личности 60 и эмфиземы 61, добавив, VEGF с матрицей может улучшить процесс набора персонала кровеносных сосудов в матричных осущanted на этих больных легких. Механические свойства также отличаются между здоровыми и больными легкими 23,62. Например, экспрессия матриксных металлопротеиназ и лизилоксидазы, которые контролируют деградацию и сшивание коллагена, соответственно, изменяются в различных легочных заболеваний, включая COPD и фиброза легких 63-67. В пораженных легких, некоторые клоны клеток-предшественников эндотелиальных легких и эпителиальных клеток истощаются 68. Таким образом, манипулируя эти факторы (ангиогенные факторы, ЕСМ, ЕСМ жесткость) или имплантации фибрина гели с добавкой клеток-предшественников 69, скорее всего, приведет к образованию функциональных кровеносных сосудов внутри матрицы и восстановления функции легких при различных патологических состояниях. Поскольку химические факторы могут быть дополнены внутри фибриновых гелей для модуляции локального ангиогенеза, эта система также может быть использован изучения конкретных экологических сигналы, которые могут нормализовать больные легкие в хронических легочных заболеваний.
Таким образом, эта статья вводит метод, чтобы внедрить фибрина гидрогель на поверхности легких живой мыши, что позволяет исследователям характеризовать легких конкретных ангиогенеза в естественных условиях. Модификация различных факторов (например, время, конечно, концентраций и комбинаций ангиогенных факторов, различные виды гидрогелей, физико-химические свойства гидрогелей) в этой системе, будет раскрыть механизмы ангиогенеза и регенерации в легких. Таким образом, эта система будет значительно расширения научных знаний о фундаментальной биологии сосудов, тканевой инженерии, а также Пульмонология.
Раскрытие информации
The authors declare that they have no competing financial interests.
Благодарности
Эта работа была поддержана за счет средств Американской ассоциации сердца (AM), Министерства обороны США (BC074986), и Бостонской детской больницы факультета Career Development Fellowship (ТМ AM). Авторы благодарят Аманда Цзяна и Элизабет Цзяна для оказания технической помощи.
Материалы
| Name | Company | Catalog Number | Comments |
| Fibrinogen from human placenta | Sigma | F4883 | For fabrication of fibrin gel |
| Thrombin from bovine plasma | Sigma | T9549 | For fabrication of fibrin gel |
| Recombinant mouse VEGF 164 | R&D | 493-MV | For supplementation to fibrin gel |
| Recombinant mouse bFGF | R&D | 3139-FB | For supplementation to fibrin gel |
| Rodent Intubation Stand | Braintree Scientific INC | RIS 100 | For intubation |
| Fiber-Optic Light Source | Fisher Scientific | 12-565-35 | For intubation |
| 21 G Elastic catheter | B.Braun | 4251652-02 | For intubation |
| MiniVent Ventilator | Harvard Apparatus | CGS-8009 | For ventilation |
| Stemi DV4 Steromicroscope | Fisher Scientific | 12-070-515 | For surgey |
| Absobable suture | Ethicon | PDP304 | Surgical suture |
| Antibody against CD31 | BD Biosciences | 553370 | Immunohistochemistry |
| Antibody against AQP5 | Abcam | AB78486 | Immunohistochemistry |
| Antibody against SP-B | Abcam | AB40876 | Immunohistochemistry |
Ссылки
- Donaldson, G. C., Seemungal, T. A., Bhowmik, A., Wedzicha, J. A. Relationship between exacerbation frequency and lung function decline in chronic obstructive pulmonary disease. Thorax. 57, 847-852 (2002).
- Lopez-Campos, J. L., Calero, C., Quintana-Gallego, E. Symptom variability in COPD: a narrative review. Int J Chron Obstruct Pulmon Dis. 8, 231-238 (2013).
- Ley, B., Collard, H. R., King, T. E. Clinical course and prediction of survival in idiopathic pulmonary fibrosis. Am J Respir Crit Care Med. 183, 431-440 (2011).
- Ferrer, M., et al. Chronic obstructive pulmonary disease stage and health-related quality of life. The Quality of Life of Chronic Obstructive Pulmonary Disease Study Group. Ann Intern Med. 127, 1072-1079 (1997).
- Reardon, J. Z., Lareau, S. C., ZuWallack, R. Functional status and quality of life in chronic obstructive pulmonary disease. Am J Med. 119, 32-37 (2006).
- De Vries, J., Kessels, B. L., Drent, M. Quality of life of idiopathic pulmonary fibrosis patients. Eur Respir J. 17, 954-961 (2001).
- Sullivan, S. D., Ramsey, S. D., Lee, T. A. The economic burden of COPD. Chest. 117, 5S-9S (2000).
- Orens, J. B., Garrity, E. R. General overview of lung transplantation and review of organ allocation. Proc Am Thorac Soc. 6, 13-19 (2009).
- Benden, C. Specific aspects of children and adolescents undergoing lung transplantation. Curr Opin Organ Transplant. 17, 509-514 (2012).
- Lyu, D. M., Zamora, M. R. Medical complications of lung transplantation. Proc Am Thorac Soc. 6, 101-107 (2009).
- Trulock, E. P., et al. Registry of the International Society for Heart and Lung Transplantation: twenty-fourth official adult lung and heart-lung transplantation report-2007. J Heart Lung Transplant. 26, 782-795 (2007).
- Weiss, D. J. Current status of stem cells and regenerative medicine in lung biology and diseases. Stem Cells. 32, 16-25 (2013).
- Ghaedi, M., et al. Human iPS cell-derived alveolar epithelium repopulates lung extracellular matrix. J Clin Invest. 123, 4950-4962 (2013).
- Ott, H. C., et al. Regeneration and orthotopic transplantation of a bioartificial lung. Nat Med. 16, 927-933 (2010).
- Petersen, T. H., et al. Tissue-engineered lungs for in vivo implantation. Science. 329, 538-541 (2010).
- Tuyl, M., et al. Angiogenic factors stimulate tubular branching morphogenesis of sonic hedgehog-deficient lungs. Dev Biol. 303, 514-526 (2007).
- Galambos, C., deMello, D. E. Molecular mechanisms of pulmonary vascular development. Pediatr Dev Pathol. 10, 1-17 (2007).
- McGrath-Morrow, S. A., et al. Vascular endothelial growth factor receptor 2 blockade disrupts postnatal lung development. Am J Respir Cell Mol Biol. 32, 420-427 (2005).
- White, A. C., Lavine, K. J., Ornitz, D. M. FGF9 and SHH regulate mesenchymal Vegfa expression and development of the pulmonary capillary network. Development. 134, 3743-3752 (2007).
- Zhao, L., Wang, K., Ferrara, N., Vu, T. H. Vascular endothelial growth factor co-ordinates proper development of lung epithelium and vasculature. Mech Dev. 122, 877-886 (2005).
- Stenmark, K. R., Abman, S. H. Lung vascular development: implications for the pathogenesis of bronchopulmonary dysplasia. Annu Rev Physiol. 67, 623-661 (2005).
- Mammoto, T., et al. LRP5 Regulates Development of Lung Microvessels and Alveoli through the Angiopoietin-Tie2 Pathway. PLoS ONE. 7, e41596(2012).
- Mammoto, T., Jiang, E., Jiang, A., Mammoto, A. ECM structure and tissue stiffness control postnatal lung development through the LRP5-Tie2 signaling system. American Journal of Respiratory Cell and Molecular Biology. 49, 1009-1018 (2013).
- Ding, B. S., et al. Endothelial-derived angiocrine signals induce and sustain regenerative lung alveolarization. Cell. 147, 539-553 (2011).
- Crivellato, E. The role of angiogenic growth factors in organogenesis. Int J Dev Biol. 55, 365-375 (2011).
- Sakurai, M. K., et al. Vascular endothelial growth factor accelerates compensatory lung growth after unilateral pneumonectomy. Am J Physiol Lung Cell Mol Physiol. 292, 742-747 (2007).
- Panigrahy, D., et al. Epoxyeicosanoids promote organ and tissue regeneration. Proc Natl Acad Sci U S A. 110, 13528-13533 (2013).
- Voelkel, N. F., Douglas, I. S., Nicolls, M. Angiogenesis in chronic lung disease. Chest. 131, 874-879 (2007).
- Hanumegowda, C., Farkas, L., Kolb, M. Angiogenesis in pulmonary fibrosis: too much or not enough. Chest. 142, 200-207 (2012).
- Levental, K. R., et al. Matrix crosslinking forces tumor progression by enhancing integrin signaling. Cell. 139, 891-906 (2009).
- Mammoto, A., Mammoto, T., Ingber, D. E. Mechanosensitive mechanisms in transcriptional regulation. J Cell Sci. 125, 3061-3073 (2012).
- Westermann, D., et al. Role of left ventricular stiffness in heart failure with normal ejection fraction. Circulation. 117, 2051-2060 (2008).
- Merchante, N., et al. Liver stiffness predicts clinical outcome in human immunodeficiency virus/hepatitis C virus-coinfected patients with compensated liver cirrhosis. Hepatology. 56, 228-238 (2012).
- Ding, B. S., et al. Inductive angiocrine signals from sinusoidal endothelium are required for liver regeneration. Nature. 468, 310-315 (2010).
- Fidler, I. J. Angiogenic heterogeneity: regulation of neoplastic angiogenesis by the organ microenvironment. J Natl Cancer Inst. 93, 1040-1041 (2001).
- Folkman, J. How is blood vessel growth regulated in normal and neoplastic tissue? G.H.A. Clowes memorial Award lecture. Cancer Res. 46, 467-473 (1986).
- Mammoto, A., et al. A mechanosensitive transcriptional mechanism that controls angiogenesis. Nature. 457, 1103-1108 (2009).
- Malinda, K. M. In vivo matrigel migration and angiogenesis assay. Methods Mol Biol. 467, 287-294 (2009).
- Norrby, K. In vivo models of angiogenesis. J Cell Mol Med. 10, 588-612 (2006).
- Mammoto, T., Jiang, A., Jiang, E., Mammoto, A. Platelet rich plasma extract promotes angiogenesis through the angiopoietin1-Tie2 pathway. Microvasc Res. 89, 15-24 (2013).
- Mosesson, M. W. Fibrinogen and fibrin structure and functions. J Thromb Haemost. 3, 1894-1904 (2005).
- Bensaid, W., et al. A biodegradable fibrin scaffold for mesenchymal stem cell transplantation. Biomaterials. 24, 2497-2502 (2003).
- Teichert-Kuliszewska, K., et al. Biological action of angiopoietin-2 in a fibrin matrix model of angiogenesis is associated with activation of Tie2. Cardiovasc Res. 49, 659-670 (2001).
- Lafleur, M. A., Handsley, M. M., Knauper, V., Murphy, G., Edwards, D. R. Endothelial tubulogenesis within fibrin gels specifically requires the activity of membrane-type-matrix metalloproteinases (MT-MMPs). J Cell Sci. 115, 3427-3438 (2002).
- Collen, A., et al. Aberrant fibrin formation and cross-linking of fibrinogen Nieuwegein, a variant with a shortened Aalpha-chain, alters endothelial capillary tube formation. Blood. 97, 973-980 (2001).
- Mammoto, T., et al. Mechanochemical Control of Mesenchymal Condensation and Embryonic Tooth Organ Formation. Dev Cell. 21, 758-769 (2011).
- Murphy, K. C., Leach, J. K. A reproducible, high throughput method for fabricating fibrin gels. BMC Res Notes. 5, 423(2012).
- Matar, A. F., Hill, J. G., Duncan, W., Orfanakis, N., Law, I. Use of biological glue to control pulmonary air leaks. Thorax. 45, 670-674 (1990).
- Thetter, O. Fibrin adhesive and its application in thoracic surgery. Thorac Cardiovasc Surg. 29, 290-292 (1981).
- Rahbarghazi, R., et al. Juxtacrine and paracrine interactions of rat marrow-derived mesenchymal stem cells, muscle-derived satellite cells, and neonatal cardiomyocytes with endothelial cells in angiogenesis dynamics. Stem Cells Dev. 22, 855-865 (2013).
- Nucera, S., Biziato, D., De Palma, M. The interplay between macrophages and angiogenesis in development, tissue injury and regeneration. Int J Dev Biol. 55, 495-503 (2011).
- Joensuu, K., et al. Interaction between marrow-derived human mesenchymal stem cells and peripheral blood mononuclear cells in endothelial cell differentiation. Scand J Surg. 100, 216-222 (2011).
- Takakura, N. Role of intimate interactions between endothelial cells and the surrounding accessory cells in the maturation of blood vessels. J Thromb Haemost. 9 Suppl 1, 144-150 (2011).
- Plantier, L., Boczkowski, J., Crestani, B. Defect of alveolar regeneration in pulmonary emphysema: role of lung fibroblasts. Int J Chron Obstruct Pulmon Dis. 2, 463-469 (2007).
- Belair, D. G., Murphy, W. L. Specific VEGF sequestering to biomaterials: influence of serum stability. Acta Biomater. 9, 8823-8831 (2013).
- Wong, C., Inman, E., Spaethe, R., Helgerson, S. Fibrin-based biomaterials to deliver human growth factors. Thromb Haemost. 89, 573-582 (2003).
- Stolzing, A., Colley, H., Scutt, A. Effect of age and diabetes on the response of mesenchymal progenitor cells to fibrin matrices. Int J Biomater. 2011, 378034(2011).
- Vailhe, B., Ronot, X., Tracqui, P., Usson, Y., Tranqui, L. In vitro angiogenesis is modulated by the mechanical properties of fibrin gels and is related to alpha(v)beta3 integrin localization. In Vitro Cell Dev Biol Anim. 33, 763-773 (1997).
- Kniazeva, E., Kachgal, S., Putnam, A. J. Effects of extracellular matrix density and mesenchymal stem cells on neovascularization in vivo. Tissue Eng Part A. 17, 905-914 (2011).
- Angio, C. T., Maniscalco, W. M. The role of vascular growth factors in hyperoxia-induced injury to the developing lung. Front Biosci. 7, 1609-1623 (2002).
- Kasahara, Y., et al. Inhibition of VEGF receptors causes lung cell apoptosis and emphysema. J Clin Invest. 106, 1311-1319 (2000).
- Owen, C. A. Roles for proteinases in the pathogenesis of chronic obstructive pulmonary disease. Int J Chron Obstruct Pulmon Dis. 3, 253-268 (2008).
- Demedts, I. K., et al. Elevated MMP-12 protein levels in induced sputum from patients with COPD. Thorax. 61, 196-201 (2006).
- Haq, I., et al. Association of MMP-2 polymorphisms with severe and very severe COPD: a case control study of MMPs-1, 9 and 12 in a European population. BMC Med Genet. 11, 7(2010).
- Mercer, P. F., et al. MMP-9, TIMP-1 and inflammatory cells in sputum from COPD patients during exacerbation. Respir Res. 6, 151(2005).
- Matute-Bello, G., et al. Essential role of MMP-12 in Fas-induced lung fibrosis. Am J Respir Cell Mol Biol. 37, 210-221 (2007).
- Sivakumar, P., Gupta, S., Sarkar, S., Sen, S. Upregulation of lysyl oxidase and MMPs during cardiac remodeling in human dilated cardiomyopathy. Mol Cell Biochem. 307, 159-167 (2008).
- Gomperts, B. N., Strieter, R. M. Stem cells and chronic lung disease. Annu Rev Med. 58, 285-298 (2007).
- Lau, A. N., Goodwin, M., Kim, C. F., Weiss, D. J. Stem cells and regenerative medicine in lung biology and diseases. Mol Ther. 20, 1116-1130 (2012).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены