Method Article
Die Implantation von Fibrin Gel auf Maus Lung Lung spezifischen Angiogenese Studieren
In diesem Artikel
Zusammenfassung
Recapitulation of the organ-specific microenvironment, which stimulates local angiogenesis, is indispensable for successful regeneration of damaged tissues. This report demonstrates a novel method to implant fibrin gels on the lung surface of living mouse in order to explore how the lung-specific microenvironment modulates angiogenesis and alveolar regeneration in adult mouse.
Zusammenfassung
Neue bedeutende Fortschritte in der Stammzellforschung und der Biotechnologie Techniken haben große Fortschritte bei der Nutzung von Biomaterialien zur Regeneration und Reparatur von Schäden in einfachen Gewebe in den orthopädischen und Zahn Feldern. Versuche, die Strukturen und Funktionen von komplexeren dreidimensionalen (3D) Organen wie Lunge regenerieren waren nicht sehr erfolgreich, da die biologischen Prozesse der Organregeneration wurden nicht gut erforscht. Es wird deutlich, dass die Angiogenese, die Bildung neuer Blutgefäße, spielt eine Schlüsselrolle bei Organregeneration. Die neu gebildeten Gefäßsystemen liefern nicht nur Sauerstoff, Nährstoffen und verschiedenen Zellbestandteile, die für die Organregeneration erforderlich sind, aber auch lehr Signale an die Regeneration von lokalen Geweben. Deshalb, um erfolgreich zu regenerieren Lungen bei einem Erwachsenen, ist es notwendig, die lungenspezifische Mikroumgebungen, bei denen Angiogenese Antriebe Regeneration lokalen Lungengewebe zu rekapitulieren. Obwohl Conventional in vivo Angiogenese-Assays, wie subkutane Implantation von extrazellulärer Matrix (ECM) -reiche Hydrogele (zB Fibrin oder Kollagengelen oder Matrigel - ECM Proteingemisch durch Engelbreth-Holm-Swarm-Maus-Sarkom-Zellen sezerniert), werden in großem Umfang genutzt, um das zu erforschen allgemeine Mechanismen der Angiogenese, lungenspezifischen Angiogenese ist nicht gut charakterisiert, weil Verfahren zur orthotope Implantation von Biomaterialien in der Lunge wurden nicht gut etabliert. Das Ziel des Protokolls ist es, eine einzigartige Methode einzuführen, um Fibrin-Gel auf der Lungenoberfläche von lebenden erwachsenen Maus implantiert werden, der eine erfolgreiche Wiederholung der Host Lunge abgeleitete Angiogenese innerhalb des Gels. Dieser Ansatz ermöglicht es Forschern, die Mechanismen, mit denen die lungenspezifischen Mikroumgebung steuert Angiogenese und alveoläre Regeneration in normalen und pathologischen Bedingungen zu erforschen. Seit implantierte Biomaterialien Release und liefern physikalischen und chemischen Signale zu benachbarten lung Gewebe kann Implantation dieser Biomaterialien auf kranken Lunge möglicherweise normalisieren die angrenzenden krankem Gewebe, so dass die Forscher neue Therapieansätze für verschiedene Arten von Lungenerkrankungen zu entwickeln.
Einleitung
Das übergeordnete Ziel dieses Protokolls ist es, ein Verfahren einzuführen, um Fibrin-Gel auf der Lungenoberfläche der erwachsenen Maus, die Forscher die molekularen Mechanismen der Lungenkreislauf und alveoläre Entwicklung charakterisieren können implantieren, und dieses Wissen, um biomimetische Materialien zu entwickeln in der Lage zu nutzen von rekapituliert physiologische Lungengefäß und alveoläre Bildung auf verschiedene Lungenkrankheiten zu behandeln.
Mehr als 35 Millionen Amerikaner leiden an chronischen Lungenerkrankungen wie chronisch obstruktive Lungenerkrankung und Lungenfibrose. Diese Patienten haben lang anhaltende chronische respiratorische Symptome wie Kurzatmigkeit, Brustenge, quälende Husten und Müdigkeit, die ihr tägliches Leben 1-3 erheblich beeinträchtigen. Trotz einer großen Aufwand zu wirksamen Therapien für diese Lungenerkrankungen zu entwickeln, derzeit gibt es keine Heilung; deshalb ist die Lebensqualität für diese Patienten schlecht und wirtschaftlichen und menschlichen Kosten sind hallogh 4-7. Derzeit ist eine Lungentransplantation die einzige Möglichkeit, Patienten im Endstadium einer chronischen Lungenerkrankungen zu speichern. Aufgrund der Knappheit von Transplantatspender, hohe Kosten, schweren Komplikationen und geringe Überlebensrate 8-11 Jedoch ist die Transplantation keine optimale Ansatz. Neue schnelle Fortschritte im Tissue Engineering Techniken konnten die Forscher implantierbaren Lungen von Bestandsauffüllung dezellularisierte ganze Lunge mit verschiedenen Arten von Vorläuferzellen oder induzierten pluripotenten Stammzellen (iPS-Zellen) 12,13 bioengineer. Allerdings sind diese biotechnologisch Lunge nur für einige Stunden nach der Implantation 12,14,15 Funktions in Wirtstiere. Verwendung von Biomaterialien, die komplexen Strukturen und Funktionen der Lunge zu regenerieren ist ebenfalls recht erfolgreich. Dies kann, weil die wichtigsten biologischen Prozesse, die erwachsenen Lungenregeneration regeln wurden nicht gut erforscht. In der Lunge ist die Bildung des vaskulären Systems eines der frühesten und bedeutendsten Ereignisse during Entwicklung und Regeneration 16-21. Neu in der Lunge liefern nicht nur Sauerstoff, Nährstoffen und verschiedenen Zellkomponenten für Organbildung erforderlich ist, sondern auch lehrreich Regulationssignale zur umgebenden Zellen 22-25 gebildeten Gefäßsystemen. So spielt die Angiogenese eine Schlüsselrolle bei der regenerativen Alveolarisierung bei erwachsenen Lungen 24,26,27. Zusätzlich trägt deregulierten Angiogenese zu chronischen Lungenerkrankungen, wie chronische obstruktive Lungenerkrankung (COPD) 28, bronchopulmonale Dysplasie (BPD), 21-23, und Lungenfibrose 29. Um somit effizienter Strategien für das Engineering Lungen oder der Behandlung von chronischen Lungenerkrankungen zu entwickeln, ist es notwendig, die grundlegenden Mechanismen der lungenspezifischen Angiogenese zu verstehen.
Jedes Organ zeigt außergewöhnliche mechanische und chemische Eigenschaften, die zwischen physiologischen und pathologischen Bedingungen 30-33 unterscheiden. Diese organspezifische microenvirongen regeln Endothelzellen Verhaltensweisen und orchestrieren Gefäßnetzwerkbildung in einer organspezifisch 24,34-36. Um somit effizienter Strategien für Lungenregeneration zu entwickeln, wobei der Mechanismus lungenspezifischen Angiogenese Basiswert muss verstanden werden. Während herkömmliche In-vivo-Angiogenese-Assays, wie subkutane Implantation Hydrogel wurden ausgiebig für Angiogeneseforschung 37-39 verwendet wurde, müssen diese Methoden nicht rekapitulieren organspezifischen Angiogenese. Kürzlich wurde ein neues Verfahren auf Matrigel in einer elastischen Form auf der Mauslunge implantieren ist entwickelt worden und dargestellt, die Blutgefäße und Lungenepithelzellen erfolgreich rekrutieren in die Gele 22. Dieser einzigartige Ansatz wird es den Forschern ermöglichen, den Mechanismus der lungenspezifischen Angiogenese sowie Wechselwirkungen zwischen Blutgefäßen und nicht-vaskulären Lungenzellen in physiologischen und pathologischen Bedingungen zu erforschen. Seit 1) Matrigel ist nicht geeignet für die klinische Anwendung; 2) die Elastic Form, um das Gel kann Wechselwirkungen zwischen Hydrogelen und Wirtslungengewebe und 3) die elastische Form an der Lunge möglicherweise verursacht eine Beeinträchtigung der Lungenfunktion und Schmerzen während der Atmung beeinflussen geworfen, als mehr klinisch relevanten Ansatz verwendet, ein 3D-Fibrin-Matrix, die angiogenen Faktoren (vaskulärer endothelialer Wachstumsfaktor (VEGF) / basischen Fibroblasten-Wachstumsfaktor (bFGF)) wurde auf der Mauslunge ohne Casting in der elastischen Form implantiert worden und hat Gast Lunge abgeleitete Angiogenese erfolgreich rekapituliert. Fibrin-Gel, Polymerfibrillen aus Thrombin gespaltenen Fibrinogen erzeugt wird, wird zum Einfangen einer Vielzahl von angiogenen Faktoren wie bFGF und VEGF die Angiogenese in vivo 40,41 beschleunigen bekannt. Wegen ihrer Regenerationsfähigkeit und biologisch abbaubare Natur 42 wird Fibringel verbreitet auf dem Gebiet des Tissue Engineering eingesetzt.
Dieser Artikel stellt einen neuen und einzigartigen Ansatz zur Fibringel auf der Lungenoberfläche lebender adul implantierent-Maus und zeigt, dass die Host-Lungen-abgeleitete Angiogenese in den Gelen in vivo rekapituliert. Diese Methode, die Forscher ermöglicht, lungenspezifischen Angiogenese zu untersuchen, wird wahrscheinlich zur Entwicklung neuer Therapieansätze für verschiedene Arten von Lungenerkrankungen führen und die Bemühungen um adulten Lunge erfolgreich regenerieren erheblich voranbringen.
Protokoll
HINWEIS: Die in-vivo-Tierstudie wurde in strikter Übereinstimmung mit den Empfehlungen in der Bedienungsanleitung für die Pflege und Verwendung von Labortieren der National Institutes of Health durchgeführt. Das Protokoll wurde überprüft und von der Animal Care und Verwenden Committee von Boston Kinderkrankenhaus (Protokoll-Nummern: 13-10-2526R, 14-02-2568R) zugelassen. Alle Arzneistoffe in diesem Protokoll verwendet werden pharmazeutischer Qualität und diese Medikamente werden unter sterilen Bedingungen hergestellt.
1. Fibrin Gel Vorbereitung
- Bereiten Fibringel dass VEGF und bFGF enthält.
- Tau-Stammlösungen von Fibrinogen und Thrombin, die bei -80 ° C bis Raumtemperatur (25 ° C) gelagert werden.
- Hinzufügen Thrombin (Endkonzentration: 2,5 U / ml), CaCl 2 (Endkonzentration: 45 mM), VEGF (Endkonzentration: 0-100 ng / ml) und bFGF (Endkonzentration: 0-100 ng / ml) zu der Fibrinogen -Lösung (Endkonzentration: 12,5 mg / ml in 0,9% sodium Chloridlösung 43-45) in einem 1,5-ml-Röhrchen.
- Vorsichtig mischen.
- Gently Pipette 200 ul der Mischung auf einer sterilen Kunststoffschale in einer tropfenweise Mode mit p200 Pipettenspitze.
- Die Tropfen bei 37 ° C für 30-60 min, bis sie sich verfestigen.
ANMERKUNG: Das erstarrte Gel kann in dem verschlossenen Kunststoffschale bei Raumtemperatur (25 ° C) für mehrere Stunden vor der Implantation (1a) gehalten werden kann.
- Schneiden Sie die Fibrin-Gel in ca. 3 x 3 x 3 mm Würfel mit kleinen chirurgische Scheren vor der Implantation.
2. Maus Vorbereitung
- Anesthetize adulten Maus (8-12 Wochen) durch intraperitoneale (IP) Injektion von Ketamin (100 mg / kg) und Xylazin (10 mg / kg) und bestätigen, dass die Maus ausreichend durch Einklemmen Zehe des Maus anästhesiert.
- Verwenden Tierarzt Salbe auf Augen der Maus bis zur Trockenheit während des Experiments zu verhindern.
- Shave fur auf der linken Seite des Brustkorbs der Maus.
- Führen Intubation der Maus.
- Platzieren Sie die Maus auf der Intubation stehen bei 70 ° abgewinkelt und halten Maus anstelle durch Einhaken seine oberen Schneidezähne in einem kleinen Gummiband an der Spitze des Stativs befindet.
- Die Zunge vorsichtig zurückziehen, um eine Seite mit stumpfen Pinzette.
- Visualisieren des Kehlkopfes mit Hilfe eines faseroptischen Gooseneck Mikroskopleuchte.
- Legen endotrachealen elastischen Katheters (21 G) in die Luftröhre.
- Überprüfen Sie, ob die Maus spontan atmenden eine reibungslose Umstellung (regular 100-150 Atemzüge / min, keine paradoxen oder flache Atmung).
- Platzieren Sie die Maus in Bauchlage unter der Dissektionsmikroskop.
- Die Maus mit einem Nagetier Ventilator mechanisch lüften (150 Atemzüge / min und 7 ml / kg Atemvolumen).
- Graf Rippen Zwischenrippenraum zwischen 4 und 5. Rippe zu finden.
- Erstellen Sie einen sterilen Bereich über den Bereich by gründlich Abwischen mit Alkohol und PVP-Jod. Decken Sie das Operationsfeld ausreichend mit einem sterilen Operationstuch.
3. Maus-Chirurgie
- Nachdem lokale Injektion von 0,25% Bupivacain (200 ul) in der Haut, machen Sie einen Querhautschnitt (ca. 1 cm Länge) über den Zwischenrippenraum mit Präparierscheren.
- Nach Injektion von 0,25% Bupivacain (200 ul) in die Zwischenrippenmuskel, einen Muskel Einschnitt zwischen dem 4. und 5. Rippe mit feinen kleinen Schere.
- Legen Sie eine Sezieren Aufroller zwischen den Rippen, um die linke Lunge vollständig zu visualisieren.
- Kratzen Sie einen kleinen Bereich (1 x 1 mm im Quadrat) der Pleura von der Mitte der linken Lunge mit feinen Pinzette.
- Drücken Sie vorsichtig auf den Bereich mit einem sterilen Wattestäbchen bis Blutungen und Luftleckagen vollständig gesteuert.
- Legen Sie kleine Menge frischer Mischung aus Fibrinogen / Thrombin (Fibrinkleber) (Schritt 20 1.1.2. & #181; l) über den Bereich mit p200 Pipettenspitze.
- Legen Sie vorsichtig eine Fibrin-Gel (Schritt 1.2) mit kleinen Zange über den Bereich (Abbildung 1b).
- Bestätigen Sie, dass das Gel auch auf den Bereich während der Atembewegungen der Lunge fest.
- Stellen Sie sicher, dass es weder massive Luft undicht oder Blutungen aus der Lunge.
- Schließen Einschnitte (Muskel- und Hautschichten) mit einer absorbierbaren Naht, welches nicht entfernt werden.
- Saugen Sie das Brusthöhle mit 27 G Nadel und 1-ml-Spritze zu Pneumothorax zu verhindern.
- Beenden der mechanischen Beatmung.
4. Mauswiederherstellung
- Achten Sie darauf, die Maus spontan atmenden eine reibungslose Umstellung (regular 100-150 Atemzüge / min, keine paradoxen oder flache Atmung).
- IP Injektion 1 ml vorgewärmtes, 0,9% NaCl, um Austrocknung zu verhindern.
- Lassen Sie mit der Maus auf dem zirkulierenden Warmwasserpolster erholen.
- Entfernen Sie die endotracheal Rohr nach der Bestätigung, dass die Maus über stabile Atmung.
- Injizieren Meloxicam (5 mg / kg, subkutane Injektion (SC), für 3 Tage als postoperative analgetische.
- Überwachen Sie die Bewegungen der Maus vorsichtig auf ein Minimum von 15 Minuten-Intervallen, bis es sternale (in der Lage, auf den Bauch rollen und bleiben aufrecht) und bei Bewusstsein.
- Nach der Wiederherstellung zurück die Maus, um einen neuen Käfig aus Mäusen isoliert ohne Operation.
- Überwachen Sie die Operationsstelle auf Anzeichen einer Infektion (Rötung, Schwellung, Ausfluss), grundlegende biologische Funktionen Tieres (Futter- und Wasseraufnahme, Wasserlassen, Stuhlgang, Gewichtszunahme) sowie klinische Anzeichen von Leiden (Piloerektion, reduziert Bewegungs) täglich im Anschluss an die chirurgischen Eingriffs.
5. Ernten der Lunge
- 7 bis 30 Tage nach der Implantation, euthanize der Maus unter Verwendung von CO 2 über Druckgasquelle.
- Einen Einschnitt zwischen der Spitze des Schwertfortsatz und der BrustbeinKerbe (mediane Sternotomie) und Ernte ganze Lunge mit dem implantierten Gel zur histologischen und biochemischen Analyse, indem die Luftröhre und seziert alle Verbindungen zum Herz, Lunge und Luftröhre.
- Fix implantierte Gel mit Lungenkrebs mit 4% Paraformaldehydlösung über Nacht bei 4 ° C, in OCT-Verbindung eingebettet werden, und nehmen Sie die Serienstufenabschnitte von 30 um Dicke.
- Führen histologische (Hämatoxylin und Eosin-Färbung) und immunhistochemische Analysen (endotheliale Marker: CD31, epithelialen Marker: Aquaporin (AQP) 5 und Surfactant Protein (SP) -B) mit konfokalen Mikroskop 22,37,40.
- Kompilieren Stapeln optischer Schnitte (30 um dick), um dreidimensionale Bilder der Lungen Endothel- und Epithelzellen mit 3D-Bildanalyse-Software 37 zu bilden.
- Quantifizieren projizierten Flächen der neugebildeten Blutgefäßen mit Bildanalyse-Software 46.
Ergebnisse
Um zu untersuchen, ob Host Lungen abgeleiteten Gefäßbildung im Inneren der Biomaterialien auf die Lunge implantiert rekapituliert Fibringele mit großen angiogenetischen Faktoren VEGF und bFGF supplementiert (0, 10 und 100 ng / ml) wurden auf die Oberfläche von lebenden Maus-Lungen implantiert berichtet mit Matrigel 22. Fibringele 47, die diese angiogene Wachstumsfaktoren enthalten, wurden hergestellt, wie in 1a gezeigt. Nach Thorakotomie wurde ein kleiner Bereich der linken Lungenoberfläche mit einer Pinzette abgekratzt und der gefertigte Fibrin-Gel wurde auf die Lunge des erwachsenen Maus unter Verwendung einer geringen Menge an Fibrinkleber, die FDA genehmigt und weithin als wirksames Dichtungsmittel verwendet, um zu stoppen, ist implantiert Leckagen und reduzieren Blutungen im Lungenoperation 48,49 (Abbildung 1b). Die meisten Mäuse erholten sich ohne schwere respiratorische Symptome (zB Pneumothorax, Atemnot). Sieben Tage nach der Implantation wurden die Mäuse getötet und die Lungen wurden harvested. Implantierte Fibrin Gel wurde 7 Tage nach der Implantation (Abbildung 1c) in die Wirtslungen integriert. 3D-Rekonstruktion der konfokalen Fluoreszenzbilder hat, dass die vom Wirt stamm CD31-positiven Endothelzellen in einem VEGF / bFGF dosisabhängige Weise gebildeten Gefäßnetze innerhalb der Gele 7 Tage nach der Implantation dargestellt (Abbildung 2a, c). Typ I (AQP5 positiv) und Typ II (SP-B positiv) Lungenepithelzellen wurden auch entlang neugebildeten Blutgefäßen im Inneren des Gels, die mit höheren Konzentrationen von VEGF und bFGF (jeweils 100 ng / ml) (Abbildung 2a) ergänzt wurden rekrutiert . H & E-Färbung histologischer Schnitte zeigten, dass andere Arten von Wirtszellen nach der Implantation (Figur 2b) auch in die Gelt 7 Tage migriert. Diese Ergebnisse legen nahe, dass Host Lunge abgeleiteten regenerativen Gefäßnetze erfolgreich innerhalb der Fibrin-Gele, die mit angiogenen Faktoren ergänzt werden und auf der Oberfläche der Erwachsenen mou implantiert konstruiertse Lunge.
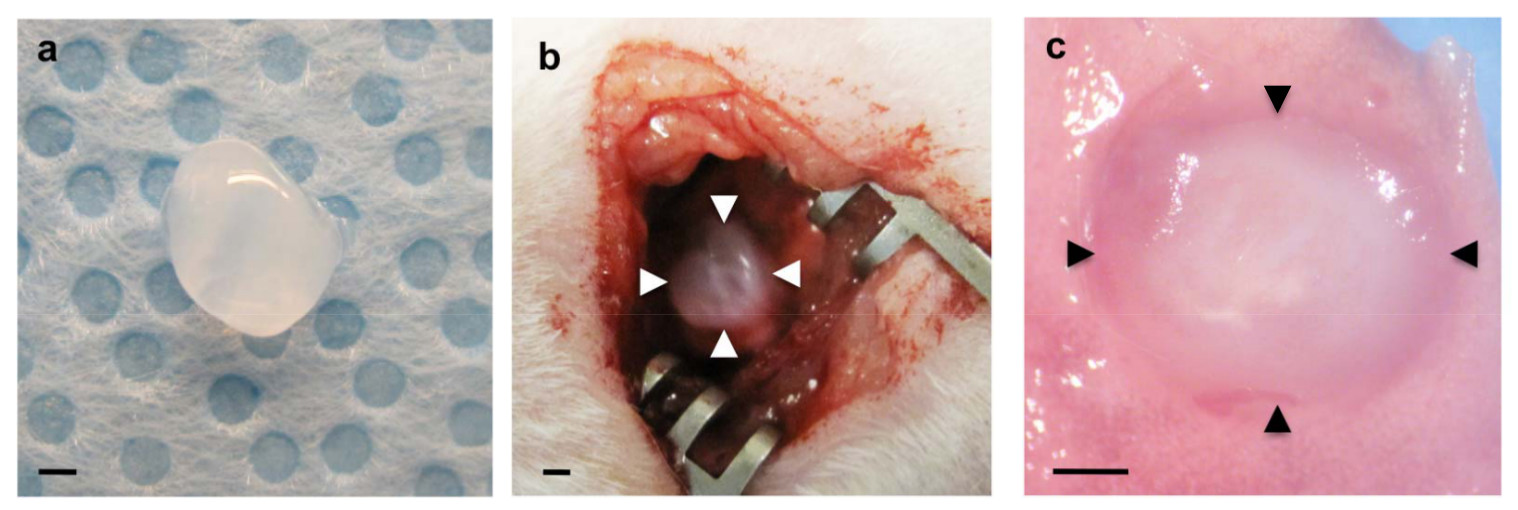
Abb. 1: (a) Fibrin-Gel vor der Implantation (b) hergestellten Fibringel über abgekratzten Pleura der linken Lunge (Pfeilspitzen) implantiert (c) Implantierte Fibringel (Pfeilspitzen) 7 Tage nach der Implantation in den Wirt Lunge aufgenommen.. Maßstabsbalken 1 mm.
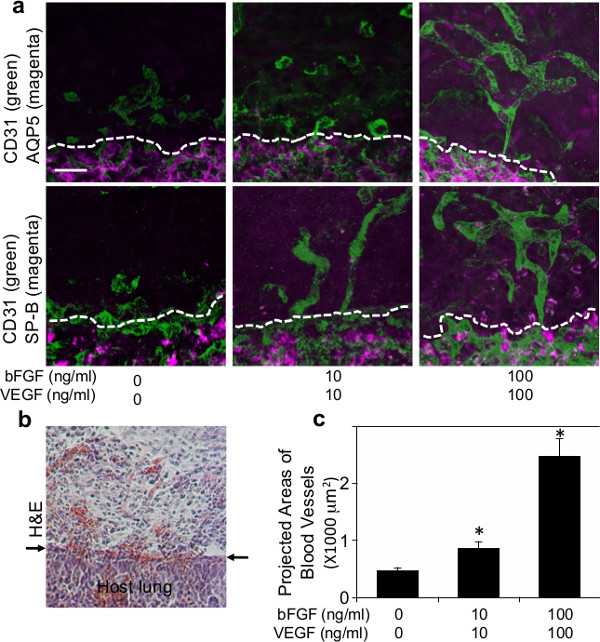
Abbildung 2: (a) Fluoreszenzbilder, die Bildung von Gefäßnetze (CD31 positiv, grün) und rekrutiert Typ I (AQP5-positiv, magenta) oder Typ II (SP-B positiv, magenta) Lungenepithelzellen in der Fibrin-Gel ergänzt verschiedenen Konzentrationen von VEGF und bFGF (0, 10 und 100 ng / ml) 7 Tage nach Implantation. Gestrichelte Linien geben die Schnittstelle zwischen implantierten Fibringel und Gastgeber Lunge. Maßstab:. 20 um (b) Lichtmikroskopische Aufnahme von H & E Färbung, die Infiltration der Wirtszellen in das Fibrin-Gel 7 Tage nach der Implantation. Pfeile zeigen die Grenzfläche zwischen dem Gel und Wirts Lunge. Maßstab: 20 um (c) Grafik, die projizierten Flächen der neu gebildeten Blutgefäße in den Fibrin-Gele, die mit verschiedenen Konzentrationen von VEGF und bFGF ergänzt werden (0, 10 und 100 ng / ml jeweils) 7 Tage nach der Implantation..
Diskussion
Dieser Artikel stellt eine neue Methode zur Biomaterialien auf der Lungenoberfläche lebender erwachsener Mäuse zu implantieren. Mit diesem System wird die Host-Lungen-abgeleitete Angiogenese erfolgreich im Material rekapituliert. Dieses System ermöglicht es den Forschern, um Übersprechen zwischen den Endothelzellen zu erforschen, andere Zellen (beispielsweise Epithelzellen, mesenchymale Zellen, Immunzellen) und verschiedene ECM-Komponenten, die für die lokale Angiogenese 50-53 und alveolären Regenerations 24,54 erforderlich. Obwohl herkömmliche Hydrogel in vivo subkutane Implantation wurde ausgiebig für Angiogeneseforschung 37-39 verwendet, müssen diese Methoden nicht rekapitulieren organspezifischen Angiogenese. Dieses System, in dem Hydrogel direkt auf der Lungenoberfläche implantiert werden, ermöglichen es den Forschern, die Rollen des lungenspezifischen Mikroumgebung in der Angiogenese und alveoläre Regeneration im erwachsenen Mauslunge zu erkunden. Diese Gele können aus verschiedenen ECM-reiche BIOMATE hergestellt werdenrialien (zB Kollagene, Fibrinen), die mit verschiedenen chemischen Faktoren (zB angiogenen Faktoren, Wachstumsfaktoren) 55,56, Vorläuferzellen und / oder iPS-Zellen ergänzt werden kann. Neben den chemischen Faktoren, mechanische Kräfte kontrollieren auch Angiogenese 23,37. Die Steifigkeit Fibringel Änderungen einer Fibrinogenkonzentration abhängig 57 und Manipulieren der Fibrinogenkonzentration die Angiogenese nicht nur durch chemische Signale, sondern auch durch körperliche Signale 58,59 beeinflussen. Daher müssen physikochemischen Eigenschaften der Fibringele sorgfältig optimiert werden, um physiologische organspezifischen Angiogenese in der Zukunft zu rekapitulieren. Wundheilung nach Abkratzen der Pleura produziert auch eine endogene Fibringerinnsel, die verschiedenen Arten von Wirtszellen beinhaltet und fördert den Heilungsprozess und Geweberegeneration. Diese natürliche Gerinnsel kann mit der exogen implantiert Fibringel interagieren und damit kontrollieren AngioUrsprung in der implantierten Gel. Fluoreszenzmarkierten Fibrinogen kann Forschern ermöglichen, zwischen natürlichen Fibringerinnsel und implantiert Fibringel unterscheiden und erkunden diese Mechanismen. Obwohl es sich um eine leistungsfähige Methode, um die Angiogenese bei erwachsenen Maus Lunge, Anwendung auf die Untersuchung von Lungenentwicklung und Krankheiten bei neugeborenen Mäusen würde wahrscheinlich vorhanden technischen Herausforderungen zu charakterisieren.
Das ultimative Ziel der Studie ist es, funktionelle Blutgefäße in Fibringele auf kranke Lunge implantiert zu gewinnen und um die Matrix als ein medizinisches Gerät verwenden, um funktionelle Lungenstrukturen wiederherzustellen. Mögliche Kommunikation zwischen Wirtszellen und der vaskulären und alveolare Strukturen innerhalb der Gele als auch die Funktionalität dieser Struktur sollte in weiteren Experimenten untersucht werden. Da VEGF Ebenen in der Lunge bei Patienten mit BPD 60 und Emphysem 61 verringert, kann die Zugabe von VEGF an die Matrix Rekrutierung von Blutgefäßen in die Matrix impl verbessernauf diesen kranken Lunge anted. Die mechanischen Eigenschaften unterscheiden sich auch zwischen gesunden und kranken Lunge 23,62. B. Expression von Matrix-Metalloproteinasen und Lysyloxidase, die den Abbau und die Vernetzung von Kollagenen zu steuern, jeweils in verschiedene Lungenerkrankungen einschließlich COPD und Lungenfibrose 63-67 geändert. In lungen werden bestimmte Abstammungslinien von Vorläufern für Lungen endotheliale und epitheliale Zellen verarmt 68. Somit Manipulation dieser Faktoren (angiogene Faktoren, ECMs, ECM Steifigkeit) oder Implantieren Fibringele mit Vorläuferzellen ergänzt 69 wird wahrscheinlich an der Bildung funktioneller Blutgefäße innerhalb der Matrix und Rückgewinnung der Lungenfunktion bei verschiedenen pathologischen Zuständen führen. Da chemische Faktoren können innerhalb der Fibringele ergänzt um lokale Angiogenese zu modulieren, kann dieses System auch genutzt erforschen spezifischen Umweltsignale, die kranke Lunge bei chronischen Lungenerkrankungen normalisiert werden kann.
Zusammenfassend diesem Artikel stellt eine Methode zur Fibrinhydrogel auf der Lungenoberfläche lebender Maus, die Forschern ermöglicht, lungenspezifischen Angiogenese in vivo zu charakterisieren zu implantieren. Modifikation von verschiedenen Faktoren (zB Zeitverlauf, Konzentrationen und Kombinationen von angiogenen Faktoren, verschiedene Arten von Hydrogelen, physikalisch-chemischen Eigenschaften von Hydrogelen) in diesem System werden die Mechanismen der Angiogenese und der Regeneration in der Lunge zu enthüllen. So wird dieses System erheblich voran wissenschaftlichen Kenntnisse der grundlegenden Gefäßbiologie, des Tissue Engineering sowie Lungenheilkunde.
Offenlegungen
The authors declare that they have no competing financial interests.
Danksagungen
Diese Arbeit wurde durch Mittel aus der American Heart Association (AM), US Department of Defense (BC074986) und Boston Kinderkrankenhaus Fakultät Career Development Fellowship (TM, PM) unterstützt. Die Autoren danken Amanda Jiang und Elisabeth Jiang für die technische Unterstützung.
Materialien
| Name | Company | Catalog Number | Comments |
| Fibrinogen from human placenta | Sigma | F4883 | For fabrication of fibrin gel |
| Thrombin from bovine plasma | Sigma | T9549 | For fabrication of fibrin gel |
| Recombinant mouse VEGF 164 | R&D | 493-MV | For supplementation to fibrin gel |
| Recombinant mouse bFGF | R&D | 3139-FB | For supplementation to fibrin gel |
| Rodent Intubation Stand | Braintree Scientific INC | RIS 100 | For intubation |
| Fiber-Optic Light Source | Fisher Scientific | 12-565-35 | For intubation |
| 21 G Elastic catheter | B.Braun | 4251652-02 | For intubation |
| MiniVent Ventilator | Harvard Apparatus | CGS-8009 | For ventilation |
| Stemi DV4 Steromicroscope | Fisher Scientific | 12-070-515 | For surgey |
| Absobable suture | Ethicon | PDP304 | Surgical suture |
| Antibody against CD31 | BD Biosciences | 553370 | Immunohistochemistry |
| Antibody against AQP5 | Abcam | AB78486 | Immunohistochemistry |
| Antibody against SP-B | Abcam | AB40876 | Immunohistochemistry |
Referenzen
- Donaldson, G. C., Seemungal, T. A., Bhowmik, A., Wedzicha, J. A. Relationship between exacerbation frequency and lung function decline in chronic obstructive pulmonary disease. Thorax. 57, 847-852 (2002).
- Lopez-Campos, J. L., Calero, C., Quintana-Gallego, E. Symptom variability in COPD: a narrative review. Int J Chron Obstruct Pulmon Dis. 8, 231-238 (2013).
- Ley, B., Collard, H. R., King, T. E. Clinical course and prediction of survival in idiopathic pulmonary fibrosis. Am J Respir Crit Care Med. 183, 431-440 (2011).
- Ferrer, M., et al. Chronic obstructive pulmonary disease stage and health-related quality of life. The Quality of Life of Chronic Obstructive Pulmonary Disease Study Group. Ann Intern Med. 127, 1072-1079 (1997).
- Reardon, J. Z., Lareau, S. C., ZuWallack, R. Functional status and quality of life in chronic obstructive pulmonary disease. Am J Med. 119, 32-37 (2006).
- De Vries, J., Kessels, B. L., Drent, M. Quality of life of idiopathic pulmonary fibrosis patients. Eur Respir J. 17, 954-961 (2001).
- Sullivan, S. D., Ramsey, S. D., Lee, T. A. The economic burden of COPD. Chest. 117, 5S-9S (2000).
- Orens, J. B., Garrity, E. R. General overview of lung transplantation and review of organ allocation. Proc Am Thorac Soc. 6, 13-19 (2009).
- Benden, C. Specific aspects of children and adolescents undergoing lung transplantation. Curr Opin Organ Transplant. 17, 509-514 (2012).
- Lyu, D. M., Zamora, M. R. Medical complications of lung transplantation. Proc Am Thorac Soc. 6, 101-107 (2009).
- Trulock, E. P., et al. Registry of the International Society for Heart and Lung Transplantation: twenty-fourth official adult lung and heart-lung transplantation report-2007. J Heart Lung Transplant. 26, 782-795 (2007).
- Weiss, D. J. Current status of stem cells and regenerative medicine in lung biology and diseases. Stem Cells. 32, 16-25 (2013).
- Ghaedi, M., et al. Human iPS cell-derived alveolar epithelium repopulates lung extracellular matrix. J Clin Invest. 123, 4950-4962 (2013).
- Ott, H. C., et al. Regeneration and orthotopic transplantation of a bioartificial lung. Nat Med. 16, 927-933 (2010).
- Petersen, T. H., et al. Tissue-engineered lungs for in vivo implantation. Science. 329, 538-541 (2010).
- Tuyl, M., et al. Angiogenic factors stimulate tubular branching morphogenesis of sonic hedgehog-deficient lungs. Dev Biol. 303, 514-526 (2007).
- Galambos, C., deMello, D. E. Molecular mechanisms of pulmonary vascular development. Pediatr Dev Pathol. 10, 1-17 (2007).
- McGrath-Morrow, S. A., et al. Vascular endothelial growth factor receptor 2 blockade disrupts postnatal lung development. Am J Respir Cell Mol Biol. 32, 420-427 (2005).
- White, A. C., Lavine, K. J., Ornitz, D. M. FGF9 and SHH regulate mesenchymal Vegfa expression and development of the pulmonary capillary network. Development. 134, 3743-3752 (2007).
- Zhao, L., Wang, K., Ferrara, N., Vu, T. H. Vascular endothelial growth factor co-ordinates proper development of lung epithelium and vasculature. Mech Dev. 122, 877-886 (2005).
- Stenmark, K. R., Abman, S. H. Lung vascular development: implications for the pathogenesis of bronchopulmonary dysplasia. Annu Rev Physiol. 67, 623-661 (2005).
- Mammoto, T., et al. LRP5 Regulates Development of Lung Microvessels and Alveoli through the Angiopoietin-Tie2 Pathway. PLoS ONE. 7, e41596(2012).
- Mammoto, T., Jiang, E., Jiang, A., Mammoto, A. ECM structure and tissue stiffness control postnatal lung development through the LRP5-Tie2 signaling system. American Journal of Respiratory Cell and Molecular Biology. 49, 1009-1018 (2013).
- Ding, B. S., et al. Endothelial-derived angiocrine signals induce and sustain regenerative lung alveolarization. Cell. 147, 539-553 (2011).
- Crivellato, E. The role of angiogenic growth factors in organogenesis. Int J Dev Biol. 55, 365-375 (2011).
- Sakurai, M. K., et al. Vascular endothelial growth factor accelerates compensatory lung growth after unilateral pneumonectomy. Am J Physiol Lung Cell Mol Physiol. 292, 742-747 (2007).
- Panigrahy, D., et al. Epoxyeicosanoids promote organ and tissue regeneration. Proc Natl Acad Sci U S A. 110, 13528-13533 (2013).
- Voelkel, N. F., Douglas, I. S., Nicolls, M. Angiogenesis in chronic lung disease. Chest. 131, 874-879 (2007).
- Hanumegowda, C., Farkas, L., Kolb, M. Angiogenesis in pulmonary fibrosis: too much or not enough. Chest. 142, 200-207 (2012).
- Levental, K. R., et al. Matrix crosslinking forces tumor progression by enhancing integrin signaling. Cell. 139, 891-906 (2009).
- Mammoto, A., Mammoto, T., Ingber, D. E. Mechanosensitive mechanisms in transcriptional regulation. J Cell Sci. 125, 3061-3073 (2012).
- Westermann, D., et al. Role of left ventricular stiffness in heart failure with normal ejection fraction. Circulation. 117, 2051-2060 (2008).
- Merchante, N., et al. Liver stiffness predicts clinical outcome in human immunodeficiency virus/hepatitis C virus-coinfected patients with compensated liver cirrhosis. Hepatology. 56, 228-238 (2012).
- Ding, B. S., et al. Inductive angiocrine signals from sinusoidal endothelium are required for liver regeneration. Nature. 468, 310-315 (2010).
- Fidler, I. J. Angiogenic heterogeneity: regulation of neoplastic angiogenesis by the organ microenvironment. J Natl Cancer Inst. 93, 1040-1041 (2001).
- Folkman, J. How is blood vessel growth regulated in normal and neoplastic tissue? G.H.A. Clowes memorial Award lecture. Cancer Res. 46, 467-473 (1986).
- Mammoto, A., et al. A mechanosensitive transcriptional mechanism that controls angiogenesis. Nature. 457, 1103-1108 (2009).
- Malinda, K. M. In vivo matrigel migration and angiogenesis assay. Methods Mol Biol. 467, 287-294 (2009).
- Norrby, K. In vivo models of angiogenesis. J Cell Mol Med. 10, 588-612 (2006).
- Mammoto, T., Jiang, A., Jiang, E., Mammoto, A. Platelet rich plasma extract promotes angiogenesis through the angiopoietin1-Tie2 pathway. Microvasc Res. 89, 15-24 (2013).
- Mosesson, M. W. Fibrinogen and fibrin structure and functions. J Thromb Haemost. 3, 1894-1904 (2005).
- Bensaid, W., et al. A biodegradable fibrin scaffold for mesenchymal stem cell transplantation. Biomaterials. 24, 2497-2502 (2003).
- Teichert-Kuliszewska, K., et al. Biological action of angiopoietin-2 in a fibrin matrix model of angiogenesis is associated with activation of Tie2. Cardiovasc Res. 49, 659-670 (2001).
- Lafleur, M. A., Handsley, M. M., Knauper, V., Murphy, G., Edwards, D. R. Endothelial tubulogenesis within fibrin gels specifically requires the activity of membrane-type-matrix metalloproteinases (MT-MMPs). J Cell Sci. 115, 3427-3438 (2002).
- Collen, A., et al. Aberrant fibrin formation and cross-linking of fibrinogen Nieuwegein, a variant with a shortened Aalpha-chain, alters endothelial capillary tube formation. Blood. 97, 973-980 (2001).
- Mammoto, T., et al. Mechanochemical Control of Mesenchymal Condensation and Embryonic Tooth Organ Formation. Dev Cell. 21, 758-769 (2011).
- Murphy, K. C., Leach, J. K. A reproducible, high throughput method for fabricating fibrin gels. BMC Res Notes. 5, 423(2012).
- Matar, A. F., Hill, J. G., Duncan, W., Orfanakis, N., Law, I. Use of biological glue to control pulmonary air leaks. Thorax. 45, 670-674 (1990).
- Thetter, O. Fibrin adhesive and its application in thoracic surgery. Thorac Cardiovasc Surg. 29, 290-292 (1981).
- Rahbarghazi, R., et al. Juxtacrine and paracrine interactions of rat marrow-derived mesenchymal stem cells, muscle-derived satellite cells, and neonatal cardiomyocytes with endothelial cells in angiogenesis dynamics. Stem Cells Dev. 22, 855-865 (2013).
- Nucera, S., Biziato, D., De Palma, M. The interplay between macrophages and angiogenesis in development, tissue injury and regeneration. Int J Dev Biol. 55, 495-503 (2011).
- Joensuu, K., et al. Interaction between marrow-derived human mesenchymal stem cells and peripheral blood mononuclear cells in endothelial cell differentiation. Scand J Surg. 100, 216-222 (2011).
- Takakura, N. Role of intimate interactions between endothelial cells and the surrounding accessory cells in the maturation of blood vessels. J Thromb Haemost. 9 Suppl 1, 144-150 (2011).
- Plantier, L., Boczkowski, J., Crestani, B. Defect of alveolar regeneration in pulmonary emphysema: role of lung fibroblasts. Int J Chron Obstruct Pulmon Dis. 2, 463-469 (2007).
- Belair, D. G., Murphy, W. L. Specific VEGF sequestering to biomaterials: influence of serum stability. Acta Biomater. 9, 8823-8831 (2013).
- Wong, C., Inman, E., Spaethe, R., Helgerson, S. Fibrin-based biomaterials to deliver human growth factors. Thromb Haemost. 89, 573-582 (2003).
- Stolzing, A., Colley, H., Scutt, A. Effect of age and diabetes on the response of mesenchymal progenitor cells to fibrin matrices. Int J Biomater. 2011, 378034(2011).
- Vailhe, B., Ronot, X., Tracqui, P., Usson, Y., Tranqui, L. In vitro angiogenesis is modulated by the mechanical properties of fibrin gels and is related to alpha(v)beta3 integrin localization. In Vitro Cell Dev Biol Anim. 33, 763-773 (1997).
- Kniazeva, E., Kachgal, S., Putnam, A. J. Effects of extracellular matrix density and mesenchymal stem cells on neovascularization in vivo. Tissue Eng Part A. 17, 905-914 (2011).
- Angio, C. T., Maniscalco, W. M. The role of vascular growth factors in hyperoxia-induced injury to the developing lung. Front Biosci. 7, 1609-1623 (2002).
- Kasahara, Y., et al. Inhibition of VEGF receptors causes lung cell apoptosis and emphysema. J Clin Invest. 106, 1311-1319 (2000).
- Owen, C. A. Roles for proteinases in the pathogenesis of chronic obstructive pulmonary disease. Int J Chron Obstruct Pulmon Dis. 3, 253-268 (2008).
- Demedts, I. K., et al. Elevated MMP-12 protein levels in induced sputum from patients with COPD. Thorax. 61, 196-201 (2006).
- Haq, I., et al. Association of MMP-2 polymorphisms with severe and very severe COPD: a case control study of MMPs-1, 9 and 12 in a European population. BMC Med Genet. 11, 7(2010).
- Mercer, P. F., et al. MMP-9, TIMP-1 and inflammatory cells in sputum from COPD patients during exacerbation. Respir Res. 6, 151(2005).
- Matute-Bello, G., et al. Essential role of MMP-12 in Fas-induced lung fibrosis. Am J Respir Cell Mol Biol. 37, 210-221 (2007).
- Sivakumar, P., Gupta, S., Sarkar, S., Sen, S. Upregulation of lysyl oxidase and MMPs during cardiac remodeling in human dilated cardiomyopathy. Mol Cell Biochem. 307, 159-167 (2008).
- Gomperts, B. N., Strieter, R. M. Stem cells and chronic lung disease. Annu Rev Med. 58, 285-298 (2007).
- Lau, A. N., Goodwin, M., Kim, C. F., Weiss, D. J. Stem cells and regenerative medicine in lung biology and diseases. Mol Ther. 20, 1116-1130 (2012).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten