Method Article
El implante de gel de fibrina en pulmón de ratón para el Estudio de la angiogénesis pulmón específico
En este artículo
Resumen
Recapitulation of the organ-specific microenvironment, which stimulates local angiogenesis, is indispensable for successful regeneration of damaged tissues. This report demonstrates a novel method to implant fibrin gels on the lung surface of living mouse in order to explore how the lung-specific microenvironment modulates angiogenesis and alveolar regeneration in adult mouse.
Resumen
Los recientes avances significativos en las técnicas de investigación de células madre y de bioingeniería han hecho grandes progresos en la utilización de biomateriales para regenerar y reparar daños en los tejidos simples en los campos de ortopedia y periodontales. Sin embargo, los intentos para regenerar las estructuras y funciones de los órganos (3D) más complejos tridimensionales tales como pulmones no han tenido mucho éxito debido a que los procesos biológicos de la regeneración de órganos no han sido bien explorados. Se está haciendo evidente que la angiogénesis, la formación de nuevos vasos sanguíneos, desempeña un papel clave en la regeneración de órganos. Recién formado vasculatures no sólo entregar el oxígeno, nutrientes y diversos componentes celulares que se requieren para la regeneración de órganos, pero también proporcionan señales instructivas para la regeneración de los tejidos locales. Por lo tanto, para regenerar con éxito pulmones en un adulto, es necesario recapitular los microambientes-pulmón específico en el que la angiogénesis unidades de regeneración de los tejidos pulmonares locales. Aunque conventional in vivo ensayos de angiogénesis, tales como la implantación subcutánea de la matriz extracelular (ECM) ricos en hidrogeles (por ejemplo, fibrina o colágeno o geles de Matrigel - mezcla de proteínas ECM secretada por las células del sarcoma de Engelbreth-Holm-Swarm ratón), se utilizan ampliamente para explorar la mecanismos generales de la angiogénesis, la angiogénesis pulmonar específica no ha sido bien caracterizado porque los métodos para la implantación ortotópica de los biomateriales en el pulmón no han sido bien establecidos. El objetivo de este protocolo es introducir un método único para implante de gel de fibrina en la superficie de pulmón de vivir ratón adulto, lo que permite la recapitulación exitosa de anfitrión angiogénesis pulmonar derivado en el interior del gel. Este enfoque permite a los investigadores a explorar los mecanismos por los que el microambiente-pulmonar específica controla la angiogénesis y la regeneración alveolar en condiciones normales y patológicas. Desde el lanzamiento biomateriales implantados y suministrar señales físicas y químicas a l adyacentetejidos ung, la implantación de estos biomateriales en pulmón enfermo potencialmente pueden normalizar los tejidos enfermos adyacentes, permitiendo a los investigadores a desarrollar nuevos enfoques terapéuticos para varios tipos de enfermedades pulmonares.
Introducción
El objetivo general de este protocolo es la introducción de un método para implantar gel de fibrina en la superficie del pulmón de ratón adulto, que permite a los investigadores caracterizar los mecanismos moleculares de vascular pulmonar y el desarrollo alveolar y aprovechar este conocimiento para desarrollar materiales biomiméticos capaz de recapitular vascular pulmonar fisiológica y la formación alveolar para tratar diversas enfermedades pulmonares.
Más de 35 millones de estadounidenses sufren de enfermedades pulmonares crónicas, como la enfermedad pulmonar obstructiva crónica y fibrosis pulmonar. Estos pacientes tienen síntomas de larga duración crónicas respiratorias como dificultad para respirar, opresión en el pecho, tos persistente y cansancio, que deterioran significativamente su vida diaria 1-3. A pesar de una gran cantidad de esfuerzo para desarrollar terapias eficaces para estas enfermedades de los pulmones, en la actualidad no existe una cura; Por lo tanto, la calidad de vida de estos pacientes es pobre y económica y los costos humanos son high 4-7. En la actualidad, el trasplante de pulmón es la única manera de salvar a los pacientes con enfermedades pulmonares crónicas en fase terminal. Sin embargo, debido a la escasez de donantes de trasplante, de alto costo, complicaciones graves, y la baja tasa de supervivencia 8-11, el trasplante no es un enfoque óptimo. Rápidos progresos recientes en las técnicas de ingeniería de tejidos ha permitido a los investigadores bioingeniería pulmón implantable por repoblar descelularizado pulmonar completo con varios tipos de células progenitoras o células madre pluripotentes inducidas (iPS) células 12,13. Sin embargo, estos pulmones bioingeniería son funcionales en animales huéspedes sólo durante varias horas después 12,14,15 implantación. Utilizando biomateriales para regenerar las complejas estructuras y funciones de los pulmones ha sido también bastante éxito. Esto puede deberse a que los procesos biológicos fundamentales que rigen la regeneración pulmonar de adultos no han sido bien explorado. En el pulmón, la formación del sistema vascular es uno de los acontecimientos más tempranos y más importantes duriel desarrollo y la regeneración 16-21 ng. Vasculaturas recién formado en el pulmón no sólo entregar oxígeno, nutrientes y diversos componentes celulares necesarios para la formación de órganos, sino que también proporcionan señales reguladoras instructivos a las células circundantes 22-25. Por lo tanto, la angiogénesis juega un papel clave en alveolarization regenerativa en pulmones adultos 24,26,27. Además, la angiogénesis desregulada contribuye a enfermedades pulmonares crónicas, como la enfermedad pulmonar obstructiva crónica (EPOC) 28, la displasia broncopulmonar (DBP) 21-23, y fibrosis pulmonar 29. Por lo tanto, para desarrollar estrategias más eficientes para la ingeniería de los pulmones o el tratamiento de enfermedades pulmonares crónicas, es necesario comprender los mecanismos fundamentales de la angiogénesis pulmonar específica.
Cada órgano muestra las propiedades mecánicas y químicas únicas, que pueden diferir entre las condiciones fisiológicas y patológicas 30-33. Estos microenviron órgano-específicamentos regulan los comportamientos de las células endoteliales y orquestan formación de la red vascular de una manera específica de órgano 24,34-36. Por lo tanto, para desarrollar estrategias más eficientes para la regeneración de pulmón, el mecanismo subyacente a la angiogénesis pulmonar específica necesita ser entendido. Mientras ensayos de angiogénesis in vivo convencionales tales como la implantación subcutánea de hidrogel se han utilizado ampliamente para la investigación de la angiogénesis 37-39, esos métodos no recapitulan la angiogénesis específico de órgano. Recientemente, un nuevo método para implantar Matrigel en un molde elástico en el pulmón de ratón ha sido desarrollado y demostrado con éxito para reclutar vasos sanguíneos y células epiteliales del pulmón en los geles 22. Este enfoque único permitirá a los investigadores explorar el mecanismo de la angiogénesis-pulmón específico, así como las interacciones entre los vasos sanguíneos y las células pulmonares no vasculares en condiciones fisiológicas y patológicas. Desde 1) Matrigel no es adecuado para la aplicación clínica; 2) el correomolde lastic utilizado para lanzar el gel puede afectar a las interacciones entre los hidrogeles y tejido pulmonar anfitrión y 3) el molde elástico en el pulmón potencialmente causa un deterioro de la función pulmonar y el dolor durante la respiración, como un enfoque más clínicamente relevante, una matriz de fibrina 3D que contiene factores angiogénicos (factor de crecimiento endotelial vascular (VEGF) / factor de crecimiento de fibroblastos básico (bFGF)) ha sido implantado en el pulmón de ratón sin poner en el molde elástico, y se ha recapitulado éxito anfitrión angiogénesis pulmonar derivados. Gel de fibrina, fibrillas de polímeros generados a partir de fibrinógeno escindido por trombina, es conocido para atrapar una variedad de factores angiogénicos como bFGF y VEGF para acelerar la angiogénesis in vivo 40,41. Debido a su capacidad regenerativa y la naturaleza biodegradable 42, gel de fibrina se utiliza ampliamente en el campo de la ingeniería de tejidos.
Este artículo presenta un enfoque novedoso y único para implante de gel de fibrina en la superficie pulmonar de adult vivirt ratón y demuestra que anfitrión angiogénesis pulmonar derivado se recapitula el interior de los geles en vivo. Este método, que permite a los investigadores estudiar la angiogénesis pulmonar específica, es probable que conduzca al desarrollo de nuevos enfoques terapéuticos para varios tipos de enfermedades pulmonares y avanzar significativamente los esfuerzos para regenerar con éxito pulmón adulto.
Protocolo
NOTA: El estudio in vivo en animales se llevó a cabo en estricta conformidad con las recomendaciones de la Guía para el Cuidado y Uso de Animales de Laboratorio de los Institutos Nacionales de Salud. El protocolo fue revisado y aprobado por el Comité de Cuidado de Animales y el empleo del Hospital Infantil de Boston (Números de Protocolo: 13-10-2526R, 14-02-2568R). Todos los fármacos utilizados en este protocolo son de grado farmacéutico y estos medicamentos se preparan en condiciones estériles.
1. Preparación del gel de fibrina
- Preparar gel de fibrina que contiene VEGF y bFGF.
- Descongelar las soluciones madre de fibrinógeno y trombina que se almacenan a -80 ° C hasta la temperatura ambiente (25 ° C).
- Añadir la trombina (concentración final: 2,5 U / ml), CaCl 2 (concentración final: 45 mM), VEGF (concentración final: 0-100 ng / ml) y bFGF (concentración final: 0-100 ng / ml) a la fibrinógeno solución (concentración final: 12,5 mg / ml en 0,9% sodium solución de cloruro 43-45) en un tubo de 1,5 ml.
- Mezclar suavemente con la pipeta.
- Pipetear suavemente 200 l de la mezcla en un plato de plástico estéril de una forma gota a gota utilizando puntas de pipeta p200.
- Incubar las gotas a 37 ° C durante 30-60 minutos hasta que se solidifican.
NOTA: El gel solidificado se puede mantener en el plato de plástico sellada a temperatura ambiente (25 ° C) durante varias horas antes de la implantación (Figura 1a).
- Recorte el gel de fibrina en aproximadamente 3 x 3 x 3 cubos mm utilizando pequeñas tijeras quirúrgicas antes de la implantación.
2. Preparación del ratón
- Anestesie ratón adulto (8-12 semanas) mediante inyección intraperitoneal (IP) de inyección de ketamina (100 mg / kg) y xilazina (10 mg / kg) y confirmar que el ratón se anestesia adecuadamente por pellizcos del dedo del pie del ratón.
- Use ungüento veterinario en los ojos del ratón para evitar la sequedad durante el experimento.
- Fu Shaver sobre el lado izquierdo de la caja torácica del ratón.
- Realizar intubación endotraqueal del ratón.
- Coloque el ratón en la intubación de pie en ángulo de 70 ° y mantenga pulsado el ratón en lugar enganchando sus incisivos superiores sobre una banda pequeña de goma situado en la parte superior del soporte.
- Retraer la lengua suavemente a un lado el uso de fórceps romos.
- Visualizar la laringe con la ayuda de un microscopio de cuello de cisne iluminador de fibra óptica.
- Insertar catéter endotraqueal elástico (21 G) en la tráquea.
- Confirme que el ratón está respirando espontáneamente de una manera suave (regular 100-150 respiraciones / min, sin respiración paradójica o superficial).
- Coloca el ratón en posición prona con el microscopio de disección.
- Mecánicamente ventilar el ratón usando un ventilador de roedores (150 respiraciones / min y 7 ml / kg de volumen corriente).
- Cuente costillas para localizar el espacio intercostal entre el 4 y 5 de la costilla.
- Crear un campo estéril sobre el área by limpiar a fondo con alcohol y povidona-yodo. Cubra el campo quirúrgico adecuadamente con un paño quirúrgico estéril.
3. Ratón Cirugía
- Después de la inyección local de bupivacaína al 0,25% (200 l) en la piel, hacer una incisión en la piel transversal (aproximadamente 1 cm de longitud) sobre el espacio intercostal usando tijeras de disección.
- Después de la inyección de bupivacaína al 0,25% (200 l) en el músculo intercostal, hacer una incisión músculo entre el 4 ° y 5 ° costilla utilizando finas tijeras pequeñas.
- Insertar un retractor de disección entre las costillas para visualizar completamente el pulmón izquierdo.
- Raspe un área pequeña (1 x 1 mm cuadrado) de la pleura visceral del centro del pulmón izquierdo utilizando unas pinzas finas.
- Aplique una leve presión sobre el área con un hisopo de algodón estéril hasta que el sangrado y fugas de aire están completamente controlados.
- Ponga una pequeña cantidad de mezcla fresca de fibrinógeno / trombina (cola de fibrina) (paso 1.1.2. 20 & #181; l) sobre la zona usando punta de la pipeta p200.
- Con cuidado, coloque un gel de fibrina (paso 1.2) usando unas pequeñas pinzas sobre el área (Figura 1b).
- Confirmar que el gel está bien fijada en la zona durante los movimientos respiratorios del pulmón.
- Asegúrese de que no hay ni fugas de aire masiva ni hemorragia del pulmón.
- Cerrar incisiones (capas musculares y de la piel) con sutura absorbible, que no tienen que ser eliminados.
- Aspirar la cavidad torácica usando 27 G aguja y jeringa de 1 ml para prevenir el neumotórax.
- Terminar la ventilación mecánica.
4. Recuperación Ratón
- Asegúrese de que el ratón está respirando espontáneamente de una manera suave (regular 100-150 respiraciones / min, sin respiración paradójica o superficial).
- IP inyectar 1 ml de pre-calentado 0,9% de NaCl para evitar la deshidratación.
- Deje que el ratón para recuperar en la plataforma de agua caliente que circula.
- Retire la endotracheal tubo después de confirmar que el ratón tiene respiración estable.
- Inyectar Meloxicam (5 mg / kg, inyección subcutánea (SC), durante 3 días como analgésico postoperatorio.
- Vigilar los movimientos del ratón cuidadosamente en un mínimo de intervalos de 15 min hasta que es esternal (capaz de rodar sobre su estómago y permanecen en posición vertical) y consciente.
- Después de la recuperación, devuelva el ratón a una nueva jaula aislada de ratones sin necesidad de cirugía.
- Supervisar el sitio quirúrgico para detectar signos de infección (enrojecimiento, inflamación, secreción), funciones biológicas básicas de animales (alimentos y la ingesta de agua, micción, defecación, aumento de peso corporal), así como los signos clínicos de dificultad (piloerección, locomoción reducida) al día siguiente a la procedimiento quirúrgico.
5. La recolección del pulmón
- 7 a 30 días después de la implantación, la eutanasia el ratón usando CO 2 a través de fuente de gas comprimido.
- Hacer una incisión entre la punta del apéndice xifoides y el esternónmuesca (esternotomía mediana) y toda la cosecha de pulmón con el gel implantado para el análisis histológico y bioquímico mediante la reducción de la tráquea y la disección de todas las conexiones al corazón, los pulmones y la tráquea.
- Fijar gel implantado con pulmón con una solución de paraformaldehído al 4% durante la noche a 4 ºC, incrustar en compuesto OCT, y tomar las secciones de paso de serie de 30 micras de espesor.
- Realizar histológico (hematoxilina y eosina) y los análisis inmunohistoquímicos (marcador endotelial: CD31, marcador epitelial: proteínas acuaporina (AQP) 5 y surfactante (SP) -B) usando el microscopio confocal 22,37,40.
- Compilar pilas de secciones ópticas (30 m de espesor) para formar imágenes tridimensionales de endotelial de pulmón y las células epiteliales de la imagen 3D utilizando el software de análisis 37.
- Cuantificar áreas proyectadas de los vasos sanguíneos de nueva formación con software de análisis 46.
Resultados
Para examinar si la formación vascular anfitrión de pulmón derivado se recapitula en el interior de los biomateriales implantados en el pulmón, geles de fibrina complementan con gran factores angiogénicos VEGF y bFGF (0, 10 y 100 ng / ml cada uno) fueron implantados en la superficie de la que viven los pulmones del ratón como informó utilizando Matrigel 22. Los geles de fibrina 47 que contienen estos factores de crecimiento angiogénicos se fabricaron como se muestra en la Figura 1a. Después de la toracotomía, una pequeña área de la superficie del pulmón izquierdo se raspó usando fórceps y el gel de fibrina fabricado se implantó en el pulmón del ratón adulto usando una pequeña cantidad de pegamento de fibrina, que es aprobado por la FDA y ampliamente utilizado como un sellante eficaz para detener fugas de aire y reducir el sangrado en cirugía pulmonar 48,49 (Figura 1b). La mayoría de los ratones se recuperaron sin síntomas respiratorios graves (por ejemplo, neumotórax, dificultad respiratoria). Siete días después de la implantación, los ratones fueron sacrificados y los pulmones eran harvested. Gel de fibrina implantado se incorporó en el pulmón de acogida 7 días después de la implantación (Figura 1c). Reconstrucción 3D de imágenes de fluorescencia confocal ha demostrado que las células endoteliales CD31-positivas derivadas del huésped formadas redes vasculares dentro de los geles de 7 días después de la implantación de una manera dependiente de la dosis de VEGF / bFGF (figura 2a, c). Tipo I (AQP5 positivo) y tipo II (SP-B positivo) células epiteliales del pulmón también fueron reclutados largo de los vasos sanguíneos recién formados dentro de los geles que fueron suplementados con mayores concentraciones de VEGF y bFGF (cada uno de 100 ng / ml) (Figura 2a) . Tinción H & E de secciones histológicas reveló que otros tipos de células huésped también migran en el gel de 7 días después de la implantación (Figura 2b). Estos hallazgos sugieren que anfitrionas redes vasculares pulmonares regenerativas derivadas de éxito se construyen dentro de los geles de fibrina que se complementan con factores angiogénicos y se implanta en la superficie de mou adultoSE pulmón.
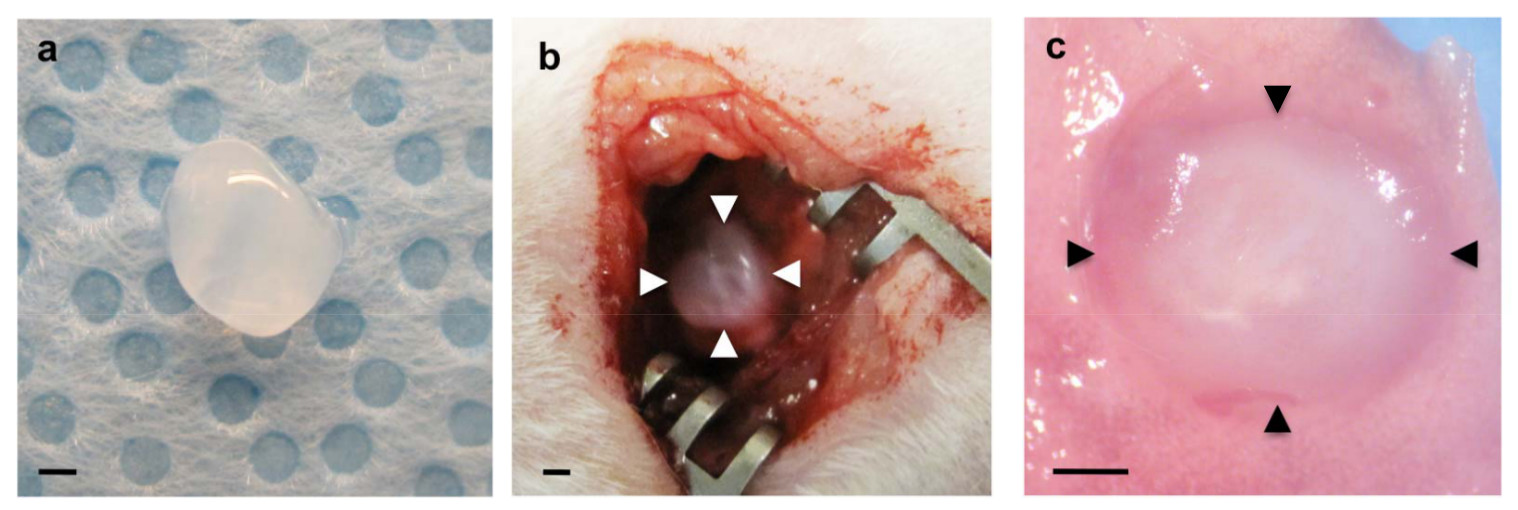
Figura 1:. (A) de gel de fibrina preparado antes de la implantación (b) gel de fibrina implantado sobre la pleura visceral raspado del pulmón izquierdo (puntas de flecha) (c) Implantado gel de fibrina (puntas de flecha) incorporado en el pulmón de acogida 7 días después de la implantación.. Las barras de escala 1 mm.
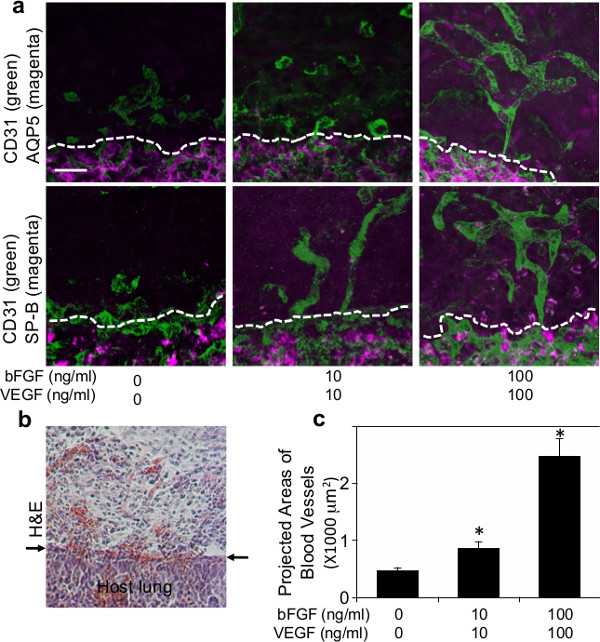
Figura 2: (a) micrografías de fluorescencia que muestra la formación de las redes vasculares (CD31 positivo; verde) y tipo reclutado I (AQP5-positiva; magenta) o tipo II (SP-B positivo; magenta) células epiteliales del pulmón dentro del gel de fibrina complementados con diversas concentraciones de VEGF y bFGF (0, 10 y 100 ng / ml cada uno) 7 días después de la implantación. Las líneas discontinuas indican la interfaz entre el gel de fibrina implantado y de pulmón host. Barra de escala:. 20 micras (b) Microfotografía de luz de la tinción de H & E mostrando infiltración de células huésped en el gel de fibrina 7 días después de la implantación. Las flechas indican la interfaz entre el gel y el pulmón host. Barra de escala: 20 m (c) Gráfico que muestra las áreas proyectadas de los vasos sanguíneos de nueva formación en los geles de fibrina que se complementan con diversas concentraciones de VEGF y bFGF (0, 10 y 100 ng / ml cada uno) 7 días después de la implantación..
Discusión
Este artículo presenta un nuevo método para implantar biomateriales en la superficie de pulmón de vida del ratón adulto. Con este sistema, la angiogénesis derivada de pulmón de acogida se recapitula con éxito dentro del material. Este sistema permite a los investigadores a explorar la diafonía entre las células endoteliales, otras células (por ejemplo, células epiteliales, células mesenquimales, células inmunes) y diversos componentes de ECM que son necesarios para la angiogénesis local de 50-53 y regeneración alveolar 24,54. Aunque la implantación subcutánea de hidrogel convencional in vivo se ha utilizado ampliamente para la investigación de la angiogénesis 37-39, esos métodos no recapitulan la angiogénesis específico de órgano. Este sistema, en el que hidrogel se implanta directamente en la superficie del pulmón, permitirá a los investigadores a explorar los roles del microambiente pulmonar específica en la angiogénesis y la regeneración alveolar en pulmón de ratón adulto. Estos geles pueden ser fabricados de diversos BIOMATE ECM-ricariales (por ejemplo, colágenos, fibrinas) que se pueden complementar con diversos factores químicos (por ejemplo, factores angiogénicos, factores de crecimiento) 55,56, células progenitoras y / o células iPS. Además de los factores químicos, fuerzas mecánicas también controlan la angiogénesis 23,37. La rigidez de los cambios de gel de fibrina en un fibrinógeno de manera dependiente de la concentración 57 y la manipulación de la concentración de fibrinógeno puede afectar la angiogénesis no sólo a través de señales químicas, sino también a través de señales físicas 58,59. Por lo tanto, las propiedades fisicoquímicas de los geles de fibrina pueden necesitar ser optimizado cuidadosamente para recapitular la angiogénesis fisiológica específica de órgano en el futuro. La curación de heridas después de raspar la pleura visceral también produce un coágulo de fibrina endógena, que incluye varios tipos de células huésped y promueve el proceso de curación y regeneración de tejidos. Este coágulo natural puede interactuar con el gel de fibrina exógenamente implantado, y por lo tanto controlar angiogénesis en el gel implantado. Fluorescently fibrinógeno marcado puede permitir a los investigadores distinguir entre coágulo de fibrina natural y gel de fibrina implantado y explorar estos mecanismos. Aunque este es un poderoso método para caracterizar la angiogénesis en los pulmones del ratón adulto, la aplicación para el estudio del desarrollo de pulmón y enfermedades en ratones recién nacidos probablemente presentan desafíos técnicos.
El objetivo final de este estudio es reclutar vasos sanguíneos funcionales en geles de fibrina implantados en pulmones enfermos y de utilizar la matriz como un dispositivo médico para restaurar las estructuras funcionales de pulmón. Posibles comunicaciones entre las células huésped y el vascular y estructuras alveolares dentro de los geles así como la funcionalidad de estas estructuras deben explorarse en futuros experimentos. Dado que los niveles de VEGF en los pulmones están disminuidos en pacientes con TLP 60 y el enfisema 61, añadiendo VEGF a la matriz puede mejorar el reclutamiento de los vasos sanguíneos en los impl matrizrealizado una apuesta inicial en estos pulmones enfermos. Propiedades mecánicas también difieren entre los pulmones sanos y enfermos 23,62. Por ejemplo, la expresión de metaloproteinasas de la matriz y la lisil oxidasa, que controlan la degradación y reticulación de los colágenos, respectivamente, se altera en diversas enfermedades pulmonares incluyendo EPOC y fibrosis pulmonar 63-67. En pulmones enfermos, ciertos linajes de células progenitoras endoteliales de pulmón y células epiteliales se agotan 68. Por lo tanto, la manipulación de estos factores (factores angiogénicos, ECMs, ECM) de rigidez o implantar geles de fibrina complementados con células progenitoras 69 es probable que conduzca a la formación de vasos sanguíneos funcionales dentro de la matriz y la recuperación de la función pulmonar en varias condiciones patológicas. Dado que los factores químicos pueden complementarse dentro de los geles de fibrina para modular la angiogénesis local, este sistema también se puede utilizar explorar señales ambientales específicas que pueden normalizar pulmones enfermos en enfermedades pulmonares crónicas.
En resumen, este artículo presenta un método para implante de hidrogel de fibrina en la superficie de pulmón de ratón vivo, que permite a los investigadores caracterizar la angiogénesis pulmonar específica in vivo. Modificación de diversos factores (por ejemplo, transcurso del tiempo, las concentraciones y combinaciones de factores angiogénicos, varios tipos de hidrogeles, propiedades fisicoquímicas de hidrogeles) en este sistema, dará a conocer los mecanismos de la angiogénesis y la regeneración en el pulmón. Por lo tanto, este sistema avanzará significativamente el conocimiento científico de la biología vascular básica, ingeniería de tejidos, así como la medicina pulmonar.
Divulgaciones
The authors declare that they have no competing financial interests.
Agradecimientos
Este trabajo fue apoyado por fondos de la American Heart Association (AM), el Departamento de Defensa de Estados Unidos (BC074986) y del Hospital Infantil de Boston Facultad beca Desarrollo Profesional (TM, AM). Los autores agradecen a Amanda Jiang y Jiang Elisabeth para la asistencia técnica.
Materiales
| Name | Company | Catalog Number | Comments |
| Fibrinogen from human placenta | Sigma | F4883 | For fabrication of fibrin gel |
| Thrombin from bovine plasma | Sigma | T9549 | For fabrication of fibrin gel |
| Recombinant mouse VEGF 164 | R&D | 493-MV | For supplementation to fibrin gel |
| Recombinant mouse bFGF | R&D | 3139-FB | For supplementation to fibrin gel |
| Rodent Intubation Stand | Braintree Scientific INC | RIS 100 | For intubation |
| Fiber-Optic Light Source | Fisher Scientific | 12-565-35 | For intubation |
| 21 G Elastic catheter | B.Braun | 4251652-02 | For intubation |
| MiniVent Ventilator | Harvard Apparatus | CGS-8009 | For ventilation |
| Stemi DV4 Steromicroscope | Fisher Scientific | 12-070-515 | For surgey |
| Absobable suture | Ethicon | PDP304 | Surgical suture |
| Antibody against CD31 | BD Biosciences | 553370 | Immunohistochemistry |
| Antibody against AQP5 | Abcam | AB78486 | Immunohistochemistry |
| Antibody against SP-B | Abcam | AB40876 | Immunohistochemistry |
Referencias
- Donaldson, G. C., Seemungal, T. A., Bhowmik, A., Wedzicha, J. A. Relationship between exacerbation frequency and lung function decline in chronic obstructive pulmonary disease. Thorax. 57, 847-852 (2002).
- Lopez-Campos, J. L., Calero, C., Quintana-Gallego, E. Symptom variability in COPD: a narrative review. Int J Chron Obstruct Pulmon Dis. 8, 231-238 (2013).
- Ley, B., Collard, H. R., King, T. E. Clinical course and prediction of survival in idiopathic pulmonary fibrosis. Am J Respir Crit Care Med. 183, 431-440 (2011).
- Ferrer, M., et al. Chronic obstructive pulmonary disease stage and health-related quality of life. The Quality of Life of Chronic Obstructive Pulmonary Disease Study Group. Ann Intern Med. 127, 1072-1079 (1997).
- Reardon, J. Z., Lareau, S. C., ZuWallack, R. Functional status and quality of life in chronic obstructive pulmonary disease. Am J Med. 119, 32-37 (2006).
- De Vries, J., Kessels, B. L., Drent, M. Quality of life of idiopathic pulmonary fibrosis patients. Eur Respir J. 17, 954-961 (2001).
- Sullivan, S. D., Ramsey, S. D., Lee, T. A. The economic burden of COPD. Chest. 117, 5S-9S (2000).
- Orens, J. B., Garrity, E. R. General overview of lung transplantation and review of organ allocation. Proc Am Thorac Soc. 6, 13-19 (2009).
- Benden, C. Specific aspects of children and adolescents undergoing lung transplantation. Curr Opin Organ Transplant. 17, 509-514 (2012).
- Lyu, D. M., Zamora, M. R. Medical complications of lung transplantation. Proc Am Thorac Soc. 6, 101-107 (2009).
- Trulock, E. P., et al. Registry of the International Society for Heart and Lung Transplantation: twenty-fourth official adult lung and heart-lung transplantation report-2007. J Heart Lung Transplant. 26, 782-795 (2007).
- Weiss, D. J. Current status of stem cells and regenerative medicine in lung biology and diseases. Stem Cells. 32, 16-25 (2013).
- Ghaedi, M., et al. Human iPS cell-derived alveolar epithelium repopulates lung extracellular matrix. J Clin Invest. 123, 4950-4962 (2013).
- Ott, H. C., et al. Regeneration and orthotopic transplantation of a bioartificial lung. Nat Med. 16, 927-933 (2010).
- Petersen, T. H., et al. Tissue-engineered lungs for in vivo implantation. Science. 329, 538-541 (2010).
- Tuyl, M., et al. Angiogenic factors stimulate tubular branching morphogenesis of sonic hedgehog-deficient lungs. Dev Biol. 303, 514-526 (2007).
- Galambos, C., deMello, D. E. Molecular mechanisms of pulmonary vascular development. Pediatr Dev Pathol. 10, 1-17 (2007).
- McGrath-Morrow, S. A., et al. Vascular endothelial growth factor receptor 2 blockade disrupts postnatal lung development. Am J Respir Cell Mol Biol. 32, 420-427 (2005).
- White, A. C., Lavine, K. J., Ornitz, D. M. FGF9 and SHH regulate mesenchymal Vegfa expression and development of the pulmonary capillary network. Development. 134, 3743-3752 (2007).
- Zhao, L., Wang, K., Ferrara, N., Vu, T. H. Vascular endothelial growth factor co-ordinates proper development of lung epithelium and vasculature. Mech Dev. 122, 877-886 (2005).
- Stenmark, K. R., Abman, S. H. Lung vascular development: implications for the pathogenesis of bronchopulmonary dysplasia. Annu Rev Physiol. 67, 623-661 (2005).
- Mammoto, T., et al. LRP5 Regulates Development of Lung Microvessels and Alveoli through the Angiopoietin-Tie2 Pathway. PLoS ONE. 7, e41596(2012).
- Mammoto, T., Jiang, E., Jiang, A., Mammoto, A. ECM structure and tissue stiffness control postnatal lung development through the LRP5-Tie2 signaling system. American Journal of Respiratory Cell and Molecular Biology. 49, 1009-1018 (2013).
- Ding, B. S., et al. Endothelial-derived angiocrine signals induce and sustain regenerative lung alveolarization. Cell. 147, 539-553 (2011).
- Crivellato, E. The role of angiogenic growth factors in organogenesis. Int J Dev Biol. 55, 365-375 (2011).
- Sakurai, M. K., et al. Vascular endothelial growth factor accelerates compensatory lung growth after unilateral pneumonectomy. Am J Physiol Lung Cell Mol Physiol. 292, 742-747 (2007).
- Panigrahy, D., et al. Epoxyeicosanoids promote organ and tissue regeneration. Proc Natl Acad Sci U S A. 110, 13528-13533 (2013).
- Voelkel, N. F., Douglas, I. S., Nicolls, M. Angiogenesis in chronic lung disease. Chest. 131, 874-879 (2007).
- Hanumegowda, C., Farkas, L., Kolb, M. Angiogenesis in pulmonary fibrosis: too much or not enough. Chest. 142, 200-207 (2012).
- Levental, K. R., et al. Matrix crosslinking forces tumor progression by enhancing integrin signaling. Cell. 139, 891-906 (2009).
- Mammoto, A., Mammoto, T., Ingber, D. E. Mechanosensitive mechanisms in transcriptional regulation. J Cell Sci. 125, 3061-3073 (2012).
- Westermann, D., et al. Role of left ventricular stiffness in heart failure with normal ejection fraction. Circulation. 117, 2051-2060 (2008).
- Merchante, N., et al. Liver stiffness predicts clinical outcome in human immunodeficiency virus/hepatitis C virus-coinfected patients with compensated liver cirrhosis. Hepatology. 56, 228-238 (2012).
- Ding, B. S., et al. Inductive angiocrine signals from sinusoidal endothelium are required for liver regeneration. Nature. 468, 310-315 (2010).
- Fidler, I. J. Angiogenic heterogeneity: regulation of neoplastic angiogenesis by the organ microenvironment. J Natl Cancer Inst. 93, 1040-1041 (2001).
- Folkman, J. How is blood vessel growth regulated in normal and neoplastic tissue? G.H.A. Clowes memorial Award lecture. Cancer Res. 46, 467-473 (1986).
- Mammoto, A., et al. A mechanosensitive transcriptional mechanism that controls angiogenesis. Nature. 457, 1103-1108 (2009).
- Malinda, K. M. In vivo matrigel migration and angiogenesis assay. Methods Mol Biol. 467, 287-294 (2009).
- Norrby, K. In vivo models of angiogenesis. J Cell Mol Med. 10, 588-612 (2006).
- Mammoto, T., Jiang, A., Jiang, E., Mammoto, A. Platelet rich plasma extract promotes angiogenesis through the angiopoietin1-Tie2 pathway. Microvasc Res. 89, 15-24 (2013).
- Mosesson, M. W. Fibrinogen and fibrin structure and functions. J Thromb Haemost. 3, 1894-1904 (2005).
- Bensaid, W., et al. A biodegradable fibrin scaffold for mesenchymal stem cell transplantation. Biomaterials. 24, 2497-2502 (2003).
- Teichert-Kuliszewska, K., et al. Biological action of angiopoietin-2 in a fibrin matrix model of angiogenesis is associated with activation of Tie2. Cardiovasc Res. 49, 659-670 (2001).
- Lafleur, M. A., Handsley, M. M., Knauper, V., Murphy, G., Edwards, D. R. Endothelial tubulogenesis within fibrin gels specifically requires the activity of membrane-type-matrix metalloproteinases (MT-MMPs). J Cell Sci. 115, 3427-3438 (2002).
- Collen, A., et al. Aberrant fibrin formation and cross-linking of fibrinogen Nieuwegein, a variant with a shortened Aalpha-chain, alters endothelial capillary tube formation. Blood. 97, 973-980 (2001).
- Mammoto, T., et al. Mechanochemical Control of Mesenchymal Condensation and Embryonic Tooth Organ Formation. Dev Cell. 21, 758-769 (2011).
- Murphy, K. C., Leach, J. K. A reproducible, high throughput method for fabricating fibrin gels. BMC Res Notes. 5, 423(2012).
- Matar, A. F., Hill, J. G., Duncan, W., Orfanakis, N., Law, I. Use of biological glue to control pulmonary air leaks. Thorax. 45, 670-674 (1990).
- Thetter, O. Fibrin adhesive and its application in thoracic surgery. Thorac Cardiovasc Surg. 29, 290-292 (1981).
- Rahbarghazi, R., et al. Juxtacrine and paracrine interactions of rat marrow-derived mesenchymal stem cells, muscle-derived satellite cells, and neonatal cardiomyocytes with endothelial cells in angiogenesis dynamics. Stem Cells Dev. 22, 855-865 (2013).
- Nucera, S., Biziato, D., De Palma, M. The interplay between macrophages and angiogenesis in development, tissue injury and regeneration. Int J Dev Biol. 55, 495-503 (2011).
- Joensuu, K., et al. Interaction between marrow-derived human mesenchymal stem cells and peripheral blood mononuclear cells in endothelial cell differentiation. Scand J Surg. 100, 216-222 (2011).
- Takakura, N. Role of intimate interactions between endothelial cells and the surrounding accessory cells in the maturation of blood vessels. J Thromb Haemost. 9 Suppl 1, 144-150 (2011).
- Plantier, L., Boczkowski, J., Crestani, B. Defect of alveolar regeneration in pulmonary emphysema: role of lung fibroblasts. Int J Chron Obstruct Pulmon Dis. 2, 463-469 (2007).
- Belair, D. G., Murphy, W. L. Specific VEGF sequestering to biomaterials: influence of serum stability. Acta Biomater. 9, 8823-8831 (2013).
- Wong, C., Inman, E., Spaethe, R., Helgerson, S. Fibrin-based biomaterials to deliver human growth factors. Thromb Haemost. 89, 573-582 (2003).
- Stolzing, A., Colley, H., Scutt, A. Effect of age and diabetes on the response of mesenchymal progenitor cells to fibrin matrices. Int J Biomater. 2011, 378034(2011).
- Vailhe, B., Ronot, X., Tracqui, P., Usson, Y., Tranqui, L. In vitro angiogenesis is modulated by the mechanical properties of fibrin gels and is related to alpha(v)beta3 integrin localization. In Vitro Cell Dev Biol Anim. 33, 763-773 (1997).
- Kniazeva, E., Kachgal, S., Putnam, A. J. Effects of extracellular matrix density and mesenchymal stem cells on neovascularization in vivo. Tissue Eng Part A. 17, 905-914 (2011).
- Angio, C. T., Maniscalco, W. M. The role of vascular growth factors in hyperoxia-induced injury to the developing lung. Front Biosci. 7, 1609-1623 (2002).
- Kasahara, Y., et al. Inhibition of VEGF receptors causes lung cell apoptosis and emphysema. J Clin Invest. 106, 1311-1319 (2000).
- Owen, C. A. Roles for proteinases in the pathogenesis of chronic obstructive pulmonary disease. Int J Chron Obstruct Pulmon Dis. 3, 253-268 (2008).
- Demedts, I. K., et al. Elevated MMP-12 protein levels in induced sputum from patients with COPD. Thorax. 61, 196-201 (2006).
- Haq, I., et al. Association of MMP-2 polymorphisms with severe and very severe COPD: a case control study of MMPs-1, 9 and 12 in a European population. BMC Med Genet. 11, 7(2010).
- Mercer, P. F., et al. MMP-9, TIMP-1 and inflammatory cells in sputum from COPD patients during exacerbation. Respir Res. 6, 151(2005).
- Matute-Bello, G., et al. Essential role of MMP-12 in Fas-induced lung fibrosis. Am J Respir Cell Mol Biol. 37, 210-221 (2007).
- Sivakumar, P., Gupta, S., Sarkar, S., Sen, S. Upregulation of lysyl oxidase and MMPs during cardiac remodeling in human dilated cardiomyopathy. Mol Cell Biochem. 307, 159-167 (2008).
- Gomperts, B. N., Strieter, R. M. Stem cells and chronic lung disease. Annu Rev Med. 58, 285-298 (2007).
- Lau, A. N., Goodwin, M., Kim, C. F., Weiss, D. J. Stem cells and regenerative medicine in lung biology and diseases. Mol Ther. 20, 1116-1130 (2012).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados