Method Article
Implantação de fibrina Gel no tapete do pulmão para o Estudo de angiogênese Lung-specific
Neste Artigo
Resumo
Recapitulation of the organ-specific microenvironment, which stimulates local angiogenesis, is indispensable for successful regeneration of damaged tissues. This report demonstrates a novel method to implant fibrin gels on the lung surface of living mouse in order to explore how the lung-specific microenvironment modulates angiogenesis and alveolar regeneration in adult mouse.
Resumo
Os recentes avanços significativos nas técnicas de pesquisa com células-tronco e bioengenharia têm feito grandes progressos na utilização de biomateriais para regenerar e reparar danos em tecidos simples nas áreas de ortopedia e periodontais. No entanto, as tentativas para regenerar as estruturas e as funções dos órgãos (3D) mais complexas tridimensionais, tais como os pulmões não têm sido muito bem sucedida, porque os processos biológicos de regeneração de órgãos não foram bem exploradas. Torna-se claro que a angiogênese, a formação de novos vasos sanguíneos, desempenha papel fundamental na regeneração de órgãos. Recentemente formado vasculaturas não só fornecer oxigénio, nutrientes e os vários componentes celulares que são necessários para a regeneração de órgãos, mas também fornecem sinais instrutivos para os tecidos em regeneração locais. Portanto, para regenerar com sucesso em pulmões de um adulto, que é necessário para recapitular os microambientes específicos do pulmão em que a angiogénese unidades de regeneração dos tecidos pulmonares locais. Embora conventional ensaios in vivo da angiogénese, tais como a implantação subcutânea de matriz extracelular (ECM) rico em hidrogéis (por exemplo, colagénio ou fibrina géis ou Matrigel - mistura de proteínas de ECM segregado por células de sarcoma de Engelbreth-Holm-Swarm rato), são amplamente utilizados para explorar a mecanismos gerais de angiogénese, a angiogénese específica do pulmão não tem sido bem caracterizada porque os métodos para o implante ortotópico de biomateriais no pulmão não foram bem estabelecidos. O objetivo deste protocolo é a introdução de um método único para implantar gel de fibrina na superfície do pulmão de vida do rato adulto, permitindo a recapitulação bem sucedida de acolhimento angiogênese derivado do pulmão dentro do gel. Esta abordagem permite aos investigadores para explorar os mecanismos pelos quais o microambiente-pulmão específico controla a angiogénese e regeneração alveolar em condições normais e patológicas. Desde o lançamento biomateriais implantados e fornecer sinais físicos e químicos para adjacente ltecidos ung, implantação destes biomateriais no pulmão doente pode potencialmente normalizar os tecidos doentes adjacentes, permitindo que pesquisadores a desenvolver novas abordagens terapêuticas para vários tipos de doenças pulmonares.
Introdução
O objetivo geral deste protocolo é a introdução de um método para implantar gel de fibrina na superfície do pulmão de rato adulto, o que permite aos pesquisadores para caracterizar os mecanismos moleculares da vascular pulmonar e desenvolvimento alveolar, e para aproveitar esse conhecimento, a fim de desenvolver materiais biomiméticos capaz de recapitular vascular pulmonar fisiológico e formação alveolar para o tratamento de várias doenças pulmonares.
Mais de 35 milhões de americanos sofrem de doenças pulmonares crônicas, incluindo doença pulmonar obstrutiva crônica e fibrose pulmonar. Esses pacientes têm sintomas crônicos de longa duração respiratórios, como falta de ar, aperto no peito, tosse persistente e cansaço, que prejudiquem significativamente a sua vida diária 1-3. Apesar de uma grande quantidade de esforço para desenvolver terapias eficazes para essas doenças pulmonares, atualmente não há cura; portanto, a qualidade de vida para estes pacientes é pobre e econômica e os custos humanos são oigh 4-7. Atualmente, o transplante de pulmão é a única maneira de salvar os pacientes em fase terminal de doenças pulmonares crônicas. No entanto, por causa da escassez de doadores de transplante, de alto custo, complicações graves, e baixa taxa de sobrevivência 11/08, o transplante não é uma abordagem ideal. Rápido progresso recente em técnicas de engenharia de tecidos tem possibilitado aos pesquisadores modificar geneticamente pulmão implantável por repovoamento todo descelulada pulmão com vários tipos de células progenitoras ou células-tronco pluripotentes induzidas (iPS) células 12,13. No entanto, esses pulmões bioengenharia são funcionais apenas em animais hospedeiros, por várias horas após a implantação 12,14,15. Utilizando biomateriais para regenerar as estruturas complexas e funções dos pulmões também tem sido bastante bem sucedida. Isso pode ser porque os processos biológicos fundamentais que regem a regeneração do pulmão adulto não têm sido bem explorado. No pulmão, a formação do sistema vascular é um dos acontecimentos mais precoces e mais importantes during desenvolvimento e regeneração 16-21. Vasculaturas recém-formados no pulmão não só fornecer oxigénio, nutrientes e os vários componentes celulares necessários para a formação de órgãos, mas também fornecem sinais reguladores instrutivos para células vizinhas 22-25. Assim, a angiogênese desempenha papel-chave na alveolarização regenerativo no pulmão adulto 24,26,27. Além disso, contribui para a angiogênese desregulamentado doenças pulmonares crônicas, como doença pulmonar obstrutiva crônica (DPOC) 28, displasia broncopulmonar (DBP) 21-23, e fibrose pulmonar 29. Assim, o desenvolvimento de estratégias mais eficientes para a engenharia pulmões ou o tratamento de doenças pulmonares crônicas, é necessário entender os mecanismos fundamentais da angiogênese específico do pulmão.
Cada órgão apresenta propriedades mecânicas e químicas únicas, que podem diferir entre as condições fisiológicas e patológicas 30-33. Estes microenviron órgão-específicamentos regular comportamentos de células endoteliais e orquestrar a formação da rede vascular de forma específica do órgão 24,34-36. Assim, o desenvolvimento de estratégias mais eficazes para a regeneração do pulmão, o mecanismo subjacente a angiogênese específico do pulmão precisa ser entendido. Embora os ensaios de angiogénese in vivo convencionais, tais como implantação subcutânea de hidrogel têm sido amplamente utilizados para pesquisa da angiogênese 37-39, esses métodos não recapitular angiogénese específica de órgão. Recentemente, um novo método para implante de Matrigel em um molde elástico no pulmão do rato tem sido desenvolvido e mostrado para recrutar com sucesso os vasos sanguíneos e células epiteliais do pulmão em 22 géis. Esta abordagem única permitirá que os investigadores para explorar o mecanismo de angiogênese específico do pulmão, bem como as interações entre os vasos sanguíneos e células pulmonares não-vasculares em condições fisiológicas e patológicas. Desde 1) Matrigel não é adequado para a aplicação clínica; 2) o emolde lastic usado para lançar o gel pode afetar interações entre hidrogéis e tecido pulmonar de acolhimento e 3) o molde elástico no pulmão potencialmente causa comprometimento da função pulmonar e dor durante a respiração, como uma abordagem mais clinicamente relevante, uma matriz de fibrina 3D contendo fatores angiogênicos (factor de crescimento endotelial vascular (VEGF) / factor de crescimento de fibroblastos básico (bFGF)) foi implantado no pulmão do rato sem vazamento no molde elástico, e tem sucesso recapitulado hospedeiro angiogénese derivados de pulmão. Gel de fibrina, fibrilas de polímero gerados a partir de fibrinogénio clivada pela trombina, a armadilha é conhecida uma variedade de factores angiogénicos, tais como bFGF e VEGF para acelerar a angiogénese in vivo 40,41. Devido à sua capacidade regenerativa e natureza biodegradável 42, gel de fibrina é amplamente utilizada no campo da engenharia de tecidos.
Este artigo apresenta uma abordagem inovadora e única para implantar gel de fibrina na superfície do pulmão de Adul vivot mouse e demonstra que o anfitrião angiogênese derivado do pulmão é recapitulada no interior dos géis in vivo. Este método, o qual permite aos investigadores a estudar angiogénese específica do pulmão, provavelmente irá levar ao desenvolvimento de novas abordagens terapêuticas para vários tipos de doenças pulmonares e avançar significativamente os esforços para regenerar com sucesso adulto pulmão.
Protocolo
NOTA: O estudo in vivo em animais foi realizado em estrita conformidade com as recomendações do Guia para o Cuidado e Uso de Animais de Laboratório do Instituto Nacional de Saúde. O protocolo foi revisto e aprovado pelo Comitê de Cuidados e Uso Animal do Hospital Infantil de Boston (números de protocolo: 13-10-2526R, 14-02-2568R). Todos os medicamentos utilizados neste protocolo são de grau farmacêutico e esses medicamentos são preparados em condições estéreis.
1. Preparação de fibrina Gel
- Prepare gel de fibrina que contém o VEGF e bFGF.
- Descongelar as soluções estoque de fibrinogénio e trombina que são armazenadas a -80 ° C até à temperatura ambiente (25 ° C).
- Adicionar trombina (concentração final: 2,5 U / ml), CaCl2 (concentração final: 45 mM), de VEGF (concentração final: 0-100 ng / ml) e bFGF (concentração final: 0-100 ng / ml) para o fibrinogénio solução (concentração final: 12,5 mg / ml em 0,9% sodium uma solução de cloreto 43-45) em um tubo de 1,5 ml.
- Misture delicadamente por pipetagem.
- Pipeta suavemente 200 ul da mistura num prato de plástico estéril de uma forma gota a gota, usando uma pipeta de ponta p200.
- Incubar as gotas a 37 ° C durante 30-60 minutos até se solidificar.
NOTA: O gel solidificado pode ser mantido no prato de plástico selado à temperatura ambiente (25 ° C) durante várias horas antes da implantação (Figura 1a).
- Apare o gel de fibrina em aproximadamente 3 x 3 x 3 cubos mm utilizando pequenas tesouras cirúrgicas antes da implantação.
2. Preparação do rato
- Anestesiar rato adulto (8-12 semanas) por injecção intraperitoneal (IP) de injecção de cetamina (100 mg / kg) e xilazina (10 mg / kg) e confirmam que o rato é adequadamente anestesiados por beliscar dedo do pé do rato.
- Use vet pomada nos olhos do mouse para prevenir o ressecamento durante o experimento.
- Shave fur sobre o lado esquerdo da caixa torácica do mouse.
- Execute entubação endotraqueal do mouse.
- Posicione o mouse sobre a intubação ficar em ângulo de 70 ° e segure o mouse no lugar ligando seus incisivos superiores ao longo de um pequeno anel de borracha localizado na parte superior do suporte.
- Gentilmente retrair a língua de um lado usando uma pinça sem corte.
- Visualizar a laringe, com o auxílio de um microscópio de pescoço de ganso iluminador de fibra óptica.
- Insira endotraqueal cateter elástico (21 G) na traquéia.
- Confirme se o mouse está respirando espontaneamente de uma forma suave (regular 100-150 ciclos / min, sem respiração paradoxal ou superficial).
- Posicione o mouse em posição frontal sob o microscópio de dissecação.
- Mecanicamente ventilar o mouse utilizando um ventilador de roedor (150 ciclos / min e 7 ml / kg volume corrente).
- Contagem costelas para localizar espaço intercostal entre 4ª e 5ª costela.
- Criar um campo estéril sobre a área by completamente limpando com álcool e iodopovidona. Cubra o campo cirúrgico adequadamente com um campo cirúrgico estéril.
3. Rato Cirurgia
- Após a injecção local de bupivacaína a 0,25% (200 ul) na pele, fazer uma incisão cutânea transversal (cerca de 1 cm de comprimento) sobre o espaço intercostal com tesouras de dissecção.
- Após a injeção de bupivacaína a 0,25% (200 mL) no músculo intercostal, fazer uma incisão do músculo entre a 4ª e 5ª costela usando uma tesoura pequena multa.
- Insira um afastador dissecando entre as costelas para visualizar totalmente o pulmão esquerdo.
- Raspe uma pequena área (1 x 1 mm quadrados) de pleura visceral do centro de pulmão esquerdo usando uma pinça fina.
- Aplique uma leve pressão sobre a área usando um cotonete estéril até que o sangramento e vazamentos são totalmente controlados.
- Coloque pequena quantidade de mistura fresca de fibrinogénio / trombina (cola de fibrina) (passo 1.1.2. 20 & #181; l) sobre a área usando ponta p200 pipeta.
- Suavemente colocar um gel de fibrina (passo 1.2), utilizando pequenas pinças sobre a área (Figura 1b).
- Confirmar que o gel é bem fixo na área durante os movimentos respiratórios dos pulmões.
- Certifique-se de que não existe nem enorme vazamento de ar, nem hemorragia do pulmão.
- Fechar incisões (camadas de músculo e pele) com sutura absorvível, que não tem de ser removido.
- Aspirar a cavidade torácica com 27 G agulha e seringa de 1 ml para evitar pneumotórax.
- Terminar ventilação mecânica.
4. Rato Recovery
- Verifique se o mouse está respirando espontaneamente de uma forma suave (regular 100-150 ciclos / min, sem respiração paradoxal ou superficial).
- IP injectar 1 ml de pré-aquecido 0,9% de NaCl para evitar a desidratação.
- Permitir mouse para recuperar na almofada de água quente circulante.
- Remover o endotrachetubo al depois de confirmar que o rato tem respiração estável.
- Injectar meloxicam (5 mg / kg, injecção subcutânea (SC), durante 3 dias como analgésico pós-operatório.
- Monitorar os movimentos do mouse com cuidado em um mínimo de 15 minutos de intervalo até que seja esternal (capaz de rolar sua estômago e permanecer em pé) e consciente.
- Após a recuperação, o retorno do mouse para uma nova gaiola isolada de ratos sem cirurgia.
- Monitorar o local da cirurgia para sinais de infecção (vermelhidão, inchaço, secreção), funções biológicas básicas do animal (alimentos e água ingestão, urinar, defecar, ganho de peso corporal), bem como sinais clínicos de angústia (piloerection, reduziu a locomoção) diariamente após a procedimento cirúrgico.
5. A colheita do Pulmão
- 7 a 30 dias após a implantação, eutanásia do rato usando CO 2 através fonte de gás comprimido.
- Faça uma incisão entre a ponta do apêndice xifóide eo esternoentalhe (esternotomia mediana) e toda a colheita de pulmão com o gel implantado para análise histológica e bioquímica, cortando a traqueia e dissecar todas as conexões com o coração, pulmões e traquéia.
- Corrigir gel implantado com pulmão com solução de paraformaldeído a 4% durante a noite a 4 ºC, incorporar em composto OCT, e tomar seções passo em série de 30 mm de espessura.
- Execute histológico (hematoxilina e eosina) e análises de imuno-histoquímica (marcador endotelial: CD31, marcador epitelial: aquaporin (AQP) 5 e surfactante proteína (SP) -B) usando microscópio confocal 22,37,40.
- Compilar pilhas de secções ópticas (30 mm de espessura) para formar imagens tridimensionais de endotelial pulmão e células epiteliais utilizando imagem 3D software de análise de 37.
- Quantificar áreas projectadas dos vasos sanguíneos recém-formados usando software de análise de imagem 46.
Resultados
Para examinar se a formação vascular pulmonar derivados do hospedeiro, se condensa no interior dos biomateriais implantados no pulmão, geles de fibrina suplementado com grandes factores angiogénicos de VEGF e bFGF (0, 10 e 100 ng / ml cada) foram implantados na superfície das que vivem nos pulmões de ratinho quanto relataram o uso de Matrigel 22. 47 geles de fibrina que contêm estes factores de crescimento angiogénicos foram fabricados como se mostra na Figura 1a. Após toracotomia, uma pequena área da superfície do pulmão esquerdo foi raspado utilizando uma pinça e o gel de fibrina fabricado foi implantado no pulmão de rato adulto utilizando a uma pequena quantidade de cola de fibrina, o qual é aprovado pela FDA e amplamente utilizada como selante eficaz para parar vazamentos de ar e reduz o sangramento em cirurgia de pulmão 48,49 (Figura 1b). A maioria dos ratos recuperaram sem sintomas respiratórios graves (por exemplo, pneumotórax, dificuldades respiratórias). Sete dias após a implantação, os ratos foram sacrificados e os pulmões foram harvested. Gel de fibrina implantado foi incorporada no pulmão hospedeiro 7 dias após a implantação (Figura 1c). Reconstrução 3D de imagens de fluorescência confocal revelou que as células endoteliais CD31-positivo derivados do hospedeiro formadas redes vasculares no interior dos géis de 7 dias após o implante de uma forma dependente da dose de VEGF / bFGF (Figura 2a, c). Tipo II I (SP-B positivo) as células epiteliais pulmonares (AQP5 positivo) e de tipo também foram recrutados ao longo dos vasos sanguíneos recentemente formados no interior dos géis que foram suplementados com concentrações mais elevadas de VEGF e bFGF (cada 100 ng / ml) (Figura 2a) . Coloração de H & E de secções histológicas revelaram que outros tipos de células hospedeiras também migraram para o gel de 7 dias após a implantação (Figura 2b). Estes resultados sugerem que as redes vasculares regenerativos derivado de pulmão hospedeiras são construídos com sucesso dentro dos geles de fibrina que são suplementados com factores angiogénicos e implantados na superfície de mou adultose pulmão.
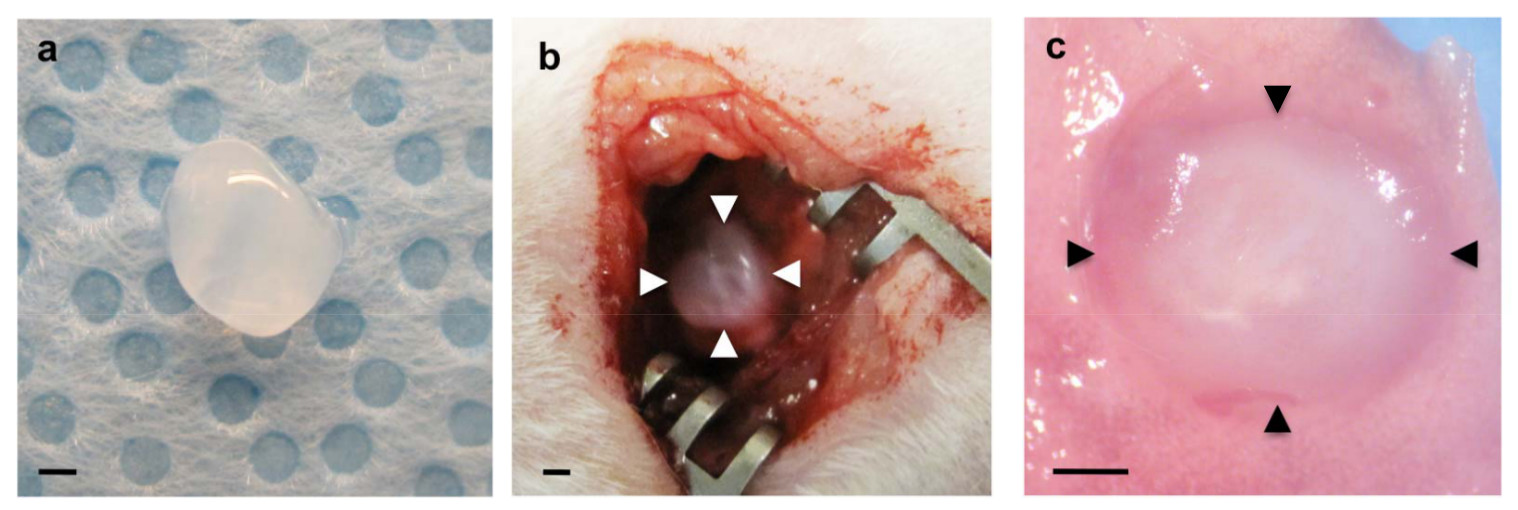
Figura 1:. (A) O gel de fibrina preparado antes da implantação (b) fibrina gel implantado sobre a pleura visceral raspadas do pulmão esquerdo (setas) (c) Implantado gel de fibrina (pontas de seta) incorporada no pulmão hospedeiro 7 dias após a implantação.. Barras de escala de 1 mm.
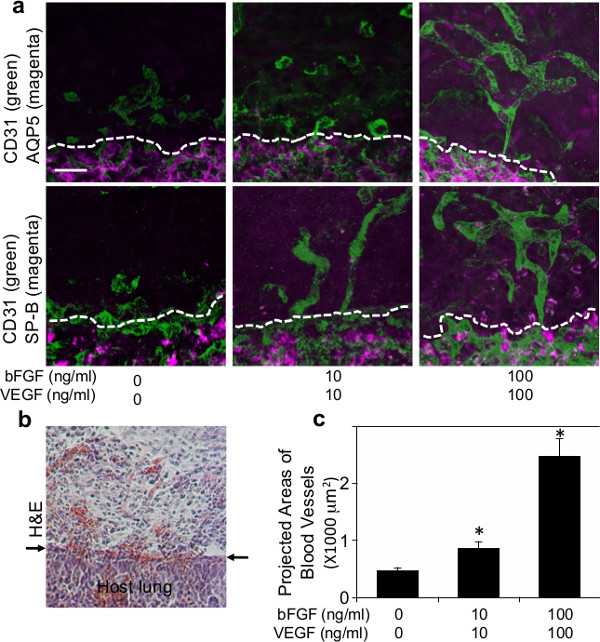
Figura 2: (a) micrografias de fluorescência mostrando a formação de redes vasculares (CD31 positivo; verde) e recrutados tipo I (AQP5-positivo; magenta) ou tipo II (SP-B positivo; magenta) células epiteliais do pulmão no interior do gel de fibrina suplementado com várias concentrações de VEGF e bFGF (0, 10 e 100 ng / ml de cada) 7 dias após a implantação. As linhas tracejadas indicam a interface entre o gel de fibrina e do pulmão implantado hospedeiro. Barra de escala:. 20 um (b) Micrografia luz de coloração de H & E mostra a infiltração de células hospedeiras em gel de fibrina a 7 dias após a implantação. As setas indicam a interface entre o gel e pulmonar do hospedeiro. Barra de escala: 20 mm (c) Gráfico mostrando áreas projectadas dos vasos sanguíneos recentemente formados nos geles de fibrina que são suplementados com várias concentrações de VEGF e bFGF (0, 10 e 100 ng / ml de cada) 7 dias após a implantação..
Discussão
Este artigo apresenta um novo método para implantar biomateriais na superfície do pulmão de vida do rato adulto. Com este sistema, a angiogénese derivados de pulmão hospedeiro com sucesso, se condensa no interior do material. Este sistema permite que os investigadores para explorar a interferência entre as células endoteliais, outras células (por exemplo, células epiteliais, células mesenquimais, células imunes), e vários componentes da matriz extracelular que são necessárias para a angiogénese local, 50-53 e regeneração alveolar 24,54. Embora o implante in vivo de hidrogel subcutânea convencional tem sido usado extensivamente para a pesquisa da angiogênese 37-39, esses métodos não recapitular angiogénese específica de órgão. Este sistema, no qual hidrogel é implantado diretamente na superfície do pulmão, vai permitir aos investigadores para explorar o papel do microambiente específico do pulmão em angiogênese e regeneração alveolar no pulmão do rato adulto. Estes géis podem ser fabricados a partir de vários BIOMATE rico em ECMriais (por exemplo, colágenos, fibrinas) que podem ser complementados com vários fatores químicos (por exemplo, fatores angiogênicos, fatores de crescimento) 55,56, as células progenitoras e / ou células iPS. Além de fatores químicos, forças mecânicas também controlar a angiogênese 23,37. A rigidez das mudanças de gel de fibrina em um dependente da concentração de fibrinogênio forma 57 e manipular a concentração de fibrinogênio pode afetar a angiogênese, não só através de sinais químicos, mas também através de pistas físicas 58,59. Portanto, as propriedades físico-químicas dos geles de fibrina pode ser necessário optimizar com cuidado para recapitular a angiogénese específica do órgão fisiológico no futuro. A cicatrização de feridas após raspagem da pleura visceral e também produz um coágulo de fibrina endógena, que inclui vários tipos de células hospedeiras e promove o processo de cicatrização e regeneração do tecido. Este coágulo natural pode interagir com o gel de fibrina exogenamente implantado, e, portanto, controlar angiogênese no gel implantado. Fluorescente fibrinogênio marcado pode permitir aos pesquisadores distinguir entre coágulo de fibrina natural e gel de fibrina implantado e explorar esses mecanismos. Embora este seja um método poderoso para caracterizar a angiogénese em pulmões de ratinho adulto, aplicação para o estudo do desenvolvimento do pulmão e doenças em ratinhos neonatais provavelmente apresentam desafios técnicos.
O objetivo final deste estudo é recrutar vasos sanguíneos funcionais em gel de fibrina implantados em pulmões doentes e de usar a matriz como um dispositivo médico para restaurar as estruturas pulmonares funcionais. Possíveis comunicações entre as células hospedeiras e o vascular e estruturas alveolares no interior dos géis, bem como a funcionalidade destas estruturas deve ser explorado em experiências futuras. Desde os níveis de VEGF nos pulmões estão diminuídos em pacientes com DBP 60 e enfisema 61, acrescentando VEGF para a matriz pode melhorar o recrutamento de vasos sanguíneos nos impl matrizanted nesses pulmões doentes. As propriedades mecânicas também diferem entre os pulmões saudáveis e doentes 23,62. Por exemplo, a expressão de metaloproteinases de matriz e lisil-oxidase, que controlam a degradação e reticulação do colagénio, respectivamente, são alteradas em várias doenças pulmonares, incluindo a DPOC e fibrose pulmonar 63-67. Em pulmões doentes, certas linhagens de células progenitoras endoteliais para pulmão e células epiteliais estão esgotados 68. Assim, a manipulação destes factores (factores angiogénicos, ECMs, rigidez ECM) ou implantando geles de fibrina suplementadas com células progenitoras 69 irá provavelmente conduzir à formação de vasos sanguíneos funcionais dentro da matriz e a recuperação da função pulmonar em várias condições patológicas. Desde factores químicos pode ser completada dentro dos geles de fibrina para modular a angiogénese local, o sistema também pode ser utilizado explorar sinais ambientais específicos que podem normalizar pulmões doentes em doenças pulmonares crónicas.
Em resumo, este artigo introduz um método para implante de hidrogel de fibrina sobre a superfície do pulmão de rato vivo, o que permite aos investigadores para caracterizar a angiogénese específica do pulmão in vivo. Modificação de vários factores (por exemplo, campo de tempo, as concentrações e combinações de factores angiogénicos, vários tipos de hidrogéis, propriedades físico-químicas dos hidrogéis) neste sistema, irá revelar os mecanismos de regeneração e a angiogénese no pulmão. Assim, este sistema vai avançar significativamente os conhecimentos científicos da biologia vascular básica, engenharia de tecidos, assim como a medicina pulmonar.
Divulgações
The authors declare that they have no competing financial interests.
Agradecimentos
Este trabalho foi financiado por fundos da American Heart Association (AM), Departamento de Defesa dos EUA (BC074986), e do Boston Children Hospital Faculdade Career Development Fellowship (TM, AM). Os autores agradecem a Amanda Jiang e Elisabeth Jiang para assistência técnica.
Materiais
| Name | Company | Catalog Number | Comments |
| Fibrinogen from human placenta | Sigma | F4883 | For fabrication of fibrin gel |
| Thrombin from bovine plasma | Sigma | T9549 | For fabrication of fibrin gel |
| Recombinant mouse VEGF 164 | R&D | 493-MV | For supplementation to fibrin gel |
| Recombinant mouse bFGF | R&D | 3139-FB | For supplementation to fibrin gel |
| Rodent Intubation Stand | Braintree Scientific INC | RIS 100 | For intubation |
| Fiber-Optic Light Source | Fisher Scientific | 12-565-35 | For intubation |
| 21 G Elastic catheter | B.Braun | 4251652-02 | For intubation |
| MiniVent Ventilator | Harvard Apparatus | CGS-8009 | For ventilation |
| Stemi DV4 Steromicroscope | Fisher Scientific | 12-070-515 | For surgey |
| Absobable suture | Ethicon | PDP304 | Surgical suture |
| Antibody against CD31 | BD Biosciences | 553370 | Immunohistochemistry |
| Antibody against AQP5 | Abcam | AB78486 | Immunohistochemistry |
| Antibody against SP-B | Abcam | AB40876 | Immunohistochemistry |
Referências
- Donaldson, G. C., Seemungal, T. A., Bhowmik, A., Wedzicha, J. A. Relationship between exacerbation frequency and lung function decline in chronic obstructive pulmonary disease. Thorax. 57, 847-852 (2002).
- Lopez-Campos, J. L., Calero, C., Quintana-Gallego, E. Symptom variability in COPD: a narrative review. Int J Chron Obstruct Pulmon Dis. 8, 231-238 (2013).
- Ley, B., Collard, H. R., King, T. E. Clinical course and prediction of survival in idiopathic pulmonary fibrosis. Am J Respir Crit Care Med. 183, 431-440 (2011).
- Ferrer, M., et al. Chronic obstructive pulmonary disease stage and health-related quality of life. The Quality of Life of Chronic Obstructive Pulmonary Disease Study Group. Ann Intern Med. 127, 1072-1079 (1997).
- Reardon, J. Z., Lareau, S. C., ZuWallack, R. Functional status and quality of life in chronic obstructive pulmonary disease. Am J Med. 119, 32-37 (2006).
- De Vries, J., Kessels, B. L., Drent, M. Quality of life of idiopathic pulmonary fibrosis patients. Eur Respir J. 17, 954-961 (2001).
- Sullivan, S. D., Ramsey, S. D., Lee, T. A. The economic burden of COPD. Chest. 117, 5S-9S (2000).
- Orens, J. B., Garrity, E. R. General overview of lung transplantation and review of organ allocation. Proc Am Thorac Soc. 6, 13-19 (2009).
- Benden, C. Specific aspects of children and adolescents undergoing lung transplantation. Curr Opin Organ Transplant. 17, 509-514 (2012).
- Lyu, D. M., Zamora, M. R. Medical complications of lung transplantation. Proc Am Thorac Soc. 6, 101-107 (2009).
- Trulock, E. P., et al. Registry of the International Society for Heart and Lung Transplantation: twenty-fourth official adult lung and heart-lung transplantation report-2007. J Heart Lung Transplant. 26, 782-795 (2007).
- Weiss, D. J. Current status of stem cells and regenerative medicine in lung biology and diseases. Stem Cells. 32, 16-25 (2013).
- Ghaedi, M., et al. Human iPS cell-derived alveolar epithelium repopulates lung extracellular matrix. J Clin Invest. 123, 4950-4962 (2013).
- Ott, H. C., et al. Regeneration and orthotopic transplantation of a bioartificial lung. Nat Med. 16, 927-933 (2010).
- Petersen, T. H., et al. Tissue-engineered lungs for in vivo implantation. Science. 329, 538-541 (2010).
- Tuyl, M., et al. Angiogenic factors stimulate tubular branching morphogenesis of sonic hedgehog-deficient lungs. Dev Biol. 303, 514-526 (2007).
- Galambos, C., deMello, D. E. Molecular mechanisms of pulmonary vascular development. Pediatr Dev Pathol. 10, 1-17 (2007).
- McGrath-Morrow, S. A., et al. Vascular endothelial growth factor receptor 2 blockade disrupts postnatal lung development. Am J Respir Cell Mol Biol. 32, 420-427 (2005).
- White, A. C., Lavine, K. J., Ornitz, D. M. FGF9 and SHH regulate mesenchymal Vegfa expression and development of the pulmonary capillary network. Development. 134, 3743-3752 (2007).
- Zhao, L., Wang, K., Ferrara, N., Vu, T. H. Vascular endothelial growth factor co-ordinates proper development of lung epithelium and vasculature. Mech Dev. 122, 877-886 (2005).
- Stenmark, K. R., Abman, S. H. Lung vascular development: implications for the pathogenesis of bronchopulmonary dysplasia. Annu Rev Physiol. 67, 623-661 (2005).
- Mammoto, T., et al. LRP5 Regulates Development of Lung Microvessels and Alveoli through the Angiopoietin-Tie2 Pathway. PLoS ONE. 7, e41596(2012).
- Mammoto, T., Jiang, E., Jiang, A., Mammoto, A. ECM structure and tissue stiffness control postnatal lung development through the LRP5-Tie2 signaling system. American Journal of Respiratory Cell and Molecular Biology. 49, 1009-1018 (2013).
- Ding, B. S., et al. Endothelial-derived angiocrine signals induce and sustain regenerative lung alveolarization. Cell. 147, 539-553 (2011).
- Crivellato, E. The role of angiogenic growth factors in organogenesis. Int J Dev Biol. 55, 365-375 (2011).
- Sakurai, M. K., et al. Vascular endothelial growth factor accelerates compensatory lung growth after unilateral pneumonectomy. Am J Physiol Lung Cell Mol Physiol. 292, 742-747 (2007).
- Panigrahy, D., et al. Epoxyeicosanoids promote organ and tissue regeneration. Proc Natl Acad Sci U S A. 110, 13528-13533 (2013).
- Voelkel, N. F., Douglas, I. S., Nicolls, M. Angiogenesis in chronic lung disease. Chest. 131, 874-879 (2007).
- Hanumegowda, C., Farkas, L., Kolb, M. Angiogenesis in pulmonary fibrosis: too much or not enough. Chest. 142, 200-207 (2012).
- Levental, K. R., et al. Matrix crosslinking forces tumor progression by enhancing integrin signaling. Cell. 139, 891-906 (2009).
- Mammoto, A., Mammoto, T., Ingber, D. E. Mechanosensitive mechanisms in transcriptional regulation. J Cell Sci. 125, 3061-3073 (2012).
- Westermann, D., et al. Role of left ventricular stiffness in heart failure with normal ejection fraction. Circulation. 117, 2051-2060 (2008).
- Merchante, N., et al. Liver stiffness predicts clinical outcome in human immunodeficiency virus/hepatitis C virus-coinfected patients with compensated liver cirrhosis. Hepatology. 56, 228-238 (2012).
- Ding, B. S., et al. Inductive angiocrine signals from sinusoidal endothelium are required for liver regeneration. Nature. 468, 310-315 (2010).
- Fidler, I. J. Angiogenic heterogeneity: regulation of neoplastic angiogenesis by the organ microenvironment. J Natl Cancer Inst. 93, 1040-1041 (2001).
- Folkman, J. How is blood vessel growth regulated in normal and neoplastic tissue? G.H.A. Clowes memorial Award lecture. Cancer Res. 46, 467-473 (1986).
- Mammoto, A., et al. A mechanosensitive transcriptional mechanism that controls angiogenesis. Nature. 457, 1103-1108 (2009).
- Malinda, K. M. In vivo matrigel migration and angiogenesis assay. Methods Mol Biol. 467, 287-294 (2009).
- Norrby, K. In vivo models of angiogenesis. J Cell Mol Med. 10, 588-612 (2006).
- Mammoto, T., Jiang, A., Jiang, E., Mammoto, A. Platelet rich plasma extract promotes angiogenesis through the angiopoietin1-Tie2 pathway. Microvasc Res. 89, 15-24 (2013).
- Mosesson, M. W. Fibrinogen and fibrin structure and functions. J Thromb Haemost. 3, 1894-1904 (2005).
- Bensaid, W., et al. A biodegradable fibrin scaffold for mesenchymal stem cell transplantation. Biomaterials. 24, 2497-2502 (2003).
- Teichert-Kuliszewska, K., et al. Biological action of angiopoietin-2 in a fibrin matrix model of angiogenesis is associated with activation of Tie2. Cardiovasc Res. 49, 659-670 (2001).
- Lafleur, M. A., Handsley, M. M., Knauper, V., Murphy, G., Edwards, D. R. Endothelial tubulogenesis within fibrin gels specifically requires the activity of membrane-type-matrix metalloproteinases (MT-MMPs). J Cell Sci. 115, 3427-3438 (2002).
- Collen, A., et al. Aberrant fibrin formation and cross-linking of fibrinogen Nieuwegein, a variant with a shortened Aalpha-chain, alters endothelial capillary tube formation. Blood. 97, 973-980 (2001).
- Mammoto, T., et al. Mechanochemical Control of Mesenchymal Condensation and Embryonic Tooth Organ Formation. Dev Cell. 21, 758-769 (2011).
- Murphy, K. C., Leach, J. K. A reproducible, high throughput method for fabricating fibrin gels. BMC Res Notes. 5, 423(2012).
- Matar, A. F., Hill, J. G., Duncan, W., Orfanakis, N., Law, I. Use of biological glue to control pulmonary air leaks. Thorax. 45, 670-674 (1990).
- Thetter, O. Fibrin adhesive and its application in thoracic surgery. Thorac Cardiovasc Surg. 29, 290-292 (1981).
- Rahbarghazi, R., et al. Juxtacrine and paracrine interactions of rat marrow-derived mesenchymal stem cells, muscle-derived satellite cells, and neonatal cardiomyocytes with endothelial cells in angiogenesis dynamics. Stem Cells Dev. 22, 855-865 (2013).
- Nucera, S., Biziato, D., De Palma, M. The interplay between macrophages and angiogenesis in development, tissue injury and regeneration. Int J Dev Biol. 55, 495-503 (2011).
- Joensuu, K., et al. Interaction between marrow-derived human mesenchymal stem cells and peripheral blood mononuclear cells in endothelial cell differentiation. Scand J Surg. 100, 216-222 (2011).
- Takakura, N. Role of intimate interactions between endothelial cells and the surrounding accessory cells in the maturation of blood vessels. J Thromb Haemost. 9 Suppl 1, 144-150 (2011).
- Plantier, L., Boczkowski, J., Crestani, B. Defect of alveolar regeneration in pulmonary emphysema: role of lung fibroblasts. Int J Chron Obstruct Pulmon Dis. 2, 463-469 (2007).
- Belair, D. G., Murphy, W. L. Specific VEGF sequestering to biomaterials: influence of serum stability. Acta Biomater. 9, 8823-8831 (2013).
- Wong, C., Inman, E., Spaethe, R., Helgerson, S. Fibrin-based biomaterials to deliver human growth factors. Thromb Haemost. 89, 573-582 (2003).
- Stolzing, A., Colley, H., Scutt, A. Effect of age and diabetes on the response of mesenchymal progenitor cells to fibrin matrices. Int J Biomater. 2011, 378034(2011).
- Vailhe, B., Ronot, X., Tracqui, P., Usson, Y., Tranqui, L. In vitro angiogenesis is modulated by the mechanical properties of fibrin gels and is related to alpha(v)beta3 integrin localization. In Vitro Cell Dev Biol Anim. 33, 763-773 (1997).
- Kniazeva, E., Kachgal, S., Putnam, A. J. Effects of extracellular matrix density and mesenchymal stem cells on neovascularization in vivo. Tissue Eng Part A. 17, 905-914 (2011).
- Angio, C. T., Maniscalco, W. M. The role of vascular growth factors in hyperoxia-induced injury to the developing lung. Front Biosci. 7, 1609-1623 (2002).
- Kasahara, Y., et al. Inhibition of VEGF receptors causes lung cell apoptosis and emphysema. J Clin Invest. 106, 1311-1319 (2000).
- Owen, C. A. Roles for proteinases in the pathogenesis of chronic obstructive pulmonary disease. Int J Chron Obstruct Pulmon Dis. 3, 253-268 (2008).
- Demedts, I. K., et al. Elevated MMP-12 protein levels in induced sputum from patients with COPD. Thorax. 61, 196-201 (2006).
- Haq, I., et al. Association of MMP-2 polymorphisms with severe and very severe COPD: a case control study of MMPs-1, 9 and 12 in a European population. BMC Med Genet. 11, 7(2010).
- Mercer, P. F., et al. MMP-9, TIMP-1 and inflammatory cells in sputum from COPD patients during exacerbation. Respir Res. 6, 151(2005).
- Matute-Bello, G., et al. Essential role of MMP-12 in Fas-induced lung fibrosis. Am J Respir Cell Mol Biol. 37, 210-221 (2007).
- Sivakumar, P., Gupta, S., Sarkar, S., Sen, S. Upregulation of lysyl oxidase and MMPs during cardiac remodeling in human dilated cardiomyopathy. Mol Cell Biochem. 307, 159-167 (2008).
- Gomperts, B. N., Strieter, R. M. Stem cells and chronic lung disease. Annu Rev Med. 58, 285-298 (2007).
- Lau, A. N., Goodwin, M., Kim, C. F., Weiss, D. J. Stem cells and regenerative medicine in lung biology and diseases. Mol Ther. 20, 1116-1130 (2012).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados