Method Article
肺特異的血管形成を研究するためにマウスの肺にフィブリンゲルの移植
要約
Recapitulation of the organ-specific microenvironment, which stimulates local angiogenesis, is indispensable for successful regeneration of damaged tissues. This report demonstrates a novel method to implant fibrin gels on the lung surface of living mouse in order to explore how the lung-specific microenvironment modulates angiogenesis and alveolar regeneration in adult mouse.
要約
幹細胞研究と生物工学技術の最近の重要な進歩は、再生し、整形外科や歯周分野のシンプルな組織における損傷を修復するために生体材料を利用することで大きな進歩を遂げている。臓器再生の生物学的プロセスはよく検討されていないので、肺などのより複雑な三次元(3D)の構造と機能を再生しようとする臓器は非常に成功していない。これは、血管新生は、新しい血管の形成は、臓器再生において重要な役割を果たしていることが明らかになってきている。新たに形成された血管系は、酸素、栄養素や臓器再生のために必要とされる様々な細胞成分を提供するだけでなく、再生地元の組織に有益な信号を提供するだけでなく。首尾成人肺を再生成するため、それは血管新生が局所肺組織の再生を駆動する肺特異的微小環境を再現することが必要である。共同もののnventional インビボでのそのようなヒドロゲル( 例えば 、フィブリンまたはコラーゲンゲルまたはマトリゲル-エンゲルブレス-ホルム-スウォームマウス肉腫細胞によって分泌ECMタンパク質の混合物)がリッチ細胞外マトリックス(ECM)の皮下移植などの血管新生アッセイ、広く探求するために利用される肺における生体材料の同所移植のための方法は十分に確立されていないため、血管新生の一般的なメカニズムは、肺特異的血管新生は、十分に特徴付けられていない。このプロトコルの目的は、ゲル内部ホスト肺由来の血管新生の成功要約を可能に、生きている成体マウスの肺の表面にフィブリンゲルを注入するユニークな方法を導入することである。このアプローチは、肺特異的微小環境が正常および病的両方の条件で血管新生および肺胞の再生を制御するメカニズムを探求する研究者を可能にします。注入された生体材料のリリース以来隣接lの物理的および化学的な信号を供給し、長官組織、罹患肺におけるこれらの生体材料の注入は、潜在的に肺疾患の様々なタイプの新しい治療アプローチを開発するための研究を可能にする、隣接した病変組織を正常化することができる。
概要
このプロトコルの全体的な目標は、研究者は肺血管および肺発達の分子機構を特徴づけることができ、成体マウスの肺表面にフィブリンゲルを注入する方法を導入すること、及び可能な生体模倣材料を開発するためにこの知識を活用することである様々な肺疾患を治療するための生理的な肺の血管および肺胞形成を反復するの。
35以上の万人のアメリカ人が慢性閉塞性肺疾患および肺線維症を含む慢性肺疾患に苦しむ。これらの患者は大幅に日常生活1-3を損なうような息切れ、胸部圧迫感、しつこい咳、および疲労などの長期的な慢性呼吸器症状を持っている。これらの肺疾患のための効果的な治療法を開発する努力が多量にもかかわらず、現在、治療法は存在しない。そのため、これらの患者の生活の質が悪いと経済で、人的コストがhiであるGH 4-7。現在、肺移植は、末期慢性肺疾患を有する患者を保存する唯一の方法である。しかし、移植ドナー、高コスト、深刻な合併症、および低い生存率8-11の不足のため、移植が最適なアプローチではありません。組織工学技術の最近の急速な進歩は、前駆細胞または人工多能性幹(iPS)細胞12,13の様々なタイプの脱細胞化肺全体を再増殖することにより、移植可能な肺をbioengineerする研究者を可能にした。しかし、これらの生体工学肺が唯一の注入12,14,15後に数時間の宿主動物において機能的である。肺の複雑な構造および機能を再生するために生体材料を利用しても、かなり成功していない。成人の肺の再生を支配する主要な生物学的プロセスが十分に検討されていないためと考えられる。肺では、血管系の形成が早いと最も重要なイベントの一つ対応時間は限らですNGの開発と再生16-21。肺で新たに形成された血管系は、酸素、栄養素や器官形成に必要な各種の細胞成分を提供するだけでなく、細胞の22〜25の周囲に有益な調節シグナルを提供するだけでなく。このように、血管新生は、成人肺24,26,27回生肺胞形成において重要な役割を果たしている。また、調節解除された血管新生は、慢性閉塞性肺疾患(COPD)28、気管支肺異形成(BPD)、21-23、および肺線維症29のような慢性の肺疾患に寄与する。したがって、肺のエンジニアリングまたは慢性肺疾患を治療するためのより効率的な戦略を開発するためには、肺特異的血管形成の基本的メカニズムを理解する必要がある。
各器官は生理学的および病理学的条件30〜33の間で異なる場合がありますユニークな機械的および化学的特性を、表示されます。これらの器官特異microenvironメンツは、内皮細胞の挙動を調節し、器官特異的に24,34-36に血管網の形成を調整する。したがって、肺の再生のためのより効率的な戦略を開発するために、肺特異的血管形成の基礎となるメカニズムは、理解される必要がある。皮下ヒドロゲル移植のような従来のin vivoでの血管形成アッセイは、血管形成の研究37-39ために広く使用されてきたが、これらの方法は、器官特異的血管形成を再現しない。最近、マウス肺弾性モールドにマトリゲルを移植するための新規な方法が開発され、成功したゲル22中に血管および肺上皮細胞を動員することが示されている。このユニークなアプローチは、研究者は肺特異的血管形成の機構、ならびに生理的および病的状態における血管および非血管肺細胞間の相互作用を探索することを可能にする。 1)マトリゲルは臨床応用には適していないので。 2)Eゲルをキャストするために使用ラスチック金型は、ヒドロゲルおよびホスト肺組織との間の相互作用に影響を与える可能性があり、3)肺弾性モールドは、潜在的に、より臨床的に関連するアプローチ、血管新生因子を含む3次元フィブリンマトリックスとして、呼吸中に肺機能および疼痛障害を引き起こす(血管内皮増殖因子(VEGF)/塩基性線維芽細胞増殖因子(bFGF))、弾性モールドに鋳造することなく、マウス肺に移植された、成功したホスト肺由来の血管新生を要約されている。フィブリンゲル、トロンビン切断されたフィブリノゲンから生成されたポリマー原線維は、トラップする生体 40,41 で血管新生を促進させるようなbFGFおよびVEGFなどの血管新生因子の様々な知られている。 、その再生能力及び生分解性の性質42、フィブリンゲルが広く組織工学の分野で用いられている。
この記事では、生きているADULの肺の表面にフィブリンゲルを注入する新規かつユニークなアプローチを紹介しますトンマウスとホスト肺由来の血管新生は、in vivoでのゲルの内部に要約されていることを示している。肺特異的血管形成を研究するための研究を可能にし、この方法は、可能性肺疾患の様々なタイプの新しい治療アプローチの開発につながると有意に正常成体肺を再生する取り組みを進めます。
プロトコル
注:in vivoでの動物実験は、国立衛生研究所の実験動物の管理と使用に関する指針の推奨事項に厳密に従って実施した。プロトコルを見直し、ボストン小児病院の動物実験委員会によって承認された(プロトコル番号:13-10-2526R、14-02-2568R)。このプロトコルで使用されるすべての薬物は、医薬品グレードであり、これらの薬物は、無菌条件下で調製される。
1.フィブリンゲルの準備
- VEGFおよびbFGFが含まれているフィブリンゲルを準備します。
- 室温(25℃)に-80℃で保存されたフィブリノーゲンおよびトロンビンのストック溶液を解凍する。
- フィブリノゲンへのCaCl 2(最終濃度:45ミリモル)、VEGF(終濃度:0〜100 ng / ml)をおよびbFGF(0-100 / mlの最終濃度)のトロンビン(2.5 U / mlの最終濃度)を添加する溶液(最終濃度:0.9%sodiu 12.5 mg / mlの1.5mlチューブにおけるm食塩43-45)。
- ピペッティングにより穏やかに混合します。
- 穏やかにp200とのピペットチップを用いて滴下様式で滅菌プラスチックシャーレ上に混合物200μlをピペット。
- 彼らが固化するまで、30〜60分間、37℃で滴をインキュベートする。
注:固化ゲル注入( 図1a)の前に数時間、室温(25℃)で密封されたプラスチックディッシュに保つことができる。
- 移植前に小さな外科用ハサミを用いて約3×3×3 mmの立方体にフィブリンゲルをトリミング。
2.マウスの準備
- 腹腔内ケタミンの(IP)注射(100mg / kg)およびキシラジン(10mg / kgの)によって成体マウス(8-12週)を麻酔し、マウスが十分にマウスのつま先をつまんで麻酔をかけていることを確認します。
- 実験中に乾燥を防ぐために、マウスの目に獣医軟膏を使用してください。
- シェーブFUマウスの胸郭の左側の上R。
- マウスの気管内挿管を行います。
- 70°の角度をなす挿管スタンドにマウスを置き、スタンドの上部にある小さなゴムバンドの上に、その上部切歯をフックによって所定の位置にマウスを保持する。
- 静かに鈍鉗子を用いて片側に舌を撤回。
- 光ファイバグースネック顕微鏡照明装置を用いて喉頭を視覚化。
- 気管内に気管内弾性カテーテル(21 G)を挿入します。
- マウスが自然発生的に(通常の100〜150呼吸/分、ない逆説的または浅い呼吸)がスムーズな方法で呼吸していることを確認してください。
- 解剖顕微鏡下で発生しやすい位置にマウスを置きます。
- 機械的にげっ歯類人工呼吸器(150呼吸/分、7ミリリットル/ kgの一回換気量)を使用して、マウスを換気する。
- 4 番目と5 番目の肋骨の間の肋間スペースを見つけるために肋骨を数える。
- エリアBの上に無菌のフィールドを作成します。yは徹底的にアルコールやポビドンヨードで拭く。無菌の外科用ドレープで適切に手術野をカバーしています。
3.マウスの手術
- 皮膚の0.25%ブピバカイン(200μl)を局所注射した後、解剖ハサミを使用して、肋間空間にわたって横断皮膚切開(約1cm長)を作る。
- 肋間筋に0.25%ブピバカイン(200μL)を注入した後、細かい小さなハサミを使用して4 番目と5 番目の肋骨の間の筋肉の切開を作る。
- 完全に左肺を可視化するために、リブの間の解剖リトラクターを挿入します。
- 細かい鉗子を使用して、左肺の中央の臓側胸膜の小さな領域(1×1mm角)をこすり。
- 出血や空気の漏れが完全に制御されるまで滅菌綿棒を使用して領域に穏やかな圧力を適用します。
- フィブリノゲン/トロンビン(フィブリン糊)の新鮮な混合物(ステップ1.1.2。20&#少量を入れて181、p200とピペットチップを使用して領域にわたってリットル)。
- 優しくエリア( 図1b)の上に小さな鉗子を用いて1フィブリンゲル(ステップ1.2)を配置。
- ゲルが十分に肺の呼吸運動中にエリア上に固定されていることを確認します。
- どちらも大規模な空気漏れや肺からの出血があることを確認してください。
- 削除する必要はありません吸収性縫合糸、との緊密な切開(筋肉と皮膚層)。
- 気胸を防ぐために27 G針および1mlシリンジを使用して胸腔を吸引する。
- 機械的な換気を終了します。
4.マウスの回復
- マウスが自然発生的にスムーズな方法(定期的な100〜150呼吸/分、ない逆説的または浅い呼吸)で呼吸していることを確認してください。
- IP脱水を防ぐために、予め温めておいた0.9%のNaClを1ml注入する。
- マウスは、循環温水パッド上で回復できるようにする。
- endotracheを削除マウスが安定した呼吸を持っていることを確認した後、他のチューブ。
- 術後の鎮痛剤として3日間、メロキシカム(5 mg / kgを皮下注射(SC)を注入する。
- それは(その胃の上にロールバックすることが可能と直立のまま)胸骨で、意識的になるまで丁寧に15分間隔の最小のマウスの動きを監視します。
- 回復後、手術をせずにマウスから単離された新しいケージにマウスを返す。
- 毎日、以下の感染の兆候(発赤、腫脹、放電)、動物の基本的な生物学的機能(食品や水の摂取、排尿、排便、体重増加)だけでなく、臨床徴候苦痛のための手術部位(立毛、縮小運動)を監視外科的手技。
5.収穫肺
- 7〜30日間、移植後、圧縮ガスの供給源を介してCO 2を使用して、マウスを安楽死させる。
- 剣状突起の先端と胸骨の間に切開を作るノッチ(胸骨正中切開)と気管を切断し、心臓、肺、気管へのすべての接続を解剖することにより組織学的および生化学分析のために注入されたゲルと収穫肺全体。
- 、、4℃で一晩、4%パラホルムアルデヒド溶液で肺に移植されたゲルを固定OCT化合物に埋め込み、厚さ30μmの連続段部を取る。
- 共焦点顕微鏡22,37,40を使用して(アクアポリン(AQP)5と界面活性タンパク質(SP)-B:CD31、上皮マーカー内皮マーカー)組織学的(ヘマトキシリン及びエオシン染色)および免疫組織化学的分析を実行します。
- 3D画像解析ソフトウェア37を使用して、肺の内皮および上皮細胞の三次元画像を形成する光学切片(厚さ30μm)のスタックをコンパイルする。
- 画像解析ソフトウェア46を使用して、新しく形成された血管の投影面積を定量化する。
結果
ホスト肺由来の血管形成は、肺に移植生体材料の中に要約されているかどうかを調べるために、主要な血管新生因子のVEGFおよびbFGF(0、10および100ng / mlの各)を補充したフィブリンゲルのように生きたマウスの肺の表面に移植したマトリゲル22を用いて報告した。 図1aに示すように、これらの血管新生増殖因子を含むフィブリンゲル47を作製した。開胸後、左肺表面の小さな領域は、鉗子を用いて掻き取り、そして製造されたフィブリンゲルは、FDAが承認され、広く停止させる効果的なシール材として使用されるフィブリン接着剤の少量を用いて、成体マウスの肺に移植した空気漏れや肺手術48,49( 図1b)の出血減らす。ほとんどのマウスは、重篤な呼吸器症状( 例えば 、気胸、呼吸困難)することなく回復した。七日、移植後、マウスを安楽死させ、肺をハーヴあったSTED。注入されたフィブリンゲルは、7日間注入( 図1c)の後に、宿主の肺に取り込まれた。共焦点蛍光画像の3D再構成は、VEGF / bFGFの用量依存的( 図2a、c)で7日間注入した後のゲルの内部に血管網を形成し、その宿主由来CD31陽性内皮細胞を示している。タイプI(AQP5陽性)及 びタイプII(SP-B陽性)肺上皮細胞は、VEGFおよびbFGF(各100 ng / ml)を( 図2a)のより高い濃度で添加したゲル内部に新しく形成された血管に沿って集められた。組織学的切片のH&E染色は、宿主細胞の他のタイプもまた( 図2b)7日移植後にゲル中に移動していることを明らかにした。これらの知見は、ホスト肺由来の再生血管網が正常血管新生因子を補充し、大人のMOUの表面に注入されるフィブリンゲルの中に構築されていることを示唆しているSE肺。
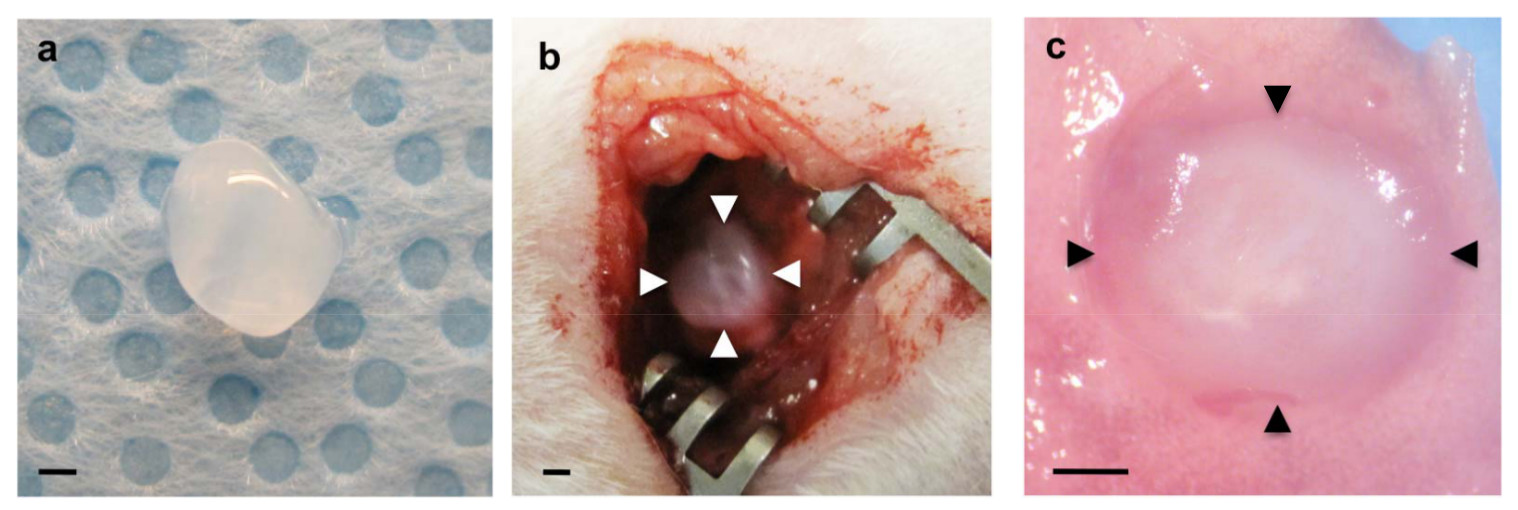
図1(a)は、フィブリンゲルは、移植前に準備7日移植後の宿主の肺に組み込ま(b)は、フィブリンゲルの左肺 (矢印)の掻き臓側胸膜の上に移植(c)に移植フィブリンゲル(矢頭)。スケールバーは1mmである。
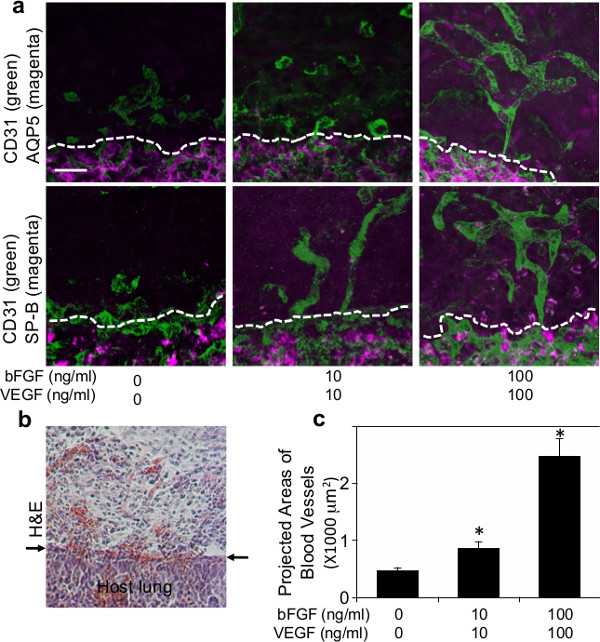
図2は、(a)は 、血管ネットワークの形成を示す蛍光顕微鏡写真(CD31ポジティブ;緑)および動員タイプI(AQP5陽性;マゼンタ)またはタイプII(SP-Bの正、マゼンタ)フィブリンゲル内部の肺上皮細胞を補充したVEGFおよびbFGFの種々の濃度(7日移植後0,10および100ng / mlの各)。破線は、移植されたフィブリンゲルとホスト肺との間のインターフェースを示している。スケールバー:20μmの(b)は 7日、移植後、フィブリンゲル中に宿主細胞の浸潤を示すH&E染色の光顕微鏡写真。矢印は、ゲルとホスト肺の間のインタフェースを示している。スケールバー:20μmの7日間、移植後VEGFおよびbFGF(0,10および100ng / mlのそれぞれ)の種々の濃度で補充されたフィブリンゲル中で新たに形成された血管の投影面積を示す(c)のグラフ。
ディスカッション
この記事では、成体マウスの生体の肺表面上の生体材料を注入するための新しい方法を紹介します。このシステムでは、ホスト肺由来の血管新生は、正常に材料内部に要約されている。このシステムは、研究者は内皮細胞、他の細胞( 例えば 、上皮細胞、間葉系細胞、免疫細胞)とローカル血管新生50〜53と肺胞の再生24,54のために必要とされる様々なECM成分の間のクロストークを探索することができます。従来のin vivoでの皮下ヒドロゲル移植は、血管新生の研究37-39に広く使用されてきたが、これらの方法は、器官特異的血管形成を再現しない。ヒドロゲルは、肺表面に直接移植されるこのシステムは、成体マウスの肺における血管形成および肺再生における肺特異的微小環境の役割を探求する研究者を可能にする。これらのゲルは、様々なECMに富むbiomateから製造することができるリアル種々の化学的因子( 例えば 、血管新生因子、成長因子)55,56、前駆細胞および/ またはiPS細胞を補充することができる( 例えば 、コラーゲン、フィブリン)。化学的要因に加えて、機械的な力は、血管新生23,37を制御する。フィブリノーゲン濃度依存的に57と化学的シグナルを介してだけでなく、物理的な手がかり58,59を介してだけでなく、血管新生に影響を与える可能性フィブリノーゲン濃度を操作することで、フィブリンゲルの剛性が変化する。したがって、フィブリンゲルの物理化学的性質は、将来的に生理的な器官特異血管新生を再現するために慎重に最適化する必要があるかもしれない。臓側胸膜掻き取り後の創傷治癒はまた、宿主細胞の種々のタイプを含み、治癒過程および組織再生を促進する内因性フィブリン塊を生成する。この天然の血餅は、外因的に移植フィブリンゲルと相互作用し、したがって、アンギオを制御することができる。移植されたゲル中の創世記。蛍光標識されたフィブリノーゲンは、天然のフィブリン塊と移植フィブリンゲルを区別し、これらのメカニズムを探索する研究者を可能にすることができる。これは、新生仔マウスだろう可能性本技術課題で肺の発達および疾患の研究に成体マウスの肺における血管新生、アプリケーションを特徴付けるための強力な方法であるが。
この研究の最終目標は、疾患、肺に移植フィブリンゲルに機能的血管を動員すると機能肺の構造を復元するために医療機器のようなマトリックスを使用することである。可能性のあるゲル内部の宿主細胞および血管および歯槽構造物との間の通信だけでなく、これらの構造の機能は、将来の実験で検討されるべきである。肺におけるVEGFレベルはBPD 60および肺気腫61を有する患者において減少しているため、マトリックスにVEGFを添加して、マトリックス独自の実装に血管の動員を改善することができるこれらの病気の肺にanted。機械的性質はまた、健康と病気の肺23,62の間で異なる。例えば、コラーゲンの分解と架橋を制御するマトリックスメタロプロテイナーゼおよびリジルオキシダーゼの発現は、それぞれ、COPD、および肺線維63-67を含む様々な肺疾患において変化している。病気の肺では、肺の内皮細胞および上皮細胞前駆細胞の特定の系統は68を枯渇されている。したがって、これらの要因を操作する(血管新生因子、ECMは、ECMの剛性)、または69前駆細胞を補充注入フィブリンゲルは、おそらく様々な病的状態における肺機能のマトリックスと回収内部機能的血管の形成につながる。化学的因子が局所血管新生を調節するためにフィブリンゲルの内部に補充することができるので、このシステムはまた、慢性肺疾患における病的な肺を正常化することができる特定の環境信号を探索に利用することができる。
要約すると、この記事では、in vivoで肺特異的血管形成を特徴づけるために、研究者を可能にする、生きたマウスの肺の表面にフィブリンヒドロゲルを移植する方法を紹介します。様々な要因の修飾( 例えば 、経時変化、濃度および血管新生因子の組合せは、ヒドロゲルの様々な種類のヒドロゲルの物理化学的性質)このシステムでは、肺における血管新生および再生のメカニズムを明らかにするであろう。したがって、このシステムは、かなり基本的な血管生物学、組織工学、ならびに肺医学の科学的知識を進む。
開示事項
The authors declare that they have no competing financial interests.
謝辞
この作品は、米国心臓協会(AM)、米国国防総省(BC074986)、ボストン小児病院学部キャリア開発フェローシップ(TM、AM)からの資金によってサポートされていました。著者は、技術支援のためのアマンダ江とエリザベート江に感謝。
資料
| Name | Company | Catalog Number | Comments |
| Fibrinogen from human placenta | Sigma | F4883 | For fabrication of fibrin gel |
| Thrombin from bovine plasma | Sigma | T9549 | For fabrication of fibrin gel |
| Recombinant mouse VEGF 164 | R&D | 493-MV | For supplementation to fibrin gel |
| Recombinant mouse bFGF | R&D | 3139-FB | For supplementation to fibrin gel |
| Rodent Intubation Stand | Braintree Scientific INC | RIS 100 | For intubation |
| Fiber-Optic Light Source | Fisher Scientific | 12-565-35 | For intubation |
| 21 G Elastic catheter | B.Braun | 4251652-02 | For intubation |
| MiniVent Ventilator | Harvard Apparatus | CGS-8009 | For ventilation |
| Stemi DV4 Steromicroscope | Fisher Scientific | 12-070-515 | For surgey |
| Absobable suture | Ethicon | PDP304 | Surgical suture |
| Antibody against CD31 | BD Biosciences | 553370 | Immunohistochemistry |
| Antibody against AQP5 | Abcam | AB78486 | Immunohistochemistry |
| Antibody against SP-B | Abcam | AB40876 | Immunohistochemistry |
参考文献
- Donaldson, G. C., Seemungal, T. A., Bhowmik, A., Wedzicha, J. A. Relationship between exacerbation frequency and lung function decline in chronic obstructive pulmonary disease. Thorax. 57, 847-852 (2002).
- Lopez-Campos, J. L., Calero, C., Quintana-Gallego, E. Symptom variability in COPD: a narrative review. Int J Chron Obstruct Pulmon Dis. 8, 231-238 (2013).
- Ley, B., Collard, H. R., King, T. E. Clinical course and prediction of survival in idiopathic pulmonary fibrosis. Am J Respir Crit Care Med. 183, 431-440 (2011).
- Ferrer, M., et al. Chronic obstructive pulmonary disease stage and health-related quality of life. The Quality of Life of Chronic Obstructive Pulmonary Disease Study Group. Ann Intern Med. 127, 1072-1079 (1997).
- Reardon, J. Z., Lareau, S. C., ZuWallack, R. Functional status and quality of life in chronic obstructive pulmonary disease. Am J Med. 119, 32-37 (2006).
- De Vries, J., Kessels, B. L., Drent, M. Quality of life of idiopathic pulmonary fibrosis patients. Eur Respir J. 17, 954-961 (2001).
- Sullivan, S. D., Ramsey, S. D., Lee, T. A. The economic burden of COPD. Chest. 117, 5S-9S (2000).
- Orens, J. B., Garrity, E. R. General overview of lung transplantation and review of organ allocation. Proc Am Thorac Soc. 6, 13-19 (2009).
- Benden, C. Specific aspects of children and adolescents undergoing lung transplantation. Curr Opin Organ Transplant. 17, 509-514 (2012).
- Lyu, D. M., Zamora, M. R. Medical complications of lung transplantation. Proc Am Thorac Soc. 6, 101-107 (2009).
- Trulock, E. P., et al. Registry of the International Society for Heart and Lung Transplantation: twenty-fourth official adult lung and heart-lung transplantation report-2007. J Heart Lung Transplant. 26, 782-795 (2007).
- Weiss, D. J. Current status of stem cells and regenerative medicine in lung biology and diseases. Stem Cells. 32, 16-25 (2013).
- Ghaedi, M., et al. Human iPS cell-derived alveolar epithelium repopulates lung extracellular matrix. J Clin Invest. 123, 4950-4962 (2013).
- Ott, H. C., et al. Regeneration and orthotopic transplantation of a bioartificial lung. Nat Med. 16, 927-933 (2010).
- Petersen, T. H., et al. Tissue-engineered lungs for in vivo implantation. Science. 329, 538-541 (2010).
- Tuyl, M., et al. Angiogenic factors stimulate tubular branching morphogenesis of sonic hedgehog-deficient lungs. Dev Biol. 303, 514-526 (2007).
- Galambos, C., deMello, D. E. Molecular mechanisms of pulmonary vascular development. Pediatr Dev Pathol. 10, 1-17 (2007).
- McGrath-Morrow, S. A., et al. Vascular endothelial growth factor receptor 2 blockade disrupts postnatal lung development. Am J Respir Cell Mol Biol. 32, 420-427 (2005).
- White, A. C., Lavine, K. J., Ornitz, D. M. FGF9 and SHH regulate mesenchymal Vegfa expression and development of the pulmonary capillary network. Development. 134, 3743-3752 (2007).
- Zhao, L., Wang, K., Ferrara, N., Vu, T. H. Vascular endothelial growth factor co-ordinates proper development of lung epithelium and vasculature. Mech Dev. 122, 877-886 (2005).
- Stenmark, K. R., Abman, S. H. Lung vascular development: implications for the pathogenesis of bronchopulmonary dysplasia. Annu Rev Physiol. 67, 623-661 (2005).
- Mammoto, T., et al. LRP5 Regulates Development of Lung Microvessels and Alveoli through the Angiopoietin-Tie2 Pathway. PLoS ONE. 7, e41596(2012).
- Mammoto, T., Jiang, E., Jiang, A., Mammoto, A. ECM structure and tissue stiffness control postnatal lung development through the LRP5-Tie2 signaling system. American Journal of Respiratory Cell and Molecular Biology. 49, 1009-1018 (2013).
- Ding, B. S., et al. Endothelial-derived angiocrine signals induce and sustain regenerative lung alveolarization. Cell. 147, 539-553 (2011).
- Crivellato, E. The role of angiogenic growth factors in organogenesis. Int J Dev Biol. 55, 365-375 (2011).
- Sakurai, M. K., et al. Vascular endothelial growth factor accelerates compensatory lung growth after unilateral pneumonectomy. Am J Physiol Lung Cell Mol Physiol. 292, 742-747 (2007).
- Panigrahy, D., et al. Epoxyeicosanoids promote organ and tissue regeneration. Proc Natl Acad Sci U S A. 110, 13528-13533 (2013).
- Voelkel, N. F., Douglas, I. S., Nicolls, M. Angiogenesis in chronic lung disease. Chest. 131, 874-879 (2007).
- Hanumegowda, C., Farkas, L., Kolb, M. Angiogenesis in pulmonary fibrosis: too much or not enough. Chest. 142, 200-207 (2012).
- Levental, K. R., et al. Matrix crosslinking forces tumor progression by enhancing integrin signaling. Cell. 139, 891-906 (2009).
- Mammoto, A., Mammoto, T., Ingber, D. E. Mechanosensitive mechanisms in transcriptional regulation. J Cell Sci. 125, 3061-3073 (2012).
- Westermann, D., et al. Role of left ventricular stiffness in heart failure with normal ejection fraction. Circulation. 117, 2051-2060 (2008).
- Merchante, N., et al. Liver stiffness predicts clinical outcome in human immunodeficiency virus/hepatitis C virus-coinfected patients with compensated liver cirrhosis. Hepatology. 56, 228-238 (2012).
- Ding, B. S., et al. Inductive angiocrine signals from sinusoidal endothelium are required for liver regeneration. Nature. 468, 310-315 (2010).
- Fidler, I. J. Angiogenic heterogeneity: regulation of neoplastic angiogenesis by the organ microenvironment. J Natl Cancer Inst. 93, 1040-1041 (2001).
- Folkman, J. How is blood vessel growth regulated in normal and neoplastic tissue? G.H.A. Clowes memorial Award lecture. Cancer Res. 46, 467-473 (1986).
- Mammoto, A., et al. A mechanosensitive transcriptional mechanism that controls angiogenesis. Nature. 457, 1103-1108 (2009).
- Malinda, K. M. In vivo matrigel migration and angiogenesis assay. Methods Mol Biol. 467, 287-294 (2009).
- Norrby, K. In vivo models of angiogenesis. J Cell Mol Med. 10, 588-612 (2006).
- Mammoto, T., Jiang, A., Jiang, E., Mammoto, A. Platelet rich plasma extract promotes angiogenesis through the angiopoietin1-Tie2 pathway. Microvasc Res. 89, 15-24 (2013).
- Mosesson, M. W. Fibrinogen and fibrin structure and functions. J Thromb Haemost. 3, 1894-1904 (2005).
- Bensaid, W., et al. A biodegradable fibrin scaffold for mesenchymal stem cell transplantation. Biomaterials. 24, 2497-2502 (2003).
- Teichert-Kuliszewska, K., et al. Biological action of angiopoietin-2 in a fibrin matrix model of angiogenesis is associated with activation of Tie2. Cardiovasc Res. 49, 659-670 (2001).
- Lafleur, M. A., Handsley, M. M., Knauper, V., Murphy, G., Edwards, D. R. Endothelial tubulogenesis within fibrin gels specifically requires the activity of membrane-type-matrix metalloproteinases (MT-MMPs). J Cell Sci. 115, 3427-3438 (2002).
- Collen, A., et al. Aberrant fibrin formation and cross-linking of fibrinogen Nieuwegein, a variant with a shortened Aalpha-chain, alters endothelial capillary tube formation. Blood. 97, 973-980 (2001).
- Mammoto, T., et al. Mechanochemical Control of Mesenchymal Condensation and Embryonic Tooth Organ Formation. Dev Cell. 21, 758-769 (2011).
- Murphy, K. C., Leach, J. K. A reproducible, high throughput method for fabricating fibrin gels. BMC Res Notes. 5, 423(2012).
- Matar, A. F., Hill, J. G., Duncan, W., Orfanakis, N., Law, I. Use of biological glue to control pulmonary air leaks. Thorax. 45, 670-674 (1990).
- Thetter, O. Fibrin adhesive and its application in thoracic surgery. Thorac Cardiovasc Surg. 29, 290-292 (1981).
- Rahbarghazi, R., et al. Juxtacrine and paracrine interactions of rat marrow-derived mesenchymal stem cells, muscle-derived satellite cells, and neonatal cardiomyocytes with endothelial cells in angiogenesis dynamics. Stem Cells Dev. 22, 855-865 (2013).
- Nucera, S., Biziato, D., De Palma, M. The interplay between macrophages and angiogenesis in development, tissue injury and regeneration. Int J Dev Biol. 55, 495-503 (2011).
- Joensuu, K., et al. Interaction between marrow-derived human mesenchymal stem cells and peripheral blood mononuclear cells in endothelial cell differentiation. Scand J Surg. 100, 216-222 (2011).
- Takakura, N. Role of intimate interactions between endothelial cells and the surrounding accessory cells in the maturation of blood vessels. J Thromb Haemost. 9 Suppl 1, 144-150 (2011).
- Plantier, L., Boczkowski, J., Crestani, B. Defect of alveolar regeneration in pulmonary emphysema: role of lung fibroblasts. Int J Chron Obstruct Pulmon Dis. 2, 463-469 (2007).
- Belair, D. G., Murphy, W. L. Specific VEGF sequestering to biomaterials: influence of serum stability. Acta Biomater. 9, 8823-8831 (2013).
- Wong, C., Inman, E., Spaethe, R., Helgerson, S. Fibrin-based biomaterials to deliver human growth factors. Thromb Haemost. 89, 573-582 (2003).
- Stolzing, A., Colley, H., Scutt, A. Effect of age and diabetes on the response of mesenchymal progenitor cells to fibrin matrices. Int J Biomater. 2011, 378034(2011).
- Vailhe, B., Ronot, X., Tracqui, P., Usson, Y., Tranqui, L. In vitro angiogenesis is modulated by the mechanical properties of fibrin gels and is related to alpha(v)beta3 integrin localization. In Vitro Cell Dev Biol Anim. 33, 763-773 (1997).
- Kniazeva, E., Kachgal, S., Putnam, A. J. Effects of extracellular matrix density and mesenchymal stem cells on neovascularization in vivo. Tissue Eng Part A. 17, 905-914 (2011).
- Angio, C. T., Maniscalco, W. M. The role of vascular growth factors in hyperoxia-induced injury to the developing lung. Front Biosci. 7, 1609-1623 (2002).
- Kasahara, Y., et al. Inhibition of VEGF receptors causes lung cell apoptosis and emphysema. J Clin Invest. 106, 1311-1319 (2000).
- Owen, C. A. Roles for proteinases in the pathogenesis of chronic obstructive pulmonary disease. Int J Chron Obstruct Pulmon Dis. 3, 253-268 (2008).
- Demedts, I. K., et al. Elevated MMP-12 protein levels in induced sputum from patients with COPD. Thorax. 61, 196-201 (2006).
- Haq, I., et al. Association of MMP-2 polymorphisms with severe and very severe COPD: a case control study of MMPs-1, 9 and 12 in a European population. BMC Med Genet. 11, 7(2010).
- Mercer, P. F., et al. MMP-9, TIMP-1 and inflammatory cells in sputum from COPD patients during exacerbation. Respir Res. 6, 151(2005).
- Matute-Bello, G., et al. Essential role of MMP-12 in Fas-induced lung fibrosis. Am J Respir Cell Mol Biol. 37, 210-221 (2007).
- Sivakumar, P., Gupta, S., Sarkar, S., Sen, S. Upregulation of lysyl oxidase and MMPs during cardiac remodeling in human dilated cardiomyopathy. Mol Cell Biochem. 307, 159-167 (2008).
- Gomperts, B. N., Strieter, R. M. Stem cells and chronic lung disease. Annu Rev Med. 58, 285-298 (2007).
- Lau, A. N., Goodwin, M., Kim, C. F., Weiss, D. J. Stem cells and regenerative medicine in lung biology and diseases. Mol Ther. 20, 1116-1130 (2012).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved