Method Article
Быстрое Выделение и очистка митохондрий Для трансплантации тканью диссоциации и дифференциальной фильтрации
В этой статье
Erratum Notice
Резюме
Способ быстрого выделения митохондрий из млекопитающих биопсии тканей описан. Печень крысы или скелетные мышечные препараты гомогенизировали с коммерческой диссоциатора ткани и митохондрии были изолированы с помощью дифференциальной фильтрацией через нейлоновое сито фильтров. Митохондриальная время изоляция <30 мин по сравнению с 60 - 100 мин с использованием альтернативных методов.
Аннотация
Ранее описанные способы митохондриальные выделения с использованием дифференциального центрифугирования и / или центрифугирование в градиенте Ficoll требуют от 60 до 100 мин, чтобы закончить. Опишем способ быстрого выделения митохондрий от биопсии млекопитающих с использованием коммерческого диссоциатор тканей и дифференциальный фильтрации. В этом протоколе, руководство гомогенизации заменяется стандартизированной цикла гомогенизации ткани диссоциатора в. Это позволяет единообразно и последовательно гомогенизации ткани, которая не легко достигается с ручным гомогенизации. После диссоциации ткани, гомогенат фильтруют через нейлоновое сито фильтров, которые устраняют повторяющиеся стадии центрифугирования. В результате, митохондриальная изоляция может быть выполнена менее чем за 30 мин. Этот протокол изоляция производится около 2 х 10 10 жизнеспособных и дыхания компетентные митохондрии от 0,18 ± 0,04 г (сырого веса) образца ткани.
Введение
Существуют Митохондрии в каждой клетке тела, кроме эритроцитов и участвуют в большом количестве важных клеточных и метаболических процессов 1-4. Из этих многих функций, повреждение митохондрий может иметь пагубные последствия 3. Для исследования митохондриальной функции и дисфункции несколько митохондриальных методы изоляции были описаны. Самые ранние опубликованные описания митохондриальной даты изоляции до 1940 5-8. Первый документально показано, попытка митохондриальной изоляцию путем измельчения ткани печени в ступке с последующим центрифугированием в солевом растворе с низкой скоростью 5,8. Позже, другие группы расширены оригинальной методике и продемонстрировал тканей фракционирования на основе дифференциального центрифугирования 6-8. Эти ранние методы легли в основу современных методов, которые часто включают гомогенизации и / или дифференциального центрифугирования 9-15. Количество homogenizatiна и центрифугирования шагов варьируется среди протоколов. Эти повторяющиеся стадии увеличить время для митохондриальной изоляции и в конечном итоге сократить жизнеспособность. Кроме того, руководство гомогенизации может привести к повреждению и противоречивые результаты митохондриальные если должным образом не контролируется 10,16.
В последнее время мы использовали гомогенизации и дифференциального центрифугирования изолировать митохондрии для трансплантации в ткани миокарда 17,18. Это длительная процедура изоляции требуется примерно 90 мин и клиническая применимость этого метода был поэтому ограничены. Для обеспечения острой терапевтического применения в клинической и хирургического лечения мы разработали быстрый митохондриальной процедуры выделения, которые могут быть выполнены в менее чем 30 мин.
Основные преимущества этого протокола, что стандартизированный ткани диссоциации позволяет единообразно и последовательно гомогенизации ткани, которая не легко достигается с ручным гомогенизации. В Additионный, использование дифференциального фильтрации вместо дифференциального центрифугирования устраняет много времени и повторяющиеся действия центрифугирования позволяет более быстрого выделения высокоочищенных, жизнеспособных и дыхания компетентных митохондрий.
Возможность изолировать жизнеспособные и дыхания компетентные митохондрии менее чем 30 мин позволяет клинической применимости. Этот протокол изоляция имеет потенциал для использования в аортокоронарное шунтирование операции (АКШ) и других лечебных процедур.
протокол
Подготовка
- Подготовьте 1 М К-HEPES исходного раствора (отрегулировать рН до 7,2 с КОН).
- Подготовить 0,5 М К-EGTA исходного раствора (отрегулировать рН до 8,0 с КОН).
- Подготовьте 1 М KH 2 PO 4 маточного раствора.
- Подготовьте 1 М MgCl 2 маточного раствора.
- Подготовка гомогенизации буфера (рН 7,2) 300 мМ сахарозы, 10 мМ HEPES, К-и 1 мМ К-EGTA. Хранить при 4 ° С.
- Подготовка дыхания буфера 250 мМ сахарозы, 2 мМ КН 2 РО 4, 10 мМ MgCl 2, 20 мМ К-HEPES буфера (рН 7,2) и 0,5 мМ К-EGTA (рН 8,0). Хранить при 4 ° С.
- Подготовка 10x PBS маточного раствора путем растворения 80 г NaCl, 2 г хлористого калия, 14,4 г Na 2 HPO 4 и 2,4 г KH 2 PO 4 в 1 л бидистиллированной H 2 O (рН 7,4).
- Приготовьте 1х PBS с помощью пипетки 100 мл 10x PBS в 1 л бидистиллированной H 2 O.
- Подготовьте Субтилизин запаса путем взвешивания 4 мг субтилизина А вв 1,5 мл пробирке. Хранить при -20 ° С до использования.
- Подготовьте BSA складе путем взвешивания 20 мг BSA в 1,5 мл пробирке. Хранить при -20 ° С до использования.
Митохондриальная Изоляция (Рисунок 1)
- Непосредственно перед изоляции, растворить субтилизина A в 1 мл буфера гомогенизации.
- Непосредственно перед изоляции, растворить БСА в 1 мл буфера гомогенизации.
- Соберите два образца свежей ткани на 6 мм удар образца биопсии и магазин в 1x PBS в 50 мл коническую центрифужную пробирку на льду.
- Передача этих двух 6 мм пуансонами ткани к диссоциации C пробирку, содержащую 5 мл охлажденного льдом буфера гомогенизации.
- Гомогенизируют ткани путем подгонки диссоциации C трубку на ткани диссоциатора и выберите предварительно установленный митохондриальную цикл изоляции (60 сек гомогенизации).
- Снимите диссоциации C трубку к ведерке со льдом.
- Добавить 250 мкл Субтилизин исходного раствора дляГомогенат, перемешать и инкубировать инверсии гомогената на льду в течение 10 мин.
- Поместите сетчатый фильтр 40 мкм на 50 мл коническую центрифужную пробирку на льду и предварительно влажного фильтра с гомогенизации буфера и гомогенат фильтруют в 50 мл коническую центрифужную пробирку на льду.
- Добавить 250 мкл свежеприготовленного BSA маточного раствора в фильтрат и перемешать с помощью инверсии.
Примечание: Пропустите этот шаг, если требуется определение митохондриальной белок. - Поместите 40 мкм фильтр на 50 мл коническую центрифужную пробирку на льду и предварительно влажного фильтра с гомогенизации буфера и гомогенат фильтруют в 50 мл коническую центрифужную пробирку на льду.
- Поместите 10 мкм фильтр на 50 мл коническую центрифужную пробирку на льду и предварительно влажного фильтра с гомогенизации буфера и гомогенат фильтруют в 50 мл коническую центрифужную пробирку на льду.
- Передача фильтрата до двух предварительно охлажденной 1,5 мл микроцентрифужных пробирках и центрифугируют при 9000 х г в течение 10 мин при4 ° C.
- Удалить супернатант и повторно приостанавливать и объединить гранул в 1 мл охлажденного льдом буфера дыхания.
ATP Анализ
Примечание: Для определения метаболической активности митохондрий изолированного АТФ люминесценции анализ может быть выполнен с использованием набора для анализа АТФ. Протокол, реагенты и стандарты были поставлены в комплекте анализа. Краткое описание процедуры описан ниже.
- Равновесие реагенты до комнатной температуры.
- Подготовка 10 мМ АТФ маточного раствора путем растворения лиофилизированного АТФ осадок в 1170 мкл бидистиллированной воды. Храните ATP стандартного раствора со и подготовили митохондриальные образцы на льду.
- Добавить 5 мл раствора субстрата буфера в пробирку лиофилизированного раствора субстрата. Осторожно перемешать и поместить в темноте.
- Добавить 100 мкл дыхания буфера во все лунки черной непрозрачной нижней, 96-луночного планшета.
- Добавить 10 мкл митохондрий от приготовленных образцов в каждую лунку OFA черный, непрозрачный низ, 96-луночный планшет. Примечание: Образцы помещали в трех экземплярах. Включите строку для стандартов и трех скважин для отрицательного контроля (Дыхание буфера).
- Добавить 50 мкл млекопитающих раствора для лизиса клеток во все лунки, в том числе стандарты и управления.
- Инкубируйте планшет при 37 ° С в течение 5 мин на орбитальном шейкере при 125 оборотах в минуту.
- Во время инкубации подготовить стандарты АТФ в концентрации 0,1 мм, 0,05 мм, 0,01 мм, 0,005 мм, 0,001 мм, а 0,0001 мМ АТР от 10 мм АТФ маточного раствора. Магазин стандартов на льду.
- После инкубации добавить 10 мкл стандартов СПС в соответствующие лунки, как указано на тарелке карте. Примечание: Стандарты выполняются в двух экземплярах.
- Добавить 50 мкл восстановленного раствора субстрата в каждую лунку.
- Инкубируйте планшет при 37 ° С на орбитальном шейкере в течение 5 мин при 125 оборотах в минуту.
- Открыть Gen5 1,11 программное обеспечение на компьютере, связанного с спектрофотометра.
- Под "Создать новый элемент ", нажмите на" Эксперимент ".
- Нажмите кнопку "По умолчанию протокола". Нажмите "Ok".
- В левом столбце, выберите "Протокол", затем "Порядок".
- Выберите "Delay". Установите в 00:10:00. Нажмите "Ok".
- Выберите "Read". Выберите "Люминесценция" из выпадающего меню. Отрегулируйте другие настройки на следующее: Читать типа конечной точки, времени интегрирования 0: 01,00 MM: ss.ss, наборы фильтров 1, отверстие выбросов, оптика Позиция Лучшие, чувствительность 100, Топ зонд Смещение по вертикали 1,00 мм.
- Когда пластина готова быть проанализированы, нажмите на значок "Read Plate" в верхнем ряду. Нажмите "Read". Когда откроется спектрофотометр, поместите пластину в лоток а A1 в верхнем левом углу. Коробка с температурой откроется. Нажмите "Read". Примечание: Более высокие значения коррелируют с повышением уровня АТФ и высшего метаболической активности.
Результаты
Фигура изложением процедурные шаги в изоляции митохондрий с помощью ткани диссоциации и дифференциальное фильтрацию показано на рисунке 1. Всего процессуальное время меньше 30 минут.
Образцы тканей были получены с использованием 6 мм биопсии удар. Вес ткани была 0,18 ± 0,04 г (сырой вес). Количество митохондрий, выделенных как определяли путем подсчета частиц по размерам было 2,4 х 10 10 ± 0,1 х 10 10 митохондрии для скелетных мышц и 2,75 х 10 10 ± 0,1 х 10 10 митохондрии для препаратов печени (2А). Для обеспечения сравнения митохондриальной число также определяется гемоцитометре. Митохондриальная число была недооценена как определяется гемоцитометре как 0,11 х 10 10 ± 0,04 х 10 10 митохондрии для скелетных мышц и 0,34 х 10 10 ± 0,09 х 10 10 митохондрии для препаратов печени (Figure 2А). Митохондриальной диаметр, как определяется на основе размера счетчика частиц показан на фиг.2В. Представитель трассировка показывает изолированные митохондрии локализуются под одной пика со средним диаметром 0,38 ± 0,17 мкм в согласии с предыдущими докладами 7.
Митохондриальной белка / г (сырой вес) ткани начинают, как определено бицинхониновой кислоты (BCA) анализа было 4,8 ± 2,9 мг / г (сырой вес) и 7,3 ± 3,5 мг / г (сырой вес) для скелетных мышц и печеночных проб, соответственно (рисунок 2C).
Митохондриальной чистоту определяли с помощью просвечивающей электронной микроскопии и показано на рисунке 2D. Митохондрии показано, что электронно-плотные с менее чем 0,01% быть сломана или повреждена. Загрязнение не-митохондриальных частиц меньше 0,001%.
Митохондриальная жизнеспособность определяется Mitotracker красный как ранее деописано 17,18. Наши результаты показывают, что изолированные митохондрии поддерживать потенциал мембраны (фиг.3А - C).
АТФ определяли, используя люминесцентный набора для анализа. Карта пластина для анализа АТФ показан на рисунке 4. Стандарты ATP высевали в двух экземплярах. Митохондриальные образцы и отрицательные контроли высевали в трех экземплярах. Содержание АТФ был 10,67 ± 4,38 нмоль / мг белка митохондрий и 14,83 ± 4,36 нмоль / мг белка митохондрий для скелетных мышц и печеночных проб соответственно (Рисунок 3D).
Дыхание митохондрий оценивали с помощью электрода Кларка типа, как описано выше 17,18. Митохондриальная скорость потребления кислорода было 178 ± 17 нМ O 2 / мин / мг белка митохондрий для скелетных мышц и 176 ± 23 нМ O 2 / мин / мг белка митохондрий для препаратов печени. Дыхательная Индекс контроль (RCI) значения были 2,45 ± 0,34 вг 2,67 ± 0,17 для скелетных мышц и подготовки проб печени соответственно (Рисунок 3E). Эти результаты аналогичны тем, которые представлены в наших предыдущих исследованиях с использованием ручной гомогенизации и дифференциального центрифугирования изолировать митохондрии 17-18.

Рис.1 Схема для выделения митохондрий с помощью ткани диссоциации и дифференциальное фильтрацию. (А) Передача двух 6 мм биоптата удары в 5 мл гомогенизации буфера в диссоциации C трубки и гомогенизации образцов с помощью программы гомогенизации 1 мин ткани диссоциатора в. (Б) Добавить 250 мкл субтилизина A маточного раствора к гомогената при диссоциации С трубки и инкубировать на льду в течение 10 мин. (С) фильтра гомогената путем предварительного -wetted 40 мкм сетчатый фильтр в 50 мл коническую центрифужную пробирку на льду, а затем добавить 250 мкл исходного раствора БСА к фильтрату. (D) Re-фильтр фильтрата с помощью нового фильтра предварительно увлажненный 40 мкм меш в 50 мл конической центрифуги на льду. (Е) Re-фильтр фильтрат через новый сетчатый фильтр предварительно увлажненный 10 мкм в 50 мл коническую центрифужную пробирку на льду. (F) Перевести фильтрата до 1,5 мл микроцентрифужных пробирках и центрифугируют при 9000 х г в течение 10 мин при 4 ° С. (G) Удалить супернатант и повторно приостанавливать и комбинировать митохондриальные гранулы в 1 мл буфера дыхания. Общее время процедуры составляет менее 30 мин. Пожалуйста, нажмите здесь, чтобы посмотреть увеличенную версию этой фигуры.
д / 51682 / 51682fig2highres.jpg "ширина =" 600 "/>
Рисунок 2. Митохондриальная выход и чистоту. (А) гемоцитометра и размер счетчик частиц митохондрии число изолирован от 0,18 ± 0,04 г ткани (сырой вес) для скелетных мышцах и печени. (В) митохондриальной размер (мг / г) распределение, как обнаружено с помощью счетчика частиц по размерам. (С) белка митохондрий мг / г сырого веса ткани для скелетных мышцах и печени. (D), просвечивающей электронной микроскопии изображение изолированных митохондрий. Шкала бар составляет 100 нм. Стрелки указывают возможное загрязнение организациями не митохондриальных частиц и поврежденных митохондрий. Пожалуйста, нажмите здесь, чтобы посмотреть увеличенную версию этой фигуры.
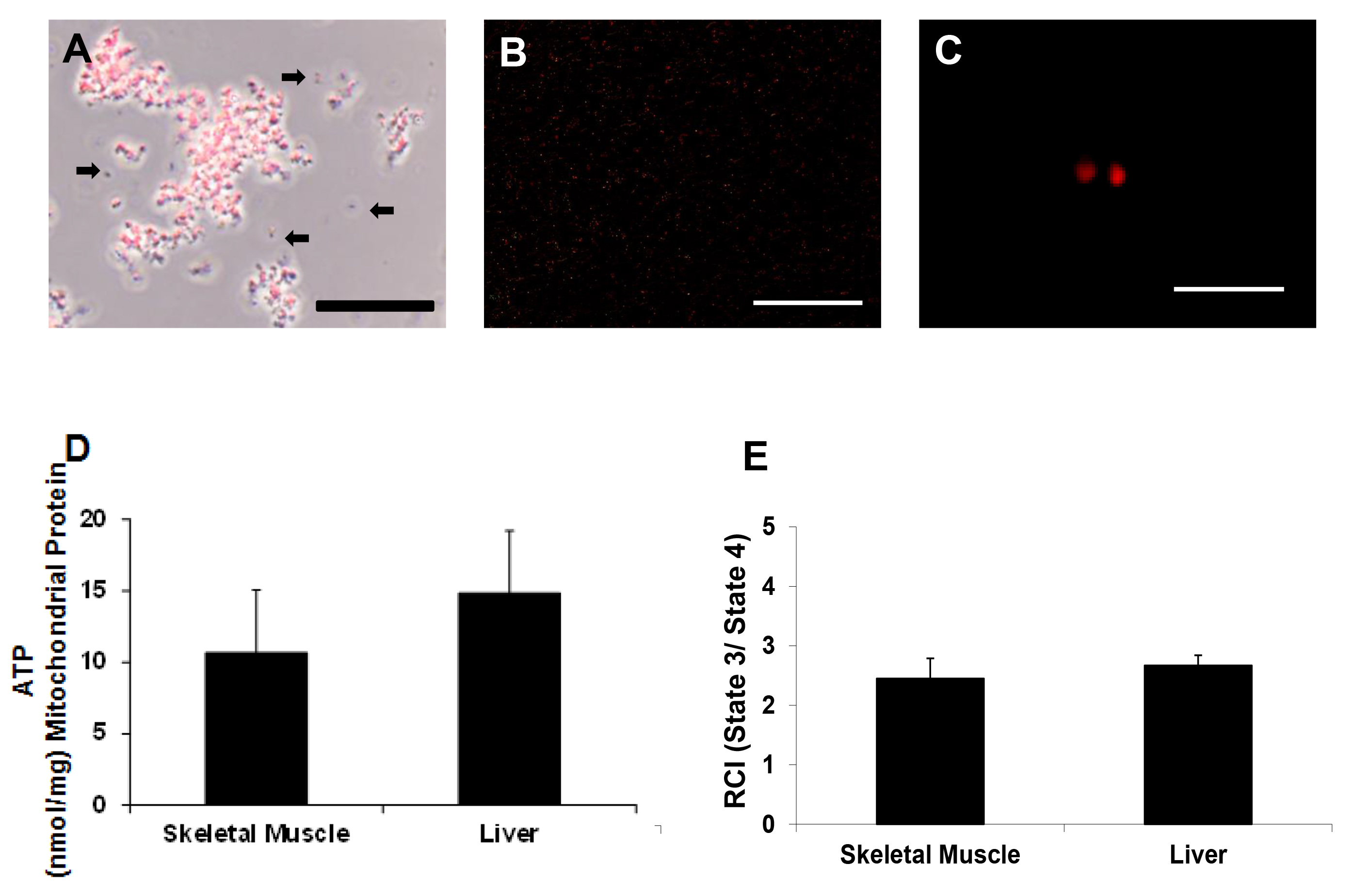 < бр /> Рисунок 3 Митохондриальная жизнеспособность. Представительства микрофотографии изолированных митохондрий (А) в рамках этапа освещения контраста и (В и С) по флуоресценции, с митохондриями, меченных Mitotracker Красной CMXRos. Шкала бары 25 мкм (А, В) и 5 мкм (С). Эти изображения показывают, что митохондрии поддерживается мембранный потенциал. Стрелки указывают митохондрии хватает мембранный потенциал или мусор (D) содержание АТФ нмоль / мг белка митохондрий как определяется анализа АТФ и (E) RCI (состояние 3 / состояние 4), как определено Кларк электрода. Пожалуйста, нажмите здесь, чтобы посмотреть увеличенную версию этот показатель.
< бр /> Рисунок 3 Митохондриальная жизнеспособность. Представительства микрофотографии изолированных митохондрий (А) в рамках этапа освещения контраста и (В и С) по флуоресценции, с митохондриями, меченных Mitotracker Красной CMXRos. Шкала бары 25 мкм (А, В) и 5 мкм (С). Эти изображения показывают, что митохондрии поддерживается мембранный потенциал. Стрелки указывают митохондрии хватает мембранный потенциал или мусор (D) содержание АТФ нмоль / мг белка митохондрий как определяется анализа АТФ и (E) RCI (состояние 3 / состояние 4), как определено Кларк электрода. Пожалуйста, нажмите здесь, чтобы посмотреть увеличенную версию этот показатель.
нагрузка / 51682 / 51682fig4highres.jpg "ширина =" 600 "/>
. Рис.4 Plate карту для АТФ анализе Эта пластина карту иллюстрирует, как установить стандарты (A1 - A12), образцы митохондрии (B1 - C6), и отрицательный контроль (C7 - C9) для анализа АТФ. В ходе анализа 100 мкл буфера дыхания, 50 мкл млекопитающих раствора для лизиса клеток и 50 мкл восстановленного раствора субстрата добавляли во все лунки (А1 - С9).
Обсуждение
Чтобы успешно изолировать митохондрии, используя этот протокол, его необходимо держать все решения и образцы тканей на льду, чтобы сохранить митохондриальную жизнеспособность. Даже тогда, когда поддерживается на льду, изолированные митохондрии будут демонстрировать уменьшение функциональной активности с течением времени 19. Мы рекомендуем, чтобы все решения и дополнения предварительно подготовлены. Мы заранее взвесить и хранить субтилизина А в 4 мг аликвоты в 1,5 мл микроцентрифужных пробирках и хранить их при -20 ° С. Аналогично БСА предварительно взвешивали и хранили в аликвотах 20 мг в 1,5 мл микроцентрифужных пробирках, которые могут храниться при температуре от -20 ° C. Непосредственно перед использованием трубки удаляются от -20 ° C и субтилизина и БСА растворяют в 1 мл буфера гомогенизации для использования в процессе выделения митохондрий.
Два биопсии удары от скелетной мышечной ткани получены с использованием 6 мм биопсии удар предоставить достаточные митохондрии для использования в клинических и хирургических процедур для терапевтических вмешательств 17-18. Чтобы оценить количество митохондрий, которые мы использовали два метода, считая размер гемоцитометра и частиц. Использование подсчета частиц по размерам рекомендуется. Размер частиц счетчик использует электрический импеданс для измерения объема частиц, проходящих через отверстия определенного размера. Размер частиц счетчик является дорогостоящим, но обеспечивает точные и надежные оценки и не зависит пользователь. Митохондриальная число оценивается hemocytometry является более экономичным. Наши исследования показали, что этот метод предоставляет различные оценки, которые примерно на порядок меньше, чем полученная с использованием частиц по размерам счетчик. Мы также отметили, что на счету полученные гемоцитометре сильно зависят от пользователя. Мы полагаем, что для обеспечения согласованных оценок всем пунктам, использующие гемоцитометра должны быть выполнены одним человеком.
Мы нашли комплекты опробования АТФ, чтобы быть полезным для определения функции митохондрий. В комплект поставки всю необходимую гeagents и обеспечивает простой и быстрый способ определения метаболической активности изолированных митохондрий. Анализ АТФ обеспечивает аналогичные результаты, как те, получены с использованием Кларк-типа электрода и, следовательно, совместим с предыдущим анализом данных 20-21.
Основным преимуществом нашего протокола изоляции митохондриальной является то, что она позволяет для изоляции высоким выходом жизнеспособных, дыхание компетентных митохондрий, свободных от загрязнения в менее 30 мин. Дифференциальный фильтрации вместо дифференциального центрифугирования значительно сокращает время процедуры. Другие протоколы включают несколько этапов центрифугирования с общее время изоляция будучи 60 мин до 100 мин 13-17. Еще одно преимущество этого протокола является то, что ткани гомогенизации стандартизирован. Диссоциатор коммерческий ткани обеспечивает стандартизированный цикл и дает последовательные и воспроизводимые результаты. Это в отличие от ручной гомогенизации, которая подлежит изменчивости пользователя инепоследовательность. Наш метод для быстрого выделения митохондрий с помощью ткани диссоциации и дифференциальное фильтрацию обеспечивает изоляцию сроки, соответствующие для клинической и хирургической терапевтического вмешательства 17,18.
Раскрытие информации
Все животные были обработаны в соответствии с действующими институциональных принципов. У нас нет никаких конкурирующих финансовых интересов раскрывать.
Благодарности
Это исследование было поддержано Национальным сердца, легких и крови институт Грант HL- 103542, и заслуженный Trailblazer Award МПБ Анестезия Фонда Исследования к CAP.
Материалы
| Name | Company | Catalog Number | Comments |
| Sucrose | Sigma Aldrich | 84100 | |
| HEPES | Sigma Aldrich | H4034 | |
| EGTA | Sigma Aldrich | E4378 | |
| Substilsin A | Sigma Aldrich | P5380 | |
| BSA | Sigma Aldrich | A7906 | |
| KH2PO4 | Sigma Aldrich | P5379 | |
| MgCl2 | Sigma Aldrich | M8266 | |
| NaCl | Sigma Aldrich | S6191 | |
| KCl | Fisher Scientific | P2173 | |
| Na2HPO4 | Fisher Scientific | S374 | |
| ATPlite Luminescence Assay System, 1,000 Assay Kit | Perkin Elmer | 6016941 | |
| 50 ml Conical Tubes | BD | 352098 | |
| 40 μm Nylon Filters | BD | 352340 | |
| GentleMACS C tube | Miltenyl Biotech | 120-005-331 | |
| 1.5 ml Eppendorf tube | Fisher Scientific | 05-408-129 | |
| 6 mm biopsy punch | Miltex | 33-36 | |
| 10 μm Pluristrainer | Pluriselect | 43-500-10-03 | |
| Eppendorf Centrifuge 5415C | Marshall Scientific | EP-5415C | |
| GentleMACS Dissociator | Miltenyl Biotech | 130-093-235 | |
| 96-well plates, tissue culture treated | VWR | 82050-732 | |
| Rotomax 120 orbital shaker | Heidolph | 544-41200-00 | |
| Synergy H4 Hybrid Multi-Mode Microplate Reader | BioTek | ||
| Multisizer 4 Coulter Counter | Beckman Coulter | A63076 | |
| Oxytherm System | Hansatech Instruments | ||
| Hemacytometer | Fisher Scientific | 267110 |
Ссылки
- van Loo, G., Saelens, X., van Gurp, M., MacFarlane, M., Martin, S. J., Vandenabeele, P. The role of mitochondrial factors in apoptosis: a Russian roulette with more than one bullet. Cell Death Differ. 9 (10), 1031-1042 (2002).
- Szabadkai, G., Duchen, M. R. Mitochondria: the hub of cellular Ca2+ signaling. Physiology (Bethesda). 23, 84-94 (2008).
- Chan, D. C. Mitochondria: Dynamic Organelles in Disease, Aging, and Development. Cell. 125 (7), 1241-1252 (2006).
- Picard, M., et al. Mitochondrial structure and function are disrupted by standard Isolation methods. PLoS ONE. 6 (3), e18317(2011).
- Bensley, R. R., Hoerr, N. Studies on cell structure by freeze-drying method; preparation and properties of mitochondria. Anat Rec. 60, 449-455 (1934).
- Claude, A. Fractionation of mammalian liver cells by differential centrifugation II. Experimental procedures and results. J Exp Med. 84 (1), 61-89 (1946).
- Hogeboom, H., Schneider, W. C., Palade, G. E. Cytochemical studies of mammalian tissues; isolation of intact mitochondria from rat liver; some biochemical properties of mitochondria and submicroscopic particulate material. J Biol Chem. 172 (2), 619-635 (1948).
- Ernster, L., Schtaz, G. Mitochondria: a historical Review. J Cell Biol. 91 (3 Pt 2), 227s-255s (1981).
- Pallotti, F., Lenaz, G. Isolation and subfractionation of mitochondria from animal cells and tissue culture lines. Methods Cell Biol. 80, 3-44 (2007).
- Schmitt, S., et al. A semi-automated method for isolating functionally intact mitochondria from cultured cells and tissue biopsies. Anal Biochem. 443 (1), 66-74 (2013).
- Fernández-Vizarra, E., Ferrín, G., Pérez-Martos, A., Fernández-Silva, P., Zeviani, M., Enríquez, J. A. Isolation of mitochondria for biogenetical studies: An update. Mitochondrion. 10 (3), 253-262 (2010).
- Graham, J. M. Chapter 3, Unit 3.3, Isolation of mitochondria from tissues and cells by differential centrifugation. Curr Protoc Cell Biol. , (2001).
- Frezza, C., Cipolat, S., Scorrano, L. Organelle isolation: functional mitochondria from mouse liver, muscle and cultured fibroblasts. Nat Protoc. 2 (2), 287-295 (2007).
- Wieckowski, M. R., Giorgi, C., Lebiedzinska, M., Duszynski, J., Pinton, P. Isolation of mitochondria-associated membranes and mitochondria from animal tissues and cells. Nat Protoc. 4 (11), 1582-1590 (2009).
- Gostimskaya, I., Galkin, A. Preparation of highly coupled rat heart mitochondria. J Vis Exp. (43), (2010).
- Gross, V. S., et al. Isolation of functional mitochondria from rat kidney and skeletal muscle without manual homogenization. Anal Biochem. 418 (2), 213-223 (2011).
- Masuzawa, A., et al. Transplantation of autologously derived mitochondria protects the heart from ischemia-reperfusion injury. American J Physiol Heart and Circ Physiol. 304 (7), (2013).
- McCully, J. D., et al. Injection of isolated mitochondria during early reperfusion for cardioprotection. American J Physiol Heart and Circ Physiol. 296 (1), 94-105 (2009).
- Olson, M. S., Von Korff, R. W. Changes in endogenous substrates of isolated rabbit heart mitochondria during storage. J Biol Chem. 242 (2), 325-332 (1967).
- Diepart, C., et al. Comparison of methods for measuring oxygen consumption in tumor cells in vitro. Anal Biochem. 396 (2), 250-256 (2010).
- Lanza, I. R., Nair, K. S. Functional assessment of isolated mitochondria in vitro. Methods Enzymol. 457, 349-372 (2009).
Erratum
Formal Correction: Erratum: Rapid Isolation And Purification Of Mitochondria For Transplantation By Tissue Dissociation And Differential Filtration
Posted by JoVE Editors on 1/05/2016. Citeable Link.
A correction was made to: Rapid Isolation And Purification Of Mitochondria For Transplantation By Tissue Dissociation And Differential Filtration. An optional step was added to step 7 of the 'Mitochondrial Isolation' section of the protocol. The step is:
1. Optional in the case that the tissue is fibrous: Centrifuge the solution at 750 x g for 4 min.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены