Method Article
快速分离纯化线粒体移植用组织分离和鉴别过滤
Erratum Notice
摘要
一种用于线粒体的从哺乳动物组织活检快速分离方法进行说明。大鼠肝或骨骼肌肉制剂匀浆与商业组织离解和线粒体是通过尼龙网过滤分离差过滤。线粒体隔离时间是相对于60 <30分钟 - 用替代的方法100分钟。
摘要
使用差速离心和/或聚蔗糖梯度离心之前描述的线粒体分离方法需要60至100分钟内完成。我们描述了线粒体利用商业组织离解和鉴别过滤哺乳动物的活组织切片检查的快速提取方法。在这个协议中,手动均化置换为组织离解的标准化的均匀化周期。这使得均匀和组织的一致均质化是不容易用手工匀化来实现的。以下组织离解,在匀浆通过尼龙网过滤器,它消除重复离心步骤过滤。其结果是,线粒体隔离可以在不到30分钟来进行。此隔离协议产生约2×10 10活和呼吸从0.18±0.04克(湿重)的组织样品主管线粒体。
引言
存在的每一个细胞在体内除了红血细胞中的线粒体,并参与了大量重要的细胞代谢过程1-4。由于这些诸多功能,线粒体损伤可能具有不利的影响3。为了研究线粒体功能和功能障碍的若干线粒体的分离方法进行了描述。线粒体隔离日至1940年5-8最早公布的帐目。第一次记录尝试通过研磨肝组织在研钵中,然后离心以盐溶液在低速5,8证实线粒体隔离。后来,其他群体扩大后,原来的程序,证明组织分离的基础上差速离心6-8。这些早期方法形成的电流的技术,往往掺入均质化,和/或差速离心9-15的基础。 homogenizati数并离心步骤不同协议之间。这些重复的步骤,增加了时间线粒体隔离,并最终降低的可行性。此外,手动均化可引起线粒体损伤和不一致的结果,如果没有适当的控制,10,16。
最近,我们使用的同质化和差速离心分离线粒体移植到心肌组织17,18。这个冗长分离过程需要约90分钟,该方法的临床适用性因此受到限制。要允许在临床和手术治疗急性治疗用途,我们已经开发出可以在不到30分钟内完成快速的线粒体分离过程。
该协议的主要好处是标准化的组织分解允许统一和组织的一致同质化是不容易用手工同质化来实现的。在乳房清洁度离子,代替差速离心的使用微分过滤消除了耗时的和重复离心步骤,允许对高度纯化的,可行的和呼吸能力的线粒体的更快速分离。
隔离可行和呼吸主管线粒体在不到30分钟的能力允许临床应用。这种隔离协议有潜力的冠状动脉旁路移植术(CABG)和其他治疗程序中使用。
研究方案
准备
- 制备的1M K-HEPES溶液(pH调节至7.2,用KOH)。
- 制备0.5M的K-EGTA溶液(调节pH值至8.0,用KOH)。
- 制备的1M KH 2 PO 4的储备溶液。
- 准备1米氯化镁储备溶液。
- 制备均质缓冲液(pH 7.2)中300mM的蔗糖,10mM的K-HEPES,和1mM K-EGTA。保存在4℃。
- 制备呼吸缓冲液250mM的蔗糖,2mM的KH 2 PO 4,10mM的MgCl 2的,20mM的K-HEPES缓冲液(pH值7.2)和0.5mM的K-EGTA(pH 8.0)中。保存在4℃。
- 制备10倍的PBS原液溶解80克的NaCl,2克的KCl,14.4称量Na 2 HPO 4,和2.4克KH 2 PO 4加入到1 L双蒸H 2 O的 (pH 7.4)中。
- 吹打百毫升10X PBS为1升双蒸H 2 O准备1X PBS
- 准备枯草杆菌蛋白酶A股称重在4毫克枯草杆菌蛋白酶A的以1.5 ml离心管中。储存在-20℃直到使用。
- 准备BSA股票称取20毫克的BSA为1.5 ml离心管中。储存在-20℃直到使用。
线粒体的分离(图1)
- 紧接隔离,溶解枯草杆菌蛋白酶A在1毫升均质缓冲液。
- 紧接隔离,BSA溶解在1毫升均质缓冲液。
- 使用6毫米活检样本冲和存储在1X PBS在冰50毫升离心管中收集两个新鲜组织标本。
- 转移组织两个6毫米拳含有5ml冰冷的均质缓冲液的分离Ç管。
- 由嵌合在组织离解的离解Ç管均质化的组织,并选择预先设定的线粒体隔离周期(60秒均化)。
- 拆下分离ç管冰桶。
- 加入250μl的枯草杆菌蛋白酶原液的匀浆,通过倒置混合,并培育在冰上匀浆10分钟。
- 放置一个40微米的筛网过滤器上的冰和预湿的过滤器以均质缓冲液50ml锥形离心管中,并过滤匀浆成冰的50ml锥形离心管中。
- 加入250微升新鲜制备的BSA储备液,向滤液并通过倒置混合。
注:省略这一步,如果需要线粒体蛋白的决心。 - 放置一个40微米的过滤器上的冰和预湿的过滤器以均质缓冲液50ml锥形离心管中,并过滤匀浆成冰的50ml锥形离心管中。
- 放置一个10微米的过滤器上的冰和预湿的过滤器以均质缓冲液50ml锥形离心管中,并过滤匀浆成冰的50ml锥形离心管中。
- 将滤液转移到2预冷1.5毫升离心管和离心9000 xg离心10分钟4ºC。
- 除去上清液并重新悬浮和结合粒料在1ml冰冷的呼吸缓冲液。
ATP含量
注意:要确定分离线粒体的ATP荧光检测可以用一个ATP检测试剂盒进行的代谢活动。的协议,试剂和标准的测定试剂盒提供。的流程的概要进行说明。
- 平衡试剂盒至室温。
- 准备10毫摩尔ATP原液在1170微升双蒸水溶解冻干ATP的颗粒。储存的ATP冰上标准储备液,准备线粒体样本。
- 加入5毫升底物缓冲溶液,以冻干底物液的小瓶中。轻轻摇匀后放置在黑暗中。
- 加入100μl呼吸缓冲液至黑色,不透明的底部,96孔板的所有孔中。
- 从所制备的样品中添加10微升线粒体向每个孔ø发黑色,不透明的底部,96孔板中。注:样品被镀以一式三份。包括行的标准,三口井为阴性对照组(呼吸缓冲器)。
- 加入50微升的哺乳动物细胞溶解液到所有孔中,包括标准和控制。
- 孵育板在37℃5分钟,在定轨摇床上以125转每分钟。
- 在孵育制备的0.1毫米,0.05毫米,0.01毫米,0.005毫米,0.001毫米,和0.0001毫摩尔ATP从10毫摩尔ATP储备溶液浓度的ATP标准。商店的标准在冰上。
- 温育后,加入10微升的三磷酸腺苷标准,以相应的孔中的板图上标明。注意:标准进行双份。
- 加入50微升重组的底物溶液的各孔中。
- 孵育板在37℃在定轨振荡器进行5分钟,在125转每分钟。
- 打开GEN5 1.11软件与分光光度计相连的计算机上。
- 在"创建新项目",点击"实验"。
- 点击"默认协议"。单击"确定"。
- 在左侧列中,选择"协议",然后选择"程序"。
- 选择"延迟"。设置为00:10:00。单击"确定"。
- 选择"读取"。从下拉菜单中选择"发光"。调整其他设置如下:读取类型的端点,积分时间0:01.00 MM:SS.SS,过滤器设置1,发射孔,光学部位顶部,感光度100,顶探头垂直偏移1.00毫米。
- 当板已准备好进行分析,点击最上面一排的"阅读板块"图标。点击"读取"。当分光光度计打开后,将板与A1孔在左上角的托盘。随着温度的对话框将打开。点击"读取"。注:值越高,关联与增加ATP水平和较高的代谢活动。
结果
一个数字,概述采用组织分离和鉴别过滤线粒体的隔离程序步骤如图1。总过程时间小于30分钟。
组织样品用6毫米活检穿孔获得。组织的重量为0.18±0.04克(湿重)。线粒体分离为通过粒径数量确定的数目为2.4×10 10±0.1×10 10线粒体对骨骼肌和2.75×10 10±0.1×10 10线粒体肝制剂( 图2A)。以允许比较线粒体数目也通过血细胞计数器确定。线粒体的数量被低估了血球的0.11厘定×10 10±0.04×10 10线粒体骨骼肌和0.34×10 10±0.09×10 10线粒体肝制剂(Figure 2A)。线粒体直径为通过基于大小的粒子计数器测定示于图2B中 。代表跟踪示出的分离的线粒体中被下一个峰为0.38±0.17微米的协议平均直径与以前的报告7本地化。
线粒体蛋白/克(湿重)起组织如通过二喹啉甲酸(BCA)测定法测定为4.8±2.9毫克/克(湿重)和7.3±3.5毫克/克(湿重),用于分别骨骼肌和肝脏样品( 图图2C)。
线粒体纯度通过透射型电子显微镜测定,并示于图2D中 。线粒体被示出为电子致密少于0.01%的断裂或损坏。污染由非线粒体颗粒小于0.001%。
线粒体活力; MitoTracker红如前面去确定划线17,18。我们的结果表明,分离的线粒体保持膜电位( 图3A - C)。
三磷酸腺苷是使用荧光检测试剂盒测定。 A板的地图为ATP的测定示于图4。的ATP标准铺板一式两份。线粒体样品和阴性对照铺板三份。 ATP的含量为10.67±4.38纳摩尔/毫克线粒体蛋白和14.83±4.36纳摩尔/毫克线粒体蛋白的骨骼肌和肝脏样品分别( 图3D)。
用克拉克型电极如前所述17,18线粒体呼吸进行了评估。线粒体耗氧率分别为178±17纳米O2 /分钟/毫克线粒体蛋白的骨骼肌和176±23纳米O2 /分钟/毫克线粒体蛋白肝的准备。呼吸控制指数(RCI)值分别为2.45±0.34ð2.67±0.17对骨骼肌和肝脏样品制备分别( 图3E)。这些结果是类似报道在我们以前使用手动均化和差速离心分离线粒体17-18研究。

图1模式用于使用组织离解和微分过滤线粒体的分离。 (A)将两个6毫米活检样品冲至5ml均质缓冲液中的解离Ç管以及使用该组织离解的1分钟均质化方案使样品均质化。(B)中加入250μl的枯草杆菌蛋白酶中的解离的储备溶液,以匀浆Ç管在冰上孵育10分钟(C)通过预过滤匀浆 -wetted 40微米的筛网过滤器中在冰上的50ml离心管中,然后加入250微升BSA储备液,向滤液(D)再过滤,通过一个新的预润湿的40微米筛网过滤,滤液在50毫升锥形离心冰上。(E)再过滤,通过在冰上的50ml离心管中一个新的预润湿的10微米的筛网过滤器的滤液(F)将滤液转移到1.5 ml离心管中并离心分离机以9000×g离心10分钟,在4℃。(G)弃上清,重新悬浮,并结合线粒体颗粒在1毫升呼吸缓冲。总过程时间小于30分钟。 请点击这里查看该图的放大版本。
D / 51682 / 51682fig2highres.jpg"WIDTH ="600"/>
图2线粒体产量和纯度。分离出0.18±0.04 g组织(湿重)为骨骼肌和肝脏(A)的血细胞计数和粒径计数器线粒体数目(B)线粒体尺寸(毫克/克)分布由粒径计数器检测到的(C)线粒体蛋白毫克/克组织湿重为骨骼肌和肝脏。分离的线粒体中的(D)的透射电子显微镜图像。比例尺为100nm。箭头表示可能的污染,非线粒体颗粒和损伤的线粒体。 请点击这里查看该图的放大版本。
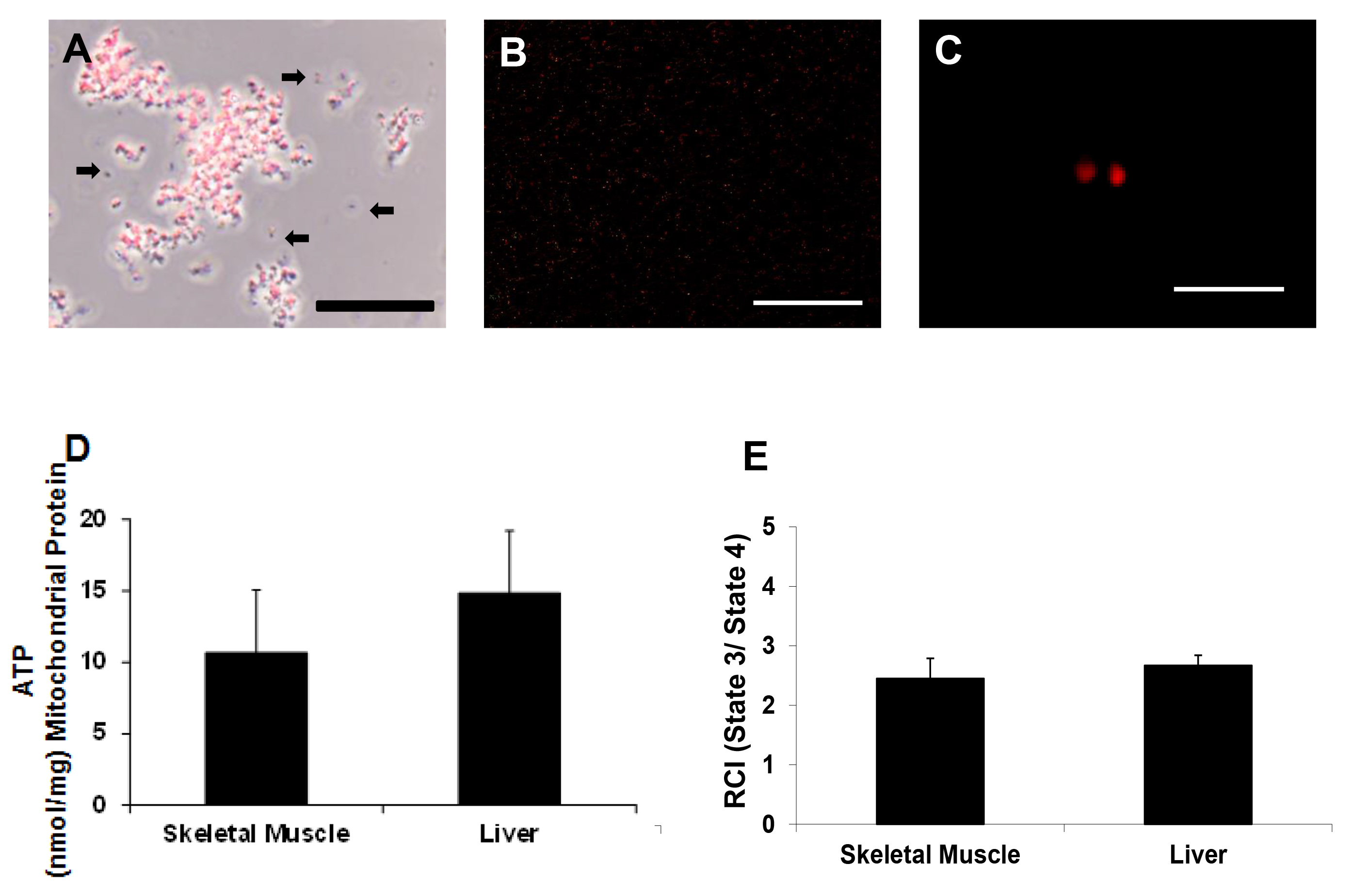 < BR /> 图3线粒体活力 。根据荧光分离线粒体(一)相衬照明和(B和C)下的代表性显微照片,线粒体标记MitoTracker红CMXRos。比例尺是25微米(A,B)和5微米(C)。这些图像表明,线粒体保持膜电位。 箭头表示缺乏线粒体膜电位或碎片(四)ATP含量纳摩尔/毫克线粒体蛋白由三磷酸腺苷检测和(E)RCI的决定(国家3/4的状态),由克拉克的电极决定。 请点击这里查看大图这个数字。
< BR /> 图3线粒体活力 。根据荧光分离线粒体(一)相衬照明和(B和C)下的代表性显微照片,线粒体标记MitoTracker红CMXRos。比例尺是25微米(A,B)和5微米(C)。这些图像表明,线粒体保持膜电位。 箭头表示缺乏线粒体膜电位或碎片(四)ATP含量纳摩尔/毫克线粒体蛋白由三磷酸腺苷检测和(E)RCI的决定(国家3/4的状态),由克拉克的电极决定。 请点击这里查看大图这个数字。
负载/ 51682 / 51682fig4highres.jpg"宽度="600"/>
图4标示的地图为ATP的测定该板图说明了如何设置标准(A1 - A12),线粒体样品(B1 - C 6),和阴性对照(C 7 - C 9)对ATP的测定。在测定过程中,加入100μl呼吸缓冲液中,加入50μl的哺乳动物细胞裂解液和50μl重建的底物溶液加入到所有孔中(A1 - C9)。
讨论
成功地分离出使用该协议,必须保持所有的解决方案和组织样品在冰上保持线粒体活力线粒体。在冰上保持甚至当,分 离线粒体将表现出随着时间的推移19的功能活性的降低。我们建议所有的解决方案和补充预先做好准备。我们预先称重并存储枯草杆菌蛋白酶A在4毫克等分试样在1.5ml微量离心管中,并将其存储在-20℃。同样的BSA被预先称重并存储在在1.5ml微量离心管20毫克等分,可以储存在-20℃。使用管之前,从-20℃下除去,枯草杆菌蛋白酶A和牛血清白蛋白溶解于1ml的均质缓冲液中的线粒体分离过程中使用。
从骨骼肌组织活检两个拳使用6毫米的活检冲床提供足够的线粒体在临床和手术过程中使用的治疗性干预17获得-18。来估计,我们使用两种方法,血细胞计数和粒径数量线粒体的数量。建议使用的粒径数量。粒度计数器使用电阻抗测量粒子穿过限定大小的孔的体积。粒度计数器是昂贵,但提供准确和可靠的估计,可由用户独立。通过血细胞计数估计线粒体数目是更经济的。我们的研究已经表明,这种方法提供了可变的估计是大小小于使用粒度计数器获得的大约一个数量级。我们也注意到,通过血细胞计数器获得的计数是高度依赖于用户。我们建议,以确保一致的估计使用血球计数都应该由一个人来完成。
我们发现ATP检测试剂盒是用于确定线粒体功能非常有用。该套件提供了所有必须的Reagents并提供了用于确定分离的线粒体代谢活性的简单和快速的方法。 ATP的测定提供了类似的结果如那些用Clark型电极得到的,因此,与以前的数据分析20-21兼容。
我们的线粒体分离方案的主要优点是,它允许一个高产可行,呼吸主管无污染,在不到30分钟的线粒体的隔离。代替差速离心的差过滤显著减少手术时间。其他协议包含若干个离心步骤,整个隔离时间为60分钟至100分钟13-17。这个协议的另一个优点是,组织均质化是标准化的。商业组织离解器提供了一个标准化的循环,并产生一致且可重复的结果。这是相对于手工匀化,是受用户可变性和不一致。我们对线粒体利用组织分离和鉴别过滤的快速分离方法,为临床和手术治疗干预17,18兼容的隔离时间框架。
披露声明
所有的动物都按照现行体制的指导方针进行处理。我们没有竞争的经济利益披露。
致谢
这项研究是由美国国家心脏,肺和血液研究所资助HL-103542,并在散麻醉研究基金会的杰出开拓者奖CAP支持。
材料
| Name | Company | Catalog Number | Comments |
| Sucrose | Sigma Aldrich | 84100 | |
| HEPES | Sigma Aldrich | H4034 | |
| EGTA | Sigma Aldrich | E4378 | |
| Substilsin A | Sigma Aldrich | P5380 | |
| BSA | Sigma Aldrich | A7906 | |
| KH2PO4 | Sigma Aldrich | P5379 | |
| MgCl2 | Sigma Aldrich | M8266 | |
| NaCl | Sigma Aldrich | S6191 | |
| KCl | Fisher Scientific | P2173 | |
| Na2HPO4 | Fisher Scientific | S374 | |
| ATPlite Luminescence Assay System, 1,000 Assay Kit | Perkin Elmer | 6016941 | |
| 50 ml Conical Tubes | BD | 352098 | |
| 40 μm Nylon Filters | BD | 352340 | |
| GentleMACS C tube | Miltenyl Biotech | 120-005-331 | |
| 1.5 ml Eppendorf tube | Fisher Scientific | 05-408-129 | |
| 6 mm biopsy punch | Miltex | 33-36 | |
| 10 μm Pluristrainer | Pluriselect | 43-500-10-03 | |
| Eppendorf Centrifuge 5415C | Marshall Scientific | EP-5415C | |
| GentleMACS Dissociator | Miltenyl Biotech | 130-093-235 | |
| 96-well plates, tissue culture treated | VWR | 82050-732 | |
| Rotomax 120 orbital shaker | Heidolph | 544-41200-00 | |
| Synergy H4 Hybrid Multi-Mode Microplate Reader | BioTek | ||
| Multisizer 4 Coulter Counter | Beckman Coulter | A63076 | |
| Oxytherm System | Hansatech Instruments | ||
| Hemacytometer | Fisher Scientific | 267110 |
参考文献
- van Loo, G., Saelens, X., van Gurp, M., MacFarlane, M., Martin, S. J., Vandenabeele, P. The role of mitochondrial factors in apoptosis: a Russian roulette with more than one bullet. Cell Death Differ. 9 (10), 1031-1042 (2002).
- Szabadkai, G., Duchen, M. R. Mitochondria: the hub of cellular Ca2+ signaling. Physiology (Bethesda). 23, 84-94 (2008).
- Chan, D. C. Mitochondria: Dynamic Organelles in Disease, Aging, and Development. Cell. 125 (7), 1241-1252 (2006).
- Picard, M., et al. Mitochondrial structure and function are disrupted by standard Isolation methods. PLoS ONE. 6 (3), e18317(2011).
- Bensley, R. R., Hoerr, N. Studies on cell structure by freeze-drying method; preparation and properties of mitochondria. Anat Rec. 60, 449-455 (1934).
- Claude, A. Fractionation of mammalian liver cells by differential centrifugation II. Experimental procedures and results. J Exp Med. 84 (1), 61-89 (1946).
- Hogeboom, H., Schneider, W. C., Palade, G. E. Cytochemical studies of mammalian tissues; isolation of intact mitochondria from rat liver; some biochemical properties of mitochondria and submicroscopic particulate material. J Biol Chem. 172 (2), 619-635 (1948).
- Ernster, L., Schtaz, G. Mitochondria: a historical Review. J Cell Biol. 91 (3 Pt 2), 227s-255s (1981).
- Pallotti, F., Lenaz, G. Isolation and subfractionation of mitochondria from animal cells and tissue culture lines. Methods Cell Biol. 80, 3-44 (2007).
- Schmitt, S., et al. A semi-automated method for isolating functionally intact mitochondria from cultured cells and tissue biopsies. Anal Biochem. 443 (1), 66-74 (2013).
- Fernández-Vizarra, E., Ferrín, G., Pérez-Martos, A., Fernández-Silva, P., Zeviani, M., Enríquez, J. A. Isolation of mitochondria for biogenetical studies: An update. Mitochondrion. 10 (3), 253-262 (2010).
- Graham, J. M. Chapter 3, Unit 3.3, Isolation of mitochondria from tissues and cells by differential centrifugation. Curr Protoc Cell Biol. , (2001).
- Frezza, C., Cipolat, S., Scorrano, L. Organelle isolation: functional mitochondria from mouse liver, muscle and cultured fibroblasts. Nat Protoc. 2 (2), 287-295 (2007).
- Wieckowski, M. R., Giorgi, C., Lebiedzinska, M., Duszynski, J., Pinton, P. Isolation of mitochondria-associated membranes and mitochondria from animal tissues and cells. Nat Protoc. 4 (11), 1582-1590 (2009).
- Gostimskaya, I., Galkin, A. Preparation of highly coupled rat heart mitochondria. J Vis Exp. (43), (2010).
- Gross, V. S., et al. Isolation of functional mitochondria from rat kidney and skeletal muscle without manual homogenization. Anal Biochem. 418 (2), 213-223 (2011).
- Masuzawa, A., et al. Transplantation of autologously derived mitochondria protects the heart from ischemia-reperfusion injury. American J Physiol Heart and Circ Physiol. 304 (7), (2013).
- McCully, J. D., et al. Injection of isolated mitochondria during early reperfusion for cardioprotection. American J Physiol Heart and Circ Physiol. 296 (1), 94-105 (2009).
- Olson, M. S., Von Korff, R. W. Changes in endogenous substrates of isolated rabbit heart mitochondria during storage. J Biol Chem. 242 (2), 325-332 (1967).
- Diepart, C., et al. Comparison of methods for measuring oxygen consumption in tumor cells in vitro. Anal Biochem. 396 (2), 250-256 (2010).
- Lanza, I. R., Nair, K. S. Functional assessment of isolated mitochondria in vitro. Methods Enzymol. 457, 349-372 (2009).
Erratum
Formal Correction: Erratum: Rapid Isolation And Purification Of Mitochondria For Transplantation By Tissue Dissociation And Differential Filtration
Posted by JoVE Editors on 1/05/2016. Citeable Link.
A correction was made to: Rapid Isolation And Purification Of Mitochondria For Transplantation By Tissue Dissociation And Differential Filtration. An optional step was added to step 7 of the 'Mitochondrial Isolation' section of the protocol. The step is:
1. Optional in the case that the tissue is fibrous: Centrifuge the solution at 750 x g for 4 min.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。