Method Article
조직 해리 차동 여과 이식 미토콘드리아의 신속한 분리 및 정제
Erratum Notice
요약
포유 동물 조직 생검에서 미토콘드리아의 신속한 분리를위한 방법을 설명한다. 쥐 간 또는 골격근 제제 상용 조직 dissociator 균질화하고, 미토콘드리아는 나일론 메쉬 필터를 통한 여과에 의해 미분을 분리 하였다. 대안적인 방법을 사용하여 100 분간 - 미토콘드리아 분리 시간은 60 비교 <30 분이다.
초록
차동 원심 분리 및 / 또는 피콜 구배 원심 분리를 사용하여 이전에 기술 된 미토콘드리아 분리 방법은 완료 60-100 분을 필요로한다. 우리는 상업적 조직 dissociator 및 차등 여과하여 포유류의 조직 검사에서 미토콘드리아의 신속한 분리를위한 방법을 설명한다. 이 프로토콜에서 수동 균질화는 조직 dissociator의 표준화 균질화 사이클로 대체됩니다. 이 균일하고 쉽게 수동 균질화 달성되지 않은 조직의 일관성 균질화 수 있습니다. 티슈 해리 다음, 균질 반복 원심 분리 단계를 제거 나일론 메쉬 필터를 통해 여과된다. 그 결과, 미토콘드리아 절연은 30 분 미만으로 수행 될 수있다. 이 분리 프로토콜은 0.18 ± 0.04 g (습 중량) 조직 샘플에서 약 2 × 10 10 실행 가능하고 호흡 능력 미토콘드리아를 얻을 수 있습니다.
서문
미토콘드리아는 적혈구를 제외한 체내 모든 세포에 존재하는 세포 및 중요한 대사 과정 1-4의 다수에 관여한다. 때문에 이러한 많은 기능의 미토콘드리아 손상이 해로운 영향 삼을 수 있습니다. 미토콘드리아 기능 부전 여러 미토콘드리아 분리 방법을 조사하기 위해서 설명되었다. 1940 5-8로 미토콘드리아 격리 날짜의 최초의 공표를 차지한다. 제 문서화 시도가 저속 5,8에서 염 용액에 원심 분리 박격포 간 조직을 분쇄하여 미토콘드리아 아이솔레이션을 보여 주었다. 나중에, 다른 그룹은 원래의 절차에 따라 팽창 차등 원심 6-8에 기초하여 조직 분획을 보여 주었다. 이러한 초기 방법은 종종 균질화, 및 / 또는 차등 원심 9-15 통합 현재 기술의 기초를 형성. homogenizati의 수단계와 원심 분리 프로토콜마다 다릅니다. 이러한 반복적 인 단계들은 미토콘드리아 분리를 위해 시간을 증가시키고, 궁극적으로 생존 능력을 감소시킨다. 제대로 10,16 제어하지 않을 경우 또한, 수동 균질화는 미토콘드리아 손상과 일치하지 않는 결과가 발생할 수 있습니다.
최근에, 우리는 심근 조직 (17, 18)에 이식 미토콘드리아를 분리 균질화 및 차등 원심 분리를 사용했다. 이 긴 분리 절차를 수행하는 데 약 90 분을 요구하고이 방법의 임상 적용 가능성 때문에 제한되었다. 임상 및 수술 적 치료에서의 급성 치료 적 사용을 허용하기 위해, 우리는 30 분 미만으로 수행 될 수있는 신속한 미토콘드리아 분리 과정을 개발 하였다.
이 프로토콜의 주요 장점은 표준화 된 조직 해리가 균일하고 쉽게 수동 균질화 달성되지 않은 조직의 일관성 균질화 수 있다는 것입니다. 와 T에서이온 차등 원심 분리 대신에 차동 여과의 사용은 시간이 많이 소요되고 고도로 정제 실용적이고 유능한 미토콘드리아 호흡의 더 신속한 분리를 허용 반복 원심 분리 단계를 제거한다.
미만 30 분에 실행 가능하고 호흡 능력 미토콘드리아를 분리 할 수있는 능력은 임상 적 적용이 가능합니다. 이 분리 프로토콜은 관상 동맥 우회 이식 수술 (CABG) 등의 치료 과정에 사용 목적이 가능성이있다.
프로토콜
준비
- 한 M K-HEPES 원액을 (KOH와 7.2 산도를 조정) 준비합니다.
- 0.5 M K-EGTA 주식 솔루션 (KOH 8.0의 산도를 조정) 준비합니다.
- 한 M KH 2 PO 4 원액을 준비합니다.
- 한 M MgCl2를 원액을 준비합니다.
- 균질화 완충액 (pH 7.2) 300 MM의 크로스, 10 mM의 K-HEPES 및 1 ㎜ K-EGTA를 준비합니다. 4 ℃에서 보관하십시오.
- 호흡 버퍼 250 MM의 자당을 준비, 2 mM의 KH 2 PO 4, 10 mM의 MgCl2를, 20 mM의 K-HEPES 완충액 (pH 7.2) 및 0.5 mM의 K-EGTA (산도 8.0). 4 ℃에서 보관하십시오.
- 의 NaCl 80g,의 KCl 2g, 나 2 HPO 4의 14.4 g, 1 L 더블 증류수 H 2 O (산도 7.4)에 KH 2 PO 4 2.4 g을 용해시켜 10 배 PBS 원액을 준비합니다.
- 1 L 더블 증류수 H 2 O로 100 ML의 10 배 PBS 피펫 팅에 의해 1X PBS를 준비
- 서브 틸리의 4 밀리그램을 무게에 의해 서브 틸리 스톡 준비1.5 ML의 microfuge 튜브. 사용할 때까지 -20 ° C에서 보관하십시오.
- 1.5 ml의 미세 원심 분리 튜브에 BSA의 20 밀리그램을 계량하여 BSA 콘텐츠를 준비합니다. 사용할 때까지 -20 ° C에서 보관하십시오.
미토콘드리아 절연 (그림 1)
- 분리 직전에, 균질화 완충액 1 ㎖에 용해 서브 틸리.
- 분리 직전에, 균질화 완충액 1 ml의 BSA를 녹인다.
- 얼음에 50 ML 원뿔 원심 분리 관에 1X PBS에서 6mm 생검 샘플 펀치와 저장소를 사용하여 두 개의 신선한 조직 샘플을 수집합니다.
- 버퍼 균질화 빙냉 5 ㎖를 함유 해리 C 관 조직이 6mm 펀치를 전송합니다.
- 티슈 dissociator에 해리 C 튜브 피팅에 의해 조직을 균질화하고 미리 설정된 미토콘드리아 분리 사이클 (60 초간 균질화)을 선택한다.
- 얼음 양동이에 해리 C 튜브를 제거합니다.
- 에 서브 틸리 원액의 250 μl를 추가파쇄는 반전하여 혼합하고 10 분간 얼음에 균질 배양.
- 균질화 버퍼 얼음과 사전에 젖은 필터에 50 ML 원뿔 원심 분리 관에 40 μm의 메쉬 필터를 넣고 얼음에 50 ML 원뿔 원심 분리 관에 균질를 필터링 할 수 있습니다.
- 여액에 새로 제조 된 BSA 원액의 250 μl를 추가하고 반전으로 섞는다.
참고 : 미토콘드리아 단백질 결정이 필요한 경우이 단계를 생략하십시오. - 균질화 버퍼 얼음과 사전에 젖은 필터에 50 ML 원뿔 원심 분리 관에 40 μm의 필터를 넣고 얼음에 50 ML 원뿔 원심 분리 관에 균질를 필터링 할 수 있습니다.
- 균질화 버퍼 얼음과 사전에 젖은 필터에 50 ML 원뿔 원심 분리 관에 10 μm의 필터를 넣고 얼음에 50 ML 원뿔 원심 분리 관에 균질를 필터링 할 수 있습니다.
- 10 분에서 9,000 XG에서이 미리 냉장 1.5 ML의 microfuge 튜브와 원심 분리기 여과 액을 전송4 ºC.
- 상층 액을 제거하고 다시 중단하고 차가운 얼음 호흡 버퍼의 1 ml의 알약을 결합한다.
ATP 분석
주 : ATP 발광 분석법은 ATP 분석 키트를 사용하여 수행 될 수있다 절연 미토콘드리아 대사 활성을 결정한다. 프로토콜은, 시약 및 표준 분석 키트에 공급되었다. 절차의 개요에 대하여 설명한다.
- RT에 키트 시약을 평형.
- 이중 증류수 1,170 μL에서 동결 건조 된 ATP 펠렛을 용해시켜 10 mM의 ATP 원액을 준비합니다. ATP에게 얼음에 표준 원액 및 준비 미토콘드리아 샘플을 저장합니다.
- 동결 건조 된 기질 용액 바이알에 기질 완충액 5 mL를 추가한다. 부드럽게 믹스와 어둠 속에서 배치합니다.
- 블랙, 불투명 하단, 96 웰 플레이트의 모든 우물에 호흡 버퍼의 100 μl를 추가합니다.
- 각 준비된 샘플에서 잘 O를 미토콘드리아의 10 μl를 추가FA 블랙, 불투명 하단, 96 웰 플레이트. 참고 : 시료는 세중 도금된다. 표준 및 음성 대조군 (호흡 버퍼)에 대한 세 우물에 대한 행을 포함합니다.
- 표준 및 컨트롤을 포함한 모든 웰에 포유 동물의 세포 용해 용액 50 μl를 추가합니다.
- 125 rpm에서 진탕에 5 분 동안 37 ºC에서 접시를 품어.
- 배양 동안 10 mM의 ATP 원액 0.1 밀리미터, 0.05 밀리미터, 0.01 밀리미터, 0.005 밀리미터, 0.001 밀리미터, 및 0.0001 mM의 ATP의 농도 ATP 표준을 준비합니다. 얼음에 보관 기준.
- 배양 후, 플레이트지도에 표시된 우물을 대응하는 ATP 기준의 10 μl를 추가합니다. 참고 : 표준은 중복 수행됩니다.
- 각 웰에 재구성 된 기질 용액 50 μl를 추가합니다.
- 125 rpm에서 5 분 동안 진탕 기에서 37 ºC에서 접시를 품어.
- 분광 광도계로 연결된 컴퓨터에서 열기 GEN5 1.11 소프트웨어입니다.
- "에서새 항목을 만들 실험 ""클릭 ".
- "기본 프로토콜"을 클릭합니다. "확인"을 클릭합니다.
- 왼쪽 열에서 다음, "절차"를 "프로토콜"을 선택합니다.
- "지연"을 선택합니다. 0시 10분 0초로 설정합니다. "확인"을 클릭합니다.
- 선택 "읽기". 드롭 다운 메뉴에서 "발광"를 선택합니다. 다음에 다른 설정을 조정 : 유형 엔드 포인트, 통합 시간 공을 읽는다 01.00 MM : SS.ss, 필터 1 세트, 배출 홀, 광학 위치 최고, 감도 100, 최고 프로브 수직 1.00 mm 오프셋.
- 판을 분석 할 준비가되면, 맨 윗줄에있는 "판을 읽고"아이콘을 클릭합니다. "읽기"를 클릭합니다. 분광 광도계가 열리면 왼쪽 상단 모서리에 잘 A1 트레이에 접시를 놓습니다. 온도에 상자가 열립니다. "읽기"를 클릭합니다. 참고 : 값이 높을수록 증가 ATP 수준 높은 신진 대사 활동과 상관 관계.
결과
티슈 해리 및 차등 여과를 이용하여 미토콘드리아 격리에서 절차 단계를 개략적 인 그림이도 1에 도시된다. 전체 절차 시간을 30 분 미만이다.
조직 샘플은 6mm 생검 펀치를 사용하여 수득 하였다. 조직의 무게는 0.18 ± 0.04 g (습 중량)이었다. 입경 계수에 의해 결정으로서 단리 미토콘드리아의 수는 2.4이었다 × 10 10 ± 0.1 × 10 10 골격근 미토콘드리아 간 제제 2.75 × 10 10 ± 0.1 × 10 10 미토콘드리아 (도 2A). 비교 미토콘드리아의 수는 혈구에 의해 결정되었다 허용합니다. 0.11로 혈구에 의해 결정되는 미토콘드리아 수가 과소 평가 된 10 × 10 × 10 ± 0.04 10 골격근위한 미토콘드리아 0.34 X 간 제제 미토콘드리아 10 × 10 10 10 ± 0.09 (Figure의 2A). 크기에 기초하여 입자 계수기에 의해 결정되는 미토콘드리아 직경은도 2b에 도시된다. 대표적인 추적은 격리 된 미토콘드리아는 이전 보고서 7 년과 일치하여 0.38 ± 0.17 μM의 평균 직경이 한 피크에서 현지화 보여줍니다.
미토콘드리아 단백질 / g (습 중량) Bicinchoninic 산 (BCA) 분석에 의해 결정되는 조직을 시작했다 4.8 ± 2.9 밀리그램 / g (습 중량) 각각 골격 근육과 간 샘플 7.3 ± 3.5 밀리그램 / g (습 중량) (그림 2C).
미토콘드리아 순도는 투과 전자 현미경에 의해 결정하고,도 2d에 도시된다. 미토콘드리아는 0.01 %가 골절 또는 손상으로 조밀과 전자 수 표시됩니다. 비 미토콘드리아 입자에 의한 오염은 0.001 % 미만이다.
이전에 해제로 미토콘드리아 생존율 MitoTracker 레드에 의해 결정 하였다17, 18 스크라이브. 우리의 결과는 고립 된 미토콘드리아 막 전위 (- C도 3a)을 유지 것으로 나타났다.
ATP는 발광 분석 키트를 사용하여 측정 하였다. ATP 분석을위한 접시 맵은 그림 4에 나타내었다. ATP 기준은 중복 도금 하였다. 미토콘드리아 샘플 및 음성 대조군은 중으로 도금 하였다. ATP 함량은 10.67 ± 4.38 nmol의 / mg의 미토콘드리아 단백질과 14.83 ± 4.36 nmol의 / mg의 미토콘드리아 단백질 골격 근육과 간 샘플에 대한 각각 (그림 3D)이었다.
미토콘드리아 호흡은 앞서 설명한 바와 같이 17, 18 클락 형 전극을 사용하여 평가 하였다. 미토콘드리아의 산소 소비 속도는 간 준비를위한 178 골격근에 대한 ± 17 나노 O 2 / 분 / mg의 미토콘드리아 단백질과 176 ± 23 나노 O 2 / 분 / mg의 미토콘드리아 단백질이었다. 호흡 제어 지수 (RCI) 값은 2.45 ± 0.34이었다골격 근육과 간 샘플 준비 각각 (그림 3E) d는 2.67 ± 0.17. 이들 결과는 미토콘드리아 17-18을 분리 수동 균질화 및 차등 원심 분리를 이용하여 우리의 이전 연구에서보고 된 것과 유사하다.

티슈 해리 및 차등 여과를 이용하여 미토콘드리아의 분리를위한도 1 스키마. (A) 이동이 6mm 생검 샘플 펀치 해리 C 튜브에서 균질화 완충액 5 ㎖ 및 조직 dissociator의 1 분간 균질화 프로그램을 사용하여 샘플을 균질화. (B) 250 μL가 해리의 파쇄 액에 원액을 서브 틸리 추가 튜브 및 C을 10 분 동안 얼음 위에서 배양한다. (C)를 통해 프리 필터 파쇄 얼음에 50 ml의 원추형 원심 분리 관에서 40 μm의 메쉬 필터 -wetted 후 여액에 BSA 스톡 용액 250 μl를 추가한다. 50 ㎖ 중의 (D)를 다시 필터 새로운 사전 습윤 40 μm의 메쉬 필터로 여과 액을 얼음에 원뿔 원심 분리기. (E)를 다시 필터는 얼음에 50 ML 원뿔 원심 분리 관에 새로운 사전 습윤 10 μm의 메쉬 필터를 통해 여과. (F)는 9,000 XG에 1.5 ㎖의 미세 원심 분리 튜브와 원심 분리기에 여과로 이동 4 ° C에서 10 분. (G)의 상층 액을 제거하고 다시 중단하고 1 ㎖의 호흡 버퍼에있는 미토콘드리아 알약을 결합한다. 총 시술 시간 미만 30 분이다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
D / 51,682 / 51682fig2highres.jpg "너비 ="600 "/>
2 미토콘드리아 수율과 순도를 그림. (A) 혈구 및 입도 카운터 미토콘드리아 번호는 골격근, 간 대 0.18 ± 0.04 g 조직 (습윤 중량)으로부터 격리. (B) 미토콘드리아 크기 (MG / g) 입도 카운터에 의해 검출 등의 분포. (C) 미토콘드리아 단백질 골격 근육과 간을위한 MG / g 조직 습 중량. 격리 된 미토콘드리아의 (D) 투과 전자 현미경 이미지. 스케일 바는 100 ㎚이다. 화살표가 아닌 미토콘드리아 입자와 손상된 미토콘드리아에 의한 오염 가능성을 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
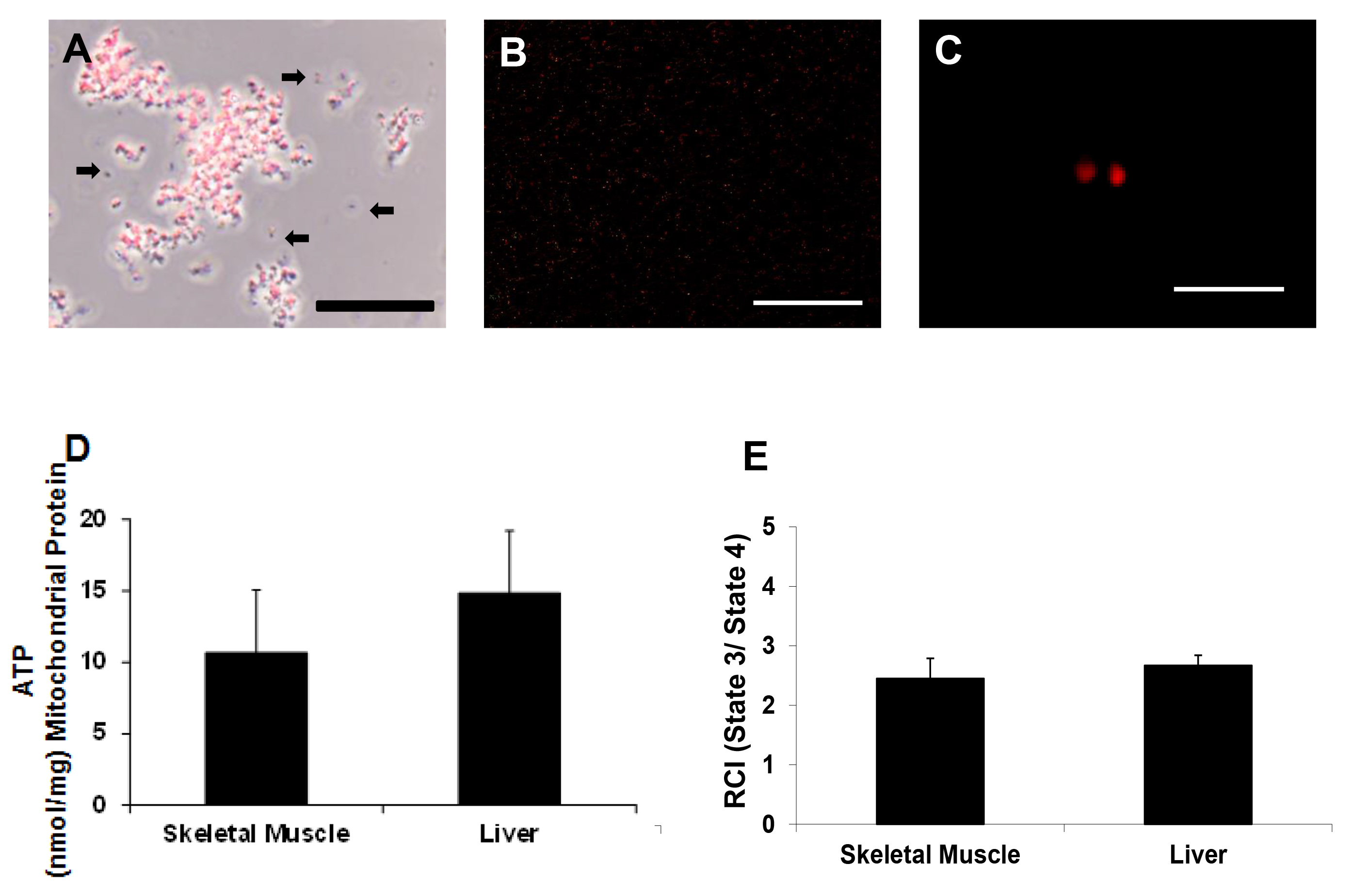 < BR /> 그림 3 미토콘드리아의 생존. MitoTracker CMXRos 레드로 형광 표지 된 미토콘드리아와 아래 위상차 조명 및 (B 및 C) 아래에 절연 미토콘드리아 (A)의 대표적인 현미경 사진. 스케일 바는 25 μm의 (A, B)와 5 μm의 (C)입니다. 이러한 이미지는 미토콘드리아 막 전위를 유지하고 있음을 나타냅니다. ATP 분석 및 (E) RCI에 의해 결정되는 화살표는 막 전위 또는 파편 (D) ATP 내용을 nmol / mg의 미토콘드리아 단백질이 결여 된 미토콘드리아를 나타냅니다 (주 3 / 주 4) 클라크 전극에 의해 결정. 의 더 큰 버전을 보려면 여기를 클릭하십시오 이 그림.
< BR /> 그림 3 미토콘드리아의 생존. MitoTracker CMXRos 레드로 형광 표지 된 미토콘드리아와 아래 위상차 조명 및 (B 및 C) 아래에 절연 미토콘드리아 (A)의 대표적인 현미경 사진. 스케일 바는 25 μm의 (A, B)와 5 μm의 (C)입니다. 이러한 이미지는 미토콘드리아 막 전위를 유지하고 있음을 나타냅니다. ATP 분석 및 (E) RCI에 의해 결정되는 화살표는 막 전위 또는 파편 (D) ATP 내용을 nmol / mg의 미토콘드리아 단백질이 결여 된 미토콘드리아를 나타냅니다 (주 3 / 주 4) 클라크 전극에 의해 결정. 의 더 큰 버전을 보려면 여기를 클릭하십시오 이 그림.
로드 / 51682 / 51682fig4highres.jpg "폭 ="600 "/>
. ATP 분석에 대한 그림 4 플레이트 맵이 판지도 (A1 - A12) 표준을 설정하는 방법을 보여줍니다, 미토콘드리아 샘플 ATP 분석을위한 - - (C9 C7) (B1 C6) 및 음성 대조군. 분석 동안, 호흡 버퍼 100 ㎕를, 포유 동물 세포 용해 용액 50 μL 및 재구성 된 기질 용액 50 ㎕를 모든 웰에 첨가 하였다 (A1 - C9).
토론
성공적으로 미토콘드리아 생존을 유지하기 위해 얼음에 모든 솔루션과 조직 샘플을 유지하는 것이 필수적입니다이 프로토콜을 사용하여 미토콘드리아를 분리합니다. 얼음에서 유지하더라도, 절연 미토콘드리아는 19 시간에 걸쳐 기능적 활성의 감소를 나타내는 것이다. 우리는 솔루션 및 추가가 미리 준비하는 것이 좋습니다. 우리는 - 무게 사전 및 1.5 ml의 미세 원심 분리 튜브에 4 밀리그램 분량 씩 서브 틸리를 저장하고 -20 ° C에 저장합니다. 마찬가지로 BSA는 미리 무게를 -20 ° C에 저장할 수 있습니다 1.5 ml의 미세 원심 분리 튜브에 20 mg을 분취에 저장됩니다. 튜브를 사용 직전는 -20 ° C에서 제거되고 서브 틸리 및 BSA는 미토콘드리아 분리 과정에 사용하기 위해 균질화 완충액 1 ㎖에 용해시킨다.
골격 근육 조직에서 두 생검 펀치는 6mm 생검 펀치 치료 개입 (17)에 대한 임상 적 및 외과 적 치료에 사용하기 위해 충분한 미토콘드리아를 제공하여 얻은-18. 우리는 두 가지 방법, 혈구 및 입자 크기 계수를 사용한 미토콘드리아의 수를 추정한다. 입자 크기 계산을 사용하는 것이 좋습니다. 입도 카운터가 정의 된 크기의 구멍을 통과하는 입자의 양을 측정하기 위해 전기 임피던스를 사용한다. 입도 카운터는 고가이지만, 정확하고 신뢰성있는 추정치를 제공하며 사용자가 독립적이다. hemocytometry 추정 미토콘드리아 수는 더 경제적입니다. 우리의 연구는이 방법은 입자 크기 카운터를 사용에 의한 것 이상이어야 크기의 약 위해 아르 변수 추정치를 제공한다는 것을 증명하고있다. 우리는 또한 혈구에 의해 얻어진 카운트는 사용자에 크게 의존하고 있음을 지적했다. 우리는 혈구를 사용하여 모든 계산이 한 사람에 의해 수행되어야한다 일관된 추정치를 확인하는 것이 좋습니다.
우리는 미토콘드리아의 기능을 확인하는 데 유용 할 ATP 분석 키트를 발견했다. 이 키트는 필요한 모든 연구를 공급eagents 및 절연 미토콘드리아 대사 활동을 결정하기위한 간단하고 신속한 방법을 제공한다. ATP 분석은 클락 형 전극을 사용하여 얻은 것과 유사한 결과를 제공하며, 따라서 이전 데이터 분석 20-21와 호환된다.
우리 미토콘드리아 분리 프로토콜의 주요한 장점은 30 분 미만의 오염이 가능한, 미토콘드리아 호흡 능력을 고 수율의 분리를 허용한다는 것이다. 차동 원심 분리 대신에 차동 여과이 크게 시술 시간을 줄일 수 있습니다. 다른 프로토콜들은 전체적으로 분리 시간은 60 분 ~ 100 분, 13 ~ 17 인 여러 원심 분리 단계를 포함. 이 프로토콜의 또 다른 이점은 조직 균질화이 표준화된다는 것이다. 상업 조직 dissociator는 표준화 사이클을 제공하고, 일관되고 재현 가능한 결과를 얻을 수 있습니다. 이 사용자의 변동과 적용을받습니다 수동 균질화 대조적이다불일치. 조직 분리 및 차등 여과를 사용하여 미토콘드리아의 빠른 분리를위한 우리의 방법은 임상 적 및 수술 적 치료 개입 (17, 18)에 대한 호환 격리 기간을 제공합니다.
공개
모든 동물은 현재 기관 가이드 라인에 따라 처리 하였다. 우리는 공개 경쟁 금융 이익을 더이 없습니다.
감사의 말
이 연구는 국립 심장, 폐, 혈액 연구소 그랜트 HL- 103542, 그리고 CAP에 BCH 마취 연구 재단의 고유 선구자 상에 의해 지원되었다.
자료
| Name | Company | Catalog Number | Comments |
| Sucrose | Sigma Aldrich | 84100 | |
| HEPES | Sigma Aldrich | H4034 | |
| EGTA | Sigma Aldrich | E4378 | |
| Substilsin A | Sigma Aldrich | P5380 | |
| BSA | Sigma Aldrich | A7906 | |
| KH2PO4 | Sigma Aldrich | P5379 | |
| MgCl2 | Sigma Aldrich | M8266 | |
| NaCl | Sigma Aldrich | S6191 | |
| KCl | Fisher Scientific | P2173 | |
| Na2HPO4 | Fisher Scientific | S374 | |
| ATPlite Luminescence Assay System, 1,000 Assay Kit | Perkin Elmer | 6016941 | |
| 50 ml Conical Tubes | BD | 352098 | |
| 40 μm Nylon Filters | BD | 352340 | |
| GentleMACS C tube | Miltenyl Biotech | 120-005-331 | |
| 1.5 ml Eppendorf tube | Fisher Scientific | 05-408-129 | |
| 6 mm biopsy punch | Miltex | 33-36 | |
| 10 μm Pluristrainer | Pluriselect | 43-500-10-03 | |
| Eppendorf Centrifuge 5415C | Marshall Scientific | EP-5415C | |
| GentleMACS Dissociator | Miltenyl Biotech | 130-093-235 | |
| 96-well plates, tissue culture treated | VWR | 82050-732 | |
| Rotomax 120 orbital shaker | Heidolph | 544-41200-00 | |
| Synergy H4 Hybrid Multi-Mode Microplate Reader | BioTek | ||
| Multisizer 4 Coulter Counter | Beckman Coulter | A63076 | |
| Oxytherm System | Hansatech Instruments | ||
| Hemacytometer | Fisher Scientific | 267110 |
참고문헌
- van Loo, G., Saelens, X., van Gurp, M., MacFarlane, M., Martin, S. J., Vandenabeele, P. The role of mitochondrial factors in apoptosis: a Russian roulette with more than one bullet. Cell Death Differ. 9 (10), 1031-1042 (2002).
- Szabadkai, G., Duchen, M. R. Mitochondria: the hub of cellular Ca2+ signaling. Physiology (Bethesda). 23, 84-94 (2008).
- Chan, D. C. Mitochondria: Dynamic Organelles in Disease, Aging, and Development. Cell. 125 (7), 1241-1252 (2006).
- Picard, M., et al. Mitochondrial structure and function are disrupted by standard Isolation methods. PLoS ONE. 6 (3), e18317(2011).
- Bensley, R. R., Hoerr, N. Studies on cell structure by freeze-drying method; preparation and properties of mitochondria. Anat Rec. 60, 449-455 (1934).
- Claude, A. Fractionation of mammalian liver cells by differential centrifugation II. Experimental procedures and results. J Exp Med. 84 (1), 61-89 (1946).
- Hogeboom, H., Schneider, W. C., Palade, G. E. Cytochemical studies of mammalian tissues; isolation of intact mitochondria from rat liver; some biochemical properties of mitochondria and submicroscopic particulate material. J Biol Chem. 172 (2), 619-635 (1948).
- Ernster, L., Schtaz, G. Mitochondria: a historical Review. J Cell Biol. 91 (3 Pt 2), 227s-255s (1981).
- Pallotti, F., Lenaz, G. Isolation and subfractionation of mitochondria from animal cells and tissue culture lines. Methods Cell Biol. 80, 3-44 (2007).
- Schmitt, S., et al. A semi-automated method for isolating functionally intact mitochondria from cultured cells and tissue biopsies. Anal Biochem. 443 (1), 66-74 (2013).
- Fernández-Vizarra, E., Ferrín, G., Pérez-Martos, A., Fernández-Silva, P., Zeviani, M., Enríquez, J. A. Isolation of mitochondria for biogenetical studies: An update. Mitochondrion. 10 (3), 253-262 (2010).
- Graham, J. M. Chapter 3, Unit 3.3, Isolation of mitochondria from tissues and cells by differential centrifugation. Curr Protoc Cell Biol. , (2001).
- Frezza, C., Cipolat, S., Scorrano, L. Organelle isolation: functional mitochondria from mouse liver, muscle and cultured fibroblasts. Nat Protoc. 2 (2), 287-295 (2007).
- Wieckowski, M. R., Giorgi, C., Lebiedzinska, M., Duszynski, J., Pinton, P. Isolation of mitochondria-associated membranes and mitochondria from animal tissues and cells. Nat Protoc. 4 (11), 1582-1590 (2009).
- Gostimskaya, I., Galkin, A. Preparation of highly coupled rat heart mitochondria. J Vis Exp. (43), (2010).
- Gross, V. S., et al. Isolation of functional mitochondria from rat kidney and skeletal muscle without manual homogenization. Anal Biochem. 418 (2), 213-223 (2011).
- Masuzawa, A., et al. Transplantation of autologously derived mitochondria protects the heart from ischemia-reperfusion injury. American J Physiol Heart and Circ Physiol. 304 (7), (2013).
- McCully, J. D., et al. Injection of isolated mitochondria during early reperfusion for cardioprotection. American J Physiol Heart and Circ Physiol. 296 (1), 94-105 (2009).
- Olson, M. S., Von Korff, R. W. Changes in endogenous substrates of isolated rabbit heart mitochondria during storage. J Biol Chem. 242 (2), 325-332 (1967).
- Diepart, C., et al. Comparison of methods for measuring oxygen consumption in tumor cells in vitro. Anal Biochem. 396 (2), 250-256 (2010).
- Lanza, I. R., Nair, K. S. Functional assessment of isolated mitochondria in vitro. Methods Enzymol. 457, 349-372 (2009).
Erratum
Formal Correction: Erratum: Rapid Isolation And Purification Of Mitochondria For Transplantation By Tissue Dissociation And Differential Filtration
Posted by JoVE Editors on 1/05/2016. Citeable Link.
A correction was made to: Rapid Isolation And Purification Of Mitochondria For Transplantation By Tissue Dissociation And Differential Filtration. An optional step was added to step 7 of the 'Mitochondrial Isolation' section of the protocol. The step is:
1. Optional in the case that the tissue is fibrous: Centrifuge the solution at 750 x g for 4 min.
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유