Method Article
Isolamento rapida e purificazione di mitocondri per il trapianto da tessuto Dissociazione e Filtrazione Differenziale
In questo articolo
Erratum Notice
Riepilogo
Un metodo rapido isolamento dei mitocondri da biopsie di tessuto mammiferi è descritto. Fegato di ratto o preparazioni muscolari scheletriche sono stati omogeneizzati con un dissociatore tessuto commerciale e mitocondri sono stati isolati per filtrazione differenziale attraverso filtri a rete di nylon. Tempo di isolamento mitocondriale è <30 min rispetto ai 60 - 100 min con metodi alternativi.
Abstract
Metodi di isolamento mitocondriali precedentemente descritti utilizzando centrifugazione differenziale e / o Ficoll gradiente di centrifugazione richiedono da 60 a 100 minuti per completare. Noi descriviamo un metodo per il rapido isolamento di mitocondri da biopsie di mammifero usando un dissociatore tessuto commerciale e filtrazione differenziale. In questo protocollo, omogeneizzazione manuale viene sostituito con il ciclo omogeneizzazione standardizzata del dissociatore tessuti. Questo permette uniforme e costante omogeneizzazione del tessuto che non è facilmente ottenibile con omogeneizzazione manuale. A seguito di dissociazione dei tessuti, l'omogeneizzato è filtrata attraverso filtri a rete di nylon, che eliminano le fasi di centrifugazione ripetitivi. Come risultato, l'isolamento mitocondriale può essere eseguito in meno di 30 min. Questo protocollo isolamento produce circa 2 x 10 10 mitocondri competenti vitali e la respirazione da 0,18 ± 0,04 g di campione di tessuto (peso a umido).
Introduzione
Esistono mitocondri in ogni cellula del corpo ad eccezione dei globuli rossi e sono coinvolti in un gran numero di importanti processi cellulari e metabolici 1-4. A causa di queste numerose funzioni, danno mitocondriale può avere effetti negativi 3. Al fine di indagare la funzione mitocondriale e disfunzione diversi metodi di isolamento mitocondriali sono state descritte. I primi resoconti pubblicati su mitocondriale data isolamento al 1940 5-8. Il primo tentativo documentato dimostrato isolamento mitocondriale dalla macinazione di tessuto epatico in un mortaio seguita da centrifugazione in una soluzione salina a bassa velocità 5,8. Più tardi, altri gruppi estesa, la procedura originale e dimostrato frazionamento del tessuto sulla base di centrifugazione differenziale di 6-8. Questi primi metodi hanno costituito la base delle tecniche attuali, che spesso incorporano omogeneizzazione, e / o differenziale centrifugazione 9-15. Il numero di homogenizatisu e centrifugazione gradini varia tra i protocolli. Questi passaggi ripetitivi aumentano il tempo per l'isolamento dei mitocondri e, infine, ridurre la vitalità. Inoltre, omogeneizzazione manuale può causare danni e inconsistenti risultati mitocondriali se non adeguatamente controllato 10,16.
Recentemente, abbiamo utilizzato omogeneizzazione e centrifugazione differenziale per isolare i mitocondri per trapianto nel tessuto miocardico 17,18. Questa procedura di isolamento lunga tenuta di circa 90 minuti e l'applicabilità clinica di questo metodo era quindi limitata. Per consentire l'uso terapeutico acuto nel trattamento clinico e chirurgico abbiamo sviluppato una rapida procedura di isolamento mitocondriale che può essere eseguito in meno di 30 min.
I principali vantaggi di questo protocollo è che la dissociazione del tessuto standardizzata consente di uniforme e coerente omogeneizzazione del tessuto che non è facilmente ottenibile con omogeneizzazione manuale. In Additione, l'uso di filtrazione differenziale al posto di centrifugazione differenziale elimina richiede tempo e le fasi di centrifugazione ripetitive consentendo un più rapido isolamento di altamente purificati, vitali e respirazione mitocondri competenti.
La capacità di isolare mitocondri competenti vitali e respirazione in meno di 30 minuti permette di applicabilità clinica. Questo protocollo di isolamento ha il potenziale per l'uso in chirurgia di bypass coronarico (CABG) e altre procedure terapeutiche.
Protocollo
Preparazione
- Preparare 1 M K-HEPES Stock Solution (aggiustare il pH a 7,2 con KOH).
- Preparare 0,5 M K-EGTA Stock Solution (aggiustare il pH a 8,0 con KOH).
- Preparare 1 M KH 2 PO 4 Stock Solution.
- Preparare 1 M MgCl 2 Stock Solution.
- Preparare omogeneizzazione Buffer (pH 7,2) saccarosio 300 mM, 10 mM K-HEPES, e 1 mM K-EGTA. Conservare a 4 ° C.
- Preparare saccarosio respirazione Buffer 250 mm, 2 mm KH 2 PO 4, 10 mM MgCl 2, 20 mM K-HEPES Buffer (pH 7,2) e 0,5 mM K-EGTA (pH 8,0). Conservare a 4 ° C.
- Preparare 10x PBS Archivio soluzione sciogliendo 80 g di NaCl, 2 g di KCl, 14,4 g di Na 2 HPO 4, e 2,4 g di KH 2 PO 4 in 1 L doppia H 2 O distillata (pH 7,4).
- Preparare 1x PBS pipettando 100 ml di 10x PBS in 1 L doppio distillata H 2 O.
- Preparare Subtilisina A Stock pesando su 4 mg di Subtilisina A inin una provetta da 1,5 ml microcentrifuga. Conservare a -20 ° C fino al momento dell'uso.
- Preparare BSA Archivio pesando i 20 mg di BSA in una provetta da 1,5 ml microcentrifuga. Conservare a -20 ° C fino al momento dell'uso.
Isolamento mitocondriale (Figura 1)
- Immediatamente prima dell'isolamento, sciogliere Subtilisina A in 1 ml di tampone di omogeneizzazione.
- Immediatamente prima dell'isolamento, BSA sciogliere in 1 ml di tampone di omogeneizzazione.
- Raccogliere due campioni di tessuto fresco con un pugno campione bioptico 6 mm e conservare in 1x PBS in una provetta da centrifuga da 50 ml conica sul ghiaccio.
- Trasferire i due punzoni 6 mm di tessuto in una provetta dissociazione C contenente 5 ml di freddo ghiaccio Omogeneizzazione Buffer.
- Omogeneizzare il tessuto inserendo il tubo di dissociazione C sul dissociatore tessuti e selezionare il ciclo di isolamento mitocondriale preimpostato (60 sec omogeneizzazione).
- Rimuovere il tubo di dissociazione C per un secchio di ghiaccio.
- Aggiungere 250 ml di Subtilisina A Stock soluzione alomogeneizzato, mescolare per inversione ed incubare l'omogeneizzato in ghiaccio per 10 min.
- Mettere un filtro a rete 40 micron su un tubo da centrifuga da 50 ml conica su ghiaccio e pre-bagnato il filtro con Omogeneizzazione Buffer e filtrare l'omogeneizzato nel tubo da centrifuga da 50 ml conica sul ghiaccio.
- Aggiungere 250 ml di preparato fresco BSA Stock Solution al filtrato e mescolare per inversione.
Nota: Omettere questo passaggio se è necessaria la determinazione delle proteine mitocondriali. - Mettere un filtro 40 micron su un tubo da centrifuga da 50 ml conica su ghiaccio e pre-bagnato il filtro con Omogeneizzazione Buffer e filtrare l'omogeneizzato nel tubo da centrifuga da 50 ml conica sul ghiaccio.
- Collocare un filtro da 10 micron su un tubo da centrifuga da 50 ml conica su ghiaccio e pre-bagnato il filtro con Omogeneizzazione Buffer e filtrare l'omogeneizzato nel tubo da centrifuga da 50 ml conica sul ghiaccio.
- Trasferire il filtrato di due pre-refrigerati provette da 1,5 ml microcentrifuga e centrifugare a 9.000 xg per 10 min a4 ° C.
- Rimuovere il surnatante e risospendere e combinare pellet in 1 ml di ghiaccio freddo respirazione Buffer.
ATP Assay
Nota: Per determinare l'attività metabolica dei mitocondri isolati un saggio luminescenza ATP può essere eseguita utilizzando un kit di test ATP. Il protocollo, reagenti e standard sono stati forniti nel kit test. Una sintesi della procedura è descritta di seguito.
- Equilibrare reagenti del kit a RT.
- Preparare 10 mM ATP Stock Solution sciogliendo liofilizzato pellet ATP in 1.170 ml di acqua bidistillata. Conservare ATP standard di soluzione Stock e campioni mitocondriali preparati sul ghiaccio.
- Aggiungere 5 ml di soluzione Tampone Substrato ad un flacone di soluzione di substrato liofilizzato. Mescolare delicatamente e mettere al buio.
- Aggiungere 100 ml di respirazione tampone a tutti i pozzetti di un nero, fondo opaco, 96 pozzetti.
- Aggiungere 10 ml di mitocondri dai campioni preparati a ciascun bene ofa nero, fondo opaco, 96 pozzetti. Nota: I campioni sono placcati in triplice copia. Include una riga per standard e tre pozzi per il controllo negativo (Respirazione Buffer).
- Aggiungere 50 ml di soluzione di lisi cellulare dei mammiferi a tutti i pozzetti, comprese le norme e controlli.
- Incubare la piastra a 37 ° C per 5 minuti su un agitatore orbitale a 125 rpm.
- Durante l'incubazione preparare norme ATP in concentrazioni di 0,1 mm, 0,05 mm, 0,01 mm, 0.005 mm, 0.001 mm, 0,0001 ATP mm dal 10 mM ATP Stock Solution. Norme Conservare su ghiaccio.
- Dopo l'incubazione, aggiungere 10 ml di norme ATP corrispondenti pozzetti come indicato nella mappa piastra. NOTA: Gli standard vengono eseguiti in duplicato.
- Aggiungere 50 ml di soluzione ricostituita di substrato in ogni pozzetto.
- Incubare la piastra a 37 ° C su agitatore orbitale per 5 min a 125 rpm.
- Aprire il software Gen5 1.11 su un computer collegato con lo spettrofotometro.
- Sotto "Creare un nuovo elemento ", cliccare su" Experiment ".
- Clicca su "protocollo predefinito". Fare clic su "Ok".
- Nella colonna di sinistra, selezionare "Protocollo", poi "Procedura".
- Selezionare "Delay". Impostare 00:10:00. Fare clic su "Ok".
- Selezionare "Leggi". Selezionare "Luminescence" dal menu a discesa. Regolare le altre impostazioni per quanto segue: Leggere tipo di endpoint, Tempo di integrazione 0: 01.00 MM: ss.ss, Filter Set 1, Emissione Foro, Ottica posizione superiore, Sensibilità 100, Offset Top sonda verticale 1,00 millimetri.
- Quando il piatto è pronto per essere analizzato, fare clic sull'icona "Leggi Targa" sulla riga in alto. Fare clic su "Read". Quando si apre lo spettrofotometro, posizionare la piastra nel cassetto con pozzetto A1 nell'angolo in alto a sinistra. Una scatola con la temperatura si aprirà. Fare clic su "Read". Nota: I valori più alti sono correlati con un aumento dei livelli di ATP e una maggiore attività metabolica.
Risultati
Una figura che illustra le fasi procedurali nel isolamento dei mitocondri mediante dissociazione dei tessuti e la filtrazione differenziale è mostrato in Figura 1. Tempo procedurale totale è inferiore a 30 min.
I campioni di tessuto sono stati ottenuti utilizzando una biopsia 6 mm. Peso del tessuto era 0,18 ± 0,04 g (peso umido). Il numero dei mitocondri isolati come determinato mediante conteggio granulometria era 2,4 x 10 10 ± 0,1 x 10 10 mitocondri di muscolo scheletrico e 2,75 x 10 10 ± 0,1 x 10 10 per preparazioni mitocondri di fegato (Figura 2A). Per consentire il confronto numero mitocondriale è stata determinata anche da emocitometro. Numero mitocondriale è stato sottovalutato, come determinato dal emocitometro come 0,11 x 10 10 ± 0.04 x 10 10 mitocondri di muscolo scheletrico e 0,34 x 10 10 ± 0,09 x 10 10 mitocondri per le preparazioni di fegato (FIGURA 2A). Diametro mitocondriale come determinata dalle dimensioni basato contatore di particelle è mostrata nella Figura 2B. Il tracciato rappresentante mostra i mitocondri isolati sono localizzati sotto un picco con diametro medio di 0,38 ± 0,17 micron in accordo con precedenti relazioni 7.
Proteina mitocondriale / g (peso umido) tessuto di base come determinato da bicinconinico Acid (BCA) dosaggio era 4,8 ± 2,9 mg / g (peso umido) e di 7.3 ± 3.5 mg / g (peso umido) per il muscolo scheletrico e campioni di fegato, rispettivamente (Figura 2C).
Purezza mitocondriale è stata determinata mediante microscopia elettronica a trasmissione ed è illustrato nella Figura 2D. I mitocondri sono indicati da elettroni denso con meno dello 0,01% è rotto o danneggiato. Contaminazione da particelle non-mitocondriali è inferiore al 0,001%.
Vitalità mitocondriale è stata determinata da MitoTracker rossa come precedentemente dedescritto 17,18. I nostri risultati mostrano che i mitocondri isolati mantengono potenziali di membrana (Figure 3A - C).
ATP è stato determinato utilizzando un kit di test luminescenti. Una mappa piastra per il saggio ATP è mostrato in Figura 4. Standard di ATP sono state piastrate in duplicato. Campioni mitocondriali ei controlli negativi sono stati placcati in triplice copia. Contenuto di ATP era 10.67 ± 4.38 nmol / mg di proteina mitocondriale e 14.83 ± 4.36 nmol / mg di proteina mitocondriale per il muscolo scheletrico e campioni di fegato, rispettivamente (Figura 3D).
Respirazione mitocondriale è stata valutata utilizzando un elettrodo di Clark come precedentemente descritto 17,18. Mitocondriale tasso di consumo di ossigeno era 178 ± 17 nM O 2 / min / mg di proteina mitocondriale nel muscolo scheletrico e 176 ± 23 nM O 2 / min / mg di proteina mitocondriale per i preparati di fegato. Indice di controllo respiratorio valori (RCI) erano 2,45 ± 0,34 und 2.67 ± 0.17 per il muscolo scheletrico e le preparazioni del campione di fegato, rispettivamente (Figura 3E). Questi risultati sono simili a quelli riportati nei nostri studi precedenti utilizzando omogeneizzazione manuale e centrifugazione differenziale per isolare i mitocondri 17-18.

Figura 1 Schema per l'isolamento dei mitocondri mediante dissociazione dei tessuti e filtrazione differenziale. (A) Trasferimento due 6 millimetri pugni campione bioptico a 5 ml di omogeneizzazione tampone in una provetta dissociazione C e omogeneizzare i campioni utilizzando il programma di omogeneizzazione 1 min del dissociatore tessuti. (B) Aggiungere 250 microlitri Subtilisina Una soluzione di riserva per l'omogeneizzato nella dissociazione tubo C e incubare in ghiaccio per 10 min. (C) Filtrare l'omogeneizzato attraverso un pre -wetted 40 micron filtro a rete in 50 ml conica provetta da centrifuga su ghiaccio e poi aggiungere 250 ml di soluzione madre BSA al filtrato. (D) Re-filtro filtrato attraverso un nuovo filtro a rete 40 micron pre-bagnata in un 50 ml centrifuga conica sul ghiaccio. (E) Re-filtro filtrato attraverso un nuovo 10 micron filtro pre-inumidito maglie in una provetta da centrifuga da 50 ml conica sul ghiaccio. (F) Trasferire il filtrato a 1,5 ml provette per microcentrifuga e centrifugare a 9.000 xg per 10 min a 4 ° C. (G) Rimuovere il supernatante e risospendere il pellet e combinare mitocondriali in 1 ml di tampone respirazione. Tempo procedura totale è inferiore a 30 min. Cliccate qui per vedere una versione più grande di questa figura.
d / 51682 / 51682fig2highres.jpg "width =" 600 "/>
Figura 2. resa mitocondriale e la purezza. (A) numero di emocitometro e particelle contatore dimensione mitocondri isolati da 0,18 ± 0,04 g di tessuto (peso umido) per il muscolo scheletrico e nel fegato. (B) formato mitocondriale (mg / g) distribuzione, come rilevato dal contatore di dimensione delle particelle. (C) la proteina mitocondriale mg / g di tessuto peso fresco per il muscolo scheletrico e fegato. (D) Microscopia elettronica a trasmissione immagine di mitocondri isolati. Barra di scala è di 100 nm. Le frecce indicano la possibile contaminazione da particelle non mitocondriali e mitocondri danneggiati. Cliccate qui per vedere una versione più grande di questa figura.
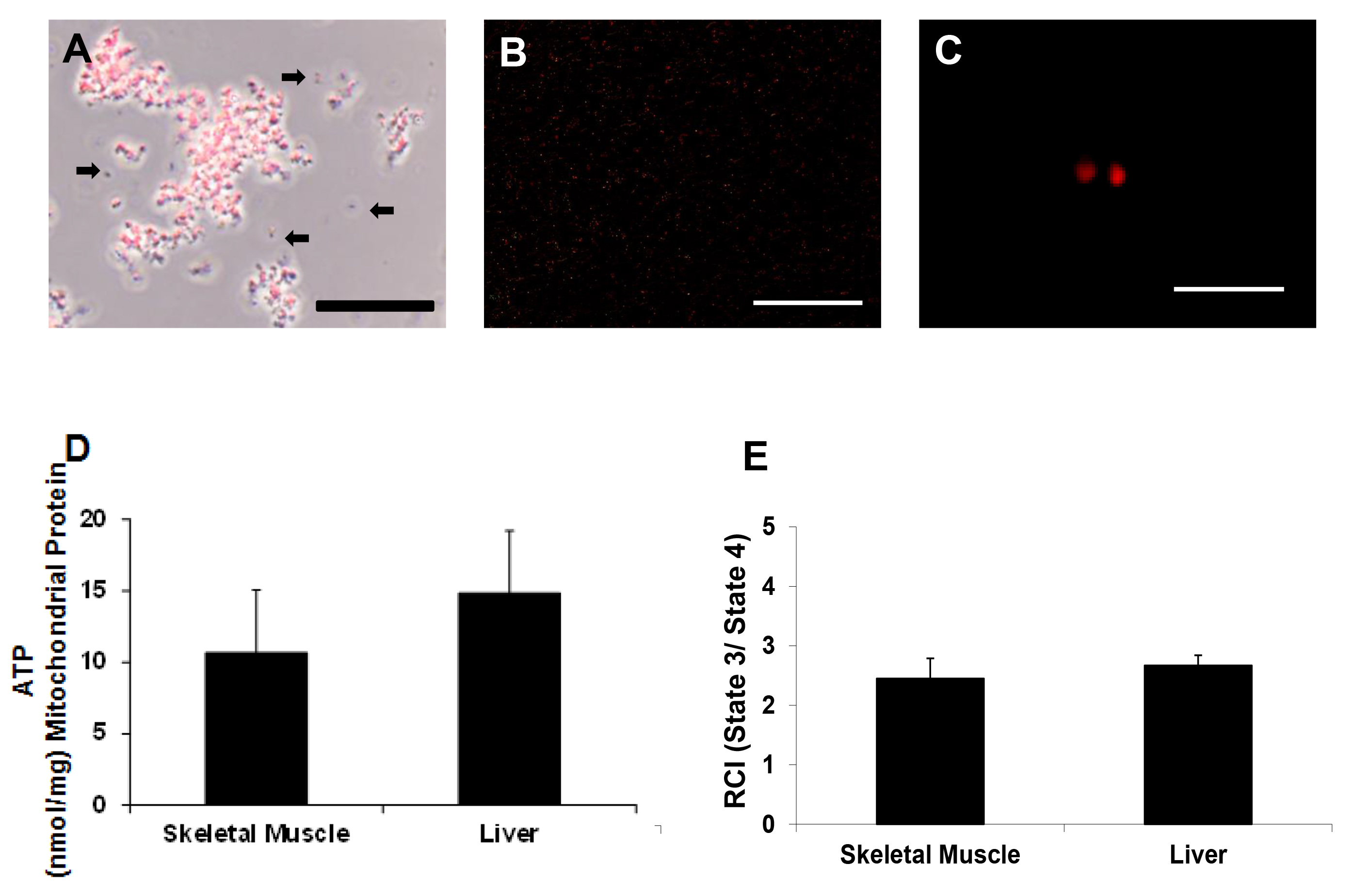 < br /> Figura 3 mitocondriale vitalità. Microfotografie rappresentativi di mitocondri isolati (A) sotto l'illuminazione a contrasto di fase e (B e C) sotto fluorescenza, con mitocondri etichettati con MitoTracker Red CMXRos. Barre di scala sono 25 micron (A, B) e 5 micron (C). Queste immagini indicano che i mitocondri mantenuto potenziale di membrana. Le frecce indicano i mitocondri mancano potenziale di membrana o detriti (D) ATP contenuto nmol / mg di proteina mitocondriale, come determinato dal test ATP e (E) RCI (stato 3 / stato 4) come determinato da elettrodo di Clark. Cliccate qui per vedere una versione più grande di questa figura.
< br /> Figura 3 mitocondriale vitalità. Microfotografie rappresentativi di mitocondri isolati (A) sotto l'illuminazione a contrasto di fase e (B e C) sotto fluorescenza, con mitocondri etichettati con MitoTracker Red CMXRos. Barre di scala sono 25 micron (A, B) e 5 micron (C). Queste immagini indicano che i mitocondri mantenuto potenziale di membrana. Le frecce indicano i mitocondri mancano potenziale di membrana o detriti (D) ATP contenuto nmol / mg di proteina mitocondriale, come determinato dal test ATP e (E) RCI (stato 3 / stato 4) come determinato da elettrodo di Clark. Cliccate qui per vedere una versione più grande di questa figura.
Carico / 51682 / 51682fig4highres.jpg "width =" 600 "/>
. Figura map 4 Piastra per test ATP Questa mappa piastra illustra come impostare standard (A1 - A12), campioni di mitocondri (B1 - C6), e negativo dei controlli (C7 - C9) per il dosaggio ATP. Durante il test, 100 ml di respirazione Buffer, 50 ml di soluzione di lisi delle cellule di mammifero e 50 ml di soluzione di substrato ricostituita vengono aggiunti a tutti i pozzetti (A1 - C9).
Discussione
Per isolare con successo mitocondri utilizzano questo protocollo è essenziale per mantenere tutte le soluzioni e campioni di tessuto sul ghiaccio per conservare la vitalità mitocondriale. Anche quando mantenuto sul ghiaccio, mitocondri isolati esporranno una diminuzione dell'attività funzionale nel tempo 19. Si raccomanda che tutte le soluzioni e le integrazioni essere pre-preparati. Abbiamo pre-pesare e immagazzinare Subtilisina A in 4 aliquote mg in 1,5 ml provette per microcentrifuga e conservare a -20 ° C. Allo stesso modo BSA è pre-pesato e conservato in aliquote da 20 mg in 1,5 ml provette per microcentrifuga che possono essere conservati a -20 ° C. Appena prima di utilizzare i tubi vengono rimossi da -20 ° C e Subtilisina A e BSA vengono sciolti in 1 ml di tampone di omogeneizzazione per l'uso nella procedura di isolamento mitocondriale.
Due pugni biopsia di tessuto muscolare scheletrico ottenuti utilizzando una biopsia 6 millimetri mitocondri forniscono sufficienti per l'uso in procedure cliniche e chirurgiche per interventi terapeutici 17-18. Per stimare il numero di mitocondri che abbiamo usato due metodi, emocitometro e conteggio delle particelle dimensione. Si raccomanda l'uso del conteggio dimensione delle particelle. Il contatore granulometria utilizza impedenza elettrica per misurare il volume di particelle che passano attraverso un'apertura di dimensioni definite. Il contatore di dimensione delle particelle è costoso, ma fornisce stime accurate e affidabili ed è user indipendente. Numero mitocondriale stimato hemocytometry è più economico. I nostri studi hanno dimostrato che questo metodo fornisce stime variabili che sono circa un ordine di grandezza inferiore a quella ottenuta utilizzando un contatore di particelle. Abbiamo anche notato che i conteggi ottenuti da emocitometro sono altamente dipendenti dal utente. Suggeriamo che per garantire stime coerenti tutti i conteggi utilizzando un emocitometro devono essere effettuate da una sola persona.
Abbiamo trovato i kit di analisi ATP per essere utile per determinare la funzione mitocondriale. Il kit fornisce tutti r necessarioeagents e fornisce un metodo semplice e veloce per determinare l'attività metabolica dei mitocondri isolati. Il dosaggio ATP fornisce risultati simili a quelli ottenuti utilizzando un elettrodo di Clark ed è quindi compatibile con il precedente analisi dei dati 20-21.
Uno dei principali vantaggi del nostro protocollo di isolamento mitocondriale è che permette per l'isolamento di un alto rendimento di vitali, respirazione mitocondri competenti liberi di contaminazione in meno di 30 min. Filtrazione differenziale al posto di centrifugazione differenziale riduce notevolmente i tempi di procedura. Altri protocolli incorporano diverse fasi di centrifugazione con il tempo complessivo di isolamento essendo 60 min a 100 min 13-17. Un altro vantaggio di questo protocollo è che omogeneizzazione tessuto è standardizzato. Il dissociatore tessuto commerciale prevede un ciclo standardizzato e produce risultati costanti e riproducibili. Questo è in contrasto con omogeneizzazione manuale che è soggetto a variabilità utente eincoerenza. Il nostro metodo per la rapida isolamento dei mitocondri mediante dissociazione dei tessuti e filtrazione differenziale fornisce un lasso di tempo di isolamento compatibile per intervento terapeutico clinica e chirurgica 17,18.
Divulgazioni
Tutti gli animali sono stati trattati in conformità con le linee guida istituzionali attuali. Noi non abbiamo concorrenti interessi finanziari da dichiarare.
Riconoscimenti
Questo studio è stato sostenuto dal National Heart, Lung, and Blood Institute di Grant HL 103542, e Distinguished Trailblazer Award Il BCH Anesthesia Research Foundation di PAC.
Materiali
| Name | Company | Catalog Number | Comments |
| Sucrose | Sigma Aldrich | 84100 | |
| HEPES | Sigma Aldrich | H4034 | |
| EGTA | Sigma Aldrich | E4378 | |
| Substilsin A | Sigma Aldrich | P5380 | |
| BSA | Sigma Aldrich | A7906 | |
| KH2PO4 | Sigma Aldrich | P5379 | |
| MgCl2 | Sigma Aldrich | M8266 | |
| NaCl | Sigma Aldrich | S6191 | |
| KCl | Fisher Scientific | P2173 | |
| Na2HPO4 | Fisher Scientific | S374 | |
| ATPlite Luminescence Assay System, 1,000 Assay Kit | Perkin Elmer | 6016941 | |
| 50 ml Conical Tubes | BD | 352098 | |
| 40 μm Nylon Filters | BD | 352340 | |
| GentleMACS C tube | Miltenyl Biotech | 120-005-331 | |
| 1.5 ml Eppendorf tube | Fisher Scientific | 05-408-129 | |
| 6 mm biopsy punch | Miltex | 33-36 | |
| 10 μm Pluristrainer | Pluriselect | 43-500-10-03 | |
| Eppendorf Centrifuge 5415C | Marshall Scientific | EP-5415C | |
| GentleMACS Dissociator | Miltenyl Biotech | 130-093-235 | |
| 96-well plates, tissue culture treated | VWR | 82050-732 | |
| Rotomax 120 orbital shaker | Heidolph | 544-41200-00 | |
| Synergy H4 Hybrid Multi-Mode Microplate Reader | BioTek | ||
| Multisizer 4 Coulter Counter | Beckman Coulter | A63076 | |
| Oxytherm System | Hansatech Instruments | ||
| Hemacytometer | Fisher Scientific | 267110 |
Riferimenti
- van Loo, G., Saelens, X., van Gurp, M., MacFarlane, M., Martin, S. J., Vandenabeele, P. The role of mitochondrial factors in apoptosis: a Russian roulette with more than one bullet. Cell Death Differ. 9 (10), 1031-1042 (2002).
- Szabadkai, G., Duchen, M. R. Mitochondria: the hub of cellular Ca2+ signaling. Physiology (Bethesda). 23, 84-94 (2008).
- Chan, D. C. Mitochondria: Dynamic Organelles in Disease, Aging, and Development. Cell. 125 (7), 1241-1252 (2006).
- Picard, M., et al. Mitochondrial structure and function are disrupted by standard Isolation methods. PLoS ONE. 6 (3), e18317(2011).
- Bensley, R. R., Hoerr, N. Studies on cell structure by freeze-drying method; preparation and properties of mitochondria. Anat Rec. 60, 449-455 (1934).
- Claude, A. Fractionation of mammalian liver cells by differential centrifugation II. Experimental procedures and results. J Exp Med. 84 (1), 61-89 (1946).
- Hogeboom, H., Schneider, W. C., Palade, G. E. Cytochemical studies of mammalian tissues; isolation of intact mitochondria from rat liver; some biochemical properties of mitochondria and submicroscopic particulate material. J Biol Chem. 172 (2), 619-635 (1948).
- Ernster, L., Schtaz, G. Mitochondria: a historical Review. J Cell Biol. 91 (3 Pt 2), 227s-255s (1981).
- Pallotti, F., Lenaz, G. Isolation and subfractionation of mitochondria from animal cells and tissue culture lines. Methods Cell Biol. 80, 3-44 (2007).
- Schmitt, S., et al. A semi-automated method for isolating functionally intact mitochondria from cultured cells and tissue biopsies. Anal Biochem. 443 (1), 66-74 (2013).
- Fernández-Vizarra, E., Ferrín, G., Pérez-Martos, A., Fernández-Silva, P., Zeviani, M., Enríquez, J. A. Isolation of mitochondria for biogenetical studies: An update. Mitochondrion. 10 (3), 253-262 (2010).
- Graham, J. M. Chapter 3, Unit 3.3, Isolation of mitochondria from tissues and cells by differential centrifugation. Curr Protoc Cell Biol. , (2001).
- Frezza, C., Cipolat, S., Scorrano, L. Organelle isolation: functional mitochondria from mouse liver, muscle and cultured fibroblasts. Nat Protoc. 2 (2), 287-295 (2007).
- Wieckowski, M. R., Giorgi, C., Lebiedzinska, M., Duszynski, J., Pinton, P. Isolation of mitochondria-associated membranes and mitochondria from animal tissues and cells. Nat Protoc. 4 (11), 1582-1590 (2009).
- Gostimskaya, I., Galkin, A. Preparation of highly coupled rat heart mitochondria. J Vis Exp. (43), (2010).
- Gross, V. S., et al. Isolation of functional mitochondria from rat kidney and skeletal muscle without manual homogenization. Anal Biochem. 418 (2), 213-223 (2011).
- Masuzawa, A., et al. Transplantation of autologously derived mitochondria protects the heart from ischemia-reperfusion injury. American J Physiol Heart and Circ Physiol. 304 (7), (2013).
- McCully, J. D., et al. Injection of isolated mitochondria during early reperfusion for cardioprotection. American J Physiol Heart and Circ Physiol. 296 (1), 94-105 (2009).
- Olson, M. S., Von Korff, R. W. Changes in endogenous substrates of isolated rabbit heart mitochondria during storage. J Biol Chem. 242 (2), 325-332 (1967).
- Diepart, C., et al. Comparison of methods for measuring oxygen consumption in tumor cells in vitro. Anal Biochem. 396 (2), 250-256 (2010).
- Lanza, I. R., Nair, K. S. Functional assessment of isolated mitochondria in vitro. Methods Enzymol. 457, 349-372 (2009).
Erratum
Formal Correction: Erratum: Rapid Isolation And Purification Of Mitochondria For Transplantation By Tissue Dissociation And Differential Filtration
Posted by JoVE Editors on 1/05/2016. Citeable Link.
A correction was made to: Rapid Isolation And Purification Of Mitochondria For Transplantation By Tissue Dissociation And Differential Filtration. An optional step was added to step 7 of the 'Mitochondrial Isolation' section of the protocol. The step is:
1. Optional in the case that the tissue is fibrous: Centrifuge the solution at 750 x g for 4 min.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon