Method Article
Новый подход к сравнительному анализу мультибелковых комплексов на основе
В этой статье
Резюме
Описанный сравнительный количественный протеомических подход направлен на получение представление в состав мультибелковых комплексов при различных условиях и продемонстрировано сравнением генетически различных штаммов. Для количественного анализа равные объемы различных фракций с градиентом плотности сахарозы, смешивают и анализировали с помощью масс-спектрометрии.
Аннотация
Введенный протокол предоставляет инструмент для анализа мультибелковых комплексов в тилакоидной мембраны, путем выявления понимание сложного состава в различных условиях. В этом протоколе подход продемонстрирована сравнением состав белкового комплекса, отвечающего за циклического потока электронов (CEF) в Chlamydomonas reinhardtii, изолированного от генетически различных штаммов. Процедура включает в себя изоляцию тилакоидных мембран, после чего их разделения на мультибелковых комплексов в градиенте плотности сахарозы центрифугирования, SDS-PAGE, иммунологического и сравнительного, количественного масс-спектрометрии (МС) на основе дифференциального метаболического маркировки (14 Н / 15 п) проанализированные штаммы. Моющие солюбилизированные тилакоидные мембраны загружаются на градиентах плотности сахарозы при равной концентрации хлорофилла. После ультрацентрифугированием, градиенты разделены на фракции, которые проанализированы масс-spectrometры на основе равного объема. Такой подход позволяет исследование состава в градиентных фракций и, кроме того, чтобы проанализировать миграционного поведения различных белков, который специально разработан для ANR1, CAS, и PGRL1. Кроме того, этот метод продемонстрировано подтверждает результаты иммуноблоттинга с и, кроме того, поддерживая выводы из предыдущих исследований (идентификации и PSI-зависимой миграции белков, которые были ранее описанных быть частью CEF-суперсложные таких как PGRL1, FNR, и цит е). Примечательно, что этот подход применим для решения широкого круга вопросов, для которых этот протокол могут быть приняты и, например, используемых для сравнительного анализа мультибелкового сложного состава, выделенного из различных условиях окружающей среды.
Введение
Фотосинтетические процессы в тилакоидных мембран растений и водорослей может функционировать в линейном и циклическом режиме. Во линейного электронного потока (LEF) фотосистемы I (PSI), фотосистемы II (ФС) и цитохром б 6 / F в конечном счете переноса электронов от воды к НАДФ + 1, что приводит к генерации НАДФН и АТФ 2. В противоположность этому, циклический поток электронов (CEF), который, как известно, индуцированный в разнообразных условиях окружающей среды, таких как состояние 2 3 и 4 анаэробных условиях, приводит к уменьшению повторного окисленного PSI инжекцией электронов обратно в цепи транспорта электронов. Этот процесс может происходить либо в стромальных стороне цитохрома Ь 6 / ж комплекса 1 или на пластохинона бассейн 5 и генерирует АТФ, но не НАДФН 2.
Целью представленного протокола является продемонстрировать масс-спектрометрии (MS) на основе меню для сравнительного, количественного анализа мультибелковых комплексов в мембранах тилакоидов из Chlamydomonas reinhardtii, чтобы разобраться в состав этих комплексов в различных условиях (на примере сравнения генетически различных штаммов). Этот подход был применен в публикации Terashima и соавт. В 2012 показывая Ca 2 +-зависимый регулирование CEF в С. reinhardtii посредничестве мультибелкового комплекса, включающего белков CAS, ANR1 и PGRL1 6. Процедура будет объяснено сравнительно анализа состава в CEF-суперсложные в двух генетически различных штаммов, тем самым воспользовавшись маркировки один из двух штаммов с тяжелой азота (N) 15. Вкратце, протокол включает в себя подготовку мембран тилакоидов, а затем моющего растворения и фракционирования фотосинтезирующих комплексов в градиентом плотности сахарозы. После фракционирования градиента, выбранный гидроразрываций двух штаммов смешивают на основе равного объема, разделенных электрофорезом в ДСН-ПААГ с последующим в геле пищеварения и последующего количественного анализа MS.
Как упоминалось выше, CEF индуцируется в различных экологических условиях и публикация с 2010 демонстрирует изоляцию функциональной CEF-сверхсложных от государства 2 заблокированные клетки C. reinhardtii 7, который был выполнен путем разделения растворенные тилакоидных мембран на градиент плотности сахарозы в течение ультрацентрифугирования. В отличие от Иваи и соавт. 7, представленный протокол описывает изоляцию CEF-сверхсложных от анаэробной выращенного С. reinhardtii культуры, следуя альтернативную процедуру. Это включает в себя изменения в протокол изоляции тилакоидной а также различия в отношении стадии солюбилизации и разделение белковых комплексов посредством ультрацентрифугирования. В настоящем Протоколе, тилакоидные мембраныизолированы с помощью процедуры, опубликованный Чуа и Bennoun 8, в то время как буферы используются для тилакоидной подготовки по Иваи и др.. содержится 25 мМ MES, 0,33 М сахарозы, 5 мм MgCl 2, 1,5 мМ NaCl (рН 6,5), как описано 9. Растворение проводили с 0,7-0,8% моющего средства (н-тридецил-β-D-мальтозид) в течение 30 мин на льду в случае Iwai с соавторами, а метод солюбилизации описано здесь основана на использовании 0,9% моющего средства (п -додецил-β-D-мальтозид (β-DM)) и выполняется в течение только 20 минут на льду. Обе группы использовали 0,8 мг на мл хлорофилла для солюбилизации с соответствующим моющим средством. Для разделения фотосинтезирующих комплексов от растворенных мембран тилакоидов Иваи и др.. Применяется концентрации сахарозы между 0.1-1.3 M, в то время как авторы этого протокола используется концентрациях от 0,4-1,3 М. последняя разность скорость центрифугирования, что ниже по сравнению к еаrlier публикации.
Солюбилизация мембран тилакоидов с неионогенных моющих средств с последующим градиент плотности сахарозы фракционирования уже применяется в многочисленных исследованиях не начиная с 1980-х до сегодняшнего дня 7, 9-14, а также применение метаболического маркировки белков является распространенным методом в области протеомики. Описанный подход применяет 15 N метаболизма маркировки для одного из двух сравниваемых штаммов при культивировании ее в присутствии тяжелого азота в качестве единственного источника азота в виде 15 N NH 4 Cl, который включен во все аминокислоты, ведущих к массе сдвиг в зависимости от аминокислотной последовательности пептида. При анализе смесь 14 N и 15 Н в течение одного MS работать, этот сдвиг массы могут быть использованы для определения образца происхождение для каждого пептида и пептида относительной распространенности можно рассчитать относительное содержание представляющий для соответствуютING белок 15.
Многочисленные количественные протеомики исследования по С. reinhardtii доступны, которые сравнивают определенное количество белка для анализа изменений в протеоме между экспериментальных условиях (например, изменения в протеоме из-за питательной 16-19 или светло стресса 20,21). По сравнению с теми исследований, в настоящее время, представленного подхода равные объемы образцов объединены и проанализированы. Эта установка позволяет изучить поведение миграции белков внутри градиента и, кроме того, чтобы проанализировать состав различных комплексов по отношению к исследованных штаммов.
Этот метод будет объясняется главным образом сосредоточиться на трех белков: Первым кандидатом является кальций белка датчик CAS хлоропластов локализованные, который был показан принять участие в фото-акклиматизации в С. reinhardtii 22. Кальций считается важным сигналомING ион для путей, которые активируются в силу различных биотических и абиотических стрессов, наконец, приводит к изменениям в экспрессии генов и клеточной физиологии 23, и было предложено, что хлоропласты могут способствовать сотовой Са 2 + сигналов посредством белка CAS 22,24,25. Второй белок ANR1 (анаэробная реакция 1 6), белок, который был показан быть вызван в бескислородных условиях выращивания в С. reinhardtii 26. В частности, CAS а также ANR1 были идентифицированы как субъединиц CEF-суперсложные и кроме того, с помощью обратного генетические подходы, было показано, что оба белка способствовать функционально CEF в естественных условиях 6, поддерживая их роли в качестве функциональных субъединиц этого белкового комплекса. Третий белок тилакоидной белок PGR5-Как 1 (PGRL1), который был показан принять участие в CEF в хламидомонады 4,27, а также в Arabidopsis 5,28 и был также идентификаторentified в работе Иваи и соавт. 7
Этот подход будет представлен, показывающий результаты двух разных экспериментов: дикого типа (WT) по сравнению с (по сравнению) штамм ΔPSI 29, демонстрируя делецию гена psab, кодирующую существенной фотосистемы I-субъединицы, которая также является частью CEF-сверхсложные и WT против pgrl1 нокаут нагрузку 4. Для каждого из этих экспериментов количественный состав CEF-суперсложные между 15 и N-14 N-меченого штамм был по сравнению.
протокол
1. Культивирование хламидомонады
- В следующем С. reinhardtii штаммы были использованы в данном исследовании: WT cc124, WT cw15-arg7 (клеточной стенки дефицитных и аргинин ауксотроф), ΔPSI мутантный штамм 29 и pgrl1 нокаут штамм 4.
- Все штаммы выращивали в Трис-ацетат-фосфат (TAP)-средних 30, при 25 ° С с непрерывным интенсивности света 20-50 мкЕ / м 2 сек и встряхивании при 120 оборотах в минуту. Культура ΔPSI должны быть обернуты с некоторым папиросной бумаги для освещенности <5 мкЕ / м 2 сек.
- Культуры меченых штаммов (ΔPSI и WT cc124 соответственно) содержится 7,5 мм 15 N NH 4 Cl, тогда как культуры для nonlabeled штаммов (WT cw15-arg7 и pgrl1 соответственно) содержится 7,5 мм 14 N NH 4 Cl. Клетки должны расти, по крайней мере четыре порождающимионы по достижению полного маркировку и должны храниться при экспоненциальной фазе роста.
- За день до начала рассчитывать эксперимент и разбавить клетки до плотности 1 х 10 6 клеток / мл в объеме не менее 750 мл / деформации.
Обратите внимание, что два типа разрывных градиентах плотности сахарозы описаны в следующей методике. В плотности фотосистемы сахарозы градиенты в соответствии с Такахаши и др.. 9 используются для разделения различных фотосинтеза белковые комплексы из изолированных и солюбилизированных тилакоидов во время в течение ночи центрифугирования и должны быть готовы за день до (см. Протокол 2) и тилакоидной градиентах плотности сахарозы 8 применяются в процессе выделения тилакоидной (см. протокол 3).
2. Подготовка Фотосистема плотности сахарозы градиенты
- Для заливки градиенты необходимы три растворы:
- 2 М сахарозы
- 10% β-ДМ в Н 2 О
- 0,5 М Трицин, рН 8,0 (NaOH)
- Используя эти запасы, подготовить следующие решения:
Концентрация: 1,3 М 1,0 М 0,85 М 0,7 М 0,65 М 0,4 М 2 М сахарозы 13 мл 10 мл 8,5 мл 7 мл 6,5 мл 4 мл 10%46;-DM 100 мкл 100 мкл 100 мкл 100 мкл 100 мкл 100 мкл 0,5 М Трицин 200 мкл 200 мкл 200 мкл 200 мкл 200 мкл 200 мкл H 2 O 6,7 мл 9,7 мл 11,2 мл 12,7 мл 13,2 мл 15,7 мл - Используйте 14 мм х 89 мм центрифужные пробирки и залить градиенты очень медленно, начиная с самой высокой плотностью сахарозы решения нижнего решения плотности.
- Налейте только на 1 мл каждого 1,3 и 1,0 М растворов и 2 мл для остальных решений.
- Оставьте градиенты на ночь в холодной комнате.
3. Анаэробные Индукционная и выделение мембран тилакоидов 8
- Перед началом изоляции тилакоидных мембран, индуцируют анаэробных условий барботированием аргоном в течение 4 часов. Выделение пузырьков может быть выполнена с помощью стеклянной пипетки в культивирования колбы при постоянном перемешивании культуры с магнитной мешалкой.
- Начнем с выделением тилакоидных мембран по гранулирования клеток в течение 5 мин при 2500 х г, ресуспендируют в буфере H1 (0,3 М сахарозы, 25 мМ HEPES (рН 7,5), 5 мМ MgCl 2).
(Обратите внимание, что, когда, начиная с выделения мембран тилакоидов образцов шульд быть на льду, чтобы избежать деградации белка, все стадии центрифугирования осуществляются при 4 ° С и работает в перчатках, настоятельно рекомендуется, чтобы избежать кератина загрязнения.) - Гранул клетки в течение 5 мин при 2500 мкг, ресуспендируют в H1 буфера.
- Перерыв клетки с двумя проходами через распылитель с давлением азота 1500 гПа (для штаммов без клеточной стенки сделать только один проход).
- Спином вниз клетки для 7 мин при 2500 х г.
(После этого шага супернатант должен быть светло-зеленый, если нет, то клетка поломка не была успешной.) - Ресуспендируют клеток в H2 буфера (0,3 М сахарозы, 5 мМ HEPES (рН 7,5), 10 мМ ЭДТА (рН 8,0)) и гранул клеток течение 10 мин при 32800 х г.
- Ресуспендируют клеток в H3 буфера (1,8 М сахарозы, 5 мМ HEPES (рН 7,5), 10 мМ ЭДТА (рН 8,0)) и гомогенизируют гранул с гончара (нет зеленого частицы не должны оставаться в конце этого рабочего этапа).
- Подготовка тилакоидных градиентов плотности сахарозы в ваннойэс (25 мм х 89 мм) по начиная с нижней слоем 12 мл H3 буфер с клетками, залить средний слой 12 мл H4 буфера (1,3 М сахарозы, 5 мМ HEPES (рН 7,5), 10 мМ ЭДТА ( рН 8,0)) и на верхней 12 мл H5 буфера (0,5 М сахарозы, 5 мМ HEPES (рН 7,5), 10 мМ ЭДТА (рН 8,0)). Будьте осторожны при заливке градиенты и избежать смешивания из трех слоев.
- Весы с H5 буфер и центрифуги тилакоидные сахарозы градиенты плотности течение 1 часа при 70700 х г.
- Удалить тилакоидных полосы от тилакоидных градиенте плотности сахарозы и разбавить их с соответствующим буфером объем H6 (5 мМ HEPES (рН 7,5), 10 мМ ЭДТА (рН 8,0)).
- Спином вниз клетки в 37900 мкг в течение 20 мин. Если гранулы не плотно, более H6 буфер необходим для этой стадии центрифугирования.
- Ресуспендируют тилакоиды в небольшом объеме H6 буфера и заполните определения концентрации хлорофилла.
4. Определение хлорофилла концентрации 31
- Определение количества хлорофилла осуществляется с 80%-ным ацетоном.
- Смешайте 995 мкл 80% ацетона и 5 мкл тилакоидов в H6 буфера (разведение 1:200).
- Vortex в течение нескольких секунд, пока не зеленые частицы остаются и затем спина вниз на 14,1 мкг в течение 5 мин.
- Возьмите супернатант и измерить вымирание на 663,6 и 646,6 нм и 750 нм, соответственно.
- Рассчитайте количество хлорофилла по следующим формулам:
- С Хл [мг / мл] = (0,01225 * E 663,6 - 0,00255 * E 646,6) * коэффициент разбавления
- С Хл б [мг / мл] = (0,02031 * E 646,6 - 0,00491 * E 663,6) * коэффициент разбавления
- С Хл [мг / мл] = С Хл + C Хл б
5. Загрузка Фотосистема плотности сахарозы градиенты
- Рассчитайте количество тилакоидов, β-DM и H6 буфера, которые необходимыдля каждого градиента:
- Каждый градиент должен быть загружен с общим объемом 700 мкл с 0,8 мг / мл хлорофилла в 0,9% β-DM (растворить β-DM в Н 2 О), заполнить оставшийся объем с H6 буфера.
- Для растворения готовить различные аликвоты с тилакоидов, β-DM и H6 буфера для каждого градиента.
- Оставьте образцы в течение 20 мин на льду с регулярно смешивания (обращения) каждые несколько минут (растворение шаг).
- Центрифуге при максимальной скорости (14000 мкг) в течение 10 мин при 4 ° С.
(После центрифугирования осадок должен быть небольшим и беловатый в то время как супернатант темно-зеленого цвета.) - Загрузите супернатант от градиентов.
- Весы с H6 буфер и спин помощью ультрацентрифугу на 134470 мкг в течение ночи (14 ч) при 4 ° С
(Обратите внимание, что успешное разделение фотосинтезирующих комплексов с использованием градиентов плотности фотосистемы сахароза, представленные в этом протоколе достигается только при условии Усинг свежевыделенные тилакоиды, так как предсказание для растворения и сложной разделения трудно сделать при работе с мембранах тилакоидов, которые были заморожены до.)
6. Фракционирование Фотосистема плотности сахарозы градиенты
- Сфотографируйте градиентов.
- Прокол отверстие в нижней части трубки с помощью иглы и фракционирования градиенты в 500 мкл труб. В качестве альтернативы, фракционирование может также быть осуществлена с использованием 96-луночного планшета (микропланшет).
- При использовании микропланшет, определяют оптическую плотность разных градиентных фракций при 675 нм.
(На этом этапе образцы могут храниться при температуре -80 ° С в течение нескольких недель.)
7. SDS-PAGE и Иммунологический
(Обратите внимание, что только для сравнения WT против ΔPSI вестерн-блот анализ был проведен, чтобы выбрать фракций для последующего MS-анализа. Для эксперимента WT против pgrl1 птДействия были выбраны посредством оптической плотности в различных фракциях.)
- Отдельные 30 мкл каждой фракции от WT и ΔPSI градиента на 13% SDS полиакриламидном геле 32.
- Выполните Вестерн-блоттинга 33, используя следующие антитела: ANR1 (TEF7) 26, PGRL1 34, CAS 6, PSI субъединицы PSAD 32 и ФС II ядро субъединицы D1. Используйте все антитела при разведении 1:1000 (для улучшенного метода обнаружения хемилюминесценции), для антитела D1, который должен быть использован при разведении 1:10000 исключением.
- На основании результатов иммунологического, взять пиковые фракции ANR1, PGRL1 и PSAD для WT и ΔPSI (здесь фракции 6 и 13, соответственно), смешать 30 мкл фракции 6 из WT и ΔPSI и сделать то же самое с фракцией 13 от оба препарата и разделить их снова на 13% SDS полиакриламидном геле.
- Для количественного сравнения WT против pgrl1 принять СEF-сверхсложные фракции, как это определено путем измерения оптической плотности в различных градиентных фракций и смешать 30 мкл обоих образцов с последующим разделением на 13% SDS полиакриламидном геле.
- Пятно белковых полос с раствором Кумасси (85% фосфористой кислоты, 757 мМ сульфат аммония, 1,2% кумасси бриллиантовым голубым, 20% метанол) в течение 2 ч при комнатной температуре или в течение ночи при 4 ° С.
- Для удаления неспецифическую окрашивание, мыть несколько раз DDH 2 O.
- Нарежьте полосы в 1 мм гелевых кусочки и приступить к перевариванию в геле.
(С другой стороны, образцы можно сушить несколько минут в вакуумной центрифуге и хранить в течение нескольких недель, прежде чем продолжить пищеварения в геле.)
8. В геле Пищеварение (изменения от Шевченко и др. 35.)
Пожалуйста, обратите внимание, чтобы подготовить все буферы и решения непосредственно перед применением и принять стеклянные бутылки для буферов, содержащих ацетонитрил (ACN). <бр /> ВНИМАНИЕ! Работа с ACN может быть вредным; более подробную информацию можно скачать с сайта: http://www.sciencelab.com/msds.php?msdsId=9927335 (2013).
- Вымойте кусочки геля с> 10 объемов DDH 2 O (~ 200 мкл) в течение 30 сек.
- Инкубируйте геля штук 300 мкл 25 мМ NH 4 HCO 3 в течение 15 мин при встряхивании, удалить жидкость.
- Инкубируйте кусочки геля с 300 мкл 25 мМ NH 4 HCO 3 в 50% ACN (приготовить путем смешивания ACN и 50 мМ NH 4 HCO 3 в соотношении 1:1) в течение 15 мин при встряхивании удалить жидкость.
- Если кусочки геля все еще синий, повторяю NH 4 HCO 3 и NH 4 HCO 3 / ACN моет, пока большая часть Coomassie не будет удален.
(Хотя большая часть окрашивания кумасси должны быть удалены, это не является необходимым для destain на кусочки геля полностью.) - Добавить 100 мкл ACN для обезвоживания куски геля в течение 5 мин. Куски геля должны сокращатьсяй выглядеть совершенно белый.
- Удалить столько ACN, насколько это возможно и заполните трипсина пищеварения. Кроме того, образцы можно хранить при -20 ° С в течение нескольких недель.
- Добавить 10-20 мкл на полосе 20 нг / мкл трипсина в 10% ACN / 25 мм NH 4 HCO 3 (недавно разбавленный), держать образцы на льду.
- Через 30 мин проверить, все раствор абсорбировали и добавить больше трипсина буфер, если это необходимо. Гель части должны быть полностью покрыты трипсина буфера. Хранить образцы на льду.
- Оставьте гель куски еще на 90 мин на льду, чтобы насытить их трипсином.
(Критический шаг: выход триптических пептидов значительно возрастает с увеличением времени инкубации на льду, вероятно, из-за медленной диффузии фермента в полиакриламидном матрицы Надо иметь небольшой избыток раствора покрытия гель части, чтобы избежать, что куски. падать сухой во время инкубации в течение ночи.) - Дайджест при 37 ° С в течение 4-6 часов. Для проведения экспериментов, требующихмаксимальная восстановления пептид, переварить в одночасье.
- После переваривания спин вниз сгущенное буфер.
- Соникатные трубы для 5 мин для элюирования пептидов и центрифуги снова.
- Сбор супернатант и перенести его в новую пробирку.
- Выполните извлечение пептида с 80 мкл 30% ACN / 1% муравьиной кислоты (FA) в звуковой бане в течение 15 мин.
- Выполнение экстракции 80 мкл 30% ACN / 1% FA в звуковой бане в течение 15 мин.
- Выполнение экстракции 80 мкл 70% ACN / 1% FA в звуковой бане в течение 15 мин.
- Центрифуга снова и бассейн супернатант с предварительного элюата.
(ФА служит для инактивации трипсина и увеличить пептидной растворимости.) - Сухой раствор пептида полностью в вакуумной центрифуге.
(На этом этапе образцы могут храниться в течение нескольких недель в -20 ° С, до того как MS-анализа). - Ресуспендируйте пептиды в 6 мкл MS буфера (5% ACN, 0,1 об / об FA, воды) и ультразвуком в течение 2-5 мин.
- Центрифуга образцов при MaximuСкорость м в течение 5 мин, чтобы удалить материал в виде частиц.
- Используйте 4 мкл супернатанта для масс-спектрометрического анализа.
9. MS-анализа данных с "Proteomatic"
Анализ данных проводили с открытым исходным кодом программного обеспечения "Proteomatic" (который может быть загружен в http://www.proteomatic.org/), платформе, которая позволяет генерировать и завершение MS / MS оценки данных трубопроводов, с помощью свободные и несвободные программы 36. Коротко, настройки описаны ниже и более подробную информацию можно найти в 6,26.
- Идентификации и количественной оценки MS-данных
Идентификация и количественное определение белков из экспериментов WT против ΔPSI были сделаны с OMSSA (версия 2.1.4 37) и qTrace 26, соответственно, как описано 6,26. Для анализа МС-данных от эксперимента WT против pgrl1 следующих обновленный трубопровод был использован:- В дополнение к OMSSA 37, белки также были определены с X! Тандем (версия 2013.02.01 38). Оба алгоритма были применены с помощью функции поиска в базе данных генерируется путем объединения JGI хламидомонады ген модель базы данных версии 4.3 с базой данных Огастес версии 10.2, а также против объединенной базе данных NCBI базы данных BK000554.2 и NC_001638.1.
- MS 2 идентификации пептидов проводили с использованием мишени приманки подхода 39. Манок для каждого белка был создан случайно перетасовки триптических пептиды, сохраняя при этом избыточность nonproteotypic пептидов.
- Статистическая проверка пептидов проводили с qvality программного обеспечения (версия 0.3.3 40) с использованием ошибке задней вероятность (PEP) пороговое менее 0,01 и результаты были отфильтрованы с предшественника массового допуском 5 частей на миллион.
- Пептиды из OMSSA и X! Тандем работает присоединились и количественно с qTrace 26 применяя следующие шаги фильтра: требуют MS 2 идентификацию, добавить имена белка / информацию о группе и требуют обе сестры пептиды.
Чтобы исследовать ли соотношение белка значительно отличались друг к другу в смешанных CEF-сверхсложные фракций из WT и pgrl1, Статистический анализ проводили с применением программы SPSS программного обеспечения (версия 21). В субъединицы цитохром б 6 / F комплекса были испытаны против друг друга, а также белков FNR, FTSH2 и HCF136 против PSI субъединиц. Пептидные отношения каждого сканирования подсчета на белка всех четырех повторах были протестированы на нормального распределения с теста Шапиро-Wilks. Так как популяция пептидные не нормально распределены (р <0,001), были выполнены непараметрические статистики. Во-первых, критерий Крускала-Уоллиса был применен оценки значительное расхождение между группами. Только если этот тест предсказал существенное различиес между группами, дальнейший анализ проводили предсказать значимых различий между двумя независимыми группами с Mann-Whitney U-тест.
Результаты
Введенный количественный подход протеомика стремится охарактеризовать состав мультибелковых комплексов в мембранах тилакоидов показывает сравнительный анализ CEF-сверхсложных компонентов в генетически различных C. reinhardtii штаммов. Описанный метод был успешно применен на Terashima соавт. 6 и включает в себя изоляцию мембран тилакоидов из анаэробных вырос культур, а затем моющего растворения. Впоследствии образцы загружаются градиента плотности сахарозы на основе равного количества хлорофилла и комплексы на фракции ультрацентрифугированием. Для количественного анализа MS-равные объемы двух градиентных фракций из различных штаммов смешивают и сравнительный анализ (рис. 1). Представленные результаты включают сравнение CEF-сверхсложные фракции между WT cw15-arg7 и ΔPSI а также WT cc124 и pgrl1 соответственно.
Для сравнения CEF-сверхсложных компонентов между WT и штамма фракции ΔPSI 6, несущих CEF-сверхсложных в WT и часть 13, пиковую часть ANR1 в штамме ΔPSI, как показали иммуноблоттинге (2А и 2В) были выбраны 6. Рисунок 3 показывает относительные коэффициенты белка как WT / ΔPSI (14 Н / 15 N) в течение нескольких ядра PSI и LHCI белков (светло-уборочных белков PSI также назван Lhca белков), а также для белков, назначенных с CEF-сверхсложных. Как и ожидалось, PSI основные белки встречаются только в образцах WT продемонстрированных отношений бесконечности в обеих фракциях. Lhca2 и Lhca9 обогащены в WT, в то время как Lhca4 -6 и -8 показать другую регулирование в обеих фракциях. Важно отметить, что LHCI белки синтезируются и накапливаются как правило, в ΔPSI мутанта 41. Сравнение полипептид по PSI-LHCIКомплекс из С. reinhardtii WT с комплексом LHCI мутанта ΔPSI показало, что большинство из Lhca2, -3 и -9 видимому, лишь слабо связаны с LHCI и, кроме того, что наличие ядра PSI необходимо для стабильного связывания. В противоположность этому, Lhca1, -4, -6, -7, -8 и образуют сложную независимую от сборки 14 PSI, которые могли бы объяснить различную регулировку Lhca4, -6 и -8 в настоящем эксперименте.
Для белков, которые будут назначены с CEF-суперсложные, его можно отличить от тех, которые являются более обильными в WT фракции 6 и фракции 13 ΔPSI мутанта, показывая сильное PSI-зависимой миграции отображаемый соотношении выше, чем одна на фракции 6 и Коэффициенты ниже, чем один или не обнаружено во фракции 13 (Lhcbm5, PGRL1, ANR1, ССС, ПФО, HCF136 и цит е) и те, которые показывают не такой сильный, но все же локализации PSI-зависимыми (ФНР, FTSH1, FTSH2 и АРМП ).
С помощью этого эксперимента Terashima соавт. 6 продемонстрировали миграционного поведения PSI-зависимых для ANR1 и CAS (2А-D и рис. 3), тем самым раскрывая их как новые белки в CEF-сверхсложных, ранее не определены 7. Выводы MS-анализа были подтверждены иммунологического и поддерживается приложением обратной генетики для подтверждения функциональной роли этих белков для CEF в естественных условиях 6. Кроме того, этот сравнительный MS-подход решительно поддерживает результаты предыдущих исследований, подтвердив белки, которые уже продемонстрировали свою часть CEF-сверхсложных таких как PGRL1, цит е и ФНР 7, а также Lhcbm5 7,9, чтобы показать PSI-зависимой локализации в градиент плотности сахарозы, что сопоставимо с ANR1 и CAS.
Сравнение фракции 6 и 13 anr1 и ΔPSI с использованием той же approacч (см. рис S8 6) продемонстрировали аналогичный состав CEF-сверхсложных в anr1 и той же тенденции к белкам ANR1, CAS и PGRL1 как показал в эксперименте WT против ΔPSI. Следует отметить, что хотя отношение белка ANR1 во фракции 6 (anr1 против ΔPSI) сравнимо с отношением WT против ΔPSI эксперимента, количество КАН и PGRL1-видимому, выше в первом эксперименте, и может быть результатом компенсации для понижающей регуляции ANR1 6.
Кроме того, обогащение ANR1 и КАН в CEF-сверхсложные фракции можно также вывести PSI-зависимой миграции нескольких других белков из этого эксперимента. Это два АТФ-зависимых металлопротеазами FTSH1 и FTSH2, которые играют фундаментальную роль в деградации ФС II центральной реакция белка D1 в хлоропластах 42,43, prefoldin-область, содержащая белок, HCF136, которая является решающим фактором для стабильности или assembлы из ФС II 44 и γ субъединицы АТФ-азы. В то время как для более поздний, соотношения между фракции 6 и 13 не показывают такой четкое различие, дальнейшие эксперименты должны проводиться для проверки, может ли другие белки также кандидаты от CEF-сверхсложных.
В качестве доказательства концепции эксперимента для этого сравнительного подхода, мы проанализировали состав CEF-сверхсложные в двух штаммов, которые оба имеют PSI, что позволяет формирование этого комплекса. Были выбраны соответствующие фракции на основе измерений оптической плотности фракционированных градиентов. Фиг.4А и 4В показаны результаты для количественного сравнения между WT и pgrl1 нокаут-штамма. Следует отметить, что ANR1 и CAS не удивительно изменилась между WT и pgrl1. Интересно, HCF136 кажется, обогащенный WT, в то время как FTSH2 кажется, обогащенный pgrl1. Статистически сиgnificant разница для обоих вышеупомянутых белков для всех PSI-субъединиц (в том числе белков LHCI) может быть подтверждена.
Кроме того, цитохром б 6 / F сложные подразделения CYT е и PETO было показано, что значительно отличается от цит B 6, цит б 6 / ж IV и PETC соответственно. Примечательно, цит е, кажется, до регулируемых в pgrl1, в то время как цит б 6 и цит б 6 / F IV немного вниз регулируется, хотя регулирование цит е синтеза, вероятно, включает в себя CYT B 6 и цит б 6 / F IV 45 . Ядерная кодировке ПТК, который также известен как Rieske белка показана аналогичная регулирование как цит B 6 и цит б 6 / F IV (т.е. вниз-регулирование в pgrl1). Это поразительно, как уменьшение или отсутствие белка Rieske еще приводить к накоплению в противномэ цит б 6 / F подразделения до ~ 60% от уровня WT в С. reinhardtii 46. Кроме того, повышающей регуляции Peto в pgrl1 Важно отметить, так как это слабо связаны субъединицы было показано, чтобы накопить к снижению уровня в C. reinhardtii мутанты, лишенные либо CYT B 6, цит б 6 / F IV или PETC 47, которые являются менее распространены в pgrl1 сравнению с WT в настоящем эксперименте.
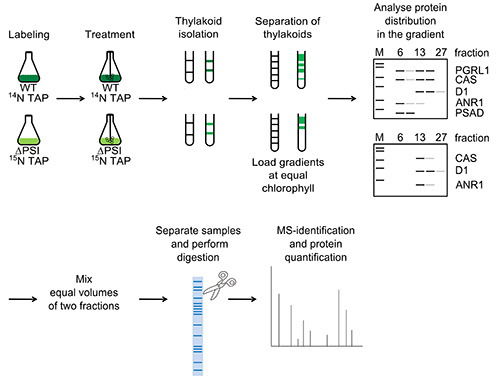
Рисунок 1. Экспериментальная рабочий процесс, как изображено на WT и ΔPSI. Клетки метаболически метили в течение по крайней мере четырех поколений, анаэробные условия, индуцированные аргона пузырьков в течение 4 часов и тилакоидные мембраны изолированы через градиента разделения. IsolaТед мембраны растворяют с помощью β-DM, наносили на градиент плотности сахарозы (для обоих штаммов равные количества хлорофилла применяются на этом этапе) и центрифугировали в течение ночи. Градиентные фракции собирают и анализируют с помощью SDS-PAGE, а также иммунологического, чтобы определить распределение белков в градиенте. Для идентификации белков с PSI-зависимой миграции, равных объемов CEF-сверхсложных фракции WT (фракция № 6) и соответствующей 15 N-меченого фракции из штамма ΔPSI смешивали и сравнительный анализ. То же самое было сделано с пиковой фракции ANR1 в штамме ΔPSI (фракция № 13). Для сравнительного количественного, MS-подхода, смешанные образцы белка были разделены электрофорезом в ДСН-ПААГ, белковые полосы окрашивали кумасси голубым раствором, а затем в геле пищеварения до MS-анализа. Нажмите здесь, чтобы увеличить ИмаGE.
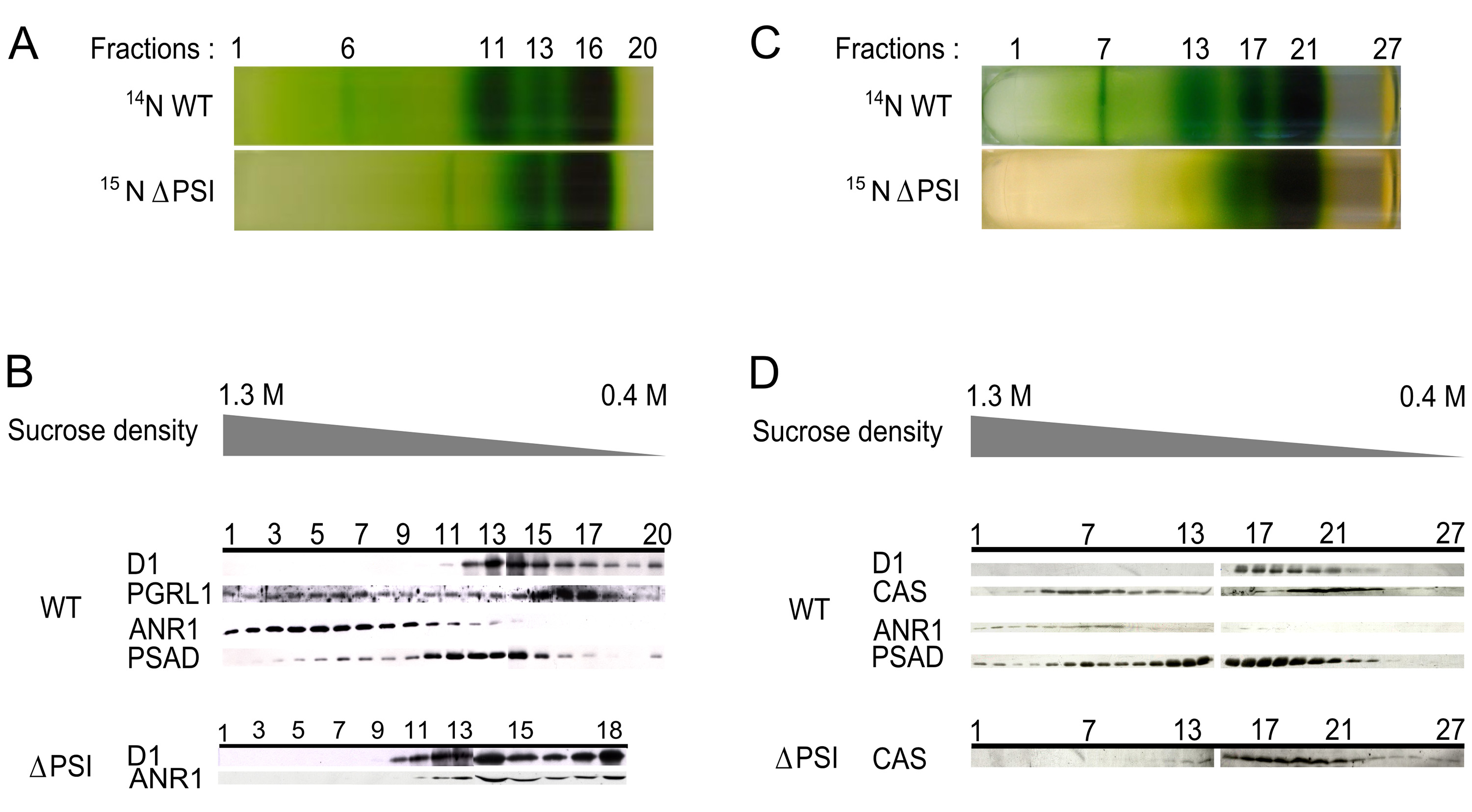
Рисунок 2. ANR1 и CAS мигрируют в нижней плотности регионов штамма ΔPSI. :. Плотности сахарозы градиенты WT и ΔPSI тилакоидов, выделенных из анаэробных условиях были разделены на 20 фракций B: иммунодетекции ANR1 в 20 фракций градиента от WT и ΔPSI. В то время как этот белок локализуется в области более высокой плотности в WT (фракция 6) это до-переместился в нижней плотности регионов в штамме ΔPSI (фракция 13) С:. Плотности сахарозы градиенты WT и ΔPSI тилакоидов изолированы от анаэробные условия были разделены на 27 фракций D:. иммунодетекции CAS в 27 фракций градиента от WT и ΔPSI. В то время как этот белок локализован то регионе с более высокой плотностью в WT (пик вокруг фракции 7) это до-переместился в нижней плотности регионов в штамме ΔPSI (пик вокруг фракции 19). (Эта цифра была изменена с Terashima др.. 6). Нажмите сюда, чтобы посмотреть увеличенное изображение.

Рисунок 3. Относительная отношения протеина, определенные во фракции 6 и 13 от БТ и ΔPSI количественной масс-спектрометрии. Фракции 6 и 13 от БТ были по сравнению с соответствующими фракций из 15 N-меченого штамма ΔPSI. Относительные показатели белка, которые представляют два биологических повторяет и три MS-работает изображены как WT / ΔPSI (14N 15 / N) для обоих анализировали фракции за исключением цит F, который был идентифицирован только во фракции 6. Этот сравнительный количественный анализ показывает, что ANR1 и CAS показать PSI-зависимой миграции в градиента плотности сахарозы (эта цифра была изменена с Terashima др.. 6). Нажмите сюда, чтобы посмотреть увеличенное изображение.

Рисунок 4. Относительные показатели протеина, определенные в CEF-сверхсложные фракции WT и pgrl1 количественной масс-спектрометрии. A: плотности сахарозы градиенты WT и pgrl1 тилакоиды выделенные из анаэробных условиях B:. Относительные показатели белка betweeн CEF-сверхсложные фракция вытекающие из четырех различных повторах изображается как WT / pgrl 1 (14 Н / 15 N). В этом эксперименте ANR1 и CAS не удивительно изменилась, в то время как FTSH2 и HCF136 демонстрируют существенные различия по сравнению со всеми PSI-субъединиц (р ≤ 0,001, как указано на *** красным; HCF136: 1900 б 6 / F сложные подразделения CYT е и PETO было показано, что значительно отличается от цит B 6, цит б 6 / ж IV и PETC, соответственно (р ≤ 0,001, как указано *** в синий; цит е : 2684 Щелкните здесь, чтобы посмотреть увеличенное изображение.
Обсуждение
Различные количественные протеомные исследования с использованием стабильным изотопом маркировки были опубликованы в последние годы. В этих экспериментах обычно два различных образцов сравниваются, из которых один образец помечен стабильного изотопа. После этого белки или пептиды из двух образцов объединены в равном соотношении и дополнительно обрабатываются вместе 48. Такие исследования часто намерены сравнить определенные изолированные клеточные отсеков (например, хлоропласты, митохондрии, или мембран тилакоидов) подвергаются различным условиях стресса 26,34,49 по расследованию вверх или вниз регулирования специфических белков. Описанный сравнительный количественный протеомических подход направлен на анализ состава мультибелковых комплексов в тилакоидной мембраны и, в отличие от вышеупомянутых исследований, основан на смешивании такой же объем образцов после отделения плотности сахарозы тилакоидных мембран, загруженной в равной концентрации хлорофилла перед ultracentrifugaТион. Этот метод был эффективно применяться Terashima и соавт. 6, которые сравнительный анализ состава CEF-сверхсложные выделен из дикого типа и штамма ΔPSI для идентификации белков, мигрирующих PSI-зависимым в градиенте плотности сахарозы.
Достижение этой стратегии подтверждается тем фактом, что MS-результаты дополнительно подтверждается иммунологического. Кроме того, Terashima и соавт. Может подтвердить выводы из предыдущих исследований (то есть идентификация и PSI-зависимой миграции белков уже описанных быть частью CEF-суперсложные, такие как PGRL1, FNR и цит F 7). Идентификация ANR1 и CAS в качестве новых компонентов CEF-машин 6 показывает этот подход как очень мощный и эффективный инструмент. Примечательно, что изолированные CEF-сверхсложные выставлены в пробирке деятельность, тем самым демонстрируя успешное очищение функпропорциональна мультибелковый комплекс 6. Применимость такого подхода и для двух штаммов, которые оба образуют CEF-сверхсложные демонстрируется сравнением WT и pgrl1.
В целом, этот метод может быть использован для обследования сложные композиции в различных штаммов или условий как показали идентификации ранее неизвестных белков, которые copurified с CEF-сверхсложные фракции (т.е. обогащение FTSH1, FTSH2, ПФО и HCF136 в CEF-сверхсложные фракция). Будут ли эти белки являются возможные новые кандидаты этого комплекса и улучшить наше понимание для различных регулирования FTHS2, HCF136, а также для цит б 6 / F субъединиц, как показало сопоставление БТ и pgrl1, необходимы дальнейшие эксперименты.
Помимо описанных преимуществ такого подхода существует разорватьаль важных шагов, которые должны быть тщательно рассмотрены при работе с этим протоколом: Нарушение клеток с распылителя является первым важным шагом. Если открытие клеток не осуществляется надлежащим образом, выход из изолированных тилакоидов будет довольно низкой и может привести к едва любой обнаружения CEF-сверхсложных после над-ночь центрифугирования. Успешное разрушение клеток может быть выведено из светло-зеленого цвета супернатанта после центрифугирования. В противоположность этому, если давление во время разрушения клеток является слишком высокой, части суперсложные может распадаться и важными факторами могут быть потеряны. Еще один шаг, влияющим на выход тилакоидов является ресуспендирование клеток с гончара. Это должно быть проведена тщательно и в конце этой стадии только несколько зеленых частицы должны оставаться. Кроме того, для приготовления сахарозы градиенты плотности за день до, так и для солюбилизации мембранных комплексов, очень важно, чтобыточно следовать этому протоколу с точки зрения концентрации β-DM, так как это очень важно для получения полностью солюбилизированных тилакоидов 50 и, следовательно, также для очистки CEF-сверхсложных. На этапе солюбилизации успешно выполняется, если небольшой, беловатый осадок наблюдается после последующей стадии центрифугирования. Другой критической точки, которые должны быть упомянуты здесь является время в течение ночи ультрацентрифугированием. Величины плотности сахарозы градиенты следует центрифугировали в течение по крайней мере двенадцати часов для достижения полного разделения фотосинтетических комплексов.
Даже несмотря на то протокол продемонстрирована с использованием C. reinhardtii для сравнительного анализа CEF-сверхсложных композиции в двух генетически различных штаммов, это легко адаптируется и к широкому кругу других вопросов, таких, как сравнительный анализ мультибелкового сложного состава, выделенного из различны охраны окружающей среды / экспериментальноеусловия или с помощью других типов фракционирования. Единственное требование этого подхода в том, что модельный организм можно культивировать в клеточной культуре, может использовать аммоний в качестве источника азота и белковых комплексов могут быть разделены на градиенте плотности сахарозы, демонстрируя широкое применение этого метода. Для дальнейшего применения этого подхода SDS-PAGE фракционирования смешанных 14 N / 15 N образцов и последующего пищеварения в геле может быть заменена применением фильтра автоматизированного метод подготовки образца (FASP). Этот метод включает применение сильных моющих средств для растворения с целью "очистить" протеом перед пищеварения и получить очищенные пептиды, предотвращая недостатки пищеварения подхода в-гель, который может ингибировать восстановление пептид, хотя следует учитывать, что в геле пищеварение описывается быть надежными, чтобы загрязнений, которые могли бы помешать пищеварению 51.
Раскрытие информации
Авторы заявляют никакого конкурирующий финансовый интерес.
Благодарности
MH признает поддержку от "Deutsche Forschungsgemeinschaft" (DFG). Автор взносы: MH предназначены исследований; KT, JS и МТ проведенных исследований и проанализировали данные; КТ и MH написал статью.
Материалы
| Name | Company | Catalog Number | Comments |
| Chemicals | |||
| Acetic acid | AppliChem | A0662 | http://www.applichem.com/home/ |
| Acetone | AppliChem | A2300 | http://www.applichem.com/home/ |
| Acetonitrile Optigrade für LC-MS | Diagonal | 9340 | Harmful, work with gloves. See protocol text for further precautions. https://www.diagonal.de/ |
| Ammonium chloride 15N | Cambridge Isotope Laboratories | 39466-62-1 | http://www.isotope.com/cil/index.cfm |
| Ammonium chloride 14N | AppliChem | A0988 | http://www.applichem.com/home/ |
| Ammonium hydrogen phosphate | AppliChem | A3583 | http://www.applichem.com/home/ |
| Ammonium sulfate | AppliChem | A3598 | http://www.applichem.com/home/ |
| Coomassie brilliant blue R-250 | Fisher Scientific | 10041653 | http://www.de.fishersci.com/index.php/deindex |
| n-Dodecyl-β-D-maltoside | AppliChem | A0819 | http://www.applichem.com/home/ |
| EDTA | AppliChem | A2937 | http://www.applichem.com/home/ |
| Formic acid | AppliChem | A3858 | http://www.applichem.com/home/ |
| HEPES | AppliChem | A3724 | http://www.applichem.com/home/ |
| Magnesium chloride | AppliChem | A4425 | http://www.applichem.com/home/ |
| Methanol | AppliChem | A2954 | http://www.applichem.com/home/ |
| Phosphorous acid | AppliChem | A0989 | http://www.applichem.com/home/ |
| Dipotassium hydrogen phosphate | AppliChem | A1042 | http://www.applichem.com/home/ |
| Potassium dihydrogen phosphate | AppliChem | A1043 | http://www.applichem.com/home/ |
| Sodium hydroxide | AppliChem | A1551 | http://www.applichem.com/home/ |
| Sucrose | AppliChem | A1125 | http://www.applichem.com/home/ |
| Tricine | AppliChem | A3954 | http://www.applichem.com/home/ |
| Tris | AppliChem | A2264 | http://www.applichem.com/home/ |
| Trypsin (sequencing grade modified) and Trypsin buffer | Promega | V5111 | http://www.promega.de/ |
| Equipment | |||
| Nebulizer (BioNeb cell disruptor) | Glas-Col | http://www.glascol.com/product/subproduct/id/75 | |
| Centrifuge tubes (14 mm x 89 mm) | Beckman Coulter | 331372 | for preparation of Takahashi style gradients
http://www.beckmancoulter.de/ |
| Centrifuge tubes 25 mm x 89 mm | Beckman Coulter | 344058 | for preparation of thylakoid isolation gradients.
http://www.beckmancoulter.de/ |
| Coulter Avanti Centrifuge J-20 XP | Beckman Coulter | http://www.beckmancoulter.de/ | |
| Fuchs-Rosenthal cell couting chamber | Diagonal | 449/72 | https://www.diagonal.de/ |
| Homogenizer (Potter) 50 ml | Fisherbrand | 10618242 | http://www.de.fishersci.com/index.php/defisherbrand |
| Pistil for homogenizer | Fisherbrand | 105252220 | http://www.de.fishersci.com/index.php/defisherbrand |
| Ultracentrifuge (Optima XPN-80 Ultracentrifuge) | Beckman Coulter | website: http://www.beckmancoulter.de/ | |
| Other | |||
| Antibodies | Agrisera | http://www.agrisera.com/en/index.html |
Ссылки
- Joliot, P., Joliot, A. Cyclic electron flow in C3 plants. Biochim. Biophys. Acta. 1757 (5-6), 362-368 (2006).
- Shikanai, T. Cyclic electron transport around photosystem I: genetic approaches. Annu. Rev. Plant Biol. 58, 199-217 (2007).
- Finazzi, G., Furia, A., Barbagallo, R. P., Forti, G. State transitions, cyclic and linear electron transport and photophosphorylation in Chlamydomonas reinhardtii. Biochim. Biophys. Acta. 1413 (3), 117-129 (1999).
- Tolleter, D., et al. Control of hydrogen photoproduction by the proton gradient generated by cyclic electron flow in Chlamydomonas reinhardtii. Plant Cell. 23 (7), 2619-2630 (2011).
- Hertle, A. P., et al. PGRL1 Is the Elusive Ferredoxin-Plastoquinone Reductase in Photosynthetic Cyclic Electron Flow. Mol. Cell. 49 (3), 511-523 (2013).
- Terashima, M., et al. Calcium-dependent regulation of cyclic photosynthetic electron transfer by a CAS, ANR1, and PGRL1 complex. PNAS. 109 (43), 17717-17722 (2012).
- Iwai, M., Takizawa, K., Tokutsu, R., Okamuro, A., Takahashi, Y., Minagawa, J. Isolation of the elusive supercomplex that drives cyclic electron flow in photosynthesis. Nature. 464 (7292), 1210-1213 (2010).
- Chua, N. H., Bennoun, P. Thylakoid Membrane Polypeptides of Chlamydomonas reinhardtii: Wild-Type and Mutant Strains Deficient in Photosystem II Reaction Center. PNAS. 72 (6), 2175-2179 (1975).
- Takahashi, H., Iwai, M., Takahashi, Y., Minagawa, J. Identification of the mobile light-harvesting complex II polypeptides for state transitions in Chlamydomonas reinhardtii. PNAS. 103 (2), 477-482 (2006).
- Ikeuchi, M., Plumley, F. G., Inoue, Y., Schmidt, G. W. Phosphorylation of Photosystem II Components, CP43 Apoprotein, D1, D2, and 10 to 11 Kilodalton Protein in Chloroplast Thylakoids of Higher Plants. Plant Physiol. 85 (3), 638-642 (1987).
- Ruban, A. V., Lee, P. J., Wentworth, M., Young, A. J., Horton, P. Determination of the Stoichiometry and Strength of Binding of Xanthophylls to the Photosystem II Light Harvesting Complexes. J. Biol. Chem. 274 (15), 10458-10465 (1999).
- Barera, S., Pagliano, C., Pape, T., Saracco, G., Barber, J. Characterization of PSII-LHCII supercomplexes isolated from pea thylakoid membrane by one-step treatment with α- and β-dodecyl-D-maltoside. Phil. Trans. R. Soc. B. 367 (1608), 3389-3399 (2012).
- Kantzilakis, K., et al. A comparative approach towards thylakoid membrane proteome analysis of unicellular green alga Scenedesmus obliquus. Biochim. Biophys. Acta. 1768 (9), 2271-2279 (2007).
- Takahashi, Y., Yasui, T., Stauber, E. J., Hippler, M. Comparison of the subunit compositions of the PSI-LHCI supercomplex and the LHCI in the green alga Chlamydomonas reinhardtii. Biochemistry. 43 (24), 7816-7823 (2004).
- Thelen, J. J., Peck, S. C. Quantitative proteomics in plants: choices in abundance. Plant Cell. 19 (11), 3339-3346 (2007).
- Hsieh, S., et al. The Proteome of Copper, Iron, Zinc, and Manganese Micronutrient Deficiency in Chlamydomonas reinhardtii. Mol. Cell. Proteom. 12 (1), 65-86 (2013).
- Longworth, J., Noirel, J., Pandhal, J., Wright, P. C., Vaidyanathan, S. HILIC- and SCX-based quantitative proteomics of Chlamydomonas reinhardtii during nitrogen starvation induced lipid and carbohydrate accumulation. J. Proteome Res. 11 (12), 5959-5971 (2012).
- Malasarn, D., et al. Zinc deficiency impacts CO2 assimilation and disrupts copper homeostasis in Chlamydomonas reinhardtii. J. Biol. Chem. 288 (15), 10672-10683 (2013).
- Höhner, R., et al. The metabolic status drives acclimation of iron deficieny responses in Chlamydomonas reinhardtii as revealed by proteomics based hierarchical clustering and reverse genetics. Mol. Cell. , (2013).
- Mahong, B., Roytrakul, S., Phaonaklop, N., Wongratana, J., Yokthongwattana, K. Proteomic analysis of a model unicellular green alga, Chlamydomonas reinhardtii, during short-term exposure to irradiance stress reveals significant down regulation of several heat-shock proteins. Planta. 235 (3), 499-511 (2012).
- Förster, B., Mathesius, U., Pogson, B. J. Comparative proteomics of high light stress in the model alga Chlamydomonas reinhardtii. Proteomics. 6 (15), 4309-4320 (2006).
- Petroutsos, D., et al. The chloroplast calcium sensor CAS is required for photoacclimation in Chlamydomonas reinhardtii. Plant Cell. 23 (8), 2950-2963 (2011).
- Dodd, A. N., Kudla, J., Sanders, D. The language of calcium signaling. Annu. Rev. Plant Biol. 61, 593-620 (2010).
- Nomura, H., Komori, T., Kobori, M., Nakahira, Y., Shiina, T. Evidence for chloroplast control of external Ca2+-induced cytosolic Ca2+ transients and stomatal closure. Plant J. 53 (6), 988-998 (2008).
- Weinl, S., et al. A plastid protein crucial for Ca2+-regulated stomatal responses. New Phytol. 179 (3), 675-686 (2008).
- Terashima, M., Specht, M., Naumann, B., Hippler, M. Characterizing the anaerobic response of Chlamydomonas reinhardtii by quantitative proteomics. Mol. Cell. Proteomics. 9 (7), 1514-1532 (2010).
- Petroutsos, D., et al. PGRL1 participates in iron-induced remodeling of the photosynthetic apparatus and in energy metabolism in Chlamydomonas reinhardtii. J. Biol. Chem. 284 (47), 32770-32781 (2009).
- DalCorso, G., et al. A complex containing PGRL1 and PGR5 is involved in the switch between linear and cyclic electron flow in Arabidopsis. Cell. 132 (2), 273-285 (2008).
- Redding, K., et al. A systematic survey of conserved histidines in the core subunits of Photosystem I by site-directed mutagenesis reveals the likely axial ligands of P700. EMBO J. 17 (1), 50-60 (1998).
- Harris, E. H. . The Chlamydomonas Sourcebook. Introduction to Chlamydomonas and its laboratory use. , (2008).
- Porra, R. J., Thompson, W. A., Kriedemann, P. E. Determination of accurate extinction coefficients and simultaneous equations for assaying chlorophylls a and b extracted with four different solvents: verification of the concentration of chlorophyll standards by atomic absorption spectroscopy. Biochim. Biophys. Acta. 975 (3), 384-394 (1989).
- Naumann, B., Stauber, E. J., Busch, A., Sommer, F., Hippler, M. N-terminal processing of Lhca3 Is a key step in remodeling of the photosystem I-light-harvesting complex under iron deficiency in Chlamydomonas reinhardtii. J. Biol. Chem. 280 (21), 20431-20441 (2005).
- Hippler, M., Klein, J., Fink, a., Allinger, T., Hoerth, P. Towards functional proteomics of membrane protein complexes: analysis of thylakoid membranes from Chlamydomonas reinhardtii. Plant J. 28 (5), 595-606 (2001).
- Naumann, B., et al. Comparative quantitative proteomics to investigate the remodeling of bioenergetic pathways under iron deficiency in Chlamydomonas reinhardtii. Proteomics. 7 (21), 3964-3979 (2007).
- Shevchenko, A., Tomas, H., Havlis, J., Olsen, J. V., Mann, M. In-gel digestion for mass spectrometric characterization of proteins and proteomes. Nat. Prot. 1 (6), 2856-2860 (2006).
- Specht, M., Kuhlgert, S., Fufezan, C., Hippler, M. Proteomics to go: Proteomatic enables the user-friendly creation of versatile MS/MS data evaluation workflows. Bioinformatics. 27 (8), 1183-1184 (2011).
- Geer, L. Y., et al. Open mass spectrometry search algorithm. J. Proteome Res. 3 (5), 958-964 (2004).
- Craig, R., Beavis, R. C. TANDEM: matching proteins with tandem mass spectra. Bioinformatics. 20 (9), 1466-1467 (2004).
- Elias, J. E., Gygi, S. P. Target-decoy search strategy for increased confidence in large-scale protein identifications by mass spectrometry. Nat. Methods. 4 (3), 207-214 (2007).
- Käll, L., Storey, J. D., Noble, W. S. QVALITY: non-parametric estimation of q-values and posterior error probabilities. Bioinformatics. 25 (7), 964-966 (2009).
- Wollman, F. A., Bennoun, P. A new chlorophyll-protein complex related to photosystem I in Chlamydomonas reinhardtii. Biochim. Biophys. Acta. 680, 352-360 (1982).
- Bailey, S., et al. A critical role for the Var2 FtsH homologue of Arabidopsis thaliana in the photosystem II repair cycle in vivo. J. Biol. Chem. 277 (3), 2006-2011 (2002).
- Kato, Y., Sakamoto, W. Protein quality control in chloroplasts: a current model of D1 protein degradation in the photosystem II repair cycle. J. Biochem. 146 (4), 463-469 (2009).
- Meurer, J., Plücken, H., Kowallik, K. V., Westhoff, P. A nuclear-encoded protein of prokaryotic origin is essential for the stability of photosystem II in Arabidopsis thaliana. EMBO J. 17 (18), 5286-5297 (1998).
- Kuras, R., Wollman, F. A. The assembly of cytochrome b6/f complexes: an approach using genetic transformation of the green alga Chlamydomonas reinhardtii. EMBO J. 13 (5), 1019-1027 (1994).
- de Vitry, C., Finazzi, G., Baymann, F., Kallas, T. Analysis of the nucleus-encoded and chloroplast-targeted rieske protein by classic and site-directed mutagenesis of Chlamydomonas. Plant Cell. 11 (10), 2031-2044 (1999).
- Hamel, P., Olive, J., Pierre, Y., Wollman, F. A., de Vitry, C. A new subunit of cytochrome b6f complex undergoes reversible phosphorylation upon state transition. J. Biol. Chem. 275 (22), 17072-17079 (2000).
- Stanislas, T., et al. Quantitative proteomics reveals a dynamic association of proteins to detergent-resistant membranes upon elicitor signaling in tobacco. Mol. Cell. Proteomics. 8 (9), 2186-2198 (2009).
- Atteia, A., et al. A proteomic survey of Chlamydomonas reinhardtii mitochondria sheds new light on the metabolic plasticity of the organelle and on the nature of the alpha-proteobacterial mitochondrial ancestor. Mol. Biol. Evol. 26 (7), 1533-1548 (2009).
- Pagliano, C., Barera, S., Chimirri, F., Saracco, G., Barber, J. Comparison of the α and β isomeric forms of the detergent n-dodecyl-D-maltoside for solubilizing photosynthetic complexes from pea thylakoid membranes. Biochim. Biophys. Acta. 1817 (8), 1506-1515 (2012).
- Wisniewski, J. R., Zougman, A., Nagaraj, N., Mann, M. Universal sample preparation method for proteome analysis. Nat. Methods. 6 (5), 3-7 (2009).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены