Method Article
に基づいた多タンパク質複合体の比較分析のための新たなアプローチ
要約
記載された比較、定量的プロテオミクスアプローチは、異なる条件下で多タンパク質複合体の組成物への洞察を得ることを目的と遺伝的に異なる菌株を比較することによって実証される。定量分析のためにショ糖密度勾配とは異なる画分の等しい体積を質量分析によって混合し、分析する。
要約
導入されたプロトコルは、異なる条件下での複雑な組成物への洞察を明らかにすることによって、チラコイド膜内の多タンパク質複合体の分析のためのツールを提供しています。このプロトコルではアプローチは、遺伝的に異なる株から単離されたコナミドリムシ環状電子流(CEF)に関与するタンパク質複合体の組成を比較することによって実証される。手順は、差動代謝標識(14 N / 15 N)に基づいて、ショ糖密度勾配遠心分離、SDS-PAGE、免疫検出および比較、定量的な質量分析(MS)による多タンパク質複合体へのそれらの分離を行い、チラコイド膜の単離を含む株を分析した。洗剤可溶化したチラコイド膜は、等しいクロロフィル濃度のショ糖密度勾配にロードされます。超遠心分離後、勾配は、質量spectrometによって分析される画分に分離されるRY同体積に基づく。このアプローチは、さらに勾配画内の組成の調査と、特にANR1、CAS、およびPGRL1に焦点を当て、異なるタンパク質の移行挙動を分析することができます。さらに、この方法は、(イムノブロットの結果を確認することにより、さらに、以前の研究からの知見を支持して、以前にCEF-supercomplex例えばPGRL1、FNRなどの一部であると記載されたタンパク質の同定およびPSI-依存性遊走を示しており、 CYT F)。注目すべきことに、このアプローチは、このプロトコルを採用することができ、 例えば、異なる環境条件から単離された多タンパク質複合体組成物の比較分析のために使用される質問の広い範囲に対処するために適用可能である。
概要
植物や藻類のチラコイド膜での光合成のプロセスは、線状および環状モードで機能することができます。リニア電子流(LEF)の間に光化学I(PSI)、光化学系II(PSII)およびシトクロムB 6 / Fは、最終的には 、NADPHとATP 2の生成につながる、NADP + 1を水から電子を移動。対照的に、状態2 3 4及び嫌気的条件等の多様な環境条件下で誘導されることが知られている環状の電子流(CEF)は、バック電子伝達鎖に電子を注入することによって酸化PSIの再減少をもたらす。このプロセスは、チトクロームB 6 / F複合体1の間質側またはプラストキノンプール5のいずれかで行われるとATPを生成しますが、無NADPH 2することができます。
提示されたプロトコルの目的は、質量分析(MS)ベースのm個を実証することである(遺伝的に異なる株と比較することによって例示される)、さまざまな条件の下でこれらの複合体の組成物への洞察を得るためにクラミドモナスのチラコイド膜での多タンパク質複合体の比較、定量分析のためのethod。このアプローチは、寺島らによる刊行物に適用された。2012年にはC言語でのCEFののCa 2 +依存性の調節を示すクラミドモナスは、タンパク質、CAS、ANR1、およびPGRL1 6を含む多タンパク質複合体により媒介される。手順は、比較的重いことにより、標識窒素(15 N)を有する二つの株のいずれかを利用して二つ遺伝的に異なる菌株におけるCEF-supercomplexの組成を分析することによって説明される。簡単に説明すると、プロトコルは、界面活性剤可溶化し、ショ糖密度勾配における光合成複合体の分画、続いてチラコイド膜の調製を含む。勾配の分画後、FRACを選択した二つの株のtionsを混合し、等しい体積に基づいてゲル内消化およびその後の定量的MS分析に続いてSDS-PAGEによって分離されている。
上述したように、CEFは異なる環境条件の下で誘導され、2010年からの出版物は、機能的なCEF-supercomplex Cの状態2ロックされたセルからの隔離を示しています超遠心分離中にショ糖密度勾配上に可溶化されたチラコイド膜を分離することによって行われた、07 ラインハーディ 。岩井ら 7とは異なり、提示されたプロトコルは、C.成長嫌気から、CEF-supercomplexの単離を記載代替手順に従うことによって、 クラミドモナスの文化。これは、チラコイド分離プロトコルにおける変化ならびに可溶化工程及び超遠心分離によるタンパク質複合体の分離に関する差異を含む。現在のプロトコルでは、チラコイド膜バッファは、岩井らによるチラコイド調製のために使用しながら、チュアとBennoun 8によって発表された手順を適用することによって単離される文献 09記載のように、25mMのMES、0.33 Mスクロース、5mMのMgCl 2、1.5mMのNaCl液(pH6.5)を含有した。ここで説明可溶化法が0.9%の界面活性剤の使用に依存しながら可溶化は、岩井および共同研究者の場合には、氷上で30分間、0.7から0.8パーセントの界面活性剤(n-トリデシル-β-D-マルトシド)を用いて行った(nは-ドデシル-β-D-マルトシド(DM-β))と、氷上で20分間だけ実行される。両グループは、それぞれの洗剤で可溶化にミリリットルあたりのクロロフィル0.8mgのを使用していました。このプロトコルの作者が範囲の濃度を使用し、一方、可溶化したチラコイド膜からの光合成複合体を分離するための岩井ら 、0.1から1.3 mのショ糖濃度を適用0.4〜M.最後の差から比べても低い遠心分離速度は、あるEAへrlier出版。
ショ糖密度勾配分画に続いて非イオン性界面活性剤とのチラコイド膜の可溶化は、すでに1980年代から、タンパク質の代謝標識の適用はプロテオミクス分野で普及の方法で、今日7、9月14日まで、至るまで数多くの研究に適用されている。記載されたアプローチは、質量に至る全てのアミノ酸に組み込まれている15 N NH 4 Cl を 、の形の唯一の窒素源として重窒素の存在下で培養することにより、2つの比較した株のいずれかの15 N代謝標識を適用するペプチドのアミノ酸配列に応じてシフトする。 1 MSラン内の14 Nおよび15 Nの混合物を分析する場合、この質量シフトは、各ペプチドの試料の起源を決定するために使用することができ、ペプチドの相対存在量は、相当の相対存在量を表す計算することができる。タンパク質15を ING。
C上の多数の定量的プロテオミクス研究クラミドモナスは、実験条件( 例えば 、栄養16〜19によるプロテオームの変化や光ストレス20,21)間のプロテオームの変化を分析するために、タンパク質の定義された量を比較した、利用可能です。これらの研究と比較して、現在提示アプローチにおいて試料の等容量を一緒にし、分析する。このセットアップでは、グラデーション内のタンパク質の移行挙動を研究するため、さらに調査した株に対して異なる複合体の組成を分析することができます。
このメソッドは、主に三つのタンパク質に集中して説明する。第一候補は、C.中の光馴化に関与することが示された葉緑体に局在するカルシウムセンサータンパク質のCASで、 クラミドモナス 22。カルシウムは、重要なシグナルであると考えられている最終的に遺伝子発現と細胞生理学23の変化につながるため、様々な生物的および非生物的ストレスに活性化され、それが葉緑体は、CASタンパク質22,24,25を介したシグナル伝達+携帯のCa 2に貢献するかもしれないことが提案された経路のためのイオンをING。第二のタンパク質はANR1(嫌気応答1 6)、Cで無酸素の成長条件下で誘導されることが示されたタンパク質であるクラミドモナス 26。とりわけ、CASならびにANR1はCEF-supercomplexのサブユニットとして同定され、また、逆遺伝学的ア プローチを用いて、それが両方のタンパク質が、このタンパク質複合体の機能的なサブユニットとしての役割を支持し、 インビボ 6 に CEFに機能的に寄与することが実証された。第3のタンパク質は、 クラミドモナス 4,27においてだけでなく、 シロイヌナズナ 5,28にCEFに関与することが示されており、また、IDだったチラコイド蛋白PGR5様1(PGRL1)、ある岩井らの作品にentified。7
ΔPSI29株(対)対野生型(WT)、PSAB遺伝子の欠失を示す、またの一部であるサブユニットIは本質的な光化学系をコードする:このアプローチは、2つの異なる実験の結果を示すことによって提示されるCEF-supercomplex及びWT対A pgrl1ノックアウト株は4。これらの実験のそれぞれについて、15 Nおよび14 N標識株は、比較されている間、CEF-supercomplexの定量的組成物。
プロトコル
1。 クラミドモナスの培養
- 以下でクラミドモナスの株を、本研究で使用した:野生型cc124、WTのcw15-arg7(細胞壁欠損およびアルギニン栄養要求)、ΔPSI変異株29とpgrl1ノックアウト株は4。
- 全ての株は、トリス-酢酸-リン酸(TAP)で増殖させた培地30、25°Cで20〜50μE/ m 2の秒の連続光強度で120 rpmで振とう。 ΔPSIの文化は、<5μE/ m 2の秒の露光のためにいくつかティッシュペーパーで包まれるべきである。
- (それぞれΔPSIおよびWT cc124)ラベルされた株の培養は、7.5 mMの15 N 塩化アンモニウムを含有していた、非標識株(WT cw15-arg7とpgrl1、それぞれ)のための培養は、7.5 mMの14 N 塩化アンモニウムを含有していたのに対し。細胞は、少なくとも4つのGENERAT増殖する必要がフルラベリングとを達成するためのイオンは、指数増殖期に維持しなければならない。
- 実験開始の前日に、少なくとも750ミリリットル/株の体積の1×10 6細胞/ mlの密度に細胞をカウントし、希釈する。
不連続ショ糖密度勾配の2種類が以下のプロトコルに記述されていることに注意してください。 光化学スクロース密度勾配は、Takahashi ら 9に記載のチラコイドショ糖密度勾配の (プロトコル2を参照)の前に一晩遠心分離中に単離し、可溶化したチラコイド異なる光合成タンパク質複合体を分離し、その日に調製しなければならないために使用され8は (プロトコル3を参照)チラコイド分離手順で適用される。
2。光化学ショ糖密度勾配の調製
- 勾配を注入するための3ストック溶液が必要である。
- 2のスクロース
- H 2 O中10%のβ-DM
- 0.5 Mのトリシン、pH8.0のナトリウム(NaOH)
- これらの株式を使用して、次の解決策を準備します。
濃度: 1.3 M 1.0 M 0.85 M 0.7 M 0.65 M 0.4 M 2のスクロース 13ミリリットル 10ミリリットル 8.5ミリリットル 7ミリリットル 6.5ミリリットル 4ミリリットル 10パーセント46;-DM 100μL 100μL 100μL 100μL 100μL 100μL 0.5 Mトリシン 200μL 200μL 200μL 200μL 200μL 200μL H 2 O 6.7ミリリットル 9.7ミリリットル 11.2ミリリットル 12.7ミリリットル 13.2ミリリットル 15.7ミリリットル - 14ミリメートルX 89ミリメートル遠心分離管を使用し、低密度の溶液に対して最も高いスクロース濃度溶液から出発し、非常にゆっくりと勾配を注ぐ。
- ソリューションの残りのための1.3および1.0 Mソリューションと2ミリリットルのための唯一の1ミリリットルずつ注ぐ。
- 低温室で一晩勾配のままにしておきます。
3。嫌気性誘導とチラコイド膜8の分離
- チラコイド膜の分離を開始する前に、4時間アルゴンをバブリングして嫌気条件を誘導する。泡立ちが磁気攪拌棒を培養の一定混合しながらフラスコの培養にガラスピペットを介して行うことができる。
- 2,500×gで5分間細胞をペレット化することにより、チラコイド膜の単離で始まり、H1緩衝液中に再懸濁(0.3 Mスクロース、25mMのHEPES(pH7.5)を、5mMのMgCl 2)。
(チラコイド膜サンプルSHの分離を開始する際に注意してくださいケラチン汚染を避けるために強く推奨している全ての遠心操作は4℃で行われ、タンパク質分解を回避するために氷上に保持し、手袋を扱うことがウルド。) - 2,500×gで、H1緩衝液中で再懸濁し、5分間、細胞をペレット化。
- 1,500 hPaの(細胞壁のない株が1つだけの通路を行うための)窒素圧で噴霧器を介して2つの通路を有する細胞を破壊する。
- 2,500×gで7分間細胞をスピンダウン。
(このステップの後、上清をされていない場合、細胞破壊が成功しなかった、薄緑でなければなりません。) - H2緩衝液(0.3 Mスクロース、5mMのHEPES(pH7.5)、10mMのEDTA(pH8.0)中)および32,800 X gで10分間ペレット細胞における細胞を再懸濁。
- H3のバッファーに再懸濁細胞(1.8 Mショ糖、5のHEPES(pH7.5)を、10mMのEDTA(pH8.0)に)とポッター(なし緑の粒子がこの作業工程の最後に残っていないはずです)でペレットを均質化する。
- 浴槽内のチラコイドショ糖密度勾配を準備します細胞との12ミリリットルH3緩衝層を底部から開始することによりエス(X 89ミリメートル25ミリメートル)は、H4緩衝液(1.3 Mスクロース、5mMのHEPES(pH7.5)、10mMのEDTA(12 mlに中間層を注ぐpH8.0)中)および上部12ミリリットルH5バッファ上(0.5 Mスクロース、5mMのHEPES(pH7.5)、10mMのEDTA(pH8.0)中)。グラデーションを注ぐときには注意が必要と3層の混合を避ける。
- H5は、X、G 70700で1時間バッファリングし、遠心チラコイドショ糖密度勾配とのバランス。
- チラコイドショ糖密度勾配からチラコイドバンドを外し、適切なボリュームH6バッファー(5のHEPES(pH7.5)に10mMのEDTA(pH8.0)で)でそれらを希釈する。
- 20分間37900×gで細胞をスピンダウン。ペレットが固まっていない場合、よりH6バッファは、この遠心分離工程に必要とされる。
- 少量H6バッファにチラコイドを再懸濁し、クロロフィル濃度の測定を進める。
4。クロロフィル濃度31の決定
- クロロフィル量の決定は、80%のアセトンを用いて行われる。
- H6バッファー(希釈1:200)に995μlの80%アセトン及びチラコイドの5μLを混ぜる。
- 数秒間ボルテックスない緑の粒子が残っていないし、次に5分間14.1×gでスピンダウンするまで。
- 上澄みを取り、それぞれ663.6と646.6 nmおよび750 nmでの吸光を測定します。
- 以下の式を用いてクロロフィル量を算出する。
- C クロロフィル [mg / mlの] =(0.01225 * E 663.6から 0.00255 * E 646,6)*希釈倍率
- C クロロフィルB [mg / mlの] =(0.02031 * E 646.6から 0.00491 * E 663.6)*希釈倍率
- C クロロフィル [mg / mlの] = C のChl + C クロロフィルB
5。光化学ショ糖密度勾配のロード
- 必要とされているチラコイド、β-DMおよびH6バッファの量を算出各勾配の場合:
- 各々の勾配が0.9%β-DM(H 2 O中のβ-DMを溶解)に0.8 mg / mlのクロロフィルと700μLの全容量をロードする必要があり、H6緩衝液を用いて、残りの容積を満たす。
- 可溶化のための各グラデーションのチラコイド、β-DMおよびH6緩衝液を用いて異なるアリコートを準備します。
- 定期的に(反転)数分おき(可溶化工程)混合しながら氷上で20分間サンプルを残す。
- 4℃で10分間、最大速度(14,000×g)で遠心
(上清は暗緑色である間遠心分離した後、ペレットは小さく、白っぽいでなければなりません。) - 勾配に上清をロードします。
- H6バッファーとのバランス、4℃で134470×gで一晩(14時間)で超遠心機を用いたスピン
(ボイジャーとき、このプロトコルで提示され光化学スクロース密度勾配を利用した光合成複合体の正常な分離が唯一達成されることに注意してください可溶化および複雑な分離のための予測が以前に凍結されてきたチラコイド膜で作業するときにすることは困難であるため、Gたて、チラコイドを単離した。)
6。光化学ショ糖密度勾配の分画
- 勾配の写真を撮る。
- 針を使用してチューブの底に穴を穿刺し、500μLチューブ内で勾配を分画。あるいは、分画はまた、96ウェルプレート(マイクロプレート)を用いて行うことができる。
- マイクロプレートを使用する場合は、675 nmで異なる勾配画分の吸光度を決定する。
(この工程において、サンプル数週間のために-80℃で保存することができる。)
7。 SDS-PAGEおよび免疫検出
(のみΔPSI対WTの比較のために、ウェスタンブロット分析は、その後のMS分析のための画分を選択することが行われていることに注意してください。実験では、WT対pgrl1 FRアクションは異なる画分の吸光度を用いて選択された。)
- 13%SDSポリアクリルアミドゲル32上のWT及びΔPSI勾配から、各分画の別々の30μL。
- ANR1(TEF7)26、PGRL1 34、CAS 6、PSIサブユニットPSAD 32とPSIIコアサブユニットD1:以下の抗体を用いたウエスタンブロット解析33を実行します。 1:10,000の希釈して使用する必要があり、D1抗体を除いて、(高感度化学発光検出技術のための)1:1,000の希釈で全ての抗体を使用してください。
- 免疫検出の結果に基づいて、WT及びΔPSIためANR1、PGRL1とPSADのピーク画分(ここでは画分はそれぞれ6および13を)取るWT及びΔPSIからの画分6を30μlを混合しからの画分13で同じことを行う製剤及び13%SDSポリアクリルアミドゲル上で再度それらを分離両方。
- 対pgrl1 WTの定量的な比較のために、Cを取る異なる勾配画分の吸光度を測定することによって決定し、13%SDSポリアクリルアミドゲル上で分離し、続いて両方のサンプルを30μlを混合としてEF-supercomplex画分。
- 室温で又は一晩4℃で2時間、クーマシー溶液でタンパク質バンド(85%亜リン酸、757 mMの硫酸アンモニウム、1.2%クマシーブリリアントブルー、20%メタノール)で染色
- 非特異的染色を除去するために、蒸留H 2 Oで数回洗浄
- 1ミリメートルゲル片にレーンをカットし、ゲル内消化を進める。
(代わりに、サンプルは真空遠心機で数分間乾燥させ、ゲル内消化を続行する前に、数週間のために保存することができます。)
8。ゲル内消化(シェフチェンコら 35から改変)
使用直前に、すべての緩衝液および溶液を準備し、アセトニトリル(ACN)を含むバッファのガラス瓶を取ることに注意してください。
注意! ACNで働くことは有害であるかもしれません。詳細については、からダウンロードできます。http://www.sciencelab.com/msds.php?msdsId=9927335(2013)。
- 30秒間のddH 2 O(〜200μL)の> 10倍量のゲル片を洗浄します。
- 、振とうしながら15分間25 mMのNH 4 HCO 3300μlのゲル片を培養する液体を除去する。
- 振とうしながら15分間(1:1の割合でACNおよび50mMのNH 4 HCO 3を混合することによって準備する)50%ACN中の25mMのNH 4 HCO 3300μLでゲル片をインキュベートし、液体を除去。
- ゲル片がまだある場合、クーマシーブルーの大部分が除去されるまで、NH 4 HCO 3、NH 4 HCO 3 / ACN洗浄を繰り返す。
(クーマシー染色の大部分が除去されるべきであるが、完全にゲル片を脱色する必要はない。) - 5分間のゲル片を脱水し、ACNを100μlを加える。ゲル片を縮小する必要がありますND真っ白に見える。
- できるだけ多くのACNを削除し、トリプシン消化を進める。あるいは、サンプルは、数週間-20°Cで保存することができる。
- 20 ngの/ 10%μLのトリプシンのACN / 25のNH 4 HCO 3(新たに希釈した)のバンドあたり10から20μl加え、氷上でサンプルを保持します。
- 30分後、すべての溶液が吸収されたかどうか確認し、必要に応じて、より多くのトリプシンバッファーを追加します。ゲル片を完全にトリプシン緩衝液で覆われるべきである。サンプルを氷上で保管してください。
- トリプシンでそれらを飽和させるために氷上でさらに90分間ゲル片を残す。
(クリティカルステップ:トリプシンペプチドの収率は、おそらく、ポリアクリルアミドマトリックス中への酵素の遅い拡散により、氷上でのインキュベーション時間の増加に伴って著しく増加することを回避するために、ゲル片を覆う溶液の小過剰を有することが必要であること片。一晩のインキュベーションの間に乾燥した秋。) - 4-6時間、37℃で消化する。必要とする実験のために最大のペプチドの回収、一晩消化する。
- 消化後、凝縮されたバッファをスピンダウン。
- 5分間の超音波処理管が再びペプチドおよび遠心分離機を溶出した。
- 上清を回収し、新しいチューブに移す。
- 15分間の超音波槽内の30%ACN / 1%ギ酸(FA)の80μlのペプチド抽出を行う。
- 15分間の超音波槽中で30%ACN / 1%のFAの80μlの抽出を行う。
- 15分間の超音波槽内の70%ACN / 1%のFAの80μlの抽出を行う。
- 遠心分離機再び前溶出液のプール上清。
(FAは、トリプシンを不活性化し、ペプチドの溶解度を増加させるのに役立つ。) - 完全真空遠心乾燥ペプチド溶液。
(この時点で、サンプルは、MS分析に進む前に、-20°Cで数週間保存することができる。) - 6μLMS緩衝液(5%ACN、0.1 V / V FA·水)と2-5分間超音波処理中に再懸濁したペプチド。
- maximuで遠心サンプルm個の速度で5分間粒状物質を除去する。
- 質量分析のために上清を4μlを使用する。
9。 「Proteomatic」とMS-データ解析
データ分析は、オープンソースソフトウェア(http://www.proteomatic.org/でダウンロードすることができます)」Proteomatic」、世代およびMS / MSデータ評価パイプラインの完成、使用することによって可能にするプラットフォームを用いて実施した自由と商用ソフトウェア36。簡単に説明すると、設定が以下に記載される、より詳細な情報が6,26に見出すことができる。
- MSデータの同定および定量
実験からの同定およびタンパク質の定量6,26が記載されているようΔPSI対WTは、それぞれ、OMSSA(バージョン2.1.4 37)およびqTrace 26を用いて行った。次の更新されたパイプラインpgrl1実験WT対からMSデータ解析のために使用した。- OMSSA 37に加えて、タンパク質はまた、Xで特定された!タンデム(バージョン2013年2月1日38)。両アルゴリズムは、オーガスタス·データベース·バージョン10.2だけでなく、NCBIデータベースのBK000554.2とNC_001638.1の参加データベースに対してでJGI クラミドモナス遺伝子モデルデータベースのバージョン4.3を組み合わせることにより、生成されたデータベースに対して検索することによって適用した。
- ペプチドのMS 2同定は、標的デコイアプローチ39を用いて行った。各タンパク質のためのおとりはnonproteotypicペプチドの冗長性を維持しながら、ランダムにトリプシンペプチドをシャッフルして作成された。
- ペプチドの統計的検証が0.01未満と結果の事後エラー確率(PEP)閾値を使用してソフトウェアqvality(バージョン0.3.3 40)を用いて行ったが5ppmの前駆体の質量公差で濾過した。
- OMSSAとXからのペプチド!タンデムランはqTraceで接合し、定量化した次のフィルタステップを適用26:、MS 2の識別を必要とするタンパク質名/グループ情報を追加して、両方の姉妹ペプチドを必要とする。
タンパク質比は、WTとpgrl1からの混合CEF-supercomplex画分に互いに向かって有意に異なっていたか否かを調べるために、統計分析は、SPSSソフトウェア(バージョン21)を適用して行った。チトクロームB 6 / F複合体のサブユニットは、互いに同様のタンパク質FNR、FTSH2およびPSIサブユニットに対するHCF136に対して試験した。すべての4つの反復試験のタンパク質あたりの各走査カウントペプチドの比は、シャピロ·ウィルクス検定で正規分布について試験した。ペプチド集団が正常に(p <0.001)分布していたため、ノンパラメトリック統計を行った。まず、クラスカル·ワリス検定を群間で有意な相違を評価することを印加した。この試験では、有意差を予測する場合にのみ群間sが、さらなる分析は、マン·ホイットニーのU-テストを持つ2つの独立したグループ間の有意差を予測するために実施した。
結果
導入された定量的プロテオミクスのアプローチは、遺伝的に異なる温度でのCEF-supercomplexコンポーネントの比較分析によって実証チラコイド膜内の多タンパク質複合体の組成物を特徴づけることを目的クラミドモナス株 。 。メソッドが正常寺島らにより適用された6記載の洗剤可溶化に続いて、嫌気性成長した培養物からのチラコイド膜の単離を含む。次いで、サンプルを、同じクロロフィル量に基づいて、ショ糖密度勾配上にロードされ、複合体は、超遠心分離によって分画する。定量的MS分析のために、異なる株から2勾配画分の等容量を混合し、比較的( 図1)分析する。提示された結果は、WT cw15-arg7とΔPSIだけでなく、それぞれのWT cc124とpgrl1、間、CEF-supercomplex画分の比較が含まれています。
イムノブロット分析によって明らかにされたCEF-supercomplex WT及び分13に、CEF-supercomplexを保有WT及びΔPSI株分6間の部品、ΔPSI株におけるANR1のピーク画の比較のために( 図2Aおよび2B)6を選択した。3は、いくつかのPSIコアとLHCIタンパク質(またLhcaタンパク質として命名PSIの集光タンパク質)ならびにためにWT /ΔPSI(14 N / 15 N)などのタンパク質の相対比を示す図 CEF-supercomplexが割り当てタンパク質について。予想通り、PSIコアタンパク質は、両画分における無限比によって実証WT試料中に見出される。 Lhca4 -6および-8両画で異なる規制を示すがLhca2とLhca9は、WTに富んでいる。それはLHCIタンパク質が合成され、ΔPSI変異体41で正常に蓄積されていることに注意することが重要です。 PSI-LHCIのポリペプチドの比較Cから複雑ΔPSI変異体のLHCI錯体とクラミドモナスの WTはLhca2の大部分は、-3、-9弱くしかLHCIに結合し、さらにPSIコアの存在は、安定な結合のために必要であることであると思われることを明らかにした。これとは対照的に、Lhca1、-4、-6、-7、および-8は今回の実験で異なるLhca4の規制、-6および-8を説明することができ、これPSI 14のアセンブリの複雑な独立して形成する。
CEF-supercomplexに割り当てられるタンパク質については、それが画分6に対して1つのより高い比率で表示される強力なPSI-依存性遊走を示し、WT画分6およびΔPSI変異体の画分13でより豊富であるものを区別することができる比率分13で検出された1かより低い(Lhcbm5、PGRL1、ANR1、CAS、PFD、HCF136とCYTのF)や、強くない示したものが、それにもかかわらず、PSI依存ローカリゼーション(FNR、FTSH1、FTSH2、およびATPC )。
この実験で寺島ら 6は 、CEF-supercomplexの新規タンパク質は、以前に7を確認していませんように、それによって、それらを明らかにし、ANR1とCAS( 図2A〜Dおよび図3)のためのPSI依存移行挙動を示した。 MS分析の結果も、免疫検出することにより確認し、 生体内で 6 における CEFのためにこれらのタンパク質の機能的役割を確認するために、逆遺伝学の適用によってサポートされていました。また、この比較は、MS-アプローチが強く、既にCEF-supercomplexなどPGRL1、CYT fとFNR 7だけでなく、Lhcbm5 7,9として表示するの一部であることが実証されている蛋白質を確認することによって、これまでの研究からの結果をサポートしていますANR1とCASに匹敵するショ糖密度勾配でのPSI-依存ローカライズ。
同じapproacを使用して分6およびANR1とΔPSIの13の比較ΔPSI対実験、WTに明らかにされるように、H(図S8 6を参照)ANR1におけるCEF-supercomplexやタンパク質ANR1、CASとPGRL1のための同じ傾向の類似の組成を示した。 (ANR1対ΔPSI)画6中ANR1のタンパク質比はΔPSI実験対WTの比率に匹敵するが、注目すべきことに、CASとPGRL1の量は、前者の実験で高いように見えるとの結果であるかもしれないANR1 6のダウンレギュレーションを補償する。
また、CEF-supercomplex分中のANR1とCASの濃縮は1にもこの実験からのいくつかの他のタンパク質のPSI-依存の移行を推定できた。これらは、安定性のために重要な要素であるプレフォルディンドメイン含有タンパク質、HCF136、葉緑体42,43におけるPSII反応中心タンパク質D1の分解において基本的な役割を果たして2 ATP依存性メタロプロテアーゼFTSH1とFTSH2ですかassembPSII 44のLYおよびATPアーゼのγサブユニット。後で1のために、画分6〜13の比率が、このような明確な違いを示さないのに対して、更なる実験は、他のタンパク質も、CEF-supercomplexの候補となりそうかどうかを検証するために実施されなければならない。
この比較アプローチのコンセプト実験の証明として、我々は、この複合体の形成を可能にするために、両方がPSIを持つ2つの株にCEF-supercomplexの組成を分析した。それぞれの画分を分画した勾配の吸光度測定値に基づいて選択した。 図4A及び4Bは WTとpgrl1ノックアウト株との間の定量的比較の結果を示す。それはANR1とCASが著しくWT及びpgrl1間で変更されていないことを指摘しなければならない。 FTSH2がpgrl1が濃縮されているように見えるしながら、興味深いことに、HCF136は、WTが濃縮されているように見える。統計学的にSi(LHCIタンパク質を含む)は、すべてのPSI-サブユニットに、上記のタンパク質の両方のためのgnificant違いが確認できた。
また、チトクロームB 6 / F、複雑なサブユニットは、F CYTとPETOは、それぞれのcyt B 6、CYT B 6 / F IVおよびPETCに有意差があることが示された。 CYT fの合成の調節は、おそらくCYT Bの6とCYT B 6 / F IV の 45を含むがCYT B 6及びCYT B 6 / F IV は 、ダウンレギュレート少しであるが、とりわけ、CYT fは、pgrl1にアップレギュレートのようです。また、リスケタンパク質として知られている核コードPETCは、CYT Bの6とCYT B 6 / FゼIV(pgrl1、すなわちダウンレギュレーション)と同様の規制を示しています。これはまだOTHの蓄積につながるリスケタンパク質の減少または欠如として顕著であるER CYT Bの6 / FサブユニットでのWTレベルの約60%にクラミドモナス 46。この緩く結合したサブユニットは、Cの減少したレベルに蓄積することが示されて以来、また、pgrl1中PETOのアップレギュレーションは、注意することが重要です今回の実験で、WTに比べpgrl1にあまり豊富であるCYT B 6のどちらかを欠いた変異株、B 6 / IVまたはPETC 47 女 CYTを、 クラミドモナス 。
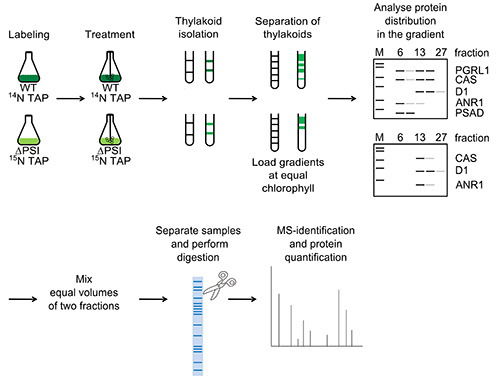
図1。WT及びΔPSIのために描かれているように実験的なワークフロー。細胞を代謝的に、少なくとも4世代のためにラベル付けされ、嫌気的条件下で4時間、アルゴンバブリングにより誘導されるとチラコイド膜は、勾配分離によって分離されている。イソラテッド膜は、ショ糖密度勾配(両方の株について葉緑素等量このステップで適用されます)にロードし、一晩遠心分離し、β-DMを使用して可溶化する。勾配画分を、勾配内のタンパク質の分布を決定するためにSDS-PAGEならびに免疫検出で分析した。 PSI依存移行を有するタンパク質を同定するために、WT CEF-supercomplex画分(画分番号6)とΔPSI株から対応する15 N標識画分の等容量を混合し、比較的分析した。同じことがΔPSI株(フラクション番号13)におけるANR1のピーク画分を用いて行った。比較、定量的MS-アプローチの場合は、混合タンパク質サンプルをタンパク質バンドを前に、MS-分析ゲル内消化し た後、クマシーブルー溶液で染色したSDS-PAGEにより分離した。 大きなIMAを見るにはここをクリックしてくださいGE。
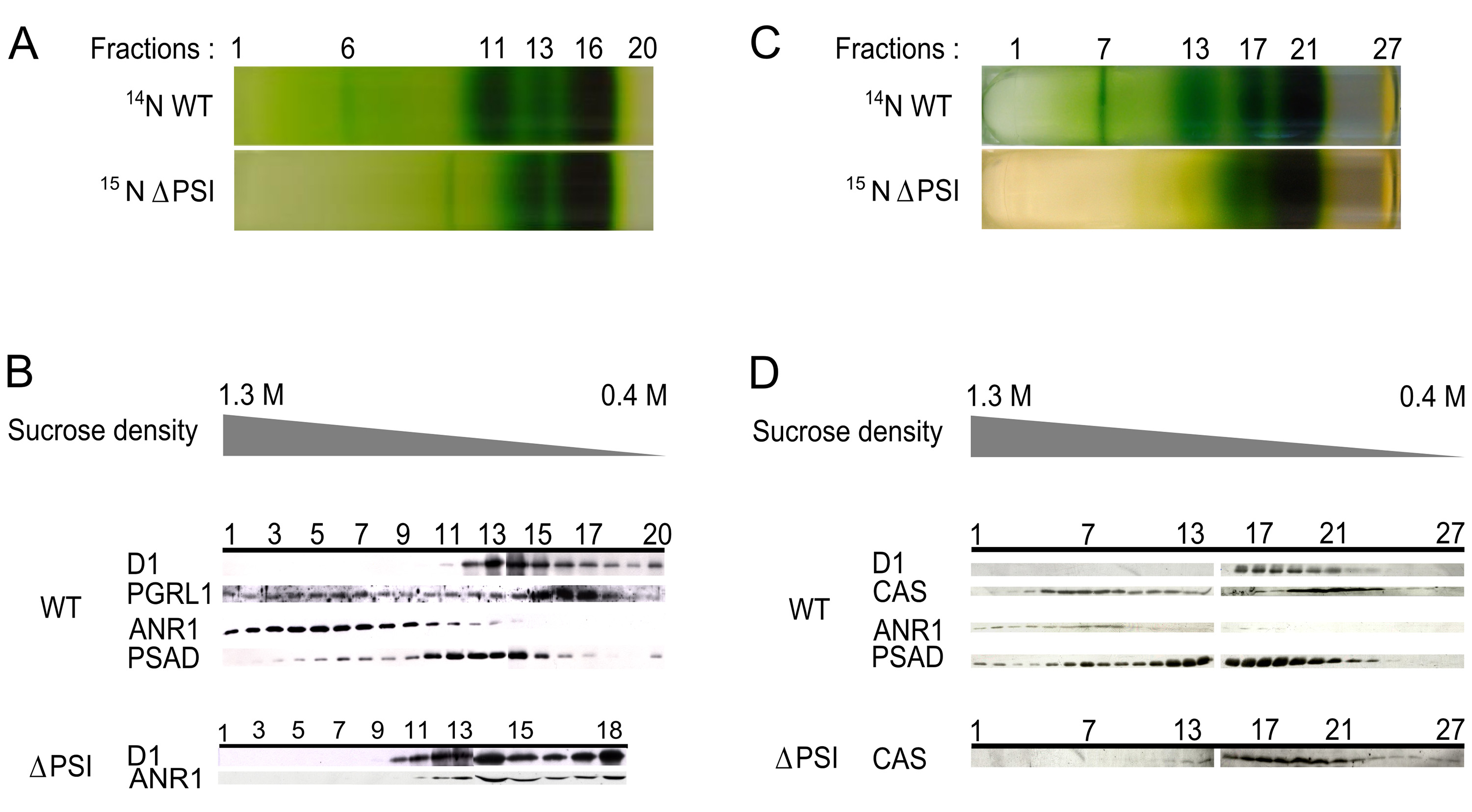
図2。ANR1とCASがΔPSI株では低密度領域に移動する。 :WT及び嫌気的条件から分離ΔPSIチラコイドのショ糖密度勾配を20画分に分離されたB:WT及びΔPSIから勾配の20画分中ANR1の免疫。このタンパク質は、WTに高密度領域に局在している間(フラクション6)それはΔPSI株(分13)に低密度領域にシフトアップされているC:WT及びΔPSIのショ糖密度勾配から隔離チラコイド嫌気的条件は27画分に分離されたD:WT及びΔPSIから勾配の27画分中のCASの免疫。このタンパク質は、Tを局所化している間WTのより高い密度領域O(フラクション7を中心にピークに達した)それは(端数19の周囲にピーキング)ΔPSI株における低密度領域にシフトアップされる。 (この図は、寺島ら 6から変更されている)。 拡大画像を表示するにはここをクリックしてください。

図3の定量的質量分析によりWTとΔPSI画分から6及び13で決定された相対的なタンパク質比。WTからの画分6および13は、15 N-標識ΔPSI株からのそれぞれの画分と比較している。 2の生物学的複製および3、MS-ランを表す相対的なタンパク質比は、WT /ΔPSI(14として示されている両方のためのN / 15 N)の6画分のみで同定されたのcyt fを除いて画分を分析した。この比較定量化はANR1とCASが(この数字は寺島ら 6から変更されている)。ショ糖密度勾配におけるPSI-依存の移行を示していることを明らかにし、より大きな画像を見るにはここをクリックしてください。

図4。定量的質量分析によって、CEF-supercomplex WTの画分とpgrl1で決定された相対タンパク質比。 :WTのショ糖密度勾配及び嫌気的条件から隔離pgrl1チラコイドB:相対タンパク質比のbetweeWT / pgrl 1(14 N / 15 N)として描かれて4異なる複製物に起因するN CEF-supercomplex分。 FTSH2とHCF136は赤で***で示されるように0.001≤すべてのPSI-サブユニット(Pと比較して有意差を示すが、この実験でANR1とCASが著しく、変更されません。HCF136:1900 B 6 / F、複雑なサブユニットは、F CYTと青に***で示したようにPETOは0.001≤P(それぞれ、CYTのB 6、CYT B 6 / F IVおよびPETCとは大きく異なることが示された。CYT F :2684 拡大画像を表示するにはここをクリックしてください。
ディスカッション
安定同位体標識を用いて、異なる定量的プロテオミクス研究は、過去数年に発表されている。これらの実験では、通常、2つの異なるサンプルは、1つのサンプルが安定同位体で標識された、比較される。その後、二つの試料からのタンパク質またはペプチドは、等しい比率で組み合わされ、一緒になって、さらに48を処理した。このような研究は、多くの場合、アップまたはダウンレギュレーション特異的タンパク質の調査する26,34,49異なるストレス条件にさらさ定義されて孤立した細胞区画( 例えば葉緑体、ミトコンドリア、またはチラコイド膜)を比較していきます。記載された比較、定量的プロテオミクスアプローチはチラコイド膜に多タンパク質複合体の組成を分析することを目的とし、前述の研究とは対照的に、前に同じクロロフィル濃度でロードチラコイド膜のスクロース密度分離後の試料の同じボリュームを混合に基づいているultracentrifugaTiONから。この方法は、効果的に比較的WT及びショ糖密度勾配でPSI-依存的移行タンパク質を同定するΔPSI株から単離されたCEF-supercomplexの組成を分析した寺島ら 6により塗布した。
この戦略の成果は、MS-結果は、さらに免疫検出でサポートされているという事実によって証明されています。さらに、寺島らは、これまでの研究からの知見を確認することができた( つまり、すでにPGRL1、FNR、およびCYT fの 7としてCEF-supercomplexの一部であることを説明したタンパク質の同定およびPSI-依存の移行)。 CEF-機械6の新規コンポーネントとしてANR1とCASの識別は非常に強力で効率的なツールとして、このアプローチを明らかにする。注目すべきことに、孤立したCEF-supercomplex、それによって機能が正常に精製を実証し、in vitro活性に展示6多タンパク質複合体をtional。また、CEF-supercomplexを形成し、どちらも2系統のためのこのアプローチの適用可能性は、WT及びpgrl1との比較によって実証されている。
CEF-supercomplex分(IEでFTSH1、FTSH2、PFD、およびHCF136の充実と同時精製される以前に同定されていないタンパク質の同定によって明らかにされるように一般に、この方法は、異なる株または条件の複雑な組成を調査するために使用することができCEF-supercomplex分)。これらのタンパク質は、この複合体の可能な新しい候補者であり、WT及びpgrl1の比較によって明らかにされるようにFTHS2、HCF136のさまざまな規制のためだけでなく、CYT B 6 / Fサブユニットのための我々の理解を向上させるためにかどうか、さらなる実験が必要である。
このアプローチのような効果のほかに、断絶がある噴霧器での細胞の破壊は、最初の重要なステップです。このプロトコルを扱う場合、慎重に検討する必要がある他の重要なステップ。セルの開口部が適切な方法で実施されていない場合は、孤立したチラコイドの収率はかなり低くなり、一晩遠心分離した後、CEF-supercomplexのほとんど検出する可能性があります。細胞の破壊に成功し、遠心分離後の上清を薄緑色から推測することができる。細胞破壊時の圧力が高すぎると逆に、supercomplexの一部が崩壊する可能性があり、重要な補因子が失われることがあります。チラコイドの収率に影響を与えるもう一つのステップは、陶芸家での細胞の再懸濁である。これは、慎重に行わなければならず、このステップの最後でほんの数緑色の粒子が残っている必要があります。ショ糖密度の製造は、膜複合体の可溶化のためだけでなく、前日にグラデーションまた、それは非常に重要であるこれはCEF-supercomplexを精製するためのもありますので、完全に可溶化したチラコイド50とを得ることが非常に重要であるため、正確には、β-DM濃度の観点から、このプロトコルに従ってください。小さな、白っぽいペレットを、その後の遠心分離ステップの後に観察された場合、可溶化工程が正常に行われた。ここで言及すべき別の重要な点は、一晩超遠心分離の時間です。ショ糖密度勾配は、光合成複合体の完全な分離を達成するために、少なくとも12時間遠心分離されるべきである。
プロトコルは、Cを用いて実証されているにもかかわらず、 2遺伝的に異なる系統におけるCEF-supercomplex物の比較分析のためのクラミドモナスは、このような明確な環境/実験から隔離多タンパク質複合体の組成物の比較分析など、他の質問の広い範囲にも容易に適応可能である条件又は分別の他のタイプを使用することによって。この方法の唯一の要件は、モデル生物は細胞培養で培養することができる、この方法の広い適用を実証し、スクロース密度勾配によって分離することができる窒素源およびタンパク質複合体としてアンモニアを使用することができることである。混合した14 N / 15 Nのサンプルおよびその後のゲル内消化のこのアプローチのSDS-PAGE分画の将来のアプリケーションのためのフィルタ支援試料調製(FASP)方法を適用することによって置き換えることができる。 1は、ゲル内ことを考慮すべきであるが、この方法では、消化の前にプロテオームを「クリーンアップ」するために、精製されたペプチドを得るために、ペプチドの回復を阻害することができるゲル内消化法の欠点を防ぐ目的とし、可溶化のための強力な洗浄剤の適用を含む消化は51消化を妨害し得る汚染に対してロバストであることが記載されている。
開示事項
著者らは、競合する経済的利害関係を宣言していません。
謝辞
MHが「ドイツ学術振興」(DFG)からの支援を認めるものです。著者 寄付:MHが調査を設計し、KT、JSとMTは、研究を行い、データを分析し、KTとMHが論文を書いた。
資料
| Name | Company | Catalog Number | Comments |
| Chemicals | |||
| Acetic acid | AppliChem | A0662 | http://www.applichem.com/home/ |
| Acetone | AppliChem | A2300 | http://www.applichem.com/home/ |
| Acetonitrile Optigrade für LC-MS | Diagonal | 9340 | Harmful, work with gloves. See protocol text for further precautions. https://www.diagonal.de/ |
| Ammonium chloride 15N | Cambridge Isotope Laboratories | 39466-62-1 | http://www.isotope.com/cil/index.cfm |
| Ammonium chloride 14N | AppliChem | A0988 | http://www.applichem.com/home/ |
| Ammonium hydrogen phosphate | AppliChem | A3583 | http://www.applichem.com/home/ |
| Ammonium sulfate | AppliChem | A3598 | http://www.applichem.com/home/ |
| Coomassie brilliant blue R-250 | Fisher Scientific | 10041653 | http://www.de.fishersci.com/index.php/deindex |
| n-Dodecyl-β-D-maltoside | AppliChem | A0819 | http://www.applichem.com/home/ |
| EDTA | AppliChem | A2937 | http://www.applichem.com/home/ |
| Formic acid | AppliChem | A3858 | http://www.applichem.com/home/ |
| HEPES | AppliChem | A3724 | http://www.applichem.com/home/ |
| Magnesium chloride | AppliChem | A4425 | http://www.applichem.com/home/ |
| Methanol | AppliChem | A2954 | http://www.applichem.com/home/ |
| Phosphorous acid | AppliChem | A0989 | http://www.applichem.com/home/ |
| Dipotassium hydrogen phosphate | AppliChem | A1042 | http://www.applichem.com/home/ |
| Potassium dihydrogen phosphate | AppliChem | A1043 | http://www.applichem.com/home/ |
| Sodium hydroxide | AppliChem | A1551 | http://www.applichem.com/home/ |
| Sucrose | AppliChem | A1125 | http://www.applichem.com/home/ |
| Tricine | AppliChem | A3954 | http://www.applichem.com/home/ |
| Tris | AppliChem | A2264 | http://www.applichem.com/home/ |
| Trypsin (sequencing grade modified) and Trypsin buffer | Promega | V5111 | http://www.promega.de/ |
| Equipment | |||
| Nebulizer (BioNeb cell disruptor) | Glas-Col | http://www.glascol.com/product/subproduct/id/75 | |
| Centrifuge tubes (14 mm x 89 mm) | Beckman Coulter | 331372 | for preparation of Takahashi style gradients
http://www.beckmancoulter.de/ |
| Centrifuge tubes 25 mm x 89 mm | Beckman Coulter | 344058 | for preparation of thylakoid isolation gradients.
http://www.beckmancoulter.de/ |
| Coulter Avanti Centrifuge J-20 XP | Beckman Coulter | http://www.beckmancoulter.de/ | |
| Fuchs-Rosenthal cell couting chamber | Diagonal | 449/72 | https://www.diagonal.de/ |
| Homogenizer (Potter) 50 ml | Fisherbrand | 10618242 | http://www.de.fishersci.com/index.php/defisherbrand |
| Pistil for homogenizer | Fisherbrand | 105252220 | http://www.de.fishersci.com/index.php/defisherbrand |
| Ultracentrifuge (Optima XPN-80 Ultracentrifuge) | Beckman Coulter | website: http://www.beckmancoulter.de/ | |
| Other | |||
| Antibodies | Agrisera | http://www.agrisera.com/en/index.html |
参考文献
- Joliot, P., Joliot, A. Cyclic electron flow in C3 plants. Biochim. Biophys. Acta. 1757 (5-6), 362-368 (2006).
- Shikanai, T. Cyclic electron transport around photosystem I: genetic approaches. Annu. Rev. Plant Biol. 58, 199-217 (2007).
- Finazzi, G., Furia, A., Barbagallo, R. P., Forti, G. State transitions, cyclic and linear electron transport and photophosphorylation in Chlamydomonas reinhardtii. Biochim. Biophys. Acta. 1413 (3), 117-129 (1999).
- Tolleter, D., et al. Control of hydrogen photoproduction by the proton gradient generated by cyclic electron flow in Chlamydomonas reinhardtii. Plant Cell. 23 (7), 2619-2630 (2011).
- Hertle, A. P., et al. PGRL1 Is the Elusive Ferredoxin-Plastoquinone Reductase in Photosynthetic Cyclic Electron Flow. Mol. Cell. 49 (3), 511-523 (2013).
- Terashima, M., et al. Calcium-dependent regulation of cyclic photosynthetic electron transfer by a CAS, ANR1, and PGRL1 complex. PNAS. 109 (43), 17717-17722 (2012).
- Iwai, M., Takizawa, K., Tokutsu, R., Okamuro, A., Takahashi, Y., Minagawa, J. Isolation of the elusive supercomplex that drives cyclic electron flow in photosynthesis. Nature. 464 (7292), 1210-1213 (2010).
- Chua, N. H., Bennoun, P. Thylakoid Membrane Polypeptides of Chlamydomonas reinhardtii: Wild-Type and Mutant Strains Deficient in Photosystem II Reaction Center. PNAS. 72 (6), 2175-2179 (1975).
- Takahashi, H., Iwai, M., Takahashi, Y., Minagawa, J. Identification of the mobile light-harvesting complex II polypeptides for state transitions in Chlamydomonas reinhardtii. PNAS. 103 (2), 477-482 (2006).
- Ikeuchi, M., Plumley, F. G., Inoue, Y., Schmidt, G. W. Phosphorylation of Photosystem II Components, CP43 Apoprotein, D1, D2, and 10 to 11 Kilodalton Protein in Chloroplast Thylakoids of Higher Plants. Plant Physiol. 85 (3), 638-642 (1987).
- Ruban, A. V., Lee, P. J., Wentworth, M., Young, A. J., Horton, P. Determination of the Stoichiometry and Strength of Binding of Xanthophylls to the Photosystem II Light Harvesting Complexes. J. Biol. Chem. 274 (15), 10458-10465 (1999).
- Barera, S., Pagliano, C., Pape, T., Saracco, G., Barber, J. Characterization of PSII-LHCII supercomplexes isolated from pea thylakoid membrane by one-step treatment with α- and β-dodecyl-D-maltoside. Phil. Trans. R. Soc. B. 367 (1608), 3389-3399 (2012).
- Kantzilakis, K., et al. A comparative approach towards thylakoid membrane proteome analysis of unicellular green alga Scenedesmus obliquus. Biochim. Biophys. Acta. 1768 (9), 2271-2279 (2007).
- Takahashi, Y., Yasui, T., Stauber, E. J., Hippler, M. Comparison of the subunit compositions of the PSI-LHCI supercomplex and the LHCI in the green alga Chlamydomonas reinhardtii. Biochemistry. 43 (24), 7816-7823 (2004).
- Thelen, J. J., Peck, S. C. Quantitative proteomics in plants: choices in abundance. Plant Cell. 19 (11), 3339-3346 (2007).
- Hsieh, S., et al. The Proteome of Copper, Iron, Zinc, and Manganese Micronutrient Deficiency in Chlamydomonas reinhardtii. Mol. Cell. Proteom. 12 (1), 65-86 (2013).
- Longworth, J., Noirel, J., Pandhal, J., Wright, P. C., Vaidyanathan, S. HILIC- and SCX-based quantitative proteomics of Chlamydomonas reinhardtii during nitrogen starvation induced lipid and carbohydrate accumulation. J. Proteome Res. 11 (12), 5959-5971 (2012).
- Malasarn, D., et al. Zinc deficiency impacts CO2 assimilation and disrupts copper homeostasis in Chlamydomonas reinhardtii. J. Biol. Chem. 288 (15), 10672-10683 (2013).
- Höhner, R., et al. The metabolic status drives acclimation of iron deficieny responses in Chlamydomonas reinhardtii as revealed by proteomics based hierarchical clustering and reverse genetics. Mol. Cell. , (2013).
- Mahong, B., Roytrakul, S., Phaonaklop, N., Wongratana, J., Yokthongwattana, K. Proteomic analysis of a model unicellular green alga, Chlamydomonas reinhardtii, during short-term exposure to irradiance stress reveals significant down regulation of several heat-shock proteins. Planta. 235 (3), 499-511 (2012).
- Förster, B., Mathesius, U., Pogson, B. J. Comparative proteomics of high light stress in the model alga Chlamydomonas reinhardtii. Proteomics. 6 (15), 4309-4320 (2006).
- Petroutsos, D., et al. The chloroplast calcium sensor CAS is required for photoacclimation in Chlamydomonas reinhardtii. Plant Cell. 23 (8), 2950-2963 (2011).
- Dodd, A. N., Kudla, J., Sanders, D. The language of calcium signaling. Annu. Rev. Plant Biol. 61, 593-620 (2010).
- Nomura, H., Komori, T., Kobori, M., Nakahira, Y., Shiina, T. Evidence for chloroplast control of external Ca2+-induced cytosolic Ca2+ transients and stomatal closure. Plant J. 53 (6), 988-998 (2008).
- Weinl, S., et al. A plastid protein crucial for Ca2+-regulated stomatal responses. New Phytol. 179 (3), 675-686 (2008).
- Terashima, M., Specht, M., Naumann, B., Hippler, M. Characterizing the anaerobic response of Chlamydomonas reinhardtii by quantitative proteomics. Mol. Cell. Proteomics. 9 (7), 1514-1532 (2010).
- Petroutsos, D., et al. PGRL1 participates in iron-induced remodeling of the photosynthetic apparatus and in energy metabolism in Chlamydomonas reinhardtii. J. Biol. Chem. 284 (47), 32770-32781 (2009).
- DalCorso, G., et al. A complex containing PGRL1 and PGR5 is involved in the switch between linear and cyclic electron flow in Arabidopsis. Cell. 132 (2), 273-285 (2008).
- Redding, K., et al. A systematic survey of conserved histidines in the core subunits of Photosystem I by site-directed mutagenesis reveals the likely axial ligands of P700. EMBO J. 17 (1), 50-60 (1998).
- Harris, E. H. . The Chlamydomonas Sourcebook. Introduction to Chlamydomonas and its laboratory use. , (2008).
- Porra, R. J., Thompson, W. A., Kriedemann, P. E. Determination of accurate extinction coefficients and simultaneous equations for assaying chlorophylls a and b extracted with four different solvents: verification of the concentration of chlorophyll standards by atomic absorption spectroscopy. Biochim. Biophys. Acta. 975 (3), 384-394 (1989).
- Naumann, B., Stauber, E. J., Busch, A., Sommer, F., Hippler, M. N-terminal processing of Lhca3 Is a key step in remodeling of the photosystem I-light-harvesting complex under iron deficiency in Chlamydomonas reinhardtii. J. Biol. Chem. 280 (21), 20431-20441 (2005).
- Hippler, M., Klein, J., Fink, a., Allinger, T., Hoerth, P. Towards functional proteomics of membrane protein complexes: analysis of thylakoid membranes from Chlamydomonas reinhardtii. Plant J. 28 (5), 595-606 (2001).
- Naumann, B., et al. Comparative quantitative proteomics to investigate the remodeling of bioenergetic pathways under iron deficiency in Chlamydomonas reinhardtii. Proteomics. 7 (21), 3964-3979 (2007).
- Shevchenko, A., Tomas, H., Havlis, J., Olsen, J. V., Mann, M. In-gel digestion for mass spectrometric characterization of proteins and proteomes. Nat. Prot. 1 (6), 2856-2860 (2006).
- Specht, M., Kuhlgert, S., Fufezan, C., Hippler, M. Proteomics to go: Proteomatic enables the user-friendly creation of versatile MS/MS data evaluation workflows. Bioinformatics. 27 (8), 1183-1184 (2011).
- Geer, L. Y., et al. Open mass spectrometry search algorithm. J. Proteome Res. 3 (5), 958-964 (2004).
- Craig, R., Beavis, R. C. TANDEM: matching proteins with tandem mass spectra. Bioinformatics. 20 (9), 1466-1467 (2004).
- Elias, J. E., Gygi, S. P. Target-decoy search strategy for increased confidence in large-scale protein identifications by mass spectrometry. Nat. Methods. 4 (3), 207-214 (2007).
- Käll, L., Storey, J. D., Noble, W. S. QVALITY: non-parametric estimation of q-values and posterior error probabilities. Bioinformatics. 25 (7), 964-966 (2009).
- Wollman, F. A., Bennoun, P. A new chlorophyll-protein complex related to photosystem I in Chlamydomonas reinhardtii. Biochim. Biophys. Acta. 680, 352-360 (1982).
- Bailey, S., et al. A critical role for the Var2 FtsH homologue of Arabidopsis thaliana in the photosystem II repair cycle in vivo. J. Biol. Chem. 277 (3), 2006-2011 (2002).
- Kato, Y., Sakamoto, W. Protein quality control in chloroplasts: a current model of D1 protein degradation in the photosystem II repair cycle. J. Biochem. 146 (4), 463-469 (2009).
- Meurer, J., Plücken, H., Kowallik, K. V., Westhoff, P. A nuclear-encoded protein of prokaryotic origin is essential for the stability of photosystem II in Arabidopsis thaliana. EMBO J. 17 (18), 5286-5297 (1998).
- Kuras, R., Wollman, F. A. The assembly of cytochrome b6/f complexes: an approach using genetic transformation of the green alga Chlamydomonas reinhardtii. EMBO J. 13 (5), 1019-1027 (1994).
- de Vitry, C., Finazzi, G., Baymann, F., Kallas, T. Analysis of the nucleus-encoded and chloroplast-targeted rieske protein by classic and site-directed mutagenesis of Chlamydomonas. Plant Cell. 11 (10), 2031-2044 (1999).
- Hamel, P., Olive, J., Pierre, Y., Wollman, F. A., de Vitry, C. A new subunit of cytochrome b6f complex undergoes reversible phosphorylation upon state transition. J. Biol. Chem. 275 (22), 17072-17079 (2000).
- Stanislas, T., et al. Quantitative proteomics reveals a dynamic association of proteins to detergent-resistant membranes upon elicitor signaling in tobacco. Mol. Cell. Proteomics. 8 (9), 2186-2198 (2009).
- Atteia, A., et al. A proteomic survey of Chlamydomonas reinhardtii mitochondria sheds new light on the metabolic plasticity of the organelle and on the nature of the alpha-proteobacterial mitochondrial ancestor. Mol. Biol. Evol. 26 (7), 1533-1548 (2009).
- Pagliano, C., Barera, S., Chimirri, F., Saracco, G., Barber, J. Comparison of the α and β isomeric forms of the detergent n-dodecyl-D-maltoside for solubilizing photosynthetic complexes from pea thylakoid membranes. Biochim. Biophys. Acta. 1817 (8), 1506-1515 (2012).
- Wisniewski, J. R., Zougman, A., Nagaraj, N., Mann, M. Universal sample preparation method for proteome analysis. Nat. Methods. 6 (5), 3-7 (2009).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved