Method Article
Метаболический Маркировка и мембраны фракционирования для сравнительного Proteomic Анализ
В этой статье
Резюме
Здесь мы опишем надежный метод для фракционирования плазмы мембран растений в моющих устойчивых и моющих растворимых мембран на основе смеси немеченый и в естественных условиях польностью 15 N меченых культур арабидопсис клеток. Процедура применяется для сравнительных протеомных исследований, чтобы понять процессы сигнализации.
Аннотация
Плазменные мембранные микродомены особенности, основанные на физических свойствах липидного и стеринового среды и имеют определенные роли в сигнальных процессов. Извлечение стеринов обогащенных мембранные микродомены из растительных клеток для протеомного анализа является трудной задачей в основном за счет нескольких стадий получения и источники загрязнений от других клеточных отсеках. Плазматической мембраны составляет лишь около 5-20% всех мембран в растительной клетке, и, следовательно, выделение высоко очищенной плазмы мембранной фракции является сложной задачей. Часто используемый способ включает водный двухфазной разделение в полиэтиленгликоле и декстрана, который дает в плазме мембранных везикул с чистотой 95% 1. Стерол богатых мембранные микродомены пределах плазматической мембране нерастворимы при обработке холодных неионогенных моющих средств при щелочном рН. Это моющее средство устойчивостью мембранную фракцию можно отделить от основной массы плазматической мембране с помощью ультрацентрифугирования в качествеucrose градиент 2. Впоследствии белки могут быть извлечены из группы низкой плотности в градиенте сахарозы по метанол / хлороформ осадков. Экстрагированного белка будет затем переваривали трипсином, обессоленной и, наконец анализируют с помощью LC-MS/MS. Наш протокол экстракции стеролов богатых микродоменов оптимизирован для подготовки чистых моющих устойчивостью мембранных фракций из культур арабидопсис клеток.
Мы используем полный метаболический маркировки арабидопсис культур подвеска клеток с К 15 NO 3 в качестве единственного источника азота для количественных сравнительных протеомных исследований следующих биологической очистки интерес 3. При смешивании равных соотношения меченых и без таковой клеточных культур для совместного извлечения белка влияние подготовительных шагов по окончательному количественного результате сохраняется на минимальном уровне. Также потери материала при добыче повлияет как контроль и образцы лечения таким же образом,д, следовательно, соотношение света и вертикальной качки пептида будет оставаться постоянным. В предлагаемом способе либо меченными или немеченными культуры клеток подвергается биологической очистки, а другой служит в качестве контроля 4.
Введение
В 1972 году Джонатан Сингер и Гарт Николсон предложил модельном флюиде Мозаика структурную модель клеточных мембран, заменяя белок-липидных-белка сэндвич модель, которая была общепринятой в начале 1960-х. Singer и Nicolson постулировано, что биологическая мембрана может рассматриваться как двумерной жидкости, где все липидные и белковые молекулы диффундируют свободно и легко 5. С этого времени, структура модель мембраны плазмы и знания состава мембраны стала еще более сложной. В частности, в плазматической мембране, структуры, такие как комплексы белков и липидов / стерола на основе структурно неупорядоченных микродоменов можно наблюдать. В искусственных модельных мембранах 6,7, стерины и сфинголипиды может боков отделить от других липидных видов формирование регионов с измененными физическими возможностями. Это разделение в клеточной мембране в основном вызвано само-связывая свойствах между стерины и высоко саturated углеводородных цепей phopsho-и сфинголипидов 8. В частности, жесткие стериновые кольца пользу взаимодействия с жестче и прямее насыщенных видов липидов и эти взаимодействия заставить соседние углеводородные цепи в более длительных конформации, увеличением толщины мембраны и твердость.
Один из обычно наблюдаемых особенностей стеролов обогащенный мембранных микродоменов был их нерастворимость при обработке неионных детергентов, таких Triton X-100 или Brij 35. Эти фракции считается идентичным с мембранными микродоменов и назывались моющие стойкие мембраны (DRM) на основе их биохимического способа получения 2. Использование неионогенных моющих средств во время извлечения DRM получил некоторую критику как биохимический подготовка DRM не может напрямую соответствуют какой-либо конкретной мембраны отсеке внутри живой клетки 9. В частности, моющее средство соотношение белка кажется важным в таких препаратов,сек различные моющие средства, а также различные количества моющего средства может дать различный состав моющего средства устойчивы мембранной фракции 10. Тем не менее, существуют доказательства, что отдельные виды белковых конкретно связать с этими клеточными стеролов богатых мембранных доменов, и что эти белки хорошо обогащенный биохимических препаратов моющих устойчивостью мембранных фракций 11. Ядро белков, которые были найдены в растительной DRM фракции, и для которых присутствие в МБК зависит стериновый, были особенно GPI-якорь белки, такие как fasciclin-как арабиногалактановых белков (FLAS) и членов семейства белков SKU. Кроме того, некоторые сигнальные белки, такие как рецептор-подобных киназ или фосфолипаз были найдены 11. Эти результаты согласуются со многими протеомных исследований по млекопитающих мембранных микродоменов 12,13. Также в растениях появляется все больше доказательств на роль мембранных микродоменов в контексте ответа на стресс 14 -16.
Протокол, описанный здесь обеспечивает надежный метод для фракционирования плазмы мембранных микродоменов и, в частности использует белок для концентрации моющего средства, что позволяет нам изображать стресс, вызванный изменениями стерина богатых мембраны отсеке 4,11,14.
протокол
ПОРЯДОК
Общие реагенты и буферы, используемые в протоколе экстракции:
- Лаборатория реактивного движения среда для арабидопсис культур подвеска клеток
- 3 мкМ Н 3 ВО 3
- 3 мкМ MnSO 4 х H 2 O
- 1.1 мкМ ZnSO 4 х 7 H 2 O
- 0,15 мкм KJ
- 0,03 мкм Na 2 MoO 4 х 2 H 2 O
- 3 нМ CoCl 2 х 6 H 2 O
- 3 нМ CuSO 4 х 5 H 2 O
- 0,9 мМ CaCl 2 х 2 H 2 O
- 0,5 мМ MgSO 4 х 7 H 2 O
- 0,5 мкМ FeSO 4 × 7 H 2 O
- 0,5 мкМ Na 2 ЭДТА х 2 H 2 O
- 0,12 мкМ тиамин HCl
- 0,16 мкМ никотиновой кислоты
- 0,097 мкМ пиридоксин HCl
- 0,107 мкМ НУК
- 0,375 мМ KH 2 PO 4
- 0,061 мМ NaH2 PO 4 х 2 H 2 O
- 0,039 мМ Na 2 HPO 4
- 0.027 мМ глицина
- 0,56 мМ мио-инозитол
- 1,5% сахарозы
- 10 мМ К 14 NO 3 или 10 мМ К 15 NO 3
Примечание: рН среды ЛРД должна быть скорректирована до 5,7 с помощью КОН. Среда должна быть стерилизованы фильтрацией или автоклавированием перед использованием.
- Буфер H
- 100 мМ HEPES-KOH (рН 7,5)
- 250 мм сахарозы
- 10% (вес / объем) глицерина
- 5 мМ ЭДТА
- 5 мМ аскорбиновой кислоты
- 0,6% (вес / объем) PVP K-25 или К-30
- 5 мМ DTT (добавить новый)
- 1 мМ PMSF (добавить новый)
- протеазы и фосфатазы ингибиторы (добавить новый)
- 50 ммоль NaF
- 1 мМ Na 3 VO 4
- 1 мМ benzamidin
- 0,3 мкМ mikrocystin
- 4 мкМ лейпептина
- коктейль ингибиторов протеаз
- Буфер Р
- 5 мМ фосфат калия
- 0,33 М сахарозы
- 3 мМ KCl
- 0,1 мМ ЭДТА
- 1 мМ DTT (добавить новый)
- Буфер TNE
- 25 мМ Трис-HCl, рН 7,5
- 150 мМ NaCl
- 5 мМ ЭДТА
- Двухфазной системе (6 г-система подходит для до 15 г образца сырого веса) способ получения
В 15 мл Сокол ингредиентов смеси труба, перечисленных ниже и тщательно перемешать:- 20% (м / м) декстран T500 - 2,6 г
- 40% (вес / вес) поли (этиленгликоль) (ПЭГ 3350) - 1,3 г
- сахароза - 0,678 г
- 0,2 М фосфат калия, рН 7,8 - 0,15 мл
- 2 М KCl - 0,014 мл
- добавить воду, пока общая масса двухфазной системе не 6 г.
- Сахарозы решения в TNE буфера
- 2.4 М, 1,6 М, 1,4 М, 0,15 М
- Реагенты для трипсина пищеварения
- UTU: 6 М мочевина, 2 М тиомочевины (рН 8,0 10 мМ Трис-HCl)
- Уменьшение буфера (1 мкг / мкл DTT в воде; 6,5 мМ)
- Алкилирование буфер (5 мкг / мкл иодацетамида в воде; 27 мМ)
- LysC эндопептидазы (0,5 мкг / мкл)
- Трипсин, изменение класса секвенирование (0,4 мкг / мкл)
- Реагенты для пептида обессоливания более C 18
- ресуспендирования раствор: 2% трифторуксусной кислоты (TFA), 5% ацетонитрила в воде
- Раствор А: 0,5% уксусной кислоты
- раствор В: 80% ацетонитрил, 0,5% уксусной кислоты
- Реагенты для обогащения фосфопептида
- Раствор А: 0,1% TFA, 5% ацетонитрил
- Раствор В: 0,1% ТФК, 80% ацетонитрила
- TiO 2 10 мкм
- Аммиак (фондовые 25% раствор)
- Пиперидин (фондовые 100%)
ПРОТОКОЛЫ
1. Метаболический Маркировка арабидопсис суспензионных культур клеток
- Расти Arabidopsis Col-0 Сотовыеподвески культуры, полученные из листьев 17 в полном 14 N-JPL среды (18; см. раздел «Общие реагентов и буферов") и один набор культур в 15 N-JPL среды в стерильной колбе при постоянном состоянии света на 80 до 100 мкмоль / м 2 сек, 23 ° С, при постоянном встряхивании при 120 оборотах в минуту.
- Для поддержания клеточных культур, инокуляции 400 мл свежей среды ЛРД 40 мл семь дневной культуры клеток в 1 л колбы.
- Заготовка клеточных культур происходит через вакуумного отсоса через широкую стеклянную воронку с сеткой из нержавеющей стали. Клетки накапливаются на сетчатой пластине и в воронке и могут быть легко собраны из там. Клетки рекомендуется замораживали при -80 ° С или в жидком азоте перед измельчением.
ПРИМЕЧАНИЕ: Для 15 N метаболически меченые клеточные культуры использовать K 15 NO 3 в качестве единственного источника азота по крайней мере два переходов через две недели 19. В EXPEriments для сравнительных протеомики, использовать 15 N надписью клеточную культуру, а также сохранять непомеченный культуру в нормальном среды. Биологическая очистка будут применяться либо с маркировкой или немеченого культуры, а другой служит контролем (рис. 1). Для приготовления белкового, обе культуры будут объединены 20. При планировании экспериментальную установку, мы рекомендуем, учитывая взаимное подписи заголовков 4, в котором такой же режим применяется один раз к 15 N-меченых клеток и один раз немеченых клеток и соответствующего немеченого или 15 N-меченые клетки служат в качестве контрольных. В этом случае двойные количества клеточных культур необходимы.
2. Плазменные Мембрана Очистка
Примечание: Все дальнейшие шаги выполняются в холодной комнате и / или на льду, если это не указано иное.
- Однородный клетки от около 1 л 7 дней культурах клеточной суспензии в жидком азоте.Материал можно хранить при -80 ° С до дальнейшего использования.
- Смешайте одинаковое количество меченых и немеченого культур замороженных клеток на основе сырого веса в химический стакан и добавить 2 объемами буфера H немедленно. В случае мембранного подготовки микродоменной предлагается использовать, по меньшей мере 7 г сырого веса обоих меченых и без таковой клеток.
- Поместите стакан на шейкере и встряхните пока материал не плавится и раствор жидкости и без кристаллов льда.
- Фильтр гомогената через один слой Miracloth в 50 мл центрифужные пробирки.
- Образцы Баланс с буферной Н и центрифуге при 10000 мкг в течение 8 мин.
- Загрузите супернатант в предварительно охлажденные пробирки ультра-центрифуги (например, для ротора Beckman Coulter SW31Ti), с объемом около 32 мл
- Образцы равновесии с буфером ч и осаждения микросом центрифугированием при 100000 х г при 4 ° С в течение 30 мин с помощью Beckman SW32Ti ротор.
- Удалить супернатант после центрифугирования.
ПРИМЕЧАНИЕ: супернатант содержит растворимые белки. Небольшое количество этой фракции могут быть сохранены для дальнейшего осаждения белка и последующего анализа также растворимых белков.
- Ресуспендируют осадок мембран из каждого образца в соответствующем количестве буферного R и загрузить на верхней части U1 двухфазной системе (рис. 2). Если используется 6 г двухфазная система, сработал ровно 2 г ресуспендированного мембраны гранул.
Примечание: Конечный объем буферной R зависит от размера в двухфазной системе, которая будет использоваться (~ 1,6 мл буфера R необходим при использовании системы 6 г). Рекомендуется использовать меньше буфер для ресуспендированием так чисто буфер может быть добавлен на двухфазной системе, чтобы получить требуемую вес, а не использовать слишком много буфер для растворения, а не быть в состоянии загрузить весь образец на двухфазной системе.
- Загрузить тот же объем чистого буфера R как используемый для гоэ образец ресуспендирование на U2.
- Медленно перемешать U1 и U2 труб путем обращения их 30x (примерно 1 инверсии / сек).
ПРИМЕЧАНИЕ: Не энергично встряхнуть двухфазной системы. Это может привести к отсутствие разделения фаз на стадии ультрацентрифугирования.
- Центрифуга образцов при 1500 х г при 4 ° С в течение 10 мин.
- Удалить супернатант после центрифугирования.
- Передача верхней фазы с U1 на U2 и повторить центрифугирования при 1500 х г при 4 ° С в течение 10 мин.
- Переместить верхнюю фазу из U2 в ультрацентрифуге труб SW41Ti и разбавить его с пятью объемами буфера R и тщательно перемешать.
ПРИМЕЧАНИЕ: Окончательное верхнюю фазу, возможно, придется быть разделен на отдельные Ультрацентрифуга труб, прежде чем он может быть разбавлен в пять раз.
- Центрифуга образцов при 200 000 х г при 4 ° С в течение одного часа с использованием ротора SW41Ti.
- Ресуспендируют осадок мембран в Смальл количество TNE буфера (обычно 200 мкл буфера используется) для изоляции моющих устойчивых мембран.
ПРИМЕЧАНИЕ: Небольшое количество этой фракции могут быть сохранены для анализа нефракционированного мембране.
ПРИМЕЧАНИЕ: мембранную фракцию плазмы можно хранить при температуре 4 ° С в течение ночи до фракционирования в моющих устойчивых оболочек и моющих растворимых фракций.
3. Моющее средство Устойчив Получение мембран
- Проверьте концентрацию плазменного мембранной фракции по Бредфорда.
- Добавить Тритон Х-100 в мембранной фракции плазмы. Конечная концентрация моющего средства должны оставаться между 0,5-1%. Моющее средство для веса белка в весовом соотношении должны остаться между 13-15.
- Образцы содрогнутся около 100 оборотов в минуту при 4 ° С в течение 30 мин.
- Добавить три тома 2,4 М сахарозы в одном объеме обрабатываемой плазматической мембраны, чтобы получить 1,8 М конечной концентрации сахарозы.
- Подготовьте сахарозы градиент в SW41Ti Ультрацентрифуга труб, загрузив соответствующие растворы сахарозы на верхней части 1,8 М фракции, как показано на рисунке 3.
- Центрифуга образцов при 250 000 х г при 4 ° С в течение 18 часов с использованием ротора Beckman SW41Ti.
- Осторожно снимите ультрацентрифуге труб от ротора, чтобы избежать нарушая полосы низкой плотности, которые могут быть видны как молочно кольца на границе 0,15 M/1.4 М сахарозы. Иногда ничего не видно, но доля по-прежнему содержит стойкую белковую фракцию моющего средства.
- Удалить фракцию 0,75 мл объема из верхней части градиента. Фракции 2 и 3, которые охватывают объем около 1,5 мл выше межфазной кольца и 0,5 мл ниже представляют моющего средства стойкий мембранной фракции. Соберите эти фракции в 15 мл пробирки Фалкон. Фракции 9 и 10 содержат моющего растворимого мембранной фракции, а также может быть собрана для сравнения. Для дальнейшего анализа бассейна FractИоны 2 и 3, а также фракции 9 и 10.
4. Добыча белки от Устойчивость фракции моющих по метанол / хлороформ
ПРИМЕЧАНИЕ: Все шаги осуществляются в комнатной температуре.
- Добавить 4 объемов метанола, собранных фракций и тщательно вихря.
- Добавить 1 объем хлороформа, тщательно вихрь.
- Добавить 3 объема воды, вихрь полностью.
- Центрифуга образцов при 2000 мкг в течение 5 мин с использованием настольной центрифуге (например Эппендорф 5417R).
- Удалить водную фазу над слоем белка в интерфазе.
- Добавить 3 объемов метанола, вихревые тщательно.
- Центрифуга образцов при 4000 х г в течение 10 мин.
- Удалить супернатант и сухой осадок. Высушенный осадок готов к в-решения пищеварения.
5. В растворе трипсина Пищеварение
ПРИМЕЧАНИЕ: В этой процедуре все шаги сделаны втемпература в помещении для уменьшения нежелательных модифицирования аминокислотных боковых цепей по денатурирующих.
- Растворите образца в небольшом объеме 6 М мочевины, 2 М thiurea, рН 8 (UTU). Использование в качестве малый объем, насколько это совместимо с образцом (обычно приблизительно 40 мкл).
- Образцы растворяли в Спин UTU на 5000 мкг в настольной центрифуге Eppendorf (например 5417R) в течение 10 мин для осаждения нерастворимого материала.
- РН конечного раствора должна быть около 8,0 для оптимального трипсин-переваривание. Проверьте с рН полос.
- Добавить 1 мкл буфера для каждого сокращения 50 мкг образца белка и инкубировать 30 мин при комнатной температуре.
ПРИМЕЧАНИЕ: Только грубая оценка содержания белка необходимо. Когда количество образца ограничен лучше пожертвовать точность, а не тратить на образец белкового анализа.
- Добавить 1 мкл буфера алкилирования для каждого образца белка 50 мкг и инкубировать 20 мин при комнатной температуре в темном.
- Добавить 0,5 мкл LysC за 50 мкг белка образца и инкубировать в течение трех часов при комнатной температуре при постоянном встряхивании при 700 оборотах в минуту. Если необходимо, дайджест также может быть осуществлено в течение ночи. Тем не менее, длительное время при высокой температуре, не рекомендуется, поскольку это может увеличить потерю пептида за счет адсорбции на пластического материала трубы в водных рН 8 условий.
- Развести пробы с четырьмя объемами 10 мМ Трис-HCl, рН 8.
Примечание: Этот шаг является абсолютно необходимым, чтобы разбавить концентрацию мочевины как трипсин очень чувствителен к высокой концентрации соли.
- Добавить 1 мкл трипсина на 50 мкг белка образца и инкубировать в течение ночи при комнатной температуре при постоянном встряхивании при 700 оборотах в минуту.
- Подкислить образцов до 0,2% ТФУ конечной концентрации до достижения рН 2 (добавить приблизительно 1/10 объема 2% трифторуксусной кислоты).
Примечание: Образцы можно хранить при - 20 ° C до использования в дальнейшем, но лучше, чтобы сохранитьих на StageTips при 4 ° С, если это в течение короткого времени (одна неделя) или сохранить их после StageTips обессоливания.
6. Изготовление C 18-StageTips
- Поставьте Empore Disk C18 на ровную чистую поверхность, например, одноразовой пластиковой чашке Петри.
- Удар небольшую диск при помощи тупого наконечником иглы для подкожных инъекций с диаметром 1,5 мм. Диск палочки в иглу и могут быть переданы в кончика пипетки.
- Нажмите диск из иглы и закрепите его в сужения кончика пипетки куском плавленого кварца или трубки фитинга во внутренней части иглы.
ПРИМЕЧАНИЕ: StageTips можно хранить сухой при комнатной температуре 21.
7. Использование C 18-StageTips для пептида опреснения и концентрации
- Условие а C 18-StageTip путем размещения 50 мкл раствора В на подготовленную StageTip. Вращайте чаевые в центрифуге при 2000 оборотов в минуту в течение 2 мин в настольной сentrifuge (например Эппендорф 5417R).
ПРИМЕЧАНИЕ: Используйте адаптеры для спин StageTips в центрифуге Эппендорф, жидкость будет собираться в 2 мл реакционную трубку. Для более крупных препаратов, советы стадии также могут быть размещены в стойке с наконечником 96 из 200 мкл наконечниками и жидкость может быть собрана в планшет для микротитрования.
ПРИМЕЧАНИЕ: Никогда не используйте более высокую скорость, чем 3000 мкг в настольной центрифуге (например Эппендорф 5417R) в связи с риском из-под С 18 диск из чаевых.
- Уравновешивают StageTip помощью 100 мкл раствора А. Спин наконечник в центрифуге при 5000 мкг в в настольной центрифуге (например Эппендорф 5417R).
- Повторите шаг 2.
- Нагрузка образца на диске, осторожно пипеткой образец в наконечником пипетки с диском внутри.
ПРИМЕЧАНИЕ: Один диск может связать ок. 100 мкг белка.
- Вращайте советы в СЕntrifuge пока весь объем образца не проходят через C 18 диска.
- Вымойте StageTips два раза с 100 мкл раствора А. прясть советы в центрифуге.
ПРИМЕЧАНИЕ: Промытые и загруженные StageTips можно хранить при температуре 4 ° С в течение до недели.
- Элюции образца с 40 мкл раствора B. Сбор элюат в свежем 1,5 мл реакционной трубки.
- Концентрат образца в Speed Vac. В идеальных условиях, остановить процесс обезвоживания, поскольку есть только приблизительно 1 или 2 мкл жидкости осталось.
Примечание: высушенные образцы могут быть сохранены в -80 ° С в течение многих лет.
- Добавить конечный объем 9 мкл ресуспендирующего решения образца и передать его на микротитрационного планшета для массового анализа спектра.
Примечание: Конечный объем использованного ресуспендирующего буфера зависит от потребностей экспериментатора и чувствительности масс-спектрометраиспользуется.
8. Альтернативная Протокол фосфопептид обогащения
Примечание: для обогащения фосфопептида, экстракция белка на стадии 2 должно быть сделано в присутствии ингибиторов фосфатазы.
Примечание: Точный концентрация белка не должны быть определены для следующих шагов. Достаточно иметь грубую оценку содержания белка, чтобы избежать ненужных потерь образца
- Подготовьте С 8-StageTips (следовать той же протокол для подготовки С 18-StageTips в шаге 6).
- Передача 1 мг TiO 2 шариков в верхнюю часть готова C 8-StageTips (использование 1 мг TiO 2 в 100 мкг белка).
- Уравновесить TiO 2 советы со 100 мкл раствора С, спина при 2000 мкг в течение 5 мин в настольной центрифуге (например Эппендорф 5417R).
- Смешайте 100 мкг переваривается и обессоленной пептидов из шага 7.7 (она должна быть в 100 мкл раствораB) со 100 мкл раствора А.
- Загрузите смешанный образец на уравновешенных TiO 2 колонки; спин при 1000 мкг, 5 мин.
- Сбор проточные и загрузить его на том же наконечником снова (держать поток через после второго прохода).
- Вымойте наконечник 100 мкл раствора А; спин при 2000 мкг в, 5 мин в настольной центрифуге (например Эппендорф 5417R).
- Элюции образца с 50 мкл 5%-ного аммиака.
- Элюции образца с 50 мкл 5% пиперидина (как Элюаты могут быть объединены).
- Немедленно подкисляют примера с использованием 50 мкл 20%-ной фосфорной кислоты. рН должно быть около 2.
ПРИМЕЧАНИЕ: Сохраните TiO 2 советы и получить порошок. Он может быть промывают раствором В и повторно использовать для одного или двух более раундов.
- Опять опреснения подкисленной пробы над C 18 советов (см. шаг 8).
9. ЖХ-МС/МС Анализ пептидных смесей
- Ресуспендируют обессоленной Phosphopeptides в ресуспендирующего буфера.
- Нагрузка ресуспендировали образец на LC-MS/MS системы выбора и приобрести спектры в зависимости данных режиме при предложенной разрешением 60000 полных ширин на полувысоте.
ПРИМЕЧАНИЕ: Для обеспечения оптимальной фрагментации, либо сканирование нейтральной потери следует применять 22, или при наличии многоступенчатой активации 23. Если ETD доступно это позволит пептид магистральной фрагментации без потери фосфорной кислоты 24.
ПРИМЕЧАНИЕ: Пик списки от исходных данных должны быть извлечены и представлены идентификации базы данных, а также для количественного определения. Здесь мы описываем настройки для использования талисманов и MSQuant, который работает для файлов исходных данных из LTQ, LTQ-Orbitrap и LTQ-ФТ инструментов (Thermo Scientific).
- Выписка пик список, используя DTAsupercharge в меню "Помощник" в MSQuant. Используйте настройки по умолчанию.
- Отправить в результате пик списке файлов, чтобы талисман поисковой системы. Critical настройки: предшественники ионной масс толерантности 10 частей на миллион, MS / MS масса толерантности 0,5 Da. Основные модификации: carbamidomethylation цистеинов, переменная модификации: окисления метионина, фосфорилирование серин, треонин, тирозин. Количественный способ: 15 Н метаболический маркировки.
- Сохранить талисмана результат, как веб-страницы файла.
- Загрузите талисман файл результатов и необработанный файл в MSQuant. Выберите все белки, представляющие интерес и запустить "Автоматическая количественное". Программа будет читать полные спектры сканирования из сырой файл и сделать пик интеграции для меченых и без таковой партнеров каждого пептида.
- Результаты Экспорт Quantitation в программе электронных таблиц или в табуляцией текстовый файл. Затем данные могут быть представлены в дальнейшего статистического анализа в Excel или с помощью дополнительных пакетов программного обеспечения, таких как Statquant 25 или взломщик 26.
Результаты
С помощью представленного протокола метаболически меченые культуры Arabidopsis клетки можно изолировать плазматические мембраны из растительной ткани (Шаг 2, фиг.2 и 4) и обогащают для моющих устойчивы мембранных фракций в плазматической мембране (шаг 3, фиг 3 и 5). Впоследствии протокол позволяет экстракция белков из этих моющих устойчивы мембранных фракций (этап 4) и переваривание белка для сравнительного протеомного анализа (этап 5). Наконец, дополнительный обогащение фосфопептидов (шаг 8) представляет особый интерес в изучении процессов клеточной сигнализации. Последний шаг то есть количественный анализ данных (шаг 9, рисунок 6) коэффициентов белок изобилии в мембранных фракций от меченого и немеченого клеточной культуре.
Типичные результаты после смешивания 2-фазной системе (шаг 2) и последующего центрифугирования являются четким цвета верхнюю фазу изеленый цвета нижнюю фазу (рис. 2). Плазменные мембранные везикулы предпочтительно связать с верхней фазы ПЭГ, в то время как мембранные везикулы из зеленых хлоропластов и других внутренних мембран включены в нижней декстрана фазы. Если разделение цветов не может быть обнаружено, шаг 2 не проводилось правильно и плазменные мембраны будут загрязнены значительными количествами внутренних мембран. Обогащение мембранных белков плазмы можно показать, протеомного анализа малых аликвот плазмы мембранных фракций и белков в нижней фазе двухфазной системы. Нижняя фаза содержит внутреннюю оболочку клетки. Например, особенно типичные известные плазматической мембране белки, такие как белки рецептора киназы показал высокое содержание в плазме мембранной фракции (ТЧ) и низкой численности в нижней фазе фракции (фиг.4А), содержащий внутренние мембраны (IM). В свою очередь, известные белки эндоплазматического ретикулума шоу высокойизобилие во внутреннем фракции мембран и не наблюдались в плазме мембранной фракции (фиг.4В).
Последующее обогащение моющих устойчивых мембранных фракций (шаг 3) будет в идеальных случаях привести к образованию молочно кольца низкой плотности мембранных везикул примерно 1/5-й высоты трубы (рис. 3). Если регулировка Triton X-100 или концентрации моющего средства в соотношении белка (этап 3.2) является оптимальным для разделения на моющих устойчивы и моющих растворимых фракций, дополнительные кольца можно наблюдать в нижней части градиента и также будет мембранные сгустки в группе с низкой плотностью. В этих случаях моющего средства в соотношении белка или общего количества моющего средства отличается от критической концентрации мицелл, необходимого для воспроизводимых разделения двух фракций мембранного домена. Использование конечной концентрации моющего средства и моющие средства для соотношения белка описано здесь, ENRichment типичных белков микродоменных, таких как remorin (AT3G61260) 27 может быть подтверждена путем сравнительного анализа масс-спектрометрическим из DRM фракции, растворимой фракции моющего средства (шаг 3,8), а также нефракционированного плазматической мембраной и внутренних мембран. Самая высокая обилие remorin белка было обнаружено в DRM фракций, как ожидалось (рис. 6А). Белки не присутствующие в мембранных микродоменов, таких как ABC-транспортера AT1G59870 (рис. 6, б), не показывают повышенный обилие в DRM фракции. Также типичные примеси, такие как митохондриального белка (AT2G07707) из комплекса АТФазы F0 (рис. 6C) и рибосомного белка (At1G001100) из рибосомы 60S (рис. 6d) не показывают обогащенного обилие в DRM фракции, хотя минимальное количество может еще предстоит определить.
После масс-спектральный анализ, белковые обилия отношений статуса фосфорилирования белков в плазмемембранные фракции меченых и без таковой клеточных культурах может быть количественно отличается (рис. 6). Типичные результаты от MSQuant ( msquant.alwaysdata.net ) количественного окна должны показать отношение интенсивности ионного один к одному для большинства выявленных пептидов (рис. 6А). Эти пептиды с отношение интенсивности ионного значительно отклоняясь от 1:1 считаются дифференциала регулируется между меченым и немеченного культуре клеток, и являются кандидатами на соответствие с белками, пострадавших от применяемого обращения (рис. 6С). Хороший контроль качества успешного метаболического маркировки является одним из элюирование оба обозначены и непомеченных версии пептида в виде единственного пика при разделении нано-ВЭЖХ (шаг 9), как показано на фиг 6B и D.

Рисунок 1. Метаболический маркировка экспериментальная стратегия. Схематическое изображение двух вариантах эксперимента при использовании полностью метаболический меченых и культуры немеченый А. THALIANA клеток. Экспериментатор может либо принять решение об использовании 14 N клетки (без маркировки) в качестве контроля и 15 N клеток (метаболически меченых), которые проходят биологическую очистку, или наоборот. В ответном эксперимента оба варианта осуществляются параллельно.

Рисунок 2. Рабочий процесс для разделения растение мембранных везикул на водной двухфазной системе, основанной на полиэтиленгликоля (ПЭГ) и декстран. Плазматической мембраны везикулы разделены на верхней фазы ПЭГ в то время как хлоропласт и другие внутренние мембраны, связанные с бутом декстран фаза после центрифугирования. С дополнительной промывки верхней фазы лучше очистка может быть достигнута, но и потери материала увеличивается.
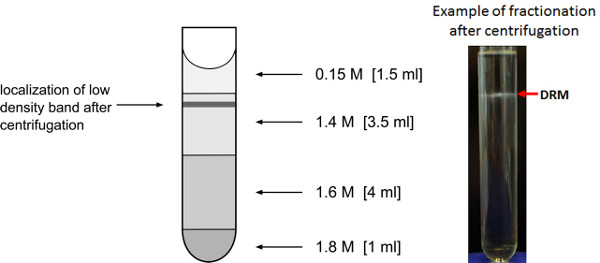
Рисунок 3. Обогащение низкой плотности мембранных фракций. Представление градиент сахарозы для обогащения низкой плотности моющих устойчивы мембранных фракций. Ожидаемое место после ночного центрифугирования плотности мембранных везикул полосы низкой указано.

Рисунок 4. Обогащение белков плазматической мембраны после очистки в двухфазной системе. Нормализованныйионные белок интенсивности для белков, измеренных в мембране (ПМ) и внутренних мембран (IM) фракции. (A) Типичные известные составляющие мембране показать гораздо более высокий изобилие в PM фракции, чем в IM фракции. (В) Природный известные компоненты внутренних мембран показывает противоположное поведение. Для нормализации, были выражены суммы интенсивности ионного для каждого белка в виде доли от общей интенсивности ионного на образец, а затем в среднем от повторов. Доля интенсивности ионных затем выражается в относительно среднего между двумя методами лечения. Планки погрешностей представляют стандартное отклонение трех препаратов из независимо выращенных культурах клеток. Нажмите здесь, чтобы увеличить рисунок .

Рисунок 5. . Обилие стандартных маркеров белка в измеренных фракций Участки представляют распределение нормированных интенсивностей ионных белок выбранных белковых маркеров в частности субклеточных отсеков (DRM - стериновые богатых микродоменов, PM - плазмалеммы, IM - внутренние мембраны, SP - растворимых белков). Численность модели (А) remorin в качестве маркера для стериновых богатых мембранных микродоменов, (B) ABC-типа белка транспортера семья как представителя не стеринового зависит от белка, (С) субъединицы митохондриальной F0 комплекса, (D) 60S субъединицы рибосом как типичный совместное очистки загрязнений. Для нормализации, были выражены суммы интенсивности ионного для каждого белка в виде доли от общей интенсивности ионного на образец, а затем в среднем от повторов. Доля интенсивности ионных затем выражается в относительно среднего между двумя сточtments. Планки погрешностей представляют стандартное отклонение трех препаратов из независимо выращенных культурах клеток. Нажмите здесь, чтобы увеличить рисунок .
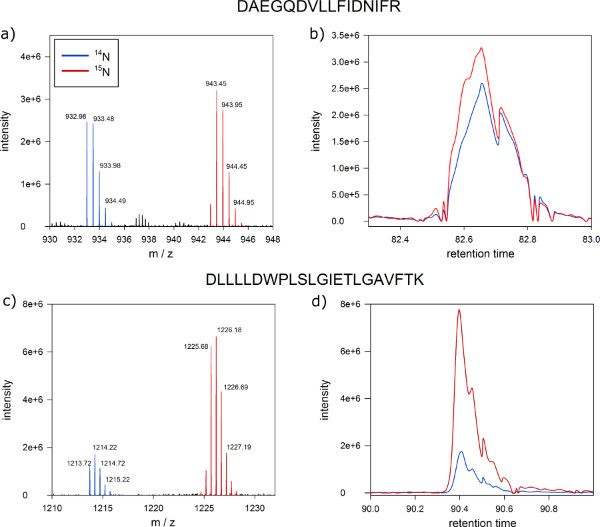
Рисунок 6. Ожидаемые результаты количественного белок масс-спектрометрии. Фотография экрана MSQuant показывая ожидаемую соотношение 1:01 интенсивности ионного пептида из смеси 1:1 белковых экстрактов из меченого и немаркированные Arabidopsis клетки. (А) полный спектр сканирования пептидной DNNLLGK ясно разделения помечены (правый пик) и без этикетки (слева пик) версия пептидов на оси м / г. Моноизотопный масса и первый изотоп обозначены синими метками. (В) Маркированный (синий)д немаркированные (красный) версии пептида совместного элюирования в виде единственного пика во нано-ВЭЖХ. (С) Полный спектр сканирования пептида с соотношением интенсивностей ионов 1:5 в качестве кандидата на дифференциально регулируемого белка. (D ) Также белки с отношениями, отличных от 1:1 сотрудничества элюата в хроматографии с обращенной фазой. Нажмите здесь, чтобы увеличить рисунок .
Обсуждение
Протокол, представленные в этой статье, содержит много шагов, и все они имеют решающее значение для получения чистого и представительного фракционирование плазмы мембраны растений в моющих устойчивых оболочек и моющих растворимых фракций. Поэтому важно следить за каждым шагом в соответствии с инструкциями.
Лечение плазменной мембранной фракции с неионного детергента (шаг 3.2) имеет сильное влияние на качество мембраны микродоменной фракционирования. Чтобы получить воспроизводимые результаты между различными препаратами, и чтобы иметь возможность сравнивать различные образцы из того же эксперимента, что очень важно, чтобы точно оценить концентрацию белков в плазматической мембране и применить моющее средство всегда в таком же соотношении по отношению к содержанию белка и всегда одной и той же конечной концентрации. Практически, это означает, что иногда это необходимо развести образцы с высокой концентрации белка или использовать различные акции концентрациитритона Х-100.
В биохимических исследований, в последнее время наблюдается тенденция среди исследователей использовать метод моющего средства без выделения мембранных микродоменов 28-30. Эти методы основаны на механическое разрушение плазматической мембраны отрезают с помощью очень тонкой иглы по аналогии с французской прессе клеток давление. Эти процедуры были успешно применены в культурах клеток млекопитающих, богатых мембранных микродоменов, но применение к клеточной стенке, содержащей организмов (дрожжи, клетки растений) не сообщалось. Использование количественных протеомики вместе с стеролов, разрушающие агенты, такие как метил-бета-циклодекстрина, было показано, что DRM фракции, полученные из растений плазматической мембране действительно содержат белки, которые являются маркерами для мембранных микродоменов 11.
Что касается окончательных результатов масс-спектрометрического количественного, типичные результаты, показанные на рисунке 6 представляют идеальную ситуацию вкоторых интенсивность ионного для большинства мечеными и немечеными пептидов близки к идентичным. Тем не менее, в некоторых случаях может наблюдаться определенная степень биологической вариации между наборами меченных и без таковой клеточных культурах. Таким образом, перед биологической очистки либо меченными или немеченными культура клеток проводят, анализ смеси меченых и без таковой контрольных клеток, как без какого-либо лечения, позволяет идентификация пептидов с отношениями расходящихся от идеального 12:59 ситуациях. Эти белки с расходящимися отношений являются показаниями для биологических вариаций. Чтобы преодолеть проблему отличительных эффектов лечения от биологических вариаций, поэтому мы предлагаем использовать взаимное маркировку в парных экспериментов 20. В ответном экспериментальной установки, оба варианта эксперимента выполняются в соответствии с предложением на рисунке 1 и следуют этапы протокола, как описано. Тогда, сравнивая отношения интенсивностей ионов из рroteins от обоих взаимных экспериментов, можно выделить, если разница между коэффициентами интенсивности ион обусловлены биологической вариации или как эффект приложенного лечения.
Другой способ решения проблемы разграничения эффектов лечения и биологической изменчивости является использование внутреннего надписью стандарта в качестве основы для всех процедур 31. В этом подходе немеченого контроль и немаркированные элементы, которые подвергаются биологической очистки, смешивают с таким же количеством тяжелых меченых клеток управления, исходя из той же партии. Это позволяет исключить влияние биологических вариаций на соотношении пептида, потому белки считаются существенными, если отношения интенсивностей ионов из 14 N-контроль / 15 N-контроля и 14 N-лечения / 15 N-контроля существенно отличаются. Это возможно, так как меченый стандарт точно такой же во всех случаях.
Один из Дрawbacks из процедуры обогащения DRM, описанной здесь являются белки совместно очистки, которые могут быть идентифицированы в моющем стойкого мембранной фракции. В списке белков, определенных с низкой плотности моющего средства устойчивостью мембранной фракции, можно регулярно наблюдать большое количество рибосомных белков. Из-за относительно низкой плотностью рибосомных белков, они мигрируют в той же фракции, как стеролов зависимых мембранных белков в градиенте сахарозы. Было показано, без всяких сомнений, что рибосомных белков являются явно не составляющие мембраны микродоменов 11. Чтобы исключить эти и другие белки совместно очищающие фактически не связанных с устойчивостью моющих низкой плотности мембранных фракций, мы предлагаем анализировать также протеомный состав внутриклеточных мембран (IM), которые могут быть извлечены из нижней фазы декстрана от двух фазная система и сравнить обилие соотношения предполагаемых загрязнений между внутренней мембране и DRMфракция (см. примеры на рисунке 5). DRM-со-очистки белков должны иметь аналогичные распространенность в обеих фракциях (IM и DRM).
Фракционирование клеточных экстрактов и мембранных микродоменов является общей стратегии для уменьшения сложности в образце для протеомного анализа 32. Таким образом, протокол, описанный здесь является полезным для всех исследованиях сигнальных процессов в плазматической мембране клеток растений. Биологические приложения в изучении ответные реакции на стресс, а также патогенных инфекций, которые все в большей степени вызывают изменения в состава мембраны плазмы и модификации мембранных белков 14,15. Помимо изучения ответные реакции на стресс, количественное определение белка распространенности в различных мембранных фракций может очень помочь аннотацию еще неизвестных белков 33 34,35.
Раскрытие информации
Авторы заявляют, что они не имеют конкурирующие финансовые интересы.
Автор, Витольд Шиманский, является сотрудником Института Макса Планка молекулярной физиологии растений. Автор, Вальтруда Шульце является сотрудником в университете Hohenheim, Германия.
Материалы
| Name | Company | Catalog Number | Comments |
| REAGENTS | |||
| Chemicals were ordered from Sigma-Aldrich unless noted otherwise | |||
| Ammonia (stock 25 % solution) | WAKO | 010-03166 | |
| TiO2 10 μm | GL-Science | 5020-75010 | |
| Empore Disk C18 | Varian | 12145004 | |
| Polyethylene glycol(PEG 3350) | Sigma | 88276 | |
| Dextran T500 | Roth | 9219.2 | |
| Trypsin | Promega | V5113 | |
| Protease inhibitor cocktail (PIC) | Sigma | P9599 | |
| K15NO3 | Cambridge Isotope Laboratories | NLM-765-PK | |
| EQUIPMENT | |||
| Optima L-80 XP Ultracentrifuge | Beckman | ||
| Plate reader | BioTek | ||
| EASY-nLC II nano-Liquid Chromatograph | Thermo Scientific | ||
| LTQ-Orbitrap mass spectrometer | Thermo Scientific | ||
| Centrifuge 5810R | Eppendorf | ||
| Centrifuge 5417R | Eppendorf | ||
| Thermomixer | Eppendorf | ||
| Speed Vac RVC 2-25 | Christ | ||
| Shaker Unimax 2010 | Heidolph | ||
Ссылки
- Alexandersson, E., Saalbach, G., Larsson, C., Kjellbom, P. Arabidopsis plasma membrane proteomics identifies components of transport, signal transduction and membrane trafficking. Plant Cell Physiol. 45, 1543-1556 (2004).
- Brown, D. A., Rose, J. K. Sorting of GPI-anchored proteins to glycolipid-enriched membrane subdomains during transport to the apical cell surface. Cell. 68, 533-544 (1992).
- Lanquar, V., et al. 15N-metabolic labeling for comparative plasma membrane proteomics in Arabidopsis cells. Proteomics. 7, 750-754 (2007).
- Kierszniowska, S., Walther, D., Schulze, W. X. Ratio-dependent significance thresholds in reciprocal 15N-labeling experiments as a robust tool in detection candidate proteins responding to biological treatment. Proteomics. 9, 1916-1924 (2009).
- Singer, S. J., Nicolson, G. L. The fluid mosaic model of the structure of cell membranes. Science. 175, 720-731 (1972).
- Simons, K., Ikonen, E. Functional rafts in cell membranes. Nature. 387, 569-5672 (1997).
- Baumgart, T., et al. Large-scale fluid/fluid phase separation of proteins and lipids in giant plasma membrane vesicles. Proc. Natl. Acad. Sci. USA. 104, 3165-3170 (2007).
- Silvius, J. R. Partitioning of membrane molecules between raft-and non raft-domains: insights from model membrane studies. Biochim. Biophys. Acta. 1746, 193-202 (2005).
- Tanner, W., Malinsky, J., Opekarova, M. In plant and animal cells, detergent-resistant membranes do not define functional membrane rafts. Plant Cell. , (2011).
- Lauwers, E., Andre, B. Association of yeast transporters with detergent-resistant membranes correlates with their cell-surface location. Traffic. 7, 1-15 (2006).
- Kierszniowska, S., Seiwert, B., Schulze, W. X. Definition of Arabidopsis sterol-rich membrane microdomains by differential treatment with methyl-ß-cyclodextrin and quantitative proteomics. Mol. Cell. Proteomics. 8, 612-623 (2009).
- Simons, K., Toomre, D. Lipid rafts and signal transduction. Nat. Rev. Mol. Cell Biol. 1, 31-39 (2000).
- Maeda, Y., Kinoshita, T. Structural remodeling, trafficking and functions of glycosylphosphatidylinositol-anchored proteins. Prog. Lipid Res. 50, (2011).
- Keinath, N. F., et al. PAMP-induced changes in plasma membrane compartmentalization reveal novel components of plant immunity. J. Biol. Chem. 285, 39140-39149 (2010).
- Stanislas, T., et al. Quantitative proteomics reveals a dynamic association of proteins to detergent resistant membranes upon elicitor signaling in tobacco. Mol. Cell. Proteomics. 8, 2186-2198 (2009).
- Minami, A., et al. Alterations in detergent-resistant plasma membrane microdomains in Arabidopsis thaliana during cold acclimation. Plant Cell Physiol. 50, 341-359 (2008).
- Pauly, M., Eberhard, S., Albersheim, P., Darvill, A., York, W. S. Effects of the mur1 mutation on xyloglucans produced by suspension-cultured Arabidopsis thaliana cells. Planta. 214, 67-74 (2001).
- Jouanneau, J. P., Peaud-Lenoel, C. Growth and synthesis of proteins in cell suspensions of a kinetin dependent tobacco. Physiol. Plant. 20, 834-850 (1967).
- Engelsberger, W. R., Erban, A., Kopka, J., Schulze, W. X. Metabolic labeling of plant cell cultures with K15NO3 as a tool for quantitative analysis of proteins and metabolites. Plant Methods. 2, 1-11 (2006).
- Arsova, B., Kierszniowska, S., Schulze, W. X. The use of heavy nitrogen in quantitative proteomics experiments in plants. Trends Plant Sci. 17, 102-112 (2012).
- Rappsilber, J., Ishihama, Y., Mann, M. Stop And Go Extraction tips for matrix-assisted laser desorption/ionization, nanoelectrospray, and LC/MS sample pretreatment in proteomics. Anal. Chem. 75, 663-670 (2003).
- Olsen, J. V., Macek, B. High accuracy mass spectrometry in large-scale analysis of protein phosphorylation. Methods Mol. Biol. 492, 131-142 (2009).
- Schroeder, M. J., Shabanowitz, J., Schwartz, J. C., Hunt, D. F., Coon, J. J. A neutral loss activation method for improved phosphopeptide sequence analysis by quadrupole ion trap mass spectrometry. Anal. Chem. 76, 3590-3598 (2004).
- Frese, C. K., et al. Improved peptide identification by targeted fragmentation using CID, HCD and ETD on an LTQ-Orbitrap Velos. Journal of Protrome Research. 10, 2377-2388 (2011).
- van Breukelen, B., vanden Toorn, H. W., Drugan, M. M., Heck, A. J. StatQuant: a post-quantification analysis toolbox for improving quantitative mass spectrometry. Bioinformatics. 25, 1472-1473 (2009).
- Zauber, H., Schulze, W. X. Proteomics wants cRacker: Automated standardized data analysis of LC/MS derived proteomic data. J. Proteome Res. 11, 5548-5555 (2012).
- Raffaele, S., Mongrand, S., Gamas, P., Niebel, A., Ott, T. Genome-wide annotation of remorins, a plant-specific protein family: Evolutionary and functional perspectives. Plant Physiol. 145, 593-600 (2007).
- Shah, M. B., Sehgal, P. B. Nondetergent isolation of rafts. Methods Mol. Biol. 398, 21-28 (2007).
- Persaud-Sawin, D. -. A., Lightcap, S., Harry, G. J. Isolation of rafts from mouse brain tissue by a detergent-free method. Journal of Lipid Research. 50, 759-767 (2009).
- Macdonald, L. J., Pike, L. J. A simplified method for the preparation of detergent-free lipid rafts. Journal of Lipid Research. 46, 1061-1067 (2005).
- Mühlhaus, T., Weiss, J., Hemme, D., Sommer, F., Schroda, M. Quantitative shotgun proteomics using a uniform 15N-labeled standard to monitor proteome dynamics in time course experiments reveals new insights into the heat stress response of Chlamydomonas reinhardtii. Mol. Cell. Proteomics. 10, M110.004739 (2011).
- Schulze, W., Usadel, B. Quantitation in mass-spectrometry-based proteomics. Annu. Rev. Plant Biol. 61, 491-516 (2010).
- Foster, L. J., de Hoog, C., Mann, M. Unbiased quantiative proteomics of lipid rafts reveales high specificity for signaling factors. Proc. Natl. Acad. Sci. USA. 100, 5813-5818 (2003).
- Lilley, K. S., Dupree, P. Plant organelle proteomics. Curr. Opin. Plant Biol. 10, 594-599 (2007).
- Sadowski, P. G., Groen, A. J., Dupree, P., Lilley, K. S. Sub-cellular localization of membrane proteins. Proteomics. 8, 3991-4011 (2008).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены