Method Article
代谢标记和膜分馏的比较蛋白质组学分析
摘要
在这里,我们描述了植物细胞质膜的基础上,未标记的混合物分馏成耐洗涤剂和清洁剂的可溶性和膜在体内完全15 N标记的拟南芥细胞培养一个强大的方法。该过程被施加于比较蛋白质组学研究,了解信令进程。
摘要
质膜微区是基于所述脂质和甾醇环境中的物理性质的功能,并有在信令进程特定角色。从植物细胞中提取甾醇富集的膜微区用于蛋白质组分析是一项艰巨的任务,主要是由于多个制备步骤和来源自其它细胞区室的污染。质膜构成大约只有5-20%的在植物细胞中的所有膜的,因而高度纯化的质膜组分的分离是具有挑战性的。经常使用的方法涉及水性两相分配中的聚乙二醇和葡聚糖,这将产生质膜囊泡为95%1的纯度。质膜内固醇丰富的膜微区是不溶性后用冷的非离子型洗涤剂在碱性pH下处理。此耐洗涤剂膜组分可以从散装质膜中作为分离通过超速离心ucrose梯度2。其后,蛋白质可以提取从由甲醇/氯仿沉淀的蔗糖梯度密度低频段。提取的蛋白质将被胰蛋白酶消化,脱盐,最后用LC-MS/MS分析。我们的提取协议甾醇富集微区被优化用于从拟南芥细胞培养清洁洗涤剂性膜级分的制备方法。
我们利用拟南芥悬浮细胞培养的全代谢标记为K 15 NO 3作为唯一的氮源为后续生物处理的利息3定量比较蛋白质组学研究。通过将标记和未标记的细胞培养物进行联合蛋白质提取的相等比例对最终定量结果的制备步骤的影响被保持在最低限度。还材料的提取过程中的损失将影响控制和以同样的方式处理的样品,一个ð因此光线和升沉肽的比率将保持不变。在所提出的方法无论是标记的或未标记的细胞培养物经历了一个生物处理,而另一作为控制4。
引言
1972年,乔纳森歌手和加思尼科尔森提出的流体镶嵌模型细胞膜的结构模型,替换被普遍接受的20世纪60年代初的蛋白质 - 脂质 - 蛋白质三明治模型。歌手和尼科尔森推测,生物膜可以被认为是一个两维的液体,所有的脂质和蛋白质分子的自由和方便5扩散。自那时起,该膜组合物的质膜和知识的结构模型变得更加复杂。特别是,在质膜内,结构,例如蛋白质复合物和脂质/固醇基础结构紊乱的微区可以观察到。在仿真模型膜6,7,固醇和鞘脂可以横向与其他脂类物质分离,形成区域与改变的物理特性。细胞膜内偏析这主要是由甾醇及高度SA之间的自相关联的属性phopsho和鞘脂8的turated烃链。特别是,刚性甾醇环青睐与硬,直饱和脂质种类以及这些相互作用迫使邻近的烃链为更长时间的构象,增加膜的厚度和硬度的相互作用。
之一的甾醇富集的膜微区中通常观察到的特征是其不溶性,在治疗与非离子洗涤剂如曲通X-100或的Brij 35。这些组分被认为是相同的膜微区,并根据其生化制备方法2,被称为耐洗涤剂膜(DRM)。非离子型洗涤剂的DRM提取过程中使用接收到的一些批评作为生化DRM制剂可以不直接对应于活细胞9中的任何特定的膜隔室。特别是,所述洗涤剂蛋白质比率似乎在这类制剂是至关重要的,一s个不同的清洁剂,以及不同量的洗涤剂可以产生不同的耐洗涤剂的膜部分10的组合物。然而,有证据表明,特定蛋白的物种特异性与这些细胞的甾醇富集膜域相关联,并且这些蛋白质以及富含洗涤剂耐膜部分11的生化制剂。被发现在植物的DRM级分,并针对其存在的DRM中是固醇依赖性蛋白质的核心,是特别GPI锚定的蛋白质,如fasciclin状阿拉伯半乳聚糖蛋白(FLAS)和SKU蛋白家族的成员。也有一些信号蛋白,如受体样激酶或磷脂酶被发现11。这些结果与对哺乳动物的膜微区12,13许多蛋白质组研究是一致的。此外,在植物有越来越多的证据表明膜微的应激反应14方面的作用-16。
这里所描述的协议提供了一个可靠的方法对质膜微区分离,特别是使用蛋白质洗涤剂浓度,使我们能够描绘固醇丰富的膜隔4,11,14应激诱导的改变。
研究方案
程序
在提取协议中常用的试剂和缓冲液:
- 喷气推进实验室的培养基拟南芥悬浮细胞培养
- 3μM的H 3 BO 3
- 3微米硫酸锰4×H 2 O的
- 1.1微米的ZnSO 4×7 H 2 O
- 0.15微米KJ
- 0.03微米的Na 2的MoO 4×2 H 2 O的
- 3纳米氯化钴2×6 H 2 O
- 3纳米硫酸铜4×5 H 2 O
- 0.9毫米氯化钙2×2 H 2 O的
- 0.5毫米硫酸镁4×7 H 2 O
- 0.5微米的FeSO 4×7 H 2 O
- 0.5微米的Na 2 EDTA×2 H 2 O的
- 0.12微米盐酸硫胺素
- 0.16微米烟酸
- 0.097微米盐酸吡哆醇
- 0.107μMNAA
- 0.375 mM的KH 2 PO 4
- 0.061毫米的NaH2 PO 4×2 H 2 O的
- 0.039毫米的Na 2 HPO 4
- 0.027 mM的甘氨酸
- 0.56毫肌醇
- 1.5%的蔗糖
- 10毫米的K 14 NO 3或10毫米的K 15 NO 3
注:pH值在JPL介质应调整到5.7,用KOH。该介质必须通过过滤或在使用前高压灭菌进行灭菌。
- 缓冲液H
- 100mM的HEPES-KOH(pH 7.5)中
- 250mM的蔗糖
- 10%(重量/体积)甘油
- 5毫米EDTA
- 5mM的抗坏血酸
- 0.6%(重量/体积),PVP K-25或K-30
- 5 mM的DTT(补充新鲜)
- 1 mM的PMSF(补充新鲜)
- 蛋白酶和磷酸酶抑制剂(补充新鲜)
- 50毫米氟化钠
- 1毫米的Na 3 VO 4
- 1毫米苄脒
- 0.3微米mikrocystin
- 4微米亮肽素
- 蛋白酶抑制剂混合物
- 缓冲液R
- 5mM磷酸钾
- 0.33M的蔗糖
- 3毫米氯化钾
- 0.1毫米EDTA
- 1 mM的DTT(补充新鲜)
- TNE缓冲液
- 的25mM的Tris-HCl,pH值7.5
- 150 mM氯化钠
- 5毫米EDTA
- 两相系统(6克 - 系统适用于高达15克样品鲜重)的制备方法
在下面列出和15毫升猎鹰管组合成分调匀:- 20%(W / W)的葡聚糖T500 - 2.6克
- 40%(W / W),聚乙二醇(PEG 3350) - 1.3克
- 蔗糖 - 0.678克
- 的0.2M磷酸钾,pH 7.8 - 0.15毫升
- 2米氯化钾 - 0.014毫升
- 加水,直到两相体系的总质量为6克
- 蔗糖溶液在TNE缓冲液
- 2.4 M,1.6 M,1.4 M,0.15M的
- 试剂胰蛋白酶消化
- UTU:6M尿素,2M硫脲(pH值为8.0的10mM的Tris-HCl)
- 还原缓冲液(1微克/微升DTT水; 6.5毫米)
- 烷基化反应缓冲液(5微克/微升碘乙酰胺在水中,27毫摩尔)
- LYSC内肽酶(0.5微克/微升)
- 胰蛋白酶,修改测序级(0.4微克/微升)
- 试剂肽脱盐超过C 18的
- 悬浮液:2%三氟乙酸(TFA),在水中的5%乙腈
- 溶液A:0.5%醋酸
- 溶液B:80%乙腈,0.5%乙酸
- 试剂磷酸化肽富集
- 溶液A:0.1%TFA,5%乙腈
- 溶液B:含0.1%TFA,80%乙腈
- TiO 2的10微米
- 氨(股票25%溶液)
- 哌啶(股100%)
PROTOCOLS
1。 拟南芥悬浮培养细胞代谢标记
- 种植拟南芥 Col-0中的细胞在整整14 N-JPL媒体来自17叶悬浮培养(18;请参阅“常用试剂和缓冲液”部分)的恒定光照条件下,在80〜100微摩尔/平方米的无菌瓶中15 N-喷气推进实验室中,一组文化2秒,23℃,在不断摇动在120rpm。
- 维持细胞培养物,接种400毫升新鲜JPL培养基用40ml七日龄的细胞培养物在1升烧瓶中。
- 通过真空抽吸,通过用不锈钢丝网广泛的玻璃漏斗细胞培养收获发生。细胞积聚在网状板和在漏斗和可以容易地从那里收集。细胞被推荐在-80℃或在液氮中研磨之前将冻结。
注:对于15 N代谢标记细胞培养用K 15 NO 3为氮的唯一来源,至少有两个通道,两个多星期19。在忠武riments的比较蛋白质组学,用15 N标记的细胞培养,同时在普通培养基上保持未标记的文化。生物处理将被应用到任何标记的或未标记的培养,而其他用作对照( 图1)。对于蛋白质制剂,两种文化将被合并20。在规划的实验装置,我们建议考虑相互的标签设置4中相同的处理,一旦应用到15 N-标记的细胞,一旦到了未标记细胞和未标记的分别或15 N标记的细胞作为对照组。在这种情况下,需要细胞培养物的双值。
2。质膜的纯化
注:所有其他步骤都进行了冷室和/或冰面上,除非它被注明。
- 从大约1升的液态氮7天前细胞悬浮培养细胞均质化。该材料可以储存在-80℃直至进一步使用。
- 基于鲜重混合标记的和未标记的冷冻的细胞培养物的相同量的烧杯中,并立即添加2体积的缓冲液H的。若膜微区的准备,建议至少使用7克两个标记和未标记细胞的鲜重。
- 将烧杯在振荡器上振摇直到材料被熔化,并将溶液是液体和没有冰晶。
- 通过一层的Miracloth的过滤匀浆入50ml离心管中。
- 平衡的样品用缓冲液H和以10,000 xg离心8分钟。
- 加载上清液进入预冷超离心管( 如转子Beckman Coulter公司SW31Ti),与约32毫升的量
- 用缓冲液H平衡的样品和通过以100,000×g离心离心在4℃下用贝克曼SW32Ti转子30分钟沉淀的微粒。
- 离心后去除上清。
注:上清液含有可溶性蛋白质。少量的这部分可被保存以供进一步的蛋白质沉淀也可溶性蛋白和随后的分析。
- 重新悬浮在缓冲液中的R各自量每个样品的膜沉淀并加载到U1的两相体系的顶部( 图2)。如果6克两相系统时,加载刚好是2克重悬膜沉淀。
注意:缓冲器的R的终体积取决于将要使用的(〜1.6缓冲液的R毫升使用6克系统时,需要的话)的两相系统的大小。它建议使用以下的缓冲液重悬如此纯净缓冲器可以被添加到两相体系中,以获得所要求的重量,而不是使用太多的缓冲液溶解,并不能在整个样品加载到两相体系。
- 加载纯缓冲r作为用于日相同体积Ë样品再悬浮到U2。
- 慢慢地倒置他们30倍(约1反转/秒)混合U1和U2管。
注意:不要大力摇晃两相体系。它可以引起缺乏的阶段,在超速离心步骤分离。
- 离心样品在1500×g离心4℃10分钟。
- 离心后去除上清。
- 从U1的转移上相到U2和在1500×g离心重复离心在4℃下10分钟。
- 将上阶段从U2到SW41Ti超速离心管和五卷缓冲的R稀释调匀。
注:最终上相可能不得不被分成独立的超速离心管之前,它可稀释5倍。
- 离心样品以200,000×g离心在4℃下用SW41Ti转子一小时。
- 重悬膜沉淀在SMaL公司的TNE缓冲液升量(通常为200μL缓冲液使用)耐洗涤剂膜隔离。
注:少量这一部分可以被保存为普通肝素质膜的分析。
注:该质膜组分可贮存于4℃过夜分馏成耐洗涤剂膜和洗涤剂可溶部分之前。
3。耐洗涤剂膜的制备
- 检查通过Bradford测定细胞膜级分的浓度。
- 加的Triton X-100至质膜组分。洗涤剂的最终浓度应保持之间0.5-1%。洗衣粉蛋白质重量的重量比应保持13-15之间。
- 摇样品在约100rpm转速,在4℃下进行30分钟。
- 添加三卷2.4米蔗糖的处理质膜的一个量,获得1.8米决赛中蔗糖的浓度。
- 通过加载为图3中所示的1.8M的级分的顶部的各自的蔗糖溶液制备在SW41Ti超速离心管的蔗糖梯度。
- 离心样品以250,000×g离心在4℃下18小时使用贝克曼SW41Ti转子。
- 小心地从转子拆下超速离心管,以避免这可能是因为在0.15 M/1.4 1M蔗糖界面乳状环可见低密度带的妨害。有时什么也看不到,但部分仍包含耐洗涤剂的蛋白质部分。
- 除去为0.75毫升的量从渐变的顶部馏分。馏分2和3,其覆盖大约150毫升相间环和下面0.5毫升以上体积表示的耐洗涤剂的膜部分。收集这些部分分为15毫升猎鹰管。级分9和10中包含的洗涤剂溶解的膜级分,并且还可以收集用于比较。作进一步的分析,池FRACT离子2和3以及馏分9和10。
4。提取蛋白,从耐洗涤剂组分由甲醇/氯仿
注:所有步骤均在室温下进行。
- 加入4倍体积的甲醇收集到的分数和涡彻底。
- 加入1体积的氯仿,涡旋彻底。
- 加入3体积的水,旋涡彻底。
- 离心样品在2000×g下使用台式离心机( 如的Eppendorf 5417R)5分钟。
- 除去蛋白层中的相间上面的水相。
- 加入3倍体积的甲醇,涡旋彻底。
- 离心样品在4000×g离心10分钟。
- 除去上清液,并干燥沉淀。将干燥的沉淀物是准备在溶液消化。
5。在溶液中的胰蛋白酶消化
注意:在此过程中的所有步骤都完成时室温下用变性剂,以减少氨基酸侧链的不必要的衍生化。
- 在体积6M尿素,2M thiurea,pH值8(UTU)小溶解样品。如与样品(通常大约40微升)兼容使用尽可能低的音量。
- 10分钟,以沉淀任何不溶性物质溶解在UTU在5000×g离心在台式离心机( 如 Eppendorf公司5417R)自旋样品。
- 最终溶液的pH值应接近8.0的最佳胰酶消化。请与pH值条。
- 加入1μl的还原缓冲液每50微克样品蛋白质孵育30分钟,在室温下进行。
注:蛋白质含量只有一个粗略的估计是必要的。当样品量是有限的,最好是牺牲精度,而不是在蛋白质测定浪费样品。
- 加入1μl的烷基化反应缓冲液,每50微克样品蛋白质孵育20分钟,在室温下在黑暗中。
- 加入0.5微升的lysC的每50微克样品蛋白质和在室温下3小时孵育恒定振摇在700rpm。如果有必要,摘要也可过夜进行。但是,不建议在温暖的温度延长时间,因为它可以增加肽损失,由于水pH值为8的条件下吸附到塑料管材料。
- 稀释样品用4倍体积的10mM Tris-盐酸,pH为8。
注意:此步骤是绝对必要的,以稀释的尿素浓度为胰蛋白酶,是高盐非常敏感。
- 加入1μl每50微克样品蛋白质的胰蛋白酶孵育过夜,在室温下用恒定振摇在700rpm。
- 酸化样品,以0.2%TFA的终浓度,以达到pH为2(添加约1/10体积的2%三氟乙酸)。
注:样品可以储存在 - 20°C,直到进一步的使用,但它是更好地存储他们StageTips在4℃,如果它是很短的时间(一周),或将其StageTips脱盐后存储。
6。的C 18 - StageTips制造
- 在平坦,干净的表面上放置一个Empore磁盘C18如一次性塑料培养皿中。
- 用钝头皮下注射针头直径为1.5mm的切出一个小圆盘。磁盘坚持在针和可转移到枪头。
- 推盘出针和由一片熔凝硅石或管道中的针的内配合的固定在移液管尖的锥形。
注:StageTips可在室温下21贮存干燥。
7。使用C 18-StageTips肽脱盐和浓缩
- 通过将50微升溶液B到准备StageTip条件为C 18-StageTip。旋转的离心分离机的前端在2,000 rpm持续2分钟在台式Çentrifuge( 如 Eppendorf公司5417R)。
注意:使用的适配器旋转StageTips在Eppendorf离心机,液体将被收集在2 ml反应管中。对于较大规模的制剂,舞台技巧也可以放置成一个尖端机架的200μl的提示96和液体可收集在微量滴定板。
注意:切勿使 用更高的速度超过3000 XG在台式离心机( 如 Eppendorf公司5417R)由于从尖端纺出了C 18盘的风险。
- 用100微升溶液A旋转尖端的离心机在5000 XG在台式离心机( 如 Eppendorf公司5417R)平衡的StageTip。
- 重复步骤2。
- 由样品仔细吹打成枪头与椎间盘内将样品到磁盘上。
注:一个光盘可以结合约。 100微克蛋白质。
- 旋在CE的提示ntrifuge直到样品的总容积通过了C 18盘。
- 用100微升溶液A的附带的秘诀在离心洗StageTips两次。
注意:洗涤并加载StageTips可以储存在4℃下进行长达一周。
- 洗脱的样品用40微升溶液B的收集在一个新的1.5毫升的反应管中的洗脱液。
- 浓缩样品中的快速真空。在理想条件下,停止脱水过程,因为这里仅有大约1或2个微升的液体。
注:干样品可以储存在-80℃多年。
- 加的9微升悬浮液对样品的最终体积,并将其转移到微量滴定板进行质谱分析。
注意:所使用的重悬浮缓冲液的最终体积是依赖于实验者和质谱仪的灵敏度的需要使用。
8。用于磷酸化肽富集的替代协议
注:对于磷酸化肽富集,蛋白质提取步骤2中,必须在磷酸酶抑制剂的存在下进行。
注意:实际蛋白质浓度不需要被用于下面的步骤确定。它足以具有的蛋白质含量的粗略估计,以避免不必要的样品损失
- 编写的C 8-StageTips(后续步骤6相同的协议,用于制备C 18 - StageTips)。
- 转移1毫克的TiO 2-珠准备C 8 - StageTips的顶部(使用1毫克的TiO 2,每100微克蛋白质)。
- 平衡在TiO 2的提示用100微升溶液C,自旋在2000×g离心5分钟,在台式离心机( 如 Eppendorf公司5417R)。
- 混合100从步骤7.7消化和脱盐肽微克(应该是在100微升的解决方案B)用100μl溶液A的
- 加载混合样品到平衡的TiO 2列;旋在1000×g离心5分钟。
- 收集流过,再重新放入到同一个提示(通过第二遍后,保持流量)。
- 用100微升溶液A洗尖;旋在2000×g离心5分钟在台式离心机( 如 Eppendorf公司5417R)。
- 洗脱样品与50微升5%的氨水中。
- 洗脱的样品用50μl5%哌啶的(洗脱液都可以组合)。
- 立即用50微升20%磷酸酸化的样品。 pH应在约2。
注:除在TiO 2的提示和检索粉末。可以用溶液B,并再次用于一个或两个以上的回合。
- 再次脱盐酸化过的样品C 18的提示(见第8步)。
9。肽混合物的LC-MS/MS分析
- 悬浮脱盐phosphopeptides在悬浮缓冲液。
- 负载重悬样品到所选择的LC-MS/MS系统并获取光谱数据依赖模式在60000全宽的半峰建议的解决方案。
注:为了获得最佳的碎片,无论是中性丢失扫描,应适用22,如果可用多级激活23。如果扣除非经常性可用它将使肽骨架碎片而不磷酸24的损失。
注意:需要从原始数据峰值列表要被提取,并提交给数据库的识别以及定量。在这里,我们描述了使用吉祥物和MSQuant,它适用于从LTQ,LTQ-的Orbitrap和LTQ-FT工具(Thermo Scientific的)原始数据文件的设置。
- 使用DTAsupercharge在MSQuant的“助手”菜单中提取峰列表。使用默认设置。
- 提交产生的峰值列表文件,以吉祥物的搜索引擎。铬itical设置:母离子的质量误差为10ppm,MS / MS质量公差0.5大。固定修饰:carbamidomethylation半胱氨酸,可变修饰:甲硫氨酸的氧化,磷酸化的丝氨酸,苏氨酸,酪氨酸。定量方法:15 N代谢标记。
- 除吉祥物结果作为网页文件。
- 加载吉祥物结果文件和原始文件到MSQuant。选择感兴趣的所有蛋白质并运行“自动定量”。该程序将读取全扫描谱图从原始文件,并执行峰积分为每个肽的标记和未标记的合作伙伴。
- 导出定量结果以电子表格程序或制表符分隔的文本文件。这些数据可以被提交到Excel或再使用软件如Statquant 25或饼干26进一步的统计分析。
结果
使用代谢标记的拟南芥细胞培养物中所提出的协议,可以从植物组织中(步骤2, 图2和图4)分离血浆膜,血浆膜中富集耐洗涤剂的膜部分(步骤3, 图3和图5)。其后,该协议允许提取从这些耐洗涤剂的膜部分(步骤4)和消化的蛋白质进行比较蛋白质组学分析(步骤5)的蛋白质。最后,磷酸(第8步)的可选的富集是研究细胞信号传导过程特别有趣。最后一步则是在由标记和未标记的细胞培养膜组分的蛋白质丰度比的定量数据分析(步骤9, 图6)。
的2相体系中(步骤2)和随后的离心混合后的典型结果是明确的有色上部相和绿颜色的下层相( 图2)。质膜囊泡优选地与上部PEG相关联,而从绿叶绿体等内饰膜的膜性囊泡被结合到下部葡聚糖相。如果分色不能观察到,在步骤2中,不进行正确和质膜将与显著金额内部膜的污染。质膜蛋白的富集可通过细胞膜组分和蛋白质中的两相系统中的较低阶段的小等份蛋白组学分析中显示。下层相含有细胞的内膜。例如,特别是典型的已知的质膜蛋白,如受体激酶蛋白表现出较高的丰度在质膜组分(PM)和低丰度在包含内部膜(IM)的下层相部分( 图4A)。反过来,已知的内质网秀高蛋白质丰度在内侧的膜部分和在质膜级分( 图4B)中未观察到。
耐洗涤剂的膜部分(步骤3)在随后的富集将在理想的情况下,导致形成的低密度膜囊在大约1/5 个管的高度( 图3),一个乳白色环。如曲通X-100的浓度,或洗涤剂的蛋白质比(步骤3.2)调整为最适合于分离成耐洗涤剂和洗涤剂可溶部分,另外的环可以在渐变的下部分被观察和也将有膜的团块在低密度带。在这些情况下,洗涤剂蛋白比率或总洗涤剂含量为必需的两个膜结构域组分的重现性分离的临界胶束浓度不同。使用最终的洗涤剂浓度和洗涤剂蛋白质比这里描述,恩诺沙星典型微区的蛋白质,如remorin的ichment(AT3G61260)27可以由DRM分数的比较质谱分析,洗涤剂可溶部分(步骤3.8),以及未分级的质膜和内部膜证实。丰度最高remorin蛋白被发现在DRM部分预期效果( 图6A)。中不存在的膜微区,如ABC转运AT1G59870( 图6B)的蛋白质,不显示出增加的丰度在DRM分数。还典型污染物,如从ATP酶F0复杂( 图6C)和核糖体蛋白(At1G001100)从60S核糖体( 图6D),线粒体蛋白(AT2G07707)不显示富集丰度在DRM分数,尽管极少量的可仍然被识别。
后在血浆中的蛋白磷酸化状态的质谱分析,蛋白质的丰度比标记和未标记的细胞培养物的膜组分可以定量区别( 图6)。从MSQuant(典型结果msquant.alwaysdata.net )定量窗口应该显示的一个的离子强度比,以一对大多数鉴定的肽( 图6A)的。这些肽离子强度比从1:1显著偏离被认为是标记和未标记细胞培养之间的差异调节,并且是候选人匹配受应用( 图6C)治疗蛋白质。成功的代谢标记的良好的质量控制是共洗脱标记的和未标记的肽的版本,在纳米HPLC分离(步骤9)的单峰, 如图6B和D。

图1。的实验设计采用的是完全的代谢标记和未标记的拟南芥细胞培养时,两种变体代谢标记实验策略。示意图。实验者可以决定使用14 N细胞(未标记),其为控制和15 N细胞(代谢标记),该经过生物 处理,或反之亦然。在一个倒数的实验设计都变体在平行进行。

图2。工作流用于植物的膜性囊泡的基于聚乙二醇(PEG)和葡聚糖的水性两相体系的分离。质膜囊泡分离成上层PEG相而叶绿体等内饰膜与博特相关离心后OM右旋糖酐阶段。与上面相的额外洗涤更好纯化就可以实现,而且材料损耗增加。
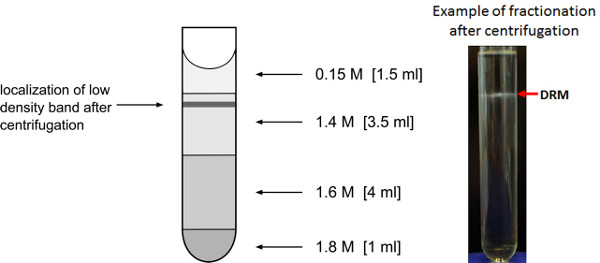
图3。低密度膜组分的富集。为代表的低密度洗涤剂耐膜组分的富集蔗糖梯度。低密度膜囊泡频带的过夜离心后的预期位置被指示。

图4。纯化在两相系统后富集质膜蛋白质的归一化蛋白质的离子强度在质膜(PM)和内部膜(IM)的级分测定的蛋白质:(A)质膜的典型的已知成分显示高得多的丰度在下午分数比IM分数。内部的膜(B)的天然已知部件示出了相反的行为。对于归一化,离子强度总和为每个蛋白的表达为每个样品总离子强度的一小部分,然后重复的平均值。总离子强度的分数,然后表示为相对于这两种治疗之间的平均值。误差线代表从独立生长的细胞培养三种制剂的标准偏差。 点击这里查看大图 。
图5。 。的测定级分中的标准蛋白标记物丰度图解表示的选择的蛋白标志物,以特定的亚细胞区室(DRM -甾醇富集微区,下午-质膜,IM -内部膜,SP -可溶性蛋白)归一化的蛋白质的离子强度的分布。 (A)的 remorin作为标记甾醇富集的膜微区,(B)ABC型转运蛋白家族蛋白作为未固醇依赖性蛋白质的代表,(C)的线粒体F0复合体亚基,(D)的 60S丰度模式核糖体的亚单位作为一个典型的共纯化的污染物。对于归一化,离子强度总和为每个蛋白的表达为每个样品总离子强度的一小部分,然后重复的平均值。总离子强度的分数,然后表示为相对于两个珍稀之间的平均tments。误差线代表从独立生长的细胞培养三种制剂的标准偏差。 点击这里查看大图 。
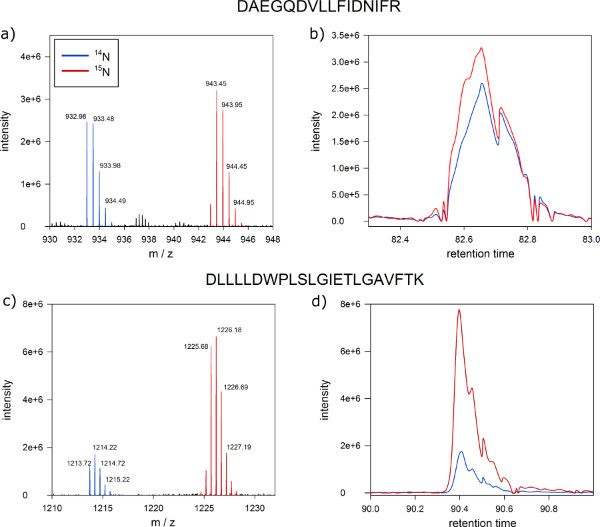
图6。从 MSQuant 定量蛋白质质谱。屏幕快照显示来自蛋白质提取物肽DNNLLGK的标记和未标记的拟南芥细胞(A)全扫描谱明确的1:1混合物中的肽为1:1的离子强度比预期的结果分离标记(右峰)和未标记(左峰)版的M / Z轴的肽。的单一同位素质量和第一同位素是由蓝色标记表示(B)的标记(蓝色)的ð未标记(红色)版本的肽共洗脱的过程中纳米HPLC色谱单峰的(C)用1:5作为一个差异调节蛋白的候选离子强度比的肽的全扫描谱(D )也与蛋白质的比例从1:1共流出反相色谱不同。 点击这里查看大图 。
讨论
在本文提出的协议包含了许多步骤,所有的人都非常重要,以获得植物质膜到洗涤剂耐膜和清洁剂的可溶性组分的纯净和有代表性的分馏。因此,作为指示要按照每个步骤是很重要的。
质膜组分与非离子型去污剂(步骤3.2)的治疗有对的膜微区分馏质量最强的影响。以获得可再现的结果不同制剂之间,并以能够从相同的实验比较不同样品,精确地评估蛋白质在细胞膜的浓度,并总是适用的洗涤剂中以相同比例相对于蛋白质含量是非常重要的并且总是以相同的终浓度。实际上,这意味着,有时有必要稀释具有高蛋白质浓度的样品或用不同浓度的股票中的Triton X-100。
在生化研究,最近有研究人员倾向于使用无洗涤剂法膜微28-30的隔离。这些方法是通过一个很小的针类似于法国压力细胞压机剪切根据质膜的机械破坏。这些程序被成功地应用到哺乳动物细胞培养丰富的膜微区,但是应用到含有生物(酵母,植物细胞)细胞壁尚未见报道。使用定量蛋白质组学连同固醇破坏剂,如甲基-β-环糊精,它表明,从植物质膜制备的DRM馏分也含有蛋白质,是标记的膜微区11。
关于质谱定量的最终结果, 图6中所示的典型的结果表示在理想的情况其中,离子强度为广大标记的和未标记的肽是接近一致的。然而,在某些情况下,一定程度的标记的和未标记的细胞培养物的集之间的生物学变异可以观察到。因此,生物处理前的任一标记或未标记的细胞进行培养时,标记的和未标记的对照细胞的混合物的分析,无论是不经任何处理,可以识别肽发散从理想差一分一点的情况下一个比率。这些蛋白质与不同比率的适应症变异生物。为了克服从生物变异显着治疗效果的挑战,因此,我们建议使用倒数标记在配对实验20。在倒数的实验装置,该实验的两个变体中执行所建议的图1和遵循的协议的步骤,如上所述。然后,在比较p的离子强度的比值从双方的倒数的实验roteins,人们可以区分如果离子强度比之间的差异是由于生物变异或作为施加治疗的效果。
为解决该问题的治疗效果和生物变异之间的区别的另一种方法是利用一个内部标记的标准,作为各处理31的参考。在该方法中,未标记的对照和未标记的细胞,进行生物处理与重标记的对照细胞中的相同量的混合,从相同批次到来。它允许取消对肽比生物变化的影响,因为蛋白质被认为是显著,如果14的N-控制/ 15 N-控制和14 N-治疗/ 15 N-控制离子强度比有显著差异。这是可能的,作为标记的标准是完全相同的所有情况。
其中博士这里所描述的DRM富集过程的awbacks是可以在洗涤剂耐膜部分被识别的共纯化的蛋白。在从低密度洗涤剂耐膜组分鉴定的蛋白的列表中,我们可以定期观察大量的核糖体的蛋白质。由于核糖体蛋白的相对低的密度,它们在相同的级分中的蔗糖梯度固醇依赖性膜蛋白迁移。结果表明没有这种核糖体蛋白显然不是膜微11成分股任何疑问。排除这些和其他共纯化的蛋白不实际的耐洗涤剂的低密度膜部分相关联,我们建议也分析了细胞内膜(IM),它可以从较低的葡聚糖相提取从2 - 的蛋白质组合物相系统,并比较所述内膜和DRM之间推定的污染物的存在比例馏分(参见图5中的例子)。 DRM-CO净化的蛋白质应该有类似的丰度在这两个分数(IM和DRM)。
细胞提取物和膜微分馏是一种常见的策略,以降低复杂样品中的蛋白组学分析32。因此,这里所描述的协议是用于在植物细胞的质膜信令进程的所有的研究是有用的。生物的应用是在学习应激反应以及病原体感染,所有在很大程度上改变诱发的血浆膜组成和膜蛋白14,15的变形例。除了 学习应激反应,蛋白质丰度在不同的膜组分的定量分析可以极大地帮助未知的蛋白质33 34,35的注释。
披露声明
作者宣称,他们有没有竞争的财务权益。
笔者维托尔德Szymanski的,是分子植物生理学的马克斯普朗克研究所的雇员。笔者瓦尔特劳德舒尔茨是雇员在霍恩海姆德国大学。
材料
| Name | Company | Catalog Number | Comments |
| REAGENTS | |||
| Chemicals were ordered from Sigma-Aldrich unless noted otherwise | |||
| Ammonia (stock 25 % solution) | WAKO | 010-03166 | |
| TiO2 10 μm | GL-Science | 5020-75010 | |
| Empore Disk C18 | Varian | 12145004 | |
| Polyethylene glycol(PEG 3350) | Sigma | 88276 | |
| Dextran T500 | Roth | 9219.2 | |
| Trypsin | Promega | V5113 | |
| Protease inhibitor cocktail (PIC) | Sigma | P9599 | |
| K15NO3 | Cambridge Isotope Laboratories | NLM-765-PK | |
| EQUIPMENT | |||
| Optima L-80 XP Ultracentrifuge | Beckman | ||
| Plate reader | BioTek | ||
| EASY-nLC II nano-Liquid Chromatograph | Thermo Scientific | ||
| LTQ-Orbitrap mass spectrometer | Thermo Scientific | ||
| Centrifuge 5810R | Eppendorf | ||
| Centrifuge 5417R | Eppendorf | ||
| Thermomixer | Eppendorf | ||
| Speed Vac RVC 2-25 | Christ | ||
| Shaker Unimax 2010 | Heidolph | ||
参考文献
- Alexandersson, E., Saalbach, G., Larsson, C., Kjellbom, P. Arabidopsis plasma membrane proteomics identifies components of transport, signal transduction and membrane trafficking. Plant Cell Physiol. 45, 1543-1556 (2004).
- Brown, D. A., Rose, J. K. Sorting of GPI-anchored proteins to glycolipid-enriched membrane subdomains during transport to the apical cell surface. Cell. 68, 533-544 (1992).
- Lanquar, V., et al. 15N-metabolic labeling for comparative plasma membrane proteomics in Arabidopsis cells. Proteomics. 7, 750-754 (2007).
- Kierszniowska, S., Walther, D., Schulze, W. X. Ratio-dependent significance thresholds in reciprocal 15N-labeling experiments as a robust tool in detection candidate proteins responding to biological treatment. Proteomics. 9, 1916-1924 (2009).
- Singer, S. J., Nicolson, G. L. The fluid mosaic model of the structure of cell membranes. Science. 175, 720-731 (1972).
- Simons, K., Ikonen, E. Functional rafts in cell membranes. Nature. 387, 569-5672 (1997).
- Baumgart, T., et al. Large-scale fluid/fluid phase separation of proteins and lipids in giant plasma membrane vesicles. Proc. Natl. Acad. Sci. USA. 104, 3165-3170 (2007).
- Silvius, J. R. Partitioning of membrane molecules between raft-and non raft-domains: insights from model membrane studies. Biochim. Biophys. Acta. 1746, 193-202 (2005).
- Tanner, W., Malinsky, J., Opekarova, M. In plant and animal cells, detergent-resistant membranes do not define functional membrane rafts. Plant Cell. , (2011).
- Lauwers, E., Andre, B. Association of yeast transporters with detergent-resistant membranes correlates with their cell-surface location. Traffic. 7, 1-15 (2006).
- Kierszniowska, S., Seiwert, B., Schulze, W. X. Definition of Arabidopsis sterol-rich membrane microdomains by differential treatment with methyl-ß-cyclodextrin and quantitative proteomics. Mol. Cell. Proteomics. 8, 612-623 (2009).
- Simons, K., Toomre, D. Lipid rafts and signal transduction. Nat. Rev. Mol. Cell Biol. 1, 31-39 (2000).
- Maeda, Y., Kinoshita, T. Structural remodeling, trafficking and functions of glycosylphosphatidylinositol-anchored proteins. Prog. Lipid Res. 50, (2011).
- Keinath, N. F., et al. PAMP-induced changes in plasma membrane compartmentalization reveal novel components of plant immunity. J. Biol. Chem. 285, 39140-39149 (2010).
- Stanislas, T., et al. Quantitative proteomics reveals a dynamic association of proteins to detergent resistant membranes upon elicitor signaling in tobacco. Mol. Cell. Proteomics. 8, 2186-2198 (2009).
- Minami, A., et al. Alterations in detergent-resistant plasma membrane microdomains in Arabidopsis thaliana during cold acclimation. Plant Cell Physiol. 50, 341-359 (2008).
- Pauly, M., Eberhard, S., Albersheim, P., Darvill, A., York, W. S. Effects of the mur1 mutation on xyloglucans produced by suspension-cultured Arabidopsis thaliana cells. Planta. 214, 67-74 (2001).
- Jouanneau, J. P., Peaud-Lenoel, C. Growth and synthesis of proteins in cell suspensions of a kinetin dependent tobacco. Physiol. Plant. 20, 834-850 (1967).
- Engelsberger, W. R., Erban, A., Kopka, J., Schulze, W. X. Metabolic labeling of plant cell cultures with K15NO3 as a tool for quantitative analysis of proteins and metabolites. Plant Methods. 2, 1-11 (2006).
- Arsova, B., Kierszniowska, S., Schulze, W. X. The use of heavy nitrogen in quantitative proteomics experiments in plants. Trends Plant Sci. 17, 102-112 (2012).
- Rappsilber, J., Ishihama, Y., Mann, M. Stop And Go Extraction tips for matrix-assisted laser desorption/ionization, nanoelectrospray, and LC/MS sample pretreatment in proteomics. Anal. Chem. 75, 663-670 (2003).
- Olsen, J. V., Macek, B. High accuracy mass spectrometry in large-scale analysis of protein phosphorylation. Methods Mol. Biol. 492, 131-142 (2009).
- Schroeder, M. J., Shabanowitz, J., Schwartz, J. C., Hunt, D. F., Coon, J. J. A neutral loss activation method for improved phosphopeptide sequence analysis by quadrupole ion trap mass spectrometry. Anal. Chem. 76, 3590-3598 (2004).
- Frese, C. K., et al. Improved peptide identification by targeted fragmentation using CID, HCD and ETD on an LTQ-Orbitrap Velos. Journal of Protrome Research. 10, 2377-2388 (2011).
- van Breukelen, B., vanden Toorn, H. W., Drugan, M. M., Heck, A. J. StatQuant: a post-quantification analysis toolbox for improving quantitative mass spectrometry. Bioinformatics. 25, 1472-1473 (2009).
- Zauber, H., Schulze, W. X. Proteomics wants cRacker: Automated standardized data analysis of LC/MS derived proteomic data. J. Proteome Res. 11, 5548-5555 (2012).
- Raffaele, S., Mongrand, S., Gamas, P., Niebel, A., Ott, T. Genome-wide annotation of remorins, a plant-specific protein family: Evolutionary and functional perspectives. Plant Physiol. 145, 593-600 (2007).
- Shah, M. B., Sehgal, P. B. Nondetergent isolation of rafts. Methods Mol. Biol. 398, 21-28 (2007).
- Persaud-Sawin, D. -. A., Lightcap, S., Harry, G. J. Isolation of rafts from mouse brain tissue by a detergent-free method. Journal of Lipid Research. 50, 759-767 (2009).
- Macdonald, L. J., Pike, L. J. A simplified method for the preparation of detergent-free lipid rafts. Journal of Lipid Research. 46, 1061-1067 (2005).
- Mühlhaus, T., Weiss, J., Hemme, D., Sommer, F., Schroda, M. Quantitative shotgun proteomics using a uniform 15N-labeled standard to monitor proteome dynamics in time course experiments reveals new insights into the heat stress response of Chlamydomonas reinhardtii. Mol. Cell. Proteomics. 10, M110.004739 (2011).
- Schulze, W., Usadel, B. Quantitation in mass-spectrometry-based proteomics. Annu. Rev. Plant Biol. 61, 491-516 (2010).
- Foster, L. J., de Hoog, C., Mann, M. Unbiased quantiative proteomics of lipid rafts reveales high specificity for signaling factors. Proc. Natl. Acad. Sci. USA. 100, 5813-5818 (2003).
- Lilley, K. S., Dupree, P. Plant organelle proteomics. Curr. Opin. Plant Biol. 10, 594-599 (2007).
- Sadowski, P. G., Groen, A. J., Dupree, P., Lilley, K. S. Sub-cellular localization of membrane proteins. Proteomics. 8, 3991-4011 (2008).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。