Method Article
الأيضية وصفها وغشاء التقطير للالمقارن تحليل البروتين من
In This Article
Summary
نحن هنا تصف طريقة قوية للتجزئة أغشية البلازما مصنع المنظفات في الأغشية القابلة للذوبان مقاومة والمنظفات يعتمد على خليط من غير المسماة في الجسم الحي بالكامل و15 N المسمى الثقافات خلية نبات الأرابيدوبسيس thaliana. يتم تطبيق هذا الإجراء للدراسات المقارنة البروتين لفهم العمليات الإشارة.
Abstract
البلازما microdomains غشاء هي الميزات على أساس الخصائص الفيزيائية للدهون وستيرول البيئة ولها أدوار معينة في عمليات الإشارة. استخراج microdomains غشاء التخصيب ستيرول من الخلايا النباتية لتحليل البروتين هو مهمة صعبة ويرجع ذلك أساسا إلى إعداد خطوات متعددة ومصادر التلوث للمن المقصورات الخلوية الأخرى. يشكل غشاء البلازما فقط حوالي 5-20٪ من جميع الأغشية في الخلايا النباتية، وبالتالي عزل عالي النقاء جزء غشاء البلازما يمثل تحديا. ويتضمن الطريقة المستخدمة في كثير من الأحيان مائي التقسيم على مرحلتين في غليكول البولي ايثيلين وديكستران والتي ينتج عنها حويصلات غشاء البلازما بدرجة نقاء 95٪ 1. microdomains غشاء ستيرول الغنية داخل غشاء البلازما هي غير قابلة للذوبان على العلاج مع المنظفات غير أيوني الباردة في درجة الحموضة القلوية. يمكن فصل هذا الكسر غشاء مقاومة للالمنظفات من غشاء البلازما بالجملة من قبل تنبيذ فائق في النحوالتدرج ucrose 2. في وقت لاحق، والبروتينات يمكن استخلاصها من الموجات المنخفضة الكثافة من التدرج السكروز بواسطة الميثانول / كلوروفورم هطول الأمطار. وبعد ذلك يتم هضمها التربسين البروتين المستخرج، المحلاة وتحليلها أخيرا LC-MS/MS. هو الأمثل لدينا بروتوكول استخراج لmicrodomains-ستيرول الغنية لإعداد نظيفة مقاومة للالمنظفات الكسور غشاء الخلية من ثقافات نبات الأرابيدوبسيس thaliana.
نستخدم وضع العلامات الأيضية الكامل للنبات الأرابيدوبسيس thaliana الثقافات الخلية التعليق مع K 15 NO 3 كمصدر للنيتروجين فقط للدراسات المقارنة البروتين الكمي التالية المعالجة البيولوجية من الفائدة 3. عن طريق خلط نسب متساوية من الثقافات خلية وصفت وغير المسماة لاستخراج البروتين مشتركة يتم الاحتفاظ تأثير على خطوات إعداد النتيجة النهائية الكمية كحد أدنى. أيضا خسائر ماديه اثناء الاستخراج سوف تؤثر على كل من الرقابة وعينات المعاملة في نفس الطريق، ووبالتالي د نسبة الضوء ويتنفس الببتيد سوف تظل ثابتة. في الطريقة المقترحة إما المسمى أو زراعة الخلايا غير المسماة تخضع لعملية المعالجة البيولوجية، في حين أن الآخر بمثابة السيطرة 4.
Introduction
في عام 1972، اقترح جوناثان سينغر ونيكلسون نموذج غارث فسيفساء السائل نموذج هيكل الأغشية الخلوية، ليحل محل النموذج ساندويتش البروتين الدهني البروتين الذي تم المقبولة عموما في أوائل 1960s. المغني ونيكلسون افترض أن غشاء بيولوجي يمكن اعتباره السائل ثنائي الأبعاد حيث نشر كل الدهون والبروتينات جزيئات بحرية وبسهولة 5. منذ ذلك الوقت، نموذج هيكل غشاء البلازما والمعرفة لتكوين غشاء أصبح أكثر تعقيدا. بشكل خاص، داخل غشاء البلازما، والهياكل مثل المجمعات البروتين والدهون / ستيرول مقرها microdomains المختلين هيكليا يمكن ملاحظتها. في الأغشية النموذج الصناعي 6،7، يمكن الجامدة والدهون الإسفنجية فصل أفقيا من الأنواع الدهون الأخرى لتشكيل الأقاليم مع ميزات المادية المتغيرة. ويتسبب هذا الفصل أساسا داخل الغشاء الخلوي من خصائص الربط الذاتي بين الجامدة وسا غايةالسلاسل الهيدروكربونية turated من phopsho والدهون الإسفنجية 8. بشكل خاص، يرن ستيرول جامدة تفضل التفاعل مع صلابة والأنواع الدهون المشبعة واستقامة هذه التفاعلات إجبار السلاسل الهيدروكربونية المجاورة إلى أكثر التشكل الموسعة، زيادة سمك الغشاء وصلابة.
كان واحدا من السمات يلاحظ عموما من ستيرول التخصيب microdomains غشاء الصلابة سفرهم عند العلاج مع المنظفات غير الأيونية مثل هذا تريتون X-100 أو بريج 35. ويعتقد أن هذه الكسور لتكون متطابقة مع microdomains الغشاء وكانت تسمى أغشية مقاومة المنظفات (DRM) على أساس على طريقة إعداد البيوكيميائية 2. استخدام المنظفات غير أيوني خلال استخراج DRM تلقى بعض الانتقادات مثل إعداد DRM البيوكيميائية قد لا تتوافق مباشرة إلى أي مقصورة غشاء محددة داخل الخلية الحية 9. وخاصة، والمنظفات لنسبة البروتين يبدو حاسما في مثل هذه الاستعدادات، ويمكن ق المنظفات المختلفة، فضلا عن كميات المنظفات المختلفة تسفر عن تكوين مختلفة من المنظفات مقاومة الغشاء جزء 10. ومع ذلك، هناك أدلة على أن الأنواع بروتين معين المنتسبين على وجه التحديد مع هذه المجالات غشاء ستيرول الغنية الخلوية، والتي يتم إثراء هذه البروتينات جيدا في التحضيرات الكيميائية الحيوية المقاومة للكسور الغشاء المنظفات 11. كان جوهر البروتينات التي تم العثور عليها في المصنع DRM كسر، والتي كان وجودها في DRMS ستيرول تعتمد، ولا سيما البروتينات GPI الراسية، مثل البروتينات مثل fasciclin arabinogalactan (إف إل أي إس) وأفراد من عائلة البروتين SKU. كما يشير بعض البروتينات، مثل تحركات مثل مستقبلات أو phospholipases تم العثور على 11. هذه النتائج متسقة مع العديد من الدراسات على البروتين microdomains غشاء الثدييات 12،13. أيضا في النباتات هناك أدلة متزايدة لدور microdomains الغشاء في سياق الاستجابة للضغط النفسي 14 -16.
بروتوكول الموصوفة هنا يوفر طريقة قوية للتجزئة من microdomains غشاء البلازما، ويستخدم بشكل خاص على البروتين لتركيز المنظفات التي تسمح لنا لتصوير الاجهاد الناجم التعديلات للستيرول الغنية غشاء مقصورة 4،11،14.
Protocol
PROCEDURE
الكواشف ومخازن الشائعة المستخدمة في بروتوكول استخراج:
- مختبر الدفع النفاث المتوسطة للنبات الأرابيدوبسيس thaliana الثقافات الخلية تعليق
- 3 ميكرومتر H 3 BO 3
- 3 ميكرومتر MnSO 4 × H 2 O
- 1.1 ميكرومتر ZnSO 4 × 7 H 2 O
- 0.15 ميكرومتر KJ
- 0.03 ميكرومتر نا 2 زارة النفط 4 × 2 H 2 O
- 3 نانومتر كوكلي 2 × 6 H 2 O
- 3 نانومتر كبريتات النحاس 4 × 5 H 2 O
- 0.9 مم CaCl 2 × 2 H 2 O
- 0.5 ملي MgSO 4 × 7 H 2 O
- 0.5 ميكرومتر FESO 4 × 7 H 2 O
- 0.5 ميكرومتر نا 2 EDTA × 2 H 2 O
- 0.12 ميكرومتر الثيامين حمض الهيدروكلوريك
- 0.16 ميكرومتر حمض النيكوتينيك
- 0.097 ميكرومتر حمض الهيدروكلوريك البيريدوكسين
- 0.107 ميكرومتر NAA
- 0.375 ملي KH 2 PO 4
- 0.061 ملي ناه2 ص 4 × 2 H 2 O
- 0.039 ملي نا 2 هبو 4
- 0.027 ملي جليكاين
- 0.56 ملي ميو اينوزيتول
- 1.5٪ سكروز
- 10 ملي K 14 NO 3 أو 10 ملي K 15 NO 3
ملاحظة: يجب أن يتم ضبط درجة الحموضة في مختبر الدفع النفاث المتوسطة إلى 5.7 مع KOH. يجب أن تكون معقمة والمتوسطة عن طريق الترشيح أو التعقيم قبل استخدامها.
- العازلة H
- 100 ملي HEPES KOH-(الرقم الهيدروجيني 7.5)
- 250 ملي السكروز
- 10٪ (ث / ت) الجلسرين
- 5 ملي EDTA
- 5 ملم حمض الاسكوربيك
- 0.6٪ (ث / ت) PVP K-25 K-30 أو
- 5 ملي DTT (إضافة جديدة)
- 1 ملم PMSF (إضافة جديدة)
- البروتيني والفوسفاتيز مثبطات (إضافة جديدة)
- 50 ملي ناف
- 1 ملم نا 3 VO 4
- 1 ملم benzamidin
- 0.3 ميكرومتر mikrocystin
- 4 ميكرومتر leupeptin
- مثبط البروتياز كوكتيل
- العازلة R
- 5 ملي فوسفات البوتاسيوم
- 0.33 M السكروز
- 3 ملي بوكل
- 0.1 ملي EDTA
- 1 ملم DTT (إضافة جديدة)
- العازلة TNE
- 25 ملي تريس، حمض الهيدروكلوريك، ودرجة الحموضة 7.5
- 150 ملي مول كلوريد الصوديوم
- 5 ملي EDTA
- نظام مرحلتين (6 ز النظام هو مناسبة لمدة تصل إلى 15 غرام من العينة الوزن الطازج) طريقة التحضير
في 15 مل فالكون المكونات أنبوب مزيج المدرجة أدناه وتخلط جيدا:- 20٪ (ث / ث) ديكستران T500 - 2.6 ز
- 40٪ (ث / ث) بولي (جلايكول الإثيلين) (PEG 3350) - 1.3 ز
- السكروز - 0.678 غ
- 0.2 M الفوسفات البوتاسيوم، ودرجة الحموضة 7،8-،15 مل
- 2 M بوكل - 0.014 مل
- يضاف الماء حتى الكتلة الاجمالية للنظام على مرحلتين هو 6 ز.
- حلول السكروز في المخزن TNE
- 2.4 M، M 1.6، 1.4 M، 0.15 M
- الكواشف لالتربسين الهضم
- UTU: 6 M اليوريا، 2 M ثيويوريا (الرقم الهيدروجيني 8.0 مع 10 ملي تريس، حمض الهيدروكلوريك)
- العازلة التخفيض (1 ميكروغرام / ميكرولتر DTT في الماء؛ 6.5 ملم)
- العازلة الألكلة (5 ميكروغرام / ميكرولتر iodoacetamide في الماء؛ 27 ملي)
- LysC ببتيداز داخلية (0.5 ميكروغرام / ميكرولتر)
- التربسين، تعديل درجة التسلسل (0.4 ميكروغرام / ميكرولتر)
- الكواشف لتحلية على الببتيد C 18
- الحل إعادة تعليق: حمض 2٪ trifluoroacetic (TFA)، و 5٪ في الماء أسيتونتريل
- الحل ج: حمض الخليك 0.5٪
- الحل ب: 80٪ أسيتونتريل، وحامض الخليك 0.5٪
- الكواشف لتخصيب phosphopeptide
- الحل ج: 0.1٪ TFA، 5٪ أسيتونتريل
- الحل ب: 0.1٪ TFA، 80٪ أسيتونتريل
- تيو 2 10 ميكرون
- الأمونيا (الأسهم حل 25٪)
- تأكسد (الأسهم 100٪)
بروتوكولات
1. وصفها التمثيل الغذائي للنبات الأرابيدوبسيس thaliana الثقافات تعليق خلية
- ينمو نبات الأرابيدوبسيس العقيد-0 الخليةالتعليق الثقافات المستمدة من أوراق 17 في الكامل 14 N-مختبر الدفع النفاث المتوسطة (18، وانظر قسم "الكواشف المشتركة ومخازن") ومجموعة واحدة من الثقافات في 15 N-مختبر الدفع النفاث في قارورة معقمة المتوسطة في حالة الضوء ثابتة عند 80 و 100 ميكرومول / م 2 ق، 23 درجة مئوية، في إطار ثابت تهتز في 120 دورة في الدقيقة.
- للحفاظ على الثقافات الخلية، وتطعيم 400 مل من الطازجة المتوسطة مختبر الدفع النفاث مع 40 مل من ثقافة سبعة ايام المحمولة القديمة في 1 L القوارير.
- حصاد الثقافات الخلية يحدث عبر فراغ شفط خلال قمع الزجاج واسعة مع شبكة الفولاذ المقاوم للصدأ. الخلايا تتراكم على لوحة شبكة والقمع، ويمكن بسهولة أن تجمع من هناك. ينصح الخلايا ليتم تجميدها في -80 درجة مئوية أو في النيتروجين السائل قبل طحن.
ملاحظة: للحصول على 15 N الثقافات الخلية المسمى أيضي استخدام K 15 NO 3 كمصدر وحيد للنيتروجين لمدة سنتين على الأقل المقاطع اكثر من اسبوعين 19. في بةriments لالبروتيوميات نسبية، واستخدام زراعة الخلايا N 15 المسمى، وكذلك الحفاظ على الثقافة غير المسماة في المتوسط العادي. وبعد ذلك يتم تطبيق المعالجة البيولوجية للثقافة إما المسمى أو غير المسماة، في حين أن الآخر بمثابة السيطرة (الشكل 1). لإعداد البروتين، سيتم الجمع بين الثقافتين 20. عند التخطيط الإعداد التجريبية، نوصي تفكر في الإعداد ووضع العلامات متبادلة 4 التي يتم تطبيق نفس العلاج مرة واحدة إلى 15 N الخلايا المسمى ومرة واحدة للخلايا غير المسماة وغير المسماة منها أو 15 خلايا N المسمى بمثابة الضوابط. في هذه الحالة، هناك حاجة إلى كميات مضاعفة من الثقافات الخلية.
2. غشاء البلازما تنقية
ملاحظة: تتم جميع خطوات إضافية في الغرفة الباردة و / أو على الجليد ما لم يتم الإشارة إلى خلاف ذلك.
- التجانس الخلايا من حوالي 1 لتر من 7 أيام الثقافات القديمة تعليق خلية في النيتروجين السائل.ويمكن تخزين المواد في -80 درجة مئوية حتى استخدامها مرة أخرى.
- مزيج نفس الكميات من مزارع الخلايا المجمدة وصفت وغير المسماة على أساس الوزن الطازج في كوب وإضافة 2 مجلدات من العازلة H فورا. في حالة إعداد microdomain غشاء يقترح استخدام لا يقل عن 7 غرام من الوزن الطازج كل من الخلايا المسمى وغير المسماة.
- ضع الكأس على شاكر ويهز حتى ذاب المادية والحل هو السائل ودون بلورات الثلج.
- تحديد جناسة من خلال طبقة واحدة من Miracloth إلى 50 مل أنابيب الطرد المركزي.
- عينات التوازن مع العازلة H وأجهزة الطرد المركزي في 10،000 x ج لمدة 8 دقائق.
- تحميل طاف في تبريد قبل أنابيب الطرد المركزي فائقة (مثل الدوار بيكمان كولتر SW31Ti)، مع حجم حوالي 32 مل
- عينات التوازن مع العازلة H وبيليه microsomes بواسطة الطرد المركزي في 100،000 x ج في 4 درجات مئوية لمدة 30 دقيقة باستخدام بيكمان SW32Ti الدوار.
- إزالة طاف بعد الطرد المركزي.
ملاحظة: طاف تحتوي على بروتينات قابلة للذوبان. يمكن حفظ كمية صغيرة من هذا الكسر لمزيد من هطول البروتين وتحليل لاحقة أيضا من البروتينات القابلة للذوبان.
- resuspend الكرية غشاء من كل عينة في كمية منها من العازلة R وتحميل على الجزء العلوي من U1 النظام على مرحلتين (الشكل 2). إذا تم استخدام 6 ز النظام على مرحلتين، تحميل بالضبط 2 غرام من بيليه معلق الغشاء.
ملاحظة: الحجم النهائي من العازلة R يعتمد على حجم النظام المرحلة الثانية التي سوف يتم استخدامها (~ 1.6 مل من العازلة R هو مطلوب عند استخدام 6 ز النظام). فمن المستحسن لاستخدام كميات أقل من العازلة إعادة تعليق لذلك عازلة نقية يمكن أن تضاف إلى النظام على مرحلتين للحصول على الوزن طالب، بدلا من استخدام الكثير عازلة للذوبان ولن تكون قادرة على تحميل العينة كاملة على النظام مرحلتين.
- تحميل نفس الحجم من الذهب الخالص العازلة R المستخدمة لعشره عينة إعادة تعليق على U2.
- مزيج ببطء U1 و U2 الأنابيب بواسطة قلب لهم 30X (حوالي 1 انعكاس / ثانية).
ملاحظة: لا يهز بقوة النظام على مرحلتين. فإنه يمكن أن يسبب عدم وجود فصل المراحل في خطوة تنبيذ فائق.
- الطرد المركزي العينات في 1500 XG في 4 درجة مئوية لمدة 10 دقيقة.
- إزالة طاف بعد الطرد المركزي.
- نقل المرحلة العليا من U1 U2 على وكرر الطرد المركزي في 1500 x ج في 4 درجة مئوية لمدة 10 دقيقة.
- نقل المرحلة العليا من U2 في أنابيب نابذة فائقة السرعة SW41Ti وتمييع مع خمسة مجلدات من العازلة R وتخلط جيدا.
ملاحظة: قد يكون المرحلة النهائية العلوي إلى أن تنقسم إلى أنابيب نابذة فائقة السرعة منفصلة قبل أن تتمكن من أن تضعف خمس مرات.
- الطرد المركزي العينات في 200،000 XG في 4 درجة مئوية لمدة ساعة واحدة باستخدام الدوار SW41Ti.
- بيليه resuspend في غشاء األصغرل كمية من العازلة TNE (عادة 200 ميكرولتر من العازلة المستخدمة) لعزل أغشية مقاومة المنظفات.
ملاحظة: يمكن حفظ كمية صغيرة من هذا الكسر لتحليل الغشاء البلازمي غير المجزأ.
ملاحظة: يمكن تخزين جزء غشاء البلازما في 4 درجات مئوية خلال الليل قبل تجزئة في أغشية مقاومة المنظفات والمنظفات كسور قابلة للذوبان.
3. المنظفات مقاومة غشاء إعداد
- تحقق تركيز جزء غشاء البلازما من قبل برادفورد مقايسة.
- إضافة تريتون X-100 إلى البلازما جزء الغشاء. تركيز النهائي من المنظفات يجب ان تبقى بين 0.5-1٪. المنظفات إلى البروتين الوزن لنسبة الوزن يجب ان تبقى بين 13-15.
- عينات هزة في حوالي 100 دورة في الدقيقة عند 4 درجة مئوية لمدة 30 دقيقة.
- إضافة ثلاثة مجلدات من 2.4 M السكروز إلى مجلد واحد من غشاء البلازما معاملة للحصول على 1.8 M تركيز النهائي من السكروز.
- إعداد التدرج السكروز في SW41Ti أنابيب نابذة فائقة السرعة عن طريق تحميل حلول السكروز منها على أعلى من 1.8 M جزء كما هو موضح في الشكل 3.
- الطرد المركزي العينات في 250،000 XG في 4 درجة مئوية لمدة 18 ساعة باستخدام الدوار بيكمان SW41Ti.
- إزالة بعناية أنابيب نابذة فائقة السرعة من الدوار لتجنب تعطيل الفرقة منخفض الكثافة التي قد تكون واضحة باعتباره حلقة حليبي في واجهة من 0.15 M/1.4 M السكروز. في بعض الأحيان يمكن أن ينظر إليه شيئا ولكن الكسر لا يزال يحتوي على البروتين المنظفات مقاومة الكسر.
- إزالة جزء من 0.75 حجم مل من أعلى التدرج. الكسور 2 و 3 التي تغطي حجم حوالي 1.5 مل فوق الحلبة البيني و 0.5 مل أدناه تمثل مقاومة المنظفات جزء الغشاء. جمع هذه الكسور في 15 مل أنابيب فالكون. الكسور 9 و 10 تحتوي على المنظفات القابلة للذوبان جزء الغشاء ويمكن أيضا أن يتم جمعها للمقارنة. لمزيد من التحليل، تجمع fractالأيونات 2 و 3 وكذلك الكسور 9 و 10.
4. استخراج البروتينات من الكسر مقاومة للمنظفات بواسطة الميثانول / كلوروفورم
ملاحظة: تتم جميع الخطوات في درجة حرارة الغرفة.
- إضافة 4 مجلدات من الميثانول إلى الكسور التي تم جمعها ودوامة بدقة.
- إضافة 1 حجم كلوروفورم، دوامة بدقة.
- إضافة 3 مجلدات من الماء، دوامة بدقة.
- الطرد المركزي العينات في 2000 x ج لمدة 5 دقائق باستخدام جهاز للطرد المركزي الفوق (على سبيل المثال إيبندورف 5417R).
- إزالة المرحلة المائية فوق طبقة البروتين في الطور البيني.
- إضافة 3 مجلدات من الميثانول، ودوامة تماما.
- الطرد المركزي العينات في 4000 x ج لمدة 10 دقيقة.
- إزالة طاف وتجفيف بيليه. بيليه المجففة مستعدة لعملية الهضم في الحل.
5. في حل التربسين الهضم
ملاحظة: في هذا الإجراء يتم تنفيذ جميع الخطوات فيدرجة حرارة الغرفة للحد من اشتقاق غير المرغوب فيها من الأحماض الأمينية الجانبية سلاسل من denaturants.
- حل عينة صغيرة من حيث الحجم 6 M اليوريا، 2 M thiurea، ودرجة الحموضة 8 (UTU). استخدام منخفضة تصل إلى حجم كما هو متوافق مع العينة (عادة حوالي 40 ميكرولتر).
- عينات تدور solubilized في UTU في 5،000 x ج في جهاز للطرد المركزي الفوق (على سبيل المثال إيبندورف 5417R) لمدة 10 دقيقة لتكوير أي مادة غير قابلة للذوبان.
- يجب أن يكون الرقم الهيدروجيني من الحل النهائي بالقرب 8.0 لأفضل التربسين الهضم. تحقق مع شرائح الأس الهيدروجيني.
- إضافة 1 ميكرولتر من العازلة التخفيض لكل 50 ميكروغرام من البروتين العينة واحتضان 30 دقيقة في درجة حرارة الغرفة.
ملاحظة: فقط تقدير تقريبي للمحتوى البروتين ضروري. عندما هو مبلغ عينة محدودة فمن الأفضل أن تضحي دقة بدلا من إضاعة عينة على فحص البروتين.
- إضافة 1 ميكرولتر من العازلة الألكلة لكل عينة البروتين 50 ميكروغرام واحتضان 20 دقيقة في درجة حرارة الغرفة في الظلام.
- إضافة 0.5 ميكرولتر من LysC في 50 ميكروغرام البروتين العينة واحتضان لمدة ثلاث ساعات في درجة حرارة الغرفة ثابتة مع اهتزاز في 700 دورة في الدقيقة. إذا لزم الأمر، يمكن للهضم أيضا أن تنفذ بين عشية وضحاها. ومع ذلك، فمن غير المستحسن تمديد الوقت في درجات حرارة دافئة لأنها يمكن أن تزيد من فقدان الببتيد بسبب الامتزاز على المواد أنبوب بلاستيكي تحت مائي درجة الحموضة 8 شروط.
- تمييع عينة مع أربعة مجلدات 10 ملي تريس، حمض الهيدروكلوريك، ودرجة الحموضة 8.
ملاحظة: هذه الخطوة غير ضرورية على الاطلاق لتخفيف تركيز اليوريا كما التربسين حساس جدا لالملح العالية.
- إضافة 1 ميكرولتر من التربسين في 50 ميكروغرام البروتين العينة واحتضان بين عشية وضحاها في درجة حرارة الغرفة ثابتة مع اهتزاز في 700 دورة في الدقيقة.
- يحمض العينات إلى 0.2٪ TFA تركيز النهائي للوصول إلى درجة الحموضة 2 (إضافة حوالي 1/10 من حجم حمض trifluoracetic 2٪).
ملاحظة: يمكن تخزين العينات في - 20 درجة مئوية حتى استخدامها أبعد من ذلك، ولكن من الأفضل لتخزينلهم على StageTips في 4 درجات مئوية إذا كان لفترة قصيرة (أسبوع واحد) أو تخزينها بعد StageTips تحلية.
6. تصنيع C-18 StageTips
- وضع Empore القرص C18 على سطح مستو ونظيف مثل البلاستيك القابل للتصرف طبق بيتري.
- لكمة من قرص صغيرة باستخدام إبرة حادة ذات الرؤوس تحت الجلد مع قطرها 1.5 مم. القرص العصي في الإبرة، ويمكن نقلها إلى طرف ماصة.
- دفع القرص من الإبرة وإصلاحه في مستدق من طرف ماصة بواسطة قطعة من السيليكا تنصهر أو أنابيب المناسب في الداخل من الإبرة.
ملاحظة: StageTips يمكن تخزين جاف في درجة حرارة الغرفة 21.
7. استخدام C-18 StageTips لإزالة الملوحة وتركيز الببتيد
- حالة A-C 18 StageTip من خلال وضع 50 ميكرولتر من محلول B على استعداد StageTip. تدور طرف في أجهزة الطرد المركزي في 2000 دورة في الدقيقة لمدة 2 دقيقة في الفوق جentrifuge (على سبيل المثال إيبندورف 5417R).
ملاحظة: استخدام محولات تدور StageTips في أجهزة الطرد المركزي إيبندورف، وسيتم جمع السائل في أنبوب رد فعل 2 مل. لاستعدادات واسعة النطاق، ويمكن أيضا أن توضع في مرحلة نصائح رف طرف مع 96 ميكرولتر من النصائح 200 والسائلة يمكن جمعها في وحة microtiter.
ملاحظة: لا تستخدم سرعات أعلى من 3،000 x ج في جهاز للطرد المركزي الفوق (على سبيل المثال إيبندورف 5417R) بسبب خطر تخرج القرص C 18 من غيض.
- تتوازن في StageTip باستخدام 100 ميكرولتر حل A. تدور طرف في أجهزة الطرد المركزي في 5000 x ج في جهاز للطرد المركزي الفوق (على سبيل المثال إيبندورف 5417R).
- كرر الخطوة 2.
- عينة الحمل على القرص بواسطة pipetting بعناية العينة إلى غيض ماصة مع القرص الداخل.
ملاحظة: قرص واحد يمكن ربط تقريبا. 100 ميكروغرام من البروتين.
- تدور نصائح في مntrifuge حتى مجلدا كاملا من عينة تمر عبر القرص C 18.
- غسل StageTips مرتين مع 100 ميكرولتر من الحل A. تدور نصائح في أجهزة الطرد المركزي.
ملاحظة: يمكن تخزين StageTips غسلها وتحميلها في 4 درجات مئوية لمدة تصل إلى أسبوع.
- أزل العينة مع 40 ميكرولتر من محلول B. جمع شطافة في الطازجة 1.5 مل أنبوب التفاعل.
- تركيز العينة في بطالة السرعة. في ظل ظروف مثالية، ووقف عملية الجفاف كما أن هناك فقط حوالي 1 أو 2 السائل ميكرولتر اليسار.
ويمكن تخزين العينات المجففة في -80 درجة مئوية لمدة سنوات: ملاحظة.
- إضافة الحجم النهائي من 9 ميكرولتر من الحل إعادة تعليق لعينة وتحويلها إلى microtiterplate لتحليل المواصفات الشامل.
ملاحظة: الحجم النهائي من المخزن المؤقت إعادة تعليق المستخدمة هي التي تعتمد على احتياجات المجرب وحساسية مطياف الكتلةالمستخدمة.
8. بروتوكول بديلة لإثراء Phosphopeptide
ملاحظة: للحصول على تخصيب phosphopeptide، ويجب أن يتم استخراج البروتين في الخطوة 2 في وجود مثبطات إنزيم الفوسفاتيز.
ملاحظة: لا يحتاج تركيز البروتين بالضبط ليتم تحديد للخطوات التالية. يكفي أن يكون هناك تقدير تقريبي للمحتوى البروتين لتجنب فقدان العينة لا لزوم لها
- إعداد C-8 StageTips (اتبع نفس البروتوكول لإعداد C-18 StageTips في الخطوة 6).
- نقل 1 ملغ من تيو 2 حبات إلى أعلى استعداد C-8 StageTips (1 ملغ استخدام تيو 2 لكل 100 ميكروغرام من البروتين).
- تتوازن تيو 2 نصائح مع 100 ميكرولتر من محلول C، وتدور في 2،000 x ج لمدة 5 دقائق في جهاز للطرد المركزي الفوق (على سبيل المثال إيبندورف 5417R).
- مزيج 100 ميكروغرام من الببتيدات هضمها والمحلاة من الخطوة 7.7 (يجب أن تكون في 100 ميكرولتر من الحلB) مع 100 ميكرولتر من الحل A.
- تحميل عينة مختلطة على معايرتها تيو 2 الأعمدة؛ تدور في 1،000 x ج، 5 دقائق.
- جمع من خلال تدفق وتحميله على نفس الطرف مرة أخرى (من خلال إبقاء تدفق بعد مرور الثاني).
- غسل طرف مع 100 ميكرولتر من محلول A؛ تدور في 2،000 x ج، 5 دقائق في جهاز للطرد المركزي الفوق (على سبيل المثال إيبندورف 5417R).
- أزل العينة مع 50 ميكرولتر من 5٪ الأمونيا.
- أزل العينة مع 50 ميكرولتر من 5٪ تأكسد (سواء eluates يمكن الجمع).
- تحمض فورا العينة باستخدام 50 ميكرولتر من 20٪ حمض الفوسفوريك. وينبغي أن تكون درجة الحموضة في حوالي 2.
ملاحظة: احفظ نصائح تيو 2 واسترداد مسحوق. ويمكن غسلها بمحلول B واستخدامها مرة أخرى عن واحد أو اثنين من أكثر جولات.
- مرة أخرى desalt عينات المحمض على C 18 نصائح (راجع الخطوة 8).
9. تحليل LC-MS/MS من الببتيد مخاليط
- في resuspend phosph المحلاةopeptides في المنطقة العازلة إعادة تعليق.
- تحميل معلق العينة على نظام LC-MS/MS الاختيار واكتساب الأطياف في وضع البيانات تعتمد على القرار المقترح من 60،000 الاعراض الكامل في نصف الحد الأقصى.
ملاحظة: للحصول على تجزئة الأمثل، إما الخسارة محايدة المسح ينبغي تطبيق 22، أو إذا كانت متوفرة تفعيل متعددة المراحل 23. إذا ETD متاح أنها سوف تسمح تجزئة الببتيد العمود الفقري من دون خسارة من حامض الفوسفوريك 24.
ملاحظة: القوائم الذروة من البيانات الخام تحتاج إلى استخراج وتقديمها إلى تحديد قاعدة البيانات وكذلك لتحديد الكميات. هنا، نحن تصف الإعدادات لاستخدام التميمة وMSQuant، والذي يعمل لملفات البيانات الخام من LTQ، LTQ-Orbitrap والصكوك LTQ FT-(الحرارية العلمية).
- استخراج قائمة الذروة باستخدام DTAsupercharge داخل "مساعد" القائمة في MSQuant. استخدام الإعدادات الافتراضية.
- يقدم الناتجة ملف قائمة الذروة إلى محرك البحث التميمة. كرإعدادات itical: السلائف أيون الشامل التسامح 10 جزء في المليون، MS / MS التسامح الشامل 0.5 دا. تعديلات ثابتة: carbamidomethylation من cysteines، تعديلات متغير: أكسدة ميثيونين، الفسفرة من سيرين، ثريونين، التيروزين. طريقة الكميات: 15 N وضع العلامات الأيضية.
- حفظ التميمة نتيجة كملف صفحة ويب.
- تحميل ملف التميمة نتيجة وملف الخام إلى MSQuant. حدد جميع البروتينات من الفائدة وتشغيل "الكميات تلقائي". سيقوم البرنامج قراءة الأطياف مسح كامل من ملف الخام والقيام التكامل الذروة للشركاء وصفت وغير المسماة كل الببتيد.
- النتائج تصدير الكميات إلى برنامج جدول بيانات أو إلى ملف نصي المفصول. ويمكن بعد ذلك تقديم البيانات لمزيد من التحليل الإحصائية في Excel أو استخدام مزيد من حزم البرمجيات مثل Statquant 25 أو 26 التكسير.
النتائج
مع بروتوكول المعروضة باستخدام المسمى أيضي الثقافات خلية نبات الأرابيدوبسيس فمن الممكن لعزل أغشية البلازما من الأنسجة النباتية (STEP2، أرقام 2 و 4)، وإثراء لمقاومة المنظفات الكسور الغشاء داخل غشاء البلازما (الخطوة 3 أرقام 3 و 5). في وقت لاحق، ويسمح البروتوكول استخراج البروتينات من هذه المنظفات مقاومة الكسور غشاء (الخطوة 4) والهضم من البروتين لتحليل البروتين النسبية (الخطوة 5). أخيرا، في إثراء اختياري من phosphopeptides (الخطوة 8) من المثير للاهتمام بشكل خاص في دراسة العمليات الإشارات الخلوية. الخطوة الأخيرة ثم هو التحليل الكمي البيانات (الخطوة 9، الشكل 6) من نسب وفرة البروتين في الكسور غشاء الخلية المسمى من الثقافة وغير المسماة.
نتائج نموذجية بعد خلط للنظام 2 في المرحلة (الخطوة 2) والطرد المركزي لاحقة هي مرحلة العليا الملونة واضحة والخضراء الملونة انخفاض المرحلة (الشكل 2). البلازما غشاء الحويصلات المنتسبين تفضيلي مع المرحلة PEG العليا، في حين يتم دمج الحويصلات الغشاء من البلاستيدات الخضراء الخضراء والأغشية الداخلية الأخرى في مرحلة ديكستران أقل. إذا لا يمكن ملاحظتها في فصل الألوان، والخطوة 2 لم تنفذ بشكل صحيح وسوف تكون ملوثة أغشية البلازما مع كميات كبيرة من الأغشية الداخلية. تخصيب للبروتينات غشاء البلازما يمكن أن تظهر من خلال تحليل البروتين من مأخوذة صغيرة من الكسور غشاء البلازما والبروتينات في المرحلة الدنيا من النظام على مرحلتين. المرحلة الدنيا يحتوي على الأغشية الداخلية للخلية. على سبيل المثال، نموذجية وخاصة البروتينات المعروفة غشاء البلازما، مثل البروتينات مستقبلات كيناز أظهرت وفرة كبيرة في جزء غشاء البلازما (بعد الظهر) وفرة منخفضة في الجزء الأسفل من جزء المرحلة (الشكل 4A) الذي يحتوي على الأغشية الداخلية (IM). في المقابل، البروتينات المعروفة من endoplasmatic الشبكة عرض عاليةلم تراع فرة في جزء الغشاء الداخلي والكسر غشاء البلازما (الشكل 4B).
سوف تخصيب اللاحقة الكسور غشاء مقاومة المنظفات (الخطوة 3) يؤدي في الحالات المثالية في تشكيل عصابة من حليبي منخفض الكثافة الحويصلات الغشاء في حوالي 1/5 عشر للارتفاع أنبوب (الشكل 3). إذا كان تعديل تريتون X-100 تركيزات أو المنظفات لنسبة البروتين (الخطوة 3.2) هو الأمثل للفصل في مقاومة المنظفات والمنظفات الكسور القابلة للذوبان، حلقات إضافية يمكن ملاحظتها في الأجزاء السفلى من التدرج وسوف يكون هناك أيضا كتل الغشاء في الفرقة منخفضة الكثافة. في هذه الحالات، المنظفات لنسبة البروتين أو المبلغ الإجمالي المنظفات يختلف عن تركيز مذيلة الحرجة اللازمة لفصل استنساخه من اثنين من كسور مجال الغشاء. باستخدام تركيز المنظفات النهائي والمنظفات لنسبة البروتين وصفها هنا، السكةichment من البروتينات microdomain نموذجية، مثل remorin (AT3G61260) 27 يمكن أكده تحليل مقارن الطيفي الشامل من DRM جزء، جزء المنظفات القابلة للذوبان (الخطوة 3.8)، وكذلك غير المجزأ غشاء البلازما والأغشية الداخلية. تم العثور على أعلى فرة من البروتين remorin في الكسور DRM كما هو متوقع (الشكل 6A). البروتينات غير موجودة في microdomains الغشاء، مثل AT1G59870 ABC-نقل (الشكل 6B)، لا تظهر وفرة وزيادة في نسبة DRM. الملوثات نموذجية أيضا، مثل البروتين الميتوكوندريا (AT2G07707) من مجمع أتباز F0 (الشكل 6C) والريباسي البروتين (At1G001100) من الريبوسوم 60S (الشكل 6D) لا تظهر وفرة المخصب في جزء DRM، على الرغم من أن الحد الأدنى من كميات يمكن لا يزال يتم تحديدها.
بعد فرة التحليل الطيفي الشامل، البروتين نسب البروتين الوضع الفسفرة في البلازماالكسور غشاء الخلية المسمى الثقافات وأونلبلد يمكن تمييزها كميا (الشكل 6). نتائج نموذجية من MSQuant ( msquant.alwaysdata.net يجب) نافذة الكميات تظهر نسبة كثافة الأيونات من 1-1 لأكثر من الببتيدات التي تم تحديدها (الشكل 6A). وتعتبر هذه الببتيدات مع أيون نسبة كثافة الانحراف بشكل ملحوظ من 1:1 كما ينظم الفرق بين زراعة الخلايا وصفت وغير المسماة، والمرشحة للمطابقة إلى البروتينات المتضررة من تطبيق العلاج (الشكل 6C). عنصر تحكم نوعية جيدة من وضع العلامات الأيضية الناجح هو المشارك شطف كل من وصفت والإصدارات الببتيد غير المسماة باعتبارها ذروة واحدة في فصل نانو HPLC (الخطوة 9) كما هو موضح في الشكلين 6B و D.

الشكل 1. استراتيجية تجريبية وضع العلامات الأيضية. تمثيل تخطيطي من نوعين مختلفين من التصميم التجريبي عند استخدام مزارع الخلايا غير المسماة A. thaliana بالكامل المسمى الأيضية و. المجرب إما أن تقرر استخدام 14 N الخلايا (غير المسماة) كوسيلة لمراقبة و15 N الخلايا (المسمى أيضي) التي تخضع المعالجة البيولوجية أو العكس بالعكس. في التصميم التجريبي متبادلة تتم كلا الخيارين بالتوازي.

الشكل 2. سير العمل لفصل غشاء الحويصلات النبات على نظام مرحلتين مائي على أساس غليكول البولي إيثيلين (PEG) وديكستران. البلازما غشاء الحويصلات فصل في المرحلة PEG العلوي بينما بلاستيدات الخضراء والأغشية الداخلية الأخرى المرتبطة بوتالمرحلة ديكستران ام بعد الطرد المركزي. مع الغسيل إضافية من المرحلة العليا تنقية أفضل يمكن أن يتحقق، ولكن يتم زيادة الخسائر المادية أيضا.
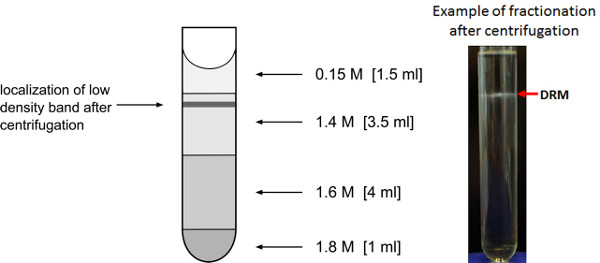
الرقم 3. تخصيب منخفض الكثافة كسور الغشاء. تمثيل التدرج السكروز لإثراء منخفض الكثافة مقاومة المنظفات الكسور الغشاء. يشار الموقع المتوقع بعد الطرد المركزي ليلة وضحاها من كثافة منخفضة غشاء الحويصلة الفرقة.

الشكل 4. تخصيب للبروتينات الغشاء البلازمي بعد تنقيتها في النظام على مرحلتين. تطبيعكثافة البروتين أيون لقياس البروتينات في غشاء البلازما (بعد الظهر) والأغشية الداخلية (IM) جزء (أ) مكونات المعروفة نموذجية من غشاء البلازما تظهر وفرة أعلى من ذلك بكثير في جزء من PM في IM الكسر. مكونات المعروفة (B) الطبيعي من الأغشية الداخلية يظهر السلوك المعاكس. للتطبيع، وأعرب عن مبالغ كثافة أيون لكل بروتين ككسر من مجموع كثافة الأيونات في العينة ثم بلغ متوسط بين مكررات. وبعد ذلك أعرب جزء من الكل شدة ايون وفقا لمتوسط بين العلاجين. أشرطة الخطأ تمثل الانحراف المعياري من ثلاثة الاستعدادات من مزارع الخلايا نمت بشكل مستقل. انقر هنا لعرض أكبر شخصية .
الرقم 5. . فرة من علامات البروتين القياسية في قياس الكسور تمثل المؤامرات توزيع تطبيع كثافة البروتين أيون من علامات اختار البروتين لمقصورات خاصة التحت خلوية (DRM - microdomains-ستيرول الغنية، PM - غشاء البلازما، والتراسل الفوري - الأغشية الداخلية، SP - البروتينات القابلة للذوبان). أنماط وفرة من (A) remorin كعلامة للmicrodomains غشاء ستيرول الغنية، (B) ABC-نوع البروتين الأسرة نقل كممثل للبروتين لا ستيرول التي تعتمد، (C) الوحيدات مجمع F0 الميتوكوندريا، (D) 60S الوحيدات من ريبوسوم كما نموذجي شارك في تنقية الملوثات. للتطبيع، وأعرب عن مبالغ كثافة أيون لكل بروتين ككسر من مجموع كثافة الأيونات في العينة ثم بلغ متوسط بين مكررات. وبعد ذلك أعرب جزء من الكل شدة ايون وفقا لمتوسط بين اثنين treatments. أشرطة الخطأ تمثل الانحراف المعياري من ثلاثة الاستعدادات من مزارع الخلايا نمت بشكل مستقل. انقر هنا لعرض أكبر شخصية .
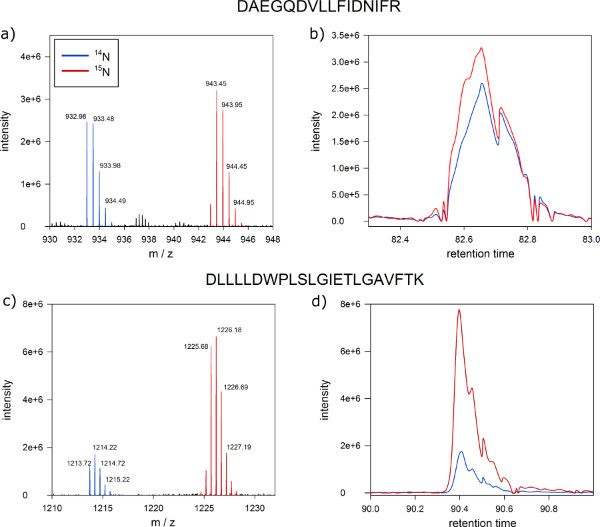
الرقم 6. النتائج المتوقعة من البروتين الكمي مطياف الكتلة. النار الشاشة من MSQuant تبين نسبة 1:1 كثافة أيون المتوقعة من الببتيد من 1:1 خليط من مستخلصات البروتين من الخلايا وصفت ونبات الأرابيدوبسيس غير المسماة: (أ) فحص كامل الطيف من الببتيد DNNLLGK بوضوح فصل المسمى (الذروة اليمين) وغير المسماة (الذروة الأيسر) نسخة من الببتيدات على المحور م / ض. يشار إلى كتلة نظير أحادي والنظائر الأولى بعلامات زرقاء. (B) وصفت (الازرق) ود غير المسماة (أحمر) إصدارات الببتيد المشترك أزل باعتبارها ذروة واحدة خلال نانو HPLC اللوني. (C) فحص كامل الطيف من الببتيد مع نسبة كثافة الأيونات من 1:05 كمرشح لبروتين منظم تفاضلي. (D ) أيضا البروتينات مع نسب مختلفة من 1:1 شارك في أزل في عكس المرحلة اللوني. انقر هنا لعرض أكبر شخصية .
Discussion
بروتوكول المعروضة في هذه الورقة تحتوي على العديد من الخطوات وجميعهم من الأهمية بمكان الحصول على تجزئة نقية وممثل للغشاء البلازما النباتية في أغشية مقاومة المنظفات والمنظفات كسور قابلة للذوبان. وبالتالي، فمن المهم أن تتبع كل خطوة وفقا للتعليمات.
علاج الكسر غشاء البلازما مع المنظفات غير الأيونية (الخطوة 3.2) لديها أقوى تأثير على نوعية غشاء microdomain تجزئة. للحصول على نتائج استنساخه بين استعدادات مختلفة، ويكون قادرا على مقارنة عينات مختلفة من نفس التجربة، فمن المهم جدا لتقييم بدقة تركيز البروتينات في الغشاء البلازمي وتطبيق المنظفات دائما في نفس النسبة فيما يتعلق محتوى البروتين ودائما لنفس تركيز النهائي. عمليا، هذا يعني أنه في بعض الأحيان لا بد من تمييع العينات مع تركيز نسبة عالية من البروتين أو لاستخدام مخزونات تركيز مختلفةمن تريتون X-100.
في الدراسات البيوكيميائية، في الآونة الأخيرة كان هناك ميل بين الباحثين لاستخدام وسيلة خالية من المنظفات لعزل microdomains غشاء 28-30. وتستند هذه الأساليب على اضطراب الميكانيكية للغشاء البلازما عن طريق القص من خلال إبرة صغيرة جدا قياسا للصحافة خلية الضغوط الفرنسية. طبقت هذه الإجراءات بنجاح على الثقافات الغنية في خلايا الثدييات microdomains الغشاء، ولكن لم يتم الإبلاغ عن التطبيق لجدار الخلية التي تحتوي على الكائنات الحية (الخميرة، وخلايا النبات). باستخدام البروتينات الكمية جنبا إلى جنب مع عوامل تعطيل ستيرول، مثل ميثيل بيتا cyclodextrin، فقد تبين أن الكسور DRM أعدت من غشاء البلازما النباتية لا تحتوي على البروتينات التي هي علامات لmicrodomains غشاء 11.
بشأن النتائج النهائية للتحليل الطيفي الكميات الشامل، ونتائج نموذجية هو مبين في الشكل (6) تمثل الوضع المثالي فيوالتي كثافة أيون بالنسبة لغالبية الببتيدات وصفت وغير المسماة هي قريبة من متطابقة. ومع ذلك، في بعض الحالات على درجة معينة من الاختلاف البيولوجي بين مجموعات من مزارع الخلايا وصفت وغير المسماة يمكن ملاحظتها. وبالتالي، قبل المعالجة البيولوجية إما المسمى أو تتم زراعة الخلايا غير المسماة بها، تحليل خليط من الخلايا السيطرة وصفت وغير المسماة، على حد سواء دون أي علاج، ويسمح تحديد الببتيدات مع نسب متباينة من واحدة مثالية لحالات واحدة. هذه البروتينات مع نسب متباينة للمؤشرات الاختلاف البيولوجي. للتغلب على التحدي المتمثل في آثار العلاج المميزة من الاختلاف البيولوجي، وبالتالي فإننا نقترح استخدام الوسم متبادلة في التجارب تقرن 20. في الإعداد التجريبية المتبادلة، يتم تنفيذ كلا الخيارين من التجربة على النحو المقترح في الشكل (1) ويتم اتباع الخطوات من البروتوكول كما هو موضح. ثم، بمقارنة نسب كثافة أيون عroteins من كل من التجارب المتبادلة، يمكن للمرء أن يميز إذا كانت الفروق بين نسب كثافة أيون هي بسبب الاختلاف البيولوجي أو كأثر للعلاج تطبيقها.
طريقة أخرى لمعالجة مشكلة التمييز بين آثار العلاج والاختلاف البيولوجي هو استخدام معيار المسمى الداخلية كمرجع لجميع العلاجات 31. في هذا النهج، يتم خلط السيطرة غير المسماة وغير المسماة الخلايا التي تخضع المعالجة البيولوجية مع نفس الكمية من الخلايا السيطرة المسمى الثقيلة، قادمة من نفس الدفعة. لأنها تتيح القضاء على تأثير الاختلاف البيولوجي على نسبة الببتيد، لأن البروتينات كما تعتبر كبيرة، إذا نسب كثافة الأيونات من 14 N-التحكم / 15 N ضبط و14 N-معالجة / 15 N-التحكم تختلف اختلافا كبيرا. هذا ممكن، كمعيار المسمى هو بالضبط نفس في جميع الحالات.
واحدة من الدكتورawbacks الإجراء تخصيب DRM الموصوفة هنا هي البروتينات المشاركة في تنقية التي يمكن تحديدها في المنظفات مقاومة الكسر الغشاء. في قائمة البروتينات التي تم تحديدها من منخفض الكثافة مقاومة للكسر الغشاء المنظفات، يمكننا أن نلاحظ بانتظام عدد كبير من البروتينات الريباسي. نظرا لكثافة منخفضة نسبيا من البروتينات الريباسي، تهاجر في نفس هذا الجزء بمثابة ستيرول البروتينات الغشاء تعتمد في التدرج السكروز. وقد تبين ذلك من دون أي شكوك أن البروتينات الريباسي بشكل واضح لا المكونة من 11 microdomains الغشاء. لاستبعاد هذه وغيرها من البروتينات شارك في تنقية لا ترتبط فعلا مع مقاومة المنظفات منخفض الكثافة كسور الغشاء، نقترح أيضا لتحليل تكوين البروتين في الأغشية داخل الخلايا (IM) التي يمكن استخلاصها من المرحلة ديكستران أقل من يومين نظام المرحلة ومقارنة نسب فرة من الملوثات المفترضة بين الغشاء الداخلي وDRMجزء (انظر الأمثلة في الشكل 5). وينبغي أن يكون البروتينات DRM المشارك تنقية فرة مماثلة في كل من الكسور (IM وDRM).
تجزئة مقتطفات الخلية وغشاء microdomains هو وضع استراتيجية مشتركة للحد من التعقيد في عينة للتحليل البروتين 32. وبالتالي، فإن بروتوكول الموصوفة هنا هو مفيد لجميع الدراسات من إشارات العمليات على غشاء البلازما من الخلايا النباتية. التطبيقات البيولوجية في دراسة استجابات التوتر وكذلك الإصابات التي الممرض جميع إلى درجة كبيرة يستحث حدوث تغييرات في تكوين غشاء البلازما وتعديل البروتينات الغشاء 14،15. إلى جانب دراسة استجابات التوتر، ويمكن تحديد الكميات من تركيزات البروتين في غشاء الكسور المختلفة تساعد إلى حد كبير الشرح من البروتينات غير معروف حتى الآن 33 34،35.
Disclosures
يعلن الكتاب أنه ليس لديهم مصالح مالية المتنافسة.
المؤلف، ويتولد زيمانسكي، هو موظف في معهد ماكس بلانك للفسيولوجيا النبات الجزيئية. المؤلف، فالتراود شولز هو موظف في جامعة هوهنهايم في ألمانيا.
Materials
| Name | Company | Catalog Number | Comments |
| REAGENTS | |||
| Chemicals were ordered from Sigma-Aldrich unless noted otherwise | |||
| Ammonia (stock 25 % solution) | WAKO | 010-03166 | |
| TiO2 10 μm | GL-Science | 5020-75010 | |
| Empore Disk C18 | Varian | 12145004 | |
| Polyethylene glycol(PEG 3350) | Sigma | 88276 | |
| Dextran T500 | Roth | 9219.2 | |
| Trypsin | Promega | V5113 | |
| Protease inhibitor cocktail (PIC) | Sigma | P9599 | |
| K15NO3 | Cambridge Isotope Laboratories | NLM-765-PK | |
| EQUIPMENT | |||
| Optima L-80 XP Ultracentrifuge | Beckman | ||
| Plate reader | BioTek | ||
| EASY-nLC II nano-Liquid Chromatograph | Thermo Scientific | ||
| LTQ-Orbitrap mass spectrometer | Thermo Scientific | ||
| Centrifuge 5810R | Eppendorf | ||
| Centrifuge 5417R | Eppendorf | ||
| Thermomixer | Eppendorf | ||
| Speed Vac RVC 2-25 | Christ | ||
| Shaker Unimax 2010 | Heidolph | ||
References
- Alexandersson, E., Saalbach, G., Larsson, C., Kjellbom, P. Arabidopsis plasma membrane proteomics identifies components of transport, signal transduction and membrane trafficking. Plant Cell Physiol. 45, 1543-1556 (2004).
- Brown, D. A., Rose, J. K. Sorting of GPI-anchored proteins to glycolipid-enriched membrane subdomains during transport to the apical cell surface. Cell. 68, 533-544 (1992).
- Lanquar, V., et al. 15N-metabolic labeling for comparative plasma membrane proteomics in Arabidopsis cells. Proteomics. 7, 750-754 (2007).
- Kierszniowska, S., Walther, D., Schulze, W. X. Ratio-dependent significance thresholds in reciprocal 15N-labeling experiments as a robust tool in detection candidate proteins responding to biological treatment. Proteomics. 9, 1916-1924 (2009).
- Singer, S. J., Nicolson, G. L. The fluid mosaic model of the structure of cell membranes. Science. 175, 720-731 (1972).
- Simons, K., Ikonen, E. Functional rafts in cell membranes. Nature. 387, 569-5672 (1997).
- Baumgart, T., et al. Large-scale fluid/fluid phase separation of proteins and lipids in giant plasma membrane vesicles. Proc. Natl. Acad. Sci. USA. 104, 3165-3170 (2007).
- Silvius, J. R. Partitioning of membrane molecules between raft-and non raft-domains: insights from model membrane studies. Biochim. Biophys. Acta. 1746, 193-202 (2005).
- Tanner, W., Malinsky, J., Opekarova, M. In plant and animal cells, detergent-resistant membranes do not define functional membrane rafts. Plant Cell. , (2011).
- Lauwers, E., Andre, B. Association of yeast transporters with detergent-resistant membranes correlates with their cell-surface location. Traffic. 7, 1-15 (2006).
- Kierszniowska, S., Seiwert, B., Schulze, W. X. Definition of Arabidopsis sterol-rich membrane microdomains by differential treatment with methyl-ß-cyclodextrin and quantitative proteomics. Mol. Cell. Proteomics. 8, 612-623 (2009).
- Simons, K., Toomre, D. Lipid rafts and signal transduction. Nat. Rev. Mol. Cell Biol. 1, 31-39 (2000).
- Maeda, Y., Kinoshita, T. Structural remodeling, trafficking and functions of glycosylphosphatidylinositol-anchored proteins. Prog. Lipid Res. 50, (2011).
- Keinath, N. F., et al. PAMP-induced changes in plasma membrane compartmentalization reveal novel components of plant immunity. J. Biol. Chem. 285, 39140-39149 (2010).
- Stanislas, T., et al. Quantitative proteomics reveals a dynamic association of proteins to detergent resistant membranes upon elicitor signaling in tobacco. Mol. Cell. Proteomics. 8, 2186-2198 (2009).
- Minami, A., et al. Alterations in detergent-resistant plasma membrane microdomains in Arabidopsis thaliana during cold acclimation. Plant Cell Physiol. 50, 341-359 (2008).
- Pauly, M., Eberhard, S., Albersheim, P., Darvill, A., York, W. S. Effects of the mur1 mutation on xyloglucans produced by suspension-cultured Arabidopsis thaliana cells. Planta. 214, 67-74 (2001).
- Jouanneau, J. P., Peaud-Lenoel, C. Growth and synthesis of proteins in cell suspensions of a kinetin dependent tobacco. Physiol. Plant. 20, 834-850 (1967).
- Engelsberger, W. R., Erban, A., Kopka, J., Schulze, W. X. Metabolic labeling of plant cell cultures with K15NO3 as a tool for quantitative analysis of proteins and metabolites. Plant Methods. 2, 1-11 (2006).
- Arsova, B., Kierszniowska, S., Schulze, W. X. The use of heavy nitrogen in quantitative proteomics experiments in plants. Trends Plant Sci. 17, 102-112 (2012).
- Rappsilber, J., Ishihama, Y., Mann, M. Stop And Go Extraction tips for matrix-assisted laser desorption/ionization, nanoelectrospray, and LC/MS sample pretreatment in proteomics. Anal. Chem. 75, 663-670 (2003).
- Olsen, J. V., Macek, B. High accuracy mass spectrometry in large-scale analysis of protein phosphorylation. Methods Mol. Biol. 492, 131-142 (2009).
- Schroeder, M. J., Shabanowitz, J., Schwartz, J. C., Hunt, D. F., Coon, J. J. A neutral loss activation method for improved phosphopeptide sequence analysis by quadrupole ion trap mass spectrometry. Anal. Chem. 76, 3590-3598 (2004).
- Frese, C. K., et al. Improved peptide identification by targeted fragmentation using CID, HCD and ETD on an LTQ-Orbitrap Velos. Journal of Protrome Research. 10, 2377-2388 (2011).
- van Breukelen, B., vanden Toorn, H. W., Drugan, M. M., Heck, A. J. StatQuant: a post-quantification analysis toolbox for improving quantitative mass spectrometry. Bioinformatics. 25, 1472-1473 (2009).
- Zauber, H., Schulze, W. X. Proteomics wants cRacker: Automated standardized data analysis of LC/MS derived proteomic data. J. Proteome Res. 11, 5548-5555 (2012).
- Raffaele, S., Mongrand, S., Gamas, P., Niebel, A., Ott, T. Genome-wide annotation of remorins, a plant-specific protein family: Evolutionary and functional perspectives. Plant Physiol. 145, 593-600 (2007).
- Shah, M. B., Sehgal, P. B. Nondetergent isolation of rafts. Methods Mol. Biol. 398, 21-28 (2007).
- Persaud-Sawin, D. -. A., Lightcap, S., Harry, G. J. Isolation of rafts from mouse brain tissue by a detergent-free method. Journal of Lipid Research. 50, 759-767 (2009).
- Macdonald, L. J., Pike, L. J. A simplified method for the preparation of detergent-free lipid rafts. Journal of Lipid Research. 46, 1061-1067 (2005).
- Mühlhaus, T., Weiss, J., Hemme, D., Sommer, F., Schroda, M. Quantitative shotgun proteomics using a uniform 15N-labeled standard to monitor proteome dynamics in time course experiments reveals new insights into the heat stress response of Chlamydomonas reinhardtii. Mol. Cell. Proteomics. 10, M110.004739 (2011).
- Schulze, W., Usadel, B. Quantitation in mass-spectrometry-based proteomics. Annu. Rev. Plant Biol. 61, 491-516 (2010).
- Foster, L. J., de Hoog, C., Mann, M. Unbiased quantiative proteomics of lipid rafts reveales high specificity for signaling factors. Proc. Natl. Acad. Sci. USA. 100, 5813-5818 (2003).
- Lilley, K. S., Dupree, P. Plant organelle proteomics. Curr. Opin. Plant Biol. 10, 594-599 (2007).
- Sadowski, P. G., Groen, A. J., Dupree, P., Lilley, K. S. Sub-cellular localization of membrane proteins. Proteomics. 8, 3991-4011 (2008).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved