Method Article
Metabólicas etiquetado y de membrana de fraccionamiento para Comparativo Proteómica Análisis de
En este artículo
Resumen
Aquí se describe un método robusto para el fraccionamiento de las membranas de plasma de plantas en las membranas solubles resistentes y detergentes detergente a base de una mezcla de no marcado e in vivo completamente 15 N cultivos de células de Arabidopsis thaliana etiquetados. El procedimiento se aplica para los estudios proteómicos comparativos para entender los procesos de señalización.
Resumen
Microdominios de membrana de plasma son características basadas en las propiedades físicas del entorno de lípidos y esteroles y tienen funciones específicas en los procesos de señalización. La extracción de microdominios de membrana enriquecidos con esteroles a partir de células de plantas para el análisis proteómico es una tarea difícil debido principalmente a múltiples pasos de preparación y las fuentes de contaminación de otros compartimentos celulares. La membrana plasmática constituye sólo alrededor del 5-20% de todas las membranas en una célula de planta, y por lo tanto el aislamiento de la fracción de membrana de plasma altamente purificado es un reto. Un método utilizado con frecuencia implica acuosa de partición de dos fases en glicol de polietileno y dextrano, que produce vesículas de la membrana de plasma con una pureza de 95% 1. Microdominios de membrana rica en esteroles dentro de la membrana de plasma son insolubles tras el tratamiento con detergentes no iónicos en frío a pH alcalino. Esta fracción de membrana resistente al detergente se puede separar de la membrana plasmática a granel por ultracentrifugación en comogradiente ucrose 2. Posteriormente, las proteínas se pueden extraer de la banda de baja densidad de la gradiente de sacarosa mediante precipitación de metanol / cloroformo. Proteína extraída a continuación, se digirió tripsina, se desalaron y finalmente analizado por LC-MS/MS. Nuestro protocolo de extracción para microdominios rica en esteroles está optimizado para la preparación de fracciones de membrana limpias detergente resistentes de cultivos de células de Arabidopsis thaliana.
Utilizamos marcaje metabólico completo de los cultivos celulares suspensión de Arabidopsis thaliana con K 15 NO 3 como única fuente de nitrógeno para los estudios proteómicos comparativos cuantitativos después del tratamiento biológico de interés 3. Mediante la mezcla de iguales proporciones de cultivos de células marcadas y no marcadas para la extracción de proteínas conjunta la influencia de pasos de preparación sobre resultado cuantitativo final se mantiene a un mínimo. También la pérdida de material durante la extracción afectará tanto el control y las muestras de tratamiento de la misma manera, unad, por tanto, la relación entre la luz y el péptido tirón se mantendrá constante. En el método propuesto ya sea marcada o no marcada cultivo celular se somete a un tratamiento biológico, mientras que el otro sirve como control 4.
Introducción
En 1972, Jonathan Singer y Garth Nicolson propusieron el modelo de mosaico fluido un modelo de estructura de las membranas celulares, en sustitución del modelo de sándwich proteína-proteína-lípido que en general se aceptó a principios de 1960. Singer y Nicolson postularon que la membrana biológica puede ser considerado como un líquido de dos dimensiones, donde todas las moléculas de lípidos y de proteínas se difunden libremente y fácilmente 5. Desde ese momento, la estructura del modelo de la membrana plasmática y el conocimiento de la composición de la membrana se hizo aún más complejo. En particular, dentro de la membrana plasmática, se pueden observar estructuras tales como complejos de proteínas y lípidos basados / esterol microdominios estructuralmente desordenados. En membranas modelo artificiales 6,7, esteroles y esfingolípidos pueden separar lateralmente de otras especies de lípidos para formar regiones con características físicas alteradas. Esta segregación dentro de la membrana celular es causada principalmente por las propiedades de auto-asociación entre esteroles y altamente sacadenas de hidrocarburos turated de phopsho-y esfingolípidos 8. En particular, los anillos de esterol rígidos favorecen interacciones con más rígido y especies de lípidos más recta saturados y estas interacciones obligan a cadenas de hidrocarburos vecinos en más conformaciones extendidas, el aumento de grosor de la membrana y la dureza.
Una de las características comúnmente observados de esterol enriquecido microdominios de membrana era su insolubilidad tras el tratamiento con detergentes no iónicos Triton X-100 tales o Brij 35. Estas fracciones se cree que son idénticos a los microdominios de membrana y fueron llamados membranas resistentes a detergentes (DRM) en función de su método de preparación bioquímica 2. El uso de detergentes no iónicos durante la extracción DRM recibió algunas críticas como la preparación DRM bioquímica puede no corresponder directamente a cualquier compartimento de membrana específico dentro de la célula viva 9. Particularmente, el detergente a la proporción de proteína parece crucial en tales preparaciones, unas de diferentes detergentes, así como diferentes cantidades de detergente pueden producir diferente composición de la fracción de membrana resistente al detergente 10. Sin embargo, hay evidencia de que las especies de proteínas particulares se asocian específicamente con estos dominios de membrana rica en esteroles celulares, y que estas proteínas son bien enriquecidas en preparaciones bioquímicas de fracciones de membrana de detergente resistente 11. El núcleo de proteínas que se encuentra en la fracción de DRM de la planta, y para los cuales la presencia de DRMs era esterol dependiente, fueron particularmente proteínas ancladas a GPI, como las proteínas-fasciclin como arabinogalactano (FLAS) y miembros de la familia de proteínas SKU. También se encontraron algunas proteínas de señalización, tales como quinasas o fosfolipasas similares al receptor de 11. Estos resultados son consistentes con muchos estudios proteómicos en microdominios de membrana de mamíferos 12,13. También en las plantas cada vez hay más pruebas para el papel de microdominios de membrana en el contexto de la respuesta de estrés 14 -16.
El protocolo descrito aquí proporciona un método robusto para el fraccionamiento de microdominios de membrana de plasma y en particular utiliza una proteína a la concentración de detergente que nos permite representar las alteraciones inducidas por el estrés de el compartimiento de membrana rica en esteroles 4,11,14.
Protocolo
PROCEDIMIENTO
Reactivos y tampones comunes usados en el protocolo de extracción:
- Medio JPL para la suspensión de cultivos celulares de Arabidopsis thaliana
- 3 M H 3 BO 3
- 3 M MnSO4 x H 2 O
- 1,1 M ZnSO 4 x 7 H 2 O
- 0,15 M KJ
- 0,03 M Na 2 Moo 4 x 2 H 2 O
- 3 nM CoCl2 x 6 H 2 O
- 3 nM CuSO 4 x 5 H 2 O
- 0,9 mM CaCl 2 x 2 H 2 O
- 0,5 mM MgSO 4 x 7 H 2 O
- 0,5 M FeSO4 x 7 H 2 O
- 0,5 M Na 2 EDTA x 2 H 2 O
- 0,12 M de HCl de tiamina
- 0,16 M de ácido nicotínico
- Piridoxina HCl 0,097 M
- 0.107 M NAA
- 0,375 mM KH 2 PO 4
- 0,061 mM NaH2 PO 4 x 2 H 2 O
- 0,039 mM Na 2 HPO 4
- Glicina 0,027 mM
- 0,56 mM myo-inositol
- 1,5% de sacarosa
- 10 mM K 14 NO 3 o 10 mM K 15 NO 3
NOTA: el pH del medio de JPL se debe ajustar a 5,7 con KOH. El medio debe ser esterilizado por filtración o tratamiento en autoclave antes de su uso.
- Tampón H
- 100 mM de HEPES-KOH (pH 7,5)
- 250 mM de sacarosa
- 10% (w / v) de glicerol
- EDTA 5 mM
- Ácido ascórbico 5 mM
- 0.6% (w / v) de PVP K-25 o K-30
- DTT 5 mM (añada fresca)
- 1 mM PMSF (añada fresca)
- inhibidores de la proteasa y fosfatasa (añadir fresca)
- NaF 50 mM
- 1 mM Na 3 VO 4
- 1 mM de benzamidin
- 0,3 M mikrocystin
- 4 M leupeptina
- cóctel inhibidor de la proteasa
- Buffer R
- Fosfato de potasio 5 mM
- 0,33 M de sacarosa
- 3 mM de KCl
- EDTA 0,1 mM
- DTT 1 mM (añada fresca)
- Tampón TNE
- 25 mM de Tris-HCl, pH 7,5
- 150 mM de NaCl
- EDTA 5 mM
- El sistema de dos fases (6 g-sistema es adecuado para un máximo de 15 g de la muestra el peso fresco) Método de preparación
En 15 ml Falcon ingredientes de la mezcla del tubo se indican a continuación y mezclar bien:- 20% (w / w) de dextrano T500 - 2,6 g
- 40% (w / w) de poli (etilenglicol) (PEG 3350) - 1,3 g
- sacarosa - 0,678 g
- 0,2 M de fosfato de potasio, pH 7,8 a 0,15 ml
- 2 M de KCl - 0.014 ml
- añadir agua hasta que la masa total del sistema de dos fases es de 6 g.
- Soluciones de sacarosa en tampón TNE
- 2,4 M, 1,6 M, 1,4 M, 0,15 M
- Reactivos para la digestión con tripsina
- UTU: 6 M de urea, 2 M tiourea (pH 8,0 con Tris-HCl 10)
- Buffer de Reducción (1 mg / l de DTT en agua; 6,5 mM)
- Buffer de alquilación (5 mg / l de yodoacetamida en agua; 27 mM)
- LysC endopeptidasa (0,5 mg / l)
- Tripsina, modificado la secuencia grado (0,4 mg / l)
- Reactivos para la desalación del péptido más de C 18
- solución de resuspensión: ácido 2% trifluoroacético (TFA), acetonitrilo 5% en agua
- Solución A: ácido acético al 0,5%
- solución B: acetonitrilo al 80%, ácido acético 0,5%
- Reactivos para el enriquecimiento phosphopeptide
- Solución A: 0,1% de TFA, 5% de acetonitrilo
- Solución B: 0,1% de TFA, 80% de acetonitrilo
- De TiO 2 10 micras
- Amoníaco (solución madre al 25%)
- Piperidina (Disponible 100%)
PROTOCOLOS
1. Marcaje metabólico de Arabidopsis thaliana suspensión celular culturas
- Crecer Arabidopsis Col-0 célulacultivos en suspensión derivadas de las hojas 17 en un medio completo 14 N-JPL (18; véase la sección "Reactivos y tampones comunes") y un conjunto de culturas en medio 15 N-JPL en frasco estéril en condiciones de luz constante en 80 a 100 mmol / m 2 s, 23 ° C, bajo agitación constante a 120 rpm.
- Para mantener los cultivos celulares, inocular 400 ml de medio JPL fresca con 40 ml de los siete cultura día celular viejo en frascos de 1 L.
- La recolección de cultivos de células se produce a través de la succión del vacío a través de un embudo de vidrio de ancho con una malla de acero inoxidable. Las células se acumulan en la placa de malla y en el embudo y pueden ser fácilmente recogidos de allí. Las células se recomiendan para ser congeladas a -80 ° C o en nitrógeno líquido antes de la molienda.
NOTA: Para 15 N cultivos de células marcadas metabólicamente utilizan el K 15 N º 3 como la única fuente de nitrógeno para al menos dos pasajes durante dos semanas 19. En experimentos para proteómica comparativa, use un cultivo celular etiquetada 15 N y también mantienen una cultura sin etiqueta en un medio normal. El tratamiento biológico se aplicará entonces a la cultura, ya sea marcado o no marcado, mientras que el otro sirve como control (Figura 1). Para la preparación de proteínas, las dos culturas se combinarán 20. Al planificar la configuración experimental, se recomienda considerar un ajuste de etiquetado recíproco 4 en el que se aplica el mismo tratamiento una vez a las células marcadas N-15 y una vez que las células no marcadas y el respectivo sin etiqueta o 15 células N-etiquetados sirven como controles. En este caso, se necesitan las cantidades dobles de cultivos de células.
2. Membrana plasmática La purificación
NOTA: Todos los pasos adicionales se llevan a cabo en la sala de frío y / o en el hielo a menos que se indique lo contrario.
- Homogeneizar las células de alrededor de 1 l de cultivos en suspensión de células 7 días de edad en nitrógeno líquido.El material se puede almacenar a -80 ° C hasta su uso posterior.
- Mezclar las mismas cantidades de cultivos celulares congelados etiqueta y etiqueta basado en el peso fresco en un vaso de precipitados y añadir 2 volúmenes de tampón H inmediatamente. En caso de la preparación de microdominios de membrana se sugiere utilizar al menos 7 g de peso fresco de ambas células marcadas y no marcadas.
- Colocar el vaso en un agitador y agitar hasta que el material se funde y la solución es líquido y sin cristales de hielo.
- Filtrar el homogenato a través de una capa de Miracloth en tubos de 50 ml de centrífuga.
- Muestras de equilibrio con tampón H y centrifugar a 10000 g durante 8 min.
- Cargue el sobrenadante en tubos ultra-centrífuga pre-enfriado (por ejemplo, para el rotor Beckman Coulter SW31Ti), con un volumen de unos 32 ml
- Muestras de equilibrio con tampón H y sedimentar los microsomas por centrifugación a 100.000 xg a 4 ° C durante 30 minutos usando rotor Beckman SW32Ti.
- Eliminar el sobrenadante después de la centrifugación.
NOTA: El sobrenadante contiene las proteínas solubles. Una pequeña cantidad de esta fracción se puede guardar para su posterior precipitación de proteínas y análisis posterior también de proteínas solubles.
- Resuspender el sedimento de membrana de cada muestra respectiva en cantidad de tampón R y cargar en la parte superior del sistema de dos fases U1 (Figura 2). Si se utiliza el sistema de dos fases 6 g, cargar exactamente 2 g de sedimento de membrana resuspendido.
NOTA: El volumen final de tampón R depende del tamaño del sistema de dos fases que se van a utilizar (~ 1,6 ml de tampón R se necesita cuando se utiliza 6 g del sistema). Se recomienda usar menos memoria intermedia para la resuspensión de manera tampón puro se puede añadir en sistema de dos fases para obtener el peso exigido, en lugar de usar demasiado tampón para solubilización y no ser capaz de cargar toda la muestra en el sistema de dos fases.
- Cargar el mismo volumen de tampón puro R tal como se utiliza para the muestra de resuspensión en U2.
- Mezcle lentamente tubos U1 y U2 invirtiendo ellos 30x (aproximadamente 1 inversión / seg).
NOTA: No agitar enérgicamente el sistema de dos fases. Se puede causar una falta de separación de las fases en la etapa de ultracentrifugación.
- Centrifugar las muestras a 1500 xga 4 ° C durante 10 min.
- Eliminar el sobrenadante después de la centrifugación.
- Transferir la fase superior de U1 en U2 y repetir la centrifugación a 1500 xga 4 ° C durante 10 min.
- Mueva la fase superior de U2 en los tubos de ultracentrífuga SW41Ti y diluirlo con cinco volúmenes de tampón I y mezclar bien.
NOTA: La fase superior final puede tener que ser dividido en tubos de ultracentrífuga separados antes de que pueda ser diluida cinco veces.
- Centrifugar las muestras a 200.000 xg a 4 ° C durante una hora usando el rotor SW41Ti.
- Resuspender sedimento de membrana en Small cantidad de tampón TNE (típicamente se utiliza 200 l de tampón) para el aislamiento de las membranas resistentes a los detergentes.
NOTA: Una pequeña cantidad de esta fracción se pueden guardar para el análisis de la membrana plasmática no fraccionada.
NOTA: La fracción de membrana de plasma se puede almacenar a 4 ° C durante la noche antes del fraccionamiento en las membranas resistentes a detergentes y fracciones solubles en detergente.
3. Detergente Resistente Preparación de la membrana
- Comprobar la concentración de la fracción de membrana de plasma mediante el ensayo de Bradford.
- Añadir Triton X-100 a la fracción de membrana de plasma. La concentración final de detergente debe estar entre 0,5 a 1%. El detergente en peso de proteínas en relación al peso debe mantenerse entre 13-15.
- Muestras Shake en torno a 100 rpm a 4 º C durante 30 min.
- Añadir tres volúmenes de 2,4 M de sacarosa a un volumen de la membrana de plasma tratado para obtener 1,8 M de concentración final de sacarosa.
- Preparar el gradiente de sacarosa en tubos de ultracentrífuga SW41Ti por la carga de las respectivas soluciones de sacarosa en la parte superior de la fracción 1,8 M como se ilustra en la Figura 3.
- Centrifugar las muestras a 250.000 xg a 4 ° C durante 18 horas utilizando el rotor Beckman SW41Ti.
- Retire con cuidado los tubos de ultracentrífuga del rotor para evitar la interrupción de la banda de baja densidad, que puede ser visible como un anillo de lechosa en la interfaz de 0,15 M/1.4 M de sacarosa. A veces no se ve nada, pero la fracción todavía contiene la fracción proteica resistente detergente.
- Eliminar la fracción de 0,75 ml de volumen de la parte superior del gradiente. Las fracciones 2 y 3 que cubren volumen de alrededor de 1,5 ml por encima del anillo de interfase y 0,5 ml por debajo representan la fracción de membrana resistente al detergente. Reunir estas fracciones en 15 ml tubos Falcon. Las fracciones 9 y 10 contienen la fracción de membrana soluble en detergente y también pueden ser recogidos para la comparación. Para un análisis más detallado, piscina fractiones 2 y 3, así como las fracciones 9 y 10.
4. Extracción de proteínas de la fracción de detergente resistentes por metanol / cloroformo
NOTA: Todas las etapas se llevan a cabo en la temperatura ambiente.
- Añadir 4 volúmenes de metanol para las fracciones recogidas y mezclar bien.
- Añadir 1 volumen de cloroformo y agitar bien.
- Añadir 3 volúmenes de agua, mezclar bien.
- Centrifugar las muestras a 2000 xg durante 5 min utilizando una centrífuga de sobremesa (por ejemplo, Eppendorf 5417R).
- Retirar la fase acuosa por encima de la capa de proteína en la interfase.
- Añadir 3 volúmenes de metanol, mezclar bien.
- Centrifugar las muestras a 4000 xg durante 10 min.
- Eliminar el sobrenadante y secar el pellet. El precipitado seco está listo para la digestión en solución.
5. En solución de tripsina digestión
NOTA: En este procedimiento, todas las medidas se realizan atemperatura ambiente para reducir la derivatización no deseada de aminoácidos cadenas laterales por los desnaturalizantes.
- Disolver la muestra en pequeño volumen de 6 M urea, 2 M thiurea, pH 8 (UTU). Utilice un precio tan bajo volumen que no entorpezca la muestra (generalmente aproximadamente 40 l).
- Muestras de Spin solubilizados en UTU a 5.000 xg en una centrífuga de sobremesa (por ejemplo, Eppendorf 5417R) durante 10 min para sedimentar cualquier material insoluble.
- El pH de la solución final debe estar cerca de 8,0 para la digestión óptima de la tripsina. Consulte con tiras de pH.
- Añadir 1 l de tampón de reducción por cada 50 g de proteína de la muestra e incubar 30 min a temperatura ambiente.
NOTA: Sólo una estimación aproximada del contenido de proteína es necesaria. Cuando la cantidad de muestra es limitado, es mejor sacrificar la precisión en lugar de perder la muestra en un ensayo de proteínas.
- Añadir 1 l de tampón de alquilación para cada proteína de la muestra 50 g e incubar 20 min a temperatura ambiente en la oscuridad.
- Añadir 0,5 l de LysC por 50 g de proteína de la muestra y se incuba durante tres horas a temperatura ambiente con agitación constante a 700 rpm. Si es necesario, el producto de digestión también se puede llevar a cabo durante la noche. Sin embargo, no se recomienda el tiempo extendido a temperaturas cálidas, ya que puede aumentar la pérdida de péptidos debido a la adsorción de material del tubo de plástico debajo acuosas pH 8 condiciones.
- Diluir la muestra con cuatro volúmenes de 10 mM de Tris-HCl, pH 8.
NOTA: Este paso es absolutamente necesario para diluir la concentración de urea como tripsina es muy sensible a la alta concentración de sal.
- Añadir 1 l de tripsina por 50 g de proteína de la muestra y se incuba durante la noche a temperatura ambiente con agitación constante a 700 rpm.
- Acidificar las muestras a 0,2% de TFA concentración final para alcanzar un pH 2 (añadir aproximadamente 1/10 de volumen de ácido trifluoroacético 2%).
NOTA: Las muestras pueden ser almacenadas a - 20 ° C hasta su uso ulterior, pero es mejor para almacenarellos en StageTips a 4 ° C si es por un corto tiempo (una semana) o almacenarlos después StageTips desalado.
6. Fabricación de C 18-StageTips
- Coloque un disco de C18 Empore sobre una superficie plana y limpia, como un plástico desechable placa de Petri.
- Perfore un pequeño disco con una aguja hipodérmica de punta roma con diámetro de 1,5 mm. El disco se pega en la aguja y puede ser transferido a una punta de pipeta.
- Empuje el disco de la aguja y fijarlo en el estrechamiento de una punta de pipeta por un pedazo de sílice o de los accesorios en el interior de la aguja de la tubería fundida.
NOTA: StageTips se pueden almacenar en seco a temperatura ambiente 21.
7. El uso de C 18-StageTips para Péptido Desalación y concentración
- Acondicionar un C-18 StageTip colocando 50 l de solución B a la StageTip preparado. Gire la punta en la centrífuga a 2000 rpm durante 2 minutos en una mesa de trabajo centrifuge (por ejemplo, Eppendorf 5417R).
NOTA: Use los adaptadores para hacer girar StageTips en una centrífuga Eppendorf, líquido será recogida en un tubo de reacción de 2 ml. Para preparaciones a gran escala, consejos de etapa también se pueden colocar en un bastidor de punta con 96 de los 200 l consejos y el líquido pueden ser recogidas en una placa de microtitulación.
NOTA: No utilizar velocidades más altas que 3.000 xg en una centrífuga de sobremesa (por ejemplo, Eppendorf 5417R) debido al riesgo de hacer girar el disco de C 18 de la punta.
- Equilibre la StageTip usando 100 l solución A. Gire la punta en la centrífuga a 5000 xg en una centrífuga de mesa (por ejemplo, Eppendorf 5417R).
- Repita el paso 2.
- Cargue la muestra en el disco con la pipeta cuidadosamente la muestra en la punta de la pipeta con el disco dentro.
NOTA: Un disco puede unirse aprox. 100 g de proteína.
- Haga girar los consejos en el centrifuge hasta que todo el volumen de la muestra pase a través del disco de C 18.
- Lávese las StageTips dos veces con 100 l de solución A. girar los consejos en la centrífuga.
NOTA: Los StageTips lavadas y cargados se pueden almacenar a 4 ° C durante hasta una semana.
- Eluir muestra con 40 l de la solución B. Recoger el eluido en un tubo nuevo 1,5 ml de reacción.
- Concentrar la muestra en el Speed Vac. En condiciones ideales, detenga el proceso de deshidratación ya que no se trata sólo de 1 o 2 l de líquido izquierda.
NOTA: Secado muestras se pueden almacenar en el -80 º C durante años.
- Añadir un volumen final de 9 l de solución de resuspensión a la muestra y la transfiere a la placa de microtitulación para el análisis de espectrometría de masas.
NOTA: El volumen final de la memoria intermedia de resuspensión utilizado depende de las necesidades de experimentador y la sensibilidad del espectrómetro de masasutilizado.
8. Protocolo alternativo para fosfopéptido Enriquecimiento
NOTA: Para el enriquecimiento de fosfopéptidos, la extracción de proteína en el paso 2 se debe hacer en la presencia de inhibidores de la fosfatasa.
NOTA: La concentración de proteína exacta no tiene que ser determinada por los siguientes pasos. Es suficiente tener una estimación aproximada del contenido de proteína para evitar la pérdida innecesaria de la muestra
- Prepare el C8-StageTips (sigue el mismo protocolo para la preparación de C 18-StageTips en el paso 6).
- Transferencia de 1 mg de TiO 2-perlas a la parte superior de preparados C 8-StageTips (uso de 1 mg de TiO 2 por 100 g de proteína).
- Equilibrar las TiO2-tips con 100 l de solución C, centrifugado a 2000 xg durante 5 minutos en una centrífuga de mesa (por ejemplo, Eppendorf 5417R).
- Mezclar 100 g de péptidos digeridos y desalado del paso 7.7 (que debe estar en 100 l de soluciónB) con 100 l de la solución A.
- Cargue muestra mixta en las equilibradas TiO2 columnas; centrifugado a 1000 xg, 5 min.
- Recoger el filtrado y cargarla en la misma punta de nuevo (mantener el flujo a través después del segundo pase).
- Lave la punta con 100 l de solución A; giran a 2.000 xg, 5 min en una centrífuga de mesa (por ejemplo, Eppendorf 5417R).
- Eluir muestra con 50 l de 5% de amoniaco.
- Eluir muestra con 50 l de 5% de piperidina (ambos eluidos se pueden combinar).
- Se acidifica inmediatamente la muestra con 50 l de ácido fosfórico al 20%. pH debe estar en torno al 2.
NOTA: Guarde los TiO2 consejos y recuperar el polvo. Se puede lavar con la solución B y se utiliza de nuevo para una o dos rondas más.
- Una vez más desalar muestras acidificadas sobre C 18 consejos (véase el paso 8).
9. LC-MS/MS Análisis de Mezclas de Péptidos
- Resuspender fosf desaladaopeptides en tampón de resuspensión.
- Cargar resuspendió la muestra en el sistema LC-MS/MS de elección y adquisición de espectros en modo depende de los datos en el sugerido resolución de 60.000 anchuras a media altura.
NOTA: Para la fragmentación óptima, ya sea escaneado neutro pérdida debe ser aplicado 22, o si se dispone de la activación de varias etapas 23. Si ETD disponible, se permite la fragmentación esqueleto peptídico sin pérdida de ácido fosfórico 24.
NOTA: Las listas de pico a partir de los datos en bruto deben ser extraído y sometido a la base de datos de identificación, así como para la cuantificación. Aquí se describe la configuración para utilizar la mascota y MSQuant, que trabaja para los archivos de datos en bruto de LTQ, LTQ-Orbitrap e instrumentos LTQ-FT (Thermo Scientific).
- Extracto lista pico usando DTAsupercharge dentro del menú "Helper" en MSQuant. Utilice la configuración predeterminada.
- Enviar resultante pico lista de archivos de motor de búsqueda de la mascota. Crajustes itical: precursores de iones de masa tolerancia de 10 ppm, MS / MS tolerancia de masa 0,5 Da. Modificaciones fijos: carbamidomethylation de cisteínas, modificaciones variables: oxidación de la metionina, la fosforilación de serina, treonina, tirosina. Método de cuantificación: 15 N marcaje metabólico.
- Ahorra Mascot resultado como archivo de página web.
- Cargue el archivo de la mascota del resultado y de archivos en bruto en MSQuant. Seleccione todas las proteínas de interés y ejecutar "cuantificación automática". El programa leerá espectros de barrido completo desde el archivo RAW y hacer pico de la integración de socios de etiqueta y etiqueta de cada péptido.
- Resultados de cuantificación de exportación a un programa de hoja de cálculo o un archivo de texto delimitado por tabuladores. Los datos pueden ser sometidas a un análisis más profundo estadística en Excel o con otros paquetes de software tales como Statquant 25 o Cracker 26.
Resultados
Con el protocolo presentado usando cultivos de células de Arabidopsis marcadas metabólicamente que es posible aislar las membranas plasmáticas a partir de tejido de la planta (paso 2, las Figuras 2 y 4), y para enriquecer resistente a detergentes fracciones de membrana dentro de la membrana de plasma (paso 3, las Figuras 3 y 5). Posteriormente, el protocolo permite la extracción de proteínas a partir de estos resistentes a detergentes fracciones de la membrana (paso 4) y la digestión de la proteína para el análisis proteómico comparativo (paso 5). Por último, el enriquecimiento opcional de fosfopéptidos (paso 8) es particularmente interesante en el estudio de los procesos de señalización celular. El último paso es entonces el análisis de datos cuantitativos (paso 9, Figura 6) de las relaciones de la abundancia de proteínas en fracciones de membrana de cultivo celular marcado y no marcado.
Los resultados típicos después de la mezcla del sistema de 2 fases (etapa 2) y posterior centrifugación son un claro fase superior de color y unverde coloreado fase inferior (Figura 2). Vesículas de membrana de plasma preferentemente asocian con la fase de PEG superior, mientras que las vesículas de membrana de los cloroplastos verdes y otras membranas interiores se incorporan en la fase de dextrano inferior. Si la separación de colores no se puede observar, el paso 2 no se llevó a cabo correctamente y membranas plasmáticas será contaminado con cantidades significativas de membranas internas. Enriquecimiento de proteínas de la membrana de plasma puede ser demostrado por el análisis proteómico de pequeñas alícuotas de las fracciones de membrana de plasma y proteínas en la fase inferior del sistema de dos fases. La fase inferior contiene las membranas internas de la célula. Por ejemplo, proteínas de la membrana particularmente típico conocido de plasma, tales como las proteínas de receptor de quinasa mostraron alta abundancia en la fracción de membrana plasmática (PM) y baja abundancia en la fracción de fase inferior (Figura 4A) que contiene las membranas internas (IM). A su vez, las proteínas conocidas de la serie retículo endoplasmático altala abundancia en la fracción de membrana interna y no se observaron en la fracción de membrana plasmática (Figura 4B).
El enriquecimiento ulterior de fracciones de membranas resistentes a detergentes (paso 3) en el caso ideal como resultado la formación de un anillo lechoso de baja densidad vesículas de membrana en aproximadamente 1/5 de la altura del tubo (Figura 3). Si el ajuste de Triton X-100 concentraciones o el detergente a la proporción de proteína (paso 3.2) es óptima para la separación en resistente a detergentes y detergentes fracciones solubles, anillos adicionales pueden ser observados en las partes inferiores del gradiente y también habrá grupos de membrana en la banda de baja densidad. En estos casos, el detergente a la proporción de proteína o la cantidad total de detergente es diferente de la concentración micelar crítica necesaria para la separación reproducible de las dos fracciones de dominio de membrana. Uso de la concentración final de detergente y un detergente a la proporción de proteína descrito aquí, Enrichment de proteínas microdominio típicos, tales como remorin (AT3G61260) 27 podría ser confirmado por un análisis comparativo de espectrometría de masas de la fracción de DRM, fracción soluble en detergente (paso 3.8), así como la membrana plasmática y las membranas internas no fraccionada. La más alta abundancia de la proteína remorin se encuentra en las fracciones de DRM como se esperaba (Figura 6A). Las proteínas no presentes en los microdominios de membrana, como el AT1G59870 ABC-transportador (Figura 6B), no muestran un aumento de la abundancia en la fracción DRM. También contaminantes típicos, como una proteína mitocondrial (AT2G07707) del complejo ATPasa F0 (Figura 6C) y la proteína ribosomal (At1G001100) del ribosoma 60S (Figura 6D) no muestran una abundancia enriquecido en la fracción de DRM, aunque cantidades mínimas pueden aún por identificar.
Después de abundancias análisis espectrométrico de masas, la proteína proporciones de estado de fosforilación de proteínas en el plasmafracciones de membrana de cultivos de células marcadas y no marcadas se pueden distinguir cuantitativamente (Figura 6). Los resultados típicos de la MSQuant ( msquant.alwaysdata.net ventana de cuantificación) deberían mostrar una relación de intensidad de iones de uno a uno para la mayoría de los péptidos identificados (Figura 6A). Esos péptidos con relación de intensidad de iones desviarse significativamente de 1:1 se consideran como diferencial regulada entre el cultivo celular marcado y no marcado, y son candidatos para la adaptación a proteínas afectadas por el tratamiento aplicado (Figura 6C). Un buen control de calidad de marcaje metabólico con éxito es el co-elución de tanto la etiqueta y versiones péptido no marcado como un solo pico en la separación de nano-HPLC (paso 9) como se muestra en las figuras 6B y D.

Figura 1. Estrategia experimental Metabólicas etiquetado. Representación esquemática de dos variantes de diseño experimental al utilizar cultivos de células sin etiqueta A. thaliana totalmente etiquetados y metabólica. El experimentador puede decidir, o bien utilizar 14 N células (sin etiqueta) como un control y 15 N (células marcadas metabólicamente) que se someten a tratamiento biológico o viceversa. En un diseño experimental recíproca ambas variantes se llevan a cabo en paralelo.

Figura 2. De flujo de trabajo para la separación de las vesículas de membrana planta en un sistema acuoso de dos fases basado en polietilenglicol (PEG) y dextrano. Vesículas de membrana de plasma separada en fase de PEG superior mientras cloroplasto y otras membranas interiores asociados con la Bottfase de dextrano OM después de la centrifugación. Con el lavado adicional de la fase superior mejor purificación se puede lograr, pero la pérdida de material también se incrementa.
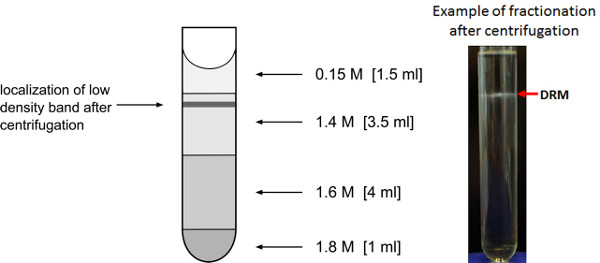
Figura 3. El enriquecimiento de las fracciones de membrana de baja densidad. Representación de gradiente de sacarosa para el enriquecimiento de las fracciones de membrana resistente a detergentes de baja densidad. La ubicación se esperaba después de la centrifugación durante la noche de la banda de vesículas de membrana de baja densidad se indica.

Figura 4. Enriquecimiento de proteínas de membrana de plasma después de la purificación en el sistema de dos fases. Normalizadointensidades de iones de proteína para las proteínas medidos en membrana plasmática (PM) y las membranas internas (IM) fracción. (A) componentes conocidos típicos de membrana plasmática muestran mucho mayor abundancia en la fracción de PM que en la fracción de mensajería instantánea. componentes (B) naturales conocidas de membranas internas muestra el comportamiento opuesto. Para la normalización, sumas de intensidad de iones para cada proteína se expresaron como una fracción de la intensidad iónica total por muestra y se promedian entre repeticiones. Fracción de las intensidades de iones totales se expresó como relación con el promedio entre los dos tratamientos. Las barras de error representan la desviación estándar de las tres preparaciones de cultivos de células cultivadas de forma independiente. Haga clic aquí para ver más grande la figura .

Figura 5. . Abundancia de marcadores de proteínas estándar dentro de fracciones medidas Parcelas representan la distribución de intensidades normalizadas de iones de proteína de marcadores proteicos elegidos a determinados compartimentos subcelulares (DRM - microdominios ricos en esteroles, PM - membrana plasmática, IM - membranas internas, SP - proteínas solubles). Patrones de abundancia de (A) remorin como un marcador para microdominios de membrana rica en esteroles, (B) de tipo ABC proteína de la familia del transportador como un representante de una proteína no esterol-dependiente, (C) de la subunidad de complejo F0 mitocondrial, (D) 60S subunidad de los ribosomas como un típico contaminante co-purificador. Para la normalización, sumas de intensidad de iones para cada proteína se expresaron como una fracción de la intensidad iónica total por muestra y se promedian entre repeticiones. Fracción de las intensidades de iones totales se expresó como relación con el promedio entre los dos tratadosAjus. Las barras de error representan la desviación estándar de las tres preparaciones de cultivos de células cultivadas de forma independiente. Haga clic aquí para ver más grande la figura .
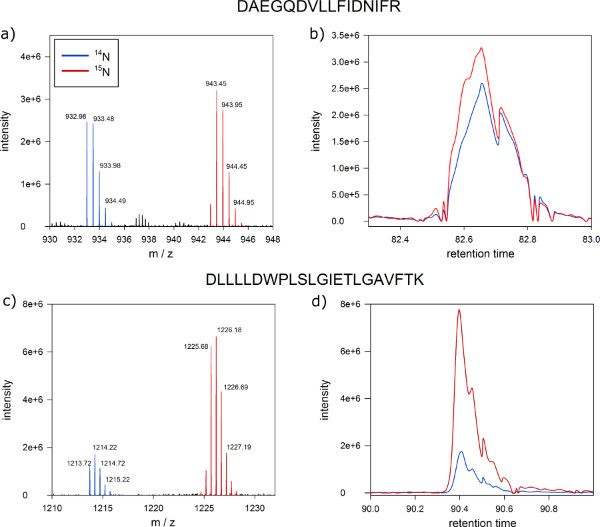
Figura 6. Resultados esperados de la proteína cuantitativa espectrometría de masas. Captura de pantalla de MSQuant que muestra la relación de 01:01 intensidad de iones se espera de un péptido a partir de una mezcla 01:01 de extractos de proteínas de la etiqueta y células de Arabidopsis no marcados. (A) espectro de exploración completa de DNNLLGK péptido claramente que separa la etiqueta (pico a la derecha) y sin marcar versión (pico de la izquierda) de los péptidos en el eje m / z. La masa monoisotópico y el primer isótopo se indican con marcas azules. (B) con etiqueta (azul) unad no marcados (rojo) versiones del péptido co-eluyen como un solo pico durante la cromatografía de nano-HPLC. (C) espectro de exploración completa de un péptido con una relación de intensidad de iones de 01:05 como un candidato para una proteína diferencialmente regulado. (D ) También las proteínas con diferentes proporciones de 1:1 coeluyen en la cromatografía de fase inversa. Haz click aquí para ver más grande la figura .
Discusión
El protocolo se presenta en este documento contiene muchos pasos y todos ellos son cruciales para obtener el fraccionamiento pura y representante de la membrana plasmática de plantas resistentes a las membranas de detergente y fracciones solubles detergentes. Por lo tanto, es importante seguir cada paso como se indica.
El tratamiento de la fracción de membrana de plasma con detergente no iónico (paso 3.2) tiene la mayor influencia en la calidad de la membrana de microdominios de fraccionamiento. Para obtener resultados reproducibles entre diferentes preparaciones, y para ser capaz de comparar las diferentes muestras del mismo experimento, es muy importante evaluar con precisión la concentración de proteínas en la membrana plasmática y para aplicar el detergente siempre en la misma proporción con respecto al contenido de proteínas y siempre a la misma concentración final. Prácticamente, esto significa que a veces es necesario diluir las muestras con alta concentración de proteínas o para usar diferentes poblaciones de concentraciónde Triton X-100.
En estudios bioquímicos, recientemente ha habido una tendencia entre los investigadores a utilizar un método libre de detergente para el aislamiento de microdominios de membrana 28-30. Estos métodos se basan en una alteración mecánica de la membrana plasmática por cizallamiento a través de una aguja muy pequeña en analogía a la prensa francesa celda de presión. Estos procedimientos se han aplicado con éxito a los cultivos celulares de mamíferos ricos en microdominios de membrana, pero la aplicación de la pared celular que contiene organismos (levaduras, células vegetales) no se ha denunciado. El uso de la proteómica cuantitativa junto con agentes de esterol de alteración, tales como metil-beta-ciclodextrina, se demostró que las fracciones de DRM preparados a partir de membrana de plasma de plantas no contienen proteínas que son marcadores para microdominios de membrana 11.
En cuanto a los resultados finales de la cuantificación de espectrometría de masas, los resultados típicos se muestran en la Figura 6 representan la situación ideal enque la intensidad de iones para la mayoría de los péptidos etiqueta y etiqueta están cerca de idéntica. Sin embargo, en algunos casos puede observarse un cierto grado de variación biológica entre los conjuntos de cultivos de células marcadas y no marcadas. Por lo tanto, antes del tratamiento biológico de cualquiera de etiquetado o de cultivo de células no marcado se lleva a cabo, el análisis de una mezcla de células de control marcados y no marcados, tanto sin ningún tratamiento, permite la identificación de péptidos con una proporciones divergentes desde el ideal para una situaciones. Estas proteínas con relaciones divergentes son indicaciones de la variación biológica. Para superar el desafío de los efectos del tratamiento distintivas de la variación biológica, por lo tanto, proponemos utilizar el etiquetado de reciprocidad en los experimentos pareados 20. En la configuración experimental de reciprocidad, se llevan a cabo las dos variantes del experimento como se propone en la Figura 1 y las etapas del protocolo se siguen como se describe. A continuación, se comparan los ratios de intensidad de iones de proteins de tanto de los experimentos recíprocos, se puede distinguir si las diferencias entre las relaciones de intensidad de iones se deben a la variación biológica o como un efecto del tratamiento aplicado.
Otro método para abordar el problema de diferenciación entre los efectos del tratamiento y la variación biológica es el uso de un estándar marcado interno como referencia para todos los tratamientos 31. En este enfoque, el control sin marcar y células no marcadas que se someten a tratamiento biológico se mezclan con la misma cantidad de células de control etiquetados pesados, procedente del mismo lote. Permite la eliminación de la influencia de la variación biológica en relación de péptido, porque las proteínas son considerados como significativos, si los ratios de intensidad de iones de 14 N-de control / 15 N-control y 14 N-tratamiento / control de la N-15 son significativamente diferentes. Esto es posible, ya que el estándar marcado es exactamente el mismo en todos los casos.
Uno de los drawbacks del procedimiento de enriquecimiento DRM descrito aquí están las proteínas co-purificación que se pueden identificar en la fracción de membrana resistente al detergente. En la lista de las proteínas identificadas a partir de la fracción de membrana resistente al detergente de baja densidad, podemos observar regularmente un gran número de proteínas ribosomales. Debido a la densidad relativamente baja de las proteínas ribosomales, que migran en la misma fracción como proteínas de la membrana dependientes de esterol en el gradiente de sacarosa. Se ha demostrado sin lugar a dudas que las proteínas ribosomales claramente no sean componentes de microdominios de membrana 11. Para excluir estas y otras proteínas de co-purificación en realidad no asociados con las fracciones de membrana de baja densidad resistente a detergentes, nos proponemos analizar también la composición proteómico de las membranas intracelulares (IM) que se pueden extraer de la fase de dextrano inferior de los dos- sistema de fase y para comparar las proporciones de abundancia de contaminantes putativo entre la membrana interna y la DRMfracción (ver ejemplos en la Figura 5). Proteínas DRM-co-purificación deberían tener abundancias similares en ambas fracciones (IM y DRM).
Fraccionamiento de extractos celulares y microdominios de membrana es una estrategia común para reducir la complejidad en una muestra para el análisis proteómico 32. Por lo tanto, el protocolo descrito aquí es útil para todos los estudios de los procesos de señalización en la membrana plasmática de las células vegetales. Las aplicaciones biológicas son en el estudio de las respuestas de estrés, así como infecciones por patógenos que todo a un alto grado inducen alteraciones en la composición de la membrana plasmática y la modificación de proteínas de membrana 14,15. Además de estudiar las respuestas al estrés, la cuantificación de la abundancia de proteínas en diferentes fracciones de membrana puede ser de gran ayuda la anotación de las proteínas hasta ahora desconocidas 33 34,35.
Divulgaciones
Los autores declaran que no tienen intereses financieros en competencia.
El autor, Witold Szymanski, es un empleado del Instituto Max Planck de Fisiología Molecular de Plantas. El autor, Waltraud Schulze es un empleado de la Universidad de Hohenheim, Alemania.
Materiales
| Name | Company | Catalog Number | Comments |
| REAGENTS | |||
| Chemicals were ordered from Sigma-Aldrich unless noted otherwise | |||
| Ammonia (stock 25 % solution) | WAKO | 010-03166 | |
| TiO2 10 μm | GL-Science | 5020-75010 | |
| Empore Disk C18 | Varian | 12145004 | |
| Polyethylene glycol(PEG 3350) | Sigma | 88276 | |
| Dextran T500 | Roth | 9219.2 | |
| Trypsin | Promega | V5113 | |
| Protease inhibitor cocktail (PIC) | Sigma | P9599 | |
| K15NO3 | Cambridge Isotope Laboratories | NLM-765-PK | |
| EQUIPMENT | |||
| Optima L-80 XP Ultracentrifuge | Beckman | ||
| Plate reader | BioTek | ||
| EASY-nLC II nano-Liquid Chromatograph | Thermo Scientific | ||
| LTQ-Orbitrap mass spectrometer | Thermo Scientific | ||
| Centrifuge 5810R | Eppendorf | ||
| Centrifuge 5417R | Eppendorf | ||
| Thermomixer | Eppendorf | ||
| Speed Vac RVC 2-25 | Christ | ||
| Shaker Unimax 2010 | Heidolph | ||
Referencias
- Alexandersson, E., Saalbach, G., Larsson, C., Kjellbom, P. Arabidopsis plasma membrane proteomics identifies components of transport, signal transduction and membrane trafficking. Plant Cell Physiol. 45, 1543-1556 (2004).
- Brown, D. A., Rose, J. K. Sorting of GPI-anchored proteins to glycolipid-enriched membrane subdomains during transport to the apical cell surface. Cell. 68, 533-544 (1992).
- Lanquar, V., et al. 15N-metabolic labeling for comparative plasma membrane proteomics in Arabidopsis cells. Proteomics. 7, 750-754 (2007).
- Kierszniowska, S., Walther, D., Schulze, W. X. Ratio-dependent significance thresholds in reciprocal 15N-labeling experiments as a robust tool in detection candidate proteins responding to biological treatment. Proteomics. 9, 1916-1924 (2009).
- Singer, S. J., Nicolson, G. L. The fluid mosaic model of the structure of cell membranes. Science. 175, 720-731 (1972).
- Simons, K., Ikonen, E. Functional rafts in cell membranes. Nature. 387, 569-5672 (1997).
- Baumgart, T., et al. Large-scale fluid/fluid phase separation of proteins and lipids in giant plasma membrane vesicles. Proc. Natl. Acad. Sci. USA. 104, 3165-3170 (2007).
- Silvius, J. R. Partitioning of membrane molecules between raft-and non raft-domains: insights from model membrane studies. Biochim. Biophys. Acta. 1746, 193-202 (2005).
- Tanner, W., Malinsky, J., Opekarova, M. In plant and animal cells, detergent-resistant membranes do not define functional membrane rafts. Plant Cell. , (2011).
- Lauwers, E., Andre, B. Association of yeast transporters with detergent-resistant membranes correlates with their cell-surface location. Traffic. 7, 1-15 (2006).
- Kierszniowska, S., Seiwert, B., Schulze, W. X. Definition of Arabidopsis sterol-rich membrane microdomains by differential treatment with methyl-ß-cyclodextrin and quantitative proteomics. Mol. Cell. Proteomics. 8, 612-623 (2009).
- Simons, K., Toomre, D. Lipid rafts and signal transduction. Nat. Rev. Mol. Cell Biol. 1, 31-39 (2000).
- Maeda, Y., Kinoshita, T. Structural remodeling, trafficking and functions of glycosylphosphatidylinositol-anchored proteins. Prog. Lipid Res. 50, (2011).
- Keinath, N. F., et al. PAMP-induced changes in plasma membrane compartmentalization reveal novel components of plant immunity. J. Biol. Chem. 285, 39140-39149 (2010).
- Stanislas, T., et al. Quantitative proteomics reveals a dynamic association of proteins to detergent resistant membranes upon elicitor signaling in tobacco. Mol. Cell. Proteomics. 8, 2186-2198 (2009).
- Minami, A., et al. Alterations in detergent-resistant plasma membrane microdomains in Arabidopsis thaliana during cold acclimation. Plant Cell Physiol. 50, 341-359 (2008).
- Pauly, M., Eberhard, S., Albersheim, P., Darvill, A., York, W. S. Effects of the mur1 mutation on xyloglucans produced by suspension-cultured Arabidopsis thaliana cells. Planta. 214, 67-74 (2001).
- Jouanneau, J. P., Peaud-Lenoel, C. Growth and synthesis of proteins in cell suspensions of a kinetin dependent tobacco. Physiol. Plant. 20, 834-850 (1967).
- Engelsberger, W. R., Erban, A., Kopka, J., Schulze, W. X. Metabolic labeling of plant cell cultures with K15NO3 as a tool for quantitative analysis of proteins and metabolites. Plant Methods. 2, 1-11 (2006).
- Arsova, B., Kierszniowska, S., Schulze, W. X. The use of heavy nitrogen in quantitative proteomics experiments in plants. Trends Plant Sci. 17, 102-112 (2012).
- Rappsilber, J., Ishihama, Y., Mann, M. Stop And Go Extraction tips for matrix-assisted laser desorption/ionization, nanoelectrospray, and LC/MS sample pretreatment in proteomics. Anal. Chem. 75, 663-670 (2003).
- Olsen, J. V., Macek, B. High accuracy mass spectrometry in large-scale analysis of protein phosphorylation. Methods Mol. Biol. 492, 131-142 (2009).
- Schroeder, M. J., Shabanowitz, J., Schwartz, J. C., Hunt, D. F., Coon, J. J. A neutral loss activation method for improved phosphopeptide sequence analysis by quadrupole ion trap mass spectrometry. Anal. Chem. 76, 3590-3598 (2004).
- Frese, C. K., et al. Improved peptide identification by targeted fragmentation using CID, HCD and ETD on an LTQ-Orbitrap Velos. Journal of Protrome Research. 10, 2377-2388 (2011).
- van Breukelen, B., vanden Toorn, H. W., Drugan, M. M., Heck, A. J. StatQuant: a post-quantification analysis toolbox for improving quantitative mass spectrometry. Bioinformatics. 25, 1472-1473 (2009).
- Zauber, H., Schulze, W. X. Proteomics wants cRacker: Automated standardized data analysis of LC/MS derived proteomic data. J. Proteome Res. 11, 5548-5555 (2012).
- Raffaele, S., Mongrand, S., Gamas, P., Niebel, A., Ott, T. Genome-wide annotation of remorins, a plant-specific protein family: Evolutionary and functional perspectives. Plant Physiol. 145, 593-600 (2007).
- Shah, M. B., Sehgal, P. B. Nondetergent isolation of rafts. Methods Mol. Biol. 398, 21-28 (2007).
- Persaud-Sawin, D. -. A., Lightcap, S., Harry, G. J. Isolation of rafts from mouse brain tissue by a detergent-free method. Journal of Lipid Research. 50, 759-767 (2009).
- Macdonald, L. J., Pike, L. J. A simplified method for the preparation of detergent-free lipid rafts. Journal of Lipid Research. 46, 1061-1067 (2005).
- Mühlhaus, T., Weiss, J., Hemme, D., Sommer, F., Schroda, M. Quantitative shotgun proteomics using a uniform 15N-labeled standard to monitor proteome dynamics in time course experiments reveals new insights into the heat stress response of Chlamydomonas reinhardtii. Mol. Cell. Proteomics. 10, M110.004739 (2011).
- Schulze, W., Usadel, B. Quantitation in mass-spectrometry-based proteomics. Annu. Rev. Plant Biol. 61, 491-516 (2010).
- Foster, L. J., de Hoog, C., Mann, M. Unbiased quantiative proteomics of lipid rafts reveales high specificity for signaling factors. Proc. Natl. Acad. Sci. USA. 100, 5813-5818 (2003).
- Lilley, K. S., Dupree, P. Plant organelle proteomics. Curr. Opin. Plant Biol. 10, 594-599 (2007).
- Sadowski, P. G., Groen, A. J., Dupree, P., Lilley, K. S. Sub-cellular localization of membrane proteins. Proteomics. 8, 3991-4011 (2008).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados