Method Article
Механическое раздражение индуцированных кальция Распространение волн в монослоев клеток: Пример бычьего эндотелиальных клеток роговицы
В этой статье
Резюме
Межклеточной Ca 2 +-Волны обусловлено щелевые каналы и полуканалы. Здесь мы описываем метод измерения межклеточных Са 2 +-Волн в монослоев клеток в ответ на местные одноклеточные механический стимул и его применение для исследования свойств и регулирование щелевые каналы и полуканалы.
Аннотация
Межклеточной коммуникации имеет важное значение для координации физиологических процессов между клетками в различных органах и тканях, в том числе головного мозга, печени, сетчатки, улитки и сосудов. В экспериментальных условиях, межклеточные Са 2 +-волны могут быть вызваны применением механической стимул к одной ячейке. Это приводит к высвобождению внутриклеточных сигнальных молекул IP-3 и Са 2 +, которые инициируют распространения Са 2 +-волны концентрически с механически стимулированных ячейки в соседних ячейках. Основные молекулярные пути, которые контролируют межклеточную Ca 2 +-волн предоставляются щелевых каналов, через прямую передачу IP 3 и полуканалы посредством высвобождения АТФ. Идентификация и характеристика свойств и регулирование различных коннексином и pannexin изоформы, что щелевые каналы и полуканалы допускаются quantificatioн распространения межклеточного Са 2 +-волны, миРНК, а также использование ингибиторов щелевых каналов и полуканалы. Здесь мы опишем метод для измерения межклеточных Ca 2 +-волны в монослоя эндотелия роговицы первичной клетки, нагруженные Fluo4-AM в ответ на контролируемые и локализованные механический стимул спровоцированы острые, кратковременные деформации ячейки в результате прикосновения к клеточной мембране с микроманипулятор-стекло с контролируемым размером микропипетки с наконечником диаметром менее 1 мкм. Мы также описывают выделение первичной бычьей роговицы эндотелиальные клетки и ее использование в качестве модельной системы для оценки Cx43-гемиканала активность в качестве ведомого силу для межклеточных Са 2 +-волн через высвобождение АТФ. Наконец, обсуждается использование, преимущества, ограничения и варианты этого метода в контексте разрыв канал перехода и гемиканала исследований.
Введение
Межклеточные связи и сигнализации имеют важное значение для координации физиологических процессов в ответ на внеклеточный агонистов на тканевом и оптово-органном уровне 1,2. Наиболее прямым способом межклеточной коммуникации создается возникновение щелевые контакты. Щелевые контакты являются бляшки каналов щелевых контактов, которые являются белковые каналы, образованные голова к голове стыковка двух коннексином (Cx) полуканалы соседних ячеек 3,4 (рис. 1). Щелевые соединения для прохода небольших сигнальных молекул с молекулярной массой менее 1,5 кДа, в том числе Са 2 + или 3 IP 5, в результате чего и модуляции Са 2 +-высвобождения из внутриклеточных запасов соседних ячеек 6 (фиг. 2). Каналов щелевых соединений жестко регулируется по внутри-и межмолекулярных взаимодействий белков и клеточных сигнальных процессах, как изменение и окислительно-восстановительныефосфорилирования 7. GJS облегчения согласованных действий связанных клеток, тем самым выступая в качестве химических и электрических синцитий. Например, распространение потенциала действия сердца через предсердных и желудочковых миоцитов опосредовано Cx основе каналов ГДж 85. CxS не только играют роль каналов щелевых контактов, но и формируют непарных полуканалы, тем самым функционируют как каналы в мембранах аналогично регулярных ионных каналов 8-10 (рис. 1). Полуканалы участвовать в паракринная сигнализации между соседними ячейками, контролируя обмена ионов и сигнальных молекул между внутри-и внеклеточной среде.
Во многих типах клеток (например, эпителиальные клетки, клетки остеобластов, астроциты, эндотелиальные клетки и т.д.) и органов (например, мозга, печени, сетчатки, улитки и сосудистой), межклеточные Са 2 +-волны имеют основополагающее значение для координации многоклеточных ответов 11. Увеличение внутриклеточного Са 2 + уровня в определенной ячейке не ограничивается этой клетке, но распространяются на окружающие соседние клетки, тем самым создавая межклеточных Са 2 +-волны 12,13. Эти межклеточные Са 2 +-волны имеют важное значение для нормальной физиологической регуляции клеточного слоя, как синцития и их регуляции был связан с патофизиологических процессах 11. В эндотелий роговицы и эпителия, различные группы 14-24, в том числе наши собственные 25-33, изучал механизмы и роли межклеточной коммуникации. В не-возбудимых клеток, как и эндотелиальные клетки роговицы, два различных режима межклеточной коммуникации происходят 28,29, а именно щелевые межклеточные связи и паракринные межклеточной коммуникации. Межклеточных щелевых контактов, коммуникация предполагает прямого обмена сигнальными молекулами через щелевые контакты 7. Gap переходаминых межклеточной коммуникации имеет решающее значение для поддержания тканевого гомеостаза, контроле пролиферации клеток, а также создание синхронизированных ответ на внеклеточный стресса 10,34,35. В ряде патологий, связь щелевых контактов снижается из-за дефектных CxS, и тем самым влияет щелевых межклеточных взаимодействий 36. Это подчеркивает важность и влияние щелевых межклеточных взаимодействий в многоклеточных организмах. В отличие от щелевых межклеточных коммуникаций, паракринные межклеточной коммуникации не зависит от межклеточной аппозиции, так как он связан с высвобождением диффузии внеклеточных мессенджеров (рис. 2). Различные типы сигнальных молекул высвобождаются во внеклеточном пространстве путем передачи сигналов клетками. Молекула затем транспортируется в клетки-мишени, где он обнаружен конкретный белок рецептора. Впоследствии рецептор-сигнал комплекс индуцирует клеточный ответ, которыйпрекращается путем удаления сигнала, инактивации или десенсибилизации. Выхода липофильных внеклеточной сигнализации посланников проникают в мембрану и действуют на внутриклеточные рецепторы. С другой стороны, гидрофильный посланники не проходят через плазматическую мембрану ответ клетки, но действовать как лиганд, который связывается с поверхностью экспрессированный рецептор белков, которые затем передают сигнал на внутриклеточную среду. Три основных семейств белков клетки поверхностным рецептором участвовать в этом процессе: ионно-канала связаны между собой, энзим-связанного, и протеин-связанные. Выпущен мессенджера молекула может действовать на рецепторы той же клетке (аутокринная) на клетки-мишени в непосредственной близости (паракринная) или на удаленные клетки-мишени, которые требуют системы кровообращения (эндокринной).
Во многих типах клеток, включая эндотелий роговицы 28,29, АТФ является одним из основных гидрофильными, паракринная факторами, которые определяют распространение межклеточных Са 2 +-волны 37-40. Дурния механической деформации, гипоксия, воспаление или стимуляции различными агентами, АТФ может быть освобожден от здоровых клеток 41-44 в ответ на напряжение сдвига, растягивать или осмотическое набухание 44,45. Различные АТФ-релиз механизмов было постулировано, в том числе везикулярный экзоцитоз 44 и множество транспортных механизмов, таких как АТФ-связывающего кассетного (ABC) транспортеры, плазмалеммы потенциал-зависимых анионных каналов 46, Р2Х7 рецептора каналов 47,48, а также коннексином полуканалы 49-52 и pannexin полуканалы 43,49,53. Внеклеточного АТФ может быть быстро гидролизуется до АДФ, АМФ и аденозин 54,55 по ectonucleotidases, которые присутствуют во внеклеточной среде. Внеклеточно выпущен АТФ и АДФ его метаболита 56 будет распространяться путем диффузии. Последующее взаимодействие этих нуклеотидов с пуринергической рецепторов в соседних ячейках было вовлечено в рropagation межклеточного Ca 2 +-волны 28,37,51. Два различных классов пуринергической рецепторы присутствуют: аденозин является основным природным лигандом для P1-пуриноцепторов, в то время как пурин (АТФ, АДФ) и пиримидиновые (UTP, UDP) нуклеотидов действовать на наиболее P2-пуриноцепторов 57.
Межклеточной коммуникации могут быть исследованы различными методами, такими как загрузка путем соскоба перенос красителя, местные uncaging агонистов, как IP 3 и Ca 2 +, механическое раздражение, и т.д.. Здесь мы опишем изучение Ca 2 +-волн вызванного механической стимуляции одной ячейки. Преимущество изучения Са 2 +-волн при механическом раздражении в том, что он обеспечивает легкий инструмент для количественной оценки распространения Ca 2 +-волны в течение долгого времени, и это позволяет количественно сравнения различных предварительной обработки клеток. В эндотелий роговицы, эти межклеточные Ca 2 +-волны позволяют сотрудничествасогласованный ответ от монослоя, добровольно выступает в качестве возможного механизма защиты нерегенеративная эндотелий роговицы помогают противостоять эндотелий внеклеточный напряжений при внутриглазной хирургии, или под воздействием медиаторов воспаления во время иммунного отторжения или увеит 58,59.
протокол
1. Выделение клеток эндотелия роговицы
Перед началом работы: Изолировать клеток из свежих глаз, полученных из местных бойню, как можно скорее после энуклеирующий глаз. Убедитесь в том, что глаз был энуклеировали от коровы максимальных 18 месяцев, пять минут после смерти и сохранил в сбалансированном солевом растворе Эрла - 1% раствором йода при 4 ° С для транспортировки в лабораторию.
- Возьмите глаз сбалансированный солевой раствор Эрла - 1% раствором йода и поместить его в чашке Петри (100 х 20 мм).
- Стерилизацию глаз с раствором, содержащим 70% этанола и промыть сбалансированный солевой раствор Эрла, содержащей 1% йода.
- От этого шага, работай в стерильных капот. Осторожно рассекают роговицу от глаз и поместите его в чашке Петри (35 х 10 мм), содержащее сбалансированный солевой раствор Эрла, с слой эпителиальных клеток вверх. Осторожно удалите оставшиеся ткани Iris STIбудем прикреплены к роговице, если необходимо.
- Передача роговицы в сбалансированный солевой раствор Эрла другой содержащие чашки Петри с эндотелиальный клеточный слой вверх и промывки дважды сбалансированный солевой раствор Эрла.
- Передача роговицы с эндотелиальный слой вверх в виде песочных часов, которая представляет собой чашеобразный блюдо и покрыть ее питательной среды. Рост среда состоит из среды Игла, модифицированную по Дульбекко, содержащей 25 мМ глюкозы, 10% фетальной бычьей сыворотки, 6,6% L-глутамина, 2,5 мкг / мл амфотерицина-В и 1% антибиотиков противогрибковым смеси, содержащей 10000 единиц / мл пенициллина, 10 000 мкг / мл стрептомицина и 25 мкг / мл амфотерицина В.
- Снимите среде с всасывающим пипетки.
- Применить 300 мкл раствора трипсина (0,5 г / л) в эндотелиальных слой роговицы (все шаги, которые включают трипсин выполнены с использованием той же концентрации).
- Поместите песочные часы содержащие роговицы в закрытой чашке Петри и положить его в МКПubator течение 30 мин при 37 ° С и 5% СО 2.
- Аккуратно очистите эндотелиальные клетки от роговицы с огневой полировкой крюкообразными стеклянной пипетки Пастера в стерильных капот.
- Отсасывать раствор, содержащий эндотелиальные клетки и добавить его в колбах с культурой (25 см 2), содержащего 4 мл культуральной среды.
- Применить 300 мкл питательной среды к роговице и повторить соскоб и добавляют раствор, содержащий эндотелиальными клетками в культуральную колбу.
- Повторите это последний шаг (1.11) еще раз.
- Поместите Культуральные флаконы содержащий роговицы эндотелиальных клеток в питательной среде в инкубаторе при температуре 37 ° С и 5% СО 2.
- Через два дня, добавляют 6 мл культуральной среды.
- Обновите ростовой среде каждый второй день.
2. Культура клеток
- Удалить культуральной среды и промыть клетки дважды сбалансированный солевой раствор Эрла, когда слияния будет достигнута (в пределах АбуT 10 дней после изоляции).
- Добавить 1,5 мл раствора трипсина к клеткам, чтобы отделить их и колбу помещают в инкубатор (37 ° C, 5% CO 2) в течение от 3 до 4 мин.
- Добавьте 12 мл ростовой среды. Внесите среду в три раза и выходить, чтобы разогнать клетки и подсчитать клетки.
- Семенной клеток с переменным фракции в зависимости от плотности клеток и поместить их в инкубатор. Приготовьте два хорошо камерные слайды (с площадью 4,2 см 2) с-клеток 165000 клеток (плотность клеток 39286 на см 2). Подготовка 80 см2 колбах культуры для нового прохода при плотности 6250 на см 2, и добавляют свежую культуральную среду до общего объема 25 мл.
- Обновите среды каждые два дня.
- Слияния клеточного слоя достигается после 3 до 4 дней. Использование клеток для экспериментов.
- Когда слияния клеточного слоя в колбах достигнут, повторите шаги 2,1 до 2,6. Клеточные культуры до прохода 2 можно использовать Fили экспериментов.
3. Механической стимуляции для индукции волны кальция
- Загрузите клетки в слайд-камерные с 10 мкМ Fluo-4 утра в фосфатно-буферном солевом растворе в течение 30 мин при 37 ° С при осторожном встряхивании.
- Удалить Fluo-4 утра раствор, промыть клетки пять раз забуференным фосфатом физиологическим раствором, клетки инкубировали с фосфатным буферным солевым раствором и оставить клетки в течение 5 мин при комнатной температуре перед измерением.
- Excite при 488 нм с аргоном и использованием лазерных светоделителе HFT 488, собирать флуоресценции при 530 нм с использованием longpass эмиссионный фильтр LP 505, установите отверстие на минимум. Используйте масло погружения объектив 40X (воздуха, 1,2 NA). В экспериментах с ARL-67156, использовать объектив 10X (воздуха, 0,3 NA).
- Искать по области, в которой клетки сливающийся на конфокальной микроскопии.
- Позиция пипетки так, чтобы она при температуре 45 ° по отношению к каретке камерные и прикосновения к клеточной мембране.Спровоцировать короткий (≈ 1 сек) механическое раздражение в одну ячейку. Механическую стимуляцию состоит из острого, кратковременные деформации ячейки, прикоснувшись менее 1% клеточной мембраны со стеклянной микропипетки (диаметр кончика <1 мкм), соединенный с пьезоэлектрическим кристаллом nanopositioner, управляется через усилитель который установлена на микро-манипулятором. Стеклянные микропипетки сделаны с микроэлектродом съемника. Убедитесь, что nanopositioner управляется напряжением от 0,2 до 1,5 В при механической стимуляции. Напряжение выше 1,5 В может привести к повреждению клеток. Для каждого типа клеток и состояние, оптимальное напряжение на механическую стимуляцию без повреждения клетки должны быть тщательно определена путем применения серии напряжений, начиная с низкой (0,2 В) до высокой (1,5 В) напряжения. Напряжение является мерой силы стимуляции, так как это напряжение определяет механические напряжения и деформации, которые применяются к клеточной мембране.силу механическую стимуляцию может быть рассчитано умножением механических напряжений с областью. Так как обе области (<3,14 мкм 2) и механическое напряжение очень низкие, сила механическую стимуляцию низка. (Обратите внимание, что, когда клетка повреждена, рассеивание флуоресценции из клетки и клетки темнеет.)
- Измерьте пространственных изменений [Ca 2 +] я после механической стимуляции с конфокальной микроскопии.
- Сбор и хранение изображений.
- Нарисовать многоугольные области, представляющей интерес для определения общей площади поверхности чувствительных клеток (активная область, AA) с помощью программного обеспечения из конфокальной микроскопии.
Результаты
Все эксперименты выполнены с соблюдением всех соответствующих руководящих принципов, правил и регулирующих органов и протокола демонстрируется осуществляется под руководством и утверждение содержания и использования животных комитета Католический университет Левена.
В бычьих эндотелиальных клеток роговицы (BCEC), функциональных щелевых выражаются и обе щелевые межклеточные связи и паракринные межклеточной коммуникации вносят значительный вклад в межклеточной коммуникации в интерактивном режиме, но главный путь было показано, что межклеточные пути паракринные связь опосредована высвобождение АТФ через Сх43 основе полуканалы 28,29. АТФ и АДФ подвергают гидролизу в аденозин монофосфат (АМФ) на ectonucleotidase E-NTPD1 (ectonucleoside трифосфат diphosphohydrolase 1, CD39 АТФ diphosphohydrolase), а затем в аденозин по 5'-ectonucleotidase CD73 28,29. АТФ и АДФ способствоватьCa 2 +-волн путем связывания с P2Y1 и P2Y2 рецепторы 28,29. Оба рецептора пару ПЛК через Gq и тем самым вызывают IP 3-индуцированной Ca 2 +-релиз (рис. 2). В BCEC, стимуляция пуринергической P2Y рецепторов приводит к быстрому увеличению [Са 2 +], которая нечувствительна к удалению [Са 2 +] или 60. [Са 2 +] пики вызванные агонистами стимуляции следуют [Са 2 +] снижение которые могут привести к стабильной, агонист-зависимых высоты, [Са 2 +] о-зависимый колебаний колебательного или возврат к базовым 60-62. В BCEC, было доказательства того, что Ca2 +-высвобождение происходит через путь с участием PLC и IP-3 29. Опорожнение IP 3-чувствительные магазинов приводит к первоначальному пик [Са 2 +] я, впоследствии следует САpacitative Са 2 +-приток приводит к началу фазы плато 63.
Механическое раздражение приводит к быстрому начальное увеличение Са 2 +, который происходит из точки стимуляции, а затем распространяется по всей механически стимулированных клетки. Наконец, внутриклеточный Ca 2 +-уровней медленно уменьшаться обратно к исходному уровню. По достижении границы ячеек, межклеточное Ca 2 +-волна распространяется в окружающие соседние клетки (NB) в волнообразно как Ca 2 +-переходные, распадающийся на базальный уровень (рис. 3). В контрольных условиях, Ca 2 +-переходных наблюдались до приблизительно от 4 до 8 слоев клеток от механически стимулированных ячейки (рис. 3). Линейный график (на правой стороне панели на фиг.3) показывает временной ход Са 2 + переходных (представленные в виде нормализованных флуоресценции (NF) значений) вмеханически стимулированных клеток и в соседних слоев клеток 4:59 (NB1, NB2, NB3, NB4 и NB5). Из рисунка 3, ясно, что нормированная флуоресценции уменьшается, а время задержки наступления [Ca 2 +] я-увеличивается при увеличении расстояния от механически стимулированных клетки. Максимальное нормированное флуоресценцию в механически стимулированных клетки была достигнута в 0,95 ± 0,04 сек. После достижения максимальной нормированной флуоресценции, нормированной флуоресценции показал очень постепенным и медленное снижение, возвращаясь к базальной значение 152 ± 6 сек после применения стимул 25.
Ингибирование паракринная межклеточный путь связи с использованием комбинации экзогенных апиразы VI (5 ед / мл в течение 30 мин) и апиразы VII (5 ед / мл в течение 30 мин), вызванное 7,5-кратное уменьшение в области, охватываемой Са2 + волны, так называемой активной области (AA, P <0,001, N = 7, П = 35) (фиг.4А). Апиразы известно для гидролиза АТФ и АДФ. Апиразы VI имеет высокую АТФазы / ADPase соотношение и апиразы VII гидролизуется преимущественно ADP 56.
С паракринные межклеточной коммуникации в эндотелий роговицы в значительной степени происходит за счет выделения АТФ, 28,29 и АТФ гидролизуется во внеклеточном пространстве ectonucleotidases, как известно, выражается в эндотелий роговицы, 29,64,65 мы исследовали влияние на АА в условиях где гидролиз АТФ подавляется ectonucleotidase использованием ингибиторов. Ингибирование ectonucleotidases с ARL-67156 (ARL; 100 мкМ в течение 30 мин) приводит к резкому усилению Са 2 +-волн, как было показано ранее в BCEC 25,26,28,29. Воздействие BCEC к ARL вызвало 3,5-кратное увеличение АА по сравнению с контрольными условиями (Р <0,001, N = 12, N = 60) (фиг.4В).
В предварительнопредыдущие исследования в нашей лаборатории, коннексином миметической пептидов (Gap26 и Gap27, таблица 2) используется, чтобы различать относительные вклады щелевых межклеточных связей и паракринные межклеточной коммуникации в межклеточном Ca 2 +-волн после механической стимуляции, с неактивным пептид ( В таблице 2) в качестве контроля 28,29.
Ингибирование щелевых каналов с Gap27 значительно сократилось распространение Ca 2 +-волны в BCEC 30. AA была значительно снижена после предварительной обработки с Gap27 (300 мкМ в течение 30 мин) (Р <0,001, N = 8, п = 40) 25 (табл. 1). Ингибирование коннексином полуканалы с коннексином-миметического пептида Gap26 28,30 значительно сократили распространение Ca 2 +-волны в BCEC 28. AA была значительно снижена после предварительной обработки с Gap26 (300 мкМ в течение 30 мин)(Р <0,001, n = 8, п = 40) 25 (табл. 1).
Мы также показали, что 43-кДа Cx изоформы был основным компонентом, лежащим в основе гемиканала-опосредованного выделения АТФ, который вызывает межклеточную Ca 2 +-волн. Использование двух независимо разработанного ориентации молекул миРНК Сх43, мы обнаружили, что А.А. была снижена примерно на 65% 33 (табл. 1). Это также опирается на эксперименты с использованием ТАТ-L2 (100 мкМ, 30 мин), проникающий в клетку пептидом, соответствующим второй половине внутриклеточной петле Сх43 (табл. 2), которое вызвало значительное снижение АА (Р <0,001 , N = 3, п = 30) (табл. 1). Важно отметить, что это снижение АА ТАТ-L2 инкубации не наблюдалось в отсутствии паракринных сигналов, поддерживая концепцию, что ТАТ-L2 селективно ингибирует Сх43 основе полуканалы но не щелевых каналов 33. Кроме того, малоподвижный ТАТ-L2 мутанта (TAT-L2 H126K/I130N) могут быть использованы в качестве контроля (табл. 2).

Рисунок 1. Формирование каналов щелевых контактов и полуканалы: схематическое изображение. А. коннексина или pannexin гемиканала образуется, когда шесть коннексинов или pannexins, которых четыре трансмембранных-домен-содержащих белков, расположены радиально вокруг центрального поры. Полуканалы расположены в плазматической мембране. Они могут состоять из идентичных подтипов белка (гомомерные полуканалы), или они могут состоять из различных подтипов белка, когда два или более изоформы экспрессируются в одной камере (гетеро полуканалы). Однотипных каналов щелевых результаты стыковка двух идентичных гомомерные или гетеромерными полуканалы. Гетеротипические щелевых каналов результаты Docking двух различных гомомерные или гетеромерными каналов. Б. Схематическое строение коннексином и pannexin щелевые каналы, соединяющие две соседние клетки и полуканалы.
(Частично изменен с 66)
Эта цифра была впервые опубликована в BioEssays. Catheleyne д'Ондта, Raf Ponsaerts, Гумберт де Smedt Герт Bultynck, и Бернард Himpens. Pannexins, дальние родственники семьи с коннексином специфических клеточных функций. BioEssays. 2009, 31, 953-974 (2009). BioEssays. Нажмите здесь, чтобы увеличить рисунок .
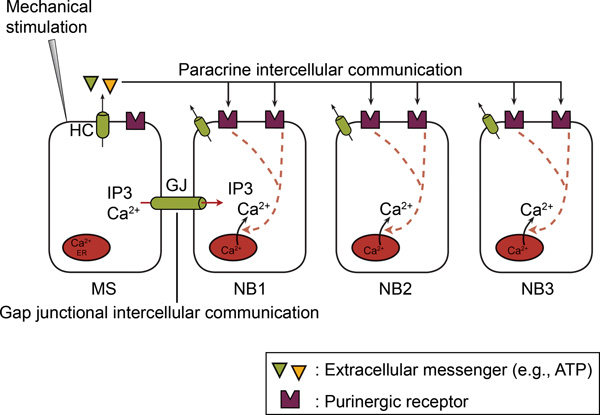
Рисунок 2. В не-возбудимых клетках, вtercellular Ca 2 +-волн включает в себя как щелевые межклеточные связи и паракринные межклеточной коммуникации. После механической стимуляции одной ячейке, Ca 2 +-рост происходит в механически стимулированных ячейки (MS) с помощью Ca 2 +-приток и / или Ca 2 +-релизе. Впоследствии, Ca 2 +-рост распространяется от механически стимулированных в соседние клетки (NB) в качестве межклеточных Ca 2 +-волны. Межклеточного распространения включает в себя два механизма, а именно щелевые межклеточные связи и паракринные межклеточной коммуникации. В щелевых межклеточной коммуникации, прямой обмен посредника (IP 3 и / или Са 2 +) происходит между цитоплазмы соседних ячеек через щелевые контакты (GJS). В паракринная межклеточных взаимодействий, мессенджера (например, АТФ) высвобождается во внеклеточное пространство, тем самым, действующих на рецепторы, расположенные на гоэлектронной поверхности соседних клеток. Полуканалы (ЖКХ) или других механизмов, посредством которых осуществляется это освобождение АТФ (см. текст). Ectonucleotidases гидролиза АТФ в АДФ и АМФ. АТФ и АДФ действуют на P2Y и / или Р2Х рецепторами на соседних клетках. (Взято из 66.)
Эта цифра была впервые опубликована в BioEssays. Catheleyne д'Ондта, Raf Ponsaerts, Гумберт де Smedt Герт Bultynck, и Бернард Himpens. Pannexins, дальние родственники семьи с коннексином специфических клеточных функций. BioEssays. 2009. 31, 953-974 (2009). BioEssays.
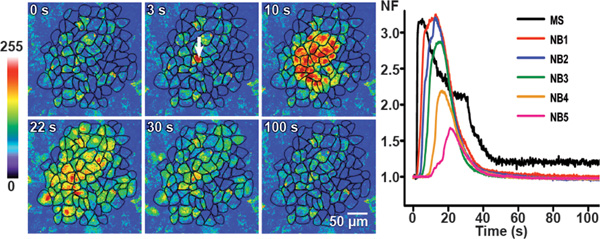
Рисунок 3. Кальций волн в контрольных условиях в BCEC. Механическое раздражение индуцированного переходных кальция приведены в разных временных точках в контрольных условиях в BCEC представителем псевдо-цветного изображения флуоресценции. ФлуоScence интенсивности до раздражения показаны на первом изображении. Белой стрелкой на втором изображении идентифицирует механически стимулированных клетки. Кальция волна распространяется до шести соседних слоев клеток с общей площадью клетки достигали волны (активная область: AA) из 62 870 мкм 2.
На правой панели с линией графика показана зависимость нормированного значение флуоресценции (NF) в механически стимулированных клетки (МС) и среднее значение NF в соседних сотах (NB) слоев 1 до 5 (NB1 в NB5). (Частично изменен с 25.)
Эта цифра была впервые опубликована в Следственный офтальмологии и Visual Science. Catheleyne д'Ондта, Raf Ponsaerts, Sangly P Шринивас, Йохан Vereecke, и Бернард Himpens. Тромбин ингибирует межклеточных волн кальция в клетках эндотелия роговицы путем модуляции полуканалы и щелевые контакты. Invest. Ophthalmol. Видимый Научно. 2007. 48 (1), 120-33 (2007). Следственный офтальмологии и Visual Science.

Рисунок 4. Значительные изменения в межклеточное распространение Ca 2 +-волны после лечения с экзогенными нуклеотидазы (слева) и с ectonucleotidase ингибиторы (справа) в BCEC. А. Значительное снижение AA после обработки BCEC с экзогенными apyrases (апиразы VI (5 ед / мл) и апиразы VII (5 ед / мл) в течение 30 мин), которые гидролизуют АТФ и АДФ, таким образом ингибировать межклеточную паракринная маршрут связи (N = 7, п = 35). * Означает Р <0,001 в присутствии против отсутствия апиразы B. Значительное увеличение AA после лечения BCEC с селективным ингибитором ectonucleotidase ARL-67156 (ARL; 100 мкМ в течение 30 мин)., Херби enhancinг паракринные межклеточные пути связи (N = 12, N = 60). * Означает Р <0,001 в присутствии по сравнению с отсутствием ARL.
| Нормализованной А.А. | Санкт ошибке | N | N | Статистика | |
| контролировать | 100 | 8,31 | 3 | 30 | |
| siScramble | 87.97 | 9,3 | 3 | 30 | |
| siCx43-1 | 32.45 | 8,23 | 3 | 30 | * |
| siCx43-2 | 35.49 | 7,06 | 3 | 30 | * |
| Контрольный пептид | 91.68 | 6,5 | 8 | 40 | |
| Gap 26 | 46,67 | 4,24 | 8 | 40 | * |
| Gap 27 | 53 | 4,76 | 8 | 40 | * |
| ТАТ-L2 | 6,99 | 0,71 | 3 | 30 | * |
Таблица 1. Влияние ориентации молекул миРНК Сх43, коннексином миметической пептидов и проникающий в клетку пептид ТАТ-L2 от нормированной активной области (AA) в BCEC.
N представляет собой количество дней экспериментов, п представляет собой количество механической стимуляции. * Означает Р <0,001 по сравнению с контрольными условиями.
| А.А. последовательности | |
| Контрольный пептид | SRGGEKNVFIV |
| Gap26 | VCYDKSFPISHVR |
| Gap27 | SRPTEKTIFII |
| ТАТ-L2 | YGRKKRRQRRR-DGANVDMHLKQIEIKKFKYGIEEHGK |
| TAT-L2H126K/I130N | YGRKKRRQRRR-DGANVDMKLKQNEIKKFKYGIEEHGK |
| 10Panx1 | WRQAAFVDSY |
Таблица 2. Аминокислотные последовательности пептидов использовали.
Обсуждение
В этой рукописи, мы опишем простой метод измерения межклеточных Ca 2 +-волн в монослоям первичных бычьих эндотелиальных клеток роговицы путем предоставления локализованных и контролируемой механической стимуляции с помощью микропипетки. Механически стимулированных клетки реагируют с локальным повышением внутриклеточного IP 3 и Ca 2 +, оба из которых имеют важное значение внутриклеточных сигнальных молекул, которые управляют межклеточных Ca 2 +-волн 11,67. IP-3 напрямую передается на соседние клетки через щелевые каналы 5, в то время как Са 2 + вызывает открытие полуканалы и высвобождение АТФ 68,69, которое вызывает Са 2 + сигналов в соседних сотах, посредством активации G-белка P2 связанной рецепторов 37-40. Относительный вклад щелевых каналов и полуканалы в этом процессе может быть охарактеризован с помощью Cx-миметическогоПептиды, АТФ-деградирующих ферментов (ectonucleotidases) и ингибиторы ectonucleotisdases. Свойствами механической стимуляции индуцированного межклеточного Са 2 +-волн в бычьих эндотелиальных клеток роговицы были полностью отличается в нашей лаборатории, 25-33. Наши результаты показывают, что межклеточные Ca 2 +-волн главным образом за счет Cx-гемиканала-опосредованное высвобождение АТФ, с Сх43 играет важную роль. Таким образом, этот метод применяется для первичного бычьего эндотелиальных клеток роговицы особенно подходит для идентификации или характеризуют регулирование Сх43 полуканалы на эндогенные уровни в родных клеток. С помощью этого метода было установлено, что активность Сх43 полуканалы критически контролируется цитоскелета актомиозин, которые могут служить в качестве эндогенного тормозной предотвращения чрезмерного и, таким образом вредные, Cx43 гемиканала открытие 25,31,32. Мы также выяснить молекулярные механизмы, лежащие в основе этого регулирования и найтиВажную роль внутримолекулярных петли / Хвост взаимодействий, которые необходимы для открытия Сх43 полуканалы 33.
Очевидно, что система очень подходит для изучения функции Cx и Panx основе щелевых каналов и полуканалы и, безусловно, не ограничивается бычьих эндотелиальных клеток роговицы, но может адаптироваться к практически любой тип клеток, а также более сложные ткани, как было показано в мозг, где механическое раздражение вызвало большие межклеточные Ca 2 +-волны, охватывающего весь полушарии 70. Различные инструменты присутствуют, чтобы оценить вклад щелевые каналы и полуканалы, в том числе Cx-миметической пептиды, АТФ-ферменты, ингибиторы ectonucleotidases и фармакологических соединений, как и 10 карбеноксолоном Panx1 (табл. 2) 49,50. Для определения вклада определенного Cx или Panx изоформы в этом процессе, тщательно разработанные зонды миРНК тargeting двух независимых регионах мРНК и яичницей-контроль должен быть использован. Степень нокдаун должны быть определены на уровне общего белка с использованием западных промокательной анализов и уровне одной клетки с помощью флуоресцентного микроскопа. Эффективность трансфекции миРНК зондов в экспериментальной монослоя клетки должны быть оценены флуоресцентной микроскопии. Для этого можно разработать дуплекс миРНК в котором флуоресцентную метку была включена в 3'-конце смысловой цепи. Важно отметить, что для правильного анализа, известный снижение Cx или Panx изоформы (> 90% снижение), а также однородное трансфекции миРНК дуплексы в монослое клеток (> 90% клеток, трансфицированных миРНК зонд) должна быть получена. Селективности разработанный миРНК зонды к цели должны быть оценены 71. Короче говоря, эти средства должны быть проверены, так что они не влияют на экспрессию других Cx или Panx изоформ или других ключевых комкомпоненты межклеточного вождения Ca 2 +-волны, или, как Р2Х P2Y рецепторов. Чтобы оценить вклад Сх43 полуканалы, мы в сотрудничестве с лаборатории д-ра Leybaert в разработке проникающий в клетку пептидом, соответствующим второй половине внутриклеточной петле Сх43 (TAT-L2), которое действует как селективный, мощным ингибитором Cx43 полуканалы при сохранении Cx43-щелевых контактов активности канала 33. В нашем исследовании мы используем 100 мкМ TAT-L2, чтобы получить полное ингибирование Сх43 полуканалы, но более низкие концентрации может быть достаточным 72. TAT-L2H126K/I130N рекомендуется в качестве отрицательного контроля 73. Чтобы оценить вклад Panx1 каналов, пептид 10Panx1 могут быть применены. Эти инструменты важны не только для исключения плазмы разрушение мембраны (см. ниже), но и для демонстрации того, что паракринная АТФ сигнализации опосредует механизмы межклеточного Са 2 +-волн по полуканалы, а не другие механизмы (например, максиально-анион каналов или высвобождение АТФ содержащей пузырьки). Наконец, как и для всех исследованиях с использованием первичных клеток, клеточных культур условий и числа проходов должен быть стандартизирован, так как биологические свойства клеток и тем самым профиля экспрессии генов в различных Cx и Panx изоформы могут изменяться с течением времени 26.
Тем не менее, существует ряд недостатков этого метода. Основным недостатком метода является то, что механическая стимуляция может вызвать разрушение мембраны плазмы, что приводит к вступлению внеклеточного Са 2 + и освобождение сигнальных молекул, как АТФ, оба из которых лежат в основе добросовестного межклеточных Ca 2 +-волн 11. Это, безусловно, усложняет (количественный) анализ межклеточного Ca 2 +-волны. Поэтому, настоятельно рекомендуется, чтобы одна я должен) использовать надлежащий контроль, то есть клеточных линий, которые не имеют выражение Cx или Panx изоформ, и инструменты, которые инrfere с функцией Cx и Panx как щелевых каналов и / или полуканалы и II) стандартизировать процедуру механической стимуляции (убедитесь, что при механическом стимулом nanopositioner управляется напряжением от 0,5 до 2 В).
Кроме того, важно отметить, что этот метод не стоять сама по себе, но должна основываться на дополнительных экспериментальных подходов к изучению и Cx Panx каналов. Это может быть достигнуто с помощью локальное увеличение внутриклеточных сигнальных молекул, которые участвуют в механическую стимуляцию-опосредованных межклеточных Са 2 +-волны, как uncaging внутриклеточного IP-3 или Са 2 + 11,74. Чтобы инициировать межклеточных Са 2 +-волны зависит от механической стимуляции, можно использовать микро-инъекции, такой как рекомбинантный проапоптотические Bax 11,75 и фото-активируемых Са 2 +-буферы, как диазо-2, что вызывает локальное падение внеклеточный [Ca 2 + ] 76, известный триггер для гемиканала открытия. Альтернативно, можно использовать на месте электропорации клетки непроницаемый сигнальных молекул, которые вызывают внутриклеточного Са 2 + высвобождением и межклеточных Са 2 +-волны, такой как IP-3 67,68. Последний метод также используется для исследования распространения гибель клеток 5,77. Эти не-механическим раздражителям обеспечить лучшую оценку интенсивности стимула-реакции. В дополнение к этим Са 2 +-волны методов распространения, важно, чтобы определить активность Cx или Panx каналов с использованием других подходов, включая определение гидрофильной поглощения красителя (например, Lucifer желтый) 78 и высвобождение АТФ не только ответ на механическое раздражение, но и в ответ на внеклеточный Ca 2 +-буферов (как EGTA) и внутриклеточного Ca 2 +-релизе молекул (например, Ca 2 +-ионофором 23187) 11,74. Кроме того, тон лучшее доказательство регулирования на уровень канала обеспечивается электрофизиологических экспериментов, либо двойные системы зажима напряжения или цельноклеточная пути зажим ооцитов Xenopus вводили мРНК или Cx Panx или HeLa клетки эктопически выразив Cx изоформ вместе с маркером, как GFP 79-84.
В заключение, использование механической стимуляции для индукции межклеточных Са 2 +-волны обеспечивает простой и надежный способ исследовать внутриклеточные связи и рассмотреть вклад и свойства Cx и Panx каналов.
Раскрытие информации
Авторы не имеют ничего раскрывать.
Благодарности
Научно-исследовательская работа выполнена в лаборатории при поддержке грантов от Фонда исследований в области - Фландрия (FWO; номера грантов и G.0545.08 G.0298.11), Межвузовской достопримечательность поляков программы (бельгийские политики в области науки; P6/28 номер гранта и P7/13) и встроена в FWO Исследования, поддерживаемые сообществом. ЦРБ после защиты докторской диссертации научно-исследовательского фонда - Фландрия (FWO). Авторы очень благодарны всем нынешним и бывшим членам лаборатории молекулярной и клеточной сигнализации (Католический университет Левена), д-р SP Шринивас (Университет Индианы Школа оптометрии, США), лаборатория доктора Leybaert (Гентский университет) и Доктор Vinken (БСУ), которые предоставили полезные обсуждения, оптимизированные процедуры или были вовлечены в разработку инструментов для изучения коннексином полуканалы.
Материалы
| Name | Company | Catalog Number | Comments |
| Earle's Balanced Salt Solution (EBSS) | Invitrogen-Gibco-Molecular Probes (Karlsruhe, Germany) | 14155-048 | |
| Iodine | Sigma-Aldrich (Deisenhofen, Germany) | 38060-1EA | |
| Dulbecco's Modified Eagle's Medium (DMEM) | Invitrogen-Gibco-Molecular Probes (Karlsruhe, Germany) | 11960-044 | |
| L-glutamine (Glutamax) | Invitrogen-Gibco-Molecular Probes (Karlsruhe, Germany) | 35050-038 | |
| Amphotericin-B | Sigma-Aldrich (Deisenhofen, Germany) | A2942 | |
| Antibiotic-antimycotic mixture | Invitrogen-Gibco-Molecular Probes (Karlsruhe, Germany) | 15240-096 | |
| Trypsin | Invitrogen-Gibco-Molecular Probes (Karlsruhe, Germany) | 25300-054 | |
| Dulbecco's PBS | Invitrogen-Gibco-Molecular Probes (Karlsruhe, Germany) | 14190-091 | |
| Fluo-4 AM | Invitrogen-Gibco-Molecular Probes (Karlsruhe, Germany) | F14217 | |
| ARL-67156 (6-N,N-Diethyl-b,g-dibromomethylene-D-ATP) | Sigma-Aldrich (Deisenhofen, Germany) | A265 | |
| Apyrase VI | Sigma-Aldrich (Deisenhofen, Germany) | A6410 | |
| Apyrase VII | Sigma-Aldrich (Deisenhofen, Germany) | A6535 | |
| Gap26 (VCYDKSFPISHVR) | Custom peptide synthesis | ||
| Gap27 (SRPTEKTIFII) | Custom peptide synthesis | ||
| Control Peptide (SRGGEKNVFIV) | Custom peptide synthesis | ||
| siRNA1 Cx43 (sense: 5'GAAGGAGGAGGAACU-CAAAdTdT) | Annealed siRNA was purchased at Eurogentec (Luik, Belgium) | ||
| siRNA2 Cx43 (sense: 5'CAAUUCUUCCUGCCGCAAUdTdT) | Annealed siRNA was purchased at Eurogentec (Luik, Belgium) | ||
| siRNA scramble: scrambled sequence of siCx43-1 (sense: 5'GGUAAACG-GAACGAGAAGAdTdT) | Annealed siRNA was purchased at Eurogentec (Luik, Belgium) | ||
| TAT-L2 (TAT- DGANVDMHLKQIEIKKFKYGIEEHGK) | Thermo Electron (Ulm, Germany) | ||
| TAT-L2-H126K/I130N (TAT-DGANVDMKLKQNEIKKFKYGIEEHGK) | Thermo Electron (Ulm, Germany) | ||
| Two chambered glass slides | Laboratory-Tek Nunc (Roskilde, Denmark) | 155380 | |
| Confocal microscope | Carl Zeiss Meditec (Jena, Germany) | LSM510 | |
| Piez–lectric crystal nanopositioner (Piezo Flexure NanoPositioner) | PI Polytech (Karlsruhe, Germany) | P-280 | |
| HVPZT-amplifier | PI Polytech (Karlsruhe, Germany) | E463 HVPZT-amplifier | |
| Glass tubes (glass replacement 3.5 nanoliter) | World Precision Instruments, Inc. Sarasota, Florida, USA | 4878 | |
| Micr–lectrode puller | Zeitz Instrumente (Munchen, Germany) | WZ DMZ-Universal Puller |
Ссылки
- Vinken, M., et al. Connexins and their channels in cell growth and cell death. Cell Signal. 18, 592-600 (2006).
- Mese, G., Richard, G., White, T. W. Gap junctions: basic structure and function. J. Invest. Dermatol. 127, 2516-2524 (2007).
- Bruzzone, R., White, T. W., Paul, D. L. Connections with connexins: the molecular basis of direct intercellular signaling. Eur. J. Biochem. 238, 1-27 (1996).
- White, T. W., Bruzzone, R., Paul, D. L. The connexin family of intercellular channel forming proteins. Kidney Int. 48, 1148-1157 (1995).
- Decrock, E., et al. Connexin-related signaling in cell death: to live or let die? Cell Death Differ. 16, 524-536 (2009).
- Herve, J. C. Gap junctional complexes: from partners to functions. Prog. Biophys. Mol. Biol. 94, 1-4 (2007).
- Herve, J. C., Bourmeyster, N., Sarrouilhe, D., Duffy, H. S. Gap junctional complexes: from partners to functions. Prog. Biophys. Mol. Biol. 94, 29-65 (2007).
- Bruzzone, R., Barbe, M. T., Jakob, N. J., Monyer, H. Pharmacological properties of homomeric and heteromeric pannexin hemichannels expressed in Xenopus oocytes. J. Neurochem. 92, 1033-1043 (2005).
- Ebihara, L., Steiner, E. Properties of a nonjunctional current expressed from a rat connexin46 cDNA in Xenopus oocytes. J. Gen. Physiol. 102, 59-74 (1993).
- Evans, W. H., De Vuyst, E., Leybaert, L. The gap junction cellular internet: connexin hemichannels enter the signalling limelight. Biochem. J. 397, 1-14 (2006).
- Leybaert, L., Sanderson, M. J. Intercellular Ca2+ waves: mechanisms and function. Physiol. Rev. 92, 1359-1392 (2012).
- Sanderson, M. J., Charles, A. C., Dirksen, E. R. Mechanical stimulation and intercellular communication increases intracellular Ca2+ in epithelial cells. Cell Regul. 1, 585-596 (1990).
- Himpens, B., Stalmans, P., Gomez, P., Malfait, M., Vereecke, J. Intra- and intercellular Ca2+ signaling in retinal pigment epithelial cells during mechanical stimulation. Faseb J. 13, 63-68 (1999).
- Williams, K. K., Watsky, M. A. Bicarbonate promotes dye coupling in the epithelium and endothelium of the rabbit cornea. Curr. Eye Res. 28, 109-120 (2004).
- Hernandez Galindo, E. E., Theiss, C., Steuhl, K. P., Meller, D. Gap junctional communication in microinjected human limbal and peripheral corneal epithelial cells cultured on intact amniotic membrane. Exp Eye Res. 76, 303-314 (2003).
- Williams, K., Watsky, M. Gap junctional communication in the human corneal endothelium and epithelium. Curr. Eye Res. 25, 29-36 (2002).
- Anderson, S. C., Stone, C., Tkach, L., SundarRaj, N. Rho and Rho-kinase (ROCK) signaling in adherens and gap junction assembly in corneal epithelium. Invest. Ophthalmol. Vis. Sci. 43, 978-986 (2002).
- Joyce, N. C., Harris, D. L., Zieske, J. D. Mitotic inhibition of corneal endothelium in neonatal rats. Invest. Ophthalmol. Vis. Sci. 39, 2572-2583 (1998).
- Klepeis, V. E., Weinger, I., Kaczmarek, E., Trinkaus-Randall, V. P2Y receptors play a critical role in epithelial cell communication and migration. J. Cell Biochem. 93, 1115-1133 (2004).
- Klepeis, V. E., Cornell-Bell, A., Trinkaus-Randall, V. Growth factors but not gap junctions play a role in injury-induced Ca2+ waves in epithelial cells. J. Cell Sci. 114, 4185-4195 (2001).
- Laux-Fenton, W. T., Donaldson, P. J., Kistler, J., Green, C. R. Connexin expression patterns in the rat cornea: molecular evidence for communication compartments. Cornea. 22, 457-464 (2003).
- Rae, J. L., Lewno, A. W., Cooper, K., Gates, P. Dye and electrical coupling between cells of the rabbit corneal endothelium. Curr. Eye Res. 8, 859-869 (1989).
- Watsky, M. A., Rae, J. L. Dye coupling in the corneal endothelium: effects of ouabain and extracellular calcium removal. Cell Tissue Res. 269, 57-63 (1992).
- Williams, K. K., Watsky, M. A. Dye spread through gap junctions in the corneal epithelium of the rabbit. Curr. Eye Res. 16, 445-452 (1997).
- D'hondt, C., Ponsaerts, R., Srinivas, S. P., Vereecke, J., Himpens, B. Thrombin inhibits intercellular calcium wave propagation in corneal endothelial cells by modulation of hemichannels and gap junctions. Invest. Ophthalmol. Vis. Sci. 48, 120-133 (2007).
- D'hondt, C., Ponsaerts, R., Srinivas, S. P., Vereecke, J., Himpens, B. Reduced intercellular communication and altered morphology of bovine corneal endothelial cells with prolonged time in cell culture. Curr. Eye Res. 34, 454-465 (2009).
- D'hondt, C., Srinivas, S. P., Vereecke, J., Himpens, B. Adenosine Opposes Thrombin-Induced Inhibition of Intercellular Calcium Wave in Corneal Endothelial Cells. Invest Ophthalmol. Vis. Sci. 48, 1518-1527 (2007).
- Gomes, P., Srinivas, S. P., Van Driessche, W., Vereecke, J., Himpens, B. ATP release through connexin hemichannels in corneal endothelial cells. Invest. Ophthalmol. Vis. Sci. 46, 1208-1218 (2005).
- Gomes, P., Srinivas, S. P., Vereecke, J., Himpens, B. ATP-dependent paracrine intercellular communication in cultured bovine corneal endothelial cells. Invest. Ophthalmol. Vis. Sci. 46, 104-113 (2005).
- Gomes, P., Srinivas, S. P., Vereecke, J., Himpens, B. Gap junctional intercellular communication in bovine corneal endothelial cells. Exp Eye Res. , (2006).
- Ponsaerts, R., et al. The myosin II ATPase inhibitor blebbistatin prevents thrombin-induced inhibition of intercellular calcium wave propagation in corneal endothelial cells. Invest. Ophthalmol. Vis. Sci. 49, 4816-4827 (2008).
- Ponsaerts, R., et al. RhoA GTPase Switch Controls Cx43-Hemichannel Activity through the Contractile System. PLoS ONE. 7, e42074(2012).
- Ponsaerts, R., et al. Intramolecular loop/tail interactions are essential for connexin 43-hemichannel activity. Faseb J. 24, 4378-4395 (2010).
- Charles, A. Reaching out beyond the synapse: glial intercellular waves coordinate metabolism. Sci STKE. 2005, pe6(2005).
- Laird, D. W. Life cycle of connexins in health and disease. Biochem. J. 394, 527-543 (2006).
- Kelsell, D. P., Dunlop, J., Hodgins, M. B. Human diseases: clues to cracking the connexin code. Trends Cell Biol. 11, 2-6 (2001).
- Pearson, R. A., Dale, N., Llaudet, E., Mobbs, P. ATP released via gap junction hemichannels from the pigment epithelium regulates neural retinal progenitor proliferation. Neuron. 46, 731-744 (2005).
- Klepeis, V. E., Weinger, I., Kaczmarek, E., Randall, V. T. P2Y receptors play a critical role in epithelial cell communication and migration. J. Cell Biochem. 93, 1115-1133 (2004).
- Cotrina, M. L., Lin, J. H., Lopez-Garcia, J. C., Naus, C. C., Nedergaard, M. ATP-mediated glia signaling. J. Neurosci. 20, 2835-2844 (2000).
- Burnstock, G., Williams, M. P2 purinergic receptors: modulation of cell function and therapeutic potential. J. Pharmacol. Exp. Ther. 295, 862-869 (2000).
- Schwiebert, E. M., Zsembery, A. Extracellular ATP as a signaling molecule for epithelial cells. Biochim. Biophys Acta. 1615, 7-32 (2003).
- Lazarowski, E. R., Boucher, R. C., Harden, T. K. Mechanisms of release of nucleotides and integration of their action as P2X- and P2Y-receptor activating molecules. Mol. Pharmacol. 64, 785-795 (2003).
- Dubyak, G. R., el-Moatassim, C. Signal transduction via P2-purinergic receptors for extracellular ATP and other nucleotides. Am. J. Physiol. 265, C577-C606 (1993).
- Blair, S. A., Kane, S. V., Clayburgh, D. R., Turner, J. R. Epithelial myosin light chain kinase expression and activity are upregulated in inflammatory bowel disease. Lab. Invest. 86, 191-201 (2006).
- Boudreault, F., Grygorczyk, R. Cell swelling-induced ATP release and gadolinium-sensitive channels. Am. J. Physiol. Cell Physiol. 282, C219-C226 (2002).
- Romanov, R. A., Rogachevskaja, O. A., Khokhlov, A. A., Kolesnikov, S. S. Voltage dependence of ATP secretion in mammalian taste cells. J. Gen. Physiol. 132, 731-744 (2008).
- Pelegrin, P., Surprenant, A. Pannexin-1 mediates large pore formation and interleukin-1beta release by the ATP-gated P2X7 receptor. Embo J. 25, 5071-5082 (2006).
- Surprenant, A., Rassendren, F., Kawashima, E., North, R. A., Buell, G. The cytolytic P2Z receptor for extracellular ATP identified as a P2X receptor (P2X7). Science. 272, 735-738 (1996).
- D'hondt, C., et al. Pannexin channels in ATP release and beyond: an unexpected rendezvous at the endoplasmic reticulum. Cell Signal. 23, 305-316 (2011).
- Leybaert, L., et al. Connexin channels, connexin mimetic peptides and ATP release. Cell Commun. Adhes. 10, 251-257 (2003).
- Stout, C. E., Costantin, J. L., Naus, C. C., Charles, A. C. Intercellular calcium signaling in astrocytes via ATP release through connexin hemichannels. J. Biol. Chem. 277, 10482-10488 (2002).
- Verma, V., Hallett, M. B., Leybaert, L., Martin, P. E., Howard Evans, W. Perturbing plasma membrane hemichannels attenuates calcium signalling in cardiac cells and HeLa cells expressing connexins. Eur. J. Cell Biol. , (2008).
- Pharmacol, B. rJ. 147, S172-S181 (2006).
- Slakey, L. L., Gordon, E. L., Pearson, J. D. A comparison of ectonucleotidase activities on vascular endothelial and smooth muscle cells. Ann. N.Y. Acad. Sci. 603, 366-378 (1990).
- Gordon, E. L., Pearson, J. D., Slakey, L. L. The hydrolysis of extracellular adenine nucleotides by cultured endothelial cells from pig aorta. Feed-forward inhibition of adenosine production at the cell surface. J. Biol. Chem. 261, 15496-15507 (1986).
- Moerenhout, M., Himpens, B., Vereecke, J. Intercellular communication upon mechanical stimulation of CPAE- endothelial cells is mediated by nucleotides. Cell Calcium. 29, 125-136 (2001).
- Ralevic, V., Burnstock, G. Receptors for purines and pyrimidines. Pharmacol. Rev. 50, 413-492 (1998).
- Edelhauser, H. F. The resiliency of the corneal endothelium to refractive and intraocular surgery. Cornea. 19, 263-273 (2000).
- George, A. J., Larkin, D. F. Corneal transplantation: the forgotten graft. Am. J. Transplant. 4, 678-685 (2004).
- Hong, S. J., Wu, K. Y., Wang, H. Z., Fong, J. C. Change of cytosolic Ca2+ mobility in cultured bovine corneal endothelial cells by endothelin-1. J. Ocul. Pharmacol. Ther. 19, 1-9 (2003).
- Crawford, K. M., MacCallum, D. K., Ernst, S. A. Histamine H1 receptor-mediated Ca2+ signaling in cultured bovine corneal endothelial cells. Invest. Ophthalmol. Vis. Sci. 33, 3041-3049 (1992).
- Crawford, K. M., MacCallum, D. K., Ernst, S. A. Agonist-induced Ca2+ mobilization in cultured bovine and human corneal endothelial cells. Curr. Eye Res. 12, 303-311 (1993).
- Srinivas, S. P., Yeh, J. C., Ong, A., Bonanno, J. A. Ca2+ mobilization in bovine corneal endothelial cells by P2 purinergic receptors. Curr. Eye Res. 17, 994-1004 (1998).
- Satpathy, M., Gallagher, P., Jin, Y., Srinivas, S. P. Extracellular ATP opposes thrombin-induced myosin light chain phosphorylation and loss of barrier integrity in corneal endothelial cells. Exp Eye Res. 81, 183-192 (2005).
- Srinivas, S. P., et al. Cell volume response to hyposmotic shock and elevated cAMP in bovine trabecular meshwork cells. Exp. Eye Res. 78, 15-26 (2004).
- D'hondt, C., Ponsaerts, R., De Smedt, H., Bultynck, G., Himpens, B. Pannexins, distant relatives of the connexin family with specific cellular functions. Bioessays. 31, 953-974 (2009).
- Boitano, S., Dirksen, E. R., Sanderson, M. J. Intercellular propagation of calcium waves mediated by inositol trisphosphate. Science. 258, 292-295 (1992).
- De Vuyst, E., et al. Intracellular calcium changes trigger connexin 32 hemichannel opening. EMBO J. 25, 34-44 (2006).
- De Vuyst, E., et al. Ca2+ regulation of connexin 43 hemichannels in C6 glioma and glial cells. Cell Calcium. 46, 176-187 (2009).
- Weissman, T. A., Riquelme, P. A., Ivic, L., Flint, A. C., Kriegstein, A. R. Calcium waves propagate through radial glial cells and modulate proliferation in the developing neocortex. Neuron. 43, 647-661 (2004).
- Iyer, S., Deutsch, K., Yan, X., Lin, B. Batch RNAi selector: a standalone program to predict specific siRNA candidates in batches with enhanced sensitivity. Computer Methods and Programs in Biomedicine. 85, 203-209 (2007).
- Stehberg, J., et al. Release of gliotransmitters through astroglial connexin 43 hemichannels is necessary for fear memory consolidation in the basolateral amygdala. Faseb J. 26, 3649-3657 (2012).
- Evans, W. H., Bultynck, G., Leybaert, L. Erratum to: Manipulating Connexin Communication Channels: Use of Peptidomimetics and the Translational Outputs. J. Membr. Biol. 245, 451(2012).
- Majumder, P., et al. ATP-mediated cell-cell signaling in the organ of Corti: the role of connexin channels. Purinergic Signal. 6, 167-187 (2010).
- Carvalho, A. C., et al. affects intracellular Ca2+ stores and induces Ca2+ wave propagation. Cell Death Differ. 11, 1265-1276 (2004).
- Torres, A., et al. Extracellular Ca2+ acts as a mediator of communication from neurons to glia. Sci. Signal. 5, ra8(2012).
- Decrock, E., et al. Transfer of IP(3) through gap junctions is critical, but not sufficient, for the spread of apoptosis. Cell Death Differ. 19 (3), 947-957 (2012).
- Beltramello, M., Piazza, V., Bukauskas, F. F., Pozzan, T., Mammano, F. Impaired permeability to Ins(1,4,5)P3 in a mutant connexin underlies recessive hereditary deafness. Nat. Cell Biol. 7 (1,4,5), 63-69 (2005).
- Bukauskas, F. F., Bukauskiene, A., Verselis, V. K. Conductance and permeability of the residual state of connexin43 gap junction channels. J. Gen. Physiol. 119, 171-186 (2002).
- Bukauskas, F. F., Verselis, V. K. Gap junction channel gating. Biochim. Biophys. Acta. 1662, 42-60 (2004).
- Dahl, G. Where are the gates in gap junction channels? Clin. Exp. Pharmacol. Physiol. 23, 1047-1052 (1996).
- Retamal, M. A., Schalper, K. A., Shoji, K. F., Bennett, M. V., Saez, J. C. Opening of connexin 43 hemichannels is increased by lowering intracellular redox potential. Proc. Natl. Acad. Sci. U.S.A. 104, 8322-8327 (2007).
- Shibayama, J., et al. Effect of charge substitutions at residue his-142 on voltage gating of connexin43 channels. Biophys. J. 91, 4054-4063 (2006).
- Desplantez, T., Verma, V., Leybaert, L., Evans, W. H., Weingart, R. Gap26, a connexin mimetic peptide, inhibits currents carried by connexin43 hemichannels and gap junction channels. Pharmacological Research: The Official Journal of the Italian Pharmacological Society. 65, 546-552 (2012).
- Delmar, M. Gap junctions as active signaling molecules for synchronous cardiac function. J. Cardiovasc. Electrophysiol. 11, 118-120 (2000).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены