Method Article
細胞単層に機械的刺激によって誘発されるカルシウム波の伝播:ウシ角膜内皮細胞の例
要約
細胞間のCa 2 +波は、ギャップ結合チャネルとヘミチャネルによって駆動される。ここでは、細胞間のCaを測定するための方法を説明 2 +波。
要約
細胞間のコミュニケーションは、脳、肝臓、網膜、蝸牛と血管系を含む、臓器や組織の様々な細胞間の生理学的プロセスの調整のために不可欠です。実験的な設定では、細胞内のCa 2 +波単一セルに機械的刺激を印加することによって誘発することができる。これは、細胞内シグナル伝達分子のIP 3およびCa 2のリリースにつながる+隣接セルへの機械的刺激を受けた細胞から+波同心円状のCa 2の伝播を開始すること。細胞内のCa 2 +波の伝播を制御する主要な分子経路は、IP 3の直接転送を通って、ATPの放出を通じてヘミチャネルによってギャップ結合チャネルによって提供されます。プロパティと異なるコネキシンおよびギャップ結合チャネルとヘミチャネルとしてpannexinアイソフォームの規制の同定と特徴付けはquantificatioで許可されているnは細胞内のCa 2 +波は、siRNA、およびギャップ結合チャネルとヘミチャネルの阻害剤の使用の広がり。ここでは、結果として細胞内のCa 2細胞の急性、短期的な変形によって引き起こさ制御およびローカライズされた機械的刺激に応答しFluo4-AMでロードプライマリー角膜内皮細胞の単層で+波を測定するための方法を説明1μm未満の先端径を有するマイクロマニピュレータ制御されたガラスマイクロピペットで細胞膜に触れる。また、+波ATPの放出を通じて細胞内のCa 2のための駆動力としてCx43の-ヘミチャネルの活性を評価するためのモデル系として、一次ウシ角膜内皮細胞およびその使用の単離を記述している。最後に、我々は、使用、利点、制限およびギャップ結合チャネルとヘミチャネル研究の文脈におけるこの方法の選択肢を議論する。
概要
細胞間のコミュニケーションとシグナリングは細胞外組織におけるアゴニスト及び全臓器レベル1,2に対応して生理学的プロセスの調整のために不可欠である。細胞間コミュニケーションの最も直接的な方法は、ギャップ結合の発生によって作成されます。ギャップ結合は、隣接するセル3,4( 図1)の2コネキシン(Cxの)ヘミチャネルの頭に頭ドッキングによって形成されたタンパク性チャネルであるギャップ結合チャネルのプラークです。ギャップ結合は、隣接セル6( 図2)の細胞内貯蔵から引き起こし、変調のCa 2 +放出のCa 2 +又はIP 3 5を含む1.5未満キロダルトンの分子量を有する小さなシグナル伝達分子の通過を可能にする。ギャップ結合チャネルはしっかりレドックス変形例のように、内および分子間相互作用によって、タンパク質と細胞内シグナル伝達プロセスによって規制されているとリン7。 GJSは、それによって化学的および電気的合胞体として作用し、接続されたセルの協調対応を容易にします。例えば、心房および心室筋細胞全体の心筋活動電位の広がりはCxに基づくGJチャネル85によって媒介される。 CXSはギャップ結合チャネルとしての役割を持っているだけでなく、対ヘミチャネルを形成することにより、定期的なイオンチャネル8-10( 図1)と同様に膜におけるチャネルとして機能していない。ヘミチャネルは、イントラと細胞外環境との間のイオンとシグナル伝達分子の交換を制御することにより、隣接するセル間のパラクリンシグナリングに参加しています。
多くの細胞型(上皮細胞、骨芽細胞、星状細胞、内皮細胞などのような)及び器官(脳、肝臓、網膜、蝸牛および脈管構造等)において、細胞間のCa 2 +波多細胞応答の調整のための基本となる 11。特定の細胞内Ca 2 +濃度の増加は、このセルに限定されるものではなく、それによって細胞内のCa 2 +波12,13を確立し 、周囲の隣接セルに伝達されない。これらの細胞内のCa 2 +波合胞体などの細胞層の正常な生理的調節のために重要であり、それらの調節不全は、病態生理学的プロセス11と関連している。角膜内皮および上皮では、私たち自身の25-33を含む異なるグループ14-24は 、細胞間コミュニケーションの仕組みや役割を学んだ。非興奮性細胞では、角膜内皮細胞のように、細胞間コミュニケーションの二つの異なるモードが28,29、すなわちギャップ結合細胞間コミュニケーションとパラクリン細胞間のコミュニケーションを発生する。ギャップ結合細胞間コミュニケーションは、ギャップジャンクション7 を介してシグナル伝達分子の直接交換を伴う。ギャップジャンクションtional細胞間の通信は、細胞増殖を制御し、細胞外ストレス10,34,35に同期された応答を確立し、組織の恒常性を維持するために重要である。病状の数は、ギャップ結合の結合が不完全によりCXSに減少し、これによって細胞間のギャップ結合コミュニケーション36に影響を及ぼしている。これは、多細胞生物におけるギャップ結合細胞間コミュニケーションの重要性と影響力を強調している。それは、細胞外拡散性メッセンジャー( 図2)の放出を伴うため、ギャップ結合細胞間の通信とは対照的に、傍分泌細胞間の通信は、細胞-細胞同格に依存しない。シグナル伝達分子の異なるタイプのシグナリング細胞によって細胞外空間に放出される。分子は、それが特定の受容体タンパク質によって検出される標的細胞に輸送される。その後、受容体シグナル複合体はどの細胞応答を誘導信号、不活化又は脱感作を除去することによって終了する。リリース脂溶性の細胞外シグナル伝達の使者は膜を貫通し、細胞内の受容体に作用。対照的に、親水性の使者が応答細胞の原形質膜を通過しないが、その後、細胞内環境への信号を中継する表面発現受容体タンパク質に結合するリガンドとして作用する。細胞表面受容体タンパク質の三大家族がこのプロセスに参加:イオンチャネル連結、酵素、およびGタンパク質結合した。解放メッセンジャー分子は、近接標的細胞(パラクリン)上、または循環系(内分泌)を必要とする遠隔標的細胞に、同一セル(自己分泌)の受容体に作用することができる。
角膜内皮28,29を含む多くの細胞型において、ATPは、細胞間のCa 2 +波37-40の伝播を駆動する主要な親水性、パラクリン要因の一つである。 DURる種々の薬剤による機械的変形、低酸素症、炎症または刺激ATPは44,45を膨潤せん断応力、伸張、又は浸透圧に応答して41-44健常細胞から放出させることができる。別のATP放出メカニズムは、同様に、小胞のエキソサイトー44、例えばATP結合カセット(ABC)トランスポーター、形質膜電位依存性アニオンチャネル46、P2X7受容チャネル47,48などのトランスポートメカニズムの過多を含む、仮定されている コネキシンのヘミチャネル49-52とpannexinのヘミチャネル43,49,53。細胞外ATPはADP、AMPに急速に加水分解されると細胞外環境に存在するectonucleotidasesで54,55をアデノシンができます。細胞外に放出されたATP及びその代謝ADP 56は拡散によって広がっていく。隣接するセルでプリン受容体とこれらのヌクレオチドのその後の相互作用は、pに関与している細胞内のCa 2 +波28,37,51のropagation。プリン受容体の二つの異なるクラスが存在している:両方のプリン(ATP、ADP)とピリミジン(UTP、UDP)ヌクレオチドが最もP2-57プリン受容体に作用しながら、アデノシンは、P1-プリン受容体の主要天然リガンドである。
細胞間のコミュニケーションは、スクレープ負荷、移染、IP 3およびCa 2 +、機械的刺激、 等のようなアゴニストのローカルアンケージングなどの異なる方法で調査することができる。ここでは、+波の伝播は、単一セルの機械的刺激によって誘発されるのCa 2の研究を説明します。機械的刺激によってのCa 2 +波伝播を研究することの利点は、時間をかけてのCa 2 +波の広がりを定量化する簡単なツールを提供し、それは定量的に細胞の異なる前処理とを比較可能にすることである。角膜内皮において、これらの細胞内のCa 2 +波共同を可能にする単層からコーディネートの応答は、ここに眼内手術中に細胞外の応力に耐えられるように内皮を助ける非再生角膜内皮の可能性の防御機構として機能しているか、免疫拒絶またはブドウ膜炎58,59間に炎症性メディエーターに暴露される。
プロトコル
1。角膜内皮細胞の分離
始める前にした場合:目をenucleating後できるだけ早く、地元の屠殺場から入手した、新鮮な目から細胞を分離します。目が最大18ヶ月、5分死後とアールの平衡塩類溶液中で保存の牛から、摘出されたことを確認してください - 4で1%ヨウ素溶液実験室への輸送のための°C。
- 1%ヨウ素溶液をペトリ皿(100×20㎜)に置く - アールの平衡塩溶液の目を取り出します。
- 70%エタノールを含有する溶液と目を殺菌し、1%のヨウ素が含まれているアールの平衡塩類溶液で洗い流してください。
- でこの手順から、無菌フードで働く。注意深く目から角膜を解剖し、上向き上皮細胞層とアールの平衡塩類溶液を含むペトリ皿(35×10mm)で、中に入れてください。慎重に残っ虹彩組織のSTIを削除必要に応じて角膜に付着う。
- 上向きの内皮細胞層とペトリ皿を含む別のアールの平衡塩類溶液に角膜を転送し、アールの平衡塩類溶液で2回すすいでください。
- カップ状の皿です砂時計に上向き内皮層と角膜を移し、増殖培地でそれをカバーしています。増殖培地は、25 mMグルコース、10%ウシ胎児血清、6.6%L-グルタミン、2.5μgの/ mlのアムホテリシン-Bと1%抗生物質 - 抗真菌剤混合物を10,000単位を含む/ mlペニシリン、10,000アンピシリンを含有するダルベッコ変法イーグル培地から成りストレプトマイシン/ mlで、25μgの/ mlのアムホテリシンBを
- 吸引ピペットで培地を除去。
- 角膜の内皮層(トリプシンを含むすべてのステップが同じ濃度を使用して行われています)にトリプシン溶液(0.5グラム/ L)を300μlを適用します。
- 覆われたペトリ皿に角膜を含む砂時計を置き、株式会社に入れ37℃で30分間ubator℃、5%CO 2。
- 優しく無菌フード内火災研磨フック状のガラスパスツールピペットを用いて角膜から内皮細胞をこすり取る。
- 内皮細胞を含む溶液を吸う、培養培地4mlを含有する培養フラスコ(25cm 2の )に追加する。
- 角膜に増殖培地300μlのを適用し、スクレイピングを繰り返し、培養フラスコに内皮細胞を含む溶液を追加します。
- もう一度、この最後のステップ(1.11)を繰り返します。
- 培養物を配置し、37℃インキュベーター内で増殖培地℃、5%CO 2で角膜内皮細胞を含有するフラスコ。
- 2日後、培養培地を6 mlを加える。
- 毎秒一日成長培地をリフレッシュします。
2。細胞培養
- 培地を取り出して、到達したコンフルエントアールの平衡塩類溶液、(アブー内で細胞を2回洗浄する分離後のtは10日)。
- それらをデタッチし、3〜4分間インキュベーター(37℃、5%CO 2)でフラスコを配置する細胞に1.5ミリリットルトリプシン溶液を加える。
- 増殖培地12ミリリットルを追加します。細胞を分散させ、細胞をカウントするために内と外培地三回ピペット。
- シード細胞密度に応じて可変の端数を持つ細胞と培養器に入れます。 165,000細胞の細胞数(1cm 2当たりの細胞密度39286)を持つ2つのウェルチャンバースライドを(4.2 cm 2との面積を持つ)を準備します。 1cm 2当たり6,250の密度で新しい道を80 cm 2と培養フラスコを準備し、25ミリリットルの合計ボリュームに新鮮な培地を追加します。
- 2日ごとに培地をリフレッシュします。
- 細胞層の密集度は、3〜4日後に到達する。実験のためにセルを使用。
- ときフラスコ内の細胞層の密集度に達している、2.6に手順2.1を繰り返します。通路2までの細胞培養物をfを用いることができるまたは実験。
3。誘導カルシウムウェーブのために機械的刺激
- 静かに振とうしながら10μMのFluo-4とチャンバースライドで細胞をロードするには、AMで37℃で30分間のためにリン酸緩衝生理食塩水。
- フルオ-4ソリューションAM削除、リン酸緩衝生理食塩水で細胞を5回洗って、リン酸緩衝生理食塩水で細胞をインキュベートし、測定前に室温で少なくとも5分間細胞を残す。
- アルゴンレーザーと使用ビームスプリッタHFT 488と488 nmで励起し、ロングパス発光フィルターLP 505を使用して530 nmで蛍光発光を収集するには、最低でもピンホールを設定します。油浸40X対物レンズ(エア、1.2 NA)を使用します。 ARL-67156を用いた実験では、10倍の対物レンズ(エア、0.3 NA)を使用します。
- 細胞は共焦点顕微鏡に合流されているフィールドを検索します。
- それは位置チャンバースライドに対しては45°であり、細胞膜に触れるように、ピペットを。単一のセルに短い(≈1秒)機械的刺激を引き起こす。機械的な刺激が簡潔ですアンプを通して運営圧電結晶ナノポジショナに結合ガラスマイクロピペット(先端直径<1μm)を持つ細胞膜の1%未満に触れることにより、細胞の急性、短期的な変形で構成されていますマイクロマニピュレータに取り付け。ガラスマイクロピペットは、微小電極プラーで作られています。ナノポジショナが機械的刺激の間に0.2〜1.5 Vの間の電圧によって運営されていることを確認してください。 1.5 V以上の電圧は、セルの損傷につながることができます。各セルタイプと条件については、細胞の損傷なし機械的刺激のための最適な電圧を慎重ハイ(1.5V)電圧(0.2 V)が低いから始まる一連の電圧を印加することによって決定されなければならない。この電圧が細胞膜に適用される機械的応力および歪みを決定するので、電圧は、刺激の力の尺度である。ザ機械的刺激の力は領域で機械的応力を掛けることによって算出することができる。領域(<3.14ミクロン2)および機械的応力の両方が非常に低いので、機械的な刺激の力が低い。 (細胞が損傷したときに、セルとセルの外蛍光漏れが暗くなりますので注意してください。)
- 共焦点顕微鏡での[Ca 2 +] iの次の機械的な刺激の空間的な変化を測定する。
- 画像を収集し、保管してください。
- 共焦点顕微鏡のソフトウェアを使用して応答性の細胞(アクティブエリア、AA)の総表面積を定義するには、興味のある多角形領域を描画します。
結果
すべての実験は、関連するすべてのガイドライン、規制、規制機関に準拠して実行され、実証されているプロトコルは、KUルーベンの動物のケアと使用委員会の指導と承認の下で行われる。
ウシ角膜内皮細胞(BCEC)で、機能的なギャップ結合を発現させ、ギャップ結合細胞間コミュニケーションとパラクリン細胞間通信の両方は、インタラクティブな方法で細胞間のコミュニケーションに大きく貢献するが、主な経路はによって仲介パラクリン細胞間の通信経路であることが示されているされているCx43のベースヘミチャネル28,29を通じてATP放出。 ATPとADPはectonucleotidase E-NTPD1(ectonucleoside三リン酸ジホ1、CD39 ATPジホ)により一リン酸(AMP)をアデノシンために加水分解され、その後、5'-ectonucleotidase CD73 28,29によってアデノシンする。 ATPとADPはに貢献P2Y1およびP2Y2受容体28,29に結合することによりCa 2 +の波の伝播。受容体Gqを介した PLCに結 合して、それによってIP呼び起こす両方3誘発性のCa 2 +放出( 図2)。 BCEC、の[Ca 2 +] O 60の除去に鈍感であるの[Ca 2 +] iの 、の急激な増加でプリンP2Y受容体の結果の刺激で。の[Ca 2 +]アゴニスト刺激により誘発されるiのピークが安定し、アゴニスト依存標高につながることができた[Ca 2 +] iの減少が続いている、の[Ca 2 +] O依存振動変動、またはベースラインに戻り60-62。 BCECでのCa 2 +放出PLCとIP 3 29が関与する経路を介して発生したことを示す証拠があった。 IP 3敏感な店を空にするの[Ca 2 +] iの 、その後カリフォルニアに続いての最初のピークにつながるpacitativeのCa 2 +流入プラトー期63の発症につながる。
機械的な刺激のCa 2の急速な立ち上がりにつながる+刺激の点に由来して、機械的に刺激し、細胞全体に広がっている。最後に、細胞内Ca 2 +レベルゆっくりベースラインレベルに戻って減少する。セル境界に到達すると、基底レベル( 図3)に減衰するのCa 2 +のような過渡波状に取り囲む周辺セル(NB)に細胞間のCa 2 +波伝播する。制御条件ではCa 2 + -トランジェント離れて機械的に刺激された細胞( 図3)から約4〜8細胞層まで観察された。折れ線グラフは、( 図3のパネルの右側)+-トランジェント(正規化された蛍光(NF)値として表される)でのCa 2の経時変化を示す機械的に刺激され、セルと隣接セル層で一から五(NB1、NB2、NB3、NB4とNB5)。 図3から、機械的に刺激された細胞からの距離が増加するとの[Ca 2 +] iの高層の増加発症しながら時間遅延、正規化された蛍光が減少することは明らかである。機械的に刺激され、セル内の最大正規蛍光が0.95に到達した±0.04秒。最大の正規化された蛍光値に到達した後、正規化された蛍光は、基底値152に戻っ±6秒刺激25を塗布した後、非常に緩やかと緩やかな減少を示した。
外因性アピラーゼVI(30分間、5 U / ml)およびアピラーゼVII(30分間、5単位/ ml)の組み合わせを使用して、傍分泌細胞間の通信経路の阻害は、Ca 2がカバーするエリア内の7.5倍の減少を引き起こし+波、いわゆるアクティブエリア(AA、P <0.001、N = 7はn = 35)( 図4A)。アピラーゼは、ATPとADPを加水分解することが知られている。アピラーゼVIは高いATPアーゼ/ ADPase比とアピラーゼVII優先的に加水分解するADP 56を持っています。
角膜内皮におけるパラクリン細胞間コミュニケーションは、主にATP放出を介して行われて以来、28,29とATPは細胞外空間に加水分解される角膜内皮に発現することが知らectonucleotidases、29,64,65によって、我々の条件にAAへの影響を調べたここで、ATP加水分解はectonucleotidaseインヒビターを用いて抑制される。 ARL-67156(ARL、30分間、100μM)とectonucleotidasesの阻害はBCEC 25,26,28,29で既に実証されているように、Ca 2 +の波伝播の強力な増強をもたらした。 ( 図4B)、ARLにBCECの曝露は、条件(N = 12、N = 60、P <0.001)を制御するために比較してAAの3.5倍の増加を引き起こした。
前で我々の研究室でvious研究、コネキシン模倣ペプチド(Gap26とGap27、 表2)不活性なペプチドで、機械的刺激に続く細胞内のCa 2 +波の伝播にギャップ結合細胞間コミュニケーションとパラクリン間コミュニケーションの相対的な寄与を区別するために使用された(対照28,29 表2)。
Gap27とギャップ結合チャネルの阻害はかなり+波BCEC 30中のCa 2の伝播を減少させた。 AAが著しくGap27(30分間、300μM)で前処理により減少した(P <0.001、N = 8、N = 40)25( 表1)。コネキシン模倣ペプチドとコネキシンヘミチャネルの阻害Gap26 28,30が大幅BCEC 28中のCa 2 +波の伝播を減少させた。 AAが大幅Gap26(30分間300μM)で前処理により減少した(P <0.001、N = 8、N = 40)25( 表1)。
また、43 kDaのCxのアイソフォームは細胞内のCa 2 +波を誘発ヘミチャネル媒介ATP放出の基礎となる主要なコンポーネントであることを示した。 Cx43のを対象とした2独立に設計されたsiRNA分子を用いて、AAが約65%33( 表1)減少したことがわかった。これは、さらにAA(P <0.001で大きな減少を引き起こしたTAT-L2(100μM、30分)、Cx43のの細胞内ループ( 表2)の後半に相当する細胞透過性ペプチドを用いた実験によって支えられていた; N = 3、N = 30)( 表1)。重要なことに、TAT-L2のインキュベーションによるAAのこの減少は、TAT-L2を選択的Cx43のベースヘミチャネルではなく、ギャップ結合チャネル33を阻害するという概念を支 持し、傍分泌シグナル伝達の非存在下で観察されなかった。さらに、不活性なTAT-L2変異体(TAT-L2 H126K/I130N)は、制御( 表2)として使用することができる。

図1。概略図:ギャップ結合チャネルとヘミチャネルの形成。四膜貫通ドメイン含有タンパク質である6コネキシンまたはpannexinsが、放射状に中央の孔の周りに配置されたとき。A.コネキシンまたはpannexinヘミチャネルが形成されているヘミチャネルは、形質膜に配置されています。彼らは、同一のタンパク質サブタイプ(ホモメリックヘミチャネル)で構成することができますまたはそれらは二つ以上のアイソフォームは、同じセル(ヘテロヘミチャネル)で表され異なるタンパク質サブタイプから構成されます。二つの同一ホモメリックまたはヘテロヘミチャネルのドッキングから同型ギャップ結合チャネル結果。 Dからの異ギャップ結合チャネル結果二つの異なるホモメリックまたはヘテロチャネルのocking。二つの隣接するセルとヘミチャネルを接続するコネキシンとpannexinギャップ結合チャネルのB.概略構造。
(部分的に66から変更)
この図はもともとBioEssaysに掲載されました。 Catheleyneドント、Smedt、ヘアートBultynck、とバーナードHimpensますDeハンバートラフPonsaerts、。 Pannexins、特定の細胞の機能を持つコネキシン家族の遠い親戚。BioEssays、2009、31、953から974(2009)。BioEssaysは 大きい数字を表示するには、ここをクリックしてください 。
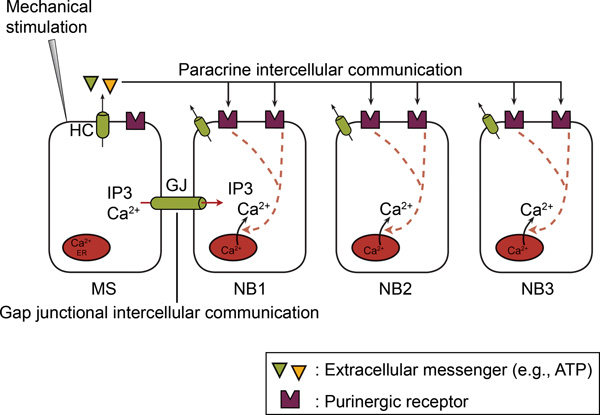
図2。非興奮性細胞では、内tercellularのCa 2 +波の伝播は、ギャップ結合細胞間コミュニケーションとパラクリン細胞間通信の両方が含まれます。単一セル、のCa 2の機械的刺激により+-上昇が機械的に刺激され、細胞内に発生した(MS)のCa 2 を介して +流入および/ またはCa 2 +の放出。その後、からのCa 2 +の上昇が伝播は、機械的に細胞内のCa 2 +波として隣接セル(NB)に刺激した。細胞間伝播には2つのメカニズム、すなわちギャップ結合細胞間コミュニケーションとパラクリン細胞間のコミュニケーションを必要とする。ギャップ結合細胞間通信では、仲介者の直接交換(IP 3及び/又はCa 2 +)は、ギャップジャンクション(GJS) を介して隣接する細胞の細胞質の間で発生します。パラクリン細胞間通信では、メッセンジャー( 例えば ATP)は、それによって、目の上にある受容体に作用して、細胞外空間に放出される隣接セルの電子表面。ヘミチャネル(HCS)または他のメカニズムは、(テキストを参照)は、このATP放出を媒介する。 ADPとAMPへEctonucleotidases加水分解ATP。 ATPとADP行為P2Y上および/または隣接セルにP2X受容体。 (66から撮影。)
この図はもともとBioEssaysに掲載されました。 Catheleyneドント、Smedt、ヘアートBultynck、とバーナードHimpensますDeハンバートラフPonsaerts、。 Pannexins、特定の細胞の機能を持つコネキシンファミリーの遠い親戚。BioEssays。2009 31、953から974(2009)。BioEssays。
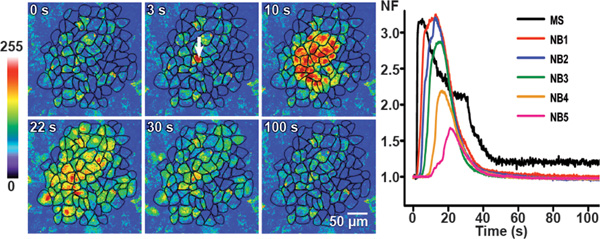
図3。 BCECにおける制御条件におけるカルシウム波伝播。機械刺激誘発性カルシウムトランジェントは代表的な疑似色の蛍光画像によってBCECにおける制御条件における異なる時間点で示されています。 fluore刺激前scence強度を最初の画像に表示されます。第二の画像に白い矢印は、機械的に刺激され、細胞を識別します。 62870μmの2:カルシウム波波(AAアクティブエリア)によって到達セルの総面積は6隣接セル層に伝播します。
折れ線グラフは、右側のパネルは機械的に刺激された細胞(MS)及び隣接細胞(NB)の層1〜5(NB1にNB5)におけるNFの平均値で正規化された蛍光値(NF)の経時変化を示している。 (部分的に25から変更しました。)
この図は、もともと調 査眼科と視覚科学に掲載されました。 Catheleyneドント、ラフPonsaerts、Sangly Pスリニバス、ヨハンVereecke、とバーナードHimpens。トロンビンは、ヘミチャネルおよびギャップ結合の変調によって角膜内皮細胞における細胞内カルシウム波の伝播を抑制する。 投資。 Ophthalmol。ヴィス。 SCI、2007。 48(1)、120から33(2007)。 調査眼科と視覚科学 。

図4。 +波外因nucleotidases(左)と治療後とBCECでectonucleotidase阻害剤(右)との細胞間のCa 2スプレッドの大幅な変更。 ATPとADPに加水分解外因apyrases(アピラーゼVI(5 U / ml)およびアピラーゼVII(5 U / ml)を30分間)とBCECの治療後のAAでA.大幅な減少、ここ阻害パラクリン細胞間の通信経路(N = 7はn = 35)。 *アピラーゼの存在対不在でP <0.001を意味選択ectonucleotidase阻害剤ARL-67156(ARL、30分間100μM)とBCECの治療後のAAでB.大幅に増加。、草本enhancinはgのパラクリン細胞間通信経路(N = 12、N = 60)。 * ARLの存在対不在でP <0.001を意味します。
| 正規化されたAA | 聖エラー | N | N | 統計 | |
| コントロール | 100 | 8.31 | 3 | 30 | |
| siScramble | 87.97 | 9.3 | 3 | 30 | |
| siCx43-1 | 32.45 | 8.23 | 3 | 30 | * |
| siCx43-2 | 35.49 | 7.06 | 3 | 30 | * |
| コントロールペプチド | 91.68 | 6.5 | 8 | 40 | |
| ギャップ26 | 46.67 | 4.24 | 8 | 40 | * |
| ギャップ27 | 53 | 4.76 | 8 | 40 | * |
| TAT-L2 | 6.99 | 0.71 | 3 | 30 | * |
表1。 BCECで正規化されたアクティブエリア(AA)にCx43のを標的とするsiRNA分子、コネキシン模倣ペプチドと細胞透過性ペプチドTAT-L2の効果。
Nは、実験の日数を表し、nは機械的な刺激の数を表す。 *制御条件に比べてP <0.001を意味します。
| AAシーケンス | |
| コントロールペプチド | SRGGEKNVFIV |
| Gap26 | VCYDKSFPISHVR |
| Gap27 | SRPTEKTIFII |
| TAT-L2 | YGRKKRRQRRR-DGANVDMHLKQIEIKKFKYGIEEHGK |
| TAT-L2H126K/I130N | YGRKKRRQRRR-DGANVDMKLKQNEIKKFKYGIEEHGK |
| 10Panx1 | WRQAAFVDSY |
表2。使用されるペプチドのアミノ酸配列。
ディスカッション
本稿では、マイクロピペットを使用して、ローカライズされた、制御された機械的刺激を提供することにより、プライマリウシ角膜内皮細胞の単層の細胞内のCa 2 +波の伝播を測定するための簡単な方法を述べる。機械的に刺激された細胞では、細胞内のCa 2 +波伝播11,67を駆動する本質的な細胞内シグナル伝達分子である、どちらも細胞内のIP 3およびCa 2における局所増加+、で応答します。のCa 2 +ヘミチャネルの開口部とGタンパク質共役P2の活性化を介して隣接セル中のCa 2 +信号をトリガATP 68,69の放出を誘発しながらIP 3を直接、ギャップ結合チャネル5 を介して隣接セルに転送される受容37-40。このプロセスのギャップ結合チャネルとヘミチャネルの相対的な寄与は、Cxの模倣の使用によって特徴付けられるペプチド、ATP分解酵素(ectonucleotidases)とectonucleotisdasesの阻害剤。ウシ角膜内皮細胞における機械的刺激によって誘発される細胞内のCa 2 +波の伝播特性を徹底的に研究室25-33で特徴づけられている。我々の結果は、細胞内のCa 2 +波の伝播は主にCx43のが顕著な役割を果たして、ATPのCX-ヘミチャネル媒介放出によって駆動されていることを示す。このように、第一のウシ角膜内皮細胞に適用されるこの方法は、天然の細胞中の内在性のレベルでのCx43ヘミチャネルの調節を特定したり特徴付けるのに特に適している。この方法を使用して、我々は、Cx43のヘミチャネルの活性が決定的に過剰なので、有害な予防内因ブレーキとして機能することができるアクトミオシン細胞骨格によって制御されることを見出しCx43のヘミチャネル開口25,31,32ている。今後もこの規制の根底にある分子機構を解明し、見つけるCx43のヘミチャネル33の開口部に不可欠な分子内ループ/テールの相互作用の重要な役割。
明らかに、このシステムは、CxのとPanxベースのギャップ結合チャネルとヘミチャネルの機能を研究するために非常に適しており、間違いなくウシ角膜内皮細胞に限定されず、実質的に任意の細胞型、また、より複雑な組織に適用可能であるとして示されている機械的刺激が大きい細胞内のCa 2 +波全体の半球を取り囲む70の引き金と脳である。さまざまなツールは、CX-模倣ペプチド、ATP分解酵素、ectonucleotidasesと49,50カルベノキソロンと10 Panx1( 表2)のような薬理学的化合物の阻害剤を含むギャップ結合チャネルとヘミチャネルの寄与を評価するために存在する。慎重に設計されたsiRNAのプローブ、このプロセスで特定のCxのかPanxアイソフォームの寄与を決定するために、TmRNAとスクランブル制御のargeting二つの独立した領域が使用されるべきである。ノックダウンの程度は、ウエスタンブロットアッセイ、蛍光顕微鏡を用いて単一細胞レベルを使用して、総タンパク質レベルで決定されるべきである。実験的な細胞単層におけるsiRNAのプローブのトランスフェクション効率は、蛍光顕微鏡検査によって評価されるべきである。このために、人は蛍光標識がセンス鎖の3 '末端に組み込んだ二重鎖のsiRNAを開発することができる。適切な分析、CxのPanx又はアイソフォーム(> 90%削減)の顕著な減少、ならびに細胞単層(内siRNA二本鎖の均一なトランスフェクション細胞の> 90%がsiRNAでトランスフェクトことに留意することが重要であるプローブ)が得られるはずである。目標に向け設計されたsiRNAプローブの選択性は71を評価すべきである。要するに、これらのツールは、それらが他のCxのかPanxアイソフォームまたは他の重要なCOMの発現に影響を与えないように検証する必要がありますponentsはP2XやP2Y受容体のように、細胞内のCa 2 +波を駆動する。 Cx43のヘミチャネルの寄与を評価するために、我々は選択的に、強力な阻害剤として作用しCx43の(TAT-L2)の細胞内ループの後半に相当する細胞透過性ペプチドを開発する博士Leybaertの研究室と協力していますCx43のヘミチャネルCx43のギャップジャンクションチャネル活性を維持しながら、33。我々の研究では、Cx43のヘミチャネルの完全な阻害を得るために、100μMTAT-L2を使用するが、より低い濃度で十分72であってもよい。 TAT-L2H126K/I130Nをネガティブコントロール73として推奨されます。 Panx1チャネルの寄与を評価するために、10Panx1ペプチドを適用することができる。これらのツールは、(Mのような形質膜破壊(下記参照)を除外するだけでなく、ヘミチャネルではなく、他のメカニズムによってそのパラクリンATPシグナリングを仲介する細胞内のCa 2 +波の伝播のメカニズムを実証するためだけでなく、重要なAXI-アニオンチャネルやATP含有小胞の放出)。最後に、初代培養細胞を用いた全ての研究に関しては、細胞培養条件と通路の数は、細胞の生物学的特性として、標準化されなければならないため、異なるCxのとPanxアイソフォームの発現プロファイルは、時間とともに変化することができる26。
それにもかかわらず、この方法には欠点がいくつかあります。メソッドへの主要な欠点は、機械的な刺激が、細胞外のCaエントリ2 +と+波の伝播11善意の細胞間のCa 2の根底どちらもATPのようなシグナル伝達分子の放出につながる、原形質膜の混乱を引き起こす可能性がある。これは間違いなく細胞内のCa 2 +波の(定量)分析が複雑になる。したがって、それは非常に1)が適切なコントロール、CxのかPanxアイソフォームの発現を欠いすなわち細胞株、およびツールを、私を使用することが推奨されている統合ギャップ結合チャネルおよび/またはヘミチャネル及びiiとしてCxのとPanxの機能を持つrfere)は(機械的刺激中ナノポジショナが0.5と2 Vの間の電圧によって運営されていることを確認してください)機械的刺激の手順を標準化する。
さらに、この方法自体が立っていないことに注意することは重要ですが、CxのとPanxチャネルを研究するために、追加の実験的アプローチによって支えられなければならない。これは、細胞内のIP 3又はCa 2 + 11,74のアンケージングのように、機械的な刺激媒介性細胞間のCa 2 +波の伝播に関与細胞内シグナル伝達分子の局所的な増大を使用することによって達成することができる。機械的刺激の細胞内のCa 2 +波の独立を開始するためには、このような組換えプロアポトーシスバックス11,75と外で地元低下します+バッファジアゾ-2のような写真の活性化のCa 2として、マイクロインジェクションを使用することができます[Ca 2 +の] 76、ヘミチャネル開口の既知のトリガー(商標)。また、人は細胞内Ca 2 +放出と細胞間をトリガーすること、細胞浸透性シグナル分子のその場でのエレクトロポレーションに使用できるのCa 2などのIP 3 67,68として+波、。後者の技術はまた、細胞死5,77の広がりを調査するために使用される。これらの非機械的刺激は、刺激強度応答のより良い評価を提供。これらのCa 2 +波伝播方法に加えて、それは(ルシファーイエロー等)の親水性染料吸収の決定を含む他のアプローチを使用して、Cxの又はPanxチャネルの活性を決定することが重要である78とATPの放出だけでなくだけでなく、細胞外のCa 2 +-バッファ(EGTAなど)と細胞内Ca 2 +放出分子(のCa 2 +イオノフォアA23187など)11,74に対応して、機械的刺激に応答。また、tを彼チャネルレベルでの調節のための最高の証拠は、異所的GFPなどのマーカーと一緒にCxのアイソフォームを発現して電気生理学的実験では、デュアル電圧クランプシステムのどちらかやCxまたはPanx mRNAと注入されたアフリカツメガエル卵母細胞のまたはHeLa細胞の全細胞パスクランプによって提供されます79-84。
結論として、細胞内のCa 2 +波を誘導するための機械的刺激の使用は、細胞内の通信を調査してCxとPanxチャネルの寄与とプロパティを調べるために、シンプルで信頼性の高い方法を提供するものである。
開示事項
著者らは、開示することは何もありません。
謝辞
実験室で行われる研究活動は、研究財団からの補助金によって支えられて - フランダース(FWO、助成番号G.0545.08とG.0298.11)、大学間の観光極プログラム(ベルギーの科学政策、助成番号P6/28とP7/13)とFWOでサポートされている研究コミュニティに埋め込まれています。フランダース(FWO) - CDHは研究財団の博士研究員である。著者は、分子·細胞内シグナル伝達(KUルーベン)、博士SPスリニバス(検眼、米国インディアナ大学)博士Leybaert(ゲント大学)との研究室の研究室のすべての現在および元メンバーに非常に感謝しています有用な議論を、最適化された手順やコネキシンヘミチャネルの研究のためのツールの開発に関与していたが提供博士Vinken(VUB)。
資料
| Name | Company | Catalog Number | Comments |
| Earle's Balanced Salt Solution (EBSS) | Invitrogen-Gibco-Molecular Probes (Karlsruhe, Germany) | 14155-048 | |
| Iodine | Sigma-Aldrich (Deisenhofen, Germany) | 38060-1EA | |
| Dulbecco's Modified Eagle's Medium (DMEM) | Invitrogen-Gibco-Molecular Probes (Karlsruhe, Germany) | 11960-044 | |
| L-glutamine (Glutamax) | Invitrogen-Gibco-Molecular Probes (Karlsruhe, Germany) | 35050-038 | |
| Amphotericin-B | Sigma-Aldrich (Deisenhofen, Germany) | A2942 | |
| Antibiotic-antimycotic mixture | Invitrogen-Gibco-Molecular Probes (Karlsruhe, Germany) | 15240-096 | |
| Trypsin | Invitrogen-Gibco-Molecular Probes (Karlsruhe, Germany) | 25300-054 | |
| Dulbecco's PBS | Invitrogen-Gibco-Molecular Probes (Karlsruhe, Germany) | 14190-091 | |
| Fluo-4 AM | Invitrogen-Gibco-Molecular Probes (Karlsruhe, Germany) | F14217 | |
| ARL-67156 (6-N,N-Diethyl-b,g-dibromomethylene-D-ATP) | Sigma-Aldrich (Deisenhofen, Germany) | A265 | |
| Apyrase VI | Sigma-Aldrich (Deisenhofen, Germany) | A6410 | |
| Apyrase VII | Sigma-Aldrich (Deisenhofen, Germany) | A6535 | |
| Gap26 (VCYDKSFPISHVR) | Custom peptide synthesis | ||
| Gap27 (SRPTEKTIFII) | Custom peptide synthesis | ||
| Control Peptide (SRGGEKNVFIV) | Custom peptide synthesis | ||
| siRNA1 Cx43 (sense: 5'GAAGGAGGAGGAACU-CAAAdTdT) | Annealed siRNA was purchased at Eurogentec (Luik, Belgium) | ||
| siRNA2 Cx43 (sense: 5'CAAUUCUUCCUGCCGCAAUdTdT) | Annealed siRNA was purchased at Eurogentec (Luik, Belgium) | ||
| siRNA scramble: scrambled sequence of siCx43-1 (sense: 5'GGUAAACG-GAACGAGAAGAdTdT) | Annealed siRNA was purchased at Eurogentec (Luik, Belgium) | ||
| TAT-L2 (TAT- DGANVDMHLKQIEIKKFKYGIEEHGK) | Thermo Electron (Ulm, Germany) | ||
| TAT-L2-H126K/I130N (TAT-DGANVDMKLKQNEIKKFKYGIEEHGK) | Thermo Electron (Ulm, Germany) | ||
| Two chambered glass slides | Laboratory-Tek Nunc (Roskilde, Denmark) | 155380 | |
| Confocal microscope | Carl Zeiss Meditec (Jena, Germany) | LSM510 | |
| Piez–lectric crystal nanopositioner (Piezo Flexure NanoPositioner) | PI Polytech (Karlsruhe, Germany) | P-280 | |
| HVPZT-amplifier | PI Polytech (Karlsruhe, Germany) | E463 HVPZT-amplifier | |
| Glass tubes (glass replacement 3.5 nanoliter) | World Precision Instruments, Inc. Sarasota, Florida, USA | 4878 | |
| Micr–lectrode puller | Zeitz Instrumente (Munchen, Germany) | WZ DMZ-Universal Puller |
参考文献
- Vinken, M., et al. Connexins and their channels in cell growth and cell death. Cell Signal. 18, 592-600 (2006).
- Mese, G., Richard, G., White, T. W. Gap junctions: basic structure and function. J. Invest. Dermatol. 127, 2516-2524 (2007).
- Bruzzone, R., White, T. W., Paul, D. L. Connections with connexins: the molecular basis of direct intercellular signaling. Eur. J. Biochem. 238, 1-27 (1996).
- White, T. W., Bruzzone, R., Paul, D. L. The connexin family of intercellular channel forming proteins. Kidney Int. 48, 1148-1157 (1995).
- Decrock, E., et al. Connexin-related signaling in cell death: to live or let die? Cell Death Differ. 16, 524-536 (2009).
- Herve, J. C. Gap junctional complexes: from partners to functions. Prog. Biophys. Mol. Biol. 94, 1-4 (2007).
- Herve, J. C., Bourmeyster, N., Sarrouilhe, D., Duffy, H. S. Gap junctional complexes: from partners to functions. Prog. Biophys. Mol. Biol. 94, 29-65 (2007).
- Bruzzone, R., Barbe, M. T., Jakob, N. J., Monyer, H. Pharmacological properties of homomeric and heteromeric pannexin hemichannels expressed in Xenopus oocytes. J. Neurochem. 92, 1033-1043 (2005).
- Ebihara, L., Steiner, E. Properties of a nonjunctional current expressed from a rat connexin46 cDNA in Xenopus oocytes. J. Gen. Physiol. 102, 59-74 (1993).
- Evans, W. H., De Vuyst, E., Leybaert, L. The gap junction cellular internet: connexin hemichannels enter the signalling limelight. Biochem. J. 397, 1-14 (2006).
- Leybaert, L., Sanderson, M. J. Intercellular Ca2+ waves: mechanisms and function. Physiol. Rev. 92, 1359-1392 (2012).
- Sanderson, M. J., Charles, A. C., Dirksen, E. R. Mechanical stimulation and intercellular communication increases intracellular Ca2+ in epithelial cells. Cell Regul. 1, 585-596 (1990).
- Himpens, B., Stalmans, P., Gomez, P., Malfait, M., Vereecke, J. Intra- and intercellular Ca2+ signaling in retinal pigment epithelial cells during mechanical stimulation. Faseb J. 13, 63-68 (1999).
- Williams, K. K., Watsky, M. A. Bicarbonate promotes dye coupling in the epithelium and endothelium of the rabbit cornea. Curr. Eye Res. 28, 109-120 (2004).
- Hernandez Galindo, E. E., Theiss, C., Steuhl, K. P., Meller, D. Gap junctional communication in microinjected human limbal and peripheral corneal epithelial cells cultured on intact amniotic membrane. Exp Eye Res. 76, 303-314 (2003).
- Williams, K., Watsky, M. Gap junctional communication in the human corneal endothelium and epithelium. Curr. Eye Res. 25, 29-36 (2002).
- Anderson, S. C., Stone, C., Tkach, L., SundarRaj, N. Rho and Rho-kinase (ROCK) signaling in adherens and gap junction assembly in corneal epithelium. Invest. Ophthalmol. Vis. Sci. 43, 978-986 (2002).
- Joyce, N. C., Harris, D. L., Zieske, J. D. Mitotic inhibition of corneal endothelium in neonatal rats. Invest. Ophthalmol. Vis. Sci. 39, 2572-2583 (1998).
- Klepeis, V. E., Weinger, I., Kaczmarek, E., Trinkaus-Randall, V. P2Y receptors play a critical role in epithelial cell communication and migration. J. Cell Biochem. 93, 1115-1133 (2004).
- Klepeis, V. E., Cornell-Bell, A., Trinkaus-Randall, V. Growth factors but not gap junctions play a role in injury-induced Ca2+ waves in epithelial cells. J. Cell Sci. 114, 4185-4195 (2001).
- Laux-Fenton, W. T., Donaldson, P. J., Kistler, J., Green, C. R. Connexin expression patterns in the rat cornea: molecular evidence for communication compartments. Cornea. 22, 457-464 (2003).
- Rae, J. L., Lewno, A. W., Cooper, K., Gates, P. Dye and electrical coupling between cells of the rabbit corneal endothelium. Curr. Eye Res. 8, 859-869 (1989).
- Watsky, M. A., Rae, J. L. Dye coupling in the corneal endothelium: effects of ouabain and extracellular calcium removal. Cell Tissue Res. 269, 57-63 (1992).
- Williams, K. K., Watsky, M. A. Dye spread through gap junctions in the corneal epithelium of the rabbit. Curr. Eye Res. 16, 445-452 (1997).
- D'hondt, C., Ponsaerts, R., Srinivas, S. P., Vereecke, J., Himpens, B. Thrombin inhibits intercellular calcium wave propagation in corneal endothelial cells by modulation of hemichannels and gap junctions. Invest. Ophthalmol. Vis. Sci. 48, 120-133 (2007).
- D'hondt, C., Ponsaerts, R., Srinivas, S. P., Vereecke, J., Himpens, B. Reduced intercellular communication and altered morphology of bovine corneal endothelial cells with prolonged time in cell culture. Curr. Eye Res. 34, 454-465 (2009).
- D'hondt, C., Srinivas, S. P., Vereecke, J., Himpens, B. Adenosine Opposes Thrombin-Induced Inhibition of Intercellular Calcium Wave in Corneal Endothelial Cells. Invest Ophthalmol. Vis. Sci. 48, 1518-1527 (2007).
- Gomes, P., Srinivas, S. P., Van Driessche, W., Vereecke, J., Himpens, B. ATP release through connexin hemichannels in corneal endothelial cells. Invest. Ophthalmol. Vis. Sci. 46, 1208-1218 (2005).
- Gomes, P., Srinivas, S. P., Vereecke, J., Himpens, B. ATP-dependent paracrine intercellular communication in cultured bovine corneal endothelial cells. Invest. Ophthalmol. Vis. Sci. 46, 104-113 (2005).
- Gomes, P., Srinivas, S. P., Vereecke, J., Himpens, B. Gap junctional intercellular communication in bovine corneal endothelial cells. Exp Eye Res. , (2006).
- Ponsaerts, R., et al. The myosin II ATPase inhibitor blebbistatin prevents thrombin-induced inhibition of intercellular calcium wave propagation in corneal endothelial cells. Invest. Ophthalmol. Vis. Sci. 49, 4816-4827 (2008).
- Ponsaerts, R., et al. RhoA GTPase Switch Controls Cx43-Hemichannel Activity through the Contractile System. PLoS ONE. 7, e42074(2012).
- Ponsaerts, R., et al. Intramolecular loop/tail interactions are essential for connexin 43-hemichannel activity. Faseb J. 24, 4378-4395 (2010).
- Charles, A. Reaching out beyond the synapse: glial intercellular waves coordinate metabolism. Sci STKE. 2005, pe6(2005).
- Laird, D. W. Life cycle of connexins in health and disease. Biochem. J. 394, 527-543 (2006).
- Kelsell, D. P., Dunlop, J., Hodgins, M. B. Human diseases: clues to cracking the connexin code. Trends Cell Biol. 11, 2-6 (2001).
- Pearson, R. A., Dale, N., Llaudet, E., Mobbs, P. ATP released via gap junction hemichannels from the pigment epithelium regulates neural retinal progenitor proliferation. Neuron. 46, 731-744 (2005).
- Klepeis, V. E., Weinger, I., Kaczmarek, E., Randall, V. T. P2Y receptors play a critical role in epithelial cell communication and migration. J. Cell Biochem. 93, 1115-1133 (2004).
- Cotrina, M. L., Lin, J. H., Lopez-Garcia, J. C., Naus, C. C., Nedergaard, M. ATP-mediated glia signaling. J. Neurosci. 20, 2835-2844 (2000).
- Burnstock, G., Williams, M. P2 purinergic receptors: modulation of cell function and therapeutic potential. J. Pharmacol. Exp. Ther. 295, 862-869 (2000).
- Schwiebert, E. M., Zsembery, A. Extracellular ATP as a signaling molecule for epithelial cells. Biochim. Biophys Acta. 1615, 7-32 (2003).
- Lazarowski, E. R., Boucher, R. C., Harden, T. K. Mechanisms of release of nucleotides and integration of their action as P2X- and P2Y-receptor activating molecules. Mol. Pharmacol. 64, 785-795 (2003).
- Dubyak, G. R., el-Moatassim, C. Signal transduction via P2-purinergic receptors for extracellular ATP and other nucleotides. Am. J. Physiol. 265, C577-C606 (1993).
- Blair, S. A., Kane, S. V., Clayburgh, D. R., Turner, J. R. Epithelial myosin light chain kinase expression and activity are upregulated in inflammatory bowel disease. Lab. Invest. 86, 191-201 (2006).
- Boudreault, F., Grygorczyk, R. Cell swelling-induced ATP release and gadolinium-sensitive channels. Am. J. Physiol. Cell Physiol. 282, C219-C226 (2002).
- Romanov, R. A., Rogachevskaja, O. A., Khokhlov, A. A., Kolesnikov, S. S. Voltage dependence of ATP secretion in mammalian taste cells. J. Gen. Physiol. 132, 731-744 (2008).
- Pelegrin, P., Surprenant, A. Pannexin-1 mediates large pore formation and interleukin-1beta release by the ATP-gated P2X7 receptor. Embo J. 25, 5071-5082 (2006).
- Surprenant, A., Rassendren, F., Kawashima, E., North, R. A., Buell, G. The cytolytic P2Z receptor for extracellular ATP identified as a P2X receptor (P2X7). Science. 272, 735-738 (1996).
- D'hondt, C., et al. Pannexin channels in ATP release and beyond: an unexpected rendezvous at the endoplasmic reticulum. Cell Signal. 23, 305-316 (2011).
- Leybaert, L., et al. Connexin channels, connexin mimetic peptides and ATP release. Cell Commun. Adhes. 10, 251-257 (2003).
- Stout, C. E., Costantin, J. L., Naus, C. C., Charles, A. C. Intercellular calcium signaling in astrocytes via ATP release through connexin hemichannels. J. Biol. Chem. 277, 10482-10488 (2002).
- Verma, V., Hallett, M. B., Leybaert, L., Martin, P. E., Howard Evans, W. Perturbing plasma membrane hemichannels attenuates calcium signalling in cardiac cells and HeLa cells expressing connexins. Eur. J. Cell Biol. , (2008).
- Pharmacol, B. rJ. 147, S172-S181 (2006).
- Slakey, L. L., Gordon, E. L., Pearson, J. D. A comparison of ectonucleotidase activities on vascular endothelial and smooth muscle cells. Ann. N.Y. Acad. Sci. 603, 366-378 (1990).
- Gordon, E. L., Pearson, J. D., Slakey, L. L. The hydrolysis of extracellular adenine nucleotides by cultured endothelial cells from pig aorta. Feed-forward inhibition of adenosine production at the cell surface. J. Biol. Chem. 261, 15496-15507 (1986).
- Moerenhout, M., Himpens, B., Vereecke, J. Intercellular communication upon mechanical stimulation of CPAE- endothelial cells is mediated by nucleotides. Cell Calcium. 29, 125-136 (2001).
- Ralevic, V., Burnstock, G. Receptors for purines and pyrimidines. Pharmacol. Rev. 50, 413-492 (1998).
- Edelhauser, H. F. The resiliency of the corneal endothelium to refractive and intraocular surgery. Cornea. 19, 263-273 (2000).
- George, A. J., Larkin, D. F. Corneal transplantation: the forgotten graft. Am. J. Transplant. 4, 678-685 (2004).
- Hong, S. J., Wu, K. Y., Wang, H. Z., Fong, J. C. Change of cytosolic Ca2+ mobility in cultured bovine corneal endothelial cells by endothelin-1. J. Ocul. Pharmacol. Ther. 19, 1-9 (2003).
- Crawford, K. M., MacCallum, D. K., Ernst, S. A. Histamine H1 receptor-mediated Ca2+ signaling in cultured bovine corneal endothelial cells. Invest. Ophthalmol. Vis. Sci. 33, 3041-3049 (1992).
- Crawford, K. M., MacCallum, D. K., Ernst, S. A. Agonist-induced Ca2+ mobilization in cultured bovine and human corneal endothelial cells. Curr. Eye Res. 12, 303-311 (1993).
- Srinivas, S. P., Yeh, J. C., Ong, A., Bonanno, J. A. Ca2+ mobilization in bovine corneal endothelial cells by P2 purinergic receptors. Curr. Eye Res. 17, 994-1004 (1998).
- Satpathy, M., Gallagher, P., Jin, Y., Srinivas, S. P. Extracellular ATP opposes thrombin-induced myosin light chain phosphorylation and loss of barrier integrity in corneal endothelial cells. Exp Eye Res. 81, 183-192 (2005).
- Srinivas, S. P., et al. Cell volume response to hyposmotic shock and elevated cAMP in bovine trabecular meshwork cells. Exp. Eye Res. 78, 15-26 (2004).
- D'hondt, C., Ponsaerts, R., De Smedt, H., Bultynck, G., Himpens, B. Pannexins, distant relatives of the connexin family with specific cellular functions. Bioessays. 31, 953-974 (2009).
- Boitano, S., Dirksen, E. R., Sanderson, M. J. Intercellular propagation of calcium waves mediated by inositol trisphosphate. Science. 258, 292-295 (1992).
- De Vuyst, E., et al. Intracellular calcium changes trigger connexin 32 hemichannel opening. EMBO J. 25, 34-44 (2006).
- De Vuyst, E., et al. Ca2+ regulation of connexin 43 hemichannels in C6 glioma and glial cells. Cell Calcium. 46, 176-187 (2009).
- Weissman, T. A., Riquelme, P. A., Ivic, L., Flint, A. C., Kriegstein, A. R. Calcium waves propagate through radial glial cells and modulate proliferation in the developing neocortex. Neuron. 43, 647-661 (2004).
- Iyer, S., Deutsch, K., Yan, X., Lin, B. Batch RNAi selector: a standalone program to predict specific siRNA candidates in batches with enhanced sensitivity. Computer Methods and Programs in Biomedicine. 85, 203-209 (2007).
- Stehberg, J., et al. Release of gliotransmitters through astroglial connexin 43 hemichannels is necessary for fear memory consolidation in the basolateral amygdala. Faseb J. 26, 3649-3657 (2012).
- Evans, W. H., Bultynck, G., Leybaert, L. Erratum to: Manipulating Connexin Communication Channels: Use of Peptidomimetics and the Translational Outputs. J. Membr. Biol. 245, 451(2012).
- Majumder, P., et al. ATP-mediated cell-cell signaling in the organ of Corti: the role of connexin channels. Purinergic Signal. 6, 167-187 (2010).
- Carvalho, A. C., et al. affects intracellular Ca2+ stores and induces Ca2+ wave propagation. Cell Death Differ. 11, 1265-1276 (2004).
- Torres, A., et al. Extracellular Ca2+ acts as a mediator of communication from neurons to glia. Sci. Signal. 5, ra8(2012).
- Decrock, E., et al. Transfer of IP(3) through gap junctions is critical, but not sufficient, for the spread of apoptosis. Cell Death Differ. 19 (3), 947-957 (2012).
- Beltramello, M., Piazza, V., Bukauskas, F. F., Pozzan, T., Mammano, F. Impaired permeability to Ins(1,4,5)P3 in a mutant connexin underlies recessive hereditary deafness. Nat. Cell Biol. 7 (1,4,5), 63-69 (2005).
- Bukauskas, F. F., Bukauskiene, A., Verselis, V. K. Conductance and permeability of the residual state of connexin43 gap junction channels. J. Gen. Physiol. 119, 171-186 (2002).
- Bukauskas, F. F., Verselis, V. K. Gap junction channel gating. Biochim. Biophys. Acta. 1662, 42-60 (2004).
- Dahl, G. Where are the gates in gap junction channels? Clin. Exp. Pharmacol. Physiol. 23, 1047-1052 (1996).
- Retamal, M. A., Schalper, K. A., Shoji, K. F., Bennett, M. V., Saez, J. C. Opening of connexin 43 hemichannels is increased by lowering intracellular redox potential. Proc. Natl. Acad. Sci. U.S.A. 104, 8322-8327 (2007).
- Shibayama, J., et al. Effect of charge substitutions at residue his-142 on voltage gating of connexin43 channels. Biophys. J. 91, 4054-4063 (2006).
- Desplantez, T., Verma, V., Leybaert, L., Evans, W. H., Weingart, R. Gap26, a connexin mimetic peptide, inhibits currents carried by connexin43 hemichannels and gap junction channels. Pharmacological Research: The Official Journal of the Italian Pharmacological Society. 65, 546-552 (2012).
- Delmar, M. Gap junctions as active signaling molecules for synchronous cardiac function. J. Cardiovasc. Electrophysiol. 11, 118-120 (2000).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved