Method Article
La stimulation mécanique induite par le calcium propagation des ondes dans des monocouches de cellules: l'exemple de bovins cellules endothéliales de la cornée
Dans cet article
Résumé
Ca intercellulaire 2 +-Ondes sont entraînés par des chaînes et hémicanaux de jonction gap. Ici, nous décrivons une méthode pour mesurer intercellulaire Ca 2 +-Ondes dans des monocouches de cellules en réponse à un stimulus mécanique seule cellule locale et son application à l'étude des propriétés et la régulation des canaux et hémicanaux de jonction gap.
Résumé
Communication intercellulaire est essentiel pour la coordination des processus physiologiques entre les cellules dans une variété d'organes et de tissus, y compris le cerveau, le foie, la rétine, la cochlée et le système vasculaire. Dans un cadre expérimental, intercellulaire Ca 2 +-ondes peut être obtenue en appliquant un stimulus mécanique à une seule cellule. Cela conduit à la libération des molécules de signalisation intracellulaire IP 3 et Ca 2 + qui initier la propagation de la Ca 2 +-onde concentrique de la cellule stimulée mécaniquement les cellules voisines. Les principales voies moléculaires qui contrôlent intercellulaire Ca 2 + propagation d'ondes sont fournis par des canaux des jonctions lacunaires par le transfert direct de IP 3 et par hemichannels par la libération d'ATP. Identification et caractérisation des propriétés et la régulation des différents isoformes connexine et pannexine les canaux et les hémicanaux de jonction gap sont autorisés par le quantification de la propagation de la Ca 2 + intracellulaire-ondes, siRNA, et l'utilisation d'inhibiteurs de canaux et hémicanaux de jonction gap. Ici, nous décrivons une méthode pour mesurer intercellulaire Ca 2 +-ondes dans des monocouches de cellules endothéliales de la cornée primaires chargé de Fluo4-AM en réponse à un stimulus mécanique contrôlée et localisée provoquée par une déformation aiguë, de courte durée de la cellule à la suite toucher de la membrane de la cellule avec une micropipette de verre micromanipulateur contrôlé avec un diamètre de pointe de moins de 1 um. Nous décrivons également l'isolement des cellules endothéliales de la cornée bovine primaire et son utilisation comme système modèle pour évaluer l'activité Cx43-hemichannel comme la force entraîné pour intercellulaire Ca 2 +-ondes à travers la libération de l'ATP. Enfin, nous discutons de l'utilisation, les avantages, les limites et les variantes de cette méthode dans le cadre du canal de jonction d'espace et la recherche de hemichannel.
Introduction
Communication intercellulaire et la signalisation sont essentiels pour la coordination des processus physiologiques en réponse à des agonistes extracellulaires au niveau du tissu et de 1,2 niveau entier organe. La façon la plus directe de la communication intercellulaire est créée par la présence de jonctions. Les jonctions lacunaires sont des plaques de canaux de jonctions lacunaires, qui sont des chaînes protéiques formés par l'accueil en tête-à-tête de deux (Cx) hemichannels connexine de cellules adjacentes 3,4 (figure 1). Les jonctions lacunaires permettent le passage de petites molécules de signalisation avec un poids moléculaire de moins de 1,5 kDa, notamment Ca2 + ou IP 3 5, ce qui provoque et de modulation du Ca 2 + de la libération des réserves intracellulaires des cellules voisines 6 (figure 2). canaux des jonctions lacunaires sont strictement réglementées par les interactions entre protéines intra-et intermoléculaires et par des processus de signalisation cellulaire, comme la modification redox etphosphorylation 7. GJ faciliter la réponse coordonnée de cellules connectées, agissant ainsi comme un syncytium chimique et électrique. Par exemple, la propagation du potentiel d'action cardiaque dans les myocytes auriculaires et ventriculaires est médiée par des canaux GJ Cx à base 85. Cx ont non seulement un rôle de canaux de jonctions lacunaires, mais aussi former hemichannels non appariés, fonctionnant ainsi comme des canaux dans les membranes de même pour les canaux ioniques réguliers 8-10 (Figure 1). Hémicanaux participent à la signalisation paracrines entre cellules voisines en contrôlant l'échange d'ions et molécules de signalisation entre l'environnement intra-et extracellulaire.
Dans de nombreux types de cellules (comme les cellules épithéliales, les cellules ostéoblastiques, les astrocytes, cellules endothéliales, etc) et des organes (comme le cerveau, le foie, la rétine, la cochlée et le système vasculaire), intercellulaire Ca 2 +-ondes sont fondamentales pour la coordination des réponses multicellulaires 11. L'augmentation des niveaux 2 + intracellulaire de Ca dans une certaine cellule ne sont pas limités à cette cellule, mais se propagent aux cellules voisines environnantes, établissant ainsi un intercellulaire Ca 2 +-ondes 12,13. Ces intercellulaire Ca 2 +-ondes sont importants pour la régulation physiologique normal de couches de cellules comme un syncytium et leur dérégulation a été associée à des processus physiopathologiques 11. Dans l'endothélium cornéen et l'épithélium, les différents groupes 14-24, y compris notre propre 25-33, a étudié les mécanismes et les rôles de la communication intercellulaire. Dans les cellules non-excitables, comme les cellules endothéliales de la cornée, deux modes distincts de communication intercellulaire surviennent 28,29, à savoir écart de jonction communication intercellulaire et de la communication intercellulaire paracrine. La communication intercellulaire par jonction implique un échange direct de molécules de signalisation via les jonctions gap 7. Gap jonctioncommunication intercellulaire internationale est essentielle pour le maintien de l'homéostasie tissulaire, contrôle de la prolifération cellulaire, et d'établir une réponse synchronisée au stress extracellulaire 10,34,35. Dans un certain nombre de pathologies, l'écart couplage de jonction est réduite en raison de Cx défectueux, et affectant la présente écart de jonction communication intercellulaire 36. Ceci souligne l'importance et l'influence de la communication intercellulaire par jonction dans les organismes multicellulaires. Contrairement à la communication intercellulaire par jonction, la communication intercellulaire paracrine ne dépend pas de l'apposition de cellule à cellule, car elle implique la libération de messagers extracellulaires diffusables (Figure 2). Différents types de molécules de signalisation sont libérés dans l'espace extracellulaire par les cellules de signalisation. La molécule est alors transporté vers la cellule cible, où elle est détectée par une protéine réceptrice spécifique. Par la suite le complexe du signal du récepteur induit une réponse cellulaire, quiil est mis fin par le retrait du signal, l'inactivation ou une désensibilisation. Lipophiles messagers extracellulaires de signalisation Sortie pénétrer la membrane et agissent sur des récepteurs intracellulaires. En revanche, les messagers hydrophiles ne traversent pas la membrane plasmique de la cellule de réponse, mais agissent comme un ligand qui se lie à-exprimés surface des protéines réceptrices, qui ensuite transmettent le signal vers le milieu intracellulaire. Trois grandes familles de protéines réceptrices de surface cellulaire participent à ce processus: canal ionique lié, lié à une enzyme et la protéine G liés. La molécule de messager libéré peut agir sur les récepteurs de la même cellule (autocrine), sur des cellules cibles à proximité (paracrine), ou sur les cellules cibles lointaines qui nécessitent le système circulatoire (endocrine).
Dans de nombreux types de cellules, y compris endothélium cornéen 28,29, l'ATP est l'un des principaux facteurs hydrophiles, paracrines qui stimulent la propagation des intercellulaire Ca 2 +-ondes 37-40. DurING déformation mécanique, l'hypoxie, l'inflammation ou de la stimulation par divers agents, ATP peuvent être libérés à partir de cellules saines 41-44 en réponse à la contrainte de cisaillement, étirement, ou gonflement osmotique 44,45. Différents mécanismes ATP à libération prolongée ont été avancées, y compris l'exocytose vésiculaire 44 et une pléthore de mécanismes de transport, tels que les cassettes (ABC) transporteurs de liaison ATP, canaux anioniques voltage-dépendants plasmiques 46, P2X7 canaux récepteurs 47,48, ainsi que connexine hemichannels 49-52 et pannexine hémicanaux 43,49,53. ATP extracellulaire peut être rapidement hydrolysé à l'ADP, l'AMP et l'adénosine 54,55 par ectonucléotidases qui sont présents dans le milieu extracellulaire. L'ATP extracellulaire libéré et son métabolite ADP 56 se propage par diffusion. L'interaction ultérieure de ces nucléotides avec des récepteurs purinergiques dans les cellules voisines a été impliquée dans la propagation de intercellulaire Ca 2 +-ondes 28,37,51. Deux classes différentes de récepteurs purinergiques sont présents: l'adénosine est le principal ligand naturel pour P1-purinorécepteurs, alors que les deux purine (ATP, ADP) et pyrimidiques (UTP, UDP) nucléotides agissent sur la plupart P2-purinorécepteurs 57.
Communication intercellulaire peut être étudiée par différentes méthodes telles que gratter chargement, transfert de colorant, uncaging locale d'agonistes comme IP3 et Ca 2 +, la stimulation mécanique, etc. Nous décrivons ici l'étude de Ca 2 + propagation d'onde provoquée par une stimulation mécanique d'une seule cellule. L'avantage d'étudier Ca 2 + propagation d'ondes par une stimulation mécanique est qu'il fournit un outil facile à quantifier la propagation de la Ca 2 +-onde au fil du temps et il permet de comparer quantitativement différents prétraitements des cellules. Dans l'endothélium cornéen, les intercellulaire Ca 2 +-ondes permettent une coréponse coordonnée à partir de la monocouche, agissant par les présentes en tant que mécanisme de défense possible de l'endothélium cornéen non régénératif aider l'endothélium pour résister aux contraintes extracellulaire lors de la chirurgie intra-oculaire, ou par exposition à des médiateurs inflammatoires pendant rejet immunitaire ou uvéite 58,59.
Protocole
1. Isolement des cellules endothéliales de la cornée
Avant de commencer: isoler les cellules des yeux neufs, provenant d'un abattoir local, dès que possible après énucléation de l'œil. Assurez-vous que l'œil a été énucléé d'une vache du maximales de 18 mois, à cinq minutes post mortem et conservées dans une solution saline équilibrée de Earle - solution d'iode de 1% à 4 ° C pour le transport au laboratoire.
- Prenez l'œil de la solution saline équilibrée de Earle - solution d'iode à 1% et le placer dans une boîte de Pétri (100 x 20 mm).
- Stériliser les yeux avec une solution contenant 70% d'éthanol et rincer avec une solution saline équilibrée de Earle contenant 1% d'iode.
- A partir de cette étape, le travail sur une hotte stérile. Disséquer soigneusement la cornée de l'œil et le placer dans une boîte de Pétri (35 x 10 mm) contenant une solution saline équilibrée de Earle, avec la couche de cellules épithéliales vers le haut. Retirez soigneusement sti de tissu restant irisll attachée à la cornée, si nécessaire.
- Transférer la cornée à la solution saline équilibrée de Earle autre boîte de Pétri contenant de la couche de cellules endothéliales vers le haut et rincer deux fois avec une solution saline équilibrée de Earle.
- Transférer la cornée avec la couche endothéliale vers le haut à un sablier, qui est un plat en forme de coupe, et le couvrir avec un milieu de croissance. Le milieu de croissance est constitué du milieu de Eagle modifié par Dulbecco contenant 25 mM de glucose, 10% de sérum de veau fœtal, 6,6% de L-glutamine, 2,5 pg / ml d'amphotéricine-B et 1% mélange d'antibiotiques antimycosiques contenant 10.000 unités / ml de pénicilline, 10.000 mg / ml de streptomycine et 25 pg / ml d'amphotéricine B.
- Retirer le support avec une pipette d'aspiration.
- Appliquer 300 ul d'une solution de trypsine (0,5 g / L) à la couche endothéliale de la cornée (toutes les étapes qui comprennent la trypsine sont effectuées en utilisant la même concentration).
- Placer le sablier contenant la cornée dans un plat de Petri couvert et le mettre dans le incubator pendant 30 min à 37 ° C et 5% de CO 2.
- Grattez délicatement les cellules endothéliales loin de la cornée avec un feu poli en forme de crochet pipette Pasteur en verre dans une hotte stérile.
- Sucer la solution contenant les cellules endothéliales et l'ajouter à des flacons de culture (25 cm 2) contenant 4 ml de milieu de culture.
- Appliquer 300 ul de milieu de croissance de la cornée et de répéter le raclage et ajouter la solution contenant les cellules endothéliales dans le flacon de culture.
- Répétez cette dernière étape (1.11) une fois de plus.
- Placer les flacons de culture contenant les cellules endothéliales de la cornée dans le milieu de culture à l'étuve à 37 ° C et 5% de CO 2.
- Après deux jours, ajouter 6 ml de milieu de culture.
- Rafraîchir le milieu de croissance tous les deux jours.
2. Culture cellulaire
- Retirez le milieu de culture et laver les cellules deux fois avec une solution saline équilibrée de Earle, lorsque la confluence est atteinte (au sein about 10 jours après isolement).
- Ajouter une solution de trypsine de 1,5 ml aux cellules pour les détacher et placer le ballon dans l'incubateur (37 ° C, 5% CO 2) pendant 3 à 4 min.
- Ajouter 12 ml de milieu de croissance. Introduire à la pipette du milieu à trois fois dans et hors de disperser les cellules et compter les cellules.
- Ensemencer les cellules avec une fraction variable selon la densité cellulaire et les mettre dans l'incubateur. Préparer deux lames bien cloisonnées (avec une surface de 4,2 cm 2) avec un nombre de cellules de cellules 165 000 (densité de cellule de 39 286 par cm 2). Préparer 80 cm 2 flacons de culture pour un nouveau passage à une densité de 6.250 par cm 2, et ajouter du milieu de culture frais jusqu'à un volume total de 25 ml.
- Actualisez la moyenne tous les deux jours.
- Confluence de la couche de cellules est atteinte après 3 à 4 jours. Utiliser des cellules pour les expériences.
- Lorsque la confluence de la couche de cellules dans les flacons est atteint, répétez les étapes 2.1 à 2.6. Cultures cellule à passage 2 peut être utilisé fou expériences.
3. La stimulation mécanique pour induire Calcium onde
- Chargez les cellules dans la diapositive chambré avec 10 uM Fluo-quatre heures dans une solution saline pendant 30 min tampon phosphate à 37 ° C en agitant doucement.
- Retirez le Fluo-quatre heures solution, se laver les cellules cinq fois avec un tampon phosphate salin, incuber les cellules avec un tampon phosphate salin et laisser les cellules pendant au moins 5 min à température ambiante avant la mesure.
- Excite à 488 nm avec laser argon et de l'utilisation diviseur de faisceau HFT 488, collecter l'émission de fluorescence à 530 nm en utilisant un filtre passe-haut émission LP 505, réglez le sténopé au minimum. Utilisez une immersion objectif 40X de pétrole (Air, 1,2 NA). Dans les expériences avec ARL-67156, utilisez un objectif 10X (Air, 0,3 NA).
- Rechercher un domaine dans lequel les cellules sont confluentes sur le microscope confocal.
- Position de la pipette de sorte qu'il est à 45 ° par rapport à la glissière et chambré toucher la membrane cellulaire.Provoquer un court stimulation mécanique (≈ 1 seconde) à une seule cellule. La stimulation mécanique se compose d'une déformation aiguë, de courte durée de la cellule de toucher moins de 1% de la membrane de la cellule avec une micropipette en verre (diamètre pointe <1 um) couplé à un nanopositionneur de cristal piézo-électrique, actionné par un amplificateur qui est monté sur un micro-manipulateur. Les pipettes en verre sont fabriqués avec un extracteur de microélectrodes. Assurez-vous que le nanopositionneur est exploité par une tension comprise entre 0,2 et 1,5 V au cours de la stimulation mécanique. Une tension supérieure à 1,5 V peut entraîner des dommages cellulaires. Pour chaque type et état de la cellule, la tension optimale pour la stimulation mécanique sans endommager la cellule doit être soigneusement déterminé en appliquant une série de tensions d'amorçage de faible (0,2 V) à grande (1,5 V) de tension. La tension est une mesure de la force de l'excitation depuis cette tension détermine la contrainte mécanique et la tension qui sont appliqués à la membrane cellulaire. Lela force de la stimulation mécanique peut être calculée en multipliant la contrainte mécanique avec la surface. Depuis la fois la zone (<3,14 um 2) et la contrainte mécanique est très faible, la force de l'excitation mécanique est faible. (Notez que quand une cellule est endommagé, les fuites de fluorescence de la cellule et la cellule devient sombre.)
- Mesurer les variations spatiales de la [Ca 2 +] i suite à une stimulation mécanique avec le microscope confocal.
- Collecter et stocker des images.
- Dessiner une région polygonale d'intérêt pour définir la zone de surface totale de cellules sensibles (zone active, AA) en utilisant le logiciel du microscope confocal.
Résultats
Toutes les expériences sont réalisées en conformité avec toutes les directives, les règlements et les organismes de réglementation et le protocole en démonstration est effectuée sous la direction et l'approbation du soin des animaux et le comité de l'utilisation de la KU Leuven.
Dans les cellules endothéliales de la cornée bovine (BCEC), les jonctions fonctionnels sont exprimés et à la fois espace de jonction communication intercellulaire et de la communication intercellulaire paracrine contribuent de manière significative à la communication intercellulaire de manière interactive, mais la voie principale a été démontré que la voie de communication intercellulaire paracrine induite par la libération d'ATP par hemichannels Cx43 basés 28,29. ATP et ADP sont hydrolysées à l'adénosine monophosphate (AMP) par le ectonucleotidase E-NTPD1 (ectonucleoside triphosphate diphosphohydrolase 1, CD39 ATP diphosphohydrolase), et par la suite à l'adénosine 5'-le ectonucleotidase CD73 28,29. ATP et ADP contribuent àle Ca 2 + propagation des ondes en se liant aux récepteurs P2Y1 et P2Y2 28,29. Les deux récepteurs couple PLC via Gq et ainsi évoquer IP 3 induite par le Ca 2 +-presse (Figure 2). En BCEC, la stimulation des récepteurs P2Y purinergiques entraîne une augmentation rapide de la [Ca 2 +] i, qui est insensible à la suppression de [Ca 2 +] o 60. [Ca 2 +] i sommets évoqués par stimulation agoniste sont suivies d'une [Ca 2 +] diminution i qui peut conduire à une élévation stable, agoniste-dépendante, [Ca 2 +] Les fluctuations oscillatoires o-dépendant, ou un retour à l'état initial 60-62. En BCEC, il a été prouvé que le Ca 2 + à libération se fait par une voie impliquant PLC et IP 3 29. Vidange des magasins 3-sensibles IP conduit à un pic initial de [Ca 2 +] i, suivie ultérieurement par une capacitative Ca 2 +-afflux menant à l'apparition de la phase plateau 63.
La stimulation mécanique conduit à une augmentation initiale rapide de Ca 2 + qui provient du point de stimulation, puis se propage dans la cellule stimulée mécaniquement. Enfin, le Ca 2 + intracellulaire niveaux diminuent lentement vers le niveau de base. Après avoir atteint les limites de la cellule, les intercellulaires Ca 2 + se propage l'onde vers les cellules environnantes voisins (NB) d'une manière comme une vague comme Ca 2 + transitoires, qui se désintègre au niveau basal (Figure 3). Dans des conditions de contrôle, Ca 2 + transitoires ont été observés jusqu'à environ 4-8 couches de cellules loin de la cellule stimulée mécaniquement (Figure 3). Le graphique (à droite des panneaux dans la figure 3) montre l'évolution temporelle de la Ca 2 + transitoires (représentés comme des valeurs normalisées de fluorescence (NF)) dansla cellule stimulée mécaniquement et dans les couches de cellules voisines de une à cinq (NB1, NB2, NB3, NB4 et NB5). De la figure 3, il est clair que les normalisées fluorescence diminue, tandis que le temps de retard pour le début de la [Ca 2 +] i hauteur augmente avec la distance de la cellule stimulée mécaniquement. La fluorescence normalisée maximale dans la cellule stimulée mécaniquement a été atteint en 0,95 ± 0,04 sec. Après avoir atteint une valeur maximale de fluorescence normalisée, la fluorescence normalisée a montré une diminution très progressif et lent, en revenant à la valeur basale 152 ± 6 secondes après l'application de l'impulsion 25.
L'inhibition de la voie de communication intercellulaire paracrine en utilisant une combinaison de facteurs exogènes apyrase VI (5 U / ml pendant 30 min) et apyrase VII (5 U / ml pendant 30 min) a provoqué une diminution de 7,5 fois dans la zone couverte par le Ca 2 +-onde, la zone dite active (AA, P <0,001, N = 7, N = 35) (figure 4A). Apyrase est connue pour hydrolyser l'ATP et de l'ADP. Apyrase VI a un ratio élevé de l'ATPase / de ADPase et apyrase VII préférentiellement hydrolyse ADP 56.
Depuis la communication intercellulaire paracrine dans l'endothélium cornéen se produit en grande partie grâce à la libération d'ATP, 28,29 et ATP est hydrolysé dans l'espace extracellulaire par ectonucléotidases, connus pour être exprimés dans l'endothélium cornéen, 29,64,65, nous avons étudié l'effet sur les AA dans des conditions où hydrolyse de l'ATP est inhibée en utilisant des inhibiteurs de ectonucleotidase. L'inhibition de ectonucléotidases avec ARL-67156 (ARL, 100 uM pendant 30 min) a entraîné une forte amélioration de la Ca 2 + propagation d'ondes, comme cela a été démontré précédemment dans BCEC 25,26,28,29. L'exposition de BCEC à ARL a provoqué une augmentation de 3,5 fois de l'AA par rapport aux conditions de contrôle (P <0,001, n = 12, n = 60) (figure 4B).
En préétudes dentes dans notre laboratoire, peptides mimétiques connexines (Gap26 et Gap27, tableau 2) ont été utilisés pour distinguer les contributions relatives des écarts de jonction communication intercellulaire et de la communication intercellulaire paracrine à intercellulaire Ca2 propagation + ondes après une stimulation mécanique, avec un peptide inactif ( Tableau 2) en tant que contrôle 28,29.
Inhibition des canaux des jonctions lacunaires avec Gap27 diminué de manière significative la propagation de la Ca 2 +-ondes dans BCEC 30. L'AA a été significativement réduite à un prétraitement avec Gap27 (300 uM pendant 30 min) (P <0,001; N = 8, n = 40) 25 (tableau 1). L'inhibition de hemichannels connexine avec le peptide mimétique connexine-Gap26 28,30 considérablement réduit la propagation de la Ca 2 +-ondes dans BCEC 28. L'AA a été significativement réduite à un prétraitement avec Gap26 (300 uM pendant 30 min)(P <0,001, N = 8, n = 40) 25 (Tableau 1).
Nous avons également montré que la 43-kDa Cx isoforme était un élément principal qui sous-tend la libération d'ATP hemichannel médiation qui provoque intercellulaire Ca 2 +-ondes. L'utilisation de deux molécules de siRNA ciblant indépendamment Cx43, nous avons constaté que l'AA a été réduite d'environ 65% 33 (tableau 1). Ceci a été soutenue par des expériences utilisant TAT-L2 (100 M, 30 min), un peptide perméable aux cellules correspondant à la seconde moitié de la boucle intracellulaire de Cx43 (tableau 2), ce qui a provoqué une réduction importante des AA (P <0,001 , N = 3, n = 30) (tableau 1). Surtout, cette réduction de AA par TAT-L2 incubation n'a pas été observé en l'absence de signalisation paracrines, soutenant l'idée que TAT-L2 inhibe sélectivement hemichannels Cx43 à base de mais pas les canaux des jonctions lacunaires 33. En outre, un inactif TAT-L2 mutant (TAT-L2 H126K/I130N) peut être utilisé en tant que témoin (Tableau 2).

Figure 1. Formation de canaux et hémicanaux de jonction Gap: représentation schématique. A. Une connexine ou pannexine hemichannel est formé lorsque six connexines ou pannexins, qui sont des protéines à quatre domaines transmembranaires contenant, sont disposées radialement autour d'un pore central. Hémicanaux sont situés dans la membrane plasmique. Elles peuvent consister en des sous-types de protéines identiques (hemichannels homomères) ou ils peuvent être constitués de différents sous-types de protéines, lorsque deux ou plusieurs isoformes sont exprimées dans la même cellule (hemichannels hétéromères). Un canal de jonction lacunaire homotypique résulte de l'accostage des deux homomère identiques ou hémicanaux hétéromères. Une jonction gap hétérotypiques résultats des canaux de la drrouillage de deux canaux homomères ou hétéromère différentes. B. Structure schématique de la connexine et pannexine canaux des jonctions lacunaires reliant deux cellules et hémicanaux adjacentes.
(Partiellement modifié à partir de 66)
Ce chiffre a été publié à l'origine dans BioEssays. Catheleyne D'hondt, Ponsaerts Raf, Humbert De Smedt, Geert Bultynck, et Bernard Himpens. Pannexins, des parents éloignés de la famille des connexines avec des fonctions cellulaires spécifiques. BioEssays. 2009, 31, 953-974 (2009). BioEssays. Cliquez ici pour agrandir la figure .
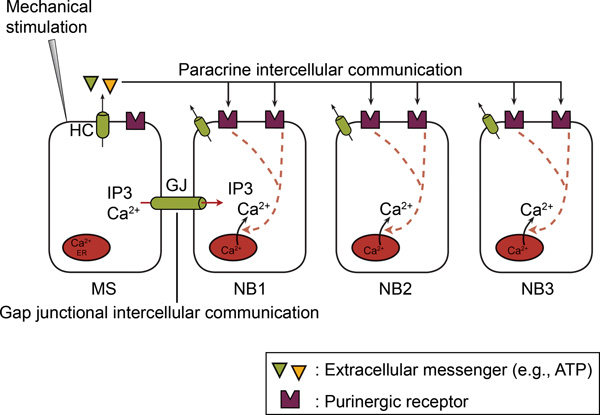
Figure 2. Dans les cellules non-excitables, dans l'tercellular Ca 2 + propagation d'ondes implique à la fois espace de jonction communication intercellulaire et de la communication intercellulaire paracrine. Lors de la stimulation mécanique d'une seule cellule, un Ca2 +-ciel apparaît dans la cellule stimulée mécaniquement (MS) via Ca2 + influx et / ou Ca 2 +-release. Par la suite, les Ca 2 + se propage hauteur de la stimulées mécaniquement les cellules voisines (NB) en tant que Ca 2 +-ondes intercellulaire. La propagation intercellulaire implique deux mécanismes, à savoir la communication intercellulaire par jonction et de la communication intercellulaire paracrine. Dans la communication intercellulaire par jonction, un échange direct d'un médiateur (IP 3 et / ou Ca 2 +) se produit entre les cytoplasmes des cellules adjacentes par des jonctions communicantes (GJ). Dans la communication intercellulaire paracrine, un messager (ex: ATP) est libéré dans l'espace extracellulaire, agissant ainsi sur les récepteurs situés sur esurface de l'e de cellules voisines. Hémicanaux (HC) ou d'autres mécanismes médiatisent cette libération d'ATP (voir texte). Ectonucléotidases hydrolyser l'ATP en ADP et AMP. ATP et ADP loi sur P2Y et / ou récepteurs P2X sur les cellules voisines. (Tiré de 66.)
Ce chiffre a été publié à l'origine dans BioEssays. Catheleyne D'hondt, Ponsaerts Raf, Humbert De Smedt, Geert Bultynck, et Bernard Himpens. Pannexins, des parents éloignés de la famille des connexines avec des fonctions cellulaires spécifiques. Des BioEssays. 2009. 31, 953-974 (2009). BioEssays.
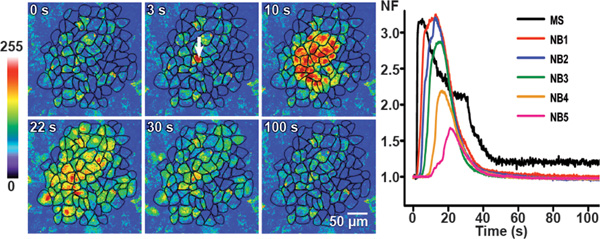
Figure 3. propagation des ondes de calcium dans des conditions de contrôle dans BCEC. stimulation mécanique des transitoires calciques induits sont présentés à différents points de temps dans des conditions de contrôle dans BCEC par des images de fluorescence pseudo-couleurs représentatives. Le fluoreintensités de scence avant stimulation sont présentés dans la première image. La flèche blanche dans la deuxième image montre la cellule stimulée mécaniquement. L'onde de calcium se propage à six couches de cellules voisines avec une superficie totale de cellules atteintes par la vague (zone active: AA) de 62 870 um 2.
Le panneau de droite avec les graphiques linéaires montre l'évolution temporelle de la valeur normalisée de fluorescence (NF) dans la cellule stimulée mécaniquement (MS) et la valeur moyenne de NF dans les cellules voisines (NB) couches 1 à 5 (NB1 à NB5). (Partiellement modifié à partir de 25.)
Ce chiffre a été publié à l'origine dans Investigative Ophthalmology and Visual Science. Catheleyne D'hondt, Raf Ponsaerts, Sangly P Srinivas, Johan Vereecke, et Bernard Himpens. La thrombine inhibe intercellulaire propagation de l'onde de calcium dans les cellules endothéliales de la cornée par une modulation de hémicanaux et jonctions communicantes. Invest. Ophtalmol. Vis. Sci. 2007. 48 (1), 120-33 (2007). Investigative Ophthalmology and Visual Science.

Figure 4. Des changements importants dans la propagation de la intercellulaire Ca 2 +-ondes après le traitement avec nucléotidases exogènes (à gauche) et avec des inhibiteurs de ectonucleotidase (à droite) BCEC. A. Diminution significative chez les AA après le traitement de BCEC avec apyrases exogènes (apyrase VI (5 U / ml) et apyrase VII (5 U / ml) pendant 30 min) qui hydrolysent l'ATP et de l'ADP, inhibant par la voie de la communication intercellulaire paracrine (N = 7, n = 35). * Signifie p <0,001 en présence vs absence de apyrase B. Augmentation significative chez les AA après le traitement de BCEC avec un inhibiteur sélectif de ectonucleotidase ARL-67156 (ARL; 100 M pendant 30 min)., Herby enhancing la voie de communication intercellulaire paracrine (N = 12, n = 60). * Signifie p <0,001 en présence vs absence d'ARL.
| Normalisé AA | St. erreur | N | n | Statistiques | |
| contrôle | 100 | 8.31 | 3 | 30 | |
| siScramble | 87.97 | 9.3 | 3 | 30 | |
| siCx43-1 | 32.45 | 8.23 | 3 | 30 | * |
| siCx43-2 | 35.49 | 7.06 | 3 | 30 | * |
| Contrôle peptide | 91.68 | 6.5 | 8 | 40 | |
| Gap 26 | 46.67 | 4.24 | 8 | 40 | * |
| Gap 27 | 53 | 4,76 | 8 | 40 | * |
| TAT-L2 | 6.99 | 0,71 | 3 | 30 | * |
Tableau 1. Effet des molécules de siRNA ciblant Cx43, connexine peptides mimétiques et la cellule perméable peptide TAT-L2 sur la zone active normalisée (AA) dans BCEC.
N représente le nombre de jours d'expérimentations, n représente le nombre de sollicitations mécaniques. * Signifie p <0,001 par rapport aux conditions de contrôle.
| Séquence AA | |
| Contrôle peptide | SRGGEKNVFIV |
| Gap26 | VCYDKSFPISHVR |
| Gap27 | SRPTEKTIFII |
| TAT-L2 | YGRKKRRQRRR-DGANVDMHLKQIEIKKFKYGIEEHGK |
| TAT-L2H126K/I130N | YGRKKRRQRRR-DGANVDMKLKQNEIKKFKYGIEEHGK |
| 10Panx1 | WRQAAFVDSY |
Tableau 2. Séquences d'acides aminés des peptides utilisés.
Discussion
Dans ce manuscrit, nous décrivons une méthode simple pour mesurer intercellulaire Ca 2 + propagation d'ondes dans des monocouches de cellules endothéliales de la cornée bovine primaire en fournissant une stimulation mécanique localisée et contrôlée à l'aide d'une micropipette. Cellules stimulées mécaniquement réagissent avec une augmentation locale IP intracellulaire 3 et Ca 2 +, qui sont tous deux molécules de signalisation intracellulaires essentielles qui animent intercellulaire Ca 2 + propagation des ondes 11,67. IP 3 est directement transféré dans des cellules voisines par l'intermédiaire de canaux de jonction lacunaire 5, tandis que Ca 2 + provoque l'ouverture de hémicanaux et la libération de l'ATP 68,69, ce qui déclenche des signaux Ca 2 + dans les cellules voisines par l'activation des protéines G couplées P2 récepteurs 37-40. La contribution relative des canaux et hémicanaux dans ce processus jonction gap peut être caractérisée par l'utilisation de Cx-mimétiquepeptides, enzymes ATP dégradants (ectonucléotidases) et les inhibiteurs de ectonucleotisdases. Les propriétés de la mécanique intercellulaire Ca 2 + propagation d'ondes stimulation induite dans les cellules endothéliales de la cornée bovine ont été caractérisées en détail dans notre laboratoire 25-33. Nos résultats indiquent que le Ca 2 + propagation d'ondes intercellulaire est principalement tirée par un communiqué Cx-hemichannel médiée par l'ATP, avec Cx43 jouer un rôle de premier plan. En tant que tel, cette méthode appliquée aux cellules endothéliales de la cornée bovine primaire est particulièrement adapté pour identifier ou caractériser la régulation de Cx43 hemichannels à des niveaux endogènes dans les cellules natives. En utilisant cette méthode, nous avons constaté que l'activité de Cx43 hemichannels est contrôlé de manière critique par le cytosquelette actomyosine, qui peut servir de prévenir un frein endogène excessive, et donc délétère, Cx43 ouverture de hemichannel 25,31,32. Nous élucider les mécanismes moléculaires qui sous-tendent cette réglementation et de trouverun rôle important des interactions de boucle / queue intramoléculaires qui sont essentiels pour l'ouverture de Cx43 hemichannels 33.
De toute évidence, ce système est très approprié pour étudier la fonction de Cx et Panx basée sur canaux et hémicanaux de jonction écart et n'est certainement pas limitée aux cellules endothéliales de la cornée bovine, mais est adaptable à pratiquement n'importe quel type de cellule et aussi des tissus plus complexes, comme cela a été démontré dans le cerveau où la stimulation mécanique déclenchée grand Ca 2 + intracellulaire-ondes englobant l'ensemble de l'hémisphère 70. Différents outils sont présents pour évaluer la contribution des chaînes et hémicanaux de jonction Gap, y compris les peptides Cx-mimétiques, des enzymes dégradant l'ATP, les inhibiteurs de ectonucléotidases et des composés pharmacologiques comme carbenoxolone et 10 Panx1 (tableau 2) 49,50. Pour déterminer la contribution d'un certain Cx ou Panx isoforme dans ce processus, les sondes de siRNA soigneusement conçus targeting deux régions indépendantes de l'ARNm et un contrôle cryptée doit être utilisée. L'étendue de knockdown doit être déterminée au niveau protéique total en utilisant des analyses Western blot et le niveau de la cellule unique en utilisant la microscopie à fluorescence. L'efficacité de transfection des sondes de siRNA dans les monocouches de cellules expérimentales devrait être évaluée par microscopie à fluorescence. Pour cela, on peut développer un siRNA duplex dans lequel un marqueur fluorescent a été incorporé à l'extrémité 3 'du brin sens. Il est important de noter que pour une bonne analyse, une réduction importante de la Cx ou Panx isoforme (> 90% de réduction), ainsi que d'une transfection homogène des duplexes de siRNA dans la monocouche cellulaire (> 90% des cellules transfectées avec le siRNA Sonde) doit être obtenue. La sélectivité des sondes siRNA conçus pour atteindre l'objectif devrait être évaluée 71. En bref, ces outils doivent être validés afin qu'ils n'affectent pas l'expression d'autres Cx ou isoformes de Panx ou autre com clésants route intercellulaire Ca 2 +-ondes, comme P2X ou P2Y récepteurs. Pour évaluer la contribution des Cx43 hemichannels, nous avons collaboré avec le laboratoire du Dr Leybaert dans le développement d'un peptide perméable aux cellules correspondant à la seconde moitié de la boucle intracellulaire de Cx43 (TAT-L2) qui agit comme un antagoniste sélectif, puissant inhibiteur de l' Cx43 hémicanaux tout en maintenant Cx43 écart-activité du canal de jonction 33. Dans nos études, nous utilisons 100 M TAT-L2 pour obtenir une inhibition complète de la Cx43 hemichannels, mais des concentrations plus faibles peuvent suffire 72. TAT-L2H126K/I130N est recommandé comme contrôle négatif 73. Pour évaluer la contribution des Panx1 canaux, le peptide 10Panx1 peut être appliquée. Ces outils sont importants non seulement pour exclure la perturbation de la membrane plasmique (voir ci-dessous), mais aussi pour démontrer que paracrines ATP médiateur de signalisation des mécanismes de propagation intercellulaire Ca 2 + par ondes hemichannels et non par d'autres mécanismes (comme mcanaux axi-anions ou la libération des vésicules contenant ATP). Enfin, comme pour toutes les études utilisant des cellules primaires, les conditions de culture cellulaire et le nombre de passages doivent être standardisés, comme les propriétés biologiques des cellules et donc le profil d'expression des différents Cx et isoformes de Panx peuvent changer au fil du temps 26.
Néanmoins, il existe un certain nombre d'inconvénients à cette méthode. Un inconvénient majeur de cette méthode est que la stimulation mécanique peut entraîner des perturbations de la membrane plasmique, ce qui conduit à l'entrée de Ca2 + et la libération de molécules de signalisation comme l'ATP, qui tous deux sont à la base de bonne foi intercellulaire Ca 2 +-wave propagation 11. Cela complique certainement l'analyse (quantitative) du Ca 2 + intracellulaire d'onde. Par conséquent, il est fortement recommandé que l'on devrait i) utiliser des contrôles adéquats, soit des lignées cellulaires qui n'ont pas l'expression d'isoformes Cx ou Panx et des outils qui interfere avec la fonction de Cx et Panx en tant que canaux de fente de jonction et / ou hémicanaux et ii) normaliser la procédure de stimulation mécanique (s'assurer que lors de la stimulation mécanique du nanopositionneur est actionné par une tension comprise entre 0,5 et 2 V).
En outre, il est important de noter que cette méthode ne tient pas en soi, mais doit être étayé par des approches expérimentales supplémentaires pour étudier les canaux Cx et Panx. Ceci peut être réalisé en utilisant une augmentation locale de molécules de signalisation intracellulaires qui participent à la stimulation mécanique intercellulaire médiée par le Ca 2 + propagation d'onde, comme le uncaging de la propriété intellectuelle intracellulaire 3 ou Ca 2 + 11,74. Pour lancer intercellulaire Ca 2 +-ondes indépendant de stimulation mécanique, on peut utiliser des micro-injection, comme pro-apoptotique Bax recombinant 11,75 et photo-activable Ca2 + tampons comme diazo-2 qui provoque une chute locale extracellulaire [Ca 2 + ] 76, un déclencheur connu pour l'ouverture hemichannel. Alternativement, on peut utiliser dans l'électroporation in situ de molécules de signalisation cellulaire imperméables qui déclenchent intracellulaire de Ca2 + intracellulaire et libération de Ca 2 +-ondes, tels que IP 3 67,68. Cette dernière technique est également utilisée pour étudier la propagation de la mort cellulaire 5,77. Ces stimuli non mécaniques permettent une meilleure évaluation de l'intensité stimulus-réponse. En plus de ces Ca 2 méthodes de propagation +-ondes, il est important de déterminer l'activité des canaux Cx ou Panx utilisant d'autres approches, y compris la détermination de l'absorption de colorant hydrophile (comme Lucifer jaune) 78 et la libération d'ATP non seulement dans réponse à la stimulation mécanique, mais aussi en réponse à Ca2 +-tampons (comme EGTA) et de Ca 2 + molécules à libération intracellulaires (comme le Ca 2 +-ionophore A23187) 11,74. En outre, til meilleure preuve de la réglementation au niveau du canal est fourni par des expériences électrophysiologiques, soit des systèmes de serrage à double tension ou serrage de chemin ensemble des cellules des ovocytes de Xenopus injectés avec Cx ou Panx ARNm ou des cellules HeLa exprimant ectopique isoformes Cx avec un marqueur comme GFP 79-84.
Pour conclure, l'utilisation de la stimulation mécanique pour induire intercellulaire Ca 2 +-ondes fournit une méthode simple et fiable pour enquêter sur la communication intracellulaire et examiner la contribution et les propriétés des canaux Cx et Panx.
Déclarations de divulgation
Les auteurs n'ont rien à révéler.
Remerciements
Les travaux de recherche effectués dans le laboratoire a été financé par des subventions de la Fondation de la recherche - Flandre (FWO, les numéros de subvention G.0545.08 et G.0298.11), le Programme des pôles d'activité interuniversitaire (Politique scientifique fédérale, numéro de subvention P6/28 et P7/13) et est intégré dans une communauté de recherche FWO-prise en charge. CDH est un chercheur post-doctoral de la Fondation de la recherche - Flandre (FWO). Les auteurs sont très reconnaissants à tous les membres actuels et anciens du Laboratoire de génétique moléculaire et de la signalisation cellulaire (KU Leuven), le Dr SP Srinivas (Indiana University School of Optometry, USA), le laboratoire du Dr Leybaert (Université de Gand) et de Dr. Vinken (VUB) qui a fourni discussions utiles, optimisé procédures ou ont été impliqués dans le développement d'outils pour l'étude des hemichannels connexine.
matériels
| Name | Company | Catalog Number | Comments |
| Earle's Balanced Salt Solution (EBSS) | Invitrogen-Gibco-Molecular Probes (Karlsruhe, Germany) | 14155-048 | |
| Iodine | Sigma-Aldrich (Deisenhofen, Germany) | 38060-1EA | |
| Dulbecco's Modified Eagle's Medium (DMEM) | Invitrogen-Gibco-Molecular Probes (Karlsruhe, Germany) | 11960-044 | |
| L-glutamine (Glutamax) | Invitrogen-Gibco-Molecular Probes (Karlsruhe, Germany) | 35050-038 | |
| Amphotericin-B | Sigma-Aldrich (Deisenhofen, Germany) | A2942 | |
| Antibiotic-antimycotic mixture | Invitrogen-Gibco-Molecular Probes (Karlsruhe, Germany) | 15240-096 | |
| Trypsin | Invitrogen-Gibco-Molecular Probes (Karlsruhe, Germany) | 25300-054 | |
| Dulbecco's PBS | Invitrogen-Gibco-Molecular Probes (Karlsruhe, Germany) | 14190-091 | |
| Fluo-4 AM | Invitrogen-Gibco-Molecular Probes (Karlsruhe, Germany) | F14217 | |
| ARL-67156 (6-N,N-Diethyl-b,g-dibromomethylene-D-ATP) | Sigma-Aldrich (Deisenhofen, Germany) | A265 | |
| Apyrase VI | Sigma-Aldrich (Deisenhofen, Germany) | A6410 | |
| Apyrase VII | Sigma-Aldrich (Deisenhofen, Germany) | A6535 | |
| Gap26 (VCYDKSFPISHVR) | Custom peptide synthesis | ||
| Gap27 (SRPTEKTIFII) | Custom peptide synthesis | ||
| Control Peptide (SRGGEKNVFIV) | Custom peptide synthesis | ||
| siRNA1 Cx43 (sense: 5'GAAGGAGGAGGAACU-CAAAdTdT) | Annealed siRNA was purchased at Eurogentec (Luik, Belgium) | ||
| siRNA2 Cx43 (sense: 5'CAAUUCUUCCUGCCGCAAUdTdT) | Annealed siRNA was purchased at Eurogentec (Luik, Belgium) | ||
| siRNA scramble: scrambled sequence of siCx43-1 (sense: 5'GGUAAACG-GAACGAGAAGAdTdT) | Annealed siRNA was purchased at Eurogentec (Luik, Belgium) | ||
| TAT-L2 (TAT- DGANVDMHLKQIEIKKFKYGIEEHGK) | Thermo Electron (Ulm, Germany) | ||
| TAT-L2-H126K/I130N (TAT-DGANVDMKLKQNEIKKFKYGIEEHGK) | Thermo Electron (Ulm, Germany) | ||
| Two chambered glass slides | Laboratory-Tek Nunc (Roskilde, Denmark) | 155380 | |
| Confocal microscope | Carl Zeiss Meditec (Jena, Germany) | LSM510 | |
| Piez–lectric crystal nanopositioner (Piezo Flexure NanoPositioner) | PI Polytech (Karlsruhe, Germany) | P-280 | |
| HVPZT-amplifier | PI Polytech (Karlsruhe, Germany) | E463 HVPZT-amplifier | |
| Glass tubes (glass replacement 3.5 nanoliter) | World Precision Instruments, Inc. Sarasota, Florida, USA | 4878 | |
| Micr–lectrode puller | Zeitz Instrumente (Munchen, Germany) | WZ DMZ-Universal Puller |
Références
- Vinken, M., et al. Connexins and their channels in cell growth and cell death. Cell Signal. 18, 592-600 (2006).
- Mese, G., Richard, G., White, T. W. Gap junctions: basic structure and function. J. Invest. Dermatol. 127, 2516-2524 (2007).
- Bruzzone, R., White, T. W., Paul, D. L. Connections with connexins: the molecular basis of direct intercellular signaling. Eur. J. Biochem. 238, 1-27 (1996).
- White, T. W., Bruzzone, R., Paul, D. L. The connexin family of intercellular channel forming proteins. Kidney Int. 48, 1148-1157 (1995).
- Decrock, E., et al. Connexin-related signaling in cell death: to live or let die? Cell Death Differ. 16, 524-536 (2009).
- Herve, J. C. Gap junctional complexes: from partners to functions. Prog. Biophys. Mol. Biol. 94, 1-4 (2007).
- Herve, J. C., Bourmeyster, N., Sarrouilhe, D., Duffy, H. S. Gap junctional complexes: from partners to functions. Prog. Biophys. Mol. Biol. 94, 29-65 (2007).
- Bruzzone, R., Barbe, M. T., Jakob, N. J., Monyer, H. Pharmacological properties of homomeric and heteromeric pannexin hemichannels expressed in Xenopus oocytes. J. Neurochem. 92, 1033-1043 (2005).
- Ebihara, L., Steiner, E. Properties of a nonjunctional current expressed from a rat connexin46 cDNA in Xenopus oocytes. J. Gen. Physiol. 102, 59-74 (1993).
- Evans, W. H., De Vuyst, E., Leybaert, L. The gap junction cellular internet: connexin hemichannels enter the signalling limelight. Biochem. J. 397, 1-14 (2006).
- Leybaert, L., Sanderson, M. J. Intercellular Ca2+ waves: mechanisms and function. Physiol. Rev. 92, 1359-1392 (2012).
- Sanderson, M. J., Charles, A. C., Dirksen, E. R. Mechanical stimulation and intercellular communication increases intracellular Ca2+ in epithelial cells. Cell Regul. 1, 585-596 (1990).
- Himpens, B., Stalmans, P., Gomez, P., Malfait, M., Vereecke, J. Intra- and intercellular Ca2+ signaling in retinal pigment epithelial cells during mechanical stimulation. Faseb J. 13, 63-68 (1999).
- Williams, K. K., Watsky, M. A. Bicarbonate promotes dye coupling in the epithelium and endothelium of the rabbit cornea. Curr. Eye Res. 28, 109-120 (2004).
- Hernandez Galindo, E. E., Theiss, C., Steuhl, K. P., Meller, D. Gap junctional communication in microinjected human limbal and peripheral corneal epithelial cells cultured on intact amniotic membrane. Exp Eye Res. 76, 303-314 (2003).
- Williams, K., Watsky, M. Gap junctional communication in the human corneal endothelium and epithelium. Curr. Eye Res. 25, 29-36 (2002).
- Anderson, S. C., Stone, C., Tkach, L., SundarRaj, N. Rho and Rho-kinase (ROCK) signaling in adherens and gap junction assembly in corneal epithelium. Invest. Ophthalmol. Vis. Sci. 43, 978-986 (2002).
- Joyce, N. C., Harris, D. L., Zieske, J. D. Mitotic inhibition of corneal endothelium in neonatal rats. Invest. Ophthalmol. Vis. Sci. 39, 2572-2583 (1998).
- Klepeis, V. E., Weinger, I., Kaczmarek, E., Trinkaus-Randall, V. P2Y receptors play a critical role in epithelial cell communication and migration. J. Cell Biochem. 93, 1115-1133 (2004).
- Klepeis, V. E., Cornell-Bell, A., Trinkaus-Randall, V. Growth factors but not gap junctions play a role in injury-induced Ca2+ waves in epithelial cells. J. Cell Sci. 114, 4185-4195 (2001).
- Laux-Fenton, W. T., Donaldson, P. J., Kistler, J., Green, C. R. Connexin expression patterns in the rat cornea: molecular evidence for communication compartments. Cornea. 22, 457-464 (2003).
- Rae, J. L., Lewno, A. W., Cooper, K., Gates, P. Dye and electrical coupling between cells of the rabbit corneal endothelium. Curr. Eye Res. 8, 859-869 (1989).
- Watsky, M. A., Rae, J. L. Dye coupling in the corneal endothelium: effects of ouabain and extracellular calcium removal. Cell Tissue Res. 269, 57-63 (1992).
- Williams, K. K., Watsky, M. A. Dye spread through gap junctions in the corneal epithelium of the rabbit. Curr. Eye Res. 16, 445-452 (1997).
- D'hondt, C., Ponsaerts, R., Srinivas, S. P., Vereecke, J., Himpens, B. Thrombin inhibits intercellular calcium wave propagation in corneal endothelial cells by modulation of hemichannels and gap junctions. Invest. Ophthalmol. Vis. Sci. 48, 120-133 (2007).
- D'hondt, C., Ponsaerts, R., Srinivas, S. P., Vereecke, J., Himpens, B. Reduced intercellular communication and altered morphology of bovine corneal endothelial cells with prolonged time in cell culture. Curr. Eye Res. 34, 454-465 (2009).
- D'hondt, C., Srinivas, S. P., Vereecke, J., Himpens, B. Adenosine Opposes Thrombin-Induced Inhibition of Intercellular Calcium Wave in Corneal Endothelial Cells. Invest Ophthalmol. Vis. Sci. 48, 1518-1527 (2007).
- Gomes, P., Srinivas, S. P., Van Driessche, W., Vereecke, J., Himpens, B. ATP release through connexin hemichannels in corneal endothelial cells. Invest. Ophthalmol. Vis. Sci. 46, 1208-1218 (2005).
- Gomes, P., Srinivas, S. P., Vereecke, J., Himpens, B. ATP-dependent paracrine intercellular communication in cultured bovine corneal endothelial cells. Invest. Ophthalmol. Vis. Sci. 46, 104-113 (2005).
- Gomes, P., Srinivas, S. P., Vereecke, J., Himpens, B. Gap junctional intercellular communication in bovine corneal endothelial cells. Exp Eye Res. , (2006).
- Ponsaerts, R., et al. The myosin II ATPase inhibitor blebbistatin prevents thrombin-induced inhibition of intercellular calcium wave propagation in corneal endothelial cells. Invest. Ophthalmol. Vis. Sci. 49, 4816-4827 (2008).
- Ponsaerts, R., et al. RhoA GTPase Switch Controls Cx43-Hemichannel Activity through the Contractile System. PLoS ONE. 7, e42074(2012).
- Ponsaerts, R., et al. Intramolecular loop/tail interactions are essential for connexin 43-hemichannel activity. Faseb J. 24, 4378-4395 (2010).
- Charles, A. Reaching out beyond the synapse: glial intercellular waves coordinate metabolism. Sci STKE. 2005, pe6(2005).
- Laird, D. W. Life cycle of connexins in health and disease. Biochem. J. 394, 527-543 (2006).
- Kelsell, D. P., Dunlop, J., Hodgins, M. B. Human diseases: clues to cracking the connexin code. Trends Cell Biol. 11, 2-6 (2001).
- Pearson, R. A., Dale, N., Llaudet, E., Mobbs, P. ATP released via gap junction hemichannels from the pigment epithelium regulates neural retinal progenitor proliferation. Neuron. 46, 731-744 (2005).
- Klepeis, V. E., Weinger, I., Kaczmarek, E., Randall, V. T. P2Y receptors play a critical role in epithelial cell communication and migration. J. Cell Biochem. 93, 1115-1133 (2004).
- Cotrina, M. L., Lin, J. H., Lopez-Garcia, J. C., Naus, C. C., Nedergaard, M. ATP-mediated glia signaling. J. Neurosci. 20, 2835-2844 (2000).
- Burnstock, G., Williams, M. P2 purinergic receptors: modulation of cell function and therapeutic potential. J. Pharmacol. Exp. Ther. 295, 862-869 (2000).
- Schwiebert, E. M., Zsembery, A. Extracellular ATP as a signaling molecule for epithelial cells. Biochim. Biophys Acta. 1615, 7-32 (2003).
- Lazarowski, E. R., Boucher, R. C., Harden, T. K. Mechanisms of release of nucleotides and integration of their action as P2X- and P2Y-receptor activating molecules. Mol. Pharmacol. 64, 785-795 (2003).
- Dubyak, G. R., el-Moatassim, C. Signal transduction via P2-purinergic receptors for extracellular ATP and other nucleotides. Am. J. Physiol. 265, C577-C606 (1993).
- Blair, S. A., Kane, S. V., Clayburgh, D. R., Turner, J. R. Epithelial myosin light chain kinase expression and activity are upregulated in inflammatory bowel disease. Lab. Invest. 86, 191-201 (2006).
- Boudreault, F., Grygorczyk, R. Cell swelling-induced ATP release and gadolinium-sensitive channels. Am. J. Physiol. Cell Physiol. 282, C219-C226 (2002).
- Romanov, R. A., Rogachevskaja, O. A., Khokhlov, A. A., Kolesnikov, S. S. Voltage dependence of ATP secretion in mammalian taste cells. J. Gen. Physiol. 132, 731-744 (2008).
- Pelegrin, P., Surprenant, A. Pannexin-1 mediates large pore formation and interleukin-1beta release by the ATP-gated P2X7 receptor. Embo J. 25, 5071-5082 (2006).
- Surprenant, A., Rassendren, F., Kawashima, E., North, R. A., Buell, G. The cytolytic P2Z receptor for extracellular ATP identified as a P2X receptor (P2X7). Science. 272, 735-738 (1996).
- D'hondt, C., et al. Pannexin channels in ATP release and beyond: an unexpected rendezvous at the endoplasmic reticulum. Cell Signal. 23, 305-316 (2011).
- Leybaert, L., et al. Connexin channels, connexin mimetic peptides and ATP release. Cell Commun. Adhes. 10, 251-257 (2003).
- Stout, C. E., Costantin, J. L., Naus, C. C., Charles, A. C. Intercellular calcium signaling in astrocytes via ATP release through connexin hemichannels. J. Biol. Chem. 277, 10482-10488 (2002).
- Verma, V., Hallett, M. B., Leybaert, L., Martin, P. E., Howard Evans, W. Perturbing plasma membrane hemichannels attenuates calcium signalling in cardiac cells and HeLa cells expressing connexins. Eur. J. Cell Biol. , (2008).
- Pharmacol, B. rJ. 147, S172-S181 (2006).
- Slakey, L. L., Gordon, E. L., Pearson, J. D. A comparison of ectonucleotidase activities on vascular endothelial and smooth muscle cells. Ann. N.Y. Acad. Sci. 603, 366-378 (1990).
- Gordon, E. L., Pearson, J. D., Slakey, L. L. The hydrolysis of extracellular adenine nucleotides by cultured endothelial cells from pig aorta. Feed-forward inhibition of adenosine production at the cell surface. J. Biol. Chem. 261, 15496-15507 (1986).
- Moerenhout, M., Himpens, B., Vereecke, J. Intercellular communication upon mechanical stimulation of CPAE- endothelial cells is mediated by nucleotides. Cell Calcium. 29, 125-136 (2001).
- Ralevic, V., Burnstock, G. Receptors for purines and pyrimidines. Pharmacol. Rev. 50, 413-492 (1998).
- Edelhauser, H. F. The resiliency of the corneal endothelium to refractive and intraocular surgery. Cornea. 19, 263-273 (2000).
- George, A. J., Larkin, D. F. Corneal transplantation: the forgotten graft. Am. J. Transplant. 4, 678-685 (2004).
- Hong, S. J., Wu, K. Y., Wang, H. Z., Fong, J. C. Change of cytosolic Ca2+ mobility in cultured bovine corneal endothelial cells by endothelin-1. J. Ocul. Pharmacol. Ther. 19, 1-9 (2003).
- Crawford, K. M., MacCallum, D. K., Ernst, S. A. Histamine H1 receptor-mediated Ca2+ signaling in cultured bovine corneal endothelial cells. Invest. Ophthalmol. Vis. Sci. 33, 3041-3049 (1992).
- Crawford, K. M., MacCallum, D. K., Ernst, S. A. Agonist-induced Ca2+ mobilization in cultured bovine and human corneal endothelial cells. Curr. Eye Res. 12, 303-311 (1993).
- Srinivas, S. P., Yeh, J. C., Ong, A., Bonanno, J. A. Ca2+ mobilization in bovine corneal endothelial cells by P2 purinergic receptors. Curr. Eye Res. 17, 994-1004 (1998).
- Satpathy, M., Gallagher, P., Jin, Y., Srinivas, S. P. Extracellular ATP opposes thrombin-induced myosin light chain phosphorylation and loss of barrier integrity in corneal endothelial cells. Exp Eye Res. 81, 183-192 (2005).
- Srinivas, S. P., et al. Cell volume response to hyposmotic shock and elevated cAMP in bovine trabecular meshwork cells. Exp. Eye Res. 78, 15-26 (2004).
- D'hondt, C., Ponsaerts, R., De Smedt, H., Bultynck, G., Himpens, B. Pannexins, distant relatives of the connexin family with specific cellular functions. Bioessays. 31, 953-974 (2009).
- Boitano, S., Dirksen, E. R., Sanderson, M. J. Intercellular propagation of calcium waves mediated by inositol trisphosphate. Science. 258, 292-295 (1992).
- De Vuyst, E., et al. Intracellular calcium changes trigger connexin 32 hemichannel opening. EMBO J. 25, 34-44 (2006).
- De Vuyst, E., et al. Ca2+ regulation of connexin 43 hemichannels in C6 glioma and glial cells. Cell Calcium. 46, 176-187 (2009).
- Weissman, T. A., Riquelme, P. A., Ivic, L., Flint, A. C., Kriegstein, A. R. Calcium waves propagate through radial glial cells and modulate proliferation in the developing neocortex. Neuron. 43, 647-661 (2004).
- Iyer, S., Deutsch, K., Yan, X., Lin, B. Batch RNAi selector: a standalone program to predict specific siRNA candidates in batches with enhanced sensitivity. Computer Methods and Programs in Biomedicine. 85, 203-209 (2007).
- Stehberg, J., et al. Release of gliotransmitters through astroglial connexin 43 hemichannels is necessary for fear memory consolidation in the basolateral amygdala. Faseb J. 26, 3649-3657 (2012).
- Evans, W. H., Bultynck, G., Leybaert, L. Erratum to: Manipulating Connexin Communication Channels: Use of Peptidomimetics and the Translational Outputs. J. Membr. Biol. 245, 451(2012).
- Majumder, P., et al. ATP-mediated cell-cell signaling in the organ of Corti: the role of connexin channels. Purinergic Signal. 6, 167-187 (2010).
- Carvalho, A. C., et al. affects intracellular Ca2+ stores and induces Ca2+ wave propagation. Cell Death Differ. 11, 1265-1276 (2004).
- Torres, A., et al. Extracellular Ca2+ acts as a mediator of communication from neurons to glia. Sci. Signal. 5, ra8(2012).
- Decrock, E., et al. Transfer of IP(3) through gap junctions is critical, but not sufficient, for the spread of apoptosis. Cell Death Differ. 19 (3), 947-957 (2012).
- Beltramello, M., Piazza, V., Bukauskas, F. F., Pozzan, T., Mammano, F. Impaired permeability to Ins(1,4,5)P3 in a mutant connexin underlies recessive hereditary deafness. Nat. Cell Biol. 7 (1,4,5), 63-69 (2005).
- Bukauskas, F. F., Bukauskiene, A., Verselis, V. K. Conductance and permeability of the residual state of connexin43 gap junction channels. J. Gen. Physiol. 119, 171-186 (2002).
- Bukauskas, F. F., Verselis, V. K. Gap junction channel gating. Biochim. Biophys. Acta. 1662, 42-60 (2004).
- Dahl, G. Where are the gates in gap junction channels? Clin. Exp. Pharmacol. Physiol. 23, 1047-1052 (1996).
- Retamal, M. A., Schalper, K. A., Shoji, K. F., Bennett, M. V., Saez, J. C. Opening of connexin 43 hemichannels is increased by lowering intracellular redox potential. Proc. Natl. Acad. Sci. U.S.A. 104, 8322-8327 (2007).
- Shibayama, J., et al. Effect of charge substitutions at residue his-142 on voltage gating of connexin43 channels. Biophys. J. 91, 4054-4063 (2006).
- Desplantez, T., Verma, V., Leybaert, L., Evans, W. H., Weingart, R. Gap26, a connexin mimetic peptide, inhibits currents carried by connexin43 hemichannels and gap junction channels. Pharmacological Research: The Official Journal of the Italian Pharmacological Society. 65, 546-552 (2012).
- Delmar, M. Gap junctions as active signaling molecules for synchronous cardiac function. J. Cardiovasc. Electrophysiol. 11, 118-120 (2000).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon