Method Article
Mechanische Stimulation induzierte Calcium Wellenausbreitung in Zellmonoschichten: Das Beispiel Bovine Endothelzellen
In diesem Artikel
Zusammenfassung
Intercellular Ca 2 +-Wellen werden von Gap Junction Kanälen und hemichannels angetrieben. Hier beschreiben wir eine Methode, um interzelluläre Ca messen 2 +-Wellen in Zellmonoschichten in Reaktion auf eine lokale Single-Cell-mechanischen Reiz und ihre Anwendung auf die Eigenschaften und Regulation von Gap Junction Kanälen und hemichannels untersuchen.
Zusammenfassung
Interzelluläre Kommunikation ist für die Koordinierung der physiologischen Prozesse zwischen Zellen in einer Vielzahl von Organen und Geweben, einschließlich des Gehirns, der Leber, der Retina, Cochlea und Gefäßsystem. In experimentellen Einstellungen interzelluläre Ca 2 +-Wellen kann durch Anlegen einer mechanischen Reiz auf eine einzelne Zelle hervorgerufen werden. Dies führt zur Freisetzung der intrazellulären Signalmoleküle IP 3 und Ca 2 +, die die Ausbreitung des Ca 2 +-Welle einzuleiten konzentrisch von der mechanisch stimuliert Zelle an den benachbarten Zellen. Die wichtigsten molekularen Signalwege, die intrazelluläre Ca 2 +-Wellenausbreitung Kontrolle durch Gap Junction Kanälen durch die direkte Übertragung von IP 3 und hemichannels durch die Freisetzung von ATP zur Verfügung gestellt. Identifizierung und Charakterisierung der Eigenschaften und der Regulierung der unterschiedlichen Connexin und Pannexin Isoformen als Gap Junction Kanälen und hemichannels werden vom quantificatio erlaubtn für die Ausbreitung der interzellulären Ca 2 +-Welle, siRNA, und die Verwendung von Inhibitoren von Gap-junction-Kanäle und hemichannels. Hier beschreiben wir eine Methode, um intrazelluläre Ca 2 +-Welle in Monoschichten von primären Endothelzellen mit Fluo4-AM in Reaktion auf eine kontrollierte und lokalisierte mechanische Reiz durch eine akute, kurz andauernde Verformung der Zelle provoziert geladen messen als Folge Berühren der Zellmembran mit einem Mikromanipulator gesteuert Glas-Mikropipette mit einem Durchmesser der Spitze von weniger als 1 um. Wir beschreiben auch die Isolierung von primären bovinen Endothelzellen und seine Verwendung als Modellsystem, um die Cx43-hemichannel Aktivität wie das angetriebene Kraft für interzelluläre Ca 2 +-Wellen durch die Freisetzung von ATP zu beurteilen. Schließlich diskutieren wir den Einsatz, Vorteile, Grenzen und Alternativen dieser Methode im Rahmen der Gap Junction Kanals und hemichannel Forschung.
Einleitung
Interzellulären Kommunikation und Signalisierung für die Koordinierung der physiologischen Prozesse in Reaktion auf extrazelluläre Agonisten an das Gewebe und ganzen Organniveau 1,2 erforderlich. Der direkte Weg der interzellulären Kommunikation wird durch das Auftreten von Gap Junctions erstellt. Gap Junctions sind Plaques von Gap Junction Kanälen, die proteinhaltige Kanäle durch den Kopf-an-Kopf-Docking von zwei Connexin (Cx) hemichannels benachbarter Zellen 3,4 (Abbildung 1) ausgebildet sind. Gap Junctions den Durchtritt von kleinen Signal-Moleküle mit einem Molekulargewicht von weniger als 1,5 kDa, darunter Ca 2 + oder IP 3 5, verursacht und Modulieren Ca 2 +-Freisetzung aus intrazellulären Speichern der von den benachbarten Zellen 6 (Abb. 2). Gap Junction Kanäle sind eng durch intra-und intermolekulare Protein-Interaktionen und zelluläre Signalwege reguliert Prozesse wie Redox-Modifikation undPhosphorylierung 7. GJS erleichtern die koordinierte Antwort von verbundenen Zellen, wodurch sie als eine chemische und elektrische Synzytium. Zum Beispiel ist die Verbreitung von Herztätigkeitspotential für die atrialen und ventrikulären Myozyten durch Cx-basierte GJ Kanäle 85 vermittelt. CXS nicht nur eine Rolle als Gap Junction Kanälen, sondern bilden auch ungepaarten hemichannels, wodurch sie als Kanäle in den Membranen ähnlich wie regelmäßige Ionenkanäle 8-10 (Abbildung 1). Hemichannels beteiligen parakrine Signalisierung zwischen benachbarten Zellen durch die Steuerung der Austausch von Ionen und Signalmoleküle zwischen dem intra-und extrazellulären Umgebung.
In vielen Zelltypen (zB Epithelzellen, Osteoblasten, Astrocyten, Endothelzellen, etc.) und Organe (wie Gehirn-, Leber-, Retina, Cochlea und dem Gefäßsystem), intrazelluläre Ca 2 +-Wellen für die Koordinierung der vielzelligen Antworten grundlegende 11. Erhöhungen der intrazellulären Ca 2 +-Spiegel in einer bestimmten Zelle nicht auf diese Zelle beschränkt, sondern Propagation in die umliegenden Nachbarzellen, wodurch eine intrazelluläre Ca 2 +-Welle 12,13. Diese intrazellulären Ca 2 +-Wellen sind für den normalen physiologischen Regulation von Zell-Schichten als Synzytium und deren Fehlregulation hat mit pathophysiologischen Prozessen 11 in Verbindung gebracht wichtig. Im Hornhautendothel und Epithel, studierte verschiedene Gruppen 14-24, 25-33 einschließlich unserer eigenen, die Mechanismen und die Rolle der interzellulären Kommunikation. In nicht-erregbaren Zellen, wie Endothelzellen, treten zwei unterschiedliche Modi der interzellulären Kommunikation 28,29, nämlich interzellulären Gap Junction-Kommunikation und parakrine interzelluläre Kommunikation. Interzellulären Gap Junction-Kommunikation beinhaltet einen direkten Austausch von Signalmolekülen über Gap Junctions 7. Gap junclen interzelluläre Kommunikation ist entscheidend für die Aufrechterhaltung Gewebshomöostase, Controlling Zellproliferation, und zur Errichtung einer synchronisierten Reaktion auf extrazelluläre Stress 10,34,35. In einer Reihe von Krankheiten, ist Gap Junction Kopplung aufgrund defekter CXS reduziert und hierdurch beeinträchtigt interzellulären Gap Junction-Kommunikation 36. Dies unterstreicht die Bedeutung und den Einfluss der interzellulären Gap Junction-Kommunikation in mehrzelligen Organismen. Im Gegensatz zu interzellulären Gap Junction-Kommunikation ist parakrine interzelluläre Kommunikation nicht abhängig von Zell-Zell-Apposition, da es die Freisetzung von diffusible extrazelluläre Botenstoffe (Abbildung 2) beinhaltet. Verschiedene Arten von Signalmolekülen in den extrazellulären Raum durch Signalisierung Zellen freigesetzt wird. Das Molekül wird dann an die Zielzelle, wo es von einem spezifischen Rezeptor Protein nachgewiesen transportiert. Anschließend wird der Rezeptor-Komplex Signal induziert eine zelluläre Antwort, dieBei Entfernung des Signals, Inaktivierung oder Desensibilisierung beendet. Veröffentlicht lipophilen extrazellulären Signalisierung Boten in die Membran eindringen und wirken auf intrazelluläre Rezeptoren. Im Gegensatz dazu hydrophilen Boten nicht über die Plasmamembran der Zelle reagiert, sondern wirken als Liganden, der an der Oberfläche exprimiert Rezeptorproteine, die dann das Relais das Signal an die intrazelluläre Umgebung bindet. Drei große Familien von Zelloberflächen-Rezeptor-Proteine in diesem Prozess zu beteiligen: Ionenkanal-vernetzt, enzyme-linked und G-Protein-gekoppelt. Das freigesetzte Botenstoff kann auf Rezeptoren der gleichen Zelle (autokrine) handeln, auf Zielzellen in unmittelbarer Nähe (parakrine) oder auf entfernten Zielzellen, die das Kreislaufsystem (endokrine) erfordern.
In vielen Zelltypen, einschließlich Endothel 28,29 ATP ist eine der wichtigsten hydrophilen, parakrine Faktoren, die die Ausbreitung der interzellulären Ca 2 +-Wellen 37-40 anzutreiben. During mechanische Verformung, Hypoxie, Entzündung oder Stimulation durch verschiedene Mittel, kann ATP von gesunden Zellen in Reaktion auf 41-44 Schubspannung, Stretch oder osmotische Schwellung 44,45 freigegeben werden. Verschiedene ATP-Freisetzung Mechanismen postuliert worden, darunter vesikulären Exozytose 44 und einer Vielzahl von Transport-Mechanismen, wie ATP-binding cassette (ABC) Transporter, plasmalemmalen spannungsabhängigen Anionen-Kanäle 46, P2X7-Rezeptor-Kanäle 47,48, sowie Connexin hemichannels 49-52 und Pannexin hemichannels 43,49,53. Extrazelluläre ATP kann schnell hydrolysiert, ADP, AMP und Adenosin 54,55 durch ectonucleotidases, die in der extrazellulären Umgebung sind. Die extrazellulär freigesetzt ATP und sein Metabolit ADP 56 wird durch Diffusion verbreiten. Die anschließende Wechselwirkung mit dieser Nukleotide Adenosin-Rezeptoren in den benachbarten Zellen in der p verwickeltropagation der interzellulären Ca 2 +-Wellen 28,37,51. Zwei Klassen von Adenosin-Rezeptoren sind: Adenosin ist die wichtigste natürliche Ligand für P1-Purinozeptoren, während sowohl purin (ATP, ADP) und pyrimidin (UTP, UDP) Nucleotide am P2-Purinozeptoren 57 handeln.
Interzelluläre Kommunikation kann durch verschiedene Methoden, wie Scrape Loading, Farbstoffübertragung lokalen Uncaging von Agonisten wie IP 3 und Ca 2 +, mechanische Stimulation etc. untersucht werden. Hier beschreiben wir die Studie von Ca 2 +-Wellenausbreitung durch mechanische Stimulation von einer einzigen Zelle ausgelöst. Der Vorteil des Studiums Ca 2 +-Wellenausbreitung durch mechanische Stimulation ist, dass es ein einfaches Werkzeug ermöglicht, um die Ausbreitung des Ca 2 +-Welle im Laufe der Zeit zu quantifizieren und ermöglicht quantitativen Vergleich verschiedener Vorbehandlungen der Zellen. In dem Endothel, diese interzelluläre Ca 2 +-Wellen erlauben coabgestimmte Antwort der Monoschicht, wird als eine mögliche Abwehrmechanismus des nicht regenerativen Hornhautendothel hilft das Endothel der extrazellulären Spannungen während einer intraokularen Operation zu widerstehen, oder unter Einwirkung von Entzündungsmediatoren während Immunabwehr oder Uveitis 58,59.
Protokoll
1. Isolierung von Endothelzellen
Bevor Sie beginnen: Isolieren Sie die Zellen aus den frischen Augen, von einem lokalen Schlachthof, so bald wie möglich nach enucleating das Auge erhalten. Stellen Sie sicher, dass das Auge von einer Kuh von maximal 18 Monate alt, nur fünf Minuten post mortem und konserviert in Balanced Salt Solution Earle wurde entkernt - 1% Jod-Lösung bei 4 ° C für den Transport zum Labor.
- Nehmen Sie das Auge aus der Balanced Salt Solution Earle - 1% Jod-Lösung und legen Sie sie in eine Petrischale (100 x 20 mm).
- Sterilisieren das Auge mit einer Lösung, die 70% Ethanol und spülen Sie mit Balanced Salt Solution Earle mit 1% Jod.
- Von diesem Schritt an, in einem sterilen Abzug arbeiten. Sorgfältig sezieren die Hornhaut aus dem Auge und legen Sie sie in einer Petrischale (35 x 10 mm) mit Earle-Balanced Salt Solution mit dem Epithelzellschicht nach oben. Entfernen Sie vorsichtig das restliche Irisgewebe still der Hornhaut angebracht, wenn nötig.
- Übertragen Sie die Hornhaut Balanced Salt anderen Earle-Lösung enthält Petrischale mit dem Endothelzellschicht nach oben und spülen Sie zweimal mit Balanced Salt Solution Earle.
- Übertragen Sie die Hornhaut mit dem Endothel nach oben in eine Sanduhr, die einen schalenförmigen Gericht ist, und bedecken Sie es mit Nährmedium. Das Nährmedium besteht aus Dulbeccos modifiziertem Eagle-Medium mit 25 mM Glukose, 10% fötales Rinderserum, 6,6% L-Glutamin, 2,5 ug / ml Amphotericin B und 1% Antibiotika-Antimykotika-Mischung, die 10.000 Einheiten / ml Penicillin, 10.000 pg / ml Streptomycin und 25 ug / ml Amphotericin B.
- Entfernen Sie das Medium mit einem Saugpipette.
- Bewerben 300 ul einer Trypsin-Lösung (0,5 g / L) auf die endotheliale Schicht der Hornhaut (all die Schritte, die Trypsin enthalten sind fertig mit der gleichen Konzentration).
- Legen Sie die Sanduhr, die die Hornhaut in einem abgedeckten Petrischale und steckte es in die incubator für 30 min bei 37 ° C und 5% CO 2.
- Vorsichtig kratzen die Endothelzellen von der Hornhaut mit einem feuerpolierten hakenförmigen Pasteurpipette aus Glas in einer sterilen Haube.
- Saugen Sie die Lösung, die die Endothelzellen und fügen Sie ihn in Kulturflaschen (25 cm 2) mit 4 ml Kulturmedium.
- Bewerben 300 ul Wachstumsmedium auf die Hornhaut und wiederholen Sie den Schaben und fügen Sie die Lösung, die die Endothelzellen der Kulturflasche.
- Wiederholen Sie diesen letzten Schritt (1.11) noch einmal.
- Legen Sie den Kulturflaschen mit den Endothelzellen in das Nährmedium im Brutschrank bei 37 ° C und 5% CO 2.
- Nach zwei Tagen, 6 ml Kulturmedium.
- Aktualisieren Sie die Wachstumsmedium jeden zweiten Tag.
2. Cell Culture
- Entfernen Sie das Kulturmedium und die Zellen zweimal mit Balanced Salt Solution Earle, wenn Konfluenz erreicht ist (max. About 10 Tage nach Isolation).
- 1,5 ml Trypsin-Lösung zu den Zellen, um sie zu lösen und der Kolben wird in den Inkubator (37 ° C, 5% CO 2) für 3 bis 4 min.
- In 12 ml Wachstumsmedium. Pipettieren die mittel dreimal in und aus, um die Zellen verteilen und zählen Sie die Zellen.
- Seed die Zellen mit einem variablen Anteil in Abhängigkeit von der Zelldichte und steckte sie in den Inkubator. Bereiten Sie zwei gut chambered Dias (mit einer Fläche von 4,2 cm 2) mit einer Zellzahl von 165.000 Zellen (Zelldichte 39.286 pro cm 2). Bereiten 80 cm 2 Kulturflaschen für eine neue Stelle bei einer Dichte von 6,250 pro cm 2, und fügen Sie frisches Kulturmedium bis zu einem Gesamtvolumen von 25 ml.
- Aktualisieren Sie die Medium alle zwei Tage.
- Konfluenz der Zellschicht wird nach 3 bis 4 Tagen erreicht. Verwenden Zellen für Experimente.
- Bei Konfluenz der Zellschicht in den Kolben erreicht wird, die Schritte 2.1 bis 2.6. Zellkulturen bis zu Passage 2 kann f verwendet werdenoder Experimente.
3. Mechanische Stimulation zur Induktion Calcium Welle
- Legen Sie die Zellen in der Kammer-Objektträger mit 10 uM Fluo-4 AM in Phosphat-gepufferter Salzlösung für 30 min bei 37 ° C unter leichtem Schütteln.
- Entfernen Sie die Fluo-4 AM Lösung, waschen Sie die Zellen fünfmal mit Phosphat-gepufferte Kochsalzlösung, brüten die Zellen mit Phosphat-gepufferter Salzlösung und lassen die Zellen für mindestens 5 min bei Raumtemperatur vor der Messung.
- Excite bei 488 nm mit Argon-Laser und Nutzung Strahlteiler HFT 488, sammeln die Fluoreszenzemission bei 530 nm mit einem Langpass Emission Filter LP 505, setzen Sie die Lochkamera mindestens. Verwenden Sie eine Öl-Immersion 40X-Objektiv (Air, 1.2 NA). In Experimenten mit ARL-67156, verwenden Sie einen 10X-Objektiv (Air, 0,3 NA).
- Suche nach einem Bereich, in dem die Zellen konfluent auf dem konfokalen Mikroskop.
- Position der Pipette, so dass es bei 45 ° in Bezug auf die Kammern Rutsche und Berühren der Zellmembran.Provozieren eine kurze (≈ 1 sec) mechanische Stimulation zu einer einzigen Zelle. Die mechanische Stimulation besteht aus einer akuten und der Kurz-bleibende Verformung der Zelle berühren, weniger als 1% der Zellmembran mit einer Glas-Mikropipette (Spitzendurchmesser <1 um), die mit einem piezoelektrischen Kristall Nanopositionierer, über einen Verstärker, der betrieben angebracht an einem Mikro-Manipulator. Die Glasmikropipetten sind mit einer Mikroelektrode Abzieher gemacht. Stellen Sie sicher, dass die Nanopositionierer durch eine Spannung zwischen 0,2 und 1,5 V ist bei der mechanischen Stimulation betrieben. Eine höhere Spannung als 1,5 V kann in der Zelle führen. Für jede Zelle Art und Zustand, muss die optimale Spannung für mechanische Stimulation ohne Zellschäden sorgfältig durch Anwendung einer Reihe von Spannungen ab Low (0,2 V) bis hoch (1,5 V) Spannung bestimmt werden. Die Spannung ist ein Maß für die Kraft der Stimulation da diese Spannung die mechanischen Spannungen und Dehnungen, die auf der Zellmembran angewendet werden. DieKraft der mechanischen Stimulation kann durch Multiplizieren der mechanischen Beanspruchung mit der Fläche berechnet werden. Da sowohl der Bereich (<3,14 um 2) und die mechanische Beanspruchung sehr gering sind, ist die Kraft der mechanischen Stimulation gering. (Beachten Sie, dass, wenn eine Zelle beschädigt ist, die Fluoreszenz tritt aus der Zelle und der Zelle dunkel wird.)
- Messen räumlichen Veränderungen in [Ca 2 +] i nach mechanischer Stimulation mit dem konfokalen Mikroskop.
- Sammeln und Speichern von Bildern.
- Zeichnen einer polygonalen Region von Interesse, um die gesamte Oberfläche der ansprechenden Zellen (aktive Fläche, AA) mit der Software des konfokalen Mikroskops zu definieren.
Ergebnisse
Alle Versuche werden unter Einhaltung aller einschlägigen Richtlinien, Vorschriften und Aufsichtsbehörden ausgeführt und das Protokoll die demonstriert wird, unter der Leitung und Genehmigung der Tierpflege und Nutzung Ausschuss der KU Leuven durchgeführt.
In Rinder-Endothelzellen (BCEC) werden funktionelle Gap Junctions ausgedrückt und beide interzellulären Gap Junction-Kommunikation und parakrine interzelluläre Kommunikation wesentlich zur interzellulären Kommunikation in einer interaktiven Art und Weise, aber der Hauptweg wurde gezeigt, dass die parakrine interzelluläre Kommunikation Weg vermittelt durch sein ATP-Freisetzung durch Cx43-basierte hemichannels 28,29. ATP und ADP hydrolysiert werden monophosphat (AMP) durch die ectonucleotidase E-NTPD1 (ectonucleoside Triphosphat Diphosphohydrolase 1, CD39 ATP Diphosphohydrolase) adenosin, und anschließend durch die 5'-ectonucleotidase CD73 28,29 Adenosin. ATP und ADP dazu beitragen,der Ca 2 +-Wellenausbreitung durch Bindung an P2Y1 und P2Y2-Rezeptoren 28,29. Beide Rezeptoren an die SPS über Gq und dadurch evozieren IP 3-induzierte Ca 2 +-Freisetzung (Abbildung 2). In BCEC die Stimulation der purinergen P2Y-Rezeptoren führt zu einer raschen Erhöhung der [Ca 2 +] i, die unempfindlich gegenüber der Entfernung von [Ca 2 +] o 60 ist. [Ca 2 +] i Peaks Agonistenstimulation hervorgerufen werden durch ein [Ca 2 +] i Abnahme, die zu einer stabilen, Agonisten-abhängige Erhöhung führen kann gefolgt, [Ca 2 +] o-abhängige oszillierende Schwankungen oder eine Rückkehr zu den Ausgangswerten 60-62. In BCEC gab es Hinweise darauf, dass Ca 2 +-Freisetzung erfolgt über einen Weg, der PLC und IP 3 29. Entleeren des IP 3-sensitive speichert führt zu einer anfänglichen Spitzenwert von [Ca 2 +] i, anschließend gefolgt von einer ca.pacitative Ca 2 +-Einstrom, die zu Beginn der Plateauphase 63.
Mechanische Stimulation führt zu einem schnellen Anstieg der anfängliche Ca 2 +, die stammt aus dem Punkt der Stimulation und breitet sich dann in der mechanisch stimulierten Zellen. Schließlich wird die intrazelluläre Ca 2 +-Niveaus langsam verringern zurück zum Basisniveau. Nach Erreichen der Zell-Grenzen, die interzelluläre Ca 2 +-Welle fortpflanzt, um die umliegenden Nachbarzellen (NB) in einer wellenartigen Weise wie ein Ca 2 +-Transienten, die Grundniveau (Abbildung 3) abklingt. In Steuerbedingungen, Ca 2 +-Transienten wurden bis zu etwa 4 bis 8 Zellschichten vom mechanisch stimulierten Zellen (Abbildung 3) beobachtet. Das Liniendiagramm (auf der rechten Seite der Paneele in Fig. 3) zeigt den zeitlichen Verlauf der Ca2 +-Transienten (dargestellt als normalisierte Fluoreszenz (NF)-Werte) indie mechanisch stimuliert Zelle und in den benachbarten Zellschichten 4.59 (NB1, NB2, NB3, NB4 und NB5). Aus 3 wird deutlich, dass die normalisierte Fluoreszenz ab, während die Zeitverzögerung für das Einsetzen der [Ca 2 +] i-Zunahme mit zunehmendem Abstand von der mechanisch stimulierten Zellen. Die jeweils höchsten Fluoreszenz im mechanisch stimulierten Zellen wurde in 0,95 ± 0,04 sec erreicht. Nach Erreichen einer maximalen normierten Wert Fluoreszenz zeigten die normalisierte Fluoreszenz eine sehr allmähliche und langsame Abnahme, wieder in den basalen Wert 152 ± 6 Sekunden nach dem Anlegen des Reizes 25.
Die Hemmung der interzellulären parakrine Kommunikationspfad unter Verwendung einer Kombination von exogenen Apyrase VI (5 U / ml für 30 min) und Apyrase VII (5 U / ml für 30 min) bewirkte eine 7,5-fache Verringerung in dem von der Ca 2 abgedeckt +-Welle, dem sogenannten aktiven Bereich (AA, P <0,001, N = 7, N = 35) (4A). Apyrase ist bekannt, dass ATP und ADP hydrolysieren. Apyrase VI hat eine hohe ATPase / ADPase Verhältnis und Apyrase VII bevorzugt hydrolysiert ADP 56.
Da parakrine interzelluläre Kommunikation im Endothel weitgehend erfolgt durch ATP-Freisetzung, 28,29 und ATP hydrolysiert wird in den extrazellulären Raum durch ectonucleotidases, bekannt, in dem Endothel exprimiert werden, 29,64,65 untersuchten wir die Wirkung auf AA in Bedingungen wo ATP Hydrolyse gehemmt wird mit ectonucleotidase Inhibitoren. Die Hemmung der ectonucleotidases mit ARL-67156 (ARL; 100 nM für 30 min) ergab starke Erhöhung der Ca 2 +-Wellenausbreitung, wie zuvor in BCEC 25,26,28,29 gezeigt. Die Exposition von BCEC zu ARL verursachte eine 3,5-fache Erhöhung des AA im Vergleich zu Bedingungen (P <0,001, N = 12, n = 60) zu steuern (Abbildung 4B).
In prebisherigen Studien in unserem Labor connexin mimetischen Peptide (Gap26 und Gap27, Tabelle 2) wurden verwendet, um die relativen Beiträge der interzellulären Gap Junction-Kommunikation und parakrine interzelluläre Kommunikation zu interzelluläre Ca 2 +-Wellenausbreitung nach mechanischer Stimulation unterscheiden mit einem inaktiven Peptid ( Tabelle 2) als Kontrolle 28,29.
Inhibition von Gap Junction Kanälen mit Gap27 signifikant verringert die Ausbreitung des Ca 2 +-Welle in BCEC 30. Das AA wurde deutlich auf eine Vorbehandlung mit Gap27 (300 pM für 30 min) reduziert (p <0,001, N = 8, n = 40) 25 (Tabelle 1). Inhibition von Connexin hemichannels mit der Connexin-mimetische Peptid Gap26 28,30 deutlich reduziert die Ausbreitung der Ca 2 +-Welle in BCEC 28. Das AA wurde deutlich auf eine Vorbehandlung mit Gap26 (300 pM für 30 min) reduziert(P <0,001, N = 8, n = 40) 25 (Tabelle 1).
Wir zeigten auch, dass der 43-kDa Isoform Cx ein Hauptbestandteil zugrunde liegenden hemichannel-vermittelte ATP-Freisetzung, die interzelluläre Ca 2 +-Wellen provoziert war. Mit Hilfe von zwei unabhängig voneinander entwickelt siRNA-Moleküle gezielt Cx43, fanden wir, dass die AA von etwa 65% 33 (Tabelle 1) wurde reduziert. Dies wurde durch Experimente mit TAT-L2 (100 pM, 30 min), ein zellpermeablen Peptid entsprechend der zweiten Hälfte des intrazellulären Schleife von Cx43 (Tabelle 2), die eine deutliche Senkung der AA (P <0,001 provoziert untermauert N = 3, n = 30) (Tabelle 1). Wichtig ist, dass diese Verringerung der AA von TAT-L2 Inkubation in Abwesenheit von parakrine Signal beobachtet, unterstützt das Konzept, dass TAT-L2 hemmt selektiv Cx43-basierte hemichannels aber nicht gap junction Kanäle 33. Ferner kann eine inaktive TAT-L2-Mutante (TAT-L2 H126K/I130N) als Kontrolle (Tabelle 2) verwendet werden.

Abbildung 1. Bildung von Gap Junction Kanälen und hemichannels: schematische Darstellung. A. A Connexin oder Pannexin hemichannel wird gebildet, wenn sechs oder Connexinen pannexins, die vier-Transmembran-Domäne-enthaltende Proteine sind, die radial um eine zentrale Pore angeordnet sind. Hemichannels in der Plasmamembran. Sie können aus identischen Protein Subtypen (homomere hemichannels) bestehen oder sie können von verschiedenen Protein Subtypen, wenn zwei oder mehrere Isoformen in der gleichen Zelle (heteromeren hemichannels) ausgedrückt bestehen. Ein homotypische gap junction Kanal ergibt sich aus der Docking von zwei identischen homomeren oder heteromeren hemichannels. A heterotypic Gap Junction Kanals ergibt sich aus der docking von zwei verschiedenen homomeren oder heteromeren Kanäle. B. Schematische Struktur von Connexin und Pannexin Gap Junction Kanälen zwei benachbarte Zellen und hemichannels.
(Teilweise ab 66 modifiziert)
Diese Figur wurde ursprünglich in BioEssays veröffentlicht. Catheleyne D'Hondt, Raf Ponsaerts, De Smedt, Geert Bultynck und Bernard Himpens Humbert. Pannexins, entfernten Verwandten der Familie connexin mit spezifischen zellulären Funktionen. BioEssays. 2.009, 31, 953-974 (2009). BioEssays. Klicke hier, um eine größere Abbildung anzuzeigen .
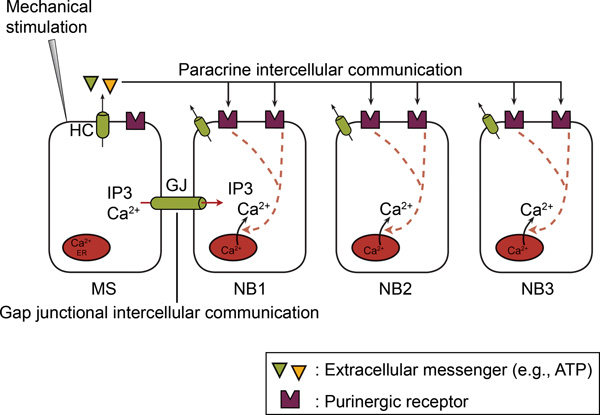
Abbildung 2. In nicht-erregbaren Zellen, die intercellular Ca 2 +-Wellenausbreitung beinhaltet sowohl interzelluläre Gap Junction-Kommunikation und parakrine interzelluläre Kommunikation. bei mechanischer Stimulation einer einzigen Zelle, ein Ca 2 +-Anstieg tritt im mechanisch stimulierten Zellen (MS) über Ca 2 +-Einstrom und / oder Ca 2 +-Freisetzung. Anschließend werden die Ca 2 +-Anstieg breitet sich von der mechanisch mit den benachbarten Zellen (NB) als interzelluläre Ca 2 +-Welle angeregt. Der interzelluläre Ausbreitung beinhaltet zwei Mechanismen, nämlich interzellulären Gap Junction Kommunikation und parakrine interzelluläre Kommunikation. In interzellulären Gap Junction-Kommunikation, erfolgt ein direkter Austausch eines Mediators (IP 3 und / oder Ca 2 +) zwischen den cytoplasms benachbarter Zellen über Gap Junctions (GJS). In parakrine interzelluläre Kommunikation, wird ein Bote (zB ATP) in den extrazellulären Raum freigesetzt, wodurch die auf Rezeptoren auf th gelegene Oberfläche von benachbarten Zellen. Hemichannels (HC) oder andere Mechanismen vermitteln diese ATP-Freisetzung (siehe Text). Ectonucleotidases hydrolysieren ATP zu ADP und AMP. ATP und ADP wirken auf P2Y und / oder P2X Rezeptoren auf benachbarten Zellen. (Ab 66 gemacht.)
Diese Figur wurde ursprünglich in BioEssays veröffentlicht. Catheleyne D'Hondt, Raf Ponsaerts, De Smedt, Geert Bultynck und Bernard Himpens Humbert. Pannexins, entfernten Verwandten der Familie connexin mit spezifischen zellulären Funktionen. BioEssays. Jahr 2009. 31. 953-974 (2009). BioEssays.
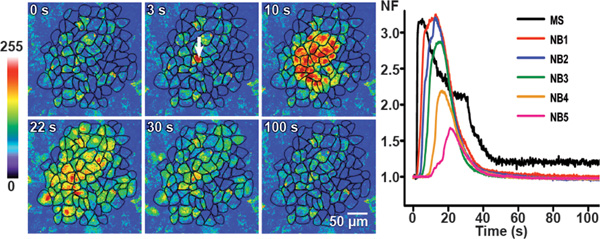
Abbildung 3. Calcium Wellenausbreitung im Kontrollbedingungen BCEC. Mechanische Stimulation induziert Calcium Transienten werden an verschiedenen Zeitpunkten in Kontrollbedingungen BCEC durch repräsentative Pseudo-farbigen Fluoreszenz-Bildern gezeigt. Die fluorescence Intensitäten vor der Stimulation sind im ersten Bild gezeigt. Der weiße Pfeil in dem zweiten Bild identifiziert die mechanisch stimulierten Zellen. Die Calcium-Welle breitet sich auf sechs benachbarten Zellschichten mit einer Gesamtfläche von Zellen von der Welle (aktive Fläche: AA) erreichte von 62.870 um 2.
Im rechten Bereich mit der Liniendiagramme zeigt den zeitlichen Verlauf des normalisierten Fluoreszenz Wert (NF) in dem mechanisch stimulierten Zellen (MS) und dem Durchschnittswert der NF in den benachbarten Zellen (NB) Schichten 1 bis 5 (NB1 zu NB5). (Teilweise ab 25 Uhr geändert.)
Diese Figur wurde ursprünglich in Investigative Ophthalmology und Visual Science veröffentlicht. Catheleyne D'Hondt, Raf Ponsaerts, Sangly P Srinivas, Johan Vereecke und Bernard Himpens. Thrombin hemmt interzellulären Kalzium Wellenausbreitung in Endothelzellen durch Modulation hemichannels und Gap Junctions. Invest. Ophthalmol. Vis. Sci. Jahr 2007. 48 (1), 120-33 (2007). Investigative Ophthalmology und Visual Wissenschaft.

Abbildung 4. Wesentliche Veränderungen in der Ausbreitung der intrazellulären Ca 2 +-Wellen nach der Behandlung mit exogenen Nukleotidasen (links) und mit ectonucleotidase Inhibitoren (rechts) in BCEC. A. signifikante Abnahme der AA nach Behandlung mit exogenen BCEC Apyrasen (Apyrase VI (5 U / ml) und Apyrase VII (5 U / ml) für 30 min), das ATP und ADP hydrolysieren, wird die Hemmung der interzellulären parakrine Kommunikationspfad (N = 7, n = 35). * Bedeutet p <0,001 in Gegenwart vs Abwesenheit Apyrase B. Deutliche AA nach der Behandlung mit einem selektiven BCEC ectonucleotidase Inhibitor ARL-67156 (ARL; 100 pM für 30 min)., Herby enhancing die parakrine interzellulären Kommunikationspfad (N = 12, n = 60). * Bedeutet p <0,001 in Gegenwart vs Abwesenheit von ARL.
| Normalized AA | St. Fehler | N | n | Statistik | |
| steuern | 100 | 8.31 | 3 | 30 | |
| siScramble | 87.97 | 9.3 | 3 | 30 | |
| siCx43-1 | 32,45 | 8,23 | 3 | 30 | * |
| siCx43-2 | 35,49 | 7,06 | 3 | 30 | * |
| Control Peptide | 91,68 | 6.5 | 8 | 40 | |
| Gap 26 | 46,67 | 4,24 | 8 | 40 | * |
| Gap 27 | 53 | 4,76 | 8 | 40 | * |
| TAT-L2 | 6.99 | 0,71 | 3 | 30 | * |
Tabelle 1. Effekt von siRNA-Molekülen gezielt Cx43, Connexin mimetische Peptide und die zellpermeablen Peptid TAT-L2 auf der normierten aktiven Bereich (AA) in BCEC.
N die Anzahl der Tage der Experimente, n die Anzahl der mechanischen Reizen. * Bedeutet p <0,001 im Vergleich zu Kontrollbedingungen.
| AA-Sequenz | |
| Control Peptide | SRGGEKNVFIV |
| Gap26 | VCYDKSFPISHVR |
| Gap27 | SRPTEKTIFII |
| TAT-L2 | YGRKKRRQRRR-DGANVDMHLKQIEIKKFKYGIEEHGK |
| TAT-L2H126K/I130N | YGRKKRRQRRR-DGANVDMKLKQNEIKKFKYGIEEHGK |
| 10Panx1 | WRQAAFVDSY |
Tabelle 2. Die Aminosäuresequenzen der Peptide verwendet.
Diskussion
In diesem Manuskript, beschreiben wir eine einfache Methode, um intrazelluläre Ca 2 +-Wellenausbreitung in Monoschichten von primären bovinen Endothelzellen zu messen, indem sie eine lokalisierte und kontrollierte mechanische Stimulation mit einer Mikropipette. Mechanisch stimulierten Zellen mit einer lokalen Erhöhung der intrazellulären IP 3 und Ca 2 + reagieren, die beide wesentliche intrazelluläre Signalmoleküle, die eine intrazelluläre Ca 2 +-Wellenausbreitung 11,67 anzutreiben sind. IP 3 wird direkt an Nachbarzellen über Gap Junction Kanälen 5 übertragen, während die Ca 2 + provoziert die Eröffnung hemichannels und die Freisetzung von ATP 68,69, die Ca 2 +-Signale in benachbarten Zellen löst durch die Aktivierung von G-Protein-gekoppelten P2 Rezeptoren 37-40. Der relative Beitrag von Gap-junction-Kanäle und hemichannels in diesem Verfahren kann durch die Verwendung von Cx-Mimetikum charakterisiert werdenPeptide, ATP-abbauenden Enzymen (ectonucleotidases) und Inhibitoren der ectonucleotisdases. Die Eigenschaften der mechanischen Stimulation induzierten intrazellulären Ca 2 +-Wellenausbreitung in bovinen Endothelzellen wurden gründlich in unserem Labor 25-33 gekennzeichnet. Unsere Ergebnisse zeigen, dass die intrazelluläre Ca 2 +-Wellenausbreitung wird hauptsächlich durch eine Cx-hemichannel-vermittelten Freisetzung von ATP, mit Cx43 spielen eine herausragende Rolle angetrieben. Daher ist dieses Verfahren angewendet, um primäre Rinder-Endothelzellen besonders geeignet zur Identifizierung oder Charakterisierung der Regulation der Cx43 hemichannels an endogenen in nativen Zellen. Mit diesem Verfahren haben wir festgestellt, dass die Aktivität von Cx43 hemichannels kritisch durch die Actomyosin Zytoskeletts, die als endogene Bremse eine übermäßige dienen können, und damit schädliche, Cx43 hemichannel Öffnung 25,31,32 gesteuert. Wir weiteren Aufklärung der molekularen Mechanismen dieser Regulation und findeneine wichtige Rolle der intramolekularen Schleife / tail Wechselwirkungen, die für die Eröffnung des Cx43 hemichannels 33 sind.
Offensichtlich ist dieses System sehr gut geeignet für die Untersuchung der Funktion von Cx und Panx auf Gap Junction Kanälen und hemichannels und auf keinen Fall an bovine Endothelzellen beschränkt, sondern ist anpassungsfähig an nahezu jeden Zelltyp und auch komplexere Gewebe, wie gezeigt worden ist im Gehirn, wo mechanische Stimulation ausgelöst große intrazelluläre Ca 2 +-Wellen, die das gesamte Halbkugel 70. Verschiedene Werkzeuge vorhanden sind, um den Beitrag der Gap Junction Kanälen und hemichannels, einschließlich Cx-mimetischen Peptide, ATP-abbauenden Enzymen, Inhibitoren der ectonucleotidases und pharmakologische Verbindungen wie Carbenoxolon und 10 PANX1 (Tabelle 2) 49,50 beurteilen. Um den Beitrag von einem bestimmten Cx oder Panx Isoform in diesen Prozess zu bestimmen, sorgfältig entworfen siRNA Sonden targeting zwei unabhängige Bereiche der mRNA und einer verschlüsselten Steuerung verwendet werden. Das Ausmaß der Knockdown sollte die Gesamtmenge Proteinebene mittels Western-Blot-Assays und die Ebene einer einzelnen Zelle durch Fluoreszenzmikroskopie ermittelt werden. Die Transfektionseffizienz der siRNA-Sonden in den experimentellen Zellmonolayern sollte durch Fluoreszenzmikroskopie beurteilt. Dazu kann man die Entwicklung einer Duplex siRNA in dem eine fluoreszierende Markierung an das 3'-Ende des Sense-Strangs eingebaut wurde. Es ist wichtig zu beachten, dass für eine ordnungsgemäße Analyse, ein bekannter Reduktion der Cx oder Panx Isoform (> 90% ige Reduktion) sowie eine homogene Transfektion der siRNA-Duplexe in der Zellrasen (> 90% der Zellen mit siRNA transfiziert Sonde) sollte erhalten werden. Die Selektivität der Sonden entwickelt siRNA auf das Ziel sollte 71 beurteilt werden. Kurz gesagt, sollten diese Werkzeuge so validiert werden, dass sie keinen Einfluss auf die Expression anderer Cx oder Panx Isoformen oder andere wichtige comKomponenten treibende interzelluläre Ca 2 +-Wellen, wie P2X oder P2Y Rezeptoren. Um den Beitrag von Cx43 hemichannels beurteilen, haben wir mit dem Labor von Dr. Leybaert bei der Entwicklung eines zellpermeablen Peptid entsprechend der zweiten Hälfte des intrazellulären Schleife von Cx43 (TAT-L2), die als selektive, potenter Inhibitor wirkt zusammen Cx43 hemichannels während Cx43-Gap Junction-Kanal-Aktivität 33. In unseren Studien, verwenden wir 100 pM TAT-L2, um eine vollständige Hemmung der Cx43 hemichannels erhalten, aber niedrigere Konzentrationen ausreichend 72 sein. TAT-L2H126K/I130N wird als negative Kontrolle 73 empfohlen. Um den Beitrag der PANX1 Kanäle zu beurteilen, kann der 10Panx1 Peptid angewendet werden. Diese Werkzeuge sind nicht nur für den Ausschluss der Plasmamembran Störung (siehe unten), sondern auch für den Nachweis, dass parakrine ATP Signalisierung vermittelt die Mechanismen der intrazellulären Ca 2 +-Wellenausbreitung durch hemichannels und nicht durch andere Mechanismen (wie m wichtigaxi-Anionen-Kanäle oder die Freisetzung von ATP-haltigen Vesikel). Schließlich wird, wie für alle Studien unter Verwendung von primären Zellen, müssen die Bedingungen der Zellkultur und die Anzahl der Kanäle standardisiert werden, da die biologischen Eigenschaften der Zellen und damit das Expressionsprofil der einzelnen Cx und Panx Isoformen im Laufe der Zeit 26 ändern.
Es gibt jedoch eine Reihe von Nachteilen dieses Verfahrens. Ein wesentlicher Nachteil des Verfahrens ist, dass die mechanische Stimulation kann Plasmamembran Störung auslösen, die zum Eintrag von extrazellulärem Ca 2 + und die Freisetzung von Signalmolekülen wie ATP, die beide echten interzelluläre Ca 2 +-Wellenausbreitung 11 zugrunde liegen. Dies ist definitiv erschwert die (quantitative) Analyse der intrazellulären Ca 2 +-Welle. Daher ist es sehr empfehlenswert, dass man i) verwenden geeignete Kontrollen, dh Zelllinien, die die Expression von Cx oder Panx Isoformen fehlt, und Tools, die interfere mit der Funktion der Cx und Panx als Gap Junction Kanäle und / oder hemichannels und ii) zu standardisieren, die mechanische Stimulation Verfahren (stellen Sie sicher, dass während der mechanische Reiz der Nanopositionierer durch eine Spannung zwischen 0,5 und 2 V betrieben wird).
Darüber hinaus ist es wichtig zu beachten, dass diese Methode nicht für sich alleine stehen, sondern sollte durch zusätzliche experimentelle Ansätze untermauert werden muss, Cx und Panx Kanäle zu studieren. Dies kann durch eine lokale Erhöhung der intrazellulären Signal-Moleküle, die in mechanisch-Stimulation-vermittelte interzelluläre Ca 2 +-Wellenausbreitung teilnehmen, wie das Uncaging der intrazellulären IP3 oder Ca 2 + 11,74 erreicht werden. Zur Einleitung interzelluläre Ca 2 +-Welle unabhängig von mechanischen Stimulation, kann man Mikro-Injektion, wie rekombinantes pro-apoptotische Bax 11,75 und photo-aktivierbaren Ca 2 +-Puffer wie Diazo-2, die einen lokalen Tropfen in extrazellulären bewirkt verwenden [Ca 2 + ] 76, ein bekannter Auslöser für hemichannel Öffnung. Alternativ kann man in situ Elektroporation von zellundurchlässigen Signalmoleküle verwenden, auslösen intrazellulären Ca 2 +-Freisetzung und interzelluläre Ca 2 +-Wellen, wie IP-3 67,68. Das letztere Verfahren wird auch verwendet, um die Ausbreitung von Zelltod 5,77 untersuchen. Diese nicht-mechanische Reize bieten eine bessere Beurteilung des Stimulus-Response-Intensität. Zusätzlich zu diesen Ca 2 +-Wellenausbreitung Methoden, ist es wichtig, die Aktivität der Cx oder Panx Kanäle mit anderen Ansätzen, einschließlich der Bestimmung des hydrophilen Farbstoffaufnahme (wie Lucifer yellow) 78 und die Freisetzung von ATP nicht nur in bestimmen als Reaktion auf mechanische Reize, sondern auch in Reaktion auf extrazelluläres Ca 2 +-Puffer (wie EGTA) und intrazelluläre Ca 2 +-Freisetzung Moleküle (wie Ca 2 +-Ionophor A23187) 11,74. Darüber hinaus ter beste Beweis für die Regulierung auf dem Kanal wird durch elektrophysiologische Experimente, entweder Dual-Voltage-Clamp-Systemen oder whole-cell Pfad Klemme Xenopus Oozyten mit Cx oder Panx mRNA oder von HeLa-Zellen ektopisch Cx Isoformen zusammen mit einem Marker wie GFP eingespritzt wird 79-84.
Zum Schluss, die Verwendung von mechanischen Stimulation zur Induktion interzelluläre Ca 2 +-Wellen bietet eine einfache und zuverlässige Methode, um die intrazelluläre Kommunikation untersuchen und prüfen, den Beitrag und die Eigenschaften von Cx und Panx Kanäle.
Offenlegungen
Autoren haben nichts zu offenbaren.
Danksagungen
Forschungsarbeiten im Labor durchgeführt wurde durch Zuschüsse aus dem Forschungsgemeinschaft - Flandern (FWO; Zuschuss Zahlen G.0545.08 und G.0298.11), der Interuniversity Attraction Poles Program (Belgian Science Policy; Grantnummer P6/28 und P7/13) und wird in einer FWO-gestützte Forschung eingebettet. CDH ist ein Post-Doc-Stipendiat der Forschungsgemeinschaft - Flandern (FWO). Die Autoren sind sehr dankbar für alle gegenwärtigen und ehemaligen Mitgliedern des Laboratory of Molecular and Cellular Signaling (KU Leuven), Dr. Srinivas SP (Indiana University School of Optometrie, USA), das Labor von Dr. Leybaert (Universität Gent) und der Dr. Vinken (VUB), die hilfreichen Diskussionen vorgesehen, optimierte Verfahren oder wurden in der Entwicklung von Werkzeugen für die Studie von Connexin hemichannels beteiligt.
Materialien
| Name | Company | Catalog Number | Comments |
| Earle's Balanced Salt Solution (EBSS) | Invitrogen-Gibco-Molecular Probes (Karlsruhe, Germany) | 14155-048 | |
| Iodine | Sigma-Aldrich (Deisenhofen, Germany) | 38060-1EA | |
| Dulbecco's Modified Eagle's Medium (DMEM) | Invitrogen-Gibco-Molecular Probes (Karlsruhe, Germany) | 11960-044 | |
| L-glutamine (Glutamax) | Invitrogen-Gibco-Molecular Probes (Karlsruhe, Germany) | 35050-038 | |
| Amphotericin-B | Sigma-Aldrich (Deisenhofen, Germany) | A2942 | |
| Antibiotic-antimycotic mixture | Invitrogen-Gibco-Molecular Probes (Karlsruhe, Germany) | 15240-096 | |
| Trypsin | Invitrogen-Gibco-Molecular Probes (Karlsruhe, Germany) | 25300-054 | |
| Dulbecco's PBS | Invitrogen-Gibco-Molecular Probes (Karlsruhe, Germany) | 14190-091 | |
| Fluo-4 AM | Invitrogen-Gibco-Molecular Probes (Karlsruhe, Germany) | F14217 | |
| ARL-67156 (6-N,N-Diethyl-b,g-dibromomethylene-D-ATP) | Sigma-Aldrich (Deisenhofen, Germany) | A265 | |
| Apyrase VI | Sigma-Aldrich (Deisenhofen, Germany) | A6410 | |
| Apyrase VII | Sigma-Aldrich (Deisenhofen, Germany) | A6535 | |
| Gap26 (VCYDKSFPISHVR) | Custom peptide synthesis | ||
| Gap27 (SRPTEKTIFII) | Custom peptide synthesis | ||
| Control Peptide (SRGGEKNVFIV) | Custom peptide synthesis | ||
| siRNA1 Cx43 (sense: 5'GAAGGAGGAGGAACU-CAAAdTdT) | Annealed siRNA was purchased at Eurogentec (Luik, Belgium) | ||
| siRNA2 Cx43 (sense: 5'CAAUUCUUCCUGCCGCAAUdTdT) | Annealed siRNA was purchased at Eurogentec (Luik, Belgium) | ||
| siRNA scramble: scrambled sequence of siCx43-1 (sense: 5'GGUAAACG-GAACGAGAAGAdTdT) | Annealed siRNA was purchased at Eurogentec (Luik, Belgium) | ||
| TAT-L2 (TAT- DGANVDMHLKQIEIKKFKYGIEEHGK) | Thermo Electron (Ulm, Germany) | ||
| TAT-L2-H126K/I130N (TAT-DGANVDMKLKQNEIKKFKYGIEEHGK) | Thermo Electron (Ulm, Germany) | ||
| Two chambered glass slides | Laboratory-Tek Nunc (Roskilde, Denmark) | 155380 | |
| Confocal microscope | Carl Zeiss Meditec (Jena, Germany) | LSM510 | |
| Piez–lectric crystal nanopositioner (Piezo Flexure NanoPositioner) | PI Polytech (Karlsruhe, Germany) | P-280 | |
| HVPZT-amplifier | PI Polytech (Karlsruhe, Germany) | E463 HVPZT-amplifier | |
| Glass tubes (glass replacement 3.5 nanoliter) | World Precision Instruments, Inc. Sarasota, Florida, USA | 4878 | |
| Micr–lectrode puller | Zeitz Instrumente (Munchen, Germany) | WZ DMZ-Universal Puller |
Referenzen
- Vinken, M., et al. Connexins and their channels in cell growth and cell death. Cell Signal. 18, 592-600 (2006).
- Mese, G., Richard, G., White, T. W. Gap junctions: basic structure and function. J. Invest. Dermatol. 127, 2516-2524 (2007).
- Bruzzone, R., White, T. W., Paul, D. L. Connections with connexins: the molecular basis of direct intercellular signaling. Eur. J. Biochem. 238, 1-27 (1996).
- White, T. W., Bruzzone, R., Paul, D. L. The connexin family of intercellular channel forming proteins. Kidney Int. 48, 1148-1157 (1995).
- Decrock, E., et al. Connexin-related signaling in cell death: to live or let die?. Cell Death Differ. 16, 524-536 (2009).
- Herve, J. C. Gap junctional complexes: from partners to functions. Prog. Biophys. Mol. Biol. 94, 1-4 (2007).
- Herve, J. C., Bourmeyster, N., Sarrouilhe, D., Duffy, H. S. Gap junctional complexes: from partners to functions. Prog. Biophys. Mol. Biol. 94, 29-65 (2007).
- Bruzzone, R., Barbe, M. T., Jakob, N. J., Monyer, H. Pharmacological properties of homomeric and heteromeric pannexin hemichannels expressed in Xenopus oocytes. J. Neurochem. 92, 1033-1043 (2005).
- Ebihara, L., Steiner, E. Properties of a nonjunctional current expressed from a rat connexin46 cDNA in Xenopus oocytes. J. Gen. Physiol. 102, 59-74 (1993).
- Evans, W. H., De Vuyst, E., Leybaert, L. The gap junction cellular internet: connexin hemichannels enter the signalling limelight. Biochem. J. 397, 1-14 (2006).
- Leybaert, L., Sanderson, M. J. Intercellular Ca2+ waves: mechanisms and function. Physiol. Rev. 92, 1359-1392 (2012).
- Sanderson, M. J., Charles, A. C., Dirksen, E. R. Mechanical stimulation and intercellular communication increases intracellular Ca2+ in epithelial cells. Cell Regul. 1, 585-596 (1990).
- Himpens, B., Stalmans, P., Gomez, P., Malfait, M., Vereecke, J. Intra- and intercellular Ca2+ signaling in retinal pigment epithelial cells during mechanical stimulation. Faseb J. 13, 63-68 (1999).
- Williams, K. K., Watsky, M. A. Bicarbonate promotes dye coupling in the epithelium and endothelium of the rabbit cornea. Curr. Eye Res. 28, 109-120 (2004).
- Hernandez Galindo, E. E., Theiss, C., Steuhl, K. P., Meller, D. Gap junctional communication in microinjected human limbal and peripheral corneal epithelial cells cultured on intact amniotic membrane. Exp Eye Res. 76, 303-314 (2003).
- Williams, K., Watsky, M. Gap junctional communication in the human corneal endothelium and epithelium. Curr. Eye Res. 25, 29-36 (2002).
- Anderson, S. C., Stone, C., Tkach, L., SundarRaj, N. Rho and Rho-kinase (ROCK) signaling in adherens and gap junction assembly in corneal epithelium. Invest. Ophthalmol. Vis. Sci. 43, 978-986 (2002).
- Joyce, N. C., Harris, D. L., Zieske, J. D. Mitotic inhibition of corneal endothelium in neonatal rats. Invest. Ophthalmol. Vis. Sci. 39, 2572-2583 (1998).
- Klepeis, V. E., Weinger, I., Kaczmarek, E., Trinkaus-Randall, V. P2Y receptors play a critical role in epithelial cell communication and migration. J. Cell Biochem. 93, 1115-1133 (2004).
- Klepeis, V. E., Cornell-Bell, A., Trinkaus-Randall, V. Growth factors but not gap junctions play a role in injury-induced Ca2+ waves in epithelial cells. J. Cell Sci. 114, 4185-4195 (2001).
- Laux-Fenton, W. T., Donaldson, P. J., Kistler, J., Green, C. R. Connexin expression patterns in the rat cornea: molecular evidence for communication compartments. Cornea. 22, 457-464 (2003).
- Rae, J. L., Lewno, A. W., Cooper, K., Gates, P. Dye and electrical coupling between cells of the rabbit corneal endothelium. Curr. Eye Res. 8, 859-869 (1989).
- Watsky, M. A., Rae, J. L. Dye coupling in the corneal endothelium: effects of ouabain and extracellular calcium removal. Cell Tissue Res. 269, 57-63 (1992).
- Williams, K. K., Watsky, M. A. Dye spread through gap junctions in the corneal epithelium of the rabbit. Curr. Eye Res. 16, 445-452 (1997).
- D'hondt, C., Ponsaerts, R., Srinivas, S. P., Vereecke, J., Himpens, B. Thrombin inhibits intercellular calcium wave propagation in corneal endothelial cells by modulation of hemichannels and gap junctions. Invest. Ophthalmol. Vis. Sci. 48, 120-133 (2007).
- D'hondt, C., Ponsaerts, R., Srinivas, S. P., Vereecke, J., Himpens, B. Reduced intercellular communication and altered morphology of bovine corneal endothelial cells with prolonged time in cell culture. Curr. Eye Res. 34, 454-465 (2009).
- D'hondt, C., Srinivas, S. P., Vereecke, J., Himpens, B. Adenosine Opposes Thrombin-Induced Inhibition of Intercellular Calcium Wave in Corneal Endothelial Cells. Invest Ophthalmol. Vis. Sci. 48, 1518-1527 (2007).
- Gomes, P., Srinivas, S. P., Van Driessche, W., Vereecke, J., Himpens, B. ATP release through connexin hemichannels in corneal endothelial cells. Invest. Ophthalmol. Vis. Sci. 46, 1208-1218 (2005).
- Gomes, P., Srinivas, S. P., Vereecke, J., Himpens, B. ATP-dependent paracrine intercellular communication in cultured bovine corneal endothelial cells. Invest. Ophthalmol. Vis. Sci. 46, 104-113 (2005).
- Gomes, P., Srinivas, S. P., Vereecke, J., Himpens, B. Gap junctional intercellular communication in bovine corneal endothelial cells. Exp Eye Res. , (2006).
- Ponsaerts, R., et al. The myosin II ATPase inhibitor blebbistatin prevents thrombin-induced inhibition of intercellular calcium wave propagation in corneal endothelial cells. Invest. Ophthalmol. Vis. Sci. 49, 4816-4827 (2008).
- Ponsaerts, R., et al. RhoA GTPase Switch Controls Cx43-Hemichannel Activity through the Contractile System. PLoS ONE. 7, e42074 (2012).
- Ponsaerts, R., et al. Intramolecular loop/tail interactions are essential for connexin 43-hemichannel activity. Faseb J. 24, 4378-4395 (2010).
- Charles, A. Reaching out beyond the synapse: glial intercellular waves coordinate metabolism. Sci STKE. 2005, pe6 (2005).
- Laird, D. W. Life cycle of connexins in health and disease. Biochem. J. 394, 527-543 (2006).
- Kelsell, D. P., Dunlop, J., Hodgins, M. B. Human diseases: clues to cracking the connexin code. Trends Cell Biol. 11, 2-6 (2001).
- Pearson, R. A., Dale, N., Llaudet, E., Mobbs, P. ATP released via gap junction hemichannels from the pigment epithelium regulates neural retinal progenitor proliferation. Neuron. 46, 731-744 (2005).
- Klepeis, V. E., Weinger, I., Kaczmarek, E., Randall, V. T. P2Y receptors play a critical role in epithelial cell communication and migration. J. Cell Biochem. 93, 1115-1133 (2004).
- Cotrina, M. L., Lin, J. H., Lopez-Garcia, J. C., Naus, C. C., Nedergaard, M. ATP-mediated glia signaling. J. Neurosci. 20, 2835-2844 (2000).
- Burnstock, G., Williams, M. P2 purinergic receptors: modulation of cell function and therapeutic potential. J. Pharmacol. Exp. Ther. 295, 862-869 (2000).
- Schwiebert, E. M., Zsembery, A. Extracellular ATP as a signaling molecule for epithelial cells. Biochim. Biophys Acta. 1615, 7-32 (2003).
- Lazarowski, E. R., Boucher, R. C., Harden, T. K. Mechanisms of release of nucleotides and integration of their action as P2X- and P2Y-receptor activating molecules. Mol. Pharmacol. 64, 785-795 (2003).
- Dubyak, G. R., el-Moatassim, C. Signal transduction via P2-purinergic receptors for extracellular ATP and other nucleotides. Am. J. Physiol. 265, C577-C606 (1993).
- Blair, S. A., Kane, S. V., Clayburgh, D. R., Turner, J. R. Epithelial myosin light chain kinase expression and activity are upregulated in inflammatory bowel disease. Lab. Invest. 86, 191-201 (2006).
- Boudreault, F., Grygorczyk, R. Cell swelling-induced ATP release and gadolinium-sensitive channels. Am. J. Physiol. Cell Physiol. 282, C219-C226 (2002).
- Romanov, R. A., Rogachevskaja, O. A., Khokhlov, A. A., Kolesnikov, S. S. Voltage dependence of ATP secretion in mammalian taste cells. J. Gen. Physiol. 132, 731-744 (2008).
- Pelegrin, P., Surprenant, A. Pannexin-1 mediates large pore formation and interleukin-1beta release by the ATP-gated P2X7 receptor. Embo J. 25, 5071-5082 (2006).
- Surprenant, A., Rassendren, F., Kawashima, E., North, R. A., Buell, G. The cytolytic P2Z receptor for extracellular ATP identified as a P2X receptor (P2X7). Science. 272, 735-738 (1996).
- D'hondt, C., et al. Pannexin channels in ATP release and beyond: an unexpected rendezvous at the endoplasmic reticulum. Cell Signal. 23, 305-316 (2011).
- Leybaert, L., et al. Connexin channels, connexin mimetic peptides and ATP release. Cell Commun. Adhes. 10, 251-257 (2003).
- Stout, C. E., Costantin, J. L., Naus, C. C., Charles, A. C. Intercellular calcium signaling in astrocytes via ATP release through connexin hemichannels. J. Biol. Chem. 277, 10482-10488 (2002).
- Verma, V., Hallett, M. B., Leybaert, L., Martin, P. E., Howard Evans, W. Perturbing plasma membrane hemichannels attenuates calcium signalling in cardiac cells and HeLa cells expressing connexins. Eur. J. Cell Biol. , (2008).
- Pharmacol, B. r. J. . 147, S172-S181 (2006).
- Slakey, L. L., Gordon, E. L., Pearson, J. D. A comparison of ectonucleotidase activities on vascular endothelial and smooth muscle cells. Ann. N.Y. Acad. Sci. 603, 366-378 (1990).
- Gordon, E. L., Pearson, J. D., Slakey, L. L. The hydrolysis of extracellular adenine nucleotides by cultured endothelial cells from pig aorta. Feed-forward inhibition of adenosine production at the cell surface. J. Biol. Chem. 261, 15496-15507 (1986).
- Moerenhout, M., Himpens, B., Vereecke, J. Intercellular communication upon mechanical stimulation of CPAE- endothelial cells is mediated by nucleotides. Cell Calcium. 29, 125-136 (2001).
- Ralevic, V., Burnstock, G. Receptors for purines and pyrimidines. Pharmacol. Rev. 50, 413-492 (1998).
- Edelhauser, H. F. The resiliency of the corneal endothelium to refractive and intraocular surgery. Cornea. 19, 263-273 (2000).
- George, A. J., Larkin, D. F. Corneal transplantation: the forgotten graft. Am. J. Transplant. 4, 678-685 (2004).
- Hong, S. J., Wu, K. Y., Wang, H. Z., Fong, J. C. Change of cytosolic Ca2+ mobility in cultured bovine corneal endothelial cells by endothelin-1. J. Ocul. Pharmacol. Ther. 19, 1-9 (2003).
- Crawford, K. M., MacCallum, D. K., Ernst, S. A. Histamine H1 receptor-mediated Ca2+ signaling in cultured bovine corneal endothelial cells. Invest. Ophthalmol. Vis. Sci. 33, 3041-3049 (1992).
- Crawford, K. M., MacCallum, D. K., Ernst, S. A. Agonist-induced Ca2+ mobilization in cultured bovine and human corneal endothelial cells. Curr. Eye Res. 12, 303-311 (1993).
- Srinivas, S. P., Yeh, J. C., Ong, A., Bonanno, J. A. Ca2+ mobilization in bovine corneal endothelial cells by P2 purinergic receptors. Curr. Eye Res. 17, 994-1004 (1998).
- Satpathy, M., Gallagher, P., Jin, Y., Srinivas, S. P. Extracellular ATP opposes thrombin-induced myosin light chain phosphorylation and loss of barrier integrity in corneal endothelial cells. Exp Eye Res. 81, 183-192 (2005).
- Srinivas, S. P., et al. Cell volume response to hyposmotic shock and elevated cAMP in bovine trabecular meshwork cells. Exp. Eye Res. 78, 15-26 (2004).
- D'hondt, C., Ponsaerts, R., De Smedt, H., Bultynck, G., Himpens, B. Pannexins, distant relatives of the connexin family with specific cellular functions. Bioessays. 31, 953-974 (2009).
- Boitano, S., Dirksen, E. R., Sanderson, M. J. Intercellular propagation of calcium waves mediated by inositol trisphosphate. Science. 258, 292-295 (1992).
- De Vuyst, E., et al. Intracellular calcium changes trigger connexin 32 hemichannel opening. EMBO J. 25, 34-44 (2006).
- De Vuyst, E., et al. Ca2+ regulation of connexin 43 hemichannels in C6 glioma and glial cells. Cell Calcium. 46, 176-187 (2009).
- Weissman, T. A., Riquelme, P. A., Ivic, L., Flint, A. C., Kriegstein, A. R. Calcium waves propagate through radial glial cells and modulate proliferation in the developing neocortex. Neuron. 43, 647-661 (2004).
- Iyer, S., Deutsch, K., Yan, X., Lin, B. Batch RNAi selector: a standalone program to predict specific siRNA candidates in batches with enhanced sensitivity. Computer Methods and Programs in Biomedicine. 85, 203-209 (2007).
- Stehberg, J., et al. Release of gliotransmitters through astroglial connexin 43 hemichannels is necessary for fear memory consolidation in the basolateral amygdala. Faseb J. 26, 3649-3657 (2012).
- Evans, W. H., Bultynck, G., Leybaert, L. Erratum to: Manipulating Connexin Communication Channels: Use of Peptidomimetics and the Translational Outputs. J. Membr. Biol. 245, 451 (2012).
- Majumder, P., et al. ATP-mediated cell-cell signaling in the organ of Corti: the role of connexin channels. Purinergic Signal. 6, 167-187 (2010).
- Carvalho, A. C., et al. affects intracellular Ca2+ stores and induces Ca2+ wave propagation. Cell Death Differ. 11, 1265-1276 (2004).
- Torres, A., et al. Extracellular Ca2+ acts as a mediator of communication from neurons to glia. Sci. Signal. 5, ra8 (2012).
- Decrock, E., et al. Transfer of IP(3) through gap junctions is critical, but not sufficient, for the spread of apoptosis. Cell Death Differ. 19 (3), 947-957 (2012).
- Beltramello, M., Piazza, V., Bukauskas, F. F., Pozzan, T., Mammano, F. Impaired permeability to Ins(1,4,5)P3 in a mutant connexin underlies recessive hereditary deafness. Nat. Cell Biol. 7 (1,4,5), 63-69 (2005).
- Bukauskas, F. F., Bukauskiene, A., Verselis, V. K. Conductance and permeability of the residual state of connexin43 gap junction channels. J. Gen. Physiol. 119, 171-186 (2002).
- Bukauskas, F. F., Verselis, V. K. Gap junction channel gating. Biochim. Biophys. Acta. 1662, 42-60 (2004).
- Dahl, G. Where are the gates in gap junction channels?. Clin. Exp. Pharmacol. Physiol. 23, 1047-1052 (1996).
- Retamal, M. A., Schalper, K. A., Shoji, K. F., Bennett, M. V., Saez, J. C. Opening of connexin 43 hemichannels is increased by lowering intracellular redox potential. Proc. Natl. Acad. Sci. U.S.A. 104, 8322-8327 (2007).
- Shibayama, J., et al. Effect of charge substitutions at residue his-142 on voltage gating of connexin43 channels. Biophys. J. 91, 4054-4063 (2006).
- Desplantez, T., Verma, V., Leybaert, L., Evans, W. H., Weingart, R. Gap26, a connexin mimetic peptide, inhibits currents carried by connexin43 hemichannels and gap junction channels. Pharmacological Research: The Official Journal of the Italian Pharmacological Society. 65, 546-552 (2012).
- Delmar, M. Gap junctions as active signaling molecules for synchronous cardiac function. J. Cardiovasc. Electrophysiol. 11, 118-120 (2000).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten