Method Article
Mecánica estimulación inducida por calcio Propagación de Ondas en monocapas de células: el ejemplo de las especies bovina células endoteliales corneales
En este artículo
Resumen
Intercelular Ca 2 + Las ondas son conducidas por canales y hemichannels brecha de la salida. Aquí se describe un método para medir intercelular Ca 2 +-Ondas en monocapas de células en respuesta a un estímulo mecánico de una sola célula local y su aplicación para investigar las propiedades y la regulación de los canales y hemichannels brecha de la salida.
Resumen
La comunicación intercelular es esencial para la coordinación de procesos fisiológicos entre las células en una variedad de órganos y tejidos, incluyendo el cerebro, el hígado, la retina, cóclea y la vasculatura. En la configuración experimental, intercelular Ca 2 +-ondas puede ser obtenido mediante la aplicación de un estímulo mecánico a una sola celda. Esto conduce a la liberación de las moléculas intracelulares de señalización IP 3 y Ca 2 + que iniciar la propagación de la Ca 2 de la onda + concéntricamente desde la célula estimulada mecánicamente a las células vecinas. Las principales vías moleculares que controlan intercelular Ca 2 de propagación de la onda + son proporcionados por los canales de salida brecha a través de la transferencia directa de IP 3 y hemichannels a través de la liberación de ATP. Identificación y caracterización de las propiedades y la regulación de diferentes conexina y isoformas pannexin como canales y hemichannels brecha de la salida son permitidas por el quantification de la propagación de la intercelular Ca 2 de la onda +, ARNsi, y el uso de inhibidores de canales y hemichannels brecha de la salida. Aquí, se describe un método para medir intercelular Ca 2 de la onda + en monocapas de células endoteliales corneales primarias cargado con Fluo4-AM en respuesta a un estímulo mecánico controlado y localizado provocado por una deformación aguda, de corta duración de la célula como resultado de tocar la membrana celular con una micropipeta de vidrio micromanipulador-controlado con un diámetro de la punta de menos de 1 m. También describe el aislamiento de células endoteliales corneales bovinas primarias y su uso como sistema modelo para evaluar la actividad Cx43-hemicanal como la fuerza impulsada por intercelular Ca 2 +-ondas a través de la liberación de ATP. Finalmente, se discute el uso, ventajas, limitaciones y alternativas de este método en el contexto del canal brecha de la salida y la investigación hemicanal.
Introducción
La comunicación intercelular y la señalización son fundamentales para la coordinación de los procesos fisiológicos en respuesta a los agonistas extracelular en el tejido y 1,2 a nivel de todo el órgano. La forma más directa de comunicación intercelular es creada por la aparición de uniones. Gap cruces son las placas de los canales de salida brecha, que son canales proteicos formados por la cabeza a la cabeza de acoplamiento de dos (Cx) hemichannels conexina de células adyacentes 3,4 (Figura 1). Gap cruces permiten el paso de pequeñas moléculas de señalización con un peso molecular de menos de 1,5 kDa, incluyendo Ca 2 + o IP 3 5, causando y la modulación de Ca 2 +-liberación de los almacenes intracelulares de las células vecinas 6 (Figura 2). Canales de salida brecha están fuertemente regulados por intra e intermolecular interacciones de las proteínas y los procesos de señalización celular, como la modificación redox yfosforilación 7. Gjs facilitar la respuesta coordinada de células conectadas, actuando como un sincitio química y eléctrica. Por ejemplo, la propagación del potencial de acción cardíaco a través de los miocitos auriculares y ventriculares está mediada por canales GJ Cx basados en 85. Cxs no sólo tienen un papel como canales de salida brecha, pero también forman hemichannels no apareados, de esta manera funcionarán como canales en las membranas de manera similar a los canales de iones regulares 8-10 (Figura 1). Hemichannels participan en la señalización paracrina entre las células vecinas mediante el control del intercambio de iones y moléculas de señalización entre el medio ambiente intra-y extracelular.
En muchos tipos de células (como las células epiteliales, células osteoblásticas, astrocitos, células endoteliales, etc) y los órganos (como el cerebro, el hígado, la retina, cóclea y el sistema vascular), intercelular Ca 2 + olas son fundamentales para la coordinación de las respuestas multicelulares 11. Los aumentos en intracelulares de Ca + niveles 2 en una determinada célula no se limitan a esta célula, pero se propagan a las células vecinas que rodean, estableciendo de ese modo un Ca intercelular 2 de la onda + 12,13. Estos intercelular Ca 2 +-ondas son importantes para la regulación fisiológica normal de las capas de células como un sincitio y su desregulación se ha asociado con los procesos fisiopatológicos 11. En el endotelio corneal y el epitelio, los diferentes grupos de 14-24, incluyendo la nuestra 25-33, estudiaron los mecanismos y las funciones de la comunicación intercelular. En células no excitables, como las células endoteliales de la córnea, dos modos distintos de la comunicación intercelular se producen 28,29, a saber brecha ocasiones la comunicación intercelular y la comunicación intercelular paracrina. Brecha ocasiones la comunicación intercelular implica un intercambio directo de moléculas de señalización a través de las uniones comunicantes 7. Gap juncla comunicación intercelular nal es crítico para mantener la homeostasis del tejido, el control de la proliferación celular, y el establecimiento de una respuesta sincronizada al estrés extracelular 10,34,35. En una serie de patologías, acoplamiento brecha de la salida se reduce debido a Cxs defectuosos, y por este medio que afecta brecha ocasiones la comunicación intercelular 36. Esto pone de relieve la importancia y la influencia de la brecha ocasiones la comunicación intercelular en los organismos multicelulares. En contraste con brecha ocasiones la comunicación intercelular, la comunicación intercelular paracrina no depende de la aposición de célula a célula, ya que implica la liberación de mensajeros extracelulares difusibles (Figura 2). Los diferentes tipos de moléculas de señalización se liberan en el espacio extracelular por señalización de células. La molécula se transporta a la célula diana donde se detecta por una proteína receptora específica. Posteriormente, el complejo receptor-señal induce una respuesta celular, que sese termina mediante la retirada de la señal, la inactivación o la desensibilización. Lipofílicas mensajeros de señalización extracelular Lanzamiento penetrar la membrana y actúan sobre los receptores intracelulares. En contraste, mensajeros hidrofílicos no atraviesan la membrana plasmática de la célula responder, sino que actúan como un ligando que se une a las proteínas del receptor expresado en la superficie, que luego se retransmiten la señal para el medio ambiente intracelular. Tres grandes familias de proteínas del receptor de la superficie celular que participen en este proceso: los canales iónicos-ligado, unido a enzima y la proteína G-vinculados. La molécula mensajera liberado puede actuar sobre los receptores de la misma célula (autocrina), sobre las células diana en estrecha proximidad (paracrina), o en las células diana distantes que requieren el sistema circulatorio (endocrina).
En muchos tipos de células, incluyendo endotelio corneal 28,29, ATP es uno de los principales factores hidrófilos, paracrinos que impulsan la propagación de intercelular Ca 2 +-ondas 37-40. DurING deformación mecánica, la hipoxia, la inflamación o la estimulación por diversos agentes, el ATP puede ser liberado de las células sanas 41-44 en respuesta a la tensión de corte, estiramiento, o osmótica hinchazón 44,45. Diferentes mecanismos de ATP de liberación se han postulado, incluyendo exocitosis vesicular 44 y una plétora de mecanismos de transporte, tales como transportadores de unión a ATP de cassette (ABC), canales de aniones dependientes de voltaje plasmalemmal 46, P2X7 canales de los receptores de 47,48, así como conexina hemichannels 49-52 y pannexin hemichannels 43,49,53. ATP extracelular puede ser hidroliza rápidamente a ADP, AMP y adenosina 54,55 por ectonucleotidasas que están presentes en el medio ambiente extracelular. El ATP liberado extracelularmente y su metabolito ADP 56 se extenderán a través de la difusión. La posterior interacción de estos nucleótidos con los receptores purinérgicos en las células vecinas se ha implicado en la propagation de intercelular Ca 2 + olas 28,37,51. Dos clases diferentes de receptores purinérgicos están presentes: la adenosina es el principal ligando natural para P1-purinoceptores, mientras tanto purina (ATP, ADP) y la pirimidina (UTP, UDP) nucleótidos actúan en la mayoría de P2-purinoceptores 57.
La comunicación intercelular puede ser investigado por diferentes métodos, tales como la carga de raspadura, la transferencia de tintes, uncaging local de los agonistas como IP 3 y Ca 2 +, la estimulación mecánica, etc. A continuación se describe el estudio de Ca 2 de propagación de la onda + provocada por la estimulación mecánica de una sola célula. La ventaja de estudiar Ca 2 de propagación de la onda + por estimulación mecánica es que proporciona una herramienta fácil de cuantificar la propagación de la Ca 2 de la onda + en el tiempo y que permite comparar cuantitativamente diferentes pretratamientos de las células. En el endotelio corneal, estos intercelular Ca 2 + olas permiten una corespuesta coordinada de la monocapa, por este medio que actúa como un posible mecanismo de defensa del endotelio corneal no regenerativa ayudar al endotelio para soportar tensiones extracelulares durante la cirugía intraocular, o tras la exposición a mediadores de la inflamación durante el rechazo inmunológico o uveítis 58,59.
Protocolo
1. Aislamiento de células endoteliales de la córnea
Antes de empezar: Aislar las células de los ojos frescos, obtenidos de un matadero local, tan pronto como sea posible después de la enucleación del ojo. Asegúrese de que el ojo fue enucleado de una vaca de máximos de 18 meses, cinco minutos después de la autopsia y conservados en solución salina equilibrada de Earle - solución de yodo al 1% a 4 ° C para su transporte al laboratorio.
- Tome el ojo de solución salina equilibrada de la Earle - solución de yodo al 1% y lo coloca en una placa de Petri (100 x 20 mm).
- Esterilizar el ojo con una solución que contiene etanol al 70% y enjuague con solución salina equilibrada de Earle que contiene 1% de yodo.
- Partir de este paso, trabajar en una campana estéril. Diseccionar cuidadosamente la córnea del ojo y colocarlo en una placa de Petri (35 x 10 mm) que contiene solución salina equilibrada de Earle, con la capa de células epiteliales hacia arriba. Retire con cuidado el sti tejido del iris restantell unido a la córnea, si es necesario.
- Transferencia de la córnea a la Solución salina equilibrada de otra Earle que contiene una placa de Petri con la capa de células endoteliales hacia arriba y enjuague dos veces con solución salina equilibrada de Earle.
- Transferir la córnea con la capa endotelial hacia arriba a un reloj de arena, que es un plato en forma de copa, y se cubre con medio de crecimiento. El medio de cultivo consiste en Medio de Eagle Modificado de Dulbecco que contiene 25 mM de glucosa, 10% de suero fetal bovino, 6,6% de L-glutamina, 2,5 mg / ml de anfotericina-B y 1% de mezcla de antibiótico-antimicótico que contiene 10.000 unidades / ml de penicilina, 10 000 g / ml de estreptomicina, y 25 mg / ml de anfotericina B.
- Retirar el medio con una pipeta de aspiración.
- Aplicar 300 l de una solución de tripsina (0,5 g / L) a la capa endotelial de la córnea (todos los pasos que incluyen tripsina se realizan utilizando la misma concentración).
- Coloque el reloj de arena que contiene la córnea en un plato de Petri cubierto y lo puso en el incubator durante 30 minutos a 37 ° C y 5% de CO 2.
- Raspar suavemente las células endoteliales de distancia de la córnea con un pulido al fuego en forma de gancho pipeta Pasteur de vidrio en una campana estéril.
- Aspirar la solución que contiene las células endoteliales y añadirlo a frascos de cultivo (25 cm 2), que contiene 4 ml de medio de cultivo.
- Aplicar 300 l de medio de crecimiento a la córnea y repetir el raspado y añadir la solución que contiene las células endoteliales para el frasco de cultivo.
- Repita este paso final (1,11) una vez más.
- Coloque el matraces de cultivo que contiene las células endoteliales de la córnea en el medio de crecimiento en la incubadora a 37 ° C y 5% de CO 2.
- Después de dos días, añadir 6 ml de medio de cultivo.
- Actualizar el medio de cultivo cada dos días.
2. Cultivo Celular
- Retirar el medio de cultivo y se lavan las células dos veces con solución salina equilibrada de Earle, cuando confluencia se alcanza (dentro de About 10 días después del aislamiento).
- Añadir 1,5 solución de tripsina ml a las células para separarlas y colocar el matraz en la incubadora (37 ° C, 5% de CO 2) durante 3 a 4 minutos.
- Añadir 12 ml de medio de crecimiento. Pipetear los medios tres veces dentro y fuera de dispersar las células y contar las células.
- Semillas de las células con una fracción variable dependiendo de la densidad de las células y los puso en la incubadora. Preparar dos diapositivas bien recámara (con un área de 4,2 cm 2) con un recuento de células de células 165 000 (densidad celular 39.286 por cm 2). Preparar 80 cm 2 frascos de cultivo de un nuevo paso a una densidad de 6.250 por cm 2, y añadir medio de cultivo nuevo hasta un volumen total de 25 ml.
- Actualizar el medio cada dos días.
- Confluencia de la capa de células que se alcanza después de 3 a 4 días. Usa las células para los experimentos.
- Cuando confluencia de la capa de células en los matraces se alcanza, repita los pasos 2.1 a 2.6. Los cultivos de células hasta el paso 2 se puede utilizar fo experimentos.
3. La estimulación mecánica para inducir calcio Wave
- Cargue las células en el portaobjetos de cámara con 10 M Fluo-04 a.m. en buffer fosfato salino durante 30 minutos a 37 ° C mientras se agita suavemente.
- Retire el Fluo-04 a.m. solución, lavar las células cinco veces con buffer fosfato salino, incubar las células con tampón fosfato salino y dejar las células durante al menos 5 minutos a temperatura ambiente antes de la medición.
- Excite a 488 nm con láser de argón y el uso divisor de haz HFT 488, recoge la emisión de fluorescencia a 530 nm utilizando un paso largo filtro de emisión LP 505, establece el agujero en el mínimo. Utilice un objetivo de 40X aceite de inmersión (Air, 1,2 NA). En experimentos con ARL-67156, utilice un objetivo de 10X (Aire, 0,3 NA).
- Búsqueda de un campo en el que las células son confluentes en el microscopio confocal.
- Posición de la pipeta de manera que está en 45 ° con respecto a la corredera de cámara y tocar la membrana celular.Provocar una breve estimulación mecánica (≈ 1 seg) a una sola celda. La estimulación mecánica consiste en una deformación aguda, de corta duración de la célula tocando brevemente menos de 1% de la membrana celular con una micropipeta de vidrio (diámetro de la punta <1 m) acoplado a un nanopositioner cristal piezoeléctrico, operado a través de un amplificador que es montado en un micromanipulador. Las micropipetas de vidrio están hechos de un extractor de microelectrodo. Asegúrese de que la nanopositioner es operado por una tensión de entre 0,2 y 1,5 V durante la estimulación mecánica. Una tensión superior a 1,5 V puede causar daño celular. Para cada tipo de célula y condiciones, la tensión óptima para la estimulación mecánica y sin daño de la célula debe ser determinada cuidadosamente mediante la aplicación de una serie de tensiones a partir de bajo (0,2 V) a alto voltaje (1,5 V). La tensión es una medida de la fuerza de la estimulación ya que esta tensión determina la tensión mecánica y la tensión que se aplica a la membrana celular. Lala fuerza de la estimulación mecánica se puede calcular multiplicando la tensión mecánica con la zona. Dado que tanto la zona (<3,14 m 2) y el estrés mecánico son muy bajos, la fuerza de la estimulación mecánica es baja. (Tenga en cuenta que cuando una célula se daña, las fugas de fluorescencia fuera de la célula y la célula se vuelve oscuro.)
- Medir los cambios espaciales de la [Ca2 +] i tras la estimulación mecánica con el microscopio confocal.
- Recoger y almacenar imágenes.
- Dibuje una región poligonal de interés para definir el área de la superficie total de las células de respuesta (área activa, AA) usando el software del microscopio confocal.
Resultados
Todos los experimentos se realizan en cumplimiento de todas las directrices, reglamentos y las agencias reguladoras y el protocolo que se está demostrado se lleva a cabo bajo la dirección y aprobación del cuidado de los animales y el empleo de la Universidad Católica de Lovaina.
En las células endoteliales corneales bovinas (BCEC), uniones funcionales se expresan y ambos brecha ocasiones la comunicación intercelular y la comunicación intercelular paracrina contribuyen de manera significativa a la comunicación intercelular de una manera interactiva, pero la vía principal se ha demostrado que la vía de la comunicación intercelular paracrina mediada por ATP liberación a través hemichannels Cx43 basados 28,29. ATP y ADP son hidrolizados a la adenosina monofosfato (AMP) por el ectonucleotidase E-NTPD1 (ectonucleoside trifosfato diphosphohydrolase 1, CD39 ATP diphosphohydrolase), y, posteriormente, a la adenosina por la 5'-ectonucleotidase CD73 28,29. ATP y ADP contribuyen ael Ca 2 de propagación de la onda + uniéndose a P2Y1 y P2Y2 receptores 28,29. Ambos receptores par de PLC a través de Gq y así evocar IP3 inducida por Ca 2 + de liberación (Figura 2). En BCEC, la estimulación de los P2Y purinérgicos receptores resulta en un rápido aumento de la [Ca2 +] i, que es insensible a la eliminación de [Ca2 +] o 60. [Ca2 +] i picos provocados por la estimulación agonista vienen seguidas de un [Ca2 +] i disminución que puede conducir a una elevación estable, dependiente de agonista, [Ca2 +] fluctuaciones oscilatorias o-dependientes, o un retorno a los valores basales 60-62. En BCEC, no ha habido evidencia de que Ca 2 +-liberación se produce a través de una vía que implica PLC y PI 3 29. Vaciado de las tiendas 3 sensibles IP lleva a un pico inicial de [Ca 2 +] i, seguido posteriormente por un capacitative Ca 2 +-afluencia que conduce a la aparición de la fase de meseta 63.
La estimulación mecánica conduce a un aumento inicial rápido en Ca 2 + que se origina desde el punto de la estimulación y luego se extiende por toda la célula estimulada mecánicamente. Por último, el Ca 2 + intracelular de los niveles poco a poco disminuye hasta el nivel de base. Al llegar a los límites de las celdas, los intercelular Ca 2 propaga la onda + a las células circundantes vecinos (NB) en forma ondulada como Ca 2 +-transitorios, que se desintegra a nivel basal (Figura 3). En condiciones de control, Ca 2 se observaron +-transitorios hasta aproximadamente de 4 a 8 capas de células fuera de la célula estimulada mecánicamente (Figura 3). El gráfico de línea (en el lado derecho de los paneles en la Figura 3) muestra el curso temporal de la Ca 2 +-transitorios (representados como valores de fluorescencia normalizados (NF)) enla célula estimulada mecánicamente y en las capas de células vecinas cuatro y cincuenta y nueve (NB1, NB2, NB3, NB4 y NB5). A partir de la figura 3, está claro que las disminuciones de fluorescencia normalizada, mientras que el retardo de tiempo para el inicio de la [Ca2 +] i altura se incrementa con la distancia creciente desde la célula estimulada mecánicamente. Se llegó a la fluorescencia normalizada máxima en la célula estimulada mecánicamente en 0,95 ± 0,04 seg. Después de alcanzar un valor de fluorescencia normalizada máxima, la fluorescencia normalizada mostró una disminución muy gradual y lento, volviendo al valor basal de 152 ± 6 segundos después de la aplicación del estímulo 25.
La inhibición de la vía de la comunicación intercelular paracrina mediante el uso de una combinación de exógena apirasa VI (5 U / ml durante 30 min) y apirasa VII (5 U / ml durante 30 min) causó una disminución de 7,5 veces en el área cubierta por el Ca 2 de la onda +, la llamada área activa (AA, P <0,001, N = 7, N = 35) (Figura 4A). Apirasa se conoce para hidrolizar ATP y ADP. Apirasa VI tiene una alta relación de ATPasa / ADPasa y apirasa VII preferentemente hidroliza ADP 56.
Puesto que la comunicación intercelular paracrina en el endotelio de la córnea se produce en gran medida a través de la liberación de ATP, 28,29 y el ATP se hidroliza en el espacio extracelular por ectonucleotidasas, que se sabe que se expresa en el endotelio de la córnea, 29,64,65 se investigó el efecto sobre AA en condiciones donde la hidrólisis de ATP se inhibe el uso de inhibidores de la ectonucleotidase. La inhibición de ectonucleotidasas con ARL-67156 (ARL; 100 mM durante 30 min) dio lugar a una fuerte mejora de la Ca 2 de propagación de la onda +, como se ha demostrado previamente en BCEC 25,26,28,29. La exposición de BCEC a ARL causó un aumento de 3,5 veces de la AA en comparación con las condiciones de control (P <0,001, N = 12, n = 60) (Figura 4B).
En el preriores estudios en nuestro laboratorio, conexina péptidos miméticos (gap26 y gap27, Tabla 2) se utilizan para distinguir las contribuciones relativas de la brecha ocasiones la comunicación intercelular y la comunicación intercelular paracrina para intercelular Ca 2 + de propagación de la onda después de la estimulación mecánica, con un péptido inactivo ( Tabla 2) como un control 28,29.
La inhibición de los canales de salida brecha con gap27 disminuyó significativamente la propagación de la Ca 2 +-wave en BCEC 30. El AA se redujo significativamente en el tratamiento previo con gap27 (300 mM durante 30 min) (p <0,001, N = 8, n = 40) 25 (Tabla 1). La inhibición de la hemichannels conexina con el péptido-mimético conexina gap26 28,30 redujo significativamente la propagación de la Ca 2 +-wave en BCEC 28. El AA se redujo significativamente en el tratamiento previo con gap26 (300 mM durante 30 min)(P <0,001, N = 8, n = 40) 25 (Tabla 1).
También puso de manifiesto que el 43-kDa isoforma Cx fue un componente principal que subyace a la liberación hemicanal mediada por ATP que provoca intercelular Ca 2 + olas. El uso de dos moléculas de siRNA dirigidos Cx43 diseñados de forma independiente, se encontró que el AA se redujo en alrededor del 65% 33 (Tabla 1). Esto se ha corroborado mediante experimentos con TAT-L2 (100 mM, 30 min), un péptido permeable a las células que corresponde a la segunda mitad del bucle intracelular de Cx43 (Tabla 2), lo que provocó una reducción importante en AA (P <0,001 , N = 3, n = 30) (Tabla 1). Es importante destacar que esta reducción en AA por incubación TAT-L2 no se observó en ausencia de señalización paracrina, apoyando el concepto de que TAT-L2 inhibe selectivamente hemichannels Cx43 basados en, pero no canales de brecha de la salida 33. Por otra parte, una forma inactiva TAT-L2 mutante (TAT-L2 H126K/I130N) se puede utilizar como un control (Tabla 2).

Figura 1. La formación de canales y hemichannels brecha de la salida: representación esquemática. A. Un conexina o pannexin hemicanal se forma cuando seis conexinas o pannexins, que son proteínas que contienen cuatro dominios transmembrana, están dispuestos radialmente alrededor de un poro central. Hemichannels se encuentran en la membrana plasmática. Pueden consistir en subtipos de proteínas idénticas (hemichannels homoméricos) o pueden consistir en diferentes subtipos de proteínas, cuando dos o más isoformas se expresan en la misma célula (hemichannels heteroméricos). Un canal brecha de la salida homotípica resulta del acoplamiento de dos homomeric idéntico o hemichannels heteroméricos. A heterotípicas brecha de la salida del canal resulta de la docking de dos canales homoméricos o heteromeric diferentes. B. Estructura esquemática de conexina y pannexin brecha cruce de canales que conectan dos células y hemichannels adyacentes.
(Parcialmente modificada a partir de 66)
Esta cifra fue publicado originalmente en BioEssays. Catheleyne D'Hondt, Ponsaerts Raf, Humberto De Smedt, Geert Bultynck y Bernard Himpens. Pannexins, parientes lejanos de la familia connexin con funciones celulares específicas. Bioensayos. 2009, 31, 953-974 (2009). Bioensayos. Haga clic aquí para ver más grande la figura .
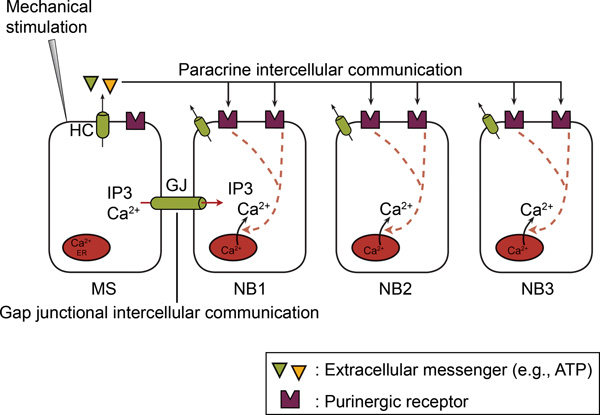
Figura 2. En células no excitables, en latercellular Ca 2 + de propagación de la onda implica tanto la brecha ocasiones la comunicación intercelular y la comunicación intercelular paracrina. Tras la estimulación mecánica de una única célula, un Ca 2 +-aumento se produce en la célula estimulada mecánicamente (MS) a través de Ca 2 +-afluencia y / o Ca 2 + de liberación. Posteriormente, los Ca 2 + se propaga altura del estimulados mecánicamente a las células vecinas (NB) como Ca 2 + intracelular de onda. La propagación intercelular implica dos mecanismos, a saber, falta de comunicación intercelular y la comunicación intercelular paracrina. En brecha ocasiones la comunicación intercelular, un intercambio directo de un mediador (IP 3 y / o Ca 2 +) se produce entre los citoplasmas de las células adyacentes a través de uniones (gjs). En la comunicación intercelular paracrina, un mensajero (por ejemplo, ATP) se libera en el espacio extracelular, de forma que actúe sobre los receptores situados en thsuperficie e de las células vecinas. Hemicanales (HC) u otros mecanismos median en este comunicado de ATP (ver texto). Ectonucleotidasas hidrolizan ATP a ADP y AMP. ATP y ADP P2Y actúan sobre y / o receptores P2X en células vecinas. (Tomado de 66.)
Esta cifra fue publicado originalmente en BioEssays. Catheleyne D'Hondt, Ponsaerts Raf, Humberto De Smedt, Geert Bultynck y Bernard Himpens. Pannexins, parientes lejanos de la familia connexin con funciones celulares específicas. Bioensayos. 2009. 31, 953-974 (2009). Bioensayos.
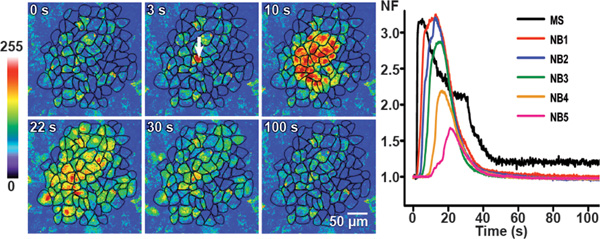
Figura 3. Propagación de las ondas de calcio en condiciones de control en BCEC. Estimulación mecánica transitorios de calcio inducidos se muestran en puntos de tiempo diferentes en condiciones de control en BCEC por imágenes de fluorescencia pseudo-colores representativos. El Fluoreintensidades scence antes de la estimulación se muestran en la primera imagen. La flecha blanca en la segunda imagen identifica la célula estimulada mecánicamente. La onda de calcio se propaga a seis capas de células vecinas, con una superficie total de células alcanzados por la onda (área activa: AA) de 62.870 m 2.
El panel de la derecha con los gráficos de líneas que muestra el curso temporal del valor de fluorescencia normalizada (NF) en la célula estimulada mecánicamente (MS) y el valor promedio de NF en las células vecinas (NB) capas 1 a 5 (NB1 a NB5). (Parcialmente modificada a partir de 25.)
Esta cifra fue publicado originalmente en Investigative Ophthalmology and Visual Science. Catheleyne D'Hondt, Raf Ponsaerts, Sangly P Srinivas, Johan Vereecke y Bernard Himpens. Inhibe la trombina intercelular propagación de las ondas de calcio en las células endoteliales de la córnea mediante la modulación de hemichannels y uniones comunicantes. Invest. Ophtalmol. Vis. . Sci. 2007. 48 (1), 120-33 (2007). Investigative Ophthalmology and Visual Science.

La Figura 4. Los cambios significativos en la difusión de intercelular Ca 2 + olas después del tratamiento con nucleotidasas exógenos (izquierda) y con los inhibidores ectonucleotidase (derecha) en BCEC. A. disminución significativa en AA después del tratamiento de BCEC con apyrases exógenos (apirasa VI (5 U / ml) y apirasa VII (5 U / ml) durante 30 min) que hidrolizan ATP y ADP, de este modo detiene la vía de la comunicación intercelular paracrina (N = 7, n = 35). * Significa p <0,001 en presencia frente a ausencia de apirasa B. Aumento significativo de AA después del tratamiento de BCEC con un inhibidor selectivo ectonucleotidase ARL-67156 (ARL; 100 mM durante 30 min)., Herbáceo enhancing de la vía de la comunicación intercelular paracrina (N = 12, n = 60). * Significa p <0,001 en presencia frente a ausencia de ARL.
| Normalizado AA | St. error | N | n | Estadística | |
| controlar | 100 | 8.31 | 3 | 30 | |
| siScramble | 87.97 | 9.3 | 3 | 30 | |
| siCx43-1 | 32.45 | 8.23 | 3 | 30 | * |
| siCx43-2 | 35.49 | 7.06 | 3 | 30 | * |
| Péptido de control | 91.68 | 6.5 | 8 | 40 | |
| Gap 26 | 46.67 | 4.24 | 8 | 40 | * |
| Gap 27 | 53 | 4.76 | 8 | 40 | * |
| TAT-L2 | 6.99 | 0.71 | 3 | 30 | * |
Tabla 1. Efecto de las moléculas de siRNA dirigidos Cx43, conexina péptidos miméticos y la célula permeable al péptido TAT-L2 en el área activa normalizado (AA) en BCEC.
N representa el número de días de experimentos, n representa el número de estimulaciones mecánicas. * Significa p <0,001 en comparación con las condiciones de control.
| Secuencia de AA | |
| Péptido de control | SRGGEKNVFIV |
| Gap26 | VCYDKSFPISHVR |
| Gap27 | SRPTEKTIFII |
| TAT-L2 | YGRKKRRQRRR-DGANVDMHLKQIEIKKFKYGIEEHGK |
| TAT-L2H126K/I130N | YGRKKRRQRRR-DGANVDMKLKQNEIKKFKYGIEEHGK |
| 10Panx1 | WRQAAFVDSY |
Tabla 2. Las secuencias de aminoácidos de los péptidos usados.
Discusión
En este manuscrito, se describe un método simple para medir intercelular Ca 2 + de propagación de la onda en monocapas de células endoteliales corneales bovinas primarias, proporcionando una estimulación mecánica localizada y controlada utilizando una micropipeta. Mecánicamente células estimuladas responden con un aumento local de IP intracelular 3 y Ca 2 +, ambos de los cuales son moléculas de señalización intracelulares esenciales que impulsan intercelular Ca 2 + en la propagación de la onda 11,67. IP 3 se transfiere directamente a las células vecinas a través de canales de brecha de la salida 5, mientras que Ca 2 + provoca la apertura de hemichannels y la liberación de ATP 68,69, lo que desencadena Ca 2 + señales en las células vecinas a través de la activación de la proteína G acoplada P2 receptores 37-40. La contribución relativa de los canales y hemichannels en este proceso brecha de la salida se puede caracterizar por el uso de Cx-miméticopéptidos, enzimas que degradan ATP (ectonucleotidasas) e inhibidores de la ectonucleotisdases. Las propiedades de Ca 2 + de propagación de la onda intercelular estimulación mecánica inducida en las células endoteliales corneales bovinas han caracterizado a fondo en nuestro laboratorio de 25-33. Nuestros resultados indican que el Ca 2 + de propagación de la onda intercelular se debe principalmente a un comunicado de Cx-hemicanal mediada por ATP, con Cx43 juega un papel destacado. Como tal, este método aplicado a las células endoteliales corneales bovinas primarias es particularmente adecuado para identificar o caracterizar la regulación de la Cx43 hemichannels a los niveles endógenos en células nativas. Usando este método, hemos encontrado que la actividad de Cx43 hemichannels es controlado críticamente por el citoesqueleto de actomiosina, que puede servir como un freno de la prevención endógena excesiva, y por lo tanto perjudicial, Cx43 apertura hemicanal 25,31,32. Nos dilucidar los mecanismos moleculares que subyacen a este reglamento y encontramosun papel importante de loop / cola interacciones intramoleculares que son esenciales para la apertura de Cx43 hemichannels 33.
Claramente, este sistema es muy adecuado para estudiar la función de Cx y Panx basado en canales y hemichannels brecha de la salida y es, sin duda no se limita a las células endoteliales corneales bovinas, pero se puede adaptar a prácticamente cualquier tipo de célula y también tejidos más complejos, como se ha demostrado en el cerebro donde la estimulación mecánica provocó gran intercelular Ca 2 + olas que abarca todo el hemisferio 70. Diferentes herramientas están presentes para evaluar la contribución de los canales y hemichannels brecha de la salida, incluyendo péptidos Cx-miméticos, enzimas ATP-degradantes, inhibidores de ectonucleotidasas y compuestos farmacológicos como carbenoxolona y 10 Panx1 (Tabla 2) 49,50. Para determinar la contribución de un cierto Cx o Panx isoforma en este proceso, las sondas de siRNA cuidadosamente diseñados targeting dos regiones independientes del ARNm y un control mezclado se debe utilizar. El grado de caída debe ser determinado en el nivel de proteína total mediante Western-Blot ensayos y el nivel de células individuales mediante microscopía fluorescente. La eficacia de la transfección de las sondas de siRNA en las monocapas de células experimentales debe ser evaluada por microscopía de fluorescencia. Para esto, uno puede desarrollar un ARNsi dúplex en el que un marcador fluorescente se ha incorporado en el extremo 3 'de la hebra codificante. Es importante tener en cuenta que para el análisis adecuado, una reducción destacada de la Cx o Panx isoforma (reducción> 90%), así como una transfección homogénea de los dúplex de siRNA en la monocapa de células (> 90% de las células transfectadas con siRNA sonda) se debe obtener. La selectividad de las sondas siRNA diseñado para alcanzar la meta debe ser evaluado 71. En resumen, estas herramientas deben ser validados por lo que no afectan a la expresión de otro Cx o isoformas Panx u otro com teclacomponentes de conducción intercelular Ca 2 +-ondas, al igual que los receptores P2X y P2Y. Para evaluar la contribución de Cx43 hemichannels, hemos colaborado con el laboratorio del Dr. Leybaert en el desarrollo de un péptido permeable a las células que corresponde a la segunda mitad del bucle intracelular de Cx43 (TAT-L2) que actúa como un inhibidor selectivo y potente de la Cx43 hemichannels manteniendo Cx43 brecha de cruce actividad del canal 33. En nuestros estudios, utilizamos 100 mM TAT-L2 para obtener una inhibición completa de la Cx43 hemichannels, pero las concentraciones más bajas pueden ser suficientes 72. TAT-L2H126K/I130N se recomienda como un control negativo 73. Para evaluar la contribución de Panx1 canales, el péptido 10Panx1 se puede aplicar. Estas herramientas son importantes no sólo para la exclusión de disrupción de la membrana plasmática (véase más adelante), pero también para demostrar que los paracrinos ATP media la señalización de los mecanismos de intercelular Ca 2 + de propagación de la onda por hemichannels y no por otros mecanismos (como maxi-canales de aniones o la liberación de vesículas que contienen ATP). Finalmente, como para todos los estudios que utilizan las células primarias, las condiciones de cultivo celular y el número de pasajes deben ser estandarizados, como las propiedades biológicas de las células y por lo tanto el perfil de expresión de las diferentes isoformas Panx Cx y pueden cambiar con el tiempo 26.
Sin embargo, hay una serie de inconvenientes a este método. Una desventaja importante de este método es que la estimulación mecánica puede provocar la interrupción de membrana de plasma, que conduce a la entrada de Ca2 + extracelular y la liberación de moléculas de señalización como el ATP, ambos de los cuales subyacen buena fe intercelular Ca 2 + en la propagación de la onda 11. Esto definitivamente complica el análisis (cuantitativo) del intercelular Ca 2 +-onda. Por lo tanto, es muy recomendable que uno debe i) utilizar los controles adecuados, es decir, las líneas celulares que carecen de la expresión de Cx o isoformas Panx y herramientas que interfere con la función de Cx y Panx como canales de brecha de la salida y / o hemichannels y ii) estandarizar el procedimiento de estimulación mecánica (asegurarse de que durante el estímulo mecánico de la nanopositioner es operado por una tensión de entre 0,5 y 2 V).
Además, es importante tener en cuenta que este método no se sostiene por sí mismo, sino que debe basarse en enfoques experimentales adicionales para estudiar Cx y Panx canales. Esto se puede lograr mediante el uso de un aumento local de moléculas de señalización intracelulares que participan en la estimulación mecánica-intercelular mediada por Ca 2 + de propagación de la onda, como el uncaging de la PI 3 o intracelular de Ca 2 + 11,74. Para iniciar intercelular Ca 2 +-onda independiente de la estimulación mecánica, se puede usar la microinyección, tales como recombinante pro-apoptótica Bax 11,75 y fotoactivable Ca 2 +-buffers como diazo-2 que provoca una caída local en extracelular [Ca 2 + ] 76, un disparador conocido por apertura hemicanal. Alternativamente, se puede utilizar la electroporación in situ de moléculas de señalización impermeables a las células que desencadenan intracelular de Ca 2 +-liberación y intercelular Ca 2 +-ondas, tales como IP 3 67,68. La última técnica también se utiliza para investigar la propagación de la muerte celular 5,77. Estos estímulos no mecánicos proporcionan una mejor evaluación de la intensidad del estímulo-respuesta. Además de estos métodos de Ca 2 + propagación de la onda, es importante para determinar la actividad de los canales de Cx o Panx utilizando otros enfoques, incluyendo la determinación de la absorción de colorante hidrófilo (como el amarillo Lucifer) 78 y la liberación de ATP no sólo en respuesta a la estimulación mecánica, pero también en respuesta a Ca2 +-buffers (como EGTA) y Ca 2 + de liberación moléculas intracelulares (como el Ca 2 +-ionóforo A23187) 11,74. Además, tque mejor prueba de la regulación en el nivel de los canales es proporcionada por experimentos electrofisiológicos, ya sea sistemas de fijación de voltaje dual o ruta de fijación de células enteras de oocitos de Xenopus inyectados con Cx o Panx ARNm o de células HeLa expresando ectópica isoformas Cx junto con un marcador como GFP 79-84.
Para concluir, la utilización de la estimulación mecánica para inducir intercelular Ca 2 +-ondas proporciona un método sencillo y fiable para investigar la comunicación intracelular y examinar la contribución y las propiedades de Cx y Panx canales.
Divulgaciones
Los autores tienen nada que revelar.
Agradecimientos
El trabajo de investigación realizado en el laboratorio fue apoyado por becas de la Fundación de Investigación - Flandes (FWO, números de concesión G.0545.08 y G.0298.11), el Programa Interuniversitario Polos de atracción (Política Científica de Bélgica, el número de concesión P6/28 y P7/13) y está incrustado en una comunidad de investigación FWO apoyado. CDH es un becario posdoctoral de la Fundación de Investigación - Flandes (FWO). Los autores están muy agradecidos a todos los miembros actuales y anteriores del Laboratorio de Señalización Celular y Molecular (Universidad Católica de Lovaina), Dr. SP Srinivas (Escuela de Optometría de la Universidad de Indiana, EE.UU.), el laboratorio del Dr. Leybaert (Universidad de Gante) y de procedimientos Dr. Vinken (VUB), que proporcionó útil para los debates, optimizado o estuvieron involucrados en el desarrollo de herramientas para el estudio de hemichannels conexina.
Materiales
| Name | Company | Catalog Number | Comments |
| Earle's Balanced Salt Solution (EBSS) | Invitrogen-Gibco-Molecular Probes (Karlsruhe, Germany) | 14155-048 | |
| Iodine | Sigma-Aldrich (Deisenhofen, Germany) | 38060-1EA | |
| Dulbecco's Modified Eagle's Medium (DMEM) | Invitrogen-Gibco-Molecular Probes (Karlsruhe, Germany) | 11960-044 | |
| L-glutamine (Glutamax) | Invitrogen-Gibco-Molecular Probes (Karlsruhe, Germany) | 35050-038 | |
| Amphotericin-B | Sigma-Aldrich (Deisenhofen, Germany) | A2942 | |
| Antibiotic-antimycotic mixture | Invitrogen-Gibco-Molecular Probes (Karlsruhe, Germany) | 15240-096 | |
| Trypsin | Invitrogen-Gibco-Molecular Probes (Karlsruhe, Germany) | 25300-054 | |
| Dulbecco's PBS | Invitrogen-Gibco-Molecular Probes (Karlsruhe, Germany) | 14190-091 | |
| Fluo-4 AM | Invitrogen-Gibco-Molecular Probes (Karlsruhe, Germany) | F14217 | |
| ARL-67156 (6-N,N-Diethyl-b,g-dibromomethylene-D-ATP) | Sigma-Aldrich (Deisenhofen, Germany) | A265 | |
| Apyrase VI | Sigma-Aldrich (Deisenhofen, Germany) | A6410 | |
| Apyrase VII | Sigma-Aldrich (Deisenhofen, Germany) | A6535 | |
| Gap26 (VCYDKSFPISHVR) | Custom peptide synthesis | ||
| Gap27 (SRPTEKTIFII) | Custom peptide synthesis | ||
| Control Peptide (SRGGEKNVFIV) | Custom peptide synthesis | ||
| siRNA1 Cx43 (sense: 5'GAAGGAGGAGGAACU-CAAAdTdT) | Annealed siRNA was purchased at Eurogentec (Luik, Belgium) | ||
| siRNA2 Cx43 (sense: 5'CAAUUCUUCCUGCCGCAAUdTdT) | Annealed siRNA was purchased at Eurogentec (Luik, Belgium) | ||
| siRNA scramble: scrambled sequence of siCx43-1 (sense: 5'GGUAAACG-GAACGAGAAGAdTdT) | Annealed siRNA was purchased at Eurogentec (Luik, Belgium) | ||
| TAT-L2 (TAT- DGANVDMHLKQIEIKKFKYGIEEHGK) | Thermo Electron (Ulm, Germany) | ||
| TAT-L2-H126K/I130N (TAT-DGANVDMKLKQNEIKKFKYGIEEHGK) | Thermo Electron (Ulm, Germany) | ||
| Two chambered glass slides | Laboratory-Tek Nunc (Roskilde, Denmark) | 155380 | |
| Confocal microscope | Carl Zeiss Meditec (Jena, Germany) | LSM510 | |
| Piez–lectric crystal nanopositioner (Piezo Flexure NanoPositioner) | PI Polytech (Karlsruhe, Germany) | P-280 | |
| HVPZT-amplifier | PI Polytech (Karlsruhe, Germany) | E463 HVPZT-amplifier | |
| Glass tubes (glass replacement 3.5 nanoliter) | World Precision Instruments, Inc. Sarasota, Florida, USA | 4878 | |
| Micr–lectrode puller | Zeitz Instrumente (Munchen, Germany) | WZ DMZ-Universal Puller |
Referencias
- Vinken, M., et al. Connexins and their channels in cell growth and cell death. Cell Signal. 18, 592-600 (2006).
- Mese, G., Richard, G., White, T. W. Gap junctions: basic structure and function. J. Invest. Dermatol. 127, 2516-2524 (2007).
- Bruzzone, R., White, T. W., Paul, D. L. Connections with connexins: the molecular basis of direct intercellular signaling. Eur. J. Biochem. 238, 1-27 (1996).
- White, T. W., Bruzzone, R., Paul, D. L. The connexin family of intercellular channel forming proteins. Kidney Int. 48, 1148-1157 (1995).
- Decrock, E., et al. Connexin-related signaling in cell death: to live or let die? Cell Death Differ. 16, 524-536 (2009).
- Herve, J. C. Gap junctional complexes: from partners to functions. Prog. Biophys. Mol. Biol. 94, 1-4 (2007).
- Herve, J. C., Bourmeyster, N., Sarrouilhe, D., Duffy, H. S. Gap junctional complexes: from partners to functions. Prog. Biophys. Mol. Biol. 94, 29-65 (2007).
- Bruzzone, R., Barbe, M. T., Jakob, N. J., Monyer, H. Pharmacological properties of homomeric and heteromeric pannexin hemichannels expressed in Xenopus oocytes. J. Neurochem. 92, 1033-1043 (2005).
- Ebihara, L., Steiner, E. Properties of a nonjunctional current expressed from a rat connexin46 cDNA in Xenopus oocytes. J. Gen. Physiol. 102, 59-74 (1993).
- Evans, W. H., De Vuyst, E., Leybaert, L. The gap junction cellular internet: connexin hemichannels enter the signalling limelight. Biochem. J. 397, 1-14 (2006).
- Leybaert, L., Sanderson, M. J. Intercellular Ca2+ waves: mechanisms and function. Physiol. Rev. 92, 1359-1392 (2012).
- Sanderson, M. J., Charles, A. C., Dirksen, E. R. Mechanical stimulation and intercellular communication increases intracellular Ca2+ in epithelial cells. Cell Regul. 1, 585-596 (1990).
- Himpens, B., Stalmans, P., Gomez, P., Malfait, M., Vereecke, J. Intra- and intercellular Ca2+ signaling in retinal pigment epithelial cells during mechanical stimulation. Faseb J. 13, 63-68 (1999).
- Williams, K. K., Watsky, M. A. Bicarbonate promotes dye coupling in the epithelium and endothelium of the rabbit cornea. Curr. Eye Res. 28, 109-120 (2004).
- Hernandez Galindo, E. E., Theiss, C., Steuhl, K. P., Meller, D. Gap junctional communication in microinjected human limbal and peripheral corneal epithelial cells cultured on intact amniotic membrane. Exp Eye Res. 76, 303-314 (2003).
- Williams, K., Watsky, M. Gap junctional communication in the human corneal endothelium and epithelium. Curr. Eye Res. 25, 29-36 (2002).
- Anderson, S. C., Stone, C., Tkach, L., SundarRaj, N. Rho and Rho-kinase (ROCK) signaling in adherens and gap junction assembly in corneal epithelium. Invest. Ophthalmol. Vis. Sci. 43, 978-986 (2002).
- Joyce, N. C., Harris, D. L., Zieske, J. D. Mitotic inhibition of corneal endothelium in neonatal rats. Invest. Ophthalmol. Vis. Sci. 39, 2572-2583 (1998).
- Klepeis, V. E., Weinger, I., Kaczmarek, E., Trinkaus-Randall, V. P2Y receptors play a critical role in epithelial cell communication and migration. J. Cell Biochem. 93, 1115-1133 (2004).
- Klepeis, V. E., Cornell-Bell, A., Trinkaus-Randall, V. Growth factors but not gap junctions play a role in injury-induced Ca2+ waves in epithelial cells. J. Cell Sci. 114, 4185-4195 (2001).
- Laux-Fenton, W. T., Donaldson, P. J., Kistler, J., Green, C. R. Connexin expression patterns in the rat cornea: molecular evidence for communication compartments. Cornea. 22, 457-464 (2003).
- Rae, J. L., Lewno, A. W., Cooper, K., Gates, P. Dye and electrical coupling between cells of the rabbit corneal endothelium. Curr. Eye Res. 8, 859-869 (1989).
- Watsky, M. A., Rae, J. L. Dye coupling in the corneal endothelium: effects of ouabain and extracellular calcium removal. Cell Tissue Res. 269, 57-63 (1992).
- Williams, K. K., Watsky, M. A. Dye spread through gap junctions in the corneal epithelium of the rabbit. Curr. Eye Res. 16, 445-452 (1997).
- D'hondt, C., Ponsaerts, R., Srinivas, S. P., Vereecke, J., Himpens, B. Thrombin inhibits intercellular calcium wave propagation in corneal endothelial cells by modulation of hemichannels and gap junctions. Invest. Ophthalmol. Vis. Sci. 48, 120-133 (2007).
- D'hondt, C., Ponsaerts, R., Srinivas, S. P., Vereecke, J., Himpens, B. Reduced intercellular communication and altered morphology of bovine corneal endothelial cells with prolonged time in cell culture. Curr. Eye Res. 34, 454-465 (2009).
- D'hondt, C., Srinivas, S. P., Vereecke, J., Himpens, B. Adenosine Opposes Thrombin-Induced Inhibition of Intercellular Calcium Wave in Corneal Endothelial Cells. Invest Ophthalmol. Vis. Sci. 48, 1518-1527 (2007).
- Gomes, P., Srinivas, S. P., Van Driessche, W., Vereecke, J., Himpens, B. ATP release through connexin hemichannels in corneal endothelial cells. Invest. Ophthalmol. Vis. Sci. 46, 1208-1218 (2005).
- Gomes, P., Srinivas, S. P., Vereecke, J., Himpens, B. ATP-dependent paracrine intercellular communication in cultured bovine corneal endothelial cells. Invest. Ophthalmol. Vis. Sci. 46, 104-113 (2005).
- Gomes, P., Srinivas, S. P., Vereecke, J., Himpens, B. Gap junctional intercellular communication in bovine corneal endothelial cells. Exp Eye Res. , (2006).
- Ponsaerts, R., et al. The myosin II ATPase inhibitor blebbistatin prevents thrombin-induced inhibition of intercellular calcium wave propagation in corneal endothelial cells. Invest. Ophthalmol. Vis. Sci. 49, 4816-4827 (2008).
- Ponsaerts, R., et al. RhoA GTPase Switch Controls Cx43-Hemichannel Activity through the Contractile System. PLoS ONE. 7, e42074(2012).
- Ponsaerts, R., et al. Intramolecular loop/tail interactions are essential for connexin 43-hemichannel activity. Faseb J. 24, 4378-4395 (2010).
- Charles, A. Reaching out beyond the synapse: glial intercellular waves coordinate metabolism. Sci STKE. 2005, pe6(2005).
- Laird, D. W. Life cycle of connexins in health and disease. Biochem. J. 394, 527-543 (2006).
- Kelsell, D. P., Dunlop, J., Hodgins, M. B. Human diseases: clues to cracking the connexin code. Trends Cell Biol. 11, 2-6 (2001).
- Pearson, R. A., Dale, N., Llaudet, E., Mobbs, P. ATP released via gap junction hemichannels from the pigment epithelium regulates neural retinal progenitor proliferation. Neuron. 46, 731-744 (2005).
- Klepeis, V. E., Weinger, I., Kaczmarek, E., Randall, V. T. P2Y receptors play a critical role in epithelial cell communication and migration. J. Cell Biochem. 93, 1115-1133 (2004).
- Cotrina, M. L., Lin, J. H., Lopez-Garcia, J. C., Naus, C. C., Nedergaard, M. ATP-mediated glia signaling. J. Neurosci. 20, 2835-2844 (2000).
- Burnstock, G., Williams, M. P2 purinergic receptors: modulation of cell function and therapeutic potential. J. Pharmacol. Exp. Ther. 295, 862-869 (2000).
- Schwiebert, E. M., Zsembery, A. Extracellular ATP as a signaling molecule for epithelial cells. Biochim. Biophys Acta. 1615, 7-32 (2003).
- Lazarowski, E. R., Boucher, R. C., Harden, T. K. Mechanisms of release of nucleotides and integration of their action as P2X- and P2Y-receptor activating molecules. Mol. Pharmacol. 64, 785-795 (2003).
- Dubyak, G. R., el-Moatassim, C. Signal transduction via P2-purinergic receptors for extracellular ATP and other nucleotides. Am. J. Physiol. 265, C577-C606 (1993).
- Blair, S. A., Kane, S. V., Clayburgh, D. R., Turner, J. R. Epithelial myosin light chain kinase expression and activity are upregulated in inflammatory bowel disease. Lab. Invest. 86, 191-201 (2006).
- Boudreault, F., Grygorczyk, R. Cell swelling-induced ATP release and gadolinium-sensitive channels. Am. J. Physiol. Cell Physiol. 282, C219-C226 (2002).
- Romanov, R. A., Rogachevskaja, O. A., Khokhlov, A. A., Kolesnikov, S. S. Voltage dependence of ATP secretion in mammalian taste cells. J. Gen. Physiol. 132, 731-744 (2008).
- Pelegrin, P., Surprenant, A. Pannexin-1 mediates large pore formation and interleukin-1beta release by the ATP-gated P2X7 receptor. Embo J. 25, 5071-5082 (2006).
- Surprenant, A., Rassendren, F., Kawashima, E., North, R. A., Buell, G. The cytolytic P2Z receptor for extracellular ATP identified as a P2X receptor (P2X7). Science. 272, 735-738 (1996).
- D'hondt, C., et al. Pannexin channels in ATP release and beyond: an unexpected rendezvous at the endoplasmic reticulum. Cell Signal. 23, 305-316 (2011).
- Leybaert, L., et al. Connexin channels, connexin mimetic peptides and ATP release. Cell Commun. Adhes. 10, 251-257 (2003).
- Stout, C. E., Costantin, J. L., Naus, C. C., Charles, A. C. Intercellular calcium signaling in astrocytes via ATP release through connexin hemichannels. J. Biol. Chem. 277, 10482-10488 (2002).
- Verma, V., Hallett, M. B., Leybaert, L., Martin, P. E., Howard Evans, W. Perturbing plasma membrane hemichannels attenuates calcium signalling in cardiac cells and HeLa cells expressing connexins. Eur. J. Cell Biol. , (2008).
- Pharmacol, B. rJ. 147, S172-S181 (2006).
- Slakey, L. L., Gordon, E. L., Pearson, J. D. A comparison of ectonucleotidase activities on vascular endothelial and smooth muscle cells. Ann. N.Y. Acad. Sci. 603, 366-378 (1990).
- Gordon, E. L., Pearson, J. D., Slakey, L. L. The hydrolysis of extracellular adenine nucleotides by cultured endothelial cells from pig aorta. Feed-forward inhibition of adenosine production at the cell surface. J. Biol. Chem. 261, 15496-15507 (1986).
- Moerenhout, M., Himpens, B., Vereecke, J. Intercellular communication upon mechanical stimulation of CPAE- endothelial cells is mediated by nucleotides. Cell Calcium. 29, 125-136 (2001).
- Ralevic, V., Burnstock, G. Receptors for purines and pyrimidines. Pharmacol. Rev. 50, 413-492 (1998).
- Edelhauser, H. F. The resiliency of the corneal endothelium to refractive and intraocular surgery. Cornea. 19, 263-273 (2000).
- George, A. J., Larkin, D. F. Corneal transplantation: the forgotten graft. Am. J. Transplant. 4, 678-685 (2004).
- Hong, S. J., Wu, K. Y., Wang, H. Z., Fong, J. C. Change of cytosolic Ca2+ mobility in cultured bovine corneal endothelial cells by endothelin-1. J. Ocul. Pharmacol. Ther. 19, 1-9 (2003).
- Crawford, K. M., MacCallum, D. K., Ernst, S. A. Histamine H1 receptor-mediated Ca2+ signaling in cultured bovine corneal endothelial cells. Invest. Ophthalmol. Vis. Sci. 33, 3041-3049 (1992).
- Crawford, K. M., MacCallum, D. K., Ernst, S. A. Agonist-induced Ca2+ mobilization in cultured bovine and human corneal endothelial cells. Curr. Eye Res. 12, 303-311 (1993).
- Srinivas, S. P., Yeh, J. C., Ong, A., Bonanno, J. A. Ca2+ mobilization in bovine corneal endothelial cells by P2 purinergic receptors. Curr. Eye Res. 17, 994-1004 (1998).
- Satpathy, M., Gallagher, P., Jin, Y., Srinivas, S. P. Extracellular ATP opposes thrombin-induced myosin light chain phosphorylation and loss of barrier integrity in corneal endothelial cells. Exp Eye Res. 81, 183-192 (2005).
- Srinivas, S. P., et al. Cell volume response to hyposmotic shock and elevated cAMP in bovine trabecular meshwork cells. Exp. Eye Res. 78, 15-26 (2004).
- D'hondt, C., Ponsaerts, R., De Smedt, H., Bultynck, G., Himpens, B. Pannexins, distant relatives of the connexin family with specific cellular functions. Bioessays. 31, 953-974 (2009).
- Boitano, S., Dirksen, E. R., Sanderson, M. J. Intercellular propagation of calcium waves mediated by inositol trisphosphate. Science. 258, 292-295 (1992).
- De Vuyst, E., et al. Intracellular calcium changes trigger connexin 32 hemichannel opening. EMBO J. 25, 34-44 (2006).
- De Vuyst, E., et al. Ca2+ regulation of connexin 43 hemichannels in C6 glioma and glial cells. Cell Calcium. 46, 176-187 (2009).
- Weissman, T. A., Riquelme, P. A., Ivic, L., Flint, A. C., Kriegstein, A. R. Calcium waves propagate through radial glial cells and modulate proliferation in the developing neocortex. Neuron. 43, 647-661 (2004).
- Iyer, S., Deutsch, K., Yan, X., Lin, B. Batch RNAi selector: a standalone program to predict specific siRNA candidates in batches with enhanced sensitivity. Computer Methods and Programs in Biomedicine. 85, 203-209 (2007).
- Stehberg, J., et al. Release of gliotransmitters through astroglial connexin 43 hemichannels is necessary for fear memory consolidation in the basolateral amygdala. Faseb J. 26, 3649-3657 (2012).
- Evans, W. H., Bultynck, G., Leybaert, L. Erratum to: Manipulating Connexin Communication Channels: Use of Peptidomimetics and the Translational Outputs. J. Membr. Biol. 245, 451(2012).
- Majumder, P., et al. ATP-mediated cell-cell signaling in the organ of Corti: the role of connexin channels. Purinergic Signal. 6, 167-187 (2010).
- Carvalho, A. C., et al. affects intracellular Ca2+ stores and induces Ca2+ wave propagation. Cell Death Differ. 11, 1265-1276 (2004).
- Torres, A., et al. Extracellular Ca2+ acts as a mediator of communication from neurons to glia. Sci. Signal. 5, ra8(2012).
- Decrock, E., et al. Transfer of IP(3) through gap junctions is critical, but not sufficient, for the spread of apoptosis. Cell Death Differ. 19 (3), 947-957 (2012).
- Beltramello, M., Piazza, V., Bukauskas, F. F., Pozzan, T., Mammano, F. Impaired permeability to Ins(1,4,5)P3 in a mutant connexin underlies recessive hereditary deafness. Nat. Cell Biol. 7 (1,4,5), 63-69 (2005).
- Bukauskas, F. F., Bukauskiene, A., Verselis, V. K. Conductance and permeability of the residual state of connexin43 gap junction channels. J. Gen. Physiol. 119, 171-186 (2002).
- Bukauskas, F. F., Verselis, V. K. Gap junction channel gating. Biochim. Biophys. Acta. 1662, 42-60 (2004).
- Dahl, G. Where are the gates in gap junction channels? Clin. Exp. Pharmacol. Physiol. 23, 1047-1052 (1996).
- Retamal, M. A., Schalper, K. A., Shoji, K. F., Bennett, M. V., Saez, J. C. Opening of connexin 43 hemichannels is increased by lowering intracellular redox potential. Proc. Natl. Acad. Sci. U.S.A. 104, 8322-8327 (2007).
- Shibayama, J., et al. Effect of charge substitutions at residue his-142 on voltage gating of connexin43 channels. Biophys. J. 91, 4054-4063 (2006).
- Desplantez, T., Verma, V., Leybaert, L., Evans, W. H., Weingart, R. Gap26, a connexin mimetic peptide, inhibits currents carried by connexin43 hemichannels and gap junction channels. Pharmacological Research: The Official Journal of the Italian Pharmacological Society. 65, 546-552 (2012).
- Delmar, M. Gap junctions as active signaling molecules for synchronous cardiac function. J. Cardiovasc. Electrophysiol. 11, 118-120 (2000).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados