Method Article
Хромосома Репликация времени в сочетании с Флуоресцентные
В этой статье
Резюме
Количественный метод для анализа хромосом времени репликации описано. Метод использует BrdU включение в сочетании с флуоресцентными На месте Гибридизации (FISH) для оценки времени репликации хромосом млекопитающих. Эта техника позволяет прямое сравнение переставить и ООН-переставить хромосом в пределах одной ячейки.
Аннотация
Mammalian DNA replication initiates at multiple sites along chromosomes at different times during S phase, following a temporal replication program. The specification of replication timing is thought to be a dynamic process regulated by tissue-specific and developmental cues that are responsive to epigenetic modifications. However, the mechanisms regulating where and when DNA replication initiates along chromosomes remains poorly understood. Homologous chromosomes usually replicate synchronously, however there are notable exceptions to this rule. For example, in female mammalian cells one of the two X chromosomes becomes late replicating through a process known as X inactivation1. Along with this delay in replication timing, estimated to be 2-3 hr, the majority of genes become transcriptionally silenced on one X chromosome. In addition, a discrete cis-acting locus, known as the X inactivation center, regulates this X inactivation process, including the induction of delayed replication timing on the entire inactive X chromosome. In addition, certain chromosome rearrangements found in cancer cells and in cells exposed to ionizing radiation display a significant delay in replication timing of >3 hours that affects the entire chromosome2,3. Recent work from our lab indicates that disruption of discrete cis-acting autosomal loci result in an extremely late replicating phenotype that affects the entire chromosome4. Additional 'chromosome engineering' studies indicate that certain chromosome rearrangements affecting many different chromosomes result in this abnormal replication-timing phenotype, suggesting that all mammalian chromosomes contain discrete cis-acting loci that control proper replication timing of individual chromosomes5.
Here, we present a method for the quantitative analysis of chromosome replication timing combined with fluorescent in situ hybridization. This method allows for a direct comparison of replication timing between homologous chromosomes within the same cell, and was adapted from6. In addition, this method allows for the unambiguous identification of chromosomal rearrangements that correlate with changes in replication timing that affect the entire chromosome. This method has advantages over recently developed high throughput micro-array or sequencing protocols that cannot distinguish between homologous alleles present on rearranged and un-rearranged chromosomes. In addition, because the method described here evaluates single cells, it can detect changes in chromosome replication timing on chromosomal rearrangements that are present in only a fraction of the cells in a population.
протокол
1. BrdU регистрации (Терминал маркировки)
- Пластина клеток до 70% слияния в 150 мм ткань культуры блюдо 24 часа до добавления BrdU.
- Заменить СМИ со свежей полной среды, содержащей 20 мкг / мл BrdU (Sigma) в соответствующие моменты времени до сбора урожая. Время, клетки культивируют в средах с BrdU будет меняться в зависимости от типа клеток и вида, как правило, G2 фаза длится от 2 до 5 ч (рис. 1).
2. Хромосома Harvest монослоя клетки культур
- Удалить культуру средств массовой информации с пластины и собрать 10 мл в 15 мл коническую трубку центрифуги. Удалите оставшиеся средства массовой информации.
- Промойте клетки один раз 10 мл Versine [или HBSS (Sigma)].
- Добавьте 5 мл 0,25% трипсина в Versine (или HBSS) к плите. Выдержите при комнатной температуре до клетки отделяются от пластинки.
- Добавить трипсинизированных клеточной суспензии в пробирку, содержащую 10 мл средства массовой информации, начиная с шага 2.1.
- Центрифуга при 400 мкг в течение 10 мин для осаждения клеток. Супернатант, оставляя 0,5 мл среды плюс осадок клеток.
- Ресуспендируют клетки тщательно с помощью пипетки с пипетки Пастера.
- Добавить 3 капли гипотонический раствор (0,075 M KCl (Sigma) нагревали до 37 ° C); смешивать клеточной суспензии с пипетки Пастера. Добавить 0,5 мл гипотонического раствора и снова перемешать с пипетки Пастера. Принесите объем гипотонический раствор по 5 мл и перемешать еще раз. Инкубировать при 37 ° С в течение 20-45 мин, в зависимости от типа клеток.
- Центрифуга при 400 х г в течение 10 мин. Супернатант, оставляя 0,5 мл среды плюс осадок клеток.
- Ресуспендируют клеточный осадок, аккуратно стряхивая трубку. Осмотически опухшие клеток будет хрупким на данный момент, так что следует проявлять осторожность, чтобы не нарушать цитоплазматической мембраны.
- Добавить 3 капли фиксатора Карнуа (1:3 Ледяная уксусная кислота: метанол); смесь, осторожно пипеткой с Пастером pipettе. Добавить 0,5 мл фиксатора и перемешать, осторожно пипеткой с пипетки Пастера. Принесите объем фиксатором по 5 мл и снова перемешать, осторожно пипеткой с пипетки Пастера. Фиксированные клетки можно хранить в темном месте при температуре -20 ° С в течение нескольких месяцев.
- Центрифуга и аспирации, как и в шаге 2.8.
- Ресуспендируют осадок клеток в свежей фиксатором; оценить объем гранул и дополнений ~ 10x объем фиксатором Карнуа.
- Добавить клеточной суспензии по каплям на мокрой, ледяной горки микроскопа; держать слайд в угол ~ 45 ° и позволяют клеточной суспензии течь по поверхности слайда. Положите слайд квартира на бумажных полотенцах и наводнений слайд с фиксатором и дайте высохнуть на воздухе. Проверьте слайды на наличие митотического спреды использованием инвертированного микроскопа.
3. РНКазы лечение и этанола обезвоживания
- Место 200 мкл 10 мкг / мл РНКазы А (Sigma) в 2х SSC для каждого слайда; инкубируют при 37 и де-г; C в течение 1 часа.
- Wash горки 3 раза с 2x SSC, рН 7,0 при комнатной температуре в течение 3 минут каждый.
- Высушить скользит через EtOH (Sigma), серия (70%, 90% и 100%) при комнатной температуре в течение 3 минут каждый.
- Воздух сухой слайды при комнатной температуре.
4. Подготовка зонда Коктейли для BAC Plus хромосомы конкретных Centromere перечисление Probe (CEP) или для всего Краски хромосомы в гибридизация
- Для BAC / CEP одновременной гибридизации, подготовить два отдельных коктейли зонд для предварительной гибридизации. Мы обнаружили, что предварительно гибридизации BAC и КЭП зондов отдельно по разным результатам строгости менее фоне и больше интенсивности сигнала. Мы также обнаружили, что отдельные Fosmids также может быть использован вместо ВАС-клонов. Коктейль разработке описанных ниже представлены объемы для одного слайда. Если обработка нескольких слайдов с использованием тех же зондов просто увеличить объемы appropr iately.
* BAC ДНК-зонда коктейль:
11,5 мкл буфера для гибридизации (50% формамид (Sigma) / 2x SSC / сульфат декстрана (Sigma)) 2 мкл дН 2 O
2,5 мкл BAC/Cot1 ДНК в дН 2 O (см. ниже для маркировки протокола) 15 мкл общего объема
* КЭП зонд коктейль:
7 мкл буфера гибридизации CEP (65% Formamide/2x SSC / декстрансульфат) 2 мкл дН 2 O
1 мкл ДНК CEP/Cot1 (приобретается prelabeled с Spectrum Orange/Cy3/Texas красный) 10 мкл общего объема
* После денатурации и предварительной гибридизации (шаг 5,1) смеси BAC зонда с зондом КЭП на соотношение 3:2 25 коктейлей мкл / слайдов и перемешать зонда.
ИЛИ
- Алиготе 20 мкл / слайд Всего зонд краски хромосомы (Cy3/Texas Red) в трубку. Приступить к денатурации и гибридизации предварительного шага.
- Денатурировать зонд коктейль (ы) при 75 ° С в течение 10 мин. Предварительно гибридизации при 37 ° С в течение 30 мин, чтобы позволить Cot1 ДНК для гибридизации с повторяющимися последовательностями и для предотвращения последующего гибридизации метафазы хромосомы.
- Денатурировать слайды в банках Коплин в 70% Formamide/2x SSC, рН 7,0 при 72 ° С в течение 3 мин.
- Сразу обезвоживает скользит через EtOH серии (70%, 90% и 100%) в банках Коплин при 4 ° С в течение 3 минут каждый.
- Разрешить слайды высохнуть на воздухе при комнатной температуре.
- Предварительно теплой слайды до 45 ° C на слайде теплее за последние 10 минут зонда предварительно hybridzation (шаг 5,1). Смешать предварительно гибридизированных коктейли зонда при необходимости и добавить 25 мкл для каждого слайда, осторожно положите покровное на каждом слайде и уплотнение по всем краям с резиновой цемента. Выдержите в течение ночи при 37 ° C в увлажненной камере для предотвращения испарения.
6. Сообщение Гибридизация Моет
- Вымойте слайды в банках Коплин 3 раза в 50% formamide/2x SSC, рН 7,0 при 38-40 ° С в течение 3 минут каждый. Температура мытья может варьироваться между зондами. Если есть высокая гибридизации фона можно увеличить температуру стирок. И наоборот, если сигнал слабый, и нет фона, то вы можете уменьшить температуру этих стирок.
- Wash скользит 1 раз в буфер PN при комнатной температуре в течение 3 минут, и переходите к шагу обнаружения BrdU.
7. BrdU Detection
- Блок слайды с PNM буфере в течение 10 мин (200 мкл / слайд) при комнатной температуре в темноте.
- Слейте слайды, включив края на бумажном полотенце. Добавить 100 мкл анти-BrdU-FITC (50 мкг / мл Roche или Millipore) в PNM буфере в течение 30 мин при 37 ° C.
- Вымойте слайды 3 раза в буфер PN при комнатной температуре в течение 3 минут каждый.
- Истощатьизбыток буфера PN на слайды по одному включением края на бумажном полотенце. Добавить 20 мкл DAPI / antifade монтаж решение (Invitrogen). Накройте слайд с бумажным полотенцем и нажмите на покровное, чтобы вытеснить пузырьки воздуха и избыточного монтаж решение. Перейдем к анализу изображений.
8. Захват изображения и количественного BrdU регистрации
- Изображения захватываются с Olympus BX61 флуоресцентного микроскопа и Olympus ПЗС-камеры, 100x цель, автоматический фильтр-колеса и Cytovision программного обеспечения (Applied Imaging). BrdU захвачен использованием FITC фильтр; хромосомы краски (Texas Red, метасистем или Cytocell), ВАС (Cy3) и CEP (Vysis Spectrum Orange) зонды, получены с помощью Texas Red или Cy3 фильтр; DAPI захватывается с DAPI фильтра (см. На рисунках 2 и 3).
- Индивидуальные хромосомы интерес отождествляется с BAC / CEP или хромосомы конкретной краски зондов (рис. 2В и 3В). ИспользующийПрограммное обеспечение Cytovision, каждая хромосома интерес "вырез" в метафазе распространению в целом, линия, проведенная через по длине хромосомы от короткого плеча на длинном плече (рис. 2С и 3С). Программное обеспечение Cytovision используется для количественной оценки интенсивности пикселя профиля по всей длине каждой хромосомы. Программное обеспечение Cytovision вычисляет площадь, занимаемая пикселов и измеряет интенсивность пикселей представлены BrdU или DAPI сигналов на каждой изолированной хромосомы. Средняя интенсивность пикселя представлена каждая хромосома затем умножается на площадь, занимаемая те пиксели, чтобы получить общее количество пикселей (Таблица 1 и Рисунок 4). Кроме того, этот протокол позволяет для визуализации последней репликации участки хромосом. Соответственно, полосчатые структуры включения BrdU позволяет для обнаружения активное тиражирование участки хромосом, и различия в сроках репликации между ChromosOme пар рассматриваются как различия в этом картина диапазонов (рис. 2 и 3). Наконец, эти различия в связывании моделей можно сравнить с известным репликации сроков карты для каждой хромосомы 6,7, что позволяет оценить разницу времени между репликации гомологичных хромосом или хромосомных плеч 4. Например, две хромосомы 6 находится в 3А отображение разницы в структуре полосы> 2 ч, по сравнению с нормальными времени репликации хромосомы 6 4.
Кроме того, аналогичная процедуре описанной здесь успешно используется для исследования асинхронного времени репликации между неактивными и активными Х-хромосомы 8,9. Активной и неактивной Х-хромосомы были определены с использованием краски Х-хромосоме. Изображения были получены с помощью Quips mFISH программного обеспечения (Vysis) и количество пикселей занимает Х-хромосомы и количество пикселей занимает флуоресцентно-ла-Белед BrdU Затем были рассчитаны с использованием NIH Image ( http://rsb.info.nih.gov/nih-image/index.html ).
9. Ник Перевод BAC ДНК для люминесцентных маркировки (Vysis)
- Добавьте следующую смесь зонд охлажденной пробирке:
70 мкл (4 мкг ДНК) в дН 2 O
10 мкл 0,2 мМ дУТФ-оранжевый или зеленый
20 мкл 0,1 мМ дТТФ
20 мкл 10х буфера Перевод Nick
40 мкл NT дНТФ (в минус дТТФ)
40 мкл перевода ник фермента
200 мкл общего объема
Инкубировать при 16 ° CO / N. Остановить реакцию при нагревании при 70 ° С в течение 10 мин. Охладить на льду в течение 5 мин. - Осаждения ДНК этанолом, добавив следующий на зонд смеси:
200 мкл решение зонд
48 мкл 3 М ацетата натрия
160 мкл Cot1DNA (.25 мкг / мкл)
1200 мкл 100% этанола - Хранить при -80 ° С в течение 10 мин до O / N.
- СпиномN Cold при 12000 х г в течение 20 мин. Слейте с этанолом. Мыть 1 раз с 70% этанола. Побочные как и раньше. Слейте с этанолом. Сухой воздух только пока не испаряется EtOH. Ресуспендируют в 40 мкл дН 2 O для конечной концентрации 100 нг / мкл BAC ДНК.
Результаты
Пример анализа репликации сроки человеческой хромосомы 6, показано на рисунке 2. Клетки, содержащие удаление гена ASAR6 4, расположенный на 6q16.1, подвергались BrdU в течение 5 часов, собирали для митотических клеток и обрабатываются для рыбы с хромосоме 6 краску зонда (Vysis) и для включения BrdU. Обратите внимание, что существует значительная разница в BrdU картина диапазонов между двумя 6, которая согласуется с задержкой репликации времени> 2 часа для одного из хромосоме 6 [см. 4 для репликации временных диапазонов структуры хромосомы 6 до Удаление]. Кроме того, существует значительная разница в общей сумме BrdU регистрации (пикселей) по сравнению с аналогичным анализом окрашивания DAPI (рис. 2D).
Другой пример анализа репликации времени для человеческой хромосоме 6 показано на рисунке 3. Клетки, содержащие образцовэлектронной удаление гена ASAR6 4, показанная если рисунок 2 подвергаются BrdU в течение 5 часов, собирали для митотических клеток и обрабатываются для рыбы с хромосоме 6 КЭП зонда плюс BAC содержащие ASAR6 гена и для включения BrdU. Обратите внимание, что удалены хромосомы 6 (Δ6) отображает более BrdU регистрации и более расширенная картина диапазонов инкорпорации BrdU чем не удалены хромосомы 6. Митотическое спреды от 7 различных клеток были обработаны как показано на рисунке 3, а пиксела профили для DAPI и BrdU приведены в таблице 1.

Рисунок 1. BrdU терминал этикетки схеме. Типичные фазы S в клетках млекопитающих, длится от 8 до 10 ч, а G2, как правило, от 2 до 5 часов. BrdU добавляют для увеличения времени (зеленые стрелки) для обозначения последней части хромосомы повторить. Thэлектронной хромосом в клетках млекопитающих повторить в соответствии с временной программой, с ранней и поздней репликации происходит в начале и в конце фазы S соответственно (черная линия). Неактивные Х-хромосомы с задержкой в репликации времени с большинством синтез ДНК, происходящие во второй половине S фаза (синяя линия). Хромосомы с задержкой сроков репликации с задержкой в обоих начала и завершения синтеза ДНК, с активной репликацией продолжается через G2 (красная линия). Асинхронный культур собирают для митотических клеток и обрабатываются для включения BrdU и рыбы.
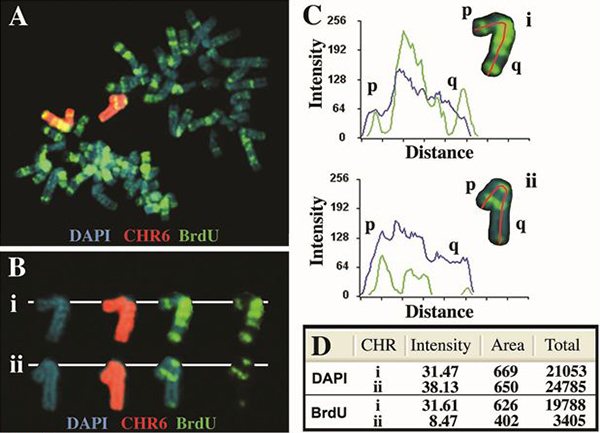
Рисунок 2. Асинхронной репликации хромосомы человека 6. Клетки, содержащие инженерных удаление гена ASAR6 4 лечились BrdU в течение 5 часов, собирали для митотических клеток и обрабатываются для BrdU регистрации и рыбы с помощью хром osome 6 краску в качестве зонда. ДНК окрашивали DAPI (синий). A) митотической распространение содержащие типичные "полосчатые" картина BrdU включения (зеленый) показано на рисунке. Хромосоме 6 краску зонд гибридизовали до двух хромосоме 6 (красный) в этой ячейке. Б) два хромосоме 6 (в I и II) были "вырезать" и отображается с тремя флуоресцентными метками разделены на различные образы. C) хромосомы 6 были проанализированы с помощью программного обеспечения Cytovision и профилей интенсивности сигнала для обоих DAPI (синий) и BrdU (зеленый) показаны. Красная линия указывает путь, используемый, от короткого плеча (р) длинные руки (Q) для количественной оценки и BrdU и DAPI. Расстояние относится к длине каждой хромосомы от короткого плеча (р) длинные руки (Q) в пикселях. D) Количественная оценка суммарного сигнала для DAPI и BrdU флуоресценции. Общая значения представляют средней интенсивности пикселя умножается на площадь, представленные этими пикселей.
igure 3 "SRC =" / files/ftp_upload/4400/4400fig3.jpg "/>
Рисунок 3. Задержка репликации хромосомы человека 6, содержащий удаление ASAR6. Клетки, содержащие инженерных удаление гена ASAR6 4 лечились BrdU в течение 5 часов, собирали для митотических клеток и обрабатываются для BrdU регистрации и рыбы с помощью хромосоме 6 КЭП плюс BAC содержащие ASAR6 гена в качестве зондов. ДНК окрашивали DAPI (синий). A) митотической распространение содержащие типичные "полосчатые" картина BrdU включения (зеленый) показано на рисунке. Хромосоме 6 КЭП зонд гибридизовали до двух хромосоме 6 (в больших красных центромерным сигнала), и BAC гибридизовали с одной хромосоме 6 (маленький красный сигнал на длинном плече) в этой ячейке. Обратите внимание на разницу в BrdU картина диапазонов между двумя 6 в. B) удалены хромосомы 6 представлена Δ6 и не удаленных 6 на 6. Два 6 были "вырезать" и отображается с помощью трех флуоресцентных меток, разделенных на отдельные изображения. C) TОн хромосоме 6 были проанализированы с помощью программного обеспечения Cytovision и профилей интенсивности сигнала для обоих DAPI (синий) и BrdU (зеленый) показаны. Красная линия указывает путь, используемый, от короткого плеча (р) длинные руки (Q) для количественной оценки и BrdU и DAPI. Расстояние относится к длине каждой хромосомы от короткого плеча (р) длинные руки (Q) в пикселях. D) Количественная оценка суммарного сигнала для DAPI и BrdU флуоресценции. Общая значения представляют средней интенсивности пикселя умножается на площадь, представленные этими пикселей.
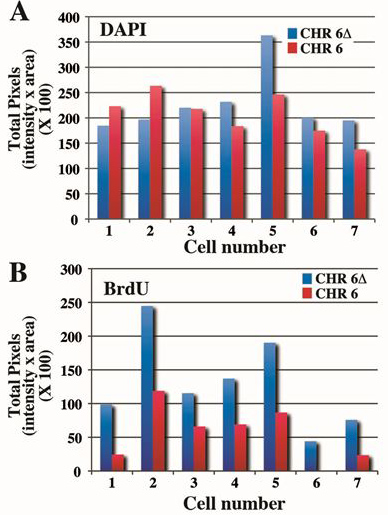
Рисунок 4. Количественная разница времени между репликацией хромосомы 6 в. Клетки, содержащие инженерных удаление гена ASAR6 4 лечились BrdU в течение 5 часов, собирали для митотических клеток и обрабатываются для BrdU регистрации и рыбы с помощью хромосоме 6 КЭП зонда плюсBAC содержащие ASAR6 гена в качестве зонда. Митотическое спреды были обработаны как показано на рисунке 3, а значения для 7 различных клеток показано (см. таблицу 1). A) окрашивание DAPI количественно и общее количество пикселей отображается для каждой ячейки. Обратите внимание, что есть только ~ 10-20% разницы между хромосомами в пределах одной ячейки. Б) включение BrdU количественно из той же хромосомы, как панель B выше. Обратите внимание, что> 2 раза разница между общим значения пиксела для удаленных и не удаленных в хромосоме 6.
Обсуждение
Подготовка хромосомы спредов является важным шагом для успешной репликации сроков анализа, описанного здесь. Включение колцемид стадии предварительной обработки до гипотоническому лечение может помочь в частоте и распространения делящихся клеток. Мы обычно предоставляют клетки colcemdi в течение 1-3 ч до сбора урожая, и использовать колцемид в конечной концентрации 10 мкг / мл. Тем не менее, включение колцемид стадии предварительной обработки может изменить длину G2 и, следовательно, может изменить видимый времени репликации и состояния конденсации хромосом 3.
Эта процедура может быть применена ко многим различным типам клеток и видов, варьируя длину инкубационного BrdU, который зависит от продолжительности клеточного цикла. Для большинства человеческих и мышиных клеточных линий, G2 фазе, как правило, 3-6 часа, поэтому BrdU лечения, как правило, в этом диапазоне. Альтернативой BrdU является 5-этинил-2'deoxyuridine (EDU) и его последующего обнаружения с использованиемфлуоресцентный азид и "мыши химии" реакции 10. Схема образования обнаружения имеет ряд преимуществ перед схемой обнаружения BrdU. Например, обнаружение образования не требуют фиксации образца или денатурация ДНК. Таким образом, использование образовательных сроков репликации ослы могут быть объединены с простыми G-полосы методы вместо рыбы для идентификации хромосом интерес.
Протокол репликации времени описано здесь специально разработан для анализа конце S фазы плюс синтез ДНК распространяются на G2. Кроме того, репликация ДНК можно наблюдать на всем протяжении S фазы, с помощью этой процедуры с помощью коротких (15-30 мин) импульсы BrdU следуют сравнительно долгой погони периоды 6-10 час. Это позволяет для визуализации включения BrdU как в начале и середине S-фазы. Например, некоторые опухоли, полученных хромосомных перестроек с задержкой в обоих начала и завершения синтеза ДНК по всей длине хромосом 3 .
Одно из преимуществ этой процедуры сроки репликации является то, что анализы репликации времени в отдельных клетках. Таким образом, он имеет возможность обнаружить различия в сроках репликации между гомологичными хромосомами, содержащихся в одной камере. Хотя существуют и другие процедуры, например. Репликация времени в гибридизация (ReTiSH, 11), которые имеют возможность обнаружить различия в сроках репликации между аллелями в определенных локусов на гомологичных хромосом, процедура, описанная здесь можно обнаружить различия в сроках репликации по всей длине хромосом. Кроме того, эта процедура может анализе различий в сроках репликации хромосом, которые присутствуют в только часть клеток населения 3. Например, многие клеточные линии рака и первичная опухоль образцы содержат хромосомных перестроек, которые присутствуют в менее чем 50% клеток. В настоящее время мы с помощью этой процедуры для анализа хромосомв первичной опухоли образцов, и были в состоянии обнаружить асинхронной репликации между хромосомами в нескольких образцах. Однако, учитывая, что первичная опухоль образцы имеют ограниченное количество митотических фигур, около одной трети первичных культур не дали достаточного числа митотических спредов.
Еще одно преимущество, что эта процедура имеет более микрочипов или секвенирования на основе анализа является то, что отдельные хромосомы анализировали, а не иммунопреципитации ДНК из пула клеток. В иммунопреципитации на основе анализа полиморфизма должны быть определены и связаны с конкретными аллелями того, чтобы отличить репликации времени между аллелями.
Кроме того, с признанием того, что многие раковые клетки содержат многочисленные перестройки хромосом 12 и наблюдение, что стресс репликации ДНК связан с геномной нестабильности в раковых клетках 13, мы считаем, что этот протокол является полезным и простым инструментом Fили рутинного анализа репликации сроки хромосом в раковых клетках.
Раскрытие информации
Нет конфликта интересов объявлены.
Благодарности
Эта работа была поддержана грантом Национального института рака, CA131967.
Материалы
| Name | Company | Catalog Number | Comments |
| Название реагента | Компания | Номер по каталогу | Комментарии (по желанию) |
| Anti-BrdU-FITC | Roche Millipore | 11202593001 MAB326F | 50 мкг / мкл |
| Ник Перевод Kit | Abbott молекулярной (Vysis) | 07J00-0001 | |
| Спектр оранжевой дУТФ | Abbott молекулярной (Vysis) | 02N33-050 | |
| КЭП | Abbott молекулярной (Vysis) | Варьируется | |
| LSI / ВКП гибридизации буфер | Abbott молекулярной (Vysis) | 06J67-011 | |
| КЭП гибридизации буфер | Abbott молекулярной (Vysis) | 07J36-001 | |
| Хромосома пайНТС | Метасистем группы | D-14NN-050-TR | |
| Olympus BX61 флуоресцентного микроскопа | Олимп | BX61TRF-1-5 | |
| Микроскоп изображений программное обеспечение системы | Прикладная изображений | Cytovision 3.93.1 | |
| Цифровые камеры | Олимп | UCMAD3 | |
РЕЦЕПТЫ НА МЕСТЕ ГИБРИДИЗАЦИИ 35 мл Формамид * (Sigma) * Важно использовать формамид, которые хранились при температуре -20 ° C. Длительное хранение комнатной температуре будет генерировать муравьиной кислоты и рН Wплохо быть слишком низкой. 50% Formamide/2x SSC 25 мл формамида (Sigma) 20x SSC, 4 л 702 г NaCl (Sigma) PN Buffer [0,1 M NaP0 4 0,1% NP_40 (Sigma)] Сделайте 0,1 М раствора каждого из фосфата натрия (Filter стерилизовать и хранить в 500 мл аликвоты). 0,1 М NaH 2 P0 4, 1 л 13,8 г NaH 2 P0 4 (Sigma): 0,1 М NaH 2 P0 4 1 L 14,2 г NaH 2 P0 4 (Sigma) PN: Отрегулируйте рН 0,1 М Na 2 HP0 4 до рН 8,0 с 0,1 М NaH 2 P0 4. Фильтр стерилизуют и добавляют 1 мл NP-40. PNM 50 мл 1,25 г сухого обезжиренного молока (Sigma) Смешайте в течение 15-20 мин при постоянном помешивании. Spin 2 раза при 400 х г в течение 10 мин. Используйте супернатант, и убедитесь, что не беспокоить осажденные белки молока. |
Ссылки
- Payer, B., Lee, J. T. X chromosome dosage compensation: how mammals keep the balance. Annu. Rev. Genet. 42, 733-772 (2008).
- Breger, K. S., Smith, L., Turker, M. S., Thayer, M. J. Ionizing radiation induces frequent translocations with delayed replication and condensation. Cancer Research. 64, 8231-8238 (2004).
- Smith, L., Plug, A., Thayer, M. Delayed Replication Timing Leads to Delayed Mitotic Chromosome Condensation and Chromosomal Instability of Chromosome Translocations. Proc. Natl. Acad. Sci. U.S.A. 98, 13300-13305 (2001).
- Stoffregen, E. P., Donley, N., Stauffer, D., Smith, L., Thayer, M. J. An autosomal locus that controls chromosome-wide replication timing and mono-allelicexpression. Hum. Mol. Genet. 20, 2366-2378 (2011).
- Breger, K. S., Smith, L., Thayer, M. J. Engineering translocations with delayed replication: evidence for cis control of chromosome replication timing. Hum. Mol. Genet. 14, 2813-2827 (2005).
- Camargo, M., Cervenka, J. Patterns of DNA replication of human chromosomes. II. Replication map and replication model. Am. J. Hum. Genet. 34, 757-780 (1982).
- Cohen, S. M., Cobb, E. R., Cordeiro-Stone, M., Kaufman, D. G. Identification of chromosomal bands replicating early in the S phase of normal human fibroblasts. Exp. Cell Res. 245 (98), 321-329 (1998).
- Diaz-Perez, S., et al. The element(s) at the nontranscribed Xist locus of the active X chromosome controls chromosomal replication timing in the mouse. Genetics. 171, 663-672 (2005).
- Diaz-Perez, S. V., et al. A deletion at the mouse Xist gene exposes trans-effects that alter the heterochromatin of the inactive X chromosome and the replication time and DNA stability of both X chromosomes. Genetics. 174, 1115-1133 (2006).
- Salic, A., Mitchison, T. J. A chemical method for fast and sensitive detection of DNA synthesis in vivo. Proc. Natl. Acad. Sci. U.S.A. 105, 2415-2420 (2008).
- Schlesinger, S., Selig, S., Bergman, Y., Cedar, H. Allelic inactivation of rDNA loci. Genes Dev. 23, 2437-2447 (2009).
- Mitelman Database of Chromosome Aberrations in Cancer. , Available from: http://cgap.nci.nih.gov/Chromosomes/Mitelman (2006).
- Branzei, D., Foiani, M. The checkpoint response to replication stress. DNA Repair (Amst). 8, 1038-1046 (2009).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены