Method Article
结合荧光染色体复制时序
摘要
染色体复制定时分析的定量方法进行说明。的方法,利用结合BrdU掺入荧光,杂交(FISH),以评估哺乳动物染色体的复制定时。这种技术允许在同一细胞重新排列和未重排的染色体直接比较。
摘要
哺乳动物DNA复制的启动在染色体上的多个站点在不同的时间在S期,随着时间的复制程序。被认为是一个动态的过程受反应的表观遗传修饰的组织特异性和发展线索,规范的复制时间。但是,调节,当启动染色体上DNA复制的机制仍然知之甚少。同源染色体的复制同步,但有显着的例外情况。例如,在雌性哺乳动物细胞中的两个X染色体中的一个成为后期复制经历一个过程被称为X染色体失活1。除了这种延迟复制时间,估计要2-3小时,一个X染色体上,成为大多数基因转录沉默。此外,一个离散的顺式作用位点,被称为X染色体失活中心,调节此X染色体失活过程中,包括第Ë感应对整个失活的X染色体的复制时间延迟。此外,一些在肿瘤细胞和细胞中的染色体重排暴露于电离辐射,显示复制时间> 3小时,影响了整个染色体2,3显着延迟。我们的实验室最近的工作表明,中断的离散顺式作用常染色体位点在极晚,影响了整个第4号染色体的复制型。额外的染色体工程的研究表明,某些染色体重排,影响了许多不同的染色体造成这种不正常的复制计时表型,这表明所有的哺乳动物染色体包含离散的顺式作用位点,控制适当的个体染色体的复制时间。
在这里,我们提出了一个方法的定量分析结合荧光原位杂交染色体复制时间。这方法允许在同一细胞同源染色体之间的复制时间的直接比较,并被改编6。此外,这种方法可以明确识别的染色体重排,与影响整个染色体的复制时间变化的。这种方法有优势,最近开发的高通量微阵列或不能区分同源基因上的重新排列和重排染色体的测序协议。此外,因为这里描述的方法的计算结果单细胞,它可以检测染色体重排,在一个群体中只有一小部分的细胞中存在的染色体复制定时变化。
研究方案
1。 BrdU掺入(末端标记)
- 至约70%汇合在一个150毫米的组织培养皿中的24小时之前加入的BrdU板细胞。
- 用新鲜的完整的媒体,含有20微克/毫升的BrdU(Sigma公司)在适当的时间点,在收获之前更换介质。用BrdU与细胞类型和种类会有所不同,典型的G2期的持续时间在2和5小时( 图1)之间的介质中培养时细胞的长度。
2。单层细胞培养染色体的收获
- 删除的文化传媒板块,并收集10毫升,15毫升的离心管中。丢弃剩余的介质。
- 冲洗细胞一次用10ml正矢[或HBSS中(Sigma公司)]。
- 加入5毫升正矢(或HBSS中)中的0.25%胰蛋白酶的板。在室温下孵育,直到细胞脱离板。
- 加入胰蛋白酶处理的细胞悬浮液从步骤2.1的介质中含有10毫升的管。
- 离心400 xg离心10分钟以沉淀细胞。吸干上清液,离开0.5毫升介质中加细胞沉淀。
- 用巴斯德吸管移液彻底重悬细胞。
- 加入3滴低渗溶液(0.075 M氯化钾(Sigma公司)温热至37℃下 ),用巴斯德移液管中的细胞悬浮液混合。加入0.5毫升低渗溶液混合,再次用巴斯德吸管。带来的低渗溶液至5毫升的量,并再次混合。在37℃下孵育20-45分钟,这取决于细胞的类型。
- 400×g离心10分钟,离心。吸干上清液,离开0.5毫升介质中加细胞沉淀。
- 重悬细胞沉淀轻轻轻拂管。在这一点上,渗透细胞肿胀是脆弱的,所以应注意不破坏细胞膜。
- 加3滴混合,轻轻移液用巴斯德pipett卡诺固定液(1:3的冰醋酸酸:甲醇);E。加入0.5毫升的固定剂和组合,用巴氏吸管轻轻吹打。带上固定液至5毫升的体积,并再次混合,轻轻移液用巴斯德移液管。固定的细胞可以被存储在黑暗中在-20℃下的数个月。
- 离心并吸出,在步骤2.8。
- 细胞沉淀重悬在新鲜固定液;估计的体积的颗粒和附加组件〜10倍的体积的卡诺固定液。
- 添加的细胞悬浮液,逐滴湿,将冰冷的显微镜载玻片上,将载玻片固定在一个〜45°角,将细胞悬浮液,并允许流过的表面的滑动。莱平放在纸巾滑动和洪水的幻灯片,固色剂,在空气中晾干。检查存在的有丝分裂利差用倒置显微镜幻灯片。
3。核糖核酸酶和乙醇脱水
- 将200μl的10微克/毫升核糖核酸酶A(Sigma)的2倍SSC到每张幻灯片孵育在37 和德克,C 1小时。
- 洗涤滑动3次,用2×SSC,每次3分钟,在室温下的pH值为7.0。
- 通过乙醇(Sigma)的系列(70%,90%和100%),在室温下,每次3分钟脱水幻灯片。
- 空气干燥,在室温下滑动。
4。 原位杂交探针鸡尾酒BAC加特定染色体着丝粒的计数探针(CEP)或整条染色体涂料的制备
- 对于BAC / CEP同时杂交预杂交,准备两个单独的探头鸡尾酒。我们已经发现,预杂交BAC和CEP探针分别根据不同的严谨的查询结果在以下的背景和更大的信号强度。我们还发现,也可以用来代替BAC克隆个别F粘粒。下面的鸡尾酒配方代表一个单一的幻灯片的体积。如果处理多张幻灯片使用相同的探头简单地增加销量appropr iately。
* BAC DNA探针鸡尾酒:
11.5微升杂交缓冲液(50%甲酰胺(Sigma公司)/ 2个SSC /硫酸葡聚糖(Sigma公司))2μL蒸馏水2 O
2.5微升BAC/Cot1 DNA在DH 2 O(见下面的标签协议)总体积15μL
* CEP探头鸡尾酒:
7微升CEP杂交缓冲液(65%Formamide/2x SSC /葡聚糖硫酸酯)2微升DH 2 O
1的微升CEP/Cot1 DNA(与频谱Orange/Cy3/Texas红prelabeled购买)10μl总体积
*在变性和预杂交(5.1)混合BAC探针与CEP探头在3:2的比例25μL/幻灯片和混合探针鸡尾酒。
或
- 等分试样20微升/滑动的的全染色体涂料探针(Cy3/Texas红色)成管。继续变性和预杂交步骤。
- 变性探针鸡尾酒(s)在75℃下 10分钟。预杂交在37℃下30分钟,以允许Cot1的DNA重复序列的杂交,以防止随后的杂交到中期染色体。
- 变性幻灯片科普林氏罐子在70%Formamide/2x SSC,pH值7.0在72°C,持续3分钟。
- 立即脱水幻灯片通过科普林氏罐子中的乙醇系列(70%,90%和100%),在4℃下,每次3分钟。
- 允许的幻灯片空气干燥,在室温下。
- 预暖的幻灯片至45℃,幻灯片上的探针的预杂交(步骤5.1)的最后10分钟的温暖。如果需要预杂交探针鸡尾酒混合,并加入25微升到每张幻灯片,轻轻将每张幻灯片上,并沿边缘用橡皮泥密封盖玻片。在37℃下孵育过夜,在潮湿的腔室,以防止蒸发。
6。发表杂交洗
- 洗净滑动科普林氏罐3次,每次3分钟,在38-40℃下在pH值为7.0×SSC,50%formamide/2x。的洗涤液的温度,可能会发生变化的探针之间。如果有高背景杂交可以增加的洗涤液的温度。反之,如果信号微弱,没有任何背景,那么你可以减少这些清洗的温度。
- 洗幻灯片1 PN缓冲的时间,在室温下 3分钟,然后继续的BrdU检测步骤。
7。的BrdU检测
- 封锁PNM缓冲液在室温下在黑暗中10分钟(200微升/幻灯片)的幻灯片。
- 排水幻灯片,打开边缘,在纸巾上。加入100微升抗BrdU-FITC(50μg/ ml的罗氏或Millipore)在PNM缓冲液30分钟,在37℃下。
- 洗净幻灯片PN缓冲液中,在室温下的3次,每次3分钟。
- 排水过剩的PN缓冲滑动打开边缘纸巾上的时间。加入20μlDAPI /的抗褪色安装的解决方案(Invitrogen公司)。 量的幻灯片用纸巾摁倒在盖玻片给逼出来的气泡和多余的安装解决方案。进行图像分析。
8。捕捉图像和量化BrdU掺入
- 与奥林巴斯BX61荧光显微镜和CCD相机奥林巴斯100倍的目标,自动过滤器轮和“Cytovision软件(应用影像)拍摄的图像。尿嘧啶被捕捉使用的FITC过滤器;染色体油漆(德克萨斯红,Metasystems或Cytocell)的,BAC的(Cy3标记)和CEP(Vysis频谱橙色)探头被捕获使用一个得克萨斯州红或Cy3的过滤器; DAPI被抓获一个DAPI过滤器(见图2和图3)。
- 个人感兴趣的染色体识别中的BAC / CEP或染色体特异性漆探针( 图2B和图3B)。利用Cytovision软件,感兴趣的每个染色体是“切出”作为一个整体从中期扩展,一条线绘制通过沿其长度从短臂的染色体长臂( 图2C和3C)。 Cytovision软件用于沿每个染色体的长度,以量化的像素强度的档案。 Cytovision软件计算的象素所占用的面积,和量化的BrdU或DAPI每个隔离染色体上的信号表示的像素的强度。的那些像素所占据的面积,以获得总的像素数( 表1和图4),然后乘以每个染色体所表示的平均像素强度。此外,该协议允许最新的复制的染色体区域的可视化。因此,条带状图案的BrdU掺入允许用于检测染色体积极复制区域,并且在复制中的定时的差异之间彩色石印青梅对被视为在此带型( 图2和图3)的差异。最后,在结合模式的这些差异可以比已知的每个染色体6,7,它允许对同源染色体或染色体臂4之间的定时差的估计值的复制的复制时间地图。例如,两个染色体6的在图3A中显示的差> 2小时的带型时相比,第6号染色体4正常的复制定时。
此外,此处所述的相似的方法已被成功地用于研究的异步复制定时之间的无效和有效的X染色体8,9。确定了使用X染色体涂料的活性和失活的X染色体。画像购入使用QUIPS mFISH软件(Vysis),和X染色体所占据的像素的数目和由荧光拉占用的像素的数目与等量的BrdU,然后计算使用NIH图像( http://rsb.info.nih.gov/nih-image/index.html )的。
9。尼克翻译BAC DNA荧光标记(Vysis)
- 下面的探针混合物冷却微型离心管:
70微升(4微克DNA)在卫生署2 O
10微升0.2毫米的dUTP,橙色或绿色
20微升0.1毫米dTTP的
20微升10倍尼克翻译缓冲液
40微升NT的dNTP(减dTTP的)
40微升的缺口转换酶
总体积200μL
孵育@ 16°CO / N。停止在70℃下加热反应10分钟。冰上冷却5分钟。 - 通过添加以下的探针混合物,用乙醇沉淀DNA:
200μL的探测解决方案
48微升3 M醋酸钠
160,微升Cot1DNA(0.25微克/ UL)
1200μL100%的乙醇 - 储存在-80℃下为10分钟到O / N。
- 自旋IŇ冷以12,000 xg离心20分钟。倾出乙醇。清洗1次,用70%的乙醇。旋前。倾出乙醇。空气干燥,直至乙醇蒸发。重悬在40μl的蒸馏水2 O的100纳克/微升的BAC DNA的最终浓度。
结果
人染色体6的复制定时分析的一个例子示出在图2中。细胞中含有ASAR6基因4,位于6q16.1删除,被暴露5小时的BrdU的有丝分裂细胞,收获和加工FISH染色体6油漆探针(Vysis)和BrdU掺入。请注意,有是一个显著差的的BrdU条带图案的2 6的之间,这是与一个延迟复制定时> 2小时中的染色体6的[见4的复制定时绑扎6号染色体模式之一相一致之前删除。此外,有一个显着差异时BrdU掺入(像素)的总量相比,一个类似的分析的DAPI染色( 图2D)。
复制时序分析人染色体6的另一个例子是在图3中所示。细胞中含有的sam4所示,当图2中被暴露到的BrdU 5小时,有丝分裂细胞的收获和加工FISH染色体6 CEP探针加上含有ASAR6基因的BAC和BrdU掺入ASAR6基因的Ê删除的。请注意,删除第6号染色体(Δ6)显示更多BrdU掺入和更广泛的BrdU掺入比非删除第6号染色体带型。如在图3中,并进行处理,从7种不同的细胞的有丝分裂利差DAPI和BrdU的像素的配置文件被示于表1。

图1。尿嘧啶,端子标签计划。最后为8至10小时,和G2在哺乳动物细胞中的一个典型的S期通常是2至5小时。添加增加的时间段(绿色箭头)标记染色体复制的最后部的BrdU。钍Ê在哺乳动物细胞中的染色体复制根据时间的程序,与早期和晚期的复制发生在S期的开始和结束,分别为(黑线)。发生在S期(蓝线)下半年与广大的DNA合成,失活的X染色体在复制时间延迟。复制时间延迟染色体中的DNA合成的起始和结束的延迟,主动复制持续通过G2(红线)。异步文化的收获细胞有丝分裂和BrdU掺入和FISH处理。
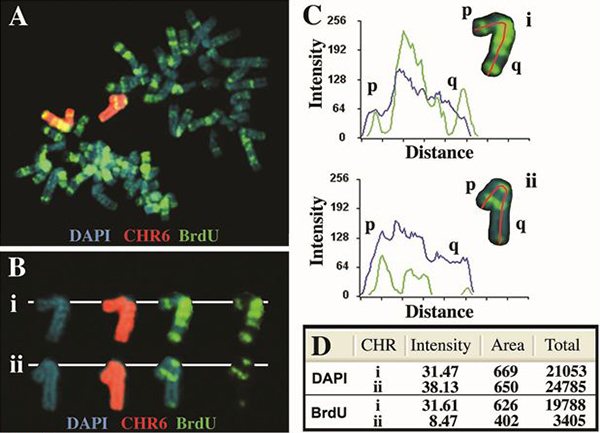
图2。人类第6号染色体的异步复制。细胞中含有一个精心设计的删除的ASAR6基因4用BrdU处理5小时,收获的细胞有丝分裂和BrdU掺入和FISH使用铬处理 osome涂料作为探针。将DNA用DAPI染色(蓝色)。 A)包含一个典型的“杀鸡取卵”的格局BrdU掺入(绿色),有丝分裂扩散。 6号染色体涂料探针杂交的两个6号染色体的(红色),在该单元格中。 B)的两个染色体6(ⅰ和ⅱ)的“切出”和显示与三个分离成不同的图像的荧光标记。 C)6号染色体的使用的Cytovision的软件和两个DAPI(蓝色)和BrdU(绿色)示出的信号强度分布的分析。红线表示使用的路径,从短臂(P)的长臂(Q)为BrdU和DAPI的量化。距离是指从短臂(对),每个染色体长臂(q)在像素为单位的长度。 D)DAPI和BrdU荧光的总信号的量化。的总的值表示的区域所代表的那些像素的平均像素强度乘以。
IGURE 3“SRC =”/ files/ftp_upload/4400/4400fig3.jpg“/>
图3:延迟复制的人类第6号染色体的缺失ASAR6。细胞中含有一个精心设计的删除的ASAR6基因4,用BrdU处理5小时,有丝分裂细胞的收获和加工BrdU掺入和FISH使用6号染色体的CEP加含有ASAR6基因为探针的BAC。将DNA用DAPI染色(蓝色)。 A)包含一个典型的“杀鸡取卵”的格局BrdU掺入(绿色),有丝分裂扩散。 6号染色体的CEP探针杂交的两个6号染色体(大红色着丝粒信号),和BAC杂交到一个单一的染色体6(长臂上的红色的小信号),在该单元格中。注意中BrdU两个6的条带图案之间的差别。 B)删除的染色体6表示由Δ6和非删除的6×6。两个6“切出”的三个荧光标记分隔成不同的图像显示。 C)T他6号染色体的分析使用的Cytovision的软件和两个DAPI(蓝色)和BrdU(绿色)示出的信号强度分布。红线表示使用的路径,从短臂(P)的长臂(Q)为BrdU和DAPI的量化。距离是指从短臂(对),每个染色体长臂(q)在像素为单位的长度。 D)DAPI和BrdU荧光的总信号的量化。的总的值表示的区域所代表的那些像素的平均像素强度乘以。
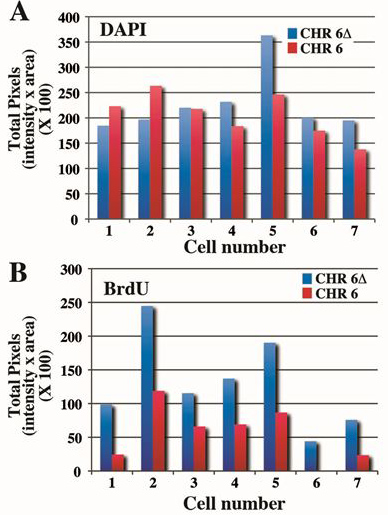
图4。量化的6号染色体的复制之间的时间差。细胞中含有一个精心设计的删除的ASAR6基因4用BrdU处理5小时,有丝分裂细胞的收获和加工BrdU掺入和FISH使用6号染色体的CEP探头加上一个BAC含有探头的ASAR6基因。有丝分裂的价差进行处理如在图3中示出7种不同的细胞的值( 见表1)。 A)的DAPI染色进行了量化和对每个小区的总像素数的显示。请注意,只有约10%至20%相同的细胞内染色体之间的差异。 B)的BrdU掺入从上述B组相同的染色体进行了量化,。请注意,有>删除和非删除的第6号染色体之间的总的像素值的2倍的差异。
讨论
染色体利差的准备是成功的复制时序分析的关键步骤这里描述。列入的秋水仙胺预处理步骤之前,低渗处理可能有助于在频率和扩频的有丝分裂细胞。我们通常会公开细胞,以colcemdi的1-3小时收获前,和使用秋水仙碱,终浓度为10微克/毫升。然而,列入秋水仙碱预处理步骤可能会改变G2的长度,因此可能会改变明显凝结染色体的复制时间和状态。
此过程可以应用到许多不同的细胞类型和种类的变化,这依赖于细胞周期的持续时间的长度的BrdU孵育。对于人类和小鼠细胞系,G2期通常是3-6小时,因此,通常在此范围内的BrdU治疗。的另一种方法的BrdU是5 - 乙炔基-'脱氧尿苷(EDU)及其随后的检测方法荧光叠氮化物和“点击化学”反应10。 EDU检测方案的BrdU检测方案有几个优点。例如,埃杜的检测并不需要:的样品固定或DNA变性。因此,可以结合使用EDU驴复制定时简单的G-带代替的FISH技术来识别感兴趣的染色体。
此处描述的复制定时协议是专门设计来测定晚S相加任何进入G2延伸的DNA合成。此外,DNA的复制可以整个S期使用此过程中,通过使用短(15-30分钟)的BrdU脉冲其次由相对长的追逐6-10小时期间进行监测。这允许在早期和中期的S相的BrdU掺入的可视化。例如,某些肿瘤衍生的染色体重排中的DNA合成的起始和结束的两个沿其整个长度的染色体3延迟。
本复制时间过程中的一大优势是,它检测单个细胞中的复制时间。因此,它具有能够检测到在复制包含在同一小区内的同源染色体之间的定时差异。虽然有其他程序, 例如 。复制原位杂交定时(ReTiSH 11),检测在复制定时同源染色体上的特定位点的等位基因之间的差异时,有能力,这里所描述的过程可以检测在沿其整个长度的染色体的复制定时的差异。此外,此过程可以测定本在人口3只有一小部分的细胞中的染色体的复制定时差异。例如,许多肿瘤细胞系和原发肿瘤样本中含有小于50%的细胞是存在于染色体重排。目前,我们正在使用此程序检测染色体在原发肿瘤样本,并已能检测多个样本的染色体之间的异步复制。然而,由于原发肿瘤样本数量是有限的,核分裂象,约三分之一的原代培养没有给予足够数量的有丝分裂利差。
拥有超过芯片或测序为基础的检测,这个过程的另一个优点是,个别染色体的检测,而不是从存储池中的细胞免疫沉淀的DNA。在免疫沉淀实验为基础的检测多态性必须被识别和链接到特定的等位基因,以区分复制等位基因之间的定时。
此外,认识到,许多癌症细胞中含有众多的染色体重排12,并观察,DNA复制的应力与在肿瘤细胞中的基因组不稳定性13,我们认为,该协议是一个有用的和简单的工具,f或在肿瘤细胞中的染色体的复制定时的常规分析。
披露声明
没有利益冲突的声明。
致谢
这项工作是支持的,CA131967美国国家癌症研究所的资助。
材料
| Name | Company | Catalog Number | Comments |
| 试剂名称 | 公司 | 目录编号 | 评论(可选) |
| 抗BrdU-FITC | 罗氏微孔 | 11202593001 MAB326F | 50微克/微升 |
| 尼克翻译工具包 | 雅培分子(Vysis) | 07J00-0001 | |
| 频谱橙色的dUTP | 雅培分子(Vysis) | 02N33-050 | |
| CEP | 雅培分子(Vysis) | 而异 | |
| LSI / WCP杂交的缓冲区 | 雅培分子(Vysis) | 06J67-011 | |
| CEP杂交缓冲液 | 雅培分子(Vysis) | 07J36-001 | |
| 染色体排新界南总区 | MetaSystems集团 | D-14NN-050-TR | |
| 奥林巴斯BX61荧光显微镜 | 奥林巴斯 | BX61TRF-1-5 | |
| 显微镜成像软件系统 | 应用成像 | Cytovision 3.93.1 | |
| 数码相机 | 奥林巴斯 | UCMAD3 | |
原位杂交食谱 35毫升甲酰胺(Sigma公司) *重要的是使用甲酰胺已被存储于-20℃下长时间室温下存放会产生甲酸和PH W生病太低。 50%Formamide/2x SSC 25毫升甲酰胺(Sigma)的 20×SSC,4 L 702克氯化钠(Sigma公司) PN缓冲区[0.1中号NaP0 4 0.1%NP_40(Sigma公司)] 请的0.1M溶液每个磷酸钠(过滤器消毒和储存在500毫升的等分试样)。 的0.1M的NaH 2 PO 4,1升 13.8克的NaH 2 PO 4(Sigma公司): 0.1 M的NaH 2 PO 4 1大号 14.2克的NaH 2 PO 4(Sigma公司) PN:0.1 M的pH值调整的Na 2 HPO 4 pH值至8.0 .1 M的NaH 2 PO 4。过滤消毒,加1毫升的NP-40。 PNM50毫升 1.25克非脂肪干奶(Sigma)的 混合15-20分钟,并不断搅拌。附带的2倍,在400×g离心10分钟。使用上清,确保不打扰沉淀牛奶中的蛋白质。 |
参考文献
- Payer, B., Lee, J. T. X chromosome dosage compensation: how mammals keep the balance. Annu. Rev. Genet. 42, 733-772 (2008).
- Breger, K. S., Smith, L., Turker, M. S., Thayer, M. J. Ionizing radiation induces frequent translocations with delayed replication and condensation. Cancer Research. 64, 8231-8238 (2004).
- Smith, L., Plug, A., Thayer, M. Delayed Replication Timing Leads to Delayed Mitotic Chromosome Condensation and Chromosomal Instability of Chromosome Translocations. Proc. Natl. Acad. Sci. U.S.A. 98, 13300-13305 (2001).
- Stoffregen, E. P., Donley, N., Stauffer, D., Smith, L., Thayer, M. J. An autosomal locus that controls chromosome-wide replication timing and mono-allelicexpression. Hum. Mol. Genet. 20, 2366-2378 (2011).
- Breger, K. S., Smith, L., Thayer, M. J. Engineering translocations with delayed replication: evidence for cis control of chromosome replication timing. Hum. Mol. Genet. 14, 2813-2827 (2005).
- Camargo, M., Cervenka, J. Patterns of DNA replication of human chromosomes. II. Replication map and replication model. Am. J. Hum. Genet. 34, 757-780 (1982).
- Cohen, S. M., Cobb, E. R., Cordeiro-Stone, M., Kaufman, D. G. Identification of chromosomal bands replicating early in the S phase of normal human fibroblasts. Exp. Cell Res. 245 (98), 321-329 (1998).
- Diaz-Perez, S., et al. The element(s) at the nontranscribed Xist locus of the active X chromosome controls chromosomal replication timing in the mouse. Genetics. 171, 663-672 (2005).
- Diaz-Perez, S. V., et al. A deletion at the mouse Xist gene exposes trans-effects that alter the heterochromatin of the inactive X chromosome and the replication time and DNA stability of both X chromosomes. Genetics. 174, 1115-1133 (2006).
- Salic, A., Mitchison, T. J. A chemical method for fast and sensitive detection of DNA synthesis in vivo. Proc. Natl. Acad. Sci. U.S.A. 105, 2415-2420 (2008).
- Schlesinger, S., Selig, S., Bergman, Y., Cedar, H. Allelic inactivation of rDNA loci. Genes Dev. 23, 2437-2447 (2009).
- Mitelman Database of Chromosome Aberrations in Cancer. , Available from: http://cgap.nci.nih.gov/Chromosomes/Mitelman (2006).
- Branzei, D., Foiani, M. The checkpoint response to replication stress. DNA Repair (Amst). 8, 1038-1046 (2009).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。