Method Article
형광등과 결합 염색체 복제 타이밍
요약
염색체 복제 타이밍 분석을위한 정량 방법 설명되어 있습니다. 방법은 형광와 함께 BrdU의 설립을 활용 현장에서 포유류의 염색체 복제 타이밍을 평가하는 하이브리드 (물고기). 이 기술은 동일한 세포 내에서 재 배열 및 취소 - 재 배열 염색체의 직접적인 비교를 할 수 있습니다.
초록
포유류의 DNA 복제는 일시적 복제 프로그램에 따라, S 단계 동안 다른 시간에 염색체를 따라 여러 사이트에서 시작합니다. 복제 타이밍 사양은 epigenetic 수정에 대한 반응 조직 별 및 발달 신호에 의해 규제 동적 과정이라고 생각합니다. 그러나, 어디에서 DNA 복제가 염색체 함께 시작하면 규제 메커니즘을 제대로 이해 남아 있습니다. 상동 염색체는 보통 그러나이 규칙에 중요한 예외가 있습니다, 동기식 복제합니다. 예를 들어, 여성 포유류의 세포에 두 개의 X 염색체 중 하나는 X의 불 활성화 1로 알려진 과정을 통해 늦은 복제됩니다. 2-3 시간이 될 것으로 추정 복제 타이밍,이 지연과 함께 유전자의 대부분은 transcriptionally 한 X 염색체에 침묵된다. 또한, X의 불 활성화 센터로 알려진 이산 시스 - 연기의 궤적은, 일 포함하여이 X의 불 활성화 과정을 조절전체 비활성 X 염색체에 지연 복제 타이밍의 전자 유도. 또한, 암 세포와 세포에서 발견 특정 염색체 rearrangements는 전체 염색체에게 2,3에 영향을 미치는> 3시간 그 복제 타이밍에 상당한 지연을 표시 이온화 방사선에 노출. 우리 연구실의 최근 작품은 이산의 중단 시스 - 행동의 전체 염색체 (4)에 영향을 미치는 매우 늦은 복제 표현형에 염색체 loci 결과를 나타냅니다. 추가 '염색체 공학'연구는 포유류의 염색체는 각 염색체의 적절한 복제 타이밍 5 제어 이산 시스 - 행동 loci가 포함되어 있다는 제안이 이상 복제 - 타이밍 표현형의 다양한 염색체 결과에 영향을 미치는 특정 염색체 rearrangements를 나타냅니다.
여기, 우리는 현장 하이브리드 화에 형광과 결합 염색체 복제 타이밍의 정량 분석하는 방법을 제시한다. 이방법은 동일한 세포 내에서 상동 염색체 간의 복제 타이밍의 직접 비교를 허용, 6에서 적응되었습니다. 또한,이 방법은 전체 염색체에 영향을 복제 타이밍의 변화와 연관 염색체 rearrangements의 모호 식별 할 수 있습니다. 이 방법은 최근에 개발 된 높은 처리량 마이크로 어레이 이상 또는 재 배열 및 염색체를 취소 뜯어을 제시 상동 대립 유전자를 구별 할 수 없습니다 프로토콜을 시퀀싱 장점이 있습니다. 여기에 설명 된 방법은 하나의 셀을 평가하기 때문에 또한, 그것은 인구의 셀의 일부만에 존재하는 염색체 rearrangements의 염색체 복제 타이밍의 변화를 감지 할 수 있습니다.
프로토콜
1. BrdU의 설립 (터미널 라벨링)
- 이전 BrdU의 추가로 150mm 조직 문화 요리 24 시간에 약 70 %의 합류로 플레이트 세포.
- 전에 수확에 적합한 시간 지점에서 20 μg / ML BrdU (시그마)를 포함하는 신선한 완벽한 미디어와 미디어를 대체합니다. 시간이 세포의 길이는 BrdU는 일반적으로 G2 단계는 시간 (그림 1) 2 사이 5 정도, 세포 유형 및 종과 다를 수있는 미디어에 배양되어 있습니다.
2. Monolayer 셀 문화의 염색체 수확
- 접시에서 문화 미디어를 제거하고 15 ML 원뿔 원심 분리기 튜브 10 ML를 수집합니다. 나머지 미디어를 폐기하십시오.
- 10 ML Versine [또는 HBSS (시그마)]로 한 번 세포를 씻어.
- 접시에 Versine (또는 HBSS)의 5 ML 0.25 % 트립신을 추가합니다. 세포 판에서 분리 될 때까지 실온에서 알을 품다.
- 단계 2.1에서 미디어 10 ML을 포함하는 튜브에 trypsinized 세포 현탁액을 추가합니다.
- 펠렛 셀에 10 분 400 XG에 원심 분리기. 0.5 미디어 ML 플러스 세포 펠렛을두고, 표면에 뜨는을 대기음.
- 파스퇴르 피펫으로 pipetting하여 철저하게 세포를 Resuspend.
- hypotonic 솔루션 3 물방울 추가 (를 0.075 M KCl (시그마)는 37 예열 ° C), 파스퇴르 (Pasteur) 피펫으로 세포 현탁액을 섞는다. 0.5 ML hypotonic 솔루션을 추가하고 파스퇴르 피펫로 다시 섞는다. 5 ML에 hypotonic 솔루션의 볼륨을 데려와 다시 한 번 섞는다. 세포 유형에 따라 20-45 분에 대해 37 ° C에서 알을 품다.
- 10 분 400 XG에 원심 분리기. 0.5 미디어 ML 플러스 세포 펠렛을두고, 표면에 뜨는을 대기음.
- 부드럽게 튜브를 flicking하여 세포 펠렛을 Resuspend. osmotically 부어 셀은이 시점에서 연약하므로주의가 세포질 세포막을 방해하지 않도록해야합니다.
- 부드럽게 파스퇴르 (Pasteur) pipett로 pipetting하여 혼합; Carnoy의 정착액 (메탄올 1시 3분 빙하 아세트산) 3 방울을 추가5. 부드럽게 파스퇴르 피펫으로 pipetting하여 0.5 ML의 정착액 및 혼합을 추가합니다. 정착액의 용적 (5) ML로 준비하고 부드럽게 파스퇴르 피펫으로 pipetting하여 다시 섞는다. 고정 셀은 몇 개월 -20 ° C에서 어둠 속에서 저장 될 수 있습니다.
- 원심 분리기 및 단계 2.8에서와 같이 대기음.
- 신선한 정착액에 세포 펠렛을 Resuspend, 펠릿 및 추가 ~ 10 배 Carnoy의 정착액의 볼륨의 볼륨을 예상하고 있습니다.
- 세포 현탁액 서부 유럽 표준시, 얼음처럼 차가운 현미경 슬라이드에 드롭 현명한을 추가, ~ 45 ° 각도로 슬라이드를 누른 상태에서 슬라이드의 표면 흐름에 세포 현탁액 할 수 있습니다. 종이 수건에 평면 슬라이드와 홍수 정착액으로 슬라이드를 마련하고 건조한 공기 할 수 있습니다. 역 현미경을 사용하여 mitotic 확산의 존재에 대한 슬라이드를 선택합니다.
3. RNase 처리 및 에탄올 탈수
- 10 μg / 각 슬라이드에 2 배 SSC의 ML RNase A (시그마)의 장소 200 μl, 37 & 드에 품다g, C 1 시간을위한.
- 워시 배 SSC, 3 분 각각에 대해 실온에서 pH를 7.0로 3 회를 슬라이드.
- 3 분 각 객실 온도에서 EtOH (시그마) 시리즈 (70 %, 90 % 및 100 %)을 통해 슬라이드를 탈수.
- 공기는 상온에서 슬라이드를 건조.
4. 현장 하이브리드 화에 BAC 플러스 염색체 특정 Centromere 열거 프로브 (CEP) 또는 전체 염색체 페인트 용 프로브 칵테일의 작성
- BAC / CEP 동시 하이브리드를 들어, 사전 하이브 리다이 제이션에 대한 두 개의 프로브 칵테일을 준비합니다. 우리는 적은 배경과 큰 신호 강도에 다른 stringencies 결과에 따라 개별적으로 BAC와 CEP 프로브를 사전 hybridizing 것으로 나타났습니다. 우리는 또한 개인 Fosmids는 BAC 클론 대신에 또한 사용될 수 있다는 것을 발견했습니다. 아래에 설명 된 칵테일 제제는 단일 슬라이드의 볼륨을 나타냅니다. 동일한 프로브를 사용하여 여러 슬라이드를 처리하는 경우 단순히 볼륨 appropr을 증가 취미가 생겼다.
* BAC DNA 프로브 칵테일 :
11.5 μl 하이브 리다이 제이션 버퍼 (50 % 포름 아미드 (시그마) / 배 SSC / Dextran 황산 (시그마)) 2 μl DH 2 O
DH 2 O의 2.5 μl BAC/Cot1 DNA (프로토콜 라벨은 아래를 참조) 15 μl 총 볼륨
* CEP 프로브 칵테일 :
7 μl CEP의 하이브 리다이 제이션 버퍼 (65 % Formamide/2x SSC / Dextran 황산) 2 μl DH 2 O
1 μl CEP/Cot1의 DNA (스펙트럼 Orange/Cy3/Texas 레드와 prelabeled 구입) 10 μl 총 볼륨
* 3시 2분 비율 25 μl / 슬라이드 및 혼합 프로브 칵테일에서 CEP 프로브와 함께 혼합 BAC 프로브를 denaturing 및 사전 하이브리드 (단계 5.1) 후.
OR
- 나누어지는 20 μl / 튜브에 전체 염색체 페인트 프로브 (Cy3/Texas 레드)의 슬라이드. 변성 및 사전 하이브 리다이 제이션 단계로 진행합니다.
- 75 변성 프로브 칵테일 (들) ° 10 분에 C. Cot1 DNA는 반복적 인 시퀀스에 잡종을 만들다하고 염색체를 metaphase하기 위해 후속 하이브리드을 방지 할 수 있도록 30 분에 37 ° C에서 프리 잡종을 만들다.
- 3 분 72시 70% Formamide/2x SSC, pH를 7.0 ° C의 Coplin 병에서 변성 슬라이드.
- 바로 3 분 각각에 대해 4에 Coplin 병에 EtOH 시리즈 (70 %, 90 % 및 100 %) ° C를 통해 슬라이드를 탈수.
- 슬라이드가 실온에서 건조한 공기 할 수 있습니다.
- 45 미리 따뜻한 슬라이드 ° C 프로브 사전 hybridzation (단계 5.1)의 마지막 10 분을위한 따뜻한 슬라이드. 필요한 경우 사전 hybridized 프로브 칵테일을 섞어서 각 슬라이드 25 UL를 추가, 부드럽게 고무 시멘트로 모든 가장자리를 따라 각 슬라이드과 인감에 coverslip를 놓습니다. 증발을 방지하기 위해 humidified 챔버에 37 ° C에서 하루 아침에 품다.
6. 게시물 하이브리드는 목욕 용품
- 3 분마다 38-40 ° C 50 % formamide/2x SSC, 산도 7.0에서 Coplin 병 3 회에 슬라이드를 씻으십시오. 세차의 온도는 프로브 사이에 다를 수 있습니다. 고 배경 하이브리드가있는 경우 귀하는 세차의 온도를 높일 수 있습니다. 신호가 희미한하고 더 배경이없는 경우 반대로, 다음이 세차의 온도를 줄일 수 있습니다.
- 워시는 상온에서 PN 버퍼 1 시간을 슬라이드 3 분을 위해, 그리고 BrdU 감지 단계로 진행합니다.
7. BrdU 검색
- 어둠 속에서 실온에서 10 분 (200 μl / 슬라이드)에 대한 PNM 버퍼를 차단 슬라이드.
- 종이 타월에 가장자리에 설정하여 슬라이드를 배수한다. 37 30 분에 PNM 버퍼에 방지 BrdU-FITC (50 μg / ML 로슈 또는 Millipore) 100 μl를 추가합니다 ° C.
- 3 분마다 실온에서 PN 버퍼에 슬라이드에게 3 번 씻으십시오.
- 배수에 초과 PN 버퍼는 종이 타월에 에지 기능을 사용하면 한 번에 하나의를 슬라이드. 20 μl DAPI / antifade 장착 솔루션 (Invitrogen)를 추가합니다. 종이 타월로 슬라이드를 커버하고 기포 및 과도한 마운트 솔루션을 강제로 coverslip에 아래로 누르십시오. 이미지 분석을 수행합니다.
8. 이미지를 캡쳐하고 BrdU의 설립을 정량화
- 이미지는 올림푸스 BX61 형광 현미경과 올림푸스 CCD 카메라, 100x 목표, 자동 필터 휠과 Cytovision 소프트웨어 (응용 이미징)을 캡처합니다. BrdU는 FITC 필터 사용하여 캡처되며 염색체 페인트를 (텍사스 빨강, Metasystems 또는 Cytocell), BAC의 (Cy3)와 CEP (Vysis 스펙트럼 오렌지) 프로브는 텍사스 레드, Cy3 필터를 사용하여 캡처되며, DAPI는 DAPI 필터 (참조로 캡처 도 2 및도 3).
- 관심 개별 염색체는 BAC / CEP 또는 염색체 특정 페인트 프로브 (그림 2B와 3B)로 식별됩니다. 활용Cytovision 소프트웨어는 관심의 각 염색체는 전체 metaphase 확산에서 "컷 아웃"입니다, 라인은 긴 팔 (그림 2C와 3C)에 짧은 팔의 염색체의 길이를 따라 통해 그려집니다. Cytovision 소프트웨어는 각 염색체의 길이를 따라 픽셀 강도 프로필을 수량화하는 데 사용됩니다. Cytovision 소프트웨어는 픽셀가 차지하는 영역을 계산하고 각 절연 염색체에있는 BrdU 또는 DAPI 신호로 표시 픽셀의 강도를 단정 지을. 각 염색체로 표현 평균 픽셀 강도 그런 다음 픽셀 (표 1, 그림 4)의 총 수를 얻기 위해 해당 픽셀이 차지하는 영역을 곱한 수 있습니다. 또한이 프로토콜은 염색체의 최신 복제 영역의 시각화 할 수 있습니다. 따라서, BrdU의 설립의 밴드 패턴은 염색체의 적극적 복제 영역의 검출이 가능하고, chromos 간의 복제 타이밍의 차이ome 쌍은이 구간 패턴 (도 2 및도 3)의 차이로 볼 수 있습니다. 마지막으로, 구속력이 패턴에 이러한 차이는 상동 염색체 또는 염색체 팔을 4 ~ 복제 타이밍 차이의 추정을 허용 각 염색체 6,7에 대해 알려진 복제 타이밍지도에 비교할 수 있습니다. 예를 들어, 두 개의 염색체 6 3A는 염색체 6 4의 정상적인 복제 타이밍에 비해> 2 시간의 패턴을 구간에서 차이를 표시 그림에 있어요.
또한, 여기에 설명 된 것과 유사한 절차를 성공적으로 비활성 및 활성 X 염색체 8,9 사이의 비동기 복제 타이밍 연구에 사용되었습니다. 운영 중 및 운영 중지 X 염색체는 X 염색체 페인트를 사용하여 확인 하였다. 이미지는 채우려 mFISH 소프트웨어 (Vysis)와 X 염색체에 의해 점령 픽셀의 수와 휘황 라 차지하는 픽셀 수를 사용하여 획득 한beled BrdU 그 다음 NIH 이미지 (사용하여 계산 된 http://rsb.info.nih.gov/nih-image/index.html을 ).
9. 형광 라벨을위한 BAC DNA의 닉 번역 (Vysis)
- microfuge 관을 차게 다음 프로브 믹스를 추가합니다 :
DH 2 O 70 μl (4 μg의 DNA)
10 μl 0.2 MM dUTP - 오렌지 나 그린
20 μl 0.1 MM dTTP
20 μl 10X 닉 번역 버퍼
40 μl NT dNTP의 (마이너스 dTTP)
40 μl 닉 번역 효소
200 μl 총 볼륨
@ 16 ° 길러 CO / N. 10 분 70시 가열에 의해 반응 ° C를 중지합니다. 5 분을 위해 얼음에 진정. - 프로브 믹스에 다음을 추가하여 에탄올로 DNA를 침전 :
200 μl 프로브 솔루션
48 μl 3 M NaOAc
160 μl Cot1DNA (0.25 μg / UL)
1200 μl 100 % EtOH - O / N. 10 분에 -80 ° C에서 저장
- i를 돌려N 20 분에 12,000 XG에서 추위. EtOH에서 가만히 따르다. 70 % EtOH로 한 시간을 씻으십시오. 이전처럼 봐. EtOH에서 가만히 따르다. 공기가 EtOH이 증발 할 때까지 건조 시키십시오. 100 NG / BAC DNA의 μl의 최종 농도 40 μl DH 2 O에 Resuspend.
결과
인간의 염색체 6의 복제 타이밍 분석의 예는 그림 2에 표시됩니다. 6q16.1에있는 ASAR6 유전자 4의 삭제를 포함하는 셀은 5 시간에 BrdU에 노출 mitotic 세포에 대한 수확 및 염색체 6 페인트 프로브 (Vysis)와 물고기와 BrdU의 설립에 대한 처리되었습니다. 두 6의 사이 BrdU 구간 패턴에 상당한 차이가 있습니다, 이는 이전에 염색체 6의 [표시 4 염색체 6 패턴을 구간 복제 타이밍에 중 하나에 대한> 2 시간의 복제시기에 지연과 일치 삭제]. 또한, DAPI의 얼룩과 비슷한 분석 (그림 2D)에 비해 BrdU의 설립 (픽셀)의 총 금액에 상당한 차이가있다.
인간의 염색체 6의 복제 타이밍 분석의 또 다른 예는 그림 3에 표시됩니다. 샘을 포함하는 셀4 그림 2는 5 시간에 BrdU에 노출 된 경우 mitotic 세포에 대한 수확, 표시 및 염색체 6 CEP 프로브 플러스 ASAR6 유전자를 포함하는 BAC와와 BrdU의 설립을위한 생선 처리 ASAR6 유전자의 전자 삭제. 삭제 된 염색체 6 (Δ6)이 삭제되지 않은 염색체 6보다 더 BrdU의 설립과 BrdU의 설립의 더 확장 된 구간 패턴을 표시합니다. 7 개의 다른 세포의 Mitotic 확산은 그림 3에서와 같이 처리되었으며 DAPI와 BrdU 모두 픽셀 프로파일은 표 1에 표시됩니다.

그림 1. BrdU 터미널 라벨 제도. 8-10 시간 정도, 그리고 G2 포유류의 세포에있는 전형적인 S 단계는 일반적으로 2-5 시간입니다. BrdU는 복제 할 수있는 염색체의 마지막 부분을 라벨을 시간의 기간 (녹색 화살표)를 증가에 추가됩니다. 일포유류의 세포에서 전자 염색체는 초 늦게 복제는 각각 S 단계의 시작과 끝 (검은 선)에서 발생과 시간적 프로그램에 따라 복제합니다. 비활성 X 염색체는 S 상 (파란색 라인)의 하반기 동안 발생하는 DNA 합성의 대부분을 복제 타이밍에 지연됩니다. 지연 복제 타이밍과 염색체가 활성화 복제 G2 (빨간색 선)를 통해 지속적으로 함께 DNA 합성의 개시와 완료에 모두 지연됩니다. 비동기 문화는 mitotic 세포에 대한 수확과 BrdU의 설립과 생선 처리됩니다.
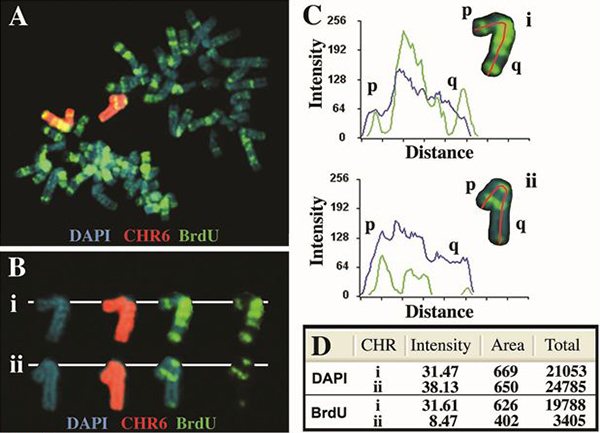
그림 2. 인간의 염색체 6 비동기 복제를 수행합니다. ASAR6 유전자 (4)의 엔지니어링 삭제를 포함하는 셀은 5 시간에 BrdU로 치료 mitotic 세포에 수확하고 chrom를 사용하여 BrdU의 설립과 생선 처리 된 프로브로 osome 6 페인트. DNA는 DAPI (파란색) 물들되었습니다. A) BrdU의 설립 (녹색)의 전형적인 "밴드"패턴을 포함하는 mitotic 확산가 표시됩니다. 염색체 6 페인트 프로브는 두 염색체 6의 (빨간색)이 셀에에 hybridized. B) 두 개의 염색체가 6의 (I 및 II)는 "잘라"와 별개의 이미지로 분리 세 가지 형광 라벨과 함께 표시했다. C) 염색체 6의는 DAPI (파란색)과 BrdU가 (녹색) 표시됩니다 모두 Cytovision 소프트웨어 및 신호 강도 프로필을 사용 분석 하였다. 빨간색 선은 짧은 팔 (P)에서 BrdU와 DAPI 모두의 정량화를위한 긴 팔 (Q)에 사용 된 경로를 나타냅니다. 거리가 짧은 팔 (P)에서 픽셀 긴 팔 (Q) 각 염색체의 길이를 의미합니다. D DAPI와 BrdU 형광 모두 전체 신호의) 정량화. 총 값은 해당 픽셀로 표시 영역을 곱한 평균 픽셀 강도를 나타냅니다.
igure 3 "SRC ="/ files/ftp_upload/4400/4400fig3.jpg "/>
그림 3은. ASAR6의 삭제를 포함하는 인간의 염색체 6 복제를 지연됩니다. ASAR6 유전자 (4)의 엔지니어링 삭제를 포함하는 세포는 mitotic 세포에 대한 수확 및 염색체 6 CEP 플러스 프로브로 ASAR6 유전자를 포함하는 BAC를 사용하여 BrdU의 설립 및 생선 가공, 5 시간에 BrdU로 치료했다. DNA는 DAPI (파란색) 물들되었습니다. A) BrdU의 설립 (녹색)의 전형적인 "밴드"패턴을 포함하는 mitotic 확산가 표시됩니다. 염색체 6 CEP 프로브는 두 염색체 6의 (대형 빨간색 centromeric 신호)에 hybridized하고, BAC는이 셀에 하나의 염색체 6 (긴 팔에 빨간색의 작은 신호)에 hybridized. 두 6의 사이 BrdU 구간 패턴의 차이를 확인합니다. B) 삭제 된 염색체 6 6 Δ6과 삭제되지 않은 6으로 표시됩니다. 두 6의는 "잘라"와 별개의 이미지로 분리 세 가지 형광 라벨과 함께 표시했다. C) T그는 염색체 6의는 DAPI (파란색)과 BrdU가 (녹색) 표시됩니다 모두 Cytovision 소프트웨어 및 신호 강도 프로필을 사용 분석 하였다. 빨간색 선은 짧은 팔 (P)에서 BrdU와 DAPI 모두의 정량화를위한 긴 팔 (Q)에 사용 된 경로를 나타냅니다. 거리가 짧은 팔 (P)에서 픽셀 긴 팔 (Q) 각 염색체의 길이를 의미합니다. D DAPI와 BrdU 형광 모두 전체 신호의) 정량화. 총 값은 해당 픽셀로 표시 영역을 곱한 평균 픽셀 강도를 나타냅니다.
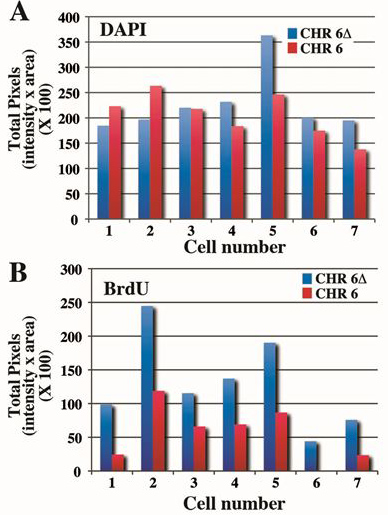
그림 4. 염색체 6의 사이의 복제 타이밍 차이 정량화. ASAR6 유전자 (4)의 엔지니어링 삭제를 포함하는 셀은 5 시간에 BrdU로 치료 mitotic 세포에 대한 수확 및 염색체 6 CEP 프로브 플러스를 사용하여 BrdU의 설립과 생선 처리 된BAC는 프로브로 ASAR6 유전자를 포함. Mitotic 확산은 그림 3에서와 같이 처리되었으며 7 개의 셀에 대한 값은 (표 1 참조) 표시됩니다. A) DAPI의 얼룩은 정량되었으며 픽셀의 총 개수는 각 셀에 대해 표시됩니다. 같은 세포 내에서 염색체 사이 ~ 10~20% 차이가 있습니다. B) BrdU의 설립은 위의 패널 B와 같은 염색체에서 정량되었다. 삭제 삭제되지 않은 염색체 6의에 대한 총 픽셀 값 사이> 2 배 차이가 있습니다.
토론
염색체 확산의 준비는 여기에 설명 된 성공적인 복제 - 타이밍 분석을위한 중요한 단계입니다. hypotonic 치료 전에 colcemid 전처리 단계의 포함은 주파수와 mitotic 세포의 확산에 도움 될 수 있습니다. 우리는 일반적으로 수확하기 전에 1-3 시간에 colcemdi에 세포를 노출, 10 UG / ML의 최종 농도에 colcemid 사용합니다. 그러나, colcemid 전처리 단계의 포함은 G2의 길이를 변경할 수 있으며, 그 결과 염색체 3 응축의 명백한 복제 타이밍 및 상태를 변경할 수 있습니다.
이 절차는 세포주기 기간에 따라 달라집니다 BrdU의 부화의 길이를 다양하여 여러 가지 세포 유형과 종에 적용 할 수 있습니다. 대부분의 인간 및 마우스 세포 라인은 G2 단계는 일반적으로 3-6 시간이므로 BrdU 트리트먼트는이 범위에 일반적으로있다. BrdU에 대한 대안은 5 ethynyl - 2'deoxyuridine (에듀) 및 사용하여 후속 검색입니다형광 azide와 "클릭 화학 '반응 10. EDU 검출 방식은 BrdU 검출 방식 이상의 몇 가지 장점이 있습니다. 예를 들어, 에듀의 감지 샘플 고정 또는 DNA의 변성을 필요로하지 않습니다. 따라서, 엉덩이 복제 타이밍에 에듀의 사용은 관심의 염색체를 확인하는 대신 물고기의 간단한 G-구간 기술과 결합 할 수 있습니다.
여기에 설명 된 복제 타이밍 프로토콜은 특별히 S 검정 후기 플러스 G2로 연장하는 DNA 합성에 설계되어 있습니다. 또한, DNA 복제는 6-10 시간의 비교적 긴 추적 기간에 이어 BrdU의 짧은 (15-30 분) 펄스를 사용하여이 절차를 사용하여 S 단계에 걸쳐 모니터링 할 수 있습니다. 이 초기 S 상 중간 모두에서 BrdU의 설립의 시각화 할 수 있습니다. 예를 들어, 특정 종양 파생 염색체 rearrangements는 염색체 (3)의 전체 길이를 따라 DNA 합성의 개시와 완료에 모두 지연됩니다 를 논의하게 될 것입니다.
이 복제 타이밍 절차 중 하나 장점은 개별 셀에 해당이 assays 복제 타이밍입니다. 따라서 동일한 셀에 포함 된 상동 염색체 간의 복제 타이밍의 차이를 감지 할 수있는 능력이 있습니다. 다른 절차가 있지만, 예. 현장 하이브리드 화에 복제 타이밍 (ReTiSH, 11) 상동 염색체에서 특정 loci에서 대립 유전자 간의 복제 타이밍의 차이를 감지 할 수있는 능력을 가지고 여기에 설명 된 절차는 염색체의 전체 길이를 따라 복제 타이밍의 차이를 감지 할 수 있습니다. 또한이 절차는 인구 3 셀의 일부만에 존재하는 염색체의 복제 타이밍에 검정 차이가 할 수 있습니다. 예를 들어 많은 암 세포 라인과 기본 종양 샘플 세포의 50 % 미만에 존재하는 염색체 rearrangements가 포함되어 있습니다. 현재 검정 염색체에이 절차를 사용하는차 종양 샘플에서 여러 샘플의 염색체 사이에 비동기 복제를 감지 할 수있었습니다. 그러나, 주요 문화 중 하나에 대한 세번째는 mitotic 확산의 충분한 숫자를 제공하는 데 실패, 기본 종양 샘플 mitotic 수치의 제한된 번호가 점을 감안할 때.
이 절차는 microarray를 통해 또는 기반 assays 순서를 가지고 또 다른 장점은 각각의 염색체는 오히려 세포의 수영장에서 immunoprecipitated DNA보다 assayed된다는 것입니다. 대립 유전자 사이의 복제 시간을 구별하기 위해 immunoprecipitation 기반 assays에 polymorphisms이 식별해야하며 특정 대립 유전자에 연결.
또한, 많은 암 세포가 많은 염색체 rearrangements 12, 및 DNA 복제 스트레스가 암 세포 13 게놈 불안정성과 연결되어 관찰을 포함하는 인식과 함께, 우리는이 프로토콜은 유용하고 간단한 도구 (F)이라고 생각합니다암 세포의 염색체의 복제 타이밍이나 일상 분석.
공개
관심 없음 충돌이 선언 없습니다.
감사의 말
이 작품은 국립 암 연구소, CA131967의 교부금에 의해 지원되었다.
자료
| Name | Company | Catalog Number | Comments |
| 시약의 이름 | 회사 | 카탈로그 번호 | 코멘트 (선택 사항) |
| 안티 BrdU-FITC | 로슈 Millipore | 11202593001 MAB326F | 50 μg / μl |
| 닉 번역 키트 | 애보트 분자 (Vysis) | 07J00-0001 | |
| 스펙트럼 오렌지 dUTP | 애보트 분자 (Vysis) | 02N33-050 | |
| CEP | 애보트 분자 (Vysis) | 다름 | |
| LSI / WCP 하이브 리다이 제이션 버퍼 | 애보트 분자 (Vysis) | 06J67-011 | |
| CEP의 하이브 리다이 제이션 버퍼 | 애보트 분자 (Vysis) | 07J36-001 | |
| 염색체 파이국세청 | MetaSystems 그룹 | D-14NN-050-TR | |
| 올림푸스 BX61 형광 현미경 | 하늘 | BX61TRF-1-5 | |
| 현미경 이미징 소프트웨어 시스템 | 응용 이미징 | Cytovision 3.93.1 | |
| 디지털 카메라 | 하늘 | UCMAD3 | |
현장 하이브 리다이 제이션 요리 IN 35 ML 포름 아미드 * (시그마) *이 -20 ° C.에 저장되어 그 포름 아미드를 사용하는 것이 중요합니다 장시간 실온 보관이 개미의 산성과 pH의 w를 생성합니다병 너무 낮. 50% Formamide/2x SSC 25 ML의 포름 아미드 (시그마) 20x SSC, 4 L 702g NaCl (시그마) PN 버퍼 [0.1 M NaP0 4 0.1 % NP_40 (시그마)] 0.1 M 솔루션 인산 나트륨의 각 (필터 소독, 500 ML의 aliquots에 저장)을 확인합니다. 0.1 M 아뇨 2 P0 4, L 13.8 g 아냐이 P0 4 (시그마) : 0.1 M 아뇨 2 P0 4 1 패 14.2 g 아냐이 P0 4 (시그마) PN : 0.1 M 아뇨 2 P0 4 2 HP0 4 산도 8.0 NA 0.1 M의 pH를 조정합니다. 필터 살균 및 NP-40의 1 ML를 추가합니다. PNM 50 ML 1.25 g 비 지방 건조 우유 (시그마) 지속적으로 저어로 15-20 분 동안 섞는다. 10 분 400 XG에 2 번 봐. 표면에 뜨는 사용하여 유발 우유 단백질을 방해하지 않도록하십시오. |
참고문헌
- Payer, B., Lee, J. T. X chromosome dosage compensation: how mammals keep the balance. Annu. Rev. Genet. 42, 733-772 (2008).
- Breger, K. S., Smith, L., Turker, M. S., Thayer, M. J. Ionizing radiation induces frequent translocations with delayed replication and condensation. Cancer Research. 64, 8231-8238 (2004).
- Smith, L., Plug, A., Thayer, M. Delayed Replication Timing Leads to Delayed Mitotic Chromosome Condensation and Chromosomal Instability of Chromosome Translocations. Proc. Natl. Acad. Sci. U.S.A. 98, 13300-13305 (2001).
- Stoffregen, E. P., Donley, N., Stauffer, D., Smith, L., Thayer, M. J. An autosomal locus that controls chromosome-wide replication timing and mono-allelicexpression. Hum. Mol. Genet. 20, 2366-2378 (2011).
- Breger, K. S., Smith, L., Thayer, M. J. Engineering translocations with delayed replication: evidence for cis control of chromosome replication timing. Hum. Mol. Genet. 14, 2813-2827 (2005).
- Camargo, M., Cervenka, J. Patterns of DNA replication of human chromosomes. II. Replication map and replication model. Am. J. Hum. Genet. 34, 757-780 (1982).
- Cohen, S. M., Cobb, E. R., Cordeiro-Stone, M., Kaufman, D. G. Identification of chromosomal bands replicating early in the S phase of normal human fibroblasts. Exp. Cell Res. 245 (98), 321-329 (1998).
- Diaz-Perez, S., et al. The element(s) at the nontranscribed Xist locus of the active X chromosome controls chromosomal replication timing in the mouse. Genetics. 171, 663-672 (2005).
- Diaz-Perez, S. V., et al. A deletion at the mouse Xist gene exposes trans-effects that alter the heterochromatin of the inactive X chromosome and the replication time and DNA stability of both X chromosomes. Genetics. 174, 1115-1133 (2006).
- Salic, A., Mitchison, T. J. A chemical method for fast and sensitive detection of DNA synthesis in vivo. Proc. Natl. Acad. Sci. U.S.A. 105, 2415-2420 (2008).
- Schlesinger, S., Selig, S., Bergman, Y., Cedar, H. Allelic inactivation of rDNA loci. Genes Dev. 23, 2437-2447 (2009).
- Mitelman Database of Chromosome Aberrations in Cancer. , Available from: http://cgap.nci.nih.gov/Chromosomes/Mitelman (2006).
- Branzei, D., Foiani, M. The checkpoint response to replication stress. DNA Repair (Amst). 8, 1038-1046 (2009).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유