Method Article
Подготовка вирусных ДНК из нуклеокапсидов
В этой статье
Резюме
Мы опишем процесс выделения высокой чистоты герпеса нуклеокапсида ДНК зараженных клеток. Окончательный ДНК захватили из раствора с высокой концентрацией и чистоты, что делает его идеально подходит для высокой пропускной последовательности, высокая точность ПЦР-реакции, и трансфекции производить новые вирусные рекомбинантов.
Аннотация
Вирусы являются облигатными паразитами сотовой, и, следовательно, изучение их ДНК требует выделения вирусного материала от клетки-хозяина загрязняющих веществ и ДНК. Несколько ниже по течению приложения требуют большого количества чистой вирусной ДНК, которая предоставляется этим протоколом. Эти приложения включают вирусные секвенирования генома, где удаление ДНК хозяина имеет решающее значение для оптимизации вывода данных вирусных последовательностей и производства новых вирусных рекомбинантных штаммов, где котрансфекцию очищенной плазмиды и линейных вирусной ДНК способствует рекомбинации. 1,2, 3
Эта процедура использует сочетание экстракции и плотности основе центрифугирования, чтобы изолировать очищенный линейный герпеса нуклеокапсида ДНК зараженных клеток. 4,5 начальной стадии очистки целью изолировать очищенной вирусной капсиды, которые содержат и защищают вирусной ДНК во время экстракции и центрифугирования шаги , которые удаляют клеточных белков и ДНК. Лизис нуклеокапсидов затем освобождает вирусной ДНК, и два последних фенол-хлороформ шаги удалить остатки белков. Окончательный ДНК захватили из раствора является высоко концентрированным и чистый, со средним диаметром 260/280 от 1.90. В зависимости от количества инфицированных клеток использовали, дает вирусных ДНК из диапазона 150-800 мкг и более. Чистоту этого ДНК делает ее стабильной в течение длительного хранения при 4С. Эта ДНК, таким образом, идеально подходит для высокой пропускной последовательности, высокая точность ПЦР-реакции, и трансфекции.
До начала протокола, важно знать среднее число клеток на блюдо (например, в среднем на 8 х 10 6 PK-15 клеток в сливной 15 см блюдо), и титр вирусной акции, которые будут использоваться ( например, 1 х 10 8 бляшкообразующих единиц на мл). Они необходимы для расчета соответствующей множественности заражения (МВД) для протокола. 6 Например, чтобы заразить 15 см блюдо PK-15 ячеек с выше вирусная акция, в МВД 5, вы должны использовать 400 мкл вирусные акции и развести его с 3,6 мл среды (общий объем инокуляции 4 мл для одного 15 см пластины).
Несколько вирусных препаратов ДНК может быть подготовлен в то же время. Количество одновременных препаратов ограничено только количество трубок проводимых ультрацентрифуге ротора (по одному на вирус, см. шаг 3,9 ниже). Здесь мы опишем процедуру, как будто делается для одного вируса.
протокол
1. Первый день: Вирусные инфекции и подготовка Буферы
- Подготовка 5-10 блюд (15 см в диаметре) из тканевой культуры клеток для инфекции, например, PK-15 ячеек для псевдобешенства вируса (PRV) или Vero клеток для вируса простого герпеса (ВПГ).
- Когда клетки на 95 - 100% сливающийся, заразить их (МВД) в 5-10. Чтобы сделать это, прививать каждую тарелку использованием вируса акций общим объемом 4 мл на пластину, затем инкубировать пластин в течение 1 часа при температуре 37 ° C. Рок пластины аккуратно каждые 15 минут, чтобы обеспечить, что клеточный монослой остается полностью покрытых вирусом посевной. Между тем, теплая среда для следующего шага.
- Через час инфекции, вирусных аспирата инокулята с плиты, добавить 15 мл теплой среде, и инкубировать при температуре 37 ° С в течение 12-20 часов во влажной инкубатора.
- Подготовка LCM буферов (см. таблицу 1) и рок-ночи при 4 ° С для тщательного перемешивания. Подготовка TNE для ресуспендирования вирусной ДНК (см. таблицу 2).
2. Второй день, Фаза 1: лизиса клеток и ультрацентрифугирования
- Визуально убедиться, что заражения клеток вызвал равномерное цитопатический эффект (ЦПЭ). Разрешить инфекции прогрессировать, пока все клетки имеют округлые, но еще не снят пластины.
- Очистите инфицированные клетки в среду, и объединить клетки и среду в 50 мл конические пробирки. Число конических труб, необходимых для этого шага будет зависеть от количества блюд используются для инфекции в шаге 1.2 выше, например, один 50 мл конической трубе могут быть использованы для гранул не более 3 блюд от 15 мл среды каждого Дополнительно:. Промыть пластин с 10 мл PBS и смешать с клетками и средой.
- Центрифуга клетки и среднего в течение 10 минут при 2000 об относительной centifugal сила (RCF) при комнатной температуре, затем аспирата супернатант и ресуспендируйте каждая гранула в 10 мл PBS. Если шарик из одной вирусная инфекция распространилась на несколько конических труб в шаге 2.2, их можно объединить в одну коническую трубку на этот шаг. Повторите центрифугирования и стремление Дополнительно:. Это гранулы могут храниться при температуре -20 ° С, а протокол продолжены на более позднее время.
3. Второй день, 2 фаза: ультрацентрифугирования
Держите осадок клеток и LCM буферов на льду по возможности в течение следующих шагов.
- Добавить β-меркаптоэтанол до 0% глицерина - LCM буфера. Начните охлаждения ультрацентрифуге (для шага 3,9 ниже), установив его на 4 ° С и включение вакуума.
- Ресуспендируют осадок клеток в 5 мл глицерина, 0% - LCM буфер, пока она больше не массивный. При необходимости, вихревые трубки, чтобы разбить любого нерастворенных осадок клеток.
- Извлечение путем добавления 1,5 мл фреона (1,1,2-трихлор-1 ,2,2-трифторэтана) и вортексе энергично. Сразу центрифуге в течение 10 мин при 2000 RCF при температуре 4 ° С. Соберите верхний слой с широким отверстием пипетки (избегая интерфейс) и переход к новой трубки Дополнительно:. Если осадок твердых желатиновых, можно быстро залить верхний слой в новую трубу.
- Повторите фреона добычи и центрифуга снова.
- Соберите верхний слой (~ 5 мл) и переход к новой трубки ультрацентрифуге polyallomer. Добавить β-меркаптоэтанол к двум оставшимся глицерин - LCM буферов.
- Подготовка градиент в трубке центрифуги polyallomer от нижележащих фреона экстракт (верхний слой) с 3 мл 5% глицерин - НОК (средний слой), а затем снова нижележащих 2,5 мл 45% глицерина - НОК (нижний слой). Использование тонкой пипетки, чтобы избежать переполнения содержимое пробирки.
- В случае необходимости, подготовить эквивалентную трубки баланса с использованием тех же пропорциях LCM буферов.
- Передача трубы в ультрацентрифуге ведра. Баланс ведра с точностью до 0,1 г друг от друга, осторожно добавляя дополнительные 0% глицерина - LCM буфер для верхнего слоя (~ 50-100 мкл на время).
- Использование холодной ультрацентрифуге с горизонтальной или размахивая ведром ротора, спина сбалансированной образцы течение 1 часа при 77000 RCF (например, 25000 оборотов в минуту для ротора SW41Ti) при температуре 4 ° C.
- Во время ультрацентрифугирования, заварить стаканом крюк, чтобы захватить плавающей ДНК на шаг осаждения этанолом (4,6 ниже). Держите оба конца пипетки Пастера стекла и приостановить средней части над пламенем. При разделе стекла почти расплавленный, тянуть осторожно, чтобы растянуть стекло, согнуть ее осторожно, чтобы создать плотно угловой крюк (<90 градусов), и тянуть резко перекрыть конца. Если кончик стекла крючок открыт, провести опрокинуться пламя так, что стекла расплавах достаточно, чтобы закрыть его.
- После центрифугирования, вы должны увидеть тонкий непрозрачный шарик с темным пятном в центре. Тщательно аспирации жидкости из трубки, в том числе капелью по сторонам, но избегая гранул в нижней части трубы.
- Добавить 0,5 мл TNE при комнатной температуре.
- Пусть гранул сидеть в течение по крайней мере 10 минут, чтобы дать гидратации гранул. Optional: гранулы могут также ресуспендируют в TNE за одну ночь, если хранить при температуре 4 ° C.
4. Третий день: "Призрак" ДНК осадков
- Разбейте гранул с помощью пипетки с малокалиберной пипетки (например, кончиком пипетки P200). Не беспокойтесь по поводу стрижки на этот шаг, потому что вирусная ДНК-прежнему содержится в капсиды в этой точке. Добавить следующие реагенты в пробирку вирусных гранул, при комнатной температуре, чтобы уничтожить капсиды:
- 4,25 мл TNE
- 0,25 мл 10% SDS
- 2 мг протеиназы К
Остерегайтесь сдвига здесь и далее, например, использование большого диаметра пипетки и не вихрь вирусного материала
- Извлечение вирусные белки, добавляя 5 мл фенол-хлороформом и немедленно начать инвертирующим или вортексе поддерживать эмульсии. Смешайте в течение 10 секунд, а затем центрифуги эмульсии в течение 5 минут при 2000 RCF при комнатной температуре. Соберите верхний слой с широким отверстием кончика пипетки, избегая интерфейса, и переход к новой трубки Дополнительно:. Использование фазовой автоподстройки гель (ПГС) труб на этом этапе, чтобы избежать загрязнения от интерфейса.
- Повторите фенол-хлороформ добычи и центрифуга снова.
- После второго фенол-хлороформ добычи, сбора верхний слой в 30 мл стеклянной трубки Corex и холод трубку при температуре -20 ° С в течение 10-15 минут, следя за тем, что она не замерзает.
- Добавьте 10 мл ледяной этанола, крышка трубки (например, растягивая кусок парафильмом М над вверху), и инвертировать смешать сразу. Часы для ДНК-"призраки" появляются, который состоит из тонкого осадка вязкой. Обратить трубки осторожно смешать все дальше и вызывать липкий ДНК осадки в кластер вместе.
- Использование стекла крюк, чтобы захватить ДНК призрак (ы). Аккуратно промокните ДНК, чтобы удалить лишнюю жидкость, затем поместите крюк (наконечник вниз) в 1,5 мл трубку и дать высохнуть. Добавить 0,25 - 0,5 мл ТЕ распустить ДНК призрак. Разрешить ресуспендирования ДНК проводили в течение не менее одного часа. Магазин ДНК при 4 ° C. Дополнительно: Для максимального выхода ДНК, разорвать стекло крюк в 1,5 мл трубки, таким образом, чтобы ресуспендирования от осколков стекла может продолжаться в течение долгого времени.
5. Представитель Результаты
С достаточно высокой МВД, камеры должны добиться полного CPE течение ~ 18 часов после заражения (ИНН) для штаммов дикого типа PRV, и ~ 24 HPI для дикого типа HSV-1 штаммов (рис. 1). Как только зараженный осадок клеток собирают, оставшиеся шаги протокол может быть завершена в один долгий день или осуществляются в течение двух дней (рис. 2).
При подготовке стеклянные крючки для захвата ДНК призрак, важно, чтобы сделать крюк углом менее 90 градусов, так что впоследствии он может вписаться в базе 1,5 мл трубки (рис. 3). Уплотнительная кончик этого крючка предотвращает потерю ДНК внутри пипетки.
ДНК-призраки форме во время осадков шаг и будет выглядеть как белый, вязкой нити (рис. 4). Эти совокупности и слипаются друг с другом и / или стекла крюк используется для захвата ДНК. Так же крючок стекло можно использовать, чтобы собрать несколько потоков ДНК из осадков решение.
| Выберите колонку от требуемого объема: | 10 мл | 15 мл | 20 мл | 40 мл |
| 1M KCL | 1,3 мл | 1,9 мл | 2,5 мл | 5 мл |
| 1М Трис (рН 7,4) | 300 мкл | 450 мкл | 600 мкл | 1,2 мл |
| 1M MgCl 2 | 50 мкл | 75 мкл | 100 мкл | 200 мкл |
| 0,5 ЭДТА | 10 мкл | 15 мкл | 20 мкл | 40 мкл |
| NP40/IGEPAL | 50 мкл | 75 мкл | 100 мкл | 200 мкл |
| β-меркаптоэтанол (добавлять непосредственно перед использованием) | 4,3 мкл | 6,5 мкл | 8,6 мкл | 17,2 мкл |
| Использование пропорции для достижения желаемого процентов глицерина (0, 5, или 45%) | ||||
| 0% глицерина | Ни один | Ни один | Ни один | Ни один |
| воды | 8,3 мл | 12,5 мл | 16,7 мл | 33,4 мл |
| 5% глицерина | 0,5 мл | 0,8 мл | 1,0 мл | 2,0 мл |
| воды | 7,8 мл | 11,7 мл | 15,7 мл | 31,4 мл |
| 45% гlycerol | 4,5 мл | 6,8 мл | 9,0 мл | 18,0 мл |
| воды | 3,8 мл | 5,7 мл | 7,7 мл | 15,4 мл |
Таблица 1. Рецепты для приготовления LCM буферов
| В течение 50 мл объема |
| 5 мл 1M NaCl |
| 2,5 мл 1М Трис, рН 7,5 |
| 1 мл 0,5 ЭДТА |
| 41,5 мл H 2 O |
Таблица 2. Подготовка TNE (0,1 М NaCl, 50 мМ Трис, рН 7,5, 10 мМ ЭДТА)
| На 1 л объема |
| 0,2 г хлорида калия |
| 0,2 г KH 2 PO 4 |
| 8 г NaCl |
| 1.15g Na 2 HPO 4 |
| H 2 O в 1 л |
Таблица 3. Подготовка PBS (2,7 мМ KCl, 1,5 мМ KH 2 PO 4, 137 мМ NaCl, 8,1 мМ Na 2 HPO 4, рН 7,0)
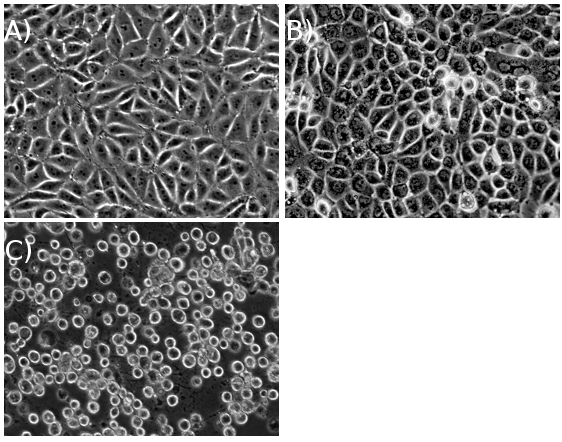
Рисунок 1. PK15 клеток () до инфекции, (б) в середине инфекции, и (С) на цитопатический эффект (ЦПЭ), после высокой множественности заражения.

Рисунок 2. Обзор протокола.

Рисунок 3. Три типичные образцы стекла крючки, используемые для сбора вирусной ДНК призраков.

Рисунок 4. Представителю пример хорошо сформированные и обильные ДНК "призрак".
Обсуждение
Части этого протокола первоначально были разработаны для выделения вируса в ДНК BSL4 условиях, но он одинаково хорошо адаптируется к не-BSL условиях. 4 Мы часто используют этот протокол, чтобы изолировать ДНК из альфа-PRV герпеса и ВПГ-1, которые имеют ДНК геномов заключен в белковый капсид и окружен липидной оболочкой. 7,8 Однако вполне вероятно, непосредственно адаптирована к другим крупным вирусы ДНК, в том числе бета-и гамма-герпеса и аденовирусы. Подобные извлечения обычно используются для РНК-содержащих вирусов, а также 9.
Надежность этого препарата ДНК вероятно, результаты нескольких методов очистки, которые включены. Начальная фреона извлечения мембраны денатурировать липидов, разделяющей клеточных компонентов, а также выпуск конверта липидов и белков внешней оболочки, которые окружают вирус герпеса капсиды. Это сопровождается ультрацентрифугирования, где тяжелая вирусная нуклеокапсидов гранул через две подушки градиент, эффективно отделяя их от большинства других клеточных компонентов. Эти капсиды ресуспендируют и вирусных нуклеокапсида ДНК высвобождается путем разрыва капсиды с протеиназы К и моющего средства. Два фенол-хлороформ экстракции тщательно удалить нуклеокапсида компонентов и все оставшиеся клеточных белков. Наконец, выпадение большого вирусных геномов ДНК в растворе снижает унос солей или частицы загрязнений.
Эта процедура, чтобы изолировать вирусного нуклеокапсида ДНК дает богатый, высокой чистоты материала для последующих применений. Сочетание нескольких добычи и центрифугирования шагов отличает этот протокол из более простых одного добычи протоколов, которые оставляют больше распада клеток или деградации белковых продуктов с ДНК 10. Белки загрязнения может уменьшить стабильность при хранении вирусной ДНК, и снизить эффективность трансфекции в клетки. Сотовая загрязнений ДНК негативно сказаться на ПЦР реакции и высокой пропускной протоколы секвенирования. 1 ДНК выход этого протокола также высока, что делает его хорошо подходит для полиморфизма длины рестрикционных фрагментов (ПДРФ) анализ и Южной промокательной. 5,11 Один нуклеокапсида подготовки обеспечивает достаточную Материал для всех этих анализов.
Количество клеток используются для инфекции воздействия возможного выхода вирусной ДНК. Для штаммов PRV с диким типом роста, ввод 5-10 блюда PK-15 ячеек (одна диаметром 15 см блюдо занимает примерно 8 х 10 6 клеток) обычно дает 250-500 мкг вирусной ДНК. Для вирусных мутантов с снизился выход инфекционных вирионов, исходного материала должны быть расширены вверх соответственно. Удвоение входного количество блюд будет примерно в два раза доходность, и могут быть обработаны с тем же количества реагентов описано здесь. Для увеличения входного за этой точкой, мы рекомендуем разделить исходного материала на два параллельных потоков обработки (например, две ячейки окатышей и две трубки добычи) через шаг 3.13. Два ультрацентрифугирования гранул того же штамма вируса могут быть объединены в одну пробирку на этом ресуспендирования шаг. Если ДНК не в форме чисто призрак в конце процедуры, основной подход решения проблемы является увеличение входного количество клеток, что позволит увеличить выход ДНК и улучшить ее осадки.
Другие условия также могут влиять на успех призрак образования. Например, важно, чтобы время урожай инфекций на момент, когда вирусная нуклеокапсидов много, но в основном внутриклеточным или клеточно-ассоциированных. Вирионы выпущен в среду не будет захвачен этой процедуры, и, следовательно, уборке клетки слишком поздно инфекции (например, когда CPE развилась до точки, где клетки отделяются от блюдо) снизит потенциал урожайности ДНК и призрак образования. Важно также, чтобы полностью растворить собрано осадок клеток в LCM буфера (шаг 3,2), чтобы в полной мере воспользоваться следующим шагом добычи, это ресуспендирования требует больше времени и заботы, если осадок клеток был заморожен на предыдущем шаге. Малой процедурные детали влияют на ДНК выход, а также. Хотя шаги 3 и 4 может быть осуществлена без использования охлажденных растворов и сохраняя все трубы на льду, успеха ДНК ореолов гораздо выше, когда реагенты держать в холоде. Кроме того, стабильность β-меркаптоэтанол в растворе снижается с течением времени, и, следовательно, добавив его в LCM решения непосредственно перед употреблением оптимизирует снижение мощности, повышение белка нарушения и увеличения выхода продукции ДНК и призрак образования. Особое внимание на эти детали улучшит выход высокого качества вирусной ДНК.
Потому что вирусная ДНК вязкая, в результате решение может быть неоднородным. Разрешение больше времени для ресуспендирования из стекла крюк увеличивает полезный выход ДНК и улучшает решение однородности. Стандартный спектрофотометрииможет быть использована для количественного определения ДНК выход и чистоту. ДНК флуориметрии обеспечивает еще более точное меры ДНК выход (например, Invitrogen PicoGreen двухцепочечной ДНК пятна).
Раскрытие информации
Нет конфликта интересов объявлены.
Благодарности
Авторы ценят вклад Грег Смит, Лиза Померанц, Мэтт Лиман, Марлиз Элдридж, Галина Staniszewska Goraczniak, и члены лаборатории Enquist в тонкой настройки этого протокола.
Материалы
| Name | Company | Catalog Number | Comments |
| Название реагента | Компания | Номер в каталоге | Комментарии |
| Фреон (1,1,2-трихлор-1 ,2,2-трифторэтана) | Рыболов | T178-4 | Проверьте с вашим учреждением для руководства по надлежащей утилизации фреона-содержащих отходов, или увидеть, Мендес и соавт. для потенциальных альтернатив фреона 9. |
| Фазы блокировки геля труб, тяжелая емкость 15 мл | 5 премьер | 2302850 | Необязательный |
| Трубы Polyallomer ультрацентрифуге | Бекман * | 331372 * | * Выберите трубы подходят для вашего собственного ультрацентрифуге; они включены только в качестве примера |
| NP-40 / Igepal | Сигма | Я-3021 | |
| PK-15 клетки | АТСС | CCL-33 | |
| Vero клетках | АТСС | CCL-81 | |
| PBS | Hyclone | SH30028.03 |
Ссылки
- Szpara, M. L., Parsons, L., Enquist, L. W. Sequence variability in clinical and laboratory isolates of herpes simplex virus 1 reveals new mutations. J Virol. 84, 5303-5313 (2010).
- Banfield, B. W., Kaufman, J. D., Randall, J. A., Pickard, G. E. Development of pseudorabies virus strains expressing red fluorescent proteins: new tools for multisynaptic labeling applications. J Virol. 77, 10106-10112 (2003).
- Kobiler, O., Lipman, Y., Therkelsen, K., Daubechies, I., Enquist, L. W. Herpesviruses carrying a Brainbow cassette reveal replication and expression of limited numbers of incoming genomes. Nat Commun. 1, 146-146 (2010).
- Enquist, L. W., Madden, M. J., Schiop-Stanley, P., Vande Woude, G. F. Cloning of herpes simplex type 1 DNA fragments in a bacteriophage lambda vector. Science. 203, 541-544 (1979).
- Smith, G. A., Enquist, L. W. Construction and transposon mutagenesis in Escherichia coli of a full-length infectious clone of pseudorabies virus, an alphaherpesvirus. J Virol. 73, 6405-6414 (1999).
- Flint, S. J., Enquist, L. W., Racaniello, V. R., Skalka, A. M. Principles of virology. , 3rd edn, ASM Press. (2008).
- Pomeranz, L. E., Reynolds, A. E., Hengartner, C. J. Molecular biology of pseudorabies virus: impact on neurovirology and veterinary medicine. Microbiol Mol Biol Rev. 69, 462-500 (2005).
- Roizman, B., Pellett, P. E. Fields Virology. Knipe, D. M., Howley, P. M. , 2 ed, Lippincott Williams & Wilkins. 2381-2397 (2001).
- Mendez, I. I., Hermann, L. L., Hazelton, P. R., Coombs, K. M. A comparative analysis of freon substitutes in the purification of reovirus and calicivirus. J Virol Methods. 90, 59-67 (2000).
- Gharabaghi, F., Aymard, M., Trotemann, P., Gerdil, C. A rapid and simplified micromethod for subtyping varicella-zoster virus. J Med Virol. 31, 129-134 (1990).
- Granstedt, A. E., Szpara, M. L., Kuhn, B., Wang, S. S., Enquist, L. W. Fluorescence-based monitoring of in vivo neural activity using a circuit-tracing pseudorabies virus. PLoS One. 4, e6923-e6923 (2009).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены