Method Article
Preparación de ADN viral de nucleocápside
En este artículo
Resumen
Se describe el proceso de aislamiento de ADN de alta pureza herpesvirus nucleocápside de las células infectadas. El final de ADN capturado de la solución es de alta concentración y pureza, por lo que es ideal para la secuenciación de alto rendimiento, alta fidelidad de las reacciones de PCR, y transfecciones para producir nuevas recombinaciones virales.
Resumen
Los virus son parásitos obligados celular, y por lo tanto el estudio de su ADN requiere aislar material viral de distancia de los contaminantes de la célula huésped y el ADN. Varias aplicaciones posteriores requieren grandes cantidades de ADN viral pura, que es proporcionada por este protocolo. Estas aplicaciones incluyen la secuenciación del genoma viral, donde la extracción de ADN del huésped es crucial para optimizar la salida de datos de secuencias virales, y la producción de nuevas cepas virales recombinantes, 1,2, donde la co-transfección de ADN purificado viral y plásmido lineal facilita la recombinación., 3
Este procedimiento utiliza una combinación de extracción y la densidad basado en la centrifugación para aislar ADN purificado herpesvirus nucleocápside lineal de las células infectadas. 4,5 Los pasos de la purificación inicial objetivo de aislar a cápsidas virales purificados, que contienen y protegen el ADN viral en las extracciones y los pasos de centrifugación que eliminan las proteínas celulares y el ADN. Lisis de la nucleocápside libera el ADN viral, y dos finales de fenol-cloroformo pasos eliminar las proteínas restantes. El final de ADN capturado de la solución está muy concentrado y puro, con un promedio de 260/280 OD de 1,90. Dependiendo de la cantidad de células infectadas, los rendimientos de la gama de ADN viral 150 a 800 mg o más. La pureza de este ADN hace que sea estable durante el almacenamiento a largo plazo a 4 ° C. Este ADN es por lo tanto ideal para el alto rendimiento de secuenciación de alta fidelidad de las reacciones de PCR, y transfección.
Antes de comenzar el protocolo, es importante conocer el número promedio de células por plato (por ejemplo, un promedio de 8 x 10 6 células PK-15 en un plato cm confluentes 15), y el título de la acción viral para ser utilizado ( por ejemplo, 1 x 10 8 unidades formadoras de placas por ml). Estos son necesarios para calcular la multiplicidad apropiado de la infección (MOI) para el protocolo. 6 Por ejemplo, para infectar a un plato de 15 cm de células PK-15 con la acción viral por encima, en una MOI de 5, se utiliza 400 l de stock viral y la mezclan con 3,6 ml de medio (volumen de inoculación total de 4 ml para una placa de 15 cm).
Múltiples preparaciones de ADN viral se puede preparar al mismo tiempo. El número de preparaciones simultáneas está limitado sólo por el número de tubos en poder del rotor ultracentrífuga (uno por virus, consulte el paso 3.9 más adelante). A continuación se describe el procedimiento como si se hace por un virus.
Protocolo
1. Primer Día: infección viral y preparación de tampones
- Preparar platos 50-10 (15 cm de diámetro) de las células de cultivo de tejidos para la infección, por ejemplo, células PK-15 para el virus de la pseudorrabia (PRV) o de células Vero de virus del herpes simple (VHS).
- Cuando las células son de 95 - 100% confluentes, que infectan a un (MOI) de 5.10. Para ello, vacunar a cada plato con stock de virus en un volumen total de 4 ml por placa, y luego se incuban las placas durante 1 hora a 37 ° C. Placas de roca suavemente cada 15 minutos para asegurarse de que la monocapa celular sigue siendo totalmente recubierto por el inóculo de virus. Mientras tanto, calentar el medio para el siguiente paso.
- Después de una hora de la infección, aspiración de inóculo viral de las placas, agregar 15 ml de medio caliente, y se incuba a 37 ° C durante 12-20 horas en un incubador humidificado.
- Preparar buffers LCM (ver Tabla 1) y el rock la noche a 4 ° C para la mezcla completa. Prepare TNE para la resuspensión de ADN viral (ver Tabla 2).
2. Segundo día, Fase 1: lisis celular y ultracentrifugación
- Confirmar visualmente que la infección de las células ha causado un efecto uniforme citopático (CPE). Permitir la infección de progreso hasta que todas las células tienen rodeados, pero no han quitado la placa.
- Raspar las células infectadas en el medio, y se combinan células y el medio en tubos de 50 ml cónicos. El número de tubos cónicos necesario para este paso dependerá de la cantidad de los platos utilizados para la infección en el Paso 1.2, por ejemplo, un tubo de 50 ml cónicos se puede utilizar para precipitar un máximo de tres platos de medio de 15 ml cada uno. Opcional: Enjuague el placas con 10 ml de PBS y se combinan con las células y medianas empresas.
- Centrifugue las células y medio durante 10 minutos a 2000 la fuerza relativa centifugal (FCR) a temperatura ambiente, y aspirar el sobrenadante y resuspender cada pellet en 10 ml de PBS. Si el sedimento de una infección viral se extendió en varios tubos cónicos en el Paso 2.2, estos se pueden recombinar en un tubo cónico en este paso. Repetir la centrifugación y la aspiración. Opcional: Esta pastilla puede ser almacenado a -20 ° C y el protocolo seguido en un momento posterior.
3. Segundo día, Fase 2: Ultracentrifugación
Mantener el sedimento celular y tampones LCM en hielo siempre que sea posible durante los siguientes pasos.
- Añadir β-mercaptoetanol al glicerol 0% - búfer LCM. Empieza a enfriar a la ultracentrífuga (para el paso por debajo de 3,9) mediante el establecimiento a 4 ° C y girando en el vacío.
- Resuspender el botón celular en 5 ml de glicerina de 0% - búfer LCM hasta que ya no es abultada. Si es necesario, el tubo de vórtice para romper cualquier disolver el sedimento celular.
- Extraer mediante la adición de 1,5 ml de freón (1,1,2-tricloro-1 ,2,2-trifluoro) y agitación vigorosa. Inmediatamente se centrifuga durante 10 minutos a 2000 fcr a una temperatura de 4 ° C. Recoger la capa superior con una punta de pipeta de gran calibre (evitando la interfaz) y la transferencia a un nuevo tubo. Opcional: Si el pellet es un sólido gelatinoso, usted puede verter la capa superior en un nuevo tubo.
- Repetir la extracción de freón y centrifugar de nuevo.
- Recoger la capa superior (~ 5 ml) y transferir a un tubo de ultracentrífuga polyallomer nuevo. Añadir β-mercaptoetanol al glicerol dos restantes - buffers LCM.
- Preparar un gradiente en el tubo de centrífuga polyallomer underlaying por el extracto de freón (capa superior) con 3 ml de glicerol al 5% - LCM (capa media), y luego underlaying de nuevo con 2,5 ml de 45% de glicerol - LCM (capa inferior). Use una pipeta fina para evitar el desbordamiento de los contenidos del tubo.
- Si es necesario, prepare un tubo de equilibrio equivalente con las mismas proporciones de búferes de LCM.
- La transferencia de los tubos en los cubos de ultracentrifugación. Balance de cubos de 0,1 g de cada uno, añadiendo lentamente glicerol extra 0% - búfer LCM a la capa superior (~ 50 a 100 l en un momento).
- Usando una ultracentrífuga frío con un rotor de cubeta horizontal o basculante, girar las muestras equilibrada durante 1 hora a 77.000 RCF (por ejemplo, 25.000 rpm para un rotor SW41Ti) a una temperatura de 4 ° C.
- Durante la ultracentrifugación, hacer un gancho de vidrio para capturar el ADN flotante en la etapa de precipitación con etanol (4.6). Sostenga los dos extremos de una pipeta Pasteur de vidrio y la suspensión de la sección media sobre una llama. Cuando una sección del vaso está casi fundido, tire suavemente para estirar el vidrio, doble suavemente para crear un gancho fuertemente inclinadas (<90 grados), y tirar fuertemente para sellar el final. Si la punta del gancho de vidrio está abierta, mantenga la punta sobre la llama para que el vidrio se funde lo suficiente como para cerrarla.
- Después de la ultracentrifugación, debería ver un fino precipitado opaco, con una mancha oscura en el centro. Con cuidado aspirar el líquido del tubo, incluyendo grasa a lo largo de los lados, pero evitando los pellets en la parte inferior del tubo.
- Añadir 0,5 ml TNE a temperatura ambiente.
- Deje que el pellet se siente por lo menos 10 minutos para permitir la hidratación de la pastilla. Opcional: La pastilla también podría volver a suspender en TNE noche a la mañana, si se conserva a 4 ° C.
4. Tercer Día: "Ghost" ADN Precipitaciones
- Romper el pellet con la pipeta con una punta de pipeta de pequeño calibre (por ejemplo, una punta de la pipeta p200). No te preocupes por corte en este paso, ya que el ADN viral es todavía contenida en cápsides en este momento. Añadir los siguientes reactivos al tubo que contiene el virus de pellets, a temperatura ambiente, para destruir cápsides:
- 4,25 ml TNE
- 0,25 ml de 10% SDS
- 2 mg de proteinasa K
Tenga cuidado con los de corte a partir de ahora, por ejemplo, el uso de gran calibre pipetas y no agite el material viral
- Extracto de proteínas virales mediante la adición de 5 ml de fenol-cloroformo y empezar inmediatamente a invertir o agitación para mantener una emulsión. Mezclar durante 10 segundos, centrifugar la emulsión durante 5 minutos a 2000 fcr a temperatura ambiente. Recoger la capa superior con una punta de gran calibre la pipeta, evitando la interfaz, y la transferencia a un nuevo tubo. Opcional: Use la fase de bloqueo de gel (PLG) en los tubos de este paso para evitar la contaminación de la interfaz.
- Repetir la extracción con fenol-cloroformo y centrifugar de nuevo.
- Después de la segunda extracción con fenol-cloroformo, recoger la capa superior en un tubo de 30 ml de cristal Corex y enfriar el tubo a -20 ° C durante 10-15 minutos, teniendo cuidado de que no se congela.
- Añadir 10 ml de etanol helado, cubrir el tubo (por ejemplo, se extiende un trozo de Parafilm M en la parte superior), e invierta para mezclar inmediatamente. Esté atento a un ADN "fantasma" que aparecen, que consiste en un precipitado viscoso delgada. Invertir el tubo suavemente para mezclar aún más y hacer que el ADN pegajoso precipita a agruparse.
- Utilice un gancho de vidrio para capturar el fantasma del ADN (s). Cuidadosamente blot el ADN para eliminar el exceso de líquido, a continuación, coloque el gancho (la punta hacia abajo) en un tubo de 1.5 ml y dejar secar. Añadir 0,25 a 0,5 ml de TE para disolver el fantasma del ADN. Permitir la resuspensión de ADN para proceder de al menos una hora. ADN se almacenan a 4 ° C. Opcional: Para maximizar el rendimiento de ADN, se rompe el gancho de vidrio en el tubo de 1.5 ml, de modo que la resuspensión de los fragmentos de vidrio pueden seguir el paso del tiempo.
5. Resultados representante
Con un alto MOI suficiente, las células deben lograr la plena CPE dentro de ~ 18 horas post-infección (hpi) para cepas de tipo salvaje PRV, y ~ 24 hpi de tipo salvaje cepas de HSV-1 (Figura 1). Una vez que el pellet de células infectadas se cosecha, el resto de pasos del protocolo se puede completar en un día largo o llevado a cabo durante dos días (Figura 2).
En la preparación de los ganchos de vidrio para capturar el fantasma del ADN, es importante que el ángulo de gancho de ser inferior a 90 grados, para que después pueda caber en la base de un tubo de 1.5 ml (Figura 3). Sellado de la punta de este gancho previene la pérdida de ADN dentro de la pipeta.
Los fantasmas de ADN se forman durante la etapa de precipitación y aparecerá como hilos blancos, viscosa (Figura 4). Estos agregados y se adhieren entre sí y / o el gancho de vidrio utilizado para capturar el ADN. Así, el gancho de vidrio mismo se puede utilizar para reunir varios hilos de ADN dentro de la solución de precipitación.
| Elija columna basada en el volumen deseado: | 10 ml | 15 ml | 20 ml | 40 ml |
| 1M KCl | 1,3 ml | 1,9 ml | 2,5 ml | 5 ml |
| 1M Tris (pH 7,4) | 300 l | 450 l | 600 l | 1,2 ml |
| MgCl2 1M | 50 l | 75 l | 100 l | 200 l |
| 0,5 EDTA | 10 l | 15 l | 20 l | 40 ml |
| NP40/IGEPAL | 50 l | 75 l | 100 l | 200 l |
| β-mercaptoetanol (agregue inmediatamente antes del uso) | 4,3 l | 6,5 l | 8,6 l | 17,2 l |
| Usar proporciones para el glicerol por ciento deseado (0, 5, o 45%) | ||||
| 0% de glicerol | Ninguno | Ninguno | Ninguno | Ninguno |
| de agua | 8,3 ml | 12,5 ml | 16,7 ml | 33,4 ml |
| 5% de glicerol | 0,5 ml | 0,8 ml | 1,0 ml | 2,0 ml |
| de agua | 7,8 ml | 11,7 ml | 15,7 ml | 31,4 ml |
| 45% glycerol | 4,5 ml | 6,8 ml | 9,0 ml | 18,0 ml |
| de agua | 3,8 ml | 5,7 ml | 7,7 ml | 15,4 ml |
Tabla 1. Recetas para la preparación de tampones LCM
| Por volumen de 50 ml |
| 5 ml de NaCl 1M |
| 2,5 ml de 1M Tris, pH 7,5 |
| Una de 0,5 ml con EDTA |
| 41,5 ml de H 2 O |
Tabla 2. Preparación de la TNE (0,1 M NaCl, 50 mM Tris, pH 7,5, 10 mM EDTA)
| Para el volumen 1 L |
| 0,2 g de KCl |
| 0,2 g de KH 2 PO 4 |
| 8 g de NaCl |
| 1,15 g de Na 2 HPO 4 |
| H 2 O a 1 litro |
Tabla 3. Preparación de PBS (2,7 mM KCl, 1,5 mM KH 2 PO 4, 137 mM NaCl, 8,1 mM Na 2 HPO 4 pH 7,0)
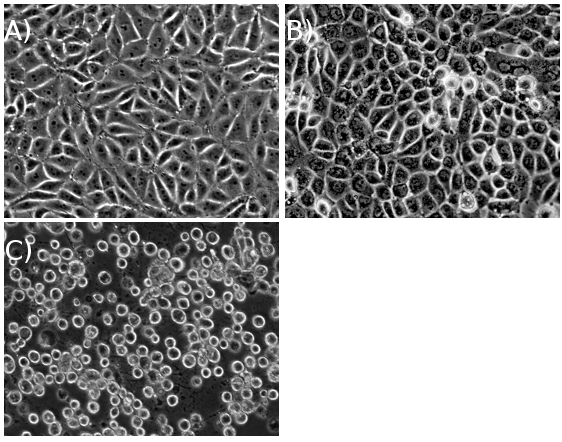
Figura 1. PK15 células (A) antes de la infección, (B) a mitad de la infección, y (C) en el efecto citopático (CPE), después de una multiplicidad de infección.

Figura 2. Descripción general del protocolo.

Figura 3. Tres ejemplos representativos de vidrio anzuelos utilizados para recoger los fantasmas del ADN viral.

Figura 4. Ejemplo representativo de un ADN bien formado y abundante "fantasma".
Discusión
Algunas partes de este protocolo fueron desarrollados originalmente para el aislamiento de ADN viral en BSL4 condiciones, pero se adapta igualmente bien a los no-BSL condiciones. 4 Se suelen usar este protocolo para aislar el ADN de la PRV alfa-herpesvirus y el VHS-1, que tienen genomas de ADN encerrado en una cápside proteica y rodeado por una envoltura lipídica. 7,8 Sin embargo, es probable que directamente adaptables a otras grandes virus de ADN, incluyendo beta-y gamma-herpesvirus y adenovirus. Extracciones similares se utilizan comúnmente para los virus de ARN y 9.
La solidez de esta preparación los resultados de ADN probablemente de los múltiples métodos de purificación que se incluyen. La primera extracción de freón membranas lipídicas desnaturalizar, la separación de los componentes celulares y también la liberación de la envoltura de lípidos y proteínas externas que rodean a tegumento cápsides herpesvirus. Esto es seguido por ultracentrifugación, donde la nucleocápside viral pesados pellets a través de dos cojines de gradiente, efectivamente que los separa de la mayoría de los demás componentes celulares. Estas cápsides se volvieron a suspender, y el ADN nucleocápside viral es liberado por la ruptura de las cápsidas con proteinasa K y detergente. Dos extracciones con fenol-cloroformo bien eliminar los componentes nucleocápside y las proteínas celulares restantes. Por último, la precipitación de los genomas de ADN viral en gran solución reduce el arrastre de sales o partículas contaminantes.
Este procedimiento para aislar el ADN nucleocápside viral proporciona abundante material, de alta pureza para aplicaciones posteriores. La combinación de la extracción de múltiples pasos de centrifugación que distingue a este protocolo de protocolos sencillos de una sola extracción de los escombros que dejan más celulares o productos de degradación de proteínas con el ADN de 10. Contaminantes de proteínas puede reducir la estabilidad de almacenamiento del ADN viral, y reducen la eficiencia de transfección en las células. Contaminantes de ADN celular un impacto negativo en las reacciones de PCR y de alto rendimiento de los protocolos de secuenciación. 1 El rendimiento de ADN de este protocolo también es alta, por lo que es muy adecuado para polimorfismo de longitud de los fragmentos de restricción (RFLP) y Southern Blot. 5,11 Una preparación nucleocápside proporciona suficiente material para todos estos análisis.
La cantidad de células utilizadas para la infección afecta a la producción final de ADN viral. Para las cepas de PRV, con una tasa de crecimiento de tipo salvaje, la introducción de platos 50-10 de células PK-15 (un 15 plato cm de diámetro tiene aproximadamente 8 x 10 6 células) por lo general los rendimientos de 250-500 ug de ADN viral. De virus mutantes con un rendimiento reducido de viriones infecciosos, el material de entrada debe ser escalado hacia arriba en consecuencia. Duplicar el número de platos de entrada será aproximadamente el doble del rendimiento, y pueden ser procesados con las mismas cantidades de reactivos descritos aquí. Para aumentar el aporte más allá de este punto, se recomienda separar el material de entrada en dos corrientes paralelas de manejo (por ejemplo, dos gránulos de las células y dos tubos de extracción) hasta el paso 3.13. Dos pastillas de ultracentrifugación de la misma cepa del virus se pueden combinar en un tubo en este paso la resuspensión. Si el ADN no se forma limpia un fantasma en el final del procedimiento, el enfoque de solución de problemas principales es aumentar la cantidad de entrada de las células, lo que incrementará el rendimiento de ADN y mejorar su precipitación.
Otras condiciones también pueden afectar el éxito de la formación del espíritu. Por ejemplo, es importante el tiempo de la cosecha de las infecciones en un momento en nucleocápside viral son abundantes, pero son en su mayoría intracelular o asociado a células. Viriones liberados en el medio de no ser capturado por este procedimiento, y por lo tanto, la recolección de células muy tarde en la infección (por ejemplo, cuando CPE ha progresado hasta el punto donde las células se desprenden de la placa) se reduce el rendimiento potencial de ADN y la formación de fantasma. También es importante que se disuelva completamente la cosecha celular en LCM buffer (Paso 3.2) para aprovechar al máximo el paso después de la extracción, lo que resuspensión requiere más tiempo y atención si el pellet de células se ha congelado en el paso anterior. Menores detalles de procedimiento afectar el rendimiento de ADN también. Mientras que los pasos 3 y 4 pueden llevarse a cabo sin el uso de soluciones refrigeradas y mantener todos los tubos en hielo, la tasa de éxito del fantasma del ADN es mucho mayor cuando los reactivos se mantienen frías. Del mismo modo, la estabilidad de β-mercaptoetanol en la disminución solución con el tiempo, y por lo tanto, la adición a las soluciones de LCM inmediatamente antes de su uso optimiza su capacidad de reducir, la mejora de la interrupción de proteínas y de ADN que aumenta el rendimiento y la formación de fantasma. Atención a estos detalles serán mejorar la calidad de la producción de ADN viral alta.
Dado que el ADN viral es viscoso, la solución resultante puede ser heterogéneo. Permitiendo más tiempo para la resuspensión del gancho de vidrio aumenta el rendimiento de ADN útil y mejora la homogeneidad de la solución. Estándar de espectrofotometríase puede utilizar para cuantificar el rendimiento y la pureza del ADN. Fluorimetría ADN proporciona las medidas más precisas de rendimiento de ADN (por ejemplo, Invitrogen PicoGreen dsDNA mancha).
Divulgaciones
No hay conflictos de interés declarado.
Agradecimientos
Los autores agradecen las contribuciones de Greg Smith, Lisa Pomeranz, Lyman Matt, Eldridge Marlies, Halina Staniszewska Goraczniak, y los miembros del laboratorio de Enquist en el perfeccionamiento de este protocolo.
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del reactivo | Empresa | Número de catálogo | Comentarios |
| Freón (1,1,2-tricloro-1 ,2,2-trifluoro) | Pescador | T178-4 | Verifique con su institución para las instrucciones sobre la eliminación adecuada de los desechos que contengan freón, o ver Mendez et al. alternativas posibles freón. 9 |
| Fase de bloqueo de los tubos de gel, la capacidad de 15ml pesado | 5 PRIME | 2302850 | Opcional |
| Polyallomer tubos de ultracentrífuga | Beckman * | 331372 * | * Seleccione los tubos adecuados para su propia ultracentrífuga, los cuales se incluyen a título de ejemplo |
| NP-40 / IGEPAL | Sigma | I-3021 | |
| Células PK-15 | ATCC | CCL-33 | |
| Las células Vero | ATCC | CCL-81 | |
| PBS | HyClone | SH30028.03 |
Referencias
- Szpara, M. L., Parsons, L., Enquist, L. W. Sequence variability in clinical and laboratory isolates of herpes simplex virus 1 reveals new mutations. J Virol. 84, 5303-5313 (2010).
- Banfield, B. W., Kaufman, J. D., Randall, J. A., Pickard, G. E. Development of pseudorabies virus strains expressing red fluorescent proteins: new tools for multisynaptic labeling applications. J Virol. 77, 10106-10112 (2003).
- Kobiler, O., Lipman, Y., Therkelsen, K., Daubechies, I., Enquist, L. W. Herpesviruses carrying a Brainbow cassette reveal replication and expression of limited numbers of incoming genomes. Nat Commun. 1, 146-146 (2010).
- Enquist, L. W., Madden, M. J., Schiop-Stanley, P., Vande Woude, G. F. Cloning of herpes simplex type 1 DNA fragments in a bacteriophage lambda vector. Science. 203, 541-544 (1979).
- Smith, G. A., Enquist, L. W. Construction and transposon mutagenesis in Escherichia coli of a full-length infectious clone of pseudorabies virus, an alphaherpesvirus. J Virol. 73, 6405-6414 (1999).
- Flint, S. J., Enquist, L. W., Racaniello, V. R., Skalka, A. M. Principles of virology. , 3rd edn, ASM Press. (2008).
- Pomeranz, L. E., Reynolds, A. E., Hengartner, C. J. Molecular biology of pseudorabies virus: impact on neurovirology and veterinary medicine. Microbiol Mol Biol Rev. 69, 462-500 (2005).
- Roizman, B., Pellett, P. E. Fields Virology. Knipe, D. M., Howley, P. M. , 2 ed, Lippincott Williams & Wilkins. 2381-2397 (2001).
- Mendez, I. I., Hermann, L. L., Hazelton, P. R., Coombs, K. M. A comparative analysis of freon substitutes in the purification of reovirus and calicivirus. J Virol Methods. 90, 59-67 (2000).
- Gharabaghi, F., Aymard, M., Trotemann, P., Gerdil, C. A rapid and simplified micromethod for subtyping varicella-zoster virus. J Med Virol. 31, 129-134 (1990).
- Granstedt, A. E., Szpara, M. L., Kuhn, B., Wang, S. S., Enquist, L. W. Fluorescence-based monitoring of in vivo neural activity using a circuit-tracing pseudorabies virus. PLoS One. 4, e6923-e6923 (2009).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados