Method Article
Herstellung viraler DNA aus Nukleokapside
In diesem Artikel
Zusammenfassung
Wir beschreiben den Prozess der Isolierung hochreiner Herpesvirus Nukleokapsid DNA aus infizierten Zellen. Die endgültige DNA aus der Lösung erfasst ist von hoher Konzentration und Reinheit und ist damit ideal für Hochdurchsatz-Sequenzierung, high fidelity PCR-Reaktionen, und Transfektionen neue virale Rekombinanten produzieren geeignet.
Zusammenfassung
Viren sind obligate Parasiten zellulären und damit die Untersuchung ihrer DNA erfordert Isolierung viraler Material vom Wirtszelle Verunreinigungen und DNA. Mehrere nachgelagerten Anwendungen erfordern große Mengen an reiner viraler DNA, die durch dieses Protokoll vorgesehen ist. Zu diesen Anwendungen zählen virale Genom-Sequenzierung, in denen die Beseitigung der Wirts-DNA ist entscheidend für die Datenausgabe für virale Sequenzen zu optimieren und die Produktion neuer viraler rekombinanten Stämmen, wo Co-Transfektion von gereinigter Plasmid-und lineare virale DNA erleichtert Rekombination. 1,2, 3
Dieses Verfahren verwendet eine Kombination von Extraktionen und Dichte-basierte Zentrifugieren zu isolieren gereinigten linearen Herpesvirus Nukleokapsid DNA aus infizierten Zellen. 4,5 Die ersten Reinigungsschritte Ziel gereinigten viralen Kapside zu isolieren, die enthalten und schützen die virale DNA während der Extraktion und Zentrifugationsschritte dass zelluläre Proteine und DNA zu entfernen. Lysis von Nukleokapside gibt dann die virale DNA, und zwei abschließende Phenol-Chloroform Schritte entfernen verbleibenden Proteine. Die endgültige DNA aus der Lösung erfasst ist hoch konzentriert und rein, mit einer durchschnittlichen OD 260/280 von 1,90. Je nach der Menge der infizierten Zellen verwendet, die Erträge der viralen DNA-Bereich von 150 bis 800 ug oder mehr. Die Reinheit dieser DNA macht es stabil während der Langzeit-Lagerung bei 4C. Diese DNA ist somit ideal für Hochdurchsatz-Sequenzierung, high fidelity PCR-Reaktionen, und Transfektionen geeignet.
Vor Beginn des Protokolls, ist es wichtig, die durchschnittliche Anzahl der Zellen pro Schale (z. B. durchschnittlich 8 x 10 6 PK-15-Zellen in einer konfluenten 15 cm Schale), und der Titer der viralen Lager verwendet werden wissen ( zB 1 x 10 8 Plaque-bildenden Einheiten pro ml). Diese sind notwendig, um die entsprechende Multiplizität der Infektion (MOI) für das Protokoll zu berechnen. 6 Zum Beispiel, um eine 15 cm Schüssel mit PK-15-Zellen mit den oben genannten viralen Lager, bei einer MOI von 5 infiziert, würden Sie 400 ul viralen Lager und verdünnen Sie es mit 3,6 ml Medium (insgesamt Impfung Volumen von 4 ml für eine 15 cm-Platte).
Mehrere virale DNA-Präparate können zur gleichen Zeit vorbereitet werden. Die Anzahl der gleichzeitigen Vorbereitung ist nur durch die Anzahl der Rohre durch die Ultrazentrifuge Rotor statt Limited (einer pro-Virus; siehe Schritt 3,9 unten). Hier beschreiben wir das Verfahren, als ob die für einen Virus getan.
Protokoll
1. Erster Tag: Virusinfektion und Herstellung der Puffer
- Bereiten 5-10 Gerichte (15 cm Durchmesser) Gewebekulturzellen für eine Infektion, simplex zB PK-15-Zellen für Pseudorabiesvirus (PRV) oder Vero-Zellen für Herpes-Virus (HSV).
- Wenn die Zellen 95 sind - 100% konfluent, infizieren sie zu einem (MOI) von 5-10. Um dies zu tun, impfen jede Platte mit Viren Lager in einem Gesamtvolumen von 4 ml pro Platte, dann inkubieren die Platten für 1 Stunde bei 37 ° C. Rock-Platten sanft alle 15 Minuten, um sicherzustellen, dass die Zellmonolayer vollständig beschichtet mit dem Virus Inokulum bleibt. In der Zwischenzeit, warm das Medium für den nächsten Schritt.
- Nach einer Stunde der Infektion, absaugen viralen Inokulum von den Platten, 15 ml warmes Medium und Inkubation bei 37 ° C für 12-20 Stunden in einem befeuchteten Inkubator.
- Bereiten LCM-Puffer (siehe Tabelle 1) und Rock-Nacht bei 4 ° C für eine gute Durchmischung. Bereiten TNE zur Resuspension der viralen DNA (siehe Tabelle 2).
2. Zweiter Tag, Phase 1: Cell Lysis und Ultrazentrifugation
- Visuell, dass die Infektion der Zellen hat einheitliche zytopathischen Effekts (CPE) verursacht. Lassen Infektion, um die Fortschritte, bis alle Zellen aufgerundet haben, aber noch nicht von der Platte gehoben.
- Kratzen Sie die infizierten Zellen in das Medium, und kombinieren Zellen und Medium in 50 ml konische Röhrchen. Die Zahl der konischen Rohren für diesen Schritt benötigt wird von der Anzahl der Gerichte für eine Infektion in Schritt 1.2 oben abhängen, kann z. B. ein 50 ml konischen Rohr zu Pellets verwendet werden maximal 3 Gerichte von 15 ml Medium je Optional:. Spülen Platten mit 10 ml PBS und mit den Zellen und Medium zu verbinden.
- Centrifuge Zellen und Medium für 10 Minuten bei 2000 relativ centifugal (RZB) bei Raumtemperatur, dann absaugen Überstand und resuspendieren jedes Pellet in 10 ml PBS. Wenn die Pellets aus einer Virusinfektion in mehrere konische Röhrchen in Schritt 2.2 verteilt wurde, können diese in einem konischen Rohr bei diesem Schritt wieder zusammengeführt werden. Wiederholen Sie die Zentrifugation und Aspiration. Optional: Das Pellet kann bei -20 ° C gelagert werden und das Protokoll weiter zu einem späteren Zeitpunkt.
3. Zweiter Tag, Phase 2: Ultrazentrifugation
Halten Sie das Zellpellet und LCM-Puffer auf Eis, wenn möglich während der folgenden Schritte.
- Add β-Mercaptoethanol auf 0% Glycerin - LCM-Puffer. Begin Kühlung der Ultrazentrifuge (für Schritt 3,9 unten), indem Sie sie auf 4 ° C und das Einschalten des Vakuums.
- Zellpellet in 5 ml von 0% Glycerin - LCM-Puffer, bis es nicht mehr klumpig. Wenn nötig, Wirbel das Rohr zu brechen alle ungelösten Zellpellet.
- Auszug durch Zugabe von 1,5 ml Freon (1,1,2-Trichlor-1 ,2,2-trifluorethan) und Vortex kräftig. Sofort für 10 min bei 2000 rcf zentrifugiert bei einer Temperatur von 4 ° C. Sammeln Sie die obere Schicht mit einem breiten Bohrung Pipettenspitze (Vermeidung der Schnittstelle) und Transfer in ein neues Röhrchen Optional:. Wenn das Pellet einer gallertartigen solide, können Sie schnell gießen Sie die obere Schicht in ein neues Röhrchen.
- Wiederholen Sie die Freon-Extraktion und Zentrifuge wieder.
- Sammeln Sie die obere Schicht (~ 5 ml) und an einem neuen Polyallomer Ultrazentrifuge Röhre. Add β-Mercaptoethanol auf die beiden verbleibenden Glycerin - LCM-Puffer.
- Bereiten Sie einen Gradienten in der Polyallomer Zentrifugenröhrchen durch Unterlegen der Freon-Extrakt (oberste Schicht) mit 3 ml 5% Glycerin - LCM (Mittelschicht) und dann wieder Unterlegen mit 2,5 ml 45% Glycerin - LCM (untere Schicht). Verwenden Sie einen dünnen Pipette zum Überlaufen des Rohres Inhalte zu verhindern.
- Falls erforderlich, bereiten eine entsprechende Balance Rohr mit den gleichen Anteilen von LCM-Puffer.
- Transfer-Rohre in Ultrazentrifuge Eimer. Balance-Eimern bis zu 0,1 g voneinander, durch vorsichtiges Hinzufügen zusätzlicher 0% Glycerin - LCM-Puffer, um die oberste Schicht (~ 50-100 ul zu einem Zeitpunkt).
- Mit einem kalten Ultrazentrifuge mit einer horizontalen oder Ausschwingrotor, drehen Sie das ausgewogene Proben für 1 Stunde bei 77.000 rcf (z. B. 25.000 UpM für eine SW41Ti Rotor) bei einer Temperatur von 4 ° C.
- Während Ultrazentrifugation, um ein Glas Haken schwimmenden DNA bei der Ethanol-Fällung (4,6 unten) zu erfassen. Halten Sie beide Enden ein Glas Pasteur-Pipette sowie die Aussetzung der mittlere Abschnitt über einer Flamme. Wenn ein Abschnitt des Glases fast geschmolzen ist, ziehen Sie vorsichtig auf das Glas strecken, biegen Sie es vorsichtig, um eine eng abgewinkelten Haken (<90 Grad) zu erstellen, und ziehen Sie kräftig zu versiegeln Ende. Wenn die Spitze des Glases Haken offen ist, halten Sie die Spitze über der Flamme, so dass das Glas schmilzt genug, um es zu schließen.
- Nach der Ultrazentrifugation, sollten Sie eine dünne opake Pellet mit einem dunklen Fleck in der Mitte zu sehen. Vorsichtig absaugen der Flüssigkeit aus dem Rohr, einschließlich Schmalz an den Seiten, aber unter Vermeidung der Pellet am Boden des Röhrchens.
- 0,5 ml TNE bei Raumtemperatur.
- Lassen Sie das Pellet für mindestens 10 Minuten lang Hydratation des Pellets zu ermöglichen. Optional: Das Pellet kann auch in TNE Nacht resuspendieren, wenn bei 4 ° C gehalten
4. Dritter Tag: "Ghost" DNA Niederschlag
- Break up das Pellet durch Pipettieren mit einer kleinkalibrigen Pipettenspitze (zB p200 Pipettenspitze). Mach dir keine Sorgen Scheren bei diesem Schritt, da die virale DNA ist noch in Kapside an dieser Stelle enthalten. Fügen Sie die folgenden Reagenzien auf das Röhrchen mit dem viralen Pellet bei Raumtemperatur, um Kapside zu zerstören:
- 4,25 ml TNE
- 0,25 ml 10% SDS
- 2 mg Proteinase K
Hüten Sie sich vor Scheren von hier aus, z. B. die Verwendung großer Bohrung Pipetten und nicht vortexen der viralen Material
- Auszug viraler Proteine durch Zugabe von 5 ml Phenol-Chloroform und beginnt sofort mit Invertieren oder Vortexen, um eine Emulsion zu erhalten. Mix für 10 Sekunden, dann Zentrifuge die Emulsion für 5 Minuten bei 2000 rcf bei Raumtemperatur. Sammeln Sie die obere Schicht mit einem breiten Bohrung Pipettenspitze, die Vermeidung der Schnittstelle und die Übertragung in ein neues Röhrchen Optional:. Verwenden Phase Lock Gel (PLG) Rohre in diesem Schritt, um eine Verunreinigung von der Oberfläche zu vermeiden.
- Wiederholen Sie die Phenol-Chloroform-Extraktion und Zentrifuge wieder.
- Nach dem zweiten Phenol-Chloroform-Extraktion, sammeln die oberste Schicht in eine 30 ml Glas Corex Röhrchen und Chill das Rohr bei -20 ° C für 10-15 Minuten, wobei darauf geachtet, dass sie nicht einfrieren.
- 10 ml eiskaltem Ethanol, decken das Rohr (z. B. durch Recken ein Stück Parafilm M over the top) und invertieren, um sofort zu mischen. Achten Sie auf eine DNA "Geist" zu erscheinen, die aus einer dünnen klebrigen Niederschlag besteht. Das Röhrchen vorsichtig weiter vermischen und verursachen den klebrigen DNA ausfällt, um die Cluster zusammen.
- Verwenden Sie ein Glas Haken, um die DNA ghost (s) zu erfassen. Sorgfältig Blot die DNA, um überschüssige Flüssigkeit zu entfernen, dann setzen Sie den Haken (Spitze nach unten) in ein 1,5 ml-Tube und trocknen lassen. Add 0,25 bis 0,5 ml TE, um die DNA Geist aufzulösen. Lassen Resuspension der DNA für mindestens 1 Stunde vor. DNA bei 4 ° C. Optional: Um DNA-Ausbeute zu maximieren, brechen das Glas Haken in die 1,5-ml-Tube kann, so dass Resuspension von der Glassplitter im Laufe der Zeit weiter.
5. Repräsentative Ergebnisse
Bei einer ausreichend hohen MOI, sollten die Zellen vollständig CPE innerhalb von ~ 18 Stunden nach der Infektion (HPI) zu erreichen für Wildtyp-PRV-Stämme, und ~ 24 hpi für Wildtyp-HSV-1-Stämme (Abbildung 1). Sobald das infizierte Zellpellet geerntet wird, können die verbleibenden Schritte-Protokoll vollständig in einem langen Tag oder sich über zwei Tage (Abbildung 2).
Bei der Vorbereitung Glas Haken an der DNA Geist zu erfassen, ist es wichtig, den Haken Winkel weniger als 90 Grad, so dass sie später in die Basis eines 1,5-ml-Tube (Abbildung 3) passen. Die Abdichtung der Spitze dieses Hakens verhindert DNA-Verlust in der Pipette.
DNA Geister Form bei der Fällung und wird als weiße, zähe Fäden (Abb. 4) erscheinen. Diese aggregieren und kleben aneinander und / oder das Glas Haken benutzt, um die DNA zu erfassen. So das gleiche Glas Haken kann verwendet werden, um aufzusammeln mehrere Threads von DNA aus dem Niederschlag Lösung sein.
| Wählen Sie Spalte auf das gewünschte Volumen: | 10 ml | 15 ml | 20 ml | 40 ml |
| 1M KCL | 1,3 ml | 1,9 ml | 2,5 ml | 5 ml |
| 1M Tris (pH 7,4) | 300 pl | 450 ul | 600 ul | 1,2 ml |
| 1M MgCl 2 | 50 pl | 75 ul | 100 ul | 200 ul |
| 0,5 EDTA | 10 pl | 15 ul | 20 pl | 40 ul |
| NP40/IGEPAL | 50 pl | 75 ul | 100 ul | 200 ul |
| β-Mercaptoethanol (unmittelbar vor Gebrauch hinzugefügt) | 4,3 ul | 6,5 ul | 8,6 ul | 17,2 ul |
| Verwenden Anteile für gewünschte Prozent Glycerin (0, 5 oder 45%) | ||||
| 0% Glycerin | Keiner | Keiner | Keiner | Keiner |
| Wasser | 8,3 ml | 12,5 ml | 16,7 ml | 33,4 ml |
| 5% Glycerin | 0,5 ml | 0,8 ml | 1,0 ml | 2,0 ml |
| Wasser | 7,8 ml | 11,7 ml | 15,7 ml | 31,4 ml |
| 45% glycerol | 4,5 ml | 6,8 ml | 9,0 ml | 18,0 ml |
| Wasser | 3,8 ml | 5,7 ml | 7,7 ml | 15,4 ml |
Tabelle 1. Rezepte für die Zubereitung von LCM-Puffer
| Für 50 ml Volumen |
| 5 ml 1M NaCl |
| 2,5 ml 1M Tris, pH 7,5 |
| 1 ml 0,5 EDTA |
| 41,5 ml H 2 O |
Tabelle 2. Vorbereitung der TNE (0,1 M NaCl, 50 mM Tris, pH 7,5, 10 mM EDTA)
| Für 1 Liter |
| 0,2 g KCl |
| 0,2 g KH 2 PO 4 |
| 8 g NaCl |
| 1,15 g Na 2 HPO 4 |
| H 2 O auf 1L |
Tabelle 3. Herstellung des PBS (2,7 mM KCl, 1,5 mM KH 2 PO 4, 137 mM NaCl und 8,1 mM Na 2 HPO 4, pH 7,0)
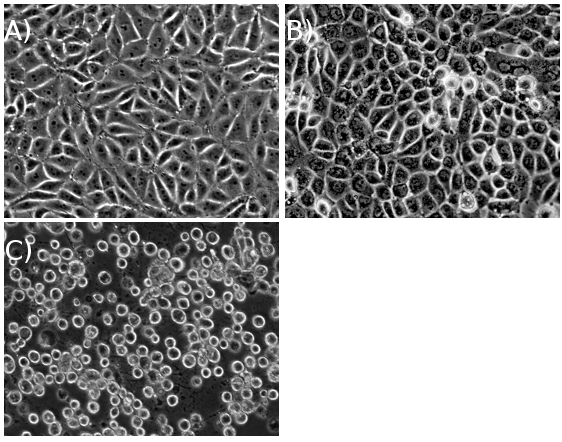
Abbildung 1. PK15-Zellen (A) vor der Infektion, (B) auf halbem Wege durch Infektion und (C) auf zytopathischen Effekt (CPE), nachdem eine hohe Multiplizität der Infektion.

Abbildung 2. Überblick über das Protokoll.

Abbildung 3. Drei repräsentative Beispiele aus Glas Haken benutzt, um die virale DNA Geister zu sammeln.

Abbildung 4. Repräsentatives Beispiel für eine wohlgeformte und reichlich DNA "Geist".
Diskussion
Teile dieses Protokoll wurden ursprünglich für die virale DNA-Isolierung in BSL4 Bedingungen entwickelt, aber es passt ebenso gut auf nicht-BSL Bedingungen. 4 Wir verwenden häufig dieses Protokoll, um DNA aus den Alpha-Herpesviren PRV und HSV-1, das DNA-Genome sind zu isolieren eingeschlossen in einem proteinhaltigen Kapsid, umgeben von einer Lipid-Hülle. 7,8 Jedoch ist es wahrscheinlich, direkt anpassungsfähig zu anderen großen DNA-Viren, wie zB Beta-und Gamma-Herpesviren und Adenoviren. Ähnliche Extraktionen werden in der Regel für die RNA-Viren. Verwendet 9
Die Robustheit dieses DNA-Präparation zu erwartenden Ergebnisse aus den verschiedenen Methoden der Reinigung, die enthalten sind. Die anfängliche Freon Extraktionen denaturieren Lipidmembranen, die Trennung Zellbestandteile und auch die Freigabe der Lipid-Hülle und äußeren Tegument Proteine, die Herpesvirus Kapside umgeben. Dies wird durch Ultrazentrifugation, wo die schwere virale Nukleokapside Pellet durch zwei Gradienten Kissen, effektiv trennt sie von den meisten anderen zellulären Komponenten gefolgt. Diese Kapside werden resuspendiert und die virale Nukleokapsid DNA ist durch Aufbrechen der Kapside mit Proteinase K und Reinigungsmittel freigegeben. Zwei Phenol-Chloroform-Extraktion gründlich entfernen Nukleokapsid Komponenten und alle übrigen zellulären Proteinen. Schließlich reduziert Fällung des großen viralen DNA-Genome in Lösung Verschleppung von Salzen oder partikuläre Verunreinigungen.
Dieses Verfahren, um virale Nukleokapsid DNA isolieren bietet reichlich, hochreines Material für nachgelagerte Anwendungen. Die Kombination von mehreren Extraktions-und Zentrifugationsschritte unterscheidet dieses Protokoll aus einfacheren Single-Extraktion-Protokolle, die mehr Zelltrümmer oder abgebauten Proteins Produkte verlassen mit dem DNA-10. Protein Verunreinigungen verringern die Lagerstabilität der viralen DNA und reduzieren Transfektionseffizienz in die Zellen. Cellular DNA Verunreinigungen negativ beeinflussen PCR-Reaktionen und Hochdurchsatz-Sequenzierung Protokolle. 1 Die DNA-Ausbeute dieses Protokolls ist ebenfalls hoch, so dass es gut Restriktionsfragmentlängenpolymorphismus (RFLP)-Analyse und Southern-Blot. 5,11 Ein Nukleokapsid Vorbereitung geeignet sorgt für ausreichende Material für alle diese Analysen.
Die Menge der Zellen für die Infektion verwendet Auswirkungen der möglichen Ausbeute von Virus-DNA. Für PRV-Stämme mit einem Wildtyp-Wachstumsrate, Eingang von 5-10 Gerichte der PK-15-Zellen (eine 15 cm Durchmesser Schüssel hält ca. 8 x 10 6 Zellen) liefert typischerweise 250-500 pg der viralen DNA. Für virale Mutanten mit einer verringerten Ausbeute an infektiösen Virionen, sollte das Ausgangsmaterial nach oben entsprechend skaliert werden. Eine Verdoppelung der Anzahl der Eingangs-Gerichte werden etwa die doppelte Ausbeute und können mit den gleichen Mengen an Reagenzien hier beschriebenen verarbeitet werden. Zur Erhöhung der Eingang über diesen Punkt hinaus, empfehlen wir die Trennung des Ausgangsmaterials in zwei parallele Handhabung Streams (zB zwei Zellpellets und zwei Extraktion Rohre) bis Schritt 3.13. Zwei Ultrazentrifugation Pellets der gleichen Virusstamm kann in einem Rohr an dieser Resuspension Schritt kombiniert werden. Wenn die DNA nicht sauber Formular ein Gespenst am Ende des Verfahrens ist die primäre Fehlersuche Ansatz bei der Eingabe Menge an Zellen, die DNA-Ausbeute erhöhen und verbessern ihre Niederschläge zunehmen.
Andere Bedingungen kann auch Auswirkungen auf den Erfolg von ghost Bildung. Zum Beispiel ist es wichtig, Zeit der Ernte von Infektionen an einem Punkt, wenn virale Nukleokapside reichlich vorhanden sind, sind aber meist intra-oder Zell-assoziierten. Virionen freigesetzt, das Medium wird durch diesen Vorgang nicht erfasst werden und somit Ernten von Zellen zu spät in der Infektion (zB bei der CPE hat bis zu dem Punkt, wo die Zellen aus der Schale lösen fortgeschritten) werden potenzielle DNA-Ausbeute und Geist zu vermindern. Es ist auch wichtig, um eine vollständige Auflösung des geernteten Zellpellet in LCM-Puffer (Schritt 3,2), um vollen Nutzen aus den folgenden Extraktionsschritt nehmen; dieser Resuspension erfordert mehr Zeit und Sorgfalt, wenn das Zellpellet wurde in der vorhergehenden Stufe eingefroren. Minor verfahrenstechnischen Details auf die DNA-Ausbeute wie auch. Während Sie die Schritte 3 und 4 können ohne Verwendung gekühlt Lösungen und halten alle Röhrchen auf Eis durchgeführt werden, ist die Erfolgsquote von DNA Geisterbilder viel höher, wenn die Reagenzien Kaltluft versorgt werden. Auch die Stabilität der β-Mercaptoethanol in Lösung sinkt im Laufe der Zeit und damit das Hinzufügen zur LCM-Lösungen unmittelbar vor der Verwendung ihrer Verringerung der Kapazität optimiert, die Verbesserung der Protein-Störungen und zunehmender DNA-Ausbeute und ghost Bildung. Sorgfältige Aufmerksamkeit auf diese Daten werden zur Verbesserung der Leistung von hoher Qualität virale DNA.
Da virale DNA ist dickflüssig, kann die resultierende Lösung heterogen sein. Dass mehr Zeit für Aufwirbelung aus dem Glas Haken erhöht die Nutzungsdauer DNA-Ausbeute und verbessert die Lösung Homogenität. Standard-Spektrophotometriekann verwendet werden, um DNA-Ausbeute und Reinheit zu quantifizieren sein. DNA Fluorimetrie bietet noch präzisere Maßnahmen der DNA-Ausbeute (zB Invitrogen PicoGreen dsDNA-Färbung).
Offenlegungen
Keine Interessenskonflikte erklärt.
Danksagungen
Die Autoren schätzen die Beiträge Greg Smith, Lisa Pomeranz, Matt Lyman, Marlies Eldridge, Halina Staniszewska Goraczniak, und die Mitglieder des Enquist Labor in die Feinabstimmung dieses Protokoll.
Materialien
| Name | Company | Catalog Number | Comments |
| Name des Reagenz | Firma | Katalog-Nummer | Kommentare |
| Freon (1,1,2-Trichlor-1 ,2,2-trifluorethan) | Fischer | T178-4 | Erkundigen Sie sich bei Ihrer Institution Richtlinien zur angemessenen Entsorgung von Freon-haltigen Abfällen, oder sehen Sie Mendez et al. für potenzielle Freon Alternativen. 9 |
| Phase Lock Gel Röhrchen, Heavy 15ml Kapazität | 5 PRIME | 2302850 | Fakultativ |
| Polyallomer Ultrazentrifuge Rohre | Beckman * | 331372 * | * Wählen Sie Röhren für Ihre eigenen Ultrazentrifuge, diese sind nur als Beispiel enthalten |
| NP-40 / IGEPAL | Sigma | I-3021 | |
| PK-15-Zellen | ATCC | CCL-33 | |
| Vero-Zellen | ATCC | CCL-81 | |
| PBS | HyClone | SH30028.03 |
Referenzen
- Szpara, M. L., Parsons, L., Enquist, L. W. Sequence variability in clinical and laboratory isolates of herpes simplex virus 1 reveals new mutations. J Virol. 84, 5303-5313 (2010).
- Banfield, B. W., Kaufman, J. D., Randall, J. A., Pickard, G. E. Development of pseudorabies virus strains expressing red fluorescent proteins: new tools for multisynaptic labeling applications. J Virol. 77, 10106-10112 (2003).
- Kobiler, O., Lipman, Y., Therkelsen, K., Daubechies, I., Enquist, L. W. Herpesviruses carrying a Brainbow cassette reveal replication and expression of limited numbers of incoming genomes. Nat Commun. 1, 146-146 (2010).
- Enquist, L. W., Madden, M. J., Schiop-Stanley, P., Vande Woude, G. F. Cloning of herpes simplex type 1 DNA fragments in a bacteriophage lambda vector. Science. 203, 541-544 (1979).
- Smith, G. A., Enquist, L. W. Construction and transposon mutagenesis in Escherichia coli of a full-length infectious clone of pseudorabies virus, an alphaherpesvirus. J Virol. 73, 6405-6414 (1999).
- Flint, S. J., Enquist, L. W., Racaniello, V. R., Skalka, A. M. Principles of virology. , 3rd edn, ASM Press. (2008).
- Pomeranz, L. E., Reynolds, A. E., Hengartner, C. J. Molecular biology of pseudorabies virus: impact on neurovirology and veterinary medicine. Microbiol Mol Biol Rev. 69, 462-500 (2005).
- Roizman, B., Pellett, P. E. Fields Virology. Knipe, D. M., Howley, P. M. , 2 ed, Lippincott Williams & Wilkins. 2381-2397 (2001).
- Mendez, I. I., Hermann, L. L., Hazelton, P. R., Coombs, K. M. A comparative analysis of freon substitutes in the purification of reovirus and calicivirus. J Virol Methods. 90, 59-67 (2000).
- Gharabaghi, F., Aymard, M., Trotemann, P., Gerdil, C. A rapid and simplified micromethod for subtyping varicella-zoster virus. J Med Virol. 31, 129-134 (1990).
- Granstedt, A. E., Szpara, M. L., Kuhn, B., Wang, S. S., Enquist, L. W. Fluorescence-based monitoring of in vivo neural activity using a circuit-tracing pseudorabies virus. PLoS One. 4, e6923-e6923 (2009).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten