Imagem de micro-TC de uma medula espinal de camundongo
Visão Geral
Fonte: Peiman Shahbeigi-Roodposhti e Sina Shahbazmohamadi, Departamento de Engenharia Biomédica, Universidade de Connecticut, Storrs, Connecticut
É um fato pouco conhecido que a descoberta e (inadvertida) utilização de raios-X rendeu o primeiro Prêmio Nobel de Física. A famosa imagem de raio-X da mão da esposa do Dr. Röntgen de 1895 que enviou ondas de choque pela comunidade científica parece a maioria das imagens modernas de raios-X médicos 2D. Embora não seja a mais nova tecnologia, a imagem de absorção de raios-X é uma ferramenta indispensável e pode ser encontrada nos principais laboratórios de P&D e universidades do mundo, hospitais, aeroportos, entre outros lugares. Indiscutivelmente, os usos mais avançados de imagens de absorção de raios-X envolvem a obtenção de informações como o tipo encontrado em um raio-X médico 2D, mas realizado em 3D através de uma tomografia computadorizada (CT ou micro-CT). Ao fazer uma série de projeções de raios-X 2D, o software avançado é capaz de reconstruir dados para formar um volume 3D. As informações 3D podem e, provavelmente, incluirão informações de dentro do objeto sondado sem ter que ser cortada. Aqui, será obtida uma microcografia, e os principais fatores que impactam a qualidade da imagem serão discutidos.
Princípios
Os raios-X podem ser vistos como fótons com uma faixa de energia de 0,1 - 100 keV ou ondas eletromagnéticas com comprimentos de onda que variam de 0,01 a 10 nm. Raios-X podem ser criados de várias maneiras diferentes, mas aqui a discussão é limitada a imagens contínuas de raios-X de feixe de cone de espectro. Esses raios-X são criados por um fenômeno conhecido como "Bremsstrahlung", que significa "radiação de frenagem" em alemão. Isso ocorre quando uma partícula carregada sofre uma aceleração [1]. Em uma fonte de raios-X, um elétron carregado negativamente é baleado em um tubo de vácuo e impacta um material alvo (geralmente tungstênio, molbênio, cobre ou outro metal) e através de sua desaceleração, emite fótons na escala de um raio-X. Um espectro contínuo de raios-X é gerado porque a desaceleração não é uniforme nem instantânea, embora haja picos na distribuição centrados em torno das energias características do material alvo, como visto em [2]. Existem diferentes curvas para diferentes energias e materiais de destino. Isso é uma coisa muito importante a ser considerada ao realizar uma micro-tomografia computadorizada e será discutida em uma seção posterior.
Um sistema micro-CT típico possui três componentes primários, como mostrado em [3]. Os componentes básicos deste sistema incluem: a) fonte de raios-X, b) estágio rotacional para montagem da amostra, e c) painel plano ou objetivo óptico com detectores CCD. Os raios-X deixam a fonte e são absorvidos, transmitidos ou espalhados pela amostra antes de chegar ao detector. A absorção é a interação predominante medida em microCT, pois diferentes materiais no corpo absorvem raios-X de forma diferente. Por exemplo, os ossos contêm muito cálcio atômico, que absorve bem os raios-X. Assim, os ossos bloqueiam os raios-X de chegar ao detector, e acabam aparecendo na imagem como uma sombra. A amostra é então girada gradualmente e o processo é repetido até que a amostra tenha sido imageda por 360° ou em alguns casos, 180°. A saída da tomografia é uma série de projeções 2D em diferentes orientações que podem ser reconstruídas em um volume 3D.
Micro-CT é uma forma de microscopia, ganhando seu nome a partir de sua capacidade de resolver recursos de micro-escala. A limitação de resolução para esta categoria específica de microCC é regida pelo tamanho do local de origem e pela propagação de energia, e pelo tipo e eficácia do detector; não pelo comprimento de onda do raio-X. A melhor resolução possível para esta categoria de micro-CT é em torno de 500-700 nm em três dimensões. No entanto, é possível detectar características de um décimo ou centésimo desse tamanho.
A ampliação é realizada na maioria dos sistemas de Tomografia computadorizada por meio de ampliação geométrica. A imagem em [3] ilustra a ideia de ampliação geométrica. É facilmente imaginado como um efeito sombra. Quanto mais perto uma fonte de luz está de um objeto; maior a sombra do objeto aparecerá em uma parede ou tela. Da mesma forma, se essa parede ou tela se afastasse da fonte de luz estacionária e da amostra, a sombra do objeto aumentaria de tamanho, mas ficaria mais fraca. Otimizar as distâncias de trabalho da fonte de raios-X e detector é uma tarefa muito desafiadora e mentalmente estimulante quando sinal suficiente, alta resolução e um curto tempo de varredura são desejados. Como em qualquer coisa, há limitações na ampliação geométrica, onde a idealização de uma fonte de ponto é destruída e as aberrações se tornam autoritárias.
Um dos muitos desafios na microCC é que a qualidade visual do volume 3D será um pouco desconhecida para o pesquisador até que o exame seja concluído e reconstruído. Embora, com bastante experiência, um exame cuidadoso de algumas projeções 2D pode fornecer informações suficientes para se sentir confiante sobre uma tomografia computadorizada. Nas seções a seguir, um conjunto de exercícios descobrirá os efeitos de diferentes parâmetros de imagem em um conjunto de dados e equipará um cientista com o entendimento necessário para obter um volume 3D limpo. Para efeitos desta investigação, amostras biológicas serão sondadas, embora o procedimento não se limite a um tipo de amostra.
Montar uma amostra soa como um passo trivial, mas é um dos mais importantes e negligenciados. Independentemente da aplicação, a amostra deve ser montada da forma mais compacta possível. Considerando a imagem em [3], imagine se a gama de posições de fonte e detector fosse limitada porque a amostra se destacava em uma direção e como isso afetaria a ampliação geométrica. Além da distância de trabalho, a montagem afeta muito o throughput. Se a amostra fosse uma articulação intacta do joelho de um rato, faria sentido montar a amostra para que a tíbia e o fêmur ficassem eretos. Assim, os raios-X passariam por uma curta distância e haveria sinal suficiente no detector. A última coisa a considerar ao montar uma amostra é estabilidade. O maior inimigo da micro-TC é o movimento. Se a magnitude do movimento amostral se aproximar da resolução da varredura, provavelmente serão dados inúteis. O movimento deve ser limitado pela adesão segura a uma montagem e com controle para a alteração da composição da amostra. Para amostras biológicas, isso significa garantir que não mudará a morfologia através da evaporação ao longo do comprimento do exame. Suspensão em gel de agarose ou embrulho em uma fina camada de filme de parafina são abordagens possíveis para evitar desidratação e movimento.
A energia de raios-X também terá um grande efeito na qualidade do volume 3D final. O objetivo é adquirir um sinal suficiente no detector enquanto tem atenuação suficiente da amostra. Atenuação de raios-X segue Equação (1), onde eu é o número final de contagens (intensidade), I0 é o número inicial de contagens, μ é o coeficiente de absorção de massa que é exclusivo de um determinado material e energia de raios-X (amplamente publicado), ρ é a densidade do material, e x é o comprimento do caminho do raio-X.
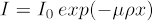 (1)
(1)
Idealmente, i/I0 (a.k.a. valor de transmissão) deve ser entre 5 - 95% para toda a orientação da amostra, com os melhores resultados vindo em torno da faixa média. Para verificar esse valor, pegue uma imagem da amostra e, em seguida, divida os valores de pixel da imagem por uma imagem de ar (ou seja, com a amostra fora do campo de visão). Essa normalização é comumente encontrada em fluxos de trabalho de software do sistema. Não é sempre que amostras biológicas exigem o uso de filtragem de raios-X na fonte, de modo que não será coberto aqui. Além de ter um valor de transmissão ideal, o número ideal de contagens para qualquer parte da amostra é de 5000 contagens. Para garantir isso, o tempo de exposição por projeção pode precisar ser aumentado. Isso aumentará o tempo total de varredura. A Figura 1 exibe projeções 2D limpas.
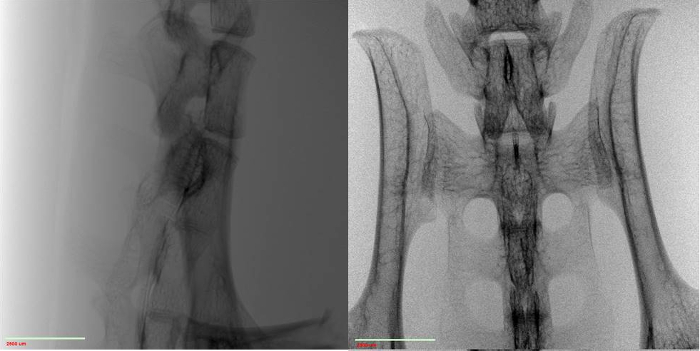
Figura 1: Imagens 2D da medula espinhal do rato normalizadas contra o ar a 0° (esquerda) e 90° (direita).
Procedimento
1. Montagem de uma amostra (osso)
- Para examinar uma rede de ossos, como uma coluna vertebral, suspenda a estrutura em um gel de agarose e permita a cura em um tubo plástico de paredes muito finas (Figura 2). A magreza do tubo é muito importante, afetando muito o rendimento do sinal e a qualidade geral da imagem. Isso, por sua vez, afeta sua capacidade de resolver recursos. O valor de transmissão do tubo deve ser o mais próximo possível de 100%.
- Monte o tubo no estágio da amostra com fita ou fazendo um suporte personalizado, garantindo que a amostra esteja estacionária e estável quando o estágio girar.

Figura 2: Coluna do rato suspensa em gel de agarose dentro de tubo plástico de parede fina sentado no estágio amostral do sistema micro-CT.
2. Aquisição de Imagens
- Ligue a fonte de raios-X para uma energia em torno da faixa de 90 keV (90 kV e 10 W).
- Após o aquecimento da fonte e a liquidar a energia, adquira uma imagem através do software do sistema.
- Verifique o valor da transmissão normalizando a imagem em relação a uma imagem de ar. Para aquisição e aplicação automática de referência, certifique-se de que a amostra pode se mover em uma determinada direção sem travar.
- Se a imagem tiver uma transmissão muito alta, diminua a energia gradualmente até que o valor de transmissão seja suficiente. Certifique-se de aumentar o tempo de exposição de acordo para que a imagem não pareça ruidosa e granuda. Se a imagem tiver transmissão muito baixa, aumente a energia gradualmente até que o valor de transmissão seja suficiente.
- Comece a mover a fonte de raios-X mais perto da amostra, enquanto tome muito cuidado para não bato-los. Trazer a fonte o mais perto possível da amostra é um passo na direção de maximizar o throughput e garantir a melhor resolução possível.
- Como isso é feito, refine o campo de visão da amostra deslocando o estágio amostral com seus atuadores lineares.
- O software mostrará um parâmetro conhecido como tamanho de pixel que é tratado semelhante à resolução atual (embora seja realmente diferente).
- Se o número ainda for muito grande e a fonte estiver muito próxima, o detector pode começar a se afastar da amostra.
- Se o número for muito pequeno, mova cautelosamente o detector para mais perto da amostra.
- Tente diferentes objetivos ópticos e posições de detector também, mas cuidado com a complicação que isso introduz ao tentar otimizar os parâmetros de varredura.
- Verifique todas as orientações da amostra para garantir que não haja acidentes para encontrar o melhor tempo de exposição. Isso é realizado devido à mudança da distância de trabalho, tamanho do pixel e posição da amostra.
- Gire lentamente a amostra em incrementos de 2 graus enquanto monitora sua posição em relação à fonte e ao detector através da câmera do gabinete. Certifique-se de mover a fonte e o detector se uma colisão pode ocorrer.
- Encontre o maior comprimento do caminho do raio-X que resulta no menor número de valores de contagem/transmissão e encontre o tempo de exposição necessário para garantir cerca de 5000 contagens em todos os lugares.
3. Submissão e Reconstrução da Tomografia
O processo de reconstrução do ponto de vista do usuário não é mais complicado do que qualquer uma das outras seleções de parâmetros feitas nas etapas anteriores. No entanto, a programação e a despesa computacional para este processo são realmente bastante substanciais. Os usuários devem procurar entender melhor o que está acontecendo sob a interface do software suave e como as decisões impactam o produto final. Muitos sistemas ct utilizam algoritmos iterativos de reconstrução algébrica em que as projeções 2D são convertidas em uma série de equações lineares descrevendo valores de pixels. Alguns outros sistemas utilizam algoritmos filtrados de projeção traseira onde radon transforma converter as projeções em um sinograma e, em seguida, são passados através de uma série de operações de integração de linha. Claro, alguns usam outras abordagens e até métodos híbridos. No menor nível de envolvimento com esses algoritmos, sabe-se que o número de projeções e o deslocamento total rotacionado têm um impacto no volume final reconstruído.
- Primeiro, decida se deve digitalizar mais de 180° ou 360° com base na proporção da amostra. Se a amostra tiver uma proporção alta, de tal forma que o comprimento do caminho do raio-X seja cerca de 4 ou mais vezes maior na orientação de 90°do que a orientação de 0°do que uma varredura de 180°seria uma escolha inteligente. (O argumento é que as informações coletadas no curto comprimento do caminho do raio-X não são tão diferentes de um lado para o outro. Se mais projeções puderem ser dedicadas às orientações longas de comprimento do caminho do caminho de raios-X do que o conjunto de dados se beneficiará. O deslocamento angular entre as projeções será menor e haverá mais informações dessas orientações complicadas sendo alimentadas nos algoritmos de reconstrução.) Se a proporção não for tão alta, use 360°-scans.
- Em seguida, escolha o número de projeções e o deslocamento angular total, que ditará o ângulo entre as projeções. Quanto menor esse ângulo, menor será a interpolação e menos informações de recursos finos serão truncadas. (Um equilíbrio deve ser estabelecido porque mais projeções significam um tempo de varredura mais longo, que se correlaciona com uma janela maior onde as amostras podem se mover, menos tempo para digitalizar outras coisas e uma vida útil de fonte mais curta. Uma regra geral é ter pelo menos 800 projeções acima de 360° e não ultrapassar 3200 projeções.
- Envie a varredura.
- Após o término da tomografia (geralmente entre 4 a 16 horas), traga séries 2D de imagens para o software de reconstrução do sistema (ou de algum código aberto).
- Selecione a correção ideal do turno do centro. O shift central é um parâmetro que alinha os projetos para alinhar (pense em um baralho de cartas que precisa ser coletado e alinhado para sentar-se como uma pilha limpa). Este valor geralmente está entre -10 a 10 pixels.
- Selecione o coeficiente de correção de endurecimento do feixe ideal. A correção de endurecimento do feixe é uma remoção artificial do contraste produzido pela filtragem de amostras. Se uma amostra for grossa o suficiente ou contiver uma gama de materiais leves e pesados, ela terá falso contraste com base na atenuação de raios-X de baixa energia (macia). Isso deve ser aplicado de forma conservadora. Um valor médio está entre 0 a 0,5.
- Submeter a reconstrução.
Resultados
As imagens a seguir dão uma visão geral dos resultados que podem ser obtidos a partir do uso de microCC com o procedimento acima indicado. Medidas qualitativas sobre absorção variada podem ser diretamente notadas com base nessas imagens. Dados quantitativos, como porosidade de material, tamanho do recurso e distribuição, etc. exigiriam processamento adicional de imagens em um software diferente.
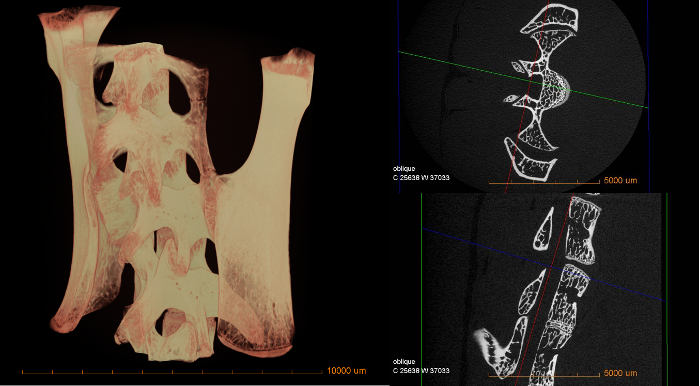
Figura 3: volume 3D de medula espinhal do rato (esquerda) e duas fatias transversais digitais (direita)
Aplicação e Resumo
Este experimento analisou os muitos fatores que devem ser considerados ao usar microC, particularmente para uma amostra biológica. Este projeto foi projetado para ajudar o pesquisador a entender como suas decisões impactarão os dados que a micro-CT pode fornecer. Como demonstrado, existem muitos parâmetros dependentes e sensíveis que devem ser considerados, incluindo: montagem, energia de raios-X, tempo de exposição, posicionamento de origem e detector, número de projeções e deslocamento angular total da varredura. Este exercício é feito como uma introdução e apenas arranha a superfície de controle sobre um conjunto de dados de tomografia computadorizada.
Este experimento se concentrou em dar uma introdução à micro-TC no que diz respeito à imagem de uma amostra biológica, mas a aplicação da tomografia de raios-X 3D se estende aos mundos da microeletrônica, geologia, fabricação aditiva, revestimentos, células de combustível e muito mais. Esses microscópios são usados para inspeção, análise de falhas, caracterização, controle de qualidade e até testes não destrutivos. Como as informações 3D reais agora são acessíveis de forma não destrutiva, as geometrias extraídas da TC podem ser importadas para simulações onde objetos podem ser testados virtualmente.
Referências
- http://www.spectroscopyonline.com/tutorial-attenuation-X-rays-matter [cited 1 November 2017]
- http://hyperphysics.phy-astr.gsu.edu/hbase/quantum/xrayc.html [cited 1 November 2017]
- A.G. Rao, V.P. Deshmukh, L. L. Lavery, H. Bale, "3D investigation of the microstructural modification in hypereutetic aluminum silicon (Al-30Si) alloy." Microscopy and Analysis 2017 [cited 1 November 2017].
Pular para...
Vídeos desta coleção:

Now Playing
Imagem de micro-TC de uma medula espinal de camundongo
Biomedical Engineering
8.0K Visualizações

Imageamento de amostras biológicas com microscopia ótica e confocal
Biomedical Engineering
35.7K Visualizações

Imageamento por MEV de Amostras Biológicas
Biomedical Engineering
23.5K Visualizações

Biodistribuição de Nano-fármacos Transportadores: Aplicações de MEV
Biomedical Engineering
9.3K Visualizações

Ultrassonografia de alta frequência da aorta abdominal
Biomedical Engineering
14.4K Visualizações

Mapeamento Quantitativo de Tensão de um Aneurisma da Aorta Abdominal
Biomedical Engineering
4.6K Visualizações

Tomografia fotoacústica para imageamento de sangue e lipídios na aorta infrarrenal
Biomedical Engineering
5.7K Visualizações

Ressonância Magnética Cardíaca
Biomedical Engineering
14.7K Visualizações

Simulações computacionais de fluidodinâmica do fluxo sanguíneo em um aneurisma cerebral
Biomedical Engineering
11.7K Visualizações

Imageamento de fluorescência de infravermelho próximo de aneurismas da aorta abdominal
Biomedical Engineering
8.2K Visualizações

Técnicas não invasivas de medição da pressão arterial
Biomedical Engineering
11.9K Visualizações

Aquisição e análise de um sinal de ECG (eletrocardiografia)
Biomedical Engineering
104.8K Visualizações

Resistência à Tração de Biomateriais Reabsorvíveis
Biomedical Engineering
7.5K Visualizações

Visualização da degeneração da articulação do joelho após lesão não invasiva do LCA em ratos
Biomedical Engineering
8.2K Visualizações

Combinação de imagens de SPECT e TC para visualizar a funcionalidade cardíaca
Biomedical Engineering
11.0K Visualizações
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados