Method Article
Planimetria digital para avaliar a cinética de fechamento de feridas em um modelo de camundongo
Neste Artigo
Resumo
As feridas representam um desafio de saúde global. Este estudo desenvolveu uma cabine fotográfica padronizada utilizando planimetria digital para minimizar a variabilidade da medição da ferida. O monitoramento de feridas em camundongos ao longo de 14 dias revelou um aumento inicial na área e no perímetro da ferida, seguido de fechamento gradual. Essa metodologia pode auxiliar na avaliação da cinética de fechamento de feridas em modelos pré-clínicos.
Resumo
As feridas crônicas, devido à sua alta prevalência, são um sério problema de saúde global. Estratégias terapêuticas eficazes podem acelerar significativamente a cicatrização, reduzindo assim o risco de complicações e aliviando a carga econômica sobre os sistemas de saúde. Embora numerosos estudos experimentais tenham investigado a cicatrização de feridas, a maioria depende de observações qualitativas ou medições diretas quantitativas. O objetivo deste estudo foi padronizar um método de medição indireta de feridas usando planimetria digital, incorporando escala e segmentação digitais. Essa abordagem aborda a falta de metodologias detalhadas e passo a passo para uma avaliação precisa da ferida. Uma cabine de fotodocumentação foi projetada e construída, e ferramentas de planimetria digital assistidas por computador foram empregadas para minimizar a variabilidade nas medições da área da ferida, perímetro e distância do centro da ferida às suas bordas. Uma ferida traumática circular (5 mm de diâmetro) foi criada na linha média dorsal ao nível da omoplata de camundongos CD1 machos (n = 4, 10 semanas de idade, 30-35 g). A evolução da ferida foi fotodocumentada por 14 dias usando a cabine de fotos personalizada, que controlava as condições de iluminação, distância focal e posicionamento do sujeito. As medidas de raspagem e ferida foram realizadas por meio de segmentação no software ImageJ, e a análise estatística foi realizada por meio de software de análise estatística. A cinética de fechamento da ferida mostrou um ligeiro aumento no tamanho e no perímetro da ferida entre o dia 0 e o dia 2, seguido por uma diminuição gradual até o fechamento completo no dia 14. A cabine de fotodocumentação e a planimetria digital assistida por computador permitiram medições quantitativas com variabilidade mínima. Em conclusão, essas ferramentas fornecem um método confiável e reprodutível para avaliar a cinética de fechamento de feridas em modelos pré-clínicos.
Introdução
A cicatrização de feridas traumáticas leva aproximadamente 21 dias e tem uma sequência bem definida de quatro fases distintas: (1) hemostasia, (2) inflamação, (3) proliferação e (4) remodelação1. Se alguma fase da cicatrização de feridas for prolongada, pode levar ao desenvolvimento de feridas crônicas1. Devido à sua alta prevalência, complicações potenciais2 e ônus econômico significativo, são considerados um problema de saúde global.
Os estudos pré-clínicos visam alcançar uma cicatrização mais rápida, promovendo a reepitelização abrangente da ferida 3,4,5, prevenindo complicações e reduzindo os custos do tratamento. Esses estudos avaliam várias estratégias, incluindo o desenvolvimento de biomateriais, intervenções farmacológicas e outros procedimentos de medicina regenerativa 6,7,8,9.
Vários modelos experimentais foram desenvolvidos para o estudo de feridas traumáticas. Alguns se concentram em características qualitativas macroscopicamente visíveis, como tamanho, indicadores de inflamação, presença de tecido de granulação, secreções e formação de crostas5. Outros analisam dados quantitativos, incluindo área, perímetro, raio, diâmetro, cor, profundidade e distâncias do centro às bordas das feridas.
Nesse sentido, a maioria das investigações in vivo mede diretamente o raio e a profundidade da ferida. No entanto, o delineamento manual das bordas da ferida em uma imagem macroscópica pode introduzir vieses na medição10. Outros estudos utilizam planimetria mecânica, utilizando folhas plásticas quadriculadas transparentes, onde as bordas da ferida são previamente delineadas; Em ambos os casos, a obtenção da área ou perímetro requer instrumentos manuais, como réguas ou planímetros digitais. Atualmente, a planimetria digital assistida por computador permite a análise computadorizada de imagens macroscópicas de feridas ou folhas plásticas. A manipulação in situ e a qualidade da imagem macroscópica são uma limitação, no entanto, essa ferramenta 11,12,13,14 reduz consideravelmente a variabilidade entre as medidas de área e perímetro.
Esta metodologia proposta oferece vantagens significativas sobre as técnicas existentes para avaliar o fechamento de feridas em camundongos15 , 16 , 17 , 18 , 19 , 20 . Embora a documentação fotográfica tenha sido considerada uma ferramenta precisa e consistente para avaliar a cinética de fechamento da ferida, estudos anteriores21,22 destacaram as limitações da medição manual da ferida, como viés do observador e variabilidade devido à iluminação e posicionamento inconsistentes da câmera. A abordagem atual aborda esses problemas padronizando as condições de imagem por meio de uma cabine personalizada, melhorando a reprodutibilidade e a precisão. Além disso, a planimetria digital computadorizada permite avaliações quantitativas mais precisas, aprimorando a avaliação das intervenções terapêuticas e minimizando os erros de medição, como evidenciado em outros estudos comparando técnicas manuais edigitais12,22, tornando-a particularmente adequada para estudos da cinética de fechamento de feridas em modelos murinos, permitindo a avaliação precisa dos tratamentos, mantendo um controle rigoroso sobre as condições de aquisição de imagens.
Protocolo
Todos os procedimentos experimentais envolvendo ratos de laboratório foram conduzidos de acordo com os padrões éticos e regulamentos estabelecidos na Norma Oficial Mexicana (NOM-062-ZOO-1999) para o manuseio e cuidado de animais de laboratório. O protocolo foi revisado e aprovado pelo Comitê Interno para o Cuidado e Uso de Animais de Laboratório (CICUAL) do Instituto Nacional de Pesquisa Nuclear (ININ) sob o número de referência CICUAL-01-23. Foram utilizados camundongos CD1 machos (n = 4), com 10 semanas de idade, peso corporal variando de 28 a 32 g. Todos os animais foram selecionados para garantir uniformidade na cepa, idade, sexo e peso corporal, minimizando a variabilidade nos resultados experimentais. Os detalhes dos reagentes e do equipamento utilizado estão listados na Tabela de Materiais.
1. Construção de cabine fotográfica para aquisição de imagens macroscópicas
NOTA: O software SolidWorks licenciado (versão 2015) foi usado para projetar uma cabine de fotos para eliminar fontes de iluminação externas. Um cubo de 40 cm × 40 cm foi construído usando um perfil de alumínio branco de uma polegada de espessura. O cubo consistia em três seções, montadas sequencialmente: teto, paredes laterais e piso (Figura 1A).
- Construção do telhado
NOTA: O telhado foi regionalizado como borda frontal (A), borda traseira (B) e bordas laterais (C e D) para orientar (Figura 1B).- Fixe na área interna da borda lateral do telhado (C e D) um perfil de alumínio com fenda (projetado para segurar vidro) com 1,5 cm de largura, 2,51 cm de espessura e 34,9 cm de comprimento (Figura 1B).
- Coloque duas placas retangulares de alumínio de 34,5 cm de comprimento x 13 cm de largura com polietileno no centro da ranhura de cada perfil de telhado (Placa 1 e 2 na Figura 1C) para permitir o deslizamento pela ranhura de ambos os perfis.
- Instale uma lâmpada tubular LED RGB de 20 cm com uma faixa de temperatura de cor de 2500-9000 K (Figura 1C) em um ângulo de 45° na borda inferior do painel 1 usando fita dupla-face.
- Monte nos painéis de cobertura 1 e 2 um painel retangular de placa de espuma de 32 cm x 12 cm com um recorte circular central de 7,82 cm de diâmetro para permitir a instalação da lente da câmera (Figura 1C).
- Construção do piso
- Coloque um pedaço quadrado de 40 cm x 40 cm de placa de espuma branca em cima dos perfis da área do piso. Corte quadrados com um comprimento lateral de 2,54 cm de cada canto da placa de espuma (Figura 1E).
- Construção de paredes laterais
- Corte quatro painéis de placa de espuma quadrangular de 40 cm x 40 cm.
- Cole dois painéis com silicone nos lados C e D para formar as paredes laterais esquerda e direita (Figura 1F).
- Prenda tiras de velcro nos perfis de alumínio A e B para facilitar a manipulação dos elementos internos da cabine de fotos. Além disso, prenda 1 cm da borda de uma linha de fixadores adesivos a dois quadrados de espuma de papelão de um lado e coloque-os nas paredes frontal e traseira (Figura 1F).
- Construção da base de referência
NOTA: Uma base de referência foi necessária para manter o camundongo em decúbito ventral durante a anestesia e durante toda a documentação da evolução da ferida. Os componentes 3D foram projetados e fabricados usando a técnica de Modelagem por Deposição Fundida (FDM) com material PLA e uma impressora 3D23,24.- Imprima em 3D a máscara com uma base de 2 cm de largura, comprimento e altura e coloque-a a 11,5 cm da borda de um retângulo de placa de espuma branca pré-cortado de 40 cm x 28 cm para manter os camundongos sob anestesia inalatória (Figura 1D, cor vermelha).
- Imprima em 3D a plataforma retangular (9 cm de comprimento, 5 cm de largura, 2,5 cm de altura) com quatro áreas extrudadas para alinhar o dorso do mouse durante a aquisição da imagem. Essas áreas apoiavam a cabeça, os membros e a região abdominal para manter a posição prona. Cole esta plataforma no centro da base de referência (Figura 1D, cor verde).
- Imprima em 3D o bloco da régua (2 cm de largura, 8 cm de comprimento, 2,5 cm de altura) e fixe-o a 1 cm do lado esquerdo da base do mouse para colocar o elemento de referência de medição necessário para o processamento digital da imagem (Figura 1D, cor azul).
- Conecte uma régua graduada de aço inoxidável de 15 cm ao bloco da régua e instale toda a base de referência dentro da cabine para dimensionamento de imagem (Figura 1D).
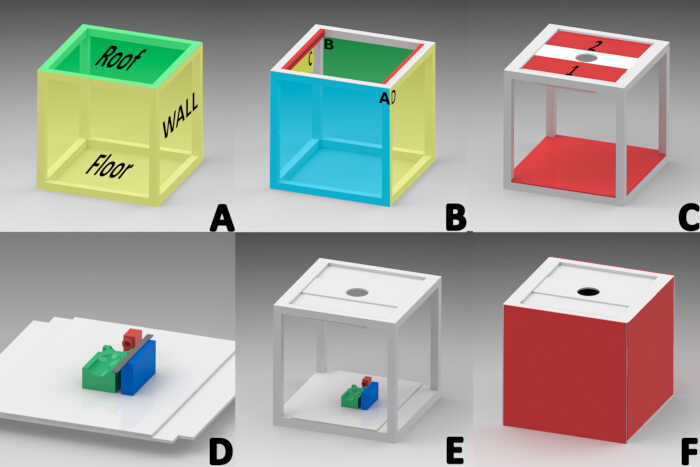
Figura 1: Diagrama para a construção do gabinete de aquisição de imagens macroscópicas. (A) Seções da cabine (teto, paredes laterais, piso). (B)Orientação dos perfis que formam a cobertura; frente (A), traseira (B) e laterais (lado interno dos perfis em vermelho "C,D"). (C) Painéis de telhado 1 e 2, instalação do tubo de luz LED, placa da lente da câmera e instalação no piso. (D) Instalação da máscara de anestesia (VERMELHO), plataforma do mouse (VERDE) e plataforma retangular para posicionamento da régua de medição (AZUL) na base de referência. (E) Localização final da base de referência. (F) Instalação de paredes laterais, frontais e traseiras. Clique aqui para ver uma versão maior desta figura.
2. Manutenção animal
- Obter autorização do comitê de bioética da instituição para testes em animais. Use camundongos CD1 (n = 4), com 10 semanas de idade, pesando 28-32 g.
- Alojar os ratos em condições padrão: manter uma temperatura de 21 °C, ciclos claro/escuro de 12/12 h, 45% de umidade e fornecer acesso ad libitum a água e comida, exceto durante sessões de fotodocumentação.
3. Geração de feridas traumáticas
- Jejue os camundongos por 8 h antes do procedimento. Anestesiar os camundongos com pentobarbital sódico intraperitoneal a 65 mg / kg25 (seguindo protocolos aprovados institucionalmente).
- Confirme a profundidade da anestesia verificando se há falta de reflexo de abstinência durante uma pinça interdigital. Aplique pomada oftálmica nos olhos para evitar o ressecamento durante a anestesia. Mantenha os camundongos a uma temperatura estável de 37 °C durante a cirurgia e recuperação (20 min).
- Coloque o camundongo em decúbito ventral e depile uma área de 2,5 cm x 3 cm da região cervical caudalmente usando lâminas cirúrgicas. Estique a pele para evitar lacerações. Realize assepsia e antissepsia usando iodopovidona alternada e enxágues com água estéril.
- Use um punção de biópsia estéril de 5 mm e aplique pressão com movimentos circulares para criar uma incisão dermoepidérmica no nível da omoplata. Remova a aba com pinça serrilhada e corte com tesoura de ponta de íris (Figura 2A).
- Em caso de presença de pontos de sangramento na ferida, aplique um choque eletricista com um dispositivo de eletrocautério para obter hemostasia.
- Coloque uma película dérmica circular de 1 cm de diâmetro sobre a ferida usando uma pinça de joalheiro para evitar contaminação e contração.
- Realize todas as cirurgias de sobrevivência em condições estéreis. Prepare o local da cirurgia com desinfetantes como iodopovidona. Use luvas estéreis e máscara e mantenha a esterilidade durante todo o procedimento usando instrumentos estéreis e minimizando o contato com superfícies não estéreis.
- Após a cirurgia, coloque os camundongos em gaiolas individuais a 24 ° C e monitore-os até que recuperem a consciência suficiente para manter a posição esternal. Certifique-se de que a temperatura corporal seja controlada durante e após a cirurgia para evitar hipotermia usando fontes externas de calor.
- Administrar analgesia até o dia 4 diluindo o cetorolaco em água potável a 5 mg/kg26.
- Após 14 dias, quando as feridas em roedores saudáveis normalmente atingem estágios avançados de cicatrização, eutanasiar os camundongos por substituição de O2 em uma câmara de CO2 seguindo os padrões internacionais. Isso marca o ponto final do estudo.
4. Aquisição de imagens macroscópicas
- Capture imagens das feridas diariamente por 14 dias consecutivos para monitorar a cinética contínua de fechamento da ferida. Use uma câmera semiprofissional ou profissional; Posicione a lente através da abertura circular no teto da cabine de fotos.
NOTA: Ajuste o cronograma conforme necessário com base nas condições experimentais. - Use um tubo de luz LED RGB no modo de temperatura de cor correlacionada (CCT), definido para 9000 K e 100% de brilho para iluminação.
- Posicione a base de referência no centro do piso da cabine de fotos.
- Coloque o camundongo na câmara de anestesia inalada por 3 min (Figura 2B).
- Após a indução da anestesia, coloque o mouse em decúbito ventral na plataforma do mouse. Prenda o focinho dentro da máscara de anestesia com sevoflurano, fornecendo sevoflurano a 5% a uma taxa de fluxo de oxigênio de 1,5 L/min (Figura 2C).
- Antes de capturar imagens, remova o filme dérmico da ferida usando uma pinça de joalheiro e alinhe a base de referência com a lente da câmera.
- Instale a parede frontal da cabine de fotos e capture imagens macroscópicas com as seguintes configurações: abertura f/3.2, tempo de exposição 1/200s, velocidade ISO 80, distância focal 4mm.
- Usando uma pinça de joalheiro, coloque um filme dérmico de 1 cm de diâmetro na ferida antes de remover a máscara de anestesia. Transfira os camundongos para gaiolas individuais e observe até a recuperação motora.
5. Processamento de imagem
- Gere uma cópia de backup das imagens macroscópicas. Processe as imagens usando o software ImageJ.
- Abra a imagem de backup no ImageJ seguindo o caminho: Arquivo > Abrir > Pesquisar nas imagens e clique em Abrir.
- Dimensione a imagem por referência: Maximize a imagem, selecione a ferramenta de linha reta , amplie a régua ao lado do mouse usando a tecla +, desenhe uma linha reta de 10 mm na imagem da régua e vá para Analisar > Definir escala > Digite " 10" para Distância conhecida > Defina a unidade de comprimento como mm e clique em Ok. Isso determina a proporção de pixels para distância para a imagem macroscópica (Figura 2D).
- Separe a área da ferida da imagem: Use a ferramenta retângulo para selecionar a área ao redor da ferida (w = 150, h = 150). Registre os valores X e Y, clique com o botão direito do mouse no retângulo > Duplicar > Nomeie o assunto > Pressione Enter. Na nova imagem, pressione + duas vezes para aumentar o zoom (Figura 2E).
- Salve a imagem cortada seguindo o caminho: Arquivo > Salvar como > Tiff > Digite o nome > Salvar.
- Crie uma duplicata da imagem cortada para evitar modificações durante a segmentação: Clique com o botão direito do mouse na imagem cortada > Duplicar > Nomeie-a adicionando "Segmentação" ao final. Em seguida, pressione Enter. Na nova imagem, pressione + duas vezes para aumentar o zoom.
- Separe a imagem em canais de cores seguindo este caminho: Tipo de > de imagem > Pilha RGB. Na imagem do canal vermelho (1/3 Vermelho), clique com o botão direito do mouse em Duplicar e pressione OK na janela Duplicar.
- Segmente a imagem do canal vermelho. Clique na imagem do canal vermelho, Imagem > Ajustar > Limite. Em seguida, selecione Padrão > Aplicar (Figura 2F).
- Retifique a região de interesse (ROI) para garantir a cobertura completa da ferida e evitar distorções de segmentação.
NOTA: Se as áreas ao redor da ferida não estiverem incluídas na segmentação, vá para Processar > Binário > Preencher Furos. Para remover pontos pretos fora da ferida, vá para Processar > Binário > Corroer. Se o comando Erodir reduzir o tamanho da ferida, corrija-o usando Processar > Binário > Dilate. - Marcar o perímetro do ROI: Editar > seleção > Criar seleção. O ROI será destacado em amarelo. Adicione-o ao ROI Manager seguindo Editar > Seleção > Adicionar ao Manager (Figura 2G).
- Valide a segmentação: abra a janela Gerenciador de ROI e selecione o ROI a ser revisado: Mais > Traduzir. Insira os valores X e Y registrados na etapa 4 e pressione OK.
- Maximize a imagem original e selecione o ROI no ROI Manager. Ajuste a ROI usando as teclas de seta até que ela se alinhe com a ferida (Figura 2H). Se o ROI corresponder à ferida, a segmentação foi bem-sucedida. Caso contrário, repita a partir da etapa 2.
- Uma vez confirmada a segmentação, obtenha as medidas da ferida: Analisar > Medir. Uma tabela de resultados exibirá os valores de área, perímetro e posição X/Y. Copie esses valores para o software SPSS para documentação e análise estatística (Figura 2I).

Figura 2: Fluxo de trabalho de medição de feridas usando planimetria digital e técnicas de segmentação. (A) Incisão dermoepidérmica usando um punção de biópsia estéril de 5 mm. (B) Colocar o camundongo em uma câmara de anestesia inalada por 3 min. (C) Documentação fotográfica posicionando o camundongo anestesiado na cabine de fotos e prendendo seu focinho dentro de uma máscara de sevoflurano. (D) Abrir a imagem obtida no ImageJ e dimensioná-la usando a régua como referência. (E) Extraindo a área da ferida usando a ferramenta retângulo. (F) Separar a imagem em canais RGB e processar o canal vermelho. (G) Delinear e gerenciar a região de interesse (ROI). (H) Validar a segmentação combinando o ROI com a ferida. (I) Medir os parâmetros da ferida e registrar os resultados para análise estatística. Clique aqui para ver uma versão maior desta figura.
6. Eutanásia pós-procedimento
NOTA: O estudo é concluído após 14 dias, momento em que as feridas em roedores saudáveis normalmente atingem estágios avançados de cicatrização. Nesta fase, os camundongos foram sacrificados humanamente seguindo o procedimento de eutanásia estabelecido institucionalmente aprovado.
- Prepare o equipamento. Certifique-se de que a câmara de eutanásia esteja limpa, seca e de tamanho apropriado para acomodar os ratos sem superlotação. Conecte a câmara a uma fonte de CO2 de grau médico com um regulador de fluxo.
- Transfira suavemente os ratos para a câmara para minimizar o estresse. Certifique-se de que eles estejam em um ambiente calmo com o mínimo de distúrbios externos.
- Defina a taxa de fluxo de CO2 para 20% -30% do volume da câmara por minuto, conforme recomendado pelas Diretrizes da AVMA para a Eutanásia de Animais. Aumente gradualmente a concentração de CO2 para evitar induzir angústia ou desconforto nos camundongos.
- Observe os camundongos de perto durante o procedimento. Procure sinais de perda gradual de consciência, incluindo atividade e respiração reduzidas, seguidas de apneia e parada cardíaca.
- Confirme a morte quando os ratos não estiverem mais respirando e não mostrarem sinais de movimento; Aguarde mais 1-2 minutos para garantir a cessação completa das funções vitais. Verifique a morte confirmando a ausência de reflexos (por exemplo, reflexo da córnea) e atividade cardíaca.
- Transfira as carcaças para recipientes designados de Resíduos Biológicos Perigosos. Siga os protocolos institucionais e as diretrizes nacionais para o descarte seguro de restos mortais.
- Registre o número de animais sacrificados, a data e quaisquer observações relevantes para garantir a conformidade com os padrões éticos e institucionais.
Resultados
Após o dimensionamento das imagens no software ImageJ, o perímetro médio (Tabela 1) e a área (Tabela 2) das feridas, juntamente com seus respectivos desvios-padrão, foram obtidos por meio de segmentação digital. Esses valores foram registrados do dia zero ao décimo quarto dia (D0-D14).
| Dia | Perímetro (mm) |
| 0 | 22,75 ± 0,8900 |
| 1 | 21,65 ± 0,0200 |
| 2 | 25,25 ± 0,5900 |
| 3 | 24,37 ± 0,1600 |
| 4 | 24.61 ± 1.2600 |
| 5 | 23,98 ± 0,5500 |
| 6 | 24,59 ± 0,4900 |
| 7 | 22,05 ± 0,2600 |
| 8 | 18.64 ± 0.6200 |
| 9 | 15,29 ± 0,1800 |
| 10 | 14,51 ± 0,3800 |
| 11 | 13,23 ± 0,1000 |
| 12 | 13,12 ± 0,3600 |
| 13 | 7,49 ± 0,2200 |
| 14 | 5,78 ± 0,1200 |
Tabela 1: Medidas de perímetro de feridas (dias 0-14). Os valores representam as medidas do perímetro da ferida (mm) a cada dia (D0-14) como média ± desvio padrão (DP).
| Dia | Área (mm2) |
| 0 | 27,56 ± 0,1500 |
| 1 | 30,64 ± 0,3100 |
| 2 | 38.05 ± 0.6100 |
| 3 | 37,85 ± 0,2500 |
| 4 | 36.30 ± 0.6000 |
| 5 | 32.93 ± 0.3600 |
| 6 | 29.83 ± 0.5700 |
| 7 | 23,77 ± 0,3500 |
| 8 | 15,43 ± 0,1800 |
| 9 | 12,75 ± 0,1400 |
| 10 | 10,72 ± 0,3200 |
| 11 | 10,69 ± 0,2600 |
| 12 | 9,55 ± 0,3200 |
| 13 | 3,03 ± 0,1400 |
| 14 | 1,82 ± 0,0900 |
Tabela 2: Medidas da área das feridas (dias 0-14). Os valores mostram as medidas da área da ferida (mm2) a cada dia (D0-14) como média ± desvio padrão (DP).
A área e o perímetro da ferida aumentaram inicialmente do dia 0 para o dia 3, indicando uma resposta inflamatória que aumentou temporariamente o tamanho da ferida além de suas medidas originais. No entanto, do dia 3 ao dia 6, tanto a área quanto o perímetro diminuíram progressivamente, com uma redução significativa observada no dia 7. Nesse ponto, as feridas mediam menos do que seu tamanho original, refletindo uma cicatrização avançada.
Para sondar a cinética de fechamento da ferida, foram utilizados dados de área para calcular a porcentagem de cicatrização da ferida com a equação de Robson 27,28 (Equação 1):

onde, %Δ A corresponde à redução percentual da área da ferida no dia da avaliação (Área Dia x) em relação à área inicial no dia zero (ÁreaDia 0).
| Dia | % de redução | ||
| 0 | 0 | ± | 0.5300 |
| 1 | -11.2 | ± | 1.1500 |
| 2 | -38 | ± | 1.8900 |
| 3 | -37.3 | ± | 1.7200 |
| 4 | -31.7 | ± | 1.7700 |
| 5 | -19.5 | ± | 1.9800 |
| 6 | -8.21 | ± | 2.1900 |
| 7 | 13.77 | ± | 2.4000 |
| 8 | 44.03 | ± | 1.8900 |
| 9 | 53.76 | ± | 1.6000 |
| 10 | 61.09 | ± | 3.1800 |
| 11 | 61.2 | ± | 3.8400 |
| 12 | 65.37 | ± | 4.1000 |
| 13 | 89.00 | ± | 5.5800 |
| 14 | 93.4 | ± | 5.0500 |
Tabela 3: Porcentagem de fechamento da ferida (equação de Robson). Os valores representam as porcentagens médias de redução da área da ferida, calculadas pela equação de Robson (Equação 1) como média ± desvio padrão (DP).
Quando os percentuais obtidos nessa equação são positivos (Tabela 3), eles indicam o fechamento da ferida, enquanto os valores negativos indicam um aumento no tamanho da ferida (Figura 3A). Para calcular a distância de retração das bordas da ferida ao centro, foram utilizados dados de área e perímetro com a equação de Gilmam 29,30,31 (Equação 2):

onde, D é a distância média de avanço linear em mm das margens em direção ao centro da ferida, A0 é a área da ferida no início do tratamento (Dia0), Ai é a área da ferida no momento da medição, P0 é o perímetro da ferida no início (Dia0), Pi o perímetro no momento da medição.
| Dia | Distância de retração (mm) |
| 0 | 0,00 ± 0,0425 |
| 1 | -0,139 ± 0,0165 |
| 2 | -0,437 ± 0,0301 |
| 3 | -0,466 ±0,0264 |
| 4 | -0,369 ± 0,0267 |
| 5 | -0,230 ± 0,0298 |
| 6 | -0,096 ±0,0279 |
| 7 | 0,169 ± 0,0292 |
| 8 | 0,586 ±0,0236 |
| 9 | 0,779 ±0,0147 |
| 10 | 0,904 ± 0,0238 |
| 11 | 0,938 ± 0,0296 |
| 12 | 1,005 ± 0,0310 |
| 13 | 1,622 ± 0,0424 |
| 14 | 1,804 ± 0,0257 |
Tabela 4: Retração das bordas da ferida (equação de Gilmam). Os valores mostram cronologicamente a retração média (mm) da borda para o centro da ferida, apresentada como média ± desvio padrão (DP).
Combinando as porcentagens de fechamento da ferida, os valores positivos da Equação 2 mostram as bordas da ferida se aproximando, indicando contração (Tabela 4). Por outro lado, os valores negativos refletem um aumento nessa distância (Figura 3B). Inicialmente, no dia 0, o diâmetro da ferida mediu 5 mm, resultando em 2,5 mm ± 0,0425 mm da borda para o centro. Essa distância inicial serviu como linha de base para o cálculo da taxa média diária de retração da ferida. A taxa de retração calculada foi então subtraída da distância inicial para gerar a taxa de fechamento sintético da ferida apresentada na Tabela 5.
| Dia | Distância da borda ao centro (mm) |
| 0 | 2,5 ± 0,0425 |
| 1 | 2,63 ± 0,0165 |
| 2 | 2,9369 ± 0,0301 |
| 3 | 2.9368 ±0.0264 |
| 4 | 2,8689 ± 0,0267 |
| 5 | 2,7298 ± 0,0298 |
| 6 | 2.5956 ±0.0279 |
| 7 | 2,3306 ± 0,0292 |
| 8 | 1,9136 ± 0,0236 |
| 9 | 1,7210 ± 0,0147 |
| 10 | 1,5962 ± 0,0238 |
| 11 | 1,5624 ± 0,0296 |
| 12 | 1,4955 ± 0,0310 |
| 13 | 0.8774 ± 0.0423 |
| 14 | 0,6954 ± 0,0257 |
Tabela 5: Taxa de fechamento da ferida (mm). Os valores mostram a retração da ferida ao longo do tempo. Isso é obtido subtraindo-se a distância da borda da ferida em cada ponto de tempo da distância inicial (2,5 mm ± 0,0425) como média ± desvio padrão (DP).
A porcentagem de fechamento foi calculada usando a equação32 de Robson (Figura 3A), comumente usada em medições sequenciais de fechamento de úlcera de neuropatia diabética, e a equação33 de Gillman (Figura 3B) é comumente empregada para monitorar o progresso da cicatrização de feridas.
No dia 0, a ferida operatória inicial (5 mm de diâmetro, representada como 100%) apresentou um aumento significativo para 138,04% no dia 2, provavelmente devido ao processo inflamatório inicial ao redor da ferida 4,34. Nesse período, neutrófilos e macrófagos migram, liberando citocinas e fatores de crescimento28. A fase inflamatória geralmente dura de um a três dias35. Ainda assim, pode se estender por várias semanas em casos de lesões extensas, infecções adicionais, condições preexistentes ou em adultos mais velhos, onde os mecanismos de reparo são retardados.
Esses resultados destacam a eficácia dessa metodologia, que combina o uso da cabine de fotos, segmentação digital e planimetria digital na captura precisa das mudanças dinâmicas na cinética de fechamento da ferida. Nesse modelo, a inflamação provavelmente causou retração da borda da ferida, levando a um aumento inicial na área e no perímetro da ferida. Além disso, identificamos que as condições ideais de iluminação para imagens macroscópicas foram alcançadas usando um tubo de luz LED RGB no modo CCT a 9000 K e 100% de intensidade, com a distância ideal da câmera definida em 18 cm do mouse.
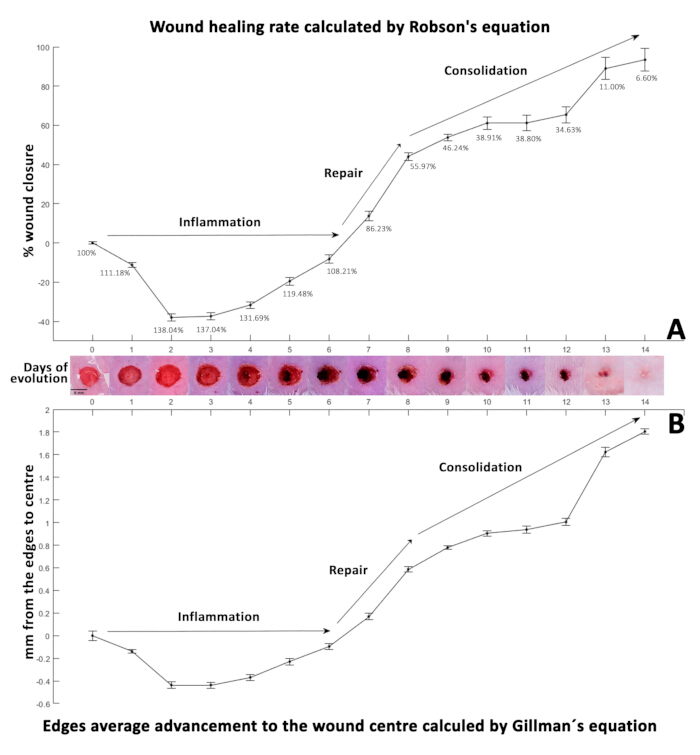
Figura 3: Cinética de cicatrização de feridas. (A) A porcentagem de fechamento da ferida calculada usando a equação de Robson. (B) Exibindo a taxa de cura ao longo do período de evolução de 14 dias, conforme determinado pela equação de Gillman. Valores negativos em ambas as equações indicam um aumento no tamanho da ferida, enquanto valores positivos estão associados ao fechamento da ferida. Ambos os painéis representam a cinética de cicatrização, com desvios padrão (DP) mostrados por barras de erro ao lado de fotografias que ilustram a evolução da ferida ao longo de 14 dias (D0-14). Clique aqui para ver uma versão maior desta figura.
A Figura 3A apresenta a porcentagem de fechamento da ferida calculada usando a equação de Robson, e a Figura 3B mostra a taxa de cicatrização ao longo do período de evolução de 14 dias, conforme determinado pela equação de Gillman33.
Discussão
Em modelos pré-clínicos, a análise quantitativa da evolução de feridas traumáticas em modelos pré-clínicos enfrenta desafios devido a fatores como tamanho da ferida, resposta inflamatória localizada34, localização e/ou manipulação. Existem métodos de planimetria manual direta36 e digital indireta 11,16,37,38 para essas medições. Em contraste com estudos que usam métodos manuais, que muitas vezes sofrem de viés do observador e variabilidade nas condições de iluminação, nosso estudo empregou planimetria digital padronizada. Estudos utilizando medidas manuais relatam maior variabilidade no tamanho da ferida10,38, enquanto nossa técnica mostrou maior consistência ao longo do tempo. Além disso, em comparação com outros métodos digitais 11,16,37,38, esse sistema controlado de iluminação e posicionamento resultou em medições mais precisas.
A falta de metodologias detalhadas e passo a passo para medir a área e o perímetro da ferida levou ao desenvolvimento de um método padronizado de medição indireta usando planimetria, dimensionamento e segmentação digitais. Para isso, foi projetada e construída uma cabine de fotodocumentação. Ao controlar as condições de iluminação, o posicionamento do sujeito e a distância da câmera, foi garantida a consistência na aquisição da imagem macroscópica, minimizando o viés nas medições da ferida. Estudos em roedores relataram o fechamento contínuo da ferida desde o dia zero, atribuído ao uso de anéis de silicone ao redor das lesões durante o procedimento cirúrgico39,16, possivelmente impedindo a retração e expansão da ferida durante a inflamação. Por outro lado, outro estudo avaliando produtos de derme artificial com fator de crescimento básico de fibroblastos (bFGF) relatou um aumento na área e no perímetroda ferida 20.
A cicatrização de feridas envolve quatro fases sequenciais: hemostasia (1-24 h)40, inflamação (1-3 dias)41, proliferação (3-21 dias)34 e consolidação (21-60 dias)4, embora possam se sobrepor 4,34. Neste estudo, a inflamação progrediu subjetivamente do dia 3 ao 6, passando para a fase proliferativa.
Essa fase de transição é crucial para a cicatrização, pois reduz a resposta inflamatória pela diminuição dos neutrófilos e aumento dos macrófagos32, promovendo a angiogênese42, a síntese de colágeno e a ativação dos fibroblastos. Os fibroblastos migram para o local da ferida, iniciando a síntese da matriz extracelular e depositando fibronectina34, colágeno, proteoglicanos, ácido hialurônico e glicosaminoglicanos, essenciais para o andaime e subsequente adesão celular43. Do dia 2 ao 6, este modelo mostrou uma redução do tamanho da ferida de 138,04% para 108,21%, indicando diminuição da inflamação.
Apesar do aumento inicial do tamanho da ferida, essa tendência se inverteu a partir do sétimo dia, chegando a 86,23%, e cicatrizou progressivamente até o 14º dia. Isso provavelmente corresponde à fase proliferativa44 e ao início da angiogênese45, formando tecido de granulação que contrai a ferida, como observado neste estudo. Padrões semelhantes de fechamento contínuo foram relatados em estudos com roedores 6,19, indicando que as feridas cicatrizam independentemente das intervenções clínicas, com diferenças na velocidade de fechamento. Assim, esse modelo poderia servir como um controle de referência.
O fechamento da ferida diminuiu do dia 9 ao 14, chegando a 6,60%. Notavelmente, crostas se formaram sobre as feridas a partir do dia 4, desprendendo-se das bordas no dia 10, revelando pequenas áreas de tecido cicatricial por baixo e desprendendo-se totalmente no dia quatorze.
É crucial observar que uma ferida macroscopicamente fechada pode apresentar diferenças microscópicas significativas, necessitando de análise histológica detalhada para observar a morfologia celular e a evolução da ferida. Essa metodologia permite dados precisos de área e perímetro com variabilidade mínima, facilitando o uso de equações matemáticas na análise da cinética de fechamento de feridas. O comportamento matemático observado nos resultados calculados usando as equações de Gillman33 (Figura 3B) e Robson32 (Figura 3A) foi consistente.
Etapas críticas do protocolo
Embora as feridas normalmente exibam transudação plasmática para o ambiente externo, este estudo controlou certos fatores que também podem influenciar os mecanismos de reparo da ferida. Em ensaios anteriores, observou-se que a hemostasia adequada promove interação entre a ferida e o filme dérmico, pois o sangramento excessivo altera a geometria da ferida e o tamanho da crosta.
Modificações e solução de problemas
A metodologia proposta permite a geração de modelos murinos com feridas maiores e mais profundas. No entanto, se o local da ferida for alterado, a base de referência deve ser reposicionada para garantir que permaneça centralizada na imagem macroscópica. Além disso, os dias para fotodocumentação e a duração do modelo podem ser ajustados.
Limitações
As limitações desse método incluem o tamanho da cabine de fotodocumentação, projetada para roedores pequenos e leves. No entanto, com modificações na base do mouse, ele pode ser adaptado para roedores maiores. Além disso, este método atualmente não mede feridas traumáticas extensionais por meio de segmentação, embora possa ser aplicado com modificações adicionais.
Importância do método em relação aos métodos existentes/alternativos
Várias metodologias para medição de feridas empregam planimetria digital 11,12,13,14. No entanto, muitas vezes eles não relatam as condições de iluminação, a distância entre a câmera e a ferida ou a repetibilidade da posição da fotodocumentação ao longo dos dias de evolução da ferida. É aqui que o estudo atual é significativo.
Neste modelo, a configuração da lâmpada RGB fornece condições ideais de iluminação no modo de temperatura de cor correlacionada (CCT) a 9000 K com 100% de brilho. A distância ideal entre a base do mouse e a lente da câmera é de 18 cm. Essas condições nos permitiram constatar que o canal vermelho da pilha RGB segmenta a área da ferida sem capturar as bordas do tecido de granulação, o que não foi relatado anteriormente.
Por fim, considerando que algumas metodologias utilizam câmeras16 montadas em equipamentos como estereoscópios, que não são acessíveis a todos os laboratórios, esta cabine de fotodocumentação oferece a oportunidade de obter imagens de alta qualidade para posterior análise.
Importância e potenciais aplicações do método em áreas específicas de pesquisa
As aplicações potenciais e a importância dessa metodologia residem em sua capacidade de eliminar vieses nas medições de feridas, gerando dados confiáveis para rastrear o processo de cicatrização. Além disso, a repetibilidade da posição do mouse permite a criação futura de uma macro ImageJ que analisa e delineia automaticamente as regiões de interesse. Além disso, se o acesso a uma câmera semiprofissional ou profissional para imagens de alta resolução não estiver disponível, o estande pode ser modificado para tirar fotos usando uma câmera de celular, que pode usar um aplicativo para adquirir fotos sem correção automática de cores.
Divulgações
Os autores declaram não haver conflitos de interesse relacionados a esta pesquisa.
Agradecimentos
Os autores gostariam de agradecer ao Consejo Nacional de Humanidades, Ciencias y Tecnologías (CONAHCyT, CVU: 933600) por meio da doação para fornecer financiamento, e ao Laboratorio Nacional de Investigación y Desarrollo de Radiofármacos del Instituto Nacional de Investigaciones Nucleares (LANIDER-ININ) por seu apoio. Além disso, a Figura 2 foi elaborada com o auxílio do software BioRender (2020), disponível em BioRender.com/p67z056.
Materiais
| Name | Company | Catalog Number | Comments |
| 5 mm Biopsy Punch | MILTEX, USA | 33-35 | To mark the wound edges |
| Aluminum with polyethylene core | Alucobond,USA | Bright Silver 119 | For the construction of the macroscopic Image Acquisition Booth |
| Camera Lens | Sony, Japan | SEL2470Z | To focus the images to photograph |
| Electrocautery | Bonart, USA | ART-E1 | To eliminates bleeding points in the wound if present. |
| Hook and loop fastener strips | VELCRO | ||
| IBM SPSS Statistics Version 22 | IBM Corporation, USA | https://www.ibm.com/analytics/spss-statistics | Used for statistical analysis of wound measurements, including area and perimeter data. |
| ImageJ Version 1.53t | National Institutes of Health, USA | https://imagej.nih.gov/ij/ | Used for processing macroscopic images, including scaling, segmentation, and measurement of wound parameters. |
| Ketorolac | SIEGFRIED RHEIN, Mexico | 493977 | For postoperative pain management |
| Miltex Iris Scissors, 4-1/8" Curved | MILTEX, USA | V95-306 | To cut the wound flap generated with the biopsy punch |
| RGB LED Light Tube | ANDOER, China | B09F8RLMSY | To illuminate the Macroscopic Image Acquisition Booth |
| Semi profesional camera | Sony, Japan | DSC-HX300 | To take the photos |
| Serrated Forceps | MILTEX, USA | V96-118 | To hold the flap during the cut |
| Sevoflurane | Baxter, USA | AMX2L9117PR | For inhaled anaesthesia |
| Sodium Pentobarbital | Aranda, Mexico | 734.448.001.212 | For intraperitoneal anaesthesia |
| SolidWorks Version 2015 | Dassault Systèmes, France | https://www.solidworks.com/ | Used to design and create 3D models for constructing accessories for the photodocumentation booth. |
| Surgical blades | HERGOM, Mexico | H10 | To shave the hair in the area where the wound will be created |
| Transparent Adhesive Dressing | 3M, USA | F51CA07 | To cover the traumatic wound |
Referências
- Martinengo, L., et al. Prevalence of chronic wounds in the general population: systematic review and meta-analysis of observational studies. Ann Epidemiol. 29, 8-15 (2019).
- Chen, X., Shi, X., Xiao, H., Xiao, D., Xu, X. Research hotspot and trend of chronic wounds: A bibliometric analysis from 2013 to 2022. Wound Repair Regen. 31 (5), 597-612 (2013).
- Gould, L., Li, W. W. Defining complete wound closure: Closing the gap in clinical trials and practice. Wound Repair Regen. 27 (3), 201-224 (2019).
- Baron, J. M., Glatz, M., Proksch, E. Optimal support of wound healing: New insights. Dermatology. 236 (6), 593-600 (2020).
- Tiwari, R., Pathak, K. Local drug delivery strategies towards wound healing. Pharmaceutics. 15 (2), 634 (2023).
- Gupta, B., Agarwal, R., Alam, M. S. Hydrogels for wound healing applications. Biomed Hydrogels. , 184-227 (2011).
- Pastar, I., et al. Pre-clinical models for wound-healing studies. Skin Tissue Models Regen Med. , 223-253 (2018).
- Shen, Z., Zhang, C., Wang, T., Xu, J. Advances in functional hydrogel wound dressings: A Review. Polymers (Basel). 15 (9), 2000 (2000).
- Wong, V. W., Sorkin, M., Glotzbach, J. P., Longaker, M. T., Gurtner, G. C. Surgical approaches to create murine models of human wound healing. J Biomed Biotechnol. 2011, 1-8 (2011).
- Peterson, N., Stevenson, H., Sahni, V. Size matters: How accurate is clinical estimation of traumatic wound size. Injury. 45 (1), 232-236 (2014).
- Öien, R. F., Håkansson, A., Hansen, B. U., Bjellerup, M. Measuring the size of ulcers by planimetry: a useful method in the clinical setting. J Wound Care. 11 (5), 165-168 (2002).
- Rogers, L. C., Bevilacqua, N. J., Armstrong, D. G., Andros, G. Digital planimetry results in more accurate wound measurements: a comparison to standard ruler measurements. J Diabetes Sci Technol. 4 (4), 799-802 (2010).
- Shamata, A., Thompson, T. Documentation and analysis of traumatic injuries in clinical forensic medicine involving structured light three-dimensional surface scanning versus photography. J Forensic Leg Med. 58, 93-100 (2018).
- Foltynski, P., Ladyzynski, P., Ciechanowska, A., Migalska-Musial, K., Judzewicz, G., Sabalinska, S. Wound area measurement with digital planimetry: Improved accuracy and precision with calibration based on 2 rulers. PLoS One. 10 (8), e0134622 (2015).
- Frank, S., Kämpfer, H. Excisional wound healing. Wound Healing: Methods Protoc. , 3-15 (2003).
- Dunn, L., et al. Murine model of wound healing. J Vis Exp. (75), e50265 (2013).
- Barakat, M., DiPietro, L. A., Chen, L. Limited Treatment options for diabetic wounds: Barriers to clinical translation despite therapeutic success in murine models. Adv Wound Care (New Rochelle). 10 (8), 436-460 (2021).
- Goh, C. C., et al. Inducing ischemia-reperfusion injury in the mouse ear skin for intravital multiphoton imaging of immune responses. J Vis Exp. (118), e54956 (2016).
- Wang, Y., et al. Autologous fat grafting promotes macrophage infiltration to increase secretion of growth factors and revascularization, thereby treating diabetic rat skin defect. Diabetes, Metab Syndr Obes: Targets and Therapy. 13, 4897-4908 (2020).
- Notodihardjo, S. C., et al. A comparison of the wound healing process after the application of three dermal substitutes with or without basic fibroblast growth factor impregnation in diabetic mice. J Plast Reconstr Aesthet Surg. 73 (8), 1547-1555 (2020).
- Thawer, H. A., Houghton, P. E., Woodbury, M. G., Keast, D., Campbell, K. A comparison of computer-assisted and manual wound size measurement. Ostomy Wound Manage. 48 (10), 46-53 (2002).
- Huang, C. X., et al. Comparison of digital and traditional skin wound closure assessment methods in mice. Lab Anim Res. 39 (1), 25 (2023).
- Subramaniam, S. R., et al. 3D printing: Overview of PLA progress. AIP Conf Proc. , 020015 (2019).
- Oleksy, M., Dynarowicz, K., Aebisher, D. Rapid prototyping technologies: 3D printing applied in medicine. Pharmaceutics. 15 (8), 2169 (2023).
- Gómez de Segura, &. #. 1. 9. 3. ;. I. Métodos de anestesia, analgesia y eutanasia. Métodos de anestesia, analgesia y eutanasia. 14, 97-127 (2016).
- Romero-Fernandez, W., et al. El 1, 2, 3 de la experimentación con animales de laboratorio. Rev Peru Med Exp Salud Publica. 33 (2), 288 (2016).
- Cukjati, D., Reberšek, S., Miklavčič, D. A reliable method of determining wound healing rate. Med Biol Eng Comput. 39 (2), 263-271 (2001).
- Payne, W. G., Bhalla, R., Hill, D. P., Pierpont, Y. N., Robson, M. C. Wound healing trajectories to determine pressure ulcer treatment efficacy. Wound Repair Regen. 11, e1 (2011).
- Cardinal, M., Eisenbud, D. E., Phillips, T., Harding, K. Early healing rates and wound area measurements are reliable predictors of later complete wound closure. Wound Repair Regen. 16 (1), 19-22 (2008).
- Tallman, P. Initial rate of healing predicts complete healing of venous ulcers. Arch Dermatol. 133 (10), 1231 (1997).
- Hopkins, N. F. G., Jamieson, C. W. Antibiotic concentration in the exudate of venous ulcers: The prediction of ulcer healing rate. Br J Surg. 70 (9), 532-534 (2005).
- Robson, M. C. Wound healing trajectories as predictors of effectiveness of therapeutic agents. Arch Surg. 135 (7), 773 (2000).
- Jessup, R. L. What is the best method for assessing the rate of wound healing? A comparison of 3 mathematical formulas. Wounds. 19 (3), 138-147 (2006).
- Landén, N. X., Li, D., Ståhle, M. Transition from inflammation to proliferation: A critical step during wound healing. Cell Mol Life Sci. 73 (20), 3861-3885 (2016).
- Szpaderska, A. M., DiPietro, L. A. Inflammation in surgical wound healing: Friend or foe. Surgery. 137 (5), 571-573 (2005).
- Hamed, E., Al Balah, O. F. A., Refaat, M., Badr, A. M., Afifi, A. Photodynamic therapy mediated by methylene blue-loaded PEG accelerates skin mouse wound healing: An immune response. Lasers in Med Sci. 39 (1), 141 (2024).
- Ibraheem, W. I., et al. Comparison of digital planimetry and ruler methods for the measurement of extraction socket wounds. Medicina (Kaunas). 59 (1), 135 (2023).
- Mayrovitz, H. N., Soontupe, L. B. Wound areas by computerized planimetry of digital images: accuracy and reliability. Wounds. 22 (5), 222-229 (2009).
- Galiano, R. D., Michaels, J., Dobryansky, M., Levine, J. P., Gurtner, G. C. Quantitative and reproducible murine model of excisional wound healing. Wound Repair Regen. 12 (4), 485-495 (2004).
- Price, A., Grey, J. E., Patel, G. K., Cbe, K. G. H. . ABC of wound healing. , 0470658975 (2022).
- Eming, S. A., Krieg, T., Davidson, J. M. Inflammation in wound repair: Molecular and cellular mechanisms. J Invest Dermatol. 127 (3), 514-525 (2007).
- Carmeliet, P. Angiogenesis in life, disease and medicine. Nature. 438 (7070), 932-936 (2005).
- López, N., Cervero, S., Jiménez, M. J., Sanchez, J. F. Cellular characterization of wound exudate as a predictor of wound healing phases. Wounds. 26 (4), 101-107 (2014).
- Liu, N. T., et al. Quantifying the effects of wound healing risk and potential on clinical measurements and outcomes of severely burned patients: A data-driven approach. Burns. 46 (2), 303-313 (2020).
- Han, C., Barakat, M., DiPietro, L. A. Angiogenesis in wound repair: Too much of a good thing. Cold Spring Harb Perspect Biol. 14 (10), a041225 (2022).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados