Method Article
פלנימטריה דיגיטלית להערכת קינטיקה של סגירת פצע במודל עכבר
In This Article
Summary
פצעים מייצגים אתגר בריאותי עולמי. מחקר זה פיתח תא צילום סטנדרטי המשתמש בפלנימטריה דיגיטלית כדי למזער את שונות מדידת הפצעים. ניטור פצעים בעכברים במשך 14 יום חשף עלייה ראשונית באזור הפצע ובהיקפו, ואחריו סגירה הדרגתית. מתודולוגיה זו עשויה לסייע בהערכת קינטיקה של סגירת פצע במודלים פרה-קליניים.
Abstract
פצעים כרוניים, בשל שכיחותם הגבוהה, מהווים דאגה בריאותית עולמית רצינית. אסטרטגיות טיפוליות יעילות יכולות להאיץ משמעותית את הריפוי, ובכך להפחית את הסיכון לסיבוכים ולהקל על הנטל הכלכלי על מערכות הבריאות. למרות שמחקרים ניסיוניים רבים חקרו ריפוי פצעים, רובם מסתמכים על תצפיות איכותניות או מדידות ישירות כמותיות. מטרת מחקר זה הייתה לתקנן שיטת מדידת פצעים עקיפה באמצעות פלנימטריה דיגיטלית, המשלבת קנה מידה ופילוח דיגיטליים. גישה זו מתייחסת להיעדר מתודולוגיות מפורטות, שלב אחר שלב, להערכה מדויקת של פצעים. תוכנן ונבנה תא תיעוד צילום, ונעשה שימוש בכלי פלנימטריה דיגיטליים בעזרת מחשב כדי למזער את השונות במדידות של אזור הפצע, ההיקף והמרחק ממרכז הפצע לקצוותיו. פצע טראומטי עגול (בקוטר 5 מ"מ) נוצר בקו האמצע הגבי ברמת השכמות של עכברי CD1 זכרים (n = 4, בן 10 שבועות, 30-35 גרם). התפתחות הפצע תועדה במשך 14 יום באמצעות תא הצילום המעוצב בהתאמה אישית, ששלט בתנאי התאורה, מרחק המוקד ומיקום הנושא. מדידות קנה מידה ופצע בוצעו באמצעות פילוח בתוכנת ImageJ, וניתוח סטטיסטי בוצע באמצעות תוכנת ניתוח סטטיסטי. הקינטיקה של סגירת הפצע הראתה עלייה קלה בגודל הפצע ובהיקפו בין היום ה-0 ליום השני, ואחריה ירידה הדרגתית עד לסגירה מוחלטת ביום ה-14. תא הצילום והפלנימטריה הדיגיטלית בעזרת מחשב אפשרו מדידות כמותיות עם שונות מינימלית. לסיכום, כלים אלה מספקים שיטה אמינה וניתנת לשחזור להערכת קינטיקה של סגירת פצע במודלים פרה-קליניים.
Introduction
ריפוי פצע טראומטי אורך כ-21 יום ויש לו רצף מוגדר היטב של ארבעה שלבים נפרדים: (1) המוסטזיס, (2) דלקת, (3) התפשטות, ו-(4) עיצוב מחדש1. אם שלב כלשהו של ריפוי פצעים ממושך, זה יכול להוביל להתפתחות פצעים כרוניים1. בשל שכיחותם הגבוהה, סיבוכים פוטנציאלייםוהנטל הכלכלי המשמעותי, הם נחשבים לבעיה בריאותית עולמית.
מחקרים פרה-קליניים שואפים להשיג ריפוי מהיר יותר על ידי קידום אפיתל מחדש מקיף של פצעים 3,4,5, מניעת סיבוכים והפחתת עלויות הטיפול. מחקרים אלה מעריכים אסטרטגיות שונות, כולל פיתוח ביו-חומרים, התערבויות פרמקולוגיות והליכים אחרים של רפואה רגנרטיבית 6,7,8,9.
פותחו מודלים ניסיוניים מרובים לחקר פצעים טראומטיים. חלקם מתמקדים במאפיינים איכותיים הנראים לעין באופן מקרוסקופי כגון גודל, מדדי דלקת, נוכחות של רקמת גרנולציה, הפרשות והיווצרות גלד5. אחרים מנתחים נתונים כמותיים, כולל שטח, היקף, רדיוס, קוטר, צבע, עומק ומרחקים מהמרכז לקצוות הפצעים.
בהקשר זה, רוב החקירות in vivo מודדות ישירות רדיוס ועומק הפצע. עם זאת, תיחום ידני של קצוות פצע בתמונה מקרוסקופית יכול להציג הטיות במדידה10. מחקרים אחרים משתמשים בפלנימטריה מכנית, תוך שימוש ביריעות פלסטיק מרושתות שקופות, כאשר קצוות הפצע מתוחמים בעבר; בשני המקרים, השגת השטח או ההיקף דורשת מכשירים ידניים כגון סרגלים או פלנימטרים דיגיטליים. כיום, פלנימטריה דיגיטלית בעזרת מחשב מאפשרת ניתוח ממוחשב של תמונות מקרוסקופיות של פצעים או יריעות פלסטיק. מניפולציה באתרה ואיכות התמונה המקרוסקופית מהווים מגבלה, עם זאת, כלי זה 11,12,13,14 מפחית במידה ניכרת את השונות בין מדידות שטח והיקף.
מתודולוגיה מוצעת זו מציעה יתרונות משמעותיים על פני הטכניקות הקיימות להערכת סגירת פצעים בעכברים 15,16,17,18,19,20. בעוד שתיעוד תמונות נחשב לכלי מדויק ועקבי להערכת קינטיקה של סגירת פצע, מחקרים קודמים21,22 הדגישו את המגבלות של מדידת פצע ידנית, כגון הטיית צופה ושונות עקב תאורה לא עקבית ומיקום מצלמה. הגישה הנוכחית מטפלת בבעיות אלה על ידי סטנדרטיזציה של תנאי הדמיה באמצעות תא שנבנה בהתאמה אישית, שיפור השחזור והדיוק. יתר על כן, פלנימטריה דיגיטלית ממוחשבת מאפשרת הערכות כמותיות מדויקות יותר, משפרת את הערכת ההתערבויות הטיפוליות וממזערת טעויות מדידה, כפי שהוכח במחקרים אחרים המשווים טכניקות ידניות ודיגיטליות12,22 מה שהופך אותה למתאימה במיוחד למחקרים על קינטיקה של סגירת פצעים במודלים של עכברים, ומאפשרת הערכה מדויקת של טיפולים על ידי שמירה על בקרה קפדנית על תנאי רכישת תמונה.
Protocol
כל הליכי הניסוי הכוללים עכברי מעבדה נערכו בהתאם לתקנים ולתקנות האתיים שנקבעו בתקן המקסיקני הרשמי (NOM-062-ZOO-1999) לטיפול וטיפול בחיות מעבדה. הפרוטוקול נבדק ואושר על ידי הוועדה הפנימית לטיפול ושימוש בחיות מעבדה (CICUAL) של המכון הלאומי למחקר גרעיני (ININ) תחת מספר סימוכין CICUAL-01-23. במחקר זה נעשה שימוש בעכברי CD1 זכרים (n = 4), בני 10 שבועות, עם משקל גוף שנע בין 28-32 גרם. כל החיות נבחרו כדי להבטיח אחידות בזן, בגיל, במין ובמשקל הגוף, ולמזער את השונות בתוצאות הניסוי. פרטי הריאגנטים והציוד המשמש מפורטים בטבלת החומרים.
1. בניית תא צילום לרכישת תמונות מקרוסקופיות
הערה: תוכנת SolidWorks מורשית (גרסה 2015) שימשה לתכנון תא צילום כדי למנוע מקורות תאורה חיצוניים. קובייה בגודל 40 ס"מ × 40 ס"מ נבנתה באמצעות פרופיל אלומיניום לבן בעובי של סנטימטר אחד. הקובייה מורכבת משלושה חלקים, שהורכבו ברצף: הגג, הקירות הצדדיים והרצפה (איור 1A).
- בניית גג
הערה: הגג היה אזורי כקצה קדמי (A), קצה אחורי (B) וקצוות צד (C ו-D) לכיוון (איור 1B).- קבע באזור הפנימי של הקצה הצדדי של הגג (C ו-D) פרופיל אלומיניום מחורץ (מתוכנן להחזיק זכוכית) ברוחב 1.5 ס"מ, בעובי 2.51 ס"מ ובאורך 34.9 ס"מ (איור 1B).
- הנח שתי לוחות אלומיניום מלבניים באורך 34.5 ס"מ על רוחב 13 ס"מ עם פוליאתילן במרכז בחריץ של כל פרופיל גג (לוח 1 ו-2 באיור 1C) כדי לאפשר החלקה דרך החריץ של שני הפרופילים.
- התקן נורת צינור RGB LED בגודל 20 ס"מ עם טווח טמפרטורת צבע של 2500-9000 K (איור 1C) בזווית של 45° בקצה התחתון של פאנל 1 באמצעות סרט דו צדדי.
- התקן על לוחות הגג 1 ו-2 לוח לוח קצף מלבני בגודל 32 ס"מ על 12 ס"מ עם חתך עגול מרכזי בקוטר 7.82 ס"מ כדי לאפשר התקנת עדשת המצלמה (איור 1C).
- בניית הרצפה
- הניחו חתיכה מרובעת של לוח קצף לבן בגודל 40 ס"מ על 40 ס"מ על גבי פרופילי שטח הרצפה. חותכים ריבועים באורך צד של 2.54 ס"מ מכל פינה של לוח הקצף (איור 1E).
- בניית קירות צד
- חותכים ארבעה לוחות לוח קצף מרובעים בגודל 40 ס"מ על 40 ס"מ.
- הדביקו שני לוחות עם סיליקון בצדדים C ו-D כדי ליצור את קירות הצד השמאלי והימני (איור 1F).
- חבר רצועות הידוק וו ולולאה לפרופילי האלומיניום A ו-B למניפולציה קלה של אלמנטים פנימיים של תא צילום. בנוסף, חבר 1 ס"מ מקצה קו של מחברים דביקים לשני ריבועי קרטון מוקצף בצד אחד, והנח אותם על הקירות הקדמיים והאחוריים (איור 1F).
- בניית בסיס הייחוס
הערה: בסיס ייחוס היה נחוץ כדי לשמור על העכבר במצב שכיבה במהלך ההרדמה ולאורך כל התיעוד של התפתחות הפצע. רכיבי תלת מימד תוכננו ויוצרו בטכניקת Fused Deposition Modeling (FDM) עם חומר PLA ומדפסת תלת מימד23,24.- הדפיסו בתלת מימד את המסכה עם בסיס של 2 ס"מ ברוחב, אורך וגובה והניחו אותה 11.5 ס"מ מקצה מלבן לוח קצף לבן חתוך מראש בגודל 40 ס"מ על 28 ס"מ כדי לשמור על העכברים תחת הרדמה בשאיפה (איור 1D, צבע אדום).
- הדפס בתלת מימד את הפלטפורמה המלבנית (9 ס"מ אורך, 5 ס"מ רוחב, 2.5 ס"מ גובה) עם ארבעה אזורים מוחצנים כדי ליישר את גב העכבר במהלך רכישת תמונה. אזורים אלה תמכו בראש, בגפיים ובאזור הבטן כדי לשמור על תנוחת השכיבה. הדביקו את הפלטפורמה הזו למרכז בסיס הייחוס (איור 1D, צבע ירוק).
- הדפיסו בתלת-ממד את בלוק הסרגל (2 ס"מ רוחב, 8 ס"מ אורך, 2.5 ס"מ גובה) וקבעו אותו 1 ס"מ מהצד השמאלי של בסיס העכבר כדי למקם את אלמנט ייחוס המדידה הדרוש לעיבוד תמונה דיגיטלית (איור 1D, צבע כחול).
- חבר סרגל מדורג מפלדת אל-חלד בגודל 15 ס"מ לבלוק הסרגל, והתקן את כל בסיס הייחוס בתוך תא הנוסעים לצורך שינוי קנה מידה של תמונה (איור 1D).
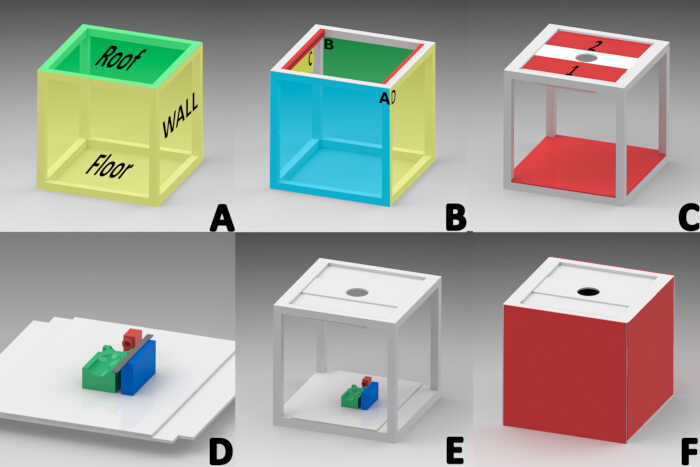
איור 1: דיאגרמה לבניית ארון רכישת התמונות המקרוסקופי. (A) חלקים של תא הנוסעים (גג, קירות צד, רצפה). (ב)כיוון הפרופילים היוצרים את הגג; קדמי (A), אחורי (B) וצדדים (הצד הפנימי של הפרופילים באדום "C,D"). (ג) לוחות גג 1 ו-2, התקנת צינור תאורת LED, לוחית עדשת מצלמה והתקנת רצפה. (D) התקנת מסכת ההרדמה (RED), פלטפורמת העכבר (GREEN) והפלטפורמה המלבנית למיקום סרגל המדידה (BLUE) על בסיס הייחוס. (ה) מיקום סופי לבסיס הייחוס. (ו) התקנת דפנות, קירות קדמיים ואחוריים. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
2. תחזוקת בעלי חיים
- קבל אישור מהוועדה הביו-אתית של המוסד לניסויים בבעלי חיים. השתמש בעכברי CD1 (n = 4), בני 10 שבועות, במשקל 28-32 גרם.
- שיכנו את העכברים בתנאים סטנדרטיים: שמרו על טמפרטורה של 21 מעלות צלזיוס, מחזורי אור/חושך של 12/12 שעות, 45% לחות, וספקו גישה חופשית למים ולמזון, למעט במהלך מפגשי תיעוד צילום.
3. יצירת פצעים טראומטיים
- צום את העכברים במשך 8 שעות לפני ההליך. להרדים את העכברים עם נתרן פנטוברביטל תוך-צפקי במינון 65 מ"ג/ק"ג25 (בהתאם לפרוטוקולים שאושרו על ידי המוסד).
- אשר את עומק ההרדמה על ידי בדיקת היעדר רפלקס נסיגה במהלך צביטה בין-דיגיטלית. מרחו משחה עיניים על העיניים למניעת יובש בזמן ההרדמה. שמור על העכברים בטמפרטורה יציבה של 37 מעלות צלזיוס במהלך הניתוח וההחלמה (20 דקות).
- הנח את העכבר בתנוחת דקוביטוס גחונית והוציא אזור של 2.5 ס"מ על 3 ס"מ מאזור צוואר הרחם בזנב באמצעות להבים כירורגיים. מותחים את העור כדי למנוע חתכים. בצע אספסיס ואנטיספסיס באמצעות שטיפות פובידון, יוד ומים סטריליים לסירוגין.
- השתמש באגרוף ביופסיה סטרילי של 5 מ"מ והפעל לחץ בתנועות מעגליות ליצירת חתך דרמו-אפידרמיס בגובה השכמות. הסר את הדש בעזרת מלקחיים משוננים וחתך בעזרת מספריים עם קצה הקשתית (איור 2A).
- במקרה של נוכחות נקודות דימום בפצע, יש להפעיל שוק חשמלי עם מכשיר צריבה חשמלית כדי להשיג המוסטזיס.
- הניחו סרט עורי עגול בקוטר 1 ס"מ על הפצע באמצעות מלקחיים של Jeweler כדי למנוע זיהום והתכווצות.
- בצע את כל ניתוחי ההישרדות בתנאים סטריליים. הכן את אתר הניתוח עם חומרי חיטוי כמו פובידון-יוד. ללבוש כפפות סטריליות ומסכה, ולשמור על סטריליות לאורך כל ההליך על ידי שימוש במכשירים סטריליים ומזעור מגע עם משטחים לא סטריליים.
- לאחר הניתוח, הניחו את העכברים בכלובים בודדים בטמפרטורה של 24 מעלות צלזיוס ועקבו אחריהם עד שהם יחזרו להכרה מספקת כדי לשמור על תנוחת החזה. ודא שטמפרטורת הגוף נשלטת במהלך הניתוח ואחריו כדי למנוע היפותרמיה על ידי שימוש במקורות חום חיצוניים.
- יש לתת משככי כאבים עד היום הרביעי על ידי דילול קטורולאק במי שתייה ב-5 מ"ג/ק"ג26.
- לאחר 14 יום, כאשר הפצעים במכרסמים בריאים מגיעים בדרך כלל לשלבי ריפוי מתקדמים, יש להמית את העכברים על ידי החלפת O2 בתא CO2 בהתאם לתקנים בינלאומיים. זה מסמן את נקודת הסיום של המחקר.
4. רכישת תמונות מקרוסקופיות
- צלם תמונות של הפצעים מדי יום במשך 14 ימים רצופים כדי לעקוב אחר הקינטיקה המתמשכת של סגירת הפצע. השתמש במצלמה חצי מקצועית או מקצועית; מקם את העדשה דרך הפתח העגול בגג תא הצילום.
הערה: התאם את לוח הזמנים לפי הצורך בהתבסס על תנאי הניסוי. - השתמש בשפופרת אור RGB LED במצב טמפרטורת צבע מתואמת (CCT), המוגדר ל-9000 K ובהירות של 100% לתאורה.
- מקם את בסיס הייחוס במרכז רצפת תא הצילום.
- הניחו את העכבר בתא ההרדמה בשאיפה למשך 3 דקות (איור 2B).
- לאחר השראת הרדמה, הנח את העכבר במצב נוטה על משטח העכבר. אבטח את החוטם בתוך מסכת ההרדמה של סבופלורן, ומספק 5% סבופלורן בקצב זרימת חמצן של 1.5 ליטר לדקה (איור 2C).
- לפני צילום תמונות, הסר את סרט העור מהפצע באמצעות מלקחיים של Jeweller ויישר את בסיס הייחוס עם עדשת המצלמה.
- התקן את הקיר הקדמי של תא הצילום וצלם תמונות מקרוסקופיות עם ההגדרות הבאות: צמצם f/3.2, זמן חשיפה 1/200 שניות, מהירות ISO 80, אורך מוקד 4 מ"מ.
- בעזרת מלקחיים של Jeweller, הניחו סרט עורי בקוטר 1 ס"מ על הפצע לפני הסרת מסכת ההרדמה. העבירו את העכברים לכלובים בודדים והתבוננו עד להתאוששות מוטורית.
5. עיבוד תמונה
- צור עותק גיבוי של התמונות המקרוסקופיות. עבד את התמונות באמצעות תוכנת ImageJ.
- פתח את תמונת הגיבוי ב-ImageJ על ידי ביצוע הנתיב: קובץ > פתח > חפש בתמונות ולאחר מכן לחץ על פתח.
- קנה מידה של התמונה לפי הפניה: הגדל את התמונה, בחר בכלי הקו הישר , התקרב לסרגל שליד העכבר באמצעות מקש +, צייר קו ישר של 10 מ"מ על תמונת הסרגל, ולאחר מכן עבור אל ניתוח > הגדר קנה מידה > הזן " 10" עבור מרחק ידוע > הגדר יחידת אורך למ "מ ולאחר מכן לחץ על אישור. זה קובע את יחס הפיקסלים למרחק עבור התמונה המקרוסקופית (איור 2D).
- הפרד את אזור הפצע מהתמונה: השתמש/י בכלי המלבן כדי לבחור את האזור סביב הפצע (w = 150, h = 150). הקלט את ערכי X ו- Y, לחץ באמצעות לחצן העכבר הימני על המלבן > שכפל > תן שם לנושא > הקש Enter. בתמונה החדשה, לחץ על + פעמיים כדי להגדיל (איור 2E).
- שמרו את התמונה שנחתכה באמצעות הנתיב: File > Save As > Tiff > הזינו את השם > Save.
- צור שכפול של התמונה החתוכה כדי למנוע שינוי במהלך הפילוח: לחץ לחיצה ימנית על התמונה החתוכה > שכפל > תן לה שם על ידי הוספת "סגמנטציה" לסוף. לאחר מכן, הקש Enter. בתמונה החדשה, לחץ על + פעמיים כדי להגדיל.
- הפרד את התמונה לערוצי צבע באמצעות הנתיב הבא: Image > Type > RGB Stack. בתמונת הערוץ האדום (1/3 אדום), לחץ לחיצה ימנית על שכפל ולחץ על אישור בחלון Duplicate.
- פלח את תמונת הערוץ האדום. לחץ על תמונת הערוץ האדום, תמונה > התאם > סף. לאחר מכן, בחר ברירת מחדל > החל (איור 2F).
- תקן את אזור העניין (ROI) כדי להבטיח כיסוי מלא של הפצע ולמנוע עיוותי סגמנטציה.
הערה: אם אזורים סביב הפצע אינם נכללים בסגמנטציה, עבור אל עיבוד > בינארי > מילוי חורים. כדי להסיר נקודות שחורות מחוץ לפצע, עבור אל Process > Binary > Erode. אם הפקודה Erode מקטינה את גודל הפצע, תקן אותו באמצעות Process > Binary > Dilate. - סמן את היקף ההחזר על ההשקעה: ערוך > בחירה > צור בחירה. החזר ההשקעה יתואר בצהוב. הוסף אותו למנהל ההחזר על ההשקעה על ידי ביצוע עריכת > בחירה > הוסף למנהל (איור 2G).
- אמת את הפילוח: פתח את חלון מנהל ההחזר על ההשקעה ובחר את ההחזר על ההשקעה לסקירה: עוד > תרגם. הזן את ערכי X ו-Y שתועדו בשלב 4 ולחץ על אישור.
- הגדל את התמונה המקורית ולאחר מכן בחר את ההחזר על ההשקעה במנהל ההחזר על ההשקעה. כוונן את החזר ה-ROI באמצעות מקשי החצים עד שהוא מתיישר עם הפצע (איור 2H). אם ההחזר על ההשקעה תואם את הפצע, הפילוח הצליח. אחרת, חזור על הפעולה משלב 2.
- לאחר אישור הפילוח, קבל את מדידות הפצע: נתח > למדוד. טבלת תוצאות תציג את ערכי השטח, ההיקף ומיקום X/Y. העתק ערכים אלה לתוכנת SPSS לתיעוד וניתוח סטטיסטי (איור 2I).

איור 2: זרימת עבודה של מדידת פצעים באמצעות טכניקות פלנימטריה ופילוח דיגיטליות. (A) חתך דרמו-אפידרמיס באמצעות אגרוף ביופסיה סטרילי של 5 מ"מ. (B) הנחת העכבר בתא הרדמה באינהלציה למשך 3 דקות. (C) תיעוד מצולם על ידי מיקום העכבר המורדם בתא הצילום וקיבוע חוטמו בתוך מסיכת סבופלורן. (D) פתיחת התמונה שהתקבלה ב-ImageJ ושינוי קנה המידה שלה באמצעות הסרגל כהפניה. (E) חילוץ אזור הפצע באמצעות כלי המלבן. (F) הפרדת התמונה לערוצי RGB ועיבוד הערוץ האדום. (ז) התוויית וניהול אזור העניין (ROI). (ח) אימות הפילוח על ידי התאמת החזר ההשקעה לפצע. (I) מדידת פרמטרים של פצע ורישום התוצאות לניתוח סטטיסטי. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
6. המתת חסד לאחר הליך
הערה: המחקר מסתיים לאחר 14 יום, ואז הפצעים במכרסמים בריאים מגיעים בדרך כלל לשלבי ריפוי מתקדמים. בשלב זה, העכברים הומתו באופן אנושי בעקבות הליך המתת החסד שאושר על ידי המוסד.
- הכן את הציוד. ודא שתא המתת החסד נקי, יבש ובגודל מתאים כדי להכיל את העכברים ללא צפיפות. חבר את החדר לאספקת CO2 בדרגה רפואית עם ווסת זרימה.
- העבירו בעדינות את העכברים לתא כדי למזער את הלחץ. ודאו שהם נמצאים בסביבה רגועה עם מינימום הפרעות חיצוניות.
- הגדר את קצב זרימת ה-CO2 ל-20%-30% מנפח החדר לדקה, כפי שהומלץ על ידי הנחיות AVMA להמתת חסד של בעלי חיים. הגדל בהדרגה את ריכוז ה-CO2 כדי למנוע גרימת מצוקה או אי נוחות בעכברים.
- התבונן בעכברים מקרוב במהלך ההליך. חפשו סימנים של אובדן הכרה הדרגתי, כולל ירידה בפעילות ובנשימה, ואחריהם דום נשימה ודום לב.
- אשר את המוות ברגע שהעכברים כבר לא נושמים ולא מראים סימני תנועה; המתן 1-2 דקות נוספות כדי להבטיח הפסקה מוחלטת של תפקודים חיוניים. אמת מוות על ידי אישור היעדר רפלקסים (למשל, רפלקס קרנית) ופעילות לבבית.
- להעביר את הפגרים למכלים ייעודיים לפסולת ביולוגית מסוכנת. פעל לפי פרוטוקולים מוסדיים והנחיות לאומיות לסילוק בטוח של שרידי בעלי חיים.
- רשום את מספר בעלי החיים שהומתו, את התאריך וכל תצפיות רלוונטיות כדי להבטיח עמידה בתקנים אתיים ומוסדיים.
תוצאות
לאחר שינוי קנה המידה של התמונות בתוכנת ImageJ, ההיקף הממוצע (טבלה 1) והשטח (טבלה 2) של הפצעים, יחד עם סטיות התקן שלהם, הושגו באמצעות פילוח דיגיטלי. ערכים אלה נרשמו מיום האפס עד היום הארבעה עשר (D0-D14).
| יום | היקף (מ"מ) |
| 0 | 22.75 ± 0.8900 |
| 1 | 21.65 ± 0.0200 |
| 2 | 25.25 ± 0.5900 |
| 3 | 24.37 ± 0.1600 |
| 4 | 24.61 ± 1.2600 |
| 5 | 23.98 ± 0.5500 |
| 6 | 24.59 ± 0.4900 |
| 7 | 22.05 ± 0.2600 |
| 8 | 18.64 ± 0.6200 |
| 9 | 15.29 ± 0.1800 |
| 10 | 14.51 ± 0.3800 |
| 11 | 13.23 ± 0.1000 |
| 12 | 13.12 ± 0.3600 |
| 13 | 7.49 ± 0.2200 |
| 14 | 5.78 ± 0.1200 |
טבלה 1: מדידות היקפיות של פצעים (ימים 0-14). הערכים מייצגים את מדידות היקף הפצע (מ"מ) בכל יום (D0-14) כממוצע ± סטיית תקן (SD).
| יום | שטח (מ"מ2) |
| 0 | 27.56 ± 0.1500 |
| 1 | 30.64 ± 0.3100 |
| 2 | 38.05 ± 0.6100 |
| 3 | 37.85 ± 0.2500 |
| 4 | 36.30 ± 0.6000 |
| 5 | 32.93 ± 0.3600 |
| 6 | 29.83 ± 0.5700 |
| 7 | 23.77 ± 0.3500 |
| 8 | 15.43 ± 0.1800 |
| 9 | 12.75 ± 0.1400 |
| 10 | 10.72 ± 0.3200 |
| 11 | 10.69 ± 0.2600 |
| 12 | 9.55 ± 0.3200 |
| 13 | 3.03 ± 0.1400 |
| 14 | 1.82 ± 0.0900 |
טבלה 2: מדידות שטח של פצעים (ימים 0-14). הערכים מציגים את מדידות שטח הפצע (מ"מ2) בכל יום (D0-14) כממוצע ± סטיית תקן (SD).
שטח הפצע וההיקף גדלו בתחילה מיום 0 ליום 3, מה שמצביע על תגובה דלקתית שהגדילה זמנית את גודל הפצע מעבר למדידות המקוריות שלו. עם זאת, מהיום השלישי ליום השישי, גם השטח וגם ההיקף פחתו בהדרגה, עם ירידה משמעותית שנצפתה ביום השביעי. בשלב זה, הפצעים נמדדו פחות מגודלם המקורי, מה ששיקף ריפוי מתקדם.
על מנת לחקור את קינטיקה של סגירת הפצע, נעשה שימוש בנתוני שטח כדי לחשב את אחוז ריפוי הפצע באמצעות משוואה27,28 של רובסון (משוואה 1):

כאשר, %Δ A מתאים לאחוז ההפחתה של אזור הפצע ביום ההערכה (אזור יום x) ביחס לאזור ההתחלתי ביום האפס (אזוריום 0).
| יום | % הפחתה | ||
| 0 | 0 | ± | 0.5300 |
| 1 | -11.2 | ± | 1.1500 |
| 2 | -38 | ± | 1.8900 |
| 3 | -37.3 | ± | 1.7200 |
| 4 | -31.7 | ± | 1.7700 |
| 5 | -19.5 | ± | 1.9800 |
| 6 | -8.21 | ± | 2.1900 |
| 7 | 13.77 | ± | 2.4000 |
| 8 | 44.03 | ± | 1.8900 |
| 9 | 53.76 | ± | 1.6000 |
| 10 | 61.09 | ± | 3.1800 |
| 11 | 61.2 | ± | 3.8400 |
| 12 | 65.37 | ± | 4.1000 |
| 13 | 89.00 | ± | 5.5800 |
| 14 | 93.4 | ± | 5.0500 |
טבלה 3: אחוז סגירת הפצע (משוואת רובסון). הערכים מייצגים את האחוזים הממוצעים של הפחתת שטח הפצע, המחושבים על ידי משוואת רובסון (משוואה 1) כממוצע ± סטיית תקן (SD).
כאשר האחוזים המתקבלים מהמשוואה הזו חיוביים (טבלה 3), הם מצביעים על סגירת פצע, בעוד שערכים שליליים מצביעים על עלייה בגודל הפצע (איור 3A). כדי לחשב את מרחק הנסיגה מקצוות הפצע למרכז, נעשה שימוש בנתונים עם משוואה 29,30,31 (משוואה 2):

כאשר, D הוא מרחק ההתקדמות הליניארי הממוצע במ"מ מהשוליים לכיוון מרכז הפצע, A0 הוא אזור הפצע בתחילת הטיפול (יום0), Ai הוא אזור הפצע בזמן המדידה, P0 הוא היקף הפצע בהתחלה (יום0), Pi ההיקף בזמן המדידה.
| יום | מרחק נסיגה (מ"מ) |
| 0 | 0.00 ± 0.0425 |
| 1 | -0.139 ± 0.0165 |
| 2 | -0.437 ± 0.0301 |
| 3 | -0.466 ±0.0264 |
| 4 | -0.369 ± 0.0267 |
| 5 | -0.230 ± 0.0298 |
| 6 | -0.096 ±0.0279 |
| 7 | 0.169 ± 0.0292 |
| 8 | 0.586 ±0.0236 |
| 9 | 0.779 ±0.0147 |
| 10 | 0.904 ± 0.0238 |
| 11 | 0.938 ± 0.0296 |
| 12 | 1.005 ± 0.0310 |
| 13 | 1.622 ± 0.0424 |
| 14 | 1.804 ± 0.0257 |
טבלה 4: נסיגת קצוות פצועים (משוואת גילם). הערכים מראים באופן כרונולוגי את הנסיגה הממוצעת (מ"מ) מהקצה למרכז הפצע, המוצגת כממוצע ± סטיית תקן (SD).
בהתאמה לאחוזי סגירת הפצע, ערכים חיוביים ממשוואה 2 מראים את קצוות הפצע מתקרבים זה לזה, מה שמעיד על התכווצות (טבלה 4). לעומת זאת, ערכים שליליים משקפים עלייה במרחק הזה (איור 3B). בתחילה, ביום 0, קוטר הפצע נמדד 5 מ"מ, וכתוצאה מכך 2.5 מ"מ ± 0.0425 מ"מ מהקצה למרכז. מרחק ראשוני זה שימש כבסיס לחישוב שיעור נסיגת הפציעה היומי הממוצע. לאחר מכן הופחת קצב הנסיגה המחושב מהמרחק ההתחלתי כדי ליצור את קצב סגירת הפצע הסינתטי המוצג בטבלה 5.
| יום | מרחק מהקצה למרכז (מ"מ) |
| 0 | 2.5 ± 0.0425 |
| 1 | 2.63 ± 0.0165 |
| 2 | 2.9369 ± 0.0301 |
| 3 | 2.9368 ±0.0264 |
| 4 | 2.8689 ± 0.0267 |
| 5 | 2.7298 ± 0.0298 |
| 6 | 2.5956 ±0.0279 |
| 7 | 2.3306 ± 0.0292 |
| 8 | 1.9136 ± 0.0236 |
| 9 | 1.7210 ± 0.0147 |
| 10 | 1.5962 ± 0.0238 |
| 11 | 1.5624 ± 0.0296 |
| 12 | 1.4955 ± 0.0310 |
| 13 | 0.8774 ± 0.0423 |
| 14 | 0.6954 ± 0.0257 |
טבלה 5: קצב סגירת הפצע (מ"מ). הערכים מראים את נסיגת הפצע לאורך זמן. זה מתקבל על ידי הפחתת המרחק מקצה הפצע בכל נקודת זמן מהמרחק ההתחלתי (2.5 מ"מ ± 0.0425) כממוצע ± סטיית תקן (SD).
אחוז הסגירה חושב באמצעות משוואה32 של רובסון (איור 3A), המשמשת בדרך כלל במדידות עוקבות של סגירת כיב נוירופתיה סוכרתית, ומשוואה33 של גילמן (איור 3B) משמשת בדרך כלל לניטור התקדמות ריפוי הפצע.
ביום ה-0, הפצע הניתוחי הראשוני (בקוטר 5 מ"מ, מיוצג כ-100%) הראה עלייה משמעותית ל-138.04% ביום השני, ככל הנראה בשל התהליך הדלקתי הראשוני סביב הפצע 4,34. במהלך תקופה זו, נויטרופילים ומקרופאגים נודדים, ומשחררים ציטוקינים וגורמי גדילה28. השלב הדלקתי נמשך בדרך כלל בין יום לשלושה ימים35. ובכל זאת, זה יכול להימשך מספר שבועות במקרים של פציעות נרחבות, זיהומים נוספים, מצבים קיימים, או אצל מבוגרים שבהם מנגנוני התיקון מתעכבים.
תוצאות אלו מדגישות את היעילות של מתודולוגיה זו, המשלבת שימוש בתא הצילום, פילוח דיגיטלי ופלנימטריה דיגיטלית בלכידת השינויים הדינמיים בקינטיקה של סגירת הפצע. במודל זה, דלקת ככל הנראה גרמה לנסיגת קצה הפצע, מה שהוביל לעלייה ראשונית באזור הפצע ובהיקפו. בנוסף, זיהינו כי תנאי התאורה האופטימליים להדמיה מקרוסקופית הושגו באמצעות שפופרת אור RGB LED במצב CCT בעוצמה של 9000 K ו-100%, כאשר מרחק המצלמה האידיאלי נקבע על 18 ס"מ מהעכבר.
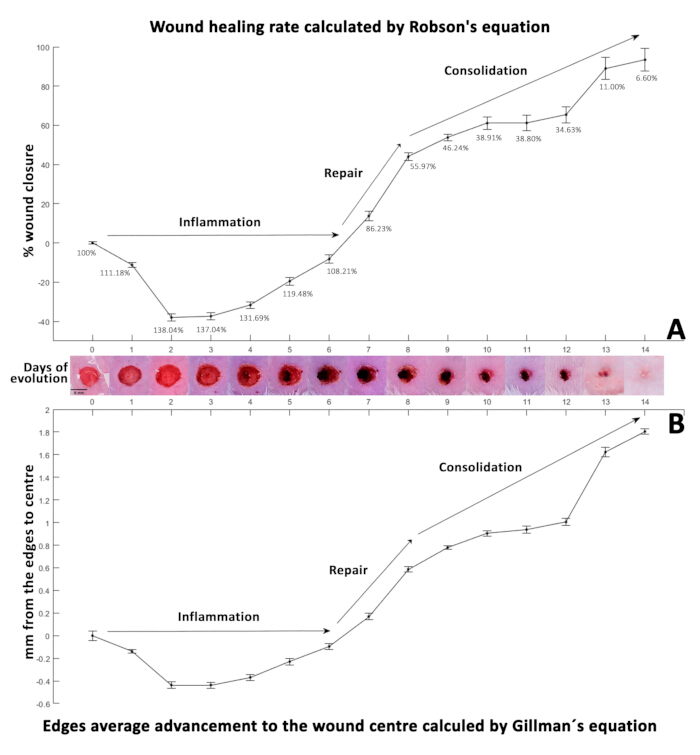
איור 3: קינטיקה של ריפוי פצעים. (A) אחוז סגירת הפצע המחושב באמצעות משוואת רובסון. (B) הצגת קצב הריפוי במהלך תקופת האבולוציה של 14 הימים כפי שנקבע על ידי משוואת גילמן. ערכים שליליים בשתי המשוואות מצביעים על עלייה בגודל הפצע, בעוד שערכים חיוביים קשורים לסגירת הפצע. שני הפאנלים מייצגים קינטיקה של ריפוי, כאשר סטיות תקן (SD) מוצגות על ידי פסי שגיאה לצד תמונות הממחישות את התפתחות הפצע לאורך 14 יום (D0-14). אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
איור 3A מציג את אחוז סגירת הפצע המחושב באמצעות משוואת רובסון, ואיור 3B מציג את קצב הריפוי לאורך תקופת האבולוציה של 14 הימים כפי שנקבע על ידי משוואת גילמן33.
Discussion
במודלים פרה-קליניים, ניתוח כמותי של התפתחות פצעים טראומטיים במודלים פרה-קליניים מתמודד עם אתגרים הנובעים מגורמים כמו גודל הפצע, תגובה דלקתית מקומית34, מיקום ו/או מניפולציה. קיימות שיטות פלנימטריה ידניות36 ועקיפות דיגיטליות 11,16,37,38 למדידות אלה. בניגוד למחקרים המשתמשים בשיטות ידניות, שלעתים קרובות סובלות מהטיית צופה ושונות בתנאי התאורה, המחקר שלנו השתמש בפלנימטריה דיגיטלית סטנדרטית. מחקרים המשתמשים במדידה ידנית מדווחים על שונות גבוהה יותר בגודל הפצע10,38, בעוד שהטכניקה שלנו הראתה עקביות רבה יותר לאורך זמן. יתר על כן, בהשוואה לשיטות דיגיטליות אחרות 11,16,37,38, מערכת תאורה ומיקום מבוקרת זו הביאה למדידות מדויקות יותר.
היעדר מתודולוגיות מפורטות שלב אחר שלב למדידת שטח והיקף הפצע הוביל לפיתוח שיטת מדידה עקיפה סטנדרטית באמצעות פלנימטריה דיגיטלית, קנה מידה ופילוח. כדי להשיג זאת, תוכנן ונבנה תא תיעוד צילום. על ידי שליטה בתנאי התאורה, מיקום הנושא ומרחק המצלמה, הובטחה עקביות ברכישת תמונה מקרוסקופית, תוך מזעור ההטיה במדידות הפצע. מחקרים במכרסמים דיווחו על סגירת פצע מתמשכת מיום האפס, המיוחסת לשימוש בטבעות סיליקון סביב הנגעים במהלך ההליך הכירורגי39,16, מה שעשוי למנוע נסיגה והתרחבות של הפצע במהלך דלקת. לעומת זאת, מחקר אחר שהעריך מוצרי דרמיס מלאכותיים עם גורם גדילה פיברובלסטים בסיסי (bFGF) דיווח על עלייה באזור הפצע ובהיקף20.
ריפוי פצעים כרוך בארבעה שלבים עוקבים: המוסטזיס (1-24 שעות)40, דלקת (1-3 ימים)41, התפשטות (3-21 ימים)34 וקונסולידציה (21-60 ימים)4, אם כי אלה יכולים לחפוף 4,34. במחקר זה, הדלקת התקדמה באופן סובייקטיבי מהיום השלישי עד השישי, ועברה לשלב ההתפשטות.
שלב מעבר זה חיוני לריפוי, מכיוון שהוא מפחית את התגובה הדלקתית על ידי הפחתת נויטרופילים והגדלת מקרופאגים32, מקדם אנגיוגנזה42, סינתזת קולגן והפעלת פיברובלסטים. פיברובלסטים נודדים לאתר הפצע, יוזמים סינתזת מטריצה חוץ-תאית ומפקידים פיברונקטין34, קולגן, פרוטאוגליקנים, חומצה היאלורונית וגליקוזאמינוגליקנים, החיוניים לפיגומים ולהדבקת תאים לאחר מכן43. מהיום השני עד השישי, מודל זה הראה ירידה בגודל הפצע מ-138.04% ל-108.21%, מה שמעיד על ירידה בדלקת.
למרות העלייה הראשונית בגודל הפצע, מגמה זו התהפכה מהיום השביעי, הגיעה ל-86.23%, והחלימה בהדרגה עד היום ה-14. סביר להניח שזה תואם את שלב ההתפשטות44 ותחילת אנגיוגנזה45, היוצרים רקמת גרנולציה המכווצת את הפצע, כפי שנצפה במחקר זה. דפוסי סגירה מתמשכים דווחו במחקרי מכרסמים 6,19, מה שמצביע על כך שפצעים נרפאים ללא קשר להתערבויות קליניות, עם הבדלים במהירות הסגירה. לפיכך, מודל זה יכול לשמש כבקרת ייחוס.
סגירת הפצע האטה מהיום ה-9-14, ובסופו של דבר הגיעה ל-6.60%. יש לציין כי גלדים נוצרו על הפצעים מהיום הרביעי, התנתקו מהקצוות ביום העשירי, חשפו אזורים קטנים של רקמת צלקת מתחת, והתנתקו לחלוטין ביום הארבעה עשר.
חשוב לציין כי פצע סגור מקרוסקופית עשוי להפגין הבדלים מיקרוסקופיים משמעותיים, מה שמחייב ניתוח היסטולוגי מפורט כדי להתבונן במורפולוגיה התאית והתפתחות הפצע. מתודולוגיה זו מאפשרת נתוני שטח והיקף מדויקים עם שונות מינימלית, מה שמקל על השימוש במשוואות מתמטיות בניתוח קינטיקה של סגירת פצע. ההתנהגות המתמטית שנצפתה בתוצאות שחושבו באמצעות משוואות33 של גילמן (איור 3B) ו-32 של רובסון (איור 3A) הייתה עקבית.
שלבים קריטיים של הפרוטוקול
למרות שפצעים בדרך כלל מציגים התמרה של פלזמה לסביבה החיצונית, מחקר זה שלט בגורמים מסוימים שיכולים להשפיע גם על מנגנוני תיקון הפצעים. בניסויים קודמים נצפה כי המוסטזיס תקין מקדם אינטראקציה בין הפצע לסרט העור, שכן דימום מוגזם משנה את גיאומטריית הפצע ואת גודל הגלד.
שינויים ופתרון בעיות
המתודולוגיה המוצעת מאפשרת יצירת מודלים של עכברים עם פצעים גדולים ועמוקים יותר. עם זאת, אם מיקום הפצע משתנה, יש למקם מחדש את בסיס הייחוס כדי להבטיח שהוא יישאר ממורכז בתמונה המקרוסקופית. בנוסף, ניתן להתאים את הימים לתיעוד הצילום ואת משך המודל.
מגבלות
המגבלות של שיטה זו כוללות את גודל תא הצילום, המיועד למכרסמים קטנים וקלים. עם זאת, עם שינויים בבסיס העכבר, ניתן להתאים אותו למכרסמים גדולים יותר. בנוסף, שיטה זו אינה מודדת כיום פצעים טראומטיים מאריכים באמצעות סגמנטציה, אם כי ניתן ליישם אותה עם שינויים נוספים.
משמעות השיטה ביחס לשיטות קיימות/אלטרנטיביות
מתודולוגיות שונות למדידת פצעים משתמשות בפלנימטריה דיגיטלית 11,12,13,14. עם זאת, לעתים קרובות הם אינם מדווחים על תנאי התאורה, המרחק בין המצלמה לפצע או החזרתיות של מיקום הצילום במהלך ימי התפתחות הפצע. זה המקום שבו המחקר הנוכחי משמעותי.
בדגם זה, תצורת מנורת ה-RGB מספקת תנאי תאורה אופטימליים במצב טמפרטורת צבע מתואמת (CCT) ב-9000 K עם בהירות של 100%. המרחק האידיאלי בין בסיס העכבר לעדשת המצלמה הוא 18 ס"מ. תנאים אלה אפשרו לנו לגלות שהתעלה האדומה של מחסנית ה-RGB מפלחת את אזור הפצע מבלי ללכוד את קצוות רקמת הגרנולציה, דבר שלא דווח בעבר.
לבסוף, בהתחשב בכך שמתודולוגיות מסוימות משתמשות במצלמות16 המותקנות על ציוד כמו סטריאוסקופים, שאינן נגישות לכל המעבדות, תא תיעוד צילום זה מציע את ההזדמנות להשיג תמונות באיכות גבוהה לניתוח שלאחר מכן.
חשיבות ויישומים פוטנציאליים של השיטה בתחומי מחקר ספציפיים
היישומים הפוטנציאליים והמשמעות של מתודולוגיה זו נעוצים ביכולתה לבטל הטיות במדידות פצעים, ולייצר נתונים אמינים למעקב אחר תהליך הריפוי. בנוסף, יכולת החזרה של מיקום העכבר מאפשרת יצירה עתידית של מאקרו ImageJ שמנתח ומתאר באופן אוטומטי אזורי עניין. יתרה מכך, אם אין גישה למצלמה חצי מקצועית או מקצועית לתמונות ברזולוציה גבוהה, ניתן לשנות את התא לצילום באמצעות מצלמת טלפון נייד, שיכולה להשתמש באפליקציה כדי לרכוש תמונות ללא תיקון צבע אוטומטי.
Disclosures
המחברים מצהירים כי אין ניגודי אינטרסים הקשורים למחקר זה.
Acknowledgements
המחברים מבקשים להודות ל-Consejo Nacional de Humanidades, Ciencias y Tecnologías (CONAHCyT, CVU: 933600) באמצעות המענק למתן מימון, ול-Laboratorio Nacional de Investigación y Desarrollo de Radiofármacos del Instituto Nacional de Investigaciones Nucleares (LANIDER-ININ) על תמיכתם. בנוסף, איור 2 הוכן בסיוע תוכנת BioRender (2020), הזמינה ב-BioRender.com/p67z056.
Materials
| Name | Company | Catalog Number | Comments |
| 5 mm Biopsy Punch | MILTEX, USA | 33-35 | To mark the wound edges |
| Aluminum with polyethylene core | Alucobond,USA | Bright Silver 119 | For the construction of the macroscopic Image Acquisition Booth |
| Camera Lens | Sony, Japan | SEL2470Z | To focus the images to photograph |
| Electrocautery | Bonart, USA | ART-E1 | To eliminates bleeding points in the wound if present. |
| Hook and loop fastener strips | VELCRO | ||
| IBM SPSS Statistics Version 22 | IBM Corporation, USA | https://www.ibm.com/analytics/spss-statistics | Used for statistical analysis of wound measurements, including area and perimeter data. |
| ImageJ Version 1.53t | National Institutes of Health, USA | https://imagej.nih.gov/ij/ | Used for processing macroscopic images, including scaling, segmentation, and measurement of wound parameters. |
| Ketorolac | SIEGFRIED RHEIN, Mexico | 493977 | For postoperative pain management |
| Miltex Iris Scissors, 4-1/8" Curved | MILTEX, USA | V95-306 | To cut the wound flap generated with the biopsy punch |
| RGB LED Light Tube | ANDOER, China | B09F8RLMSY | To illuminate the Macroscopic Image Acquisition Booth |
| Semi profesional camera | Sony, Japan | DSC-HX300 | To take the photos |
| Serrated Forceps | MILTEX, USA | V96-118 | To hold the flap during the cut |
| Sevoflurane | Baxter, USA | AMX2L9117PR | For inhaled anaesthesia |
| Sodium Pentobarbital | Aranda, Mexico | 734.448.001.212 | For intraperitoneal anaesthesia |
| SolidWorks Version 2015 | Dassault Systèmes, France | https://www.solidworks.com/ | Used to design and create 3D models for constructing accessories for the photodocumentation booth. |
| Surgical blades | HERGOM, Mexico | H10 | To shave the hair in the area where the wound will be created |
| Transparent Adhesive Dressing | 3M, USA | F51CA07 | To cover the traumatic wound |
References
- Martinengo, L., et al. Prevalence of chronic wounds in the general population: systematic review and meta-analysis of observational studies. Ann Epidemiol. 29, 8-15 (2019).
- Chen, X., Shi, X., Xiao, H., Xiao, D., Xu, X. Research hotspot and trend of chronic wounds: A bibliometric analysis from 2013 to 2022. Wound Repair Regen. 31 (5), 597-612 (2013).
- Gould, L., Li, W. W. Defining complete wound closure: Closing the gap in clinical trials and practice. Wound Repair Regen. 27 (3), 201-224 (2019).
- Baron, J. M., Glatz, M., Proksch, E. Optimal support of wound healing: New insights. Dermatology. 236 (6), 593-600 (2020).
- Tiwari, R., Pathak, K. Local drug delivery strategies towards wound healing. Pharmaceutics. 15 (2), 634 (2023).
- Gupta, B., Agarwal, R., Alam, M. S. Hydrogels for wound healing applications. Biomed Hydrogels. , 184-227 (2011).
- Pastar, I., et al. Pre-clinical models for wound-healing studies. Skin Tissue Models Regen Med. , 223-253 (2018).
- Shen, Z., Zhang, C., Wang, T., Xu, J. Advances in functional hydrogel wound dressings: A Review. Polymers (Basel). 15 (9), 2000 (2000).
- Wong, V. W., Sorkin, M., Glotzbach, J. P., Longaker, M. T., Gurtner, G. C. Surgical approaches to create murine models of human wound healing. J Biomed Biotechnol. 2011, 1-8 (2011).
- Peterson, N., Stevenson, H., Sahni, V. Size matters: How accurate is clinical estimation of traumatic wound size. Injury. 45 (1), 232-236 (2014).
- Öien, R. F., Håkansson, A., Hansen, B. U., Bjellerup, M. Measuring the size of ulcers by planimetry: a useful method in the clinical setting. J Wound Care. 11 (5), 165-168 (2002).
- Rogers, L. C., Bevilacqua, N. J., Armstrong, D. G., Andros, G. Digital planimetry results in more accurate wound measurements: a comparison to standard ruler measurements. J Diabetes Sci Technol. 4 (4), 799-802 (2010).
- Shamata, A., Thompson, T. Documentation and analysis of traumatic injuries in clinical forensic medicine involving structured light three-dimensional surface scanning versus photography. J Forensic Leg Med. 58, 93-100 (2018).
- Foltynski, P., Ladyzynski, P., Ciechanowska, A., Migalska-Musial, K., Judzewicz, G., Sabalinska, S. Wound area measurement with digital planimetry: Improved accuracy and precision with calibration based on 2 rulers. PLoS One. 10 (8), e0134622 (2015).
- Frank, S., Kämpfer, H. Excisional wound healing. Wound Healing: Methods Protoc. , 3-15 (2003).
- Dunn, L., et al. Murine model of wound healing. J Vis Exp. (75), e50265 (2013).
- Barakat, M., DiPietro, L. A., Chen, L. Limited Treatment options for diabetic wounds: Barriers to clinical translation despite therapeutic success in murine models. Adv Wound Care (New Rochelle). 10 (8), 436-460 (2021).
- Goh, C. C., et al. Inducing ischemia-reperfusion injury in the mouse ear skin for intravital multiphoton imaging of immune responses. J Vis Exp. (118), e54956 (2016).
- Wang, Y., et al. Autologous fat grafting promotes macrophage infiltration to increase secretion of growth factors and revascularization, thereby treating diabetic rat skin defect. Diabetes, Metab Syndr Obes: Targets and Therapy. 13, 4897-4908 (2020).
- Notodihardjo, S. C., et al. A comparison of the wound healing process after the application of three dermal substitutes with or without basic fibroblast growth factor impregnation in diabetic mice. J Plast Reconstr Aesthet Surg. 73 (8), 1547-1555 (2020).
- Thawer, H. A., Houghton, P. E., Woodbury, M. G., Keast, D., Campbell, K. A comparison of computer-assisted and manual wound size measurement. Ostomy Wound Manage. 48 (10), 46-53 (2002).
- Huang, C. X., et al. Comparison of digital and traditional skin wound closure assessment methods in mice. Lab Anim Res. 39 (1), 25 (2023).
- Subramaniam, S. R., et al. 3D printing: Overview of PLA progress. AIP Conf Proc. , 020015 (2019).
- Oleksy, M., Dynarowicz, K., Aebisher, D. Rapid prototyping technologies: 3D printing applied in medicine. Pharmaceutics. 15 (8), 2169 (2023).
- Gómez de Segura, &. #. 1. 9. 3. ;. I. Métodos de anestesia, analgesia y eutanasia. Métodos de anestesia, analgesia y eutanasia. 14, 97-127 (2016).
- Romero-Fernandez, W., et al. El 1, 2, 3 de la experimentación con animales de laboratorio. Rev Peru Med Exp Salud Publica. 33 (2), 288 (2016).
- Cukjati, D., Reberšek, S., Miklavčič, D. A reliable method of determining wound healing rate. Med Biol Eng Comput. 39 (2), 263-271 (2001).
- Payne, W. G., Bhalla, R., Hill, D. P., Pierpont, Y. N., Robson, M. C. Wound healing trajectories to determine pressure ulcer treatment efficacy. Wound Repair Regen. 11, e1 (2011).
- Cardinal, M., Eisenbud, D. E., Phillips, T., Harding, K. Early healing rates and wound area measurements are reliable predictors of later complete wound closure. Wound Repair Regen. 16 (1), 19-22 (2008).
- Tallman, P. Initial rate of healing predicts complete healing of venous ulcers. Arch Dermatol. 133 (10), 1231 (1997).
- Hopkins, N. F. G., Jamieson, C. W. Antibiotic concentration in the exudate of venous ulcers: The prediction of ulcer healing rate. Br J Surg. 70 (9), 532-534 (2005).
- Robson, M. C. Wound healing trajectories as predictors of effectiveness of therapeutic agents. Arch Surg. 135 (7), 773 (2000).
- Jessup, R. L. What is the best method for assessing the rate of wound healing? A comparison of 3 mathematical formulas. Wounds. 19 (3), 138-147 (2006).
- Landén, N. X., Li, D., Ståhle, M. Transition from inflammation to proliferation: A critical step during wound healing. Cell Mol Life Sci. 73 (20), 3861-3885 (2016).
- Szpaderska, A. M., DiPietro, L. A. Inflammation in surgical wound healing: Friend or foe. Surgery. 137 (5), 571-573 (2005).
- Hamed, E., Al Balah, O. F. A., Refaat, M., Badr, A. M., Afifi, A. Photodynamic therapy mediated by methylene blue-loaded PEG accelerates skin mouse wound healing: An immune response. Lasers in Med Sci. 39 (1), 141 (2024).
- Ibraheem, W. I., et al. Comparison of digital planimetry and ruler methods for the measurement of extraction socket wounds. Medicina (Kaunas). 59 (1), 135 (2023).
- Mayrovitz, H. N., Soontupe, L. B. Wound areas by computerized planimetry of digital images: accuracy and reliability. Wounds. 22 (5), 222-229 (2009).
- Galiano, R. D., Michaels, J., Dobryansky, M., Levine, J. P., Gurtner, G. C. Quantitative and reproducible murine model of excisional wound healing. Wound Repair Regen. 12 (4), 485-495 (2004).
- Price, A., Grey, J. E., Patel, G. K., Cbe, K. G. H. . ABC of wound healing. , 0470658975 (2022).
- Eming, S. A., Krieg, T., Davidson, J. M. Inflammation in wound repair: Molecular and cellular mechanisms. J Invest Dermatol. 127 (3), 514-525 (2007).
- Carmeliet, P. Angiogenesis in life, disease and medicine. Nature. 438 (7070), 932-936 (2005).
- López, N., Cervero, S., Jiménez, M. J., Sanchez, J. F. Cellular characterization of wound exudate as a predictor of wound healing phases. Wounds. 26 (4), 101-107 (2014).
- Liu, N. T., et al. Quantifying the effects of wound healing risk and potential on clinical measurements and outcomes of severely burned patients: A data-driven approach. Burns. 46 (2), 303-313 (2020).
- Han, C., Barakat, M., DiPietro, L. A. Angiogenesis in wound repair: Too much of a good thing. Cold Spring Harb Perspect Biol. 14 (10), a041225 (2022).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved