Method Article
マウスモデルにおける創傷閉鎖速度を評価するためのデジタルプラニメトリー
要約
創傷は世界的な健康課題です。この研究では、創傷測定のばらつきを最小限に抑えるために、デジタル面積測定を利用した標準化されたフォトブースを開発しました。マウスの創傷を14日間にわたってモニタリングしたところ、創傷面積と周囲が最初に増加し、その後徐々に閉鎖されることが明らかになりました。この方法論は、前臨床モデルにおける創傷閉鎖動態の評価に役立つ可能性があります。
要約
慢性創傷は、その高い有病率により、深刻な世界的な健康問題です。効果的な治療戦略は、治癒を大幅に加速し、それによって合併症のリスクを減らし、医療システムの経済的負担を軽減することができます。創傷治癒については数多くの実験的研究が研究されていますが、そのほとんどは定性的観察または定量的な直接測定に依存しています。この研究の目的は、デジタル プラニメトリーを使用した間接創傷測定方法を標準化することであり、デジタル スケーリングとセグメンテーションを組み込んでいます。このアプローチは、正確な創傷評価のための詳細な段階的な方法論の欠如に対処します。フォトドキュメンテーションブースが設計および建設され、コンピューター支援のデジタル面積測定ツールが採用されて、創傷領域、周囲、および創傷の中心からその端までの距離の測定のばらつきが最小限に抑えられました。円形の外傷性創傷(直径5mm)を、雄のCD1マウス(n = 4、10週齢、30〜35g)の肩甲骨レベルの背側正中線上に作成しました。創傷の進展は、照明条件、焦点距離、被写体の位置を制御するカスタムデザインのフォトブースを使用して、14日間フォトドキュメンテーションされました。スケーリングと創傷測定は、ImageJソフトウェアのセグメンテーションを使用して実行し、統計分析ソフトウェアは統計分析ソフトウェアを使用して実行しました。創傷閉鎖の動態は、0日目と2日目の間に創傷のサイズと周囲がわずかに増加し、その後、14日目までに完全に閉鎖するまで徐々に減少することを示しました。フォトドキュメンテーションブースとコンピューター支援デジタル面積測定により、ばらつきを最小限に抑えた定量的測定が可能になりました。結論として、これらのツールは、前臨床モデルにおける創傷閉鎖動態を評価するための信頼性と再現性のある方法を提供します。
概要
外傷性創傷治癒には約 21 日かかり、(1) 止血、(2) 炎症、(3) 増殖、(4) リモデリング1 の 4 つの異なる段階の明確な順序があります。創傷治癒のいずれかの段階が長引くと、慢性創傷の発症につながる可能性があります1。その高い有病率、潜在的な合併症2、および重大な経済的負担のために、彼らは世界的な健康問題と見なされています。
前臨床試験は、包括的な創傷再上皮化3,4,5を促進し、合併症を予防し、治療コストを削減することにより、より迅速な治癒を達成することを目的としています。これらの研究では、生体材料の開発、薬理学的介入、その他の再生医療処置など、さまざまな戦略が評価されています6,7,8,9。
外傷性創傷の研究のために、複数の実験モデルが開発されています。いくつかは、サイズ、炎症指標、肉芽組織の存在、分泌物、かさぶた形成など、巨視的に見える定性的特性に焦点を当てています5。また、面積、周囲長、半径、直径、色、深さ、傷の中心から端までの距離などの定量的データを分析しているものもあります。
この点で、ほとんどのin vivo研究は創傷の半径と深さを直接測定します。しかし、巨視的画像における創傷エッジの手動による描写は、測定にバイアスをもたらす可能性がある10。他の研究では、透明な格子状のプラスチックシートを使用して、創傷の端が以前に描かれている場所で、機械的面積測定を使用しています。どちらの場合も、面積または周囲を取得するには、定規やデジタル平面計などの手動機器が必要です。今日では、コンピュータ支援デジタルプラニメトリーにより、創傷やプラスチックシートの巨視的画像のコンピュータによる分析が可能になりました。その場での操作と巨視的画像の品質には制限がありますが、このツール11,12,13,14は、面積と周囲の測定値の間のばらつきを大幅に低減します。
この提案された方法論は、マウス15、16、17、18、19、20における創傷閉鎖を評価するための既存の技術よりも大きな利点を提供します。写真記録は、創傷閉鎖の動態を評価するための正確で一貫性のあるツールと見なされてきましたが、以前の研究21,22 では、観察者のバイアスや、照明やカメラの位置が一貫していないことによる変動性など、手動による創傷測定の限界が浮き彫りになっています。現在のアプローチでは、特注ブースを通じてイメージング条件を標準化することで、これらの問題に対処し、再現性と精度を向上させています。さらに、コンピュータ化されたデジタルプラニメトリーは、より正確な定量的評価を可能にし、治療介入の評価を強化し、測定誤差を最小限に抑えることができます。これは、手動技術とデジタル技術を比較する他の研究で証明されているように12,22、マウスモデルの創傷閉鎖動態の研究に特に適しており、画像取得条件を厳密に制御することで治療の正確な評価を可能にします。
プロトコル
実験用マウスを含むすべての実験手順は、実験動物の取り扱いと世話に関するメキシコの公式規格(NOM-062-ZOO-1999)に定められた倫理基準と規制に従って実施されました。このプロトコルは、国立原子核研究所(ININ)の実験動物のケアと使用のための内部委員会(CICUAL)によってレビューされ、参照番号CICUAL-01-23で承認されました。この研究では、体重が28〜32 gの10週齢の雄CD1マウス(n = 4)が使用されました。すべての動物は、系統、年齢、性別、および体重の均一性を確保し、実験結果のばらつきを最小限に抑えるように選択されました。試薬および使用した機器の詳細は、材料表に記載されています。
1. 巨視的画像取得のためのフォトブース施工
注:ライセンスされたSolidWorksソフトウェア(バージョン2015)を使用して、外部光源を排除するためのフォトブースを設計しました。40 cm × 40 cm の立方体は、厚さ 1 インチの白いアルミニウム プロファイルを使用して構築されました。キューブは、屋根、側壁、床の 3 つのセクションで構成され、順番に組み立てられました (図 1A)。
- 屋根工事
注意: 屋根は、前端(A)、後端(B)、および側面端(CおよびD)の向きに地域化されています(図1B)。- 屋根の側端(CおよびD)の内側領域に、幅1.5 cm、厚さ2.51 cm、長さ34.9 cmのスロット付きアルミニウムプロファイル(ガラスを保持するように設計されています)を固定します(図1B)。
- 長さ34.5cm×幅13cmの長方形のアルミニウムプレートを2枚、中央にポリエチレンを敷き詰め、各ルーフプロファイル( 図1Cのプレート1と2)の溝に置き、両方のプロファイルの溝をスライドできるようにします。
- 色温度範囲が20〜9000 K(図1C)の20 cm RGB LEDチューブライトを、両面テープを使用してパネル1の下側の端に45°の角度で取り付けます。
- 屋根パネル1および2に、カメラレンズを取り付けることができるように、中央に直径7.82cmの円形の切り欠きが付いた32 cm x 12 cmの長方形のフォームボードパネルを取り付けます(図1C)。
- 床の構造
- 40 cm x 40 cm四方の白いフォームボードを床面積のプロファイルの上に置きます。フォームボードの各角から一辺の長さが2.54cmの正方形を切り取ります(図1E)。
- 側壁の建設
- 40 cm x 40 cmの四角形のフォームボードパネル4枚をカットします。
- 側面CとDに2つのパネルをシリコンで接着して、左右の側面を形成します(図1F)。
- フックとループファスナーストリップをアルミニウムプロファイルAとBに取り付けて、内部の写真ブース要素を簡単に操作できます。また、一列に並んだ接着剤の端から1cmのところに、片側の発泡スチロール段ボールの四角い部分に取り付け、前面と背面に貼ります(図1F)。
- 基準ベースの構築
注:麻酔中および創傷の進展の文書化全体を通じてマウスを腹臥位に維持するためには、参照ベースが必要でした。3Dコンポーネントは、PLA材料と3Dプリンタ23,24を使用した熱溶解積層法(FDM)技術を使用して設計および製造されました。- 幅、長さ、高さが2 cmのベースでマスクを3Dプリントし、事前にカットされた40 cm x 28 cmの白いフォームボードの長方形の端から11.5 cmの位置に配置して、マウスを吸入麻酔下に維持します(図1D、赤色)。
- 長方形のプラットフォーム(長さ9 cm、幅5 cm、高さ2.5 cm)を3Dプリントし、4つの押し出し領域を使用して、画像取得中にマウスの背側を位置合わせします。これらの領域は、腹臥位を維持するために頭、手足、腹部を支えていました。このプラットフォームをリファレンスベースの中心に接着します(図1D、緑色)。
- 定規ブロック(幅2 cm、長さ8 cm、高さ2.5 cm)を3Dプリントし、マウスベースの左側から1 cmに固定して、デジタル画像処理に必要な測定基準要素を配置します(図1D、青色)。
- 15 cmのステンレス鋼の目盛り付き定規を定規ブロックに取り付け、画像スケーリングのためにキャビン内にリファレンスベース全体を取り付けます(図1D)。
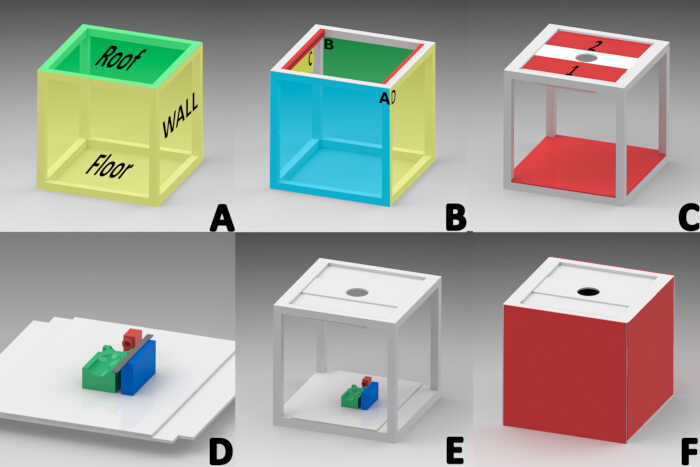
図1:巨視的画像取得キャビネットの構造図(A)キャビンのセクション(屋根、側壁、床)。(イ)屋根を形成するプロファイルの向き。フロント(A)、リア(B)、およびサイド(プロファイルの内側)の赤い「C、D」。(C)屋根パネル1、2、LEDライトチューブの取り付け、カメラのレンズプレート、床面の取り付け。(D)麻酔マスク(RED)、マウスプラットフォーム(GREEN)、および測定定規(BLUE)を基準ベースに配置するための長方形のプラットフォームのインストール。(E) 参照ベースの最終的な位置。(F)側面、前面、および背面の壁の設置。この図の拡大版を表示するには、ここをクリックしてください。
2. 動物の飼育
- 施設の生命倫理委員会から動物実験の許可を得てください。10週齢、体重28〜32gのCD1マウス(n = 4)を使用します。
- 標準的な条件下でマウスを飼育します:温度を21°C、明暗サイクルを12/12時間、湿度45%に維持し、フォトドキュメンテーションセッション中を除き、水と餌に 自由 にアクセスできるようにします。
3.外傷性創傷の発生
- 手順の8時間前にマウスを絶食します。マウスを腹腔内ナトリウムペントバルビタールで 65 mg/kg25 で麻酔します (施設で承認されたプロトコルに従います)。
- 指間ピンチ時の離脱反射の欠如をチェックして、麻酔の深さを確認します。麻酔中の乾燥を防ぐために、眼科用軟膏を目に塗ります。.手術中および回復中は、マウスを37°Cの安定した温度に保ちます(20分)。
- マウスを腹側褥瘡の位置に置き、外科用ブレードを使用して頸部から2.5 cm x 3 cmの領域を尾側に脱毛します。裂傷を避けるために皮膚を伸ばします。ポビドンヨードと滅菌水すすぎを交互に使用して、無菌と消毒を行います。
- 滅菌済みの5mm生検パンチを使用し、円を描くように圧力をかけて、肩甲骨レベルで真皮表皮切開を行います。鋸歯状の鉗子でフラップを取り外し、虹彩先端のはさみで切ります(図2A)。
- 創傷に出血点がある場合は、電気焼灼装置を使用して電気ショックを適用して止血を達成します。
- ジュエラー鉗子を使用して、直径1cmの円形の皮膚フィルムを傷口に貼り付け、汚染と収縮を防ぎます。
- すべてのサバイバル手術は無菌条件下で行ってください。ポビドンヨードなどの消毒剤で手術部位を準備します。滅菌手袋とマスクを着用し、滅菌器具を使用し、非滅菌表面との接触を最小限に抑えることにより、手順全体を通して滅菌を維持します。
- 手術後、マウスを24°Cの個々のケージに入れ、胸骨の位置を維持するのに十分な意識を取り戻すまでマウスを監視します。手術中および手術後の体温管理を確認し、外部熱源を使用して低体温症を予防します。
- ケトロラックを飲料水で5 mg / kg26に希釈することにより、4日目まで鎮痛剤を投与します。.
- 14日後、健康なげっ歯類の創傷が通常治癒の進行段階に達したら、国際基準に従ってCO2チャンバーでマウスをO2置換して安楽死させます。これは、研究のエンドポイントを示しています。
4. 巨視的画像取得
- 創傷の画像を 14 日間連続して毎日キャプチャし、創傷閉鎖の連続的な動態を監視します。セミプロ用またはプロ用のカメラを使用してください。フォトブースの屋根の円形の開口部にレンズを配置します。
注:実験条件に基づいて、必要に応じてスケジュールを調整してください。 - RGB LEDライトチューブを相関色温度(CCT)モードで使用し、照明に9000Kと100%の明るさに設定します。
- リファレンスベースをフォトブースの床の中央に配置します。
- マウスを吸入麻酔チャンバーに3分間置きます(図2B)。
- 麻酔を誘発した後、マウスをマウスプラットフォーム上で腹臥位に置きます。セボフルラン麻酔マスク内に鼻を固定し、1.5 L / minの酸素流量で5%セボフルランを送達します(図2C)。
- 画像を撮影する前に、ジュエラー鉗子を使用して傷口から皮膚フィルムをはがし、リファレンスベースをカメラのレンズに合わせます。
- フォトブースの前面壁を設置し、絞りf / 3.2、露出時間1/200秒、ISO感度80、焦点距離4mmの設定で巨視的な画像を撮影します。
- ジュエラー鉗子を使用して、麻酔マスクを取り外す前に、直径1cmの皮膚フィルムを傷口に貼り付けます。マウスを個々のケージに移し、運動が回復するまで観察します。
5. 画像処理
- 巨視的イメージのバックアップ・コピーを生成します。ImageJソフトウェアを使用して画像を処理します。
- ImageJ でバックアップ イメージを開くには、イメージ内の [ファイル] > [開く] > [検索 ] の順にクリックします。
- 参照して画像を拡大縮小する:画像を最大化し、直線ツールを選択し、+キーを使用してマウスの横にある定規を拡大し、定規画像に10 mmの直線を描き、[分析]>>[スケールの設定]に移動し、[既知の距離]に「10」を入力し>長さの単位をmmに設定し、[OK]をクリックします。これにより、巨視的な画像のピクセルと距離の比率が決まります (図 2D)。
- 創傷領域を画像から分離する:長方形ツールを使用して、創傷の周囲の領域を選択します(w = 150、h = 150)。XとYの値を記録し、 長方形を右クリックして>Duplicate>件名に名前を付け>Enterキーを押します。新しい画像で、+を2回押してズームインします(図2E)。
- 次のパスに従ってトリミングした画像を保存します: File > Save As > Tiff > 名前を入力して Save>。
- セグメンテーション中の変更を避けるために、切り抜いた画像の複製を作成する: 切り抜いた>画像を右クリックして [複製] > 最後に「Segmentation」を追加して名前を付けます。次に、Enterキーを押します。新しい画像で、+ を 2 回押してズームインします。
- イメージをカラーチャネルに分割するには、 イメージ>タイプ>RGBスタックのパスに従います。赤チャンネルの画像(1/3赤)で、[ 複製]を右クリックし、[複製]ウィンドウで [OK ]を押します。
- 赤チャンネルの画像をセグメント化します。赤チャンネルの画像をクリックし、[ Image > Adjust > Threshold]をクリックします。次に、[ Default (デフォルト)] > [Apply (適用 )] を選択します (図 2F )。
- 関心領域(ROI)を補正して、完全な創傷カバレッジを確保し、セグメンテーションの歪みを回避します。
注意: 傷口の周囲の領域がセグメンテーションに含まれていない場合は、 穴を埋めるプロセス>バイナリ>に進みます。傷口の外側の黒い点を取り除くには、 Process > Binary > Erodeに進みます。[Erode]コマンドによって傷のサイズが小さくなる場合は、[Process > Binary > Dilate]を使用して傷のサイズを矯正します。 - ROIの周囲をマークします: 「選択範囲の編集」>「選択範囲の作成」>。ROIは黄色で囲まれます。[ Edit > Selection] > [Add to Manager ] (図 2G) に従って、ROI Manager に追加します。
- セグメンテーションの検証: ROI マネージャー ウィンドウを開き、レビューする ROI を選択します: [その他] > [翻訳] を選択します。手順4で記録したX値とY値を入力し、[ OK]を押します。
- 元の画像を最大化し、ROI マネージャーで ROI を選択します。矢印キーを使用して、ROIが傷口と揃うまでROIを調整します(図2H)。ROIが創傷と一致する場合、セグメンテーションは成功しています。それ以外の場合は、手順 2 から繰り返します。
- セグメンテーションが確認されたら、創傷測定値を取得します: 分析>測定。結果テーブルには、面積、周囲長、および X/Y 位置の値が表示されます。これらの値をSPSSソフトウェアにコピーして、文書化と統計解析を行います(図2I)。

図2:デジタルプラニメトリーおよびセグメンテーション技術を使用した創傷測定のワークフロー(A)滅菌5mm生検パンチを使用した真皮表皮切開。(B)マウスを吸入麻酔チャンバーに3分間置く(C)麻酔をかけたマウスをフォトブースに配置し、その鼻をセボフルランマスク内に固定することにより、写真記録。(D)取得した画像をImageJで開き、定規を基準にして拡大縮小します。(E)長方形ツールを使用して創傷領域を抽出します。(F)画像をRGBチャンネルに分離し、赤チャンネルを処理します。(G)関心領域(ROI)の概要と管理。(H)ROIを創傷と一致させることにより、セグメンテーションを検証します。(I)創傷パラメータを測定し、統計分析のために結果を記録する。この図の拡大版を表示するには、ここをクリックしてください。
6.手続き後の安楽死
注:この研究は14日後に終了し、その時点で健康なげっ歯類の創傷は通常、治癒の進行段階に達します。この段階で、マウスは、確立された制度的に承認された安楽死手順に従って人道的に安楽死させられました。
- 機器を準備します。安楽死チャンバーが清潔で乾燥しており、過密にならずにマウスを収容するための適切なサイズであることを確認してください。チャンバーをフローレギュレーターで医療グレードのCO2 供給に接続します。
- ストレスを最小限に抑えるために、マウスをチャンバーに優しく移します。彼らが外部からの妨害を最小限に抑えた穏やかな環境にいることを確認してください。
- 動物の安楽死に関するAVMAガイドラインで推奨されているように、CO2の流量をチャンバーの容積の1分あたりの20%〜30%に設定します。マウスに苦痛や不快感を誘発しないように、CO2濃度を徐々に増やします。
- 処置中はマウスを間近で観察してください。活動や呼吸の減少、その後の無呼吸や心停止など、意識が徐々に失われる兆候を探します。
- マウスが呼吸しなくなり、動きの兆候が見られなくなったら、死亡を確認します。重要な機能が完全に停止することを確認するために、さらに1〜2分待ちます。反射(角膜反射など)と心臓の活動の欠如を確認して、死亡を確認します。
- 死骸を指定された生物学的有害廃棄物容器に移します。動物の遺体を安全に処分するための制度的プロトコルと国のガイドラインに従ってください。
- 安楽死させた動物の数、日付、および関連する観察結果を記録して、倫理的および制度的基準の遵守を確保します。
結果
ImageJソフトウェアで画像をスケーリングした後、創傷の平均周囲長(表1)と面積(表2)、およびそれぞれの標準偏差をデジタルセグメンテーションによって取得しました。これらの値は、0 日目から 14 日目 (D0-D14) まで記録されました。
| 日 | 周囲長(mm) |
| 0 | 22.75±0.8900 |
| 1 | 21.65±0.0200 |
| 2 | 25.25±0.5900 |
| 3 | 24.37 ± 0.1600 |
| 4 | 24.61±1.2600 |
| 5 | 23.98±0.5500 |
| 6 | 24.59±0.4900 |
| 7 | 22.05±0.2600 |
| 8 | 18.64±0.6200 |
| 9 | 15.29 ± 0.1800 |
| 10 | 14.51±0.3800 |
| 11 | 13.23 ± 0.1000 |
| 12 | 13.12 ± 0.3600 |
| 13 | 7.49 ± 0.2200 |
| 14 | 5.78 ± 0.1200 |
表1:創傷の周囲測定(0〜14日目)。 値は、毎日 (D0-14) の創傷周囲測定値 (mm) を平均±標準偏差 (SD) として表します。
| 日 | 面積 (mm2) |
| 0 | 27.56 ± 0.1500 |
| 1 | 30.64 ± 0.3100 |
| 2 | 38.05±0.6100 |
| 3 | 37.85 ± 0.2500 |
| 4 | 36.30±0.6000 |
| 5 | 32.93 ± 0.3600 |
| 6 | 29.83±0.5700 |
| 7 | 23.77 ± 0.3500 |
| 8 | 15.43 ± 0.1800 |
| 9 | 12.75 ± 0.1400 |
| 10 | 10.72 ± 0.3200 |
| 11 | 10.69±0.2600 |
| 12 | 9.55±0.3200 |
| 13 | 3.03±0.1400 |
| 14 | 1.82±0.0900 |
表2:創傷の面積測定(0〜14日目)。 値は、毎日 (D0-14) の創傷面積の測定値 (mm2) を平均±標準偏差 (SD) として示しています。
創傷面積と周囲長は当初、0日目から3日目にかけて増加し、炎症反応により創傷のサイズが元の測定値を超えて一時的に拡大したことを示しています。しかし、3日目から6日目にかけて、面積と周囲の両方が徐々に減少し、7日目までに大幅な減少が観察されました。この時点で、傷は元のサイズよりも小さく、治癒が進んでいることを反映していました。
創傷閉鎖の動力学を調査するために、面積データを使用して、ロブソンの式27,28 (式 1) で創傷治癒の割合を計算しました。

ここで、%Δ A は、評価日 (Area Day x) における創傷領域の減少率に対応します。これは、ゼロ日目 (AreaDay0) の初期領域に対するものです。
| 日 | 削減率 | ||
| 0 | 0 | ± | 0.5300 |
| 1 | -11.2 | ± | 1.1500 |
| 2 | -38 | ± | 1.8900 |
| 3 | -37.3 | ± | 1.7200 |
| 4 | -31.7 | ± | 1.7700 |
| 5 | -19.5 | ± | 1.9800 |
| 6 | -8.21 | ± | 2.1900 |
| 7 | 13.77 | ± | 2.4000 |
| 8 | 44.03 | ± | 1.8900 |
| 9 | 53.76 | ± | 1.6000 |
| 10 | 61.09 | ± | 3.1800 |
| 11 | 61.2 | ± | 3.8400 |
| 12 | 65.37 | ± | 4.1000 |
| 13 | 89.00 | ± | 5.5800 |
| 14 | 93.4 | ± | 5.0500 |
表3:創傷閉鎖率(ロブソン式)。 値は、ロブソン方程式 (式 1) によって平均±標準偏差 (SD) として計算された、創傷面積の縮小の平均パーセンテージを表します。
この式から得られるパーセンテージが正の場合(表3)、それらは創傷閉鎖を示し、負の値は創傷サイズの増加を示します(図3A)。創傷エッジから中心、面積、および周囲のデータまでの収縮距離を計算するために、Gilmam の式 29,30,31 (式 2) で使用しました。

ここで、Dは縁から創傷の中心に向かう平均線形前進距離(mm単位)、A0は治療開始時(0日目)の創傷面積、A.iは測定時の創傷面積、P0は開始時(0日目)の創傷周囲長、 Pi 測定時の周囲長。
| 日 | 後退距離(mm) |
| 0 | 0.00±0.0425 |
| 1 | -0.139 ± 0.0165 |
| 2 | -0.437 ± 0.0301 |
| 3 | △0.466 ±0.0264 |
| 4 | -0.369 ± 0.0267 |
| 5 | -0.230 ± 0.0298 |
| 6 | △0.096 ±0.0279 |
| 7 | 0.169 ± 0.0292 |
| 8 | 0.586 ±0.0236 |
| 9 | 0.779±0.0147 |
| 10 | 0.904 ± 0.0238 |
| 11 | 0.938±0.0296 |
| 12 | 1.005±0.0310 |
| 13 | 1.622 ± 0.0424 |
| 14 | 1.804 ± 0.0257 |
表4:創傷エッジの収縮(ギルマムの式)。 値は、創傷の端から中心までの平均収縮率 (mm) を時系列で示し、平均±標準偏差 (SD) で表されます。
創傷閉鎖率を一致させると、 式 2 の正の値は、創傷エッジが互いに接近していることを示し、収縮を示しています (表 4)。逆に、負の値はこの距離の増加を反映しています(図3B)。最初に、0日目に、創傷径は5mmを測定し、端から中心まで0.0425mm±2.5mmになりました。この初期距離は、1 日の平均創傷収縮率を計算するためのベースラインとして機能しました。次に、計算された収縮率を初期距離から差し引いて、 表5に示す合成創傷閉鎖率を生成しました。
| 日 | 端から中心までの距離(mm) |
| 0 | 2.5 ± 0.0425 |
| 1 | 2.63 ± 0.0165 |
| 2 | 2.9369 ± 0.0301 |
| 3 | 2.9368 ±0.0264 |
| 4 | 2.8689 ± 0.0267 |
| 5 | 2.7298 ± 0.0298 |
| 6 | 2.5956、±0.0279 |
| 7 | 2.3306 ± 0.0292 |
| 8 | 1.9136±0.0236 |
| 9 | 1.7210±0.0147 |
| 10 | 1.5962 ± 0.0238 |
| 11 | 1.5624±0.0296 |
| 12 | 1.4955±0.0310 |
| 13 | 0.8774 ± 0.0423 |
| 14 | 0.6954±0.0257 |
表5:創傷閉鎖率(mm)。 値は、時間の経過に伴う創傷の収縮を示します。これは、初期距離 (2.5 mm ± 0.0425) から各時点における創傷エッジからの距離を平均±標準偏差 (SD) として差し引くことによって得られます。
閉鎖の割合は、糖尿病性神経障害潰瘍閉鎖の逐次測定で一般的に使用されるロブソンの式32 (図3A)を使用して計算され、ギルマンの式33 (図3B)は創傷治癒の進行を監視するために一般的に使用されます。
0日目に、最初の外科的創傷(直径5mm、100%として表される)は、おそらく創傷4,34の周りの初期炎症過程によるもので、2日目までに138.04%に有意な増加を示しました。この期間中、好中球とマクロファージは移動し、サイトカインと成長因子を放出します28。炎症期は通常1〜3日続きます35。それでも、広範囲にわたる怪我、追加の感染症、既存の状態の場合、または修復メカニズムが遅れている高齢者の場合、数週間長くなる可能性があります。
これらの結果は、フォトブース、デジタルセグメンテーション、およびデジタルプラニメトリーの使用を組み合わせて、創傷閉鎖速度の動的変化を正確に捉えるこの方法論の有効性を強調しています。このモデルでは、炎症が創傷縁の収縮を引き起こした可能性が高く、創傷面積と周囲が最初に増加しました。さらに、9000 K、100%の強度でCCTモードのRGB LEDライトチューブを使用し、マウスから18 cmに設定された理想的なカメラ距離を使用して、巨視的イメージングに最適な照明条件を達成できることを特定しました。
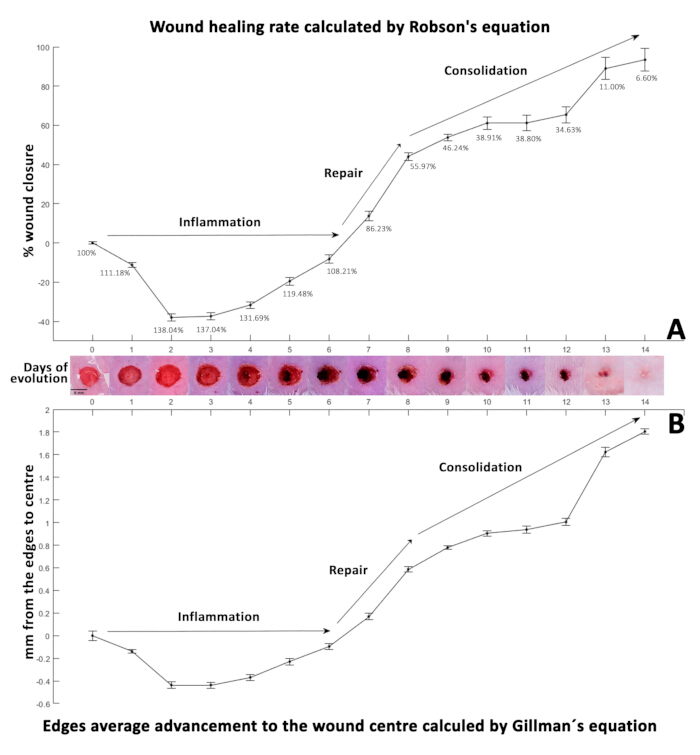
図3: 創傷治癒速度論。 (A)ロブソン方程式を使用して計算された創傷閉鎖の割合。(B)ギルマン方程式によって決定される14日間の進化期間にわたる治癒率を表示します。両方の方程式の負の値は創傷サイズの増加を示し、正の値は創傷閉鎖に関連しています。どちらのパネルも治癒速度を表しており、標準偏差(SD)はエラーバーで示され、14日間の創傷の進展を示す写真(D0-14)が掲載されています。 この図の拡大版を表示するには、ここをクリックしてください。
図3A は、ロブソン方程式を用いて計算された創傷閉鎖の割合を示し、 図3B は、ギルマン方程式33によって決定される14日間の進化期間にわたる治癒率を示している。
ディスカッション
前臨床モデルでは、前臨床モデルにおける外傷性創傷の進化を定量的に分析することは、創傷の大きさ、局所的な炎症反応34、位置、および/または操作などの要因による課題に直面します。これらの測定には、直接手動36および間接デジタル11,16,37,38の面積測定法が存在します。観察者のバイアスや照明条件のばらつきに悩まされることが多い手動の方法を使用した研究とは対照的に、私たちの研究では標準化されたデジタル面積測定を採用しました。手動測定を使用した研究では、創傷サイズの変動が大きいと報告されています10,38、一方、私たちの技術は時間の経過とともにより大きな一貫性を示しました。さらに、他のデジタル方法11,16,37,38と比較して、この制御された照明および位置決めシステムは、より正確な測定をもたらした。
創傷面積と周囲を測定するための詳細な段階的な方法論がなかったため、デジタル面積測定、スケーリング、およびセグメンテーションを使用した標準化された間接測定方法が開発されました。そのために、フォトドキュメンテーションブースが設計・建設されました。照明条件、被写体の位置、カメラの距離を制御することで、巨視的な画像取得の一貫性を確保し、創傷測定のバイアスを最小限に抑えました。げっ歯類の研究では、外科的処置中に病変の周囲にシリコンリングを使用したことに起因する、ゼロ日目からの継続的な創傷閉鎖が報告されています39,16、炎症中の創傷の収縮と拡張を防ぐ可能性があります。逆に、基本的な線維芽細胞成長因子(bFGF)を持つ人工真皮製品を評価した別の研究では、創傷面積と周囲の増加が報告されました20。
創傷治癒には、止血(1-24時間)40、炎症(1-3日)41、増殖(3-21日)34、および硬化(21-60日)4の4つの連続した段階が含まれますが、これらは重複する可能性があります4,34。この研究では、炎症は3日目から6日目まで主観的に進行し、増殖期に移行しました。
この移行期は、好中球を減少させ、マクロファージ32を増加させることにより炎症反応を減少させ、血管新生42、コラーゲン合成、および線維芽細胞の活性化を促進するため、治癒にとって重要である。線維芽細胞は創傷部位に移動し、細胞外マトリックス合成を開始し、フィブロネクチン34、コラーゲン、プロテオグリカン、ヒアルロン酸、およびグリコサミノグリカンを沈着させ、これは足場とその後の細胞接着に不可欠です43。2 日目から 6 日目にかけて、このモデルは創傷サイズが 138.04% から 108.21% に縮小し、炎症の減少を示しました。
最初の創傷サイズの増加にもかかわらず、この傾向は7日目から逆転し、86.23%に達し、14日目まで徐々に治癒しました。これは、この研究で観察されたように、増殖期44および血管新生45の開始に対応し、創傷を収縮させる肉芽組織を形成する可能性が高い。同様の連続的な閉鎖パターンがげっ歯類の研究でも報告されており6,19、臨床的介入に関係なく創傷が治癒し、閉鎖速度に違いがあることを示しています。したがって、このモデルは参照コントロールとして機能する可能性があります。
創傷閉鎖は9日目から14日目にかけて遅くなり、最終的には6.60%に達しました。特に、4日目から傷口の上にかさぶたが形成され、10日目までに端から剥がれ、その下の瘢痕組織の小さな領域が現れ、14日目までに完全に剥がれ落ちました。
巨視的に閉じた創傷は、有意な微視的差異を示す可能性があり、細胞の形態と創傷の進化を観察するために詳細な組織学的分析が必要であることに注意することが重要です。この方法論により、ばらつきを最小限に抑えた正確な面積と周囲のデータが得られ、創傷閉鎖の動力学の分析に数式を使用することが容易になります。ギルマンの33 (図3B)とロブソンの32 (図3A)の方程式を使用して計算された結果で観察された数学的振る舞いは一貫していました。
プロトコルの重要なステップ
創傷は通常、外部環境への血漿浸出を示しますが、この研究では、創傷修復メカニズムにも影響を与える可能性のある特定の要因を制御しました。以前の試験では、過度の出血が創傷の形状とかさぶたのサイズを変化させるため、適切な止血が創傷と真皮フィルムとの間の相互作用を促進することが観察されました。
変更とトラブルシューティング
提案された方法論により、より大きく、より深い傷を持つマウスモデルを生成することができます。ただし、創傷位置を変更した場合は、基準ベースを再配置して、巨視的画像の中央に留まるようにする必要があります。さらに、フォトドキュメンテーションの日数とモデルの期間を調整できます。
制限
この方法の限界には、小型で軽量なげっ歯類用に設計されたフォトドキュメンテーションブースのサイズが含まれます。ただし、マウスベースに変更を加えることで、より大きなげっ歯類に適応させることができます。さらに、この方法は現在、セグメンテーションによる伸展性外傷性創傷の測定は行われていませんが、さらに変更を加えることで適用できます。
既存/代替方法に対する本手法の重要性
創傷測定のための様々な方法論は、デジタルプラニメトリー11,12,13,14を採用しています。しかし、多くの場合、照明条件、カメラと傷口の距離、または創傷の進展の日にわたるフォトドキュメンテーション位置の再現性は報告されません。これが、現在の研究が重要である点です。
このモデルでは、RGBランプ構成は、9000K、輝度100%の相関色温度(CCT)モードで最適な照明条件を提供します。マウスベースとカメラレンズの間の理想的な距離は18cmです。これらの条件により、RGBスタックの赤いチャネルが、以前に報告されていない肉芽組織のエッジを捕捉せずに創傷領域をセグメント化することを発見しました。
最後に、一部の方法論では、ステレオスコープのような機器に取り付けられたカメラ16 を使用するが、これはすべての研究室がアクセスできるわけではないことを考慮すると、このフォトドキュメンテーションブースは、その後の分析のために高品質の画像を取得する機会を提供する。
特定の研究分野における本分析法の重要性と応用可能性
この方法論の潜在的な用途と重要性は、創傷測定のバイアスを排除し、治癒過程を追跡するための信頼性の高いデータを生成する能力にあります。さらに、マウス位置の再現性により、関心領域を自動的に分析して描写するImageJマクロを将来作成することができます。また、セミプロ用やプロ用のカメラで高解像度の画像を撮影できない場合は、携帯電話のカメラで写真を撮るようにブースを改造し、アプリを使って自動色補正なしで写真を取得することができます。
開示事項
著者らは、この研究に関連する利益相反がないことを宣言します。
謝辞
著者らは、助成金を通じてConsejo Nacional de Humanidades, Ciencias y Tecnologías (CONAHCyT, CVU: 933600)、およびLaboratorio Nacional de Investigación y Desarrollo de Radiofármacos del Instituto Nacional de Investigaciones Nucleares (LANIDER-ININ)の支援に感謝します。さらに、図2は、BioRender.com/p67z056 で入手可能なBioRenderソフトウェア(2020)の支援を受けて作成されました。
資料
| Name | Company | Catalog Number | Comments |
| 5 mm Biopsy Punch | MILTEX, USA | 33-35 | To mark the wound edges |
| Aluminum with polyethylene core | Alucobond,USA | Bright Silver 119 | For the construction of the macroscopic Image Acquisition Booth |
| Camera Lens | Sony, Japan | SEL2470Z | To focus the images to photograph |
| Electrocautery | Bonart, USA | ART-E1 | To eliminates bleeding points in the wound if present. |
| Hook and loop fastener strips | VELCRO | ||
| IBM SPSS Statistics Version 22 | IBM Corporation, USA | https://www.ibm.com/analytics/spss-statistics | Used for statistical analysis of wound measurements, including area and perimeter data. |
| ImageJ Version 1.53t | National Institutes of Health, USA | https://imagej.nih.gov/ij/ | Used for processing macroscopic images, including scaling, segmentation, and measurement of wound parameters. |
| Ketorolac | SIEGFRIED RHEIN, Mexico | 493977 | For postoperative pain management |
| Miltex Iris Scissors, 4-1/8" Curved | MILTEX, USA | V95-306 | To cut the wound flap generated with the biopsy punch |
| RGB LED Light Tube | ANDOER, China | B09F8RLMSY | To illuminate the Macroscopic Image Acquisition Booth |
| Semi profesional camera | Sony, Japan | DSC-HX300 | To take the photos |
| Serrated Forceps | MILTEX, USA | V96-118 | To hold the flap during the cut |
| Sevoflurane | Baxter, USA | AMX2L9117PR | For inhaled anaesthesia |
| Sodium Pentobarbital | Aranda, Mexico | 734.448.001.212 | For intraperitoneal anaesthesia |
| SolidWorks Version 2015 | Dassault Systèmes, France | https://www.solidworks.com/ | Used to design and create 3D models for constructing accessories for the photodocumentation booth. |
| Surgical blades | HERGOM, Mexico | H10 | To shave the hair in the area where the wound will be created |
| Transparent Adhesive Dressing | 3M, USA | F51CA07 | To cover the traumatic wound |
参考文献
- Martinengo, L., et al. Prevalence of chronic wounds in the general population: systematic review and meta-analysis of observational studies. Ann Epidemiol. 29, 8-15 (2019).
- Chen, X., Shi, X., Xiao, H., Xiao, D., Xu, X. Research hotspot and trend of chronic wounds: A bibliometric analysis from 2013 to 2022. Wound Repair Regen. 31 (5), 597-612 (2013).
- Gould, L., Li, W. W. Defining complete wound closure: Closing the gap in clinical trials and practice. Wound Repair Regen. 27 (3), 201-224 (2019).
- Baron, J. M., Glatz, M., Proksch, E. Optimal support of wound healing: New insights. Dermatology. 236 (6), 593-600 (2020).
- Tiwari, R., Pathak, K. Local drug delivery strategies towards wound healing. Pharmaceutics. 15 (2), 634 (2023).
- Gupta, B., Agarwal, R., Alam, M. S. Hydrogels for wound healing applications. Biomed Hydrogels. , 184-227 (2011).
- Pastar, I., et al. Pre-clinical models for wound-healing studies. Skin Tissue Models Regen Med. , 223-253 (2018).
- Shen, Z., Zhang, C., Wang, T., Xu, J. Advances in functional hydrogel wound dressings: A Review. Polymers (Basel). 15 (9), 2000 (2000).
- Wong, V. W., Sorkin, M., Glotzbach, J. P., Longaker, M. T., Gurtner, G. C. Surgical approaches to create murine models of human wound healing. J Biomed Biotechnol. 2011, 1-8 (2011).
- Peterson, N., Stevenson, H., Sahni, V. Size matters: How accurate is clinical estimation of traumatic wound size. Injury. 45 (1), 232-236 (2014).
- Öien, R. F., Håkansson, A., Hansen, B. U., Bjellerup, M. Measuring the size of ulcers by planimetry: a useful method in the clinical setting. J Wound Care. 11 (5), 165-168 (2002).
- Rogers, L. C., Bevilacqua, N. J., Armstrong, D. G., Andros, G. Digital planimetry results in more accurate wound measurements: a comparison to standard ruler measurements. J Diabetes Sci Technol. 4 (4), 799-802 (2010).
- Shamata, A., Thompson, T. Documentation and analysis of traumatic injuries in clinical forensic medicine involving structured light three-dimensional surface scanning versus photography. J Forensic Leg Med. 58, 93-100 (2018).
- Foltynski, P., Ladyzynski, P., Ciechanowska, A., Migalska-Musial, K., Judzewicz, G., Sabalinska, S. Wound area measurement with digital planimetry: Improved accuracy and precision with calibration based on 2 rulers. PLoS One. 10 (8), e0134622 (2015).
- Frank, S., Kämpfer, H. Excisional wound healing. Wound Healing: Methods Protoc. , 3-15 (2003).
- Dunn, L., et al. Murine model of wound healing. J Vis Exp. (75), e50265 (2013).
- Barakat, M., DiPietro, L. A., Chen, L. Limited Treatment options for diabetic wounds: Barriers to clinical translation despite therapeutic success in murine models. Adv Wound Care (New Rochelle). 10 (8), 436-460 (2021).
- Goh, C. C., et al. Inducing ischemia-reperfusion injury in the mouse ear skin for intravital multiphoton imaging of immune responses. J Vis Exp. (118), e54956 (2016).
- Wang, Y., et al. Autologous fat grafting promotes macrophage infiltration to increase secretion of growth factors and revascularization, thereby treating diabetic rat skin defect. Diabetes, Metab Syndr Obes: Targets and Therapy. 13, 4897-4908 (2020).
- Notodihardjo, S. C., et al. A comparison of the wound healing process after the application of three dermal substitutes with or without basic fibroblast growth factor impregnation in diabetic mice. J Plast Reconstr Aesthet Surg. 73 (8), 1547-1555 (2020).
- Thawer, H. A., Houghton, P. E., Woodbury, M. G., Keast, D., Campbell, K. A comparison of computer-assisted and manual wound size measurement. Ostomy Wound Manage. 48 (10), 46-53 (2002).
- Huang, C. X., et al. Comparison of digital and traditional skin wound closure assessment methods in mice. Lab Anim Res. 39 (1), 25 (2023).
- Subramaniam, S. R., et al. 3D printing: Overview of PLA progress. AIP Conf Proc. , 020015 (2019).
- Oleksy, M., Dynarowicz, K., Aebisher, D. Rapid prototyping technologies: 3D printing applied in medicine. Pharmaceutics. 15 (8), 2169 (2023).
- Gómez de Segura, &. #. 1. 9. 3. ;. I. Métodos de anestesia, analgesia y eutanasia. Métodos de anestesia, analgesia y eutanasia. 14, 97-127 (2016).
- Romero-Fernandez, W., et al. El 1, 2, 3 de la experimentación con animales de laboratorio. Rev Peru Med Exp Salud Publica. 33 (2), 288 (2016).
- Cukjati, D., Reberšek, S., Miklavčič, D. A reliable method of determining wound healing rate. Med Biol Eng Comput. 39 (2), 263-271 (2001).
- Payne, W. G., Bhalla, R., Hill, D. P., Pierpont, Y. N., Robson, M. C. Wound healing trajectories to determine pressure ulcer treatment efficacy. Wound Repair Regen. 11, e1 (2011).
- Cardinal, M., Eisenbud, D. E., Phillips, T., Harding, K. Early healing rates and wound area measurements are reliable predictors of later complete wound closure. Wound Repair Regen. 16 (1), 19-22 (2008).
- Tallman, P. Initial rate of healing predicts complete healing of venous ulcers. Arch Dermatol. 133 (10), 1231 (1997).
- Hopkins, N. F. G., Jamieson, C. W. Antibiotic concentration in the exudate of venous ulcers: The prediction of ulcer healing rate. Br J Surg. 70 (9), 532-534 (2005).
- Robson, M. C. Wound healing trajectories as predictors of effectiveness of therapeutic agents. Arch Surg. 135 (7), 773 (2000).
- Jessup, R. L. What is the best method for assessing the rate of wound healing? A comparison of 3 mathematical formulas. Wounds. 19 (3), 138-147 (2006).
- Landén, N. X., Li, D., Ståhle, M. Transition from inflammation to proliferation: A critical step during wound healing. Cell Mol Life Sci. 73 (20), 3861-3885 (2016).
- Szpaderska, A. M., DiPietro, L. A. Inflammation in surgical wound healing: Friend or foe. Surgery. 137 (5), 571-573 (2005).
- Hamed, E., Al Balah, O. F. A., Refaat, M., Badr, A. M., Afifi, A. Photodynamic therapy mediated by methylene blue-loaded PEG accelerates skin mouse wound healing: An immune response. Lasers in Med Sci. 39 (1), 141 (2024).
- Ibraheem, W. I., et al. Comparison of digital planimetry and ruler methods for the measurement of extraction socket wounds. Medicina (Kaunas). 59 (1), 135 (2023).
- Mayrovitz, H. N., Soontupe, L. B. Wound areas by computerized planimetry of digital images: accuracy and reliability. Wounds. 22 (5), 222-229 (2009).
- Galiano, R. D., Michaels, J., Dobryansky, M., Levine, J. P., Gurtner, G. C. Quantitative and reproducible murine model of excisional wound healing. Wound Repair Regen. 12 (4), 485-495 (2004).
- Price, A., Grey, J. E., Patel, G. K., Cbe, K. G. H. . ABC of wound healing. , 0470658975 (2022).
- Eming, S. A., Krieg, T., Davidson, J. M. Inflammation in wound repair: Molecular and cellular mechanisms. J Invest Dermatol. 127 (3), 514-525 (2007).
- Carmeliet, P. Angiogenesis in life, disease and medicine. Nature. 438 (7070), 932-936 (2005).
- López, N., Cervero, S., Jiménez, M. J., Sanchez, J. F. Cellular characterization of wound exudate as a predictor of wound healing phases. Wounds. 26 (4), 101-107 (2014).
- Liu, N. T., et al. Quantifying the effects of wound healing risk and potential on clinical measurements and outcomes of severely burned patients: A data-driven approach. Burns. 46 (2), 303-313 (2020).
- Han, C., Barakat, M., DiPietro, L. A. Angiogenesis in wound repair: Too much of a good thing. Cold Spring Harb Perspect Biol. 14 (10), a041225 (2022).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved