Method Article
Cultivo de esferóides de câncer de pâncreas tridimensionais desmoplásicos de co-cultura
Neste Artigo
Resumo
O câncer de pâncreas continua sendo um dos cânceres mais difíceis de tratar. Portanto, é fundamental que os modelos pré-clínicos que avaliam a eficácia do tratamento sejam reprodutíveis e clinicamente relevantes. Este protocolo descreve um procedimento simples de co-cultura para gerar esferoides desmoplásicos reprodutíveis e clinicamente relevantes.
Resumo
O adenocarcinoma ductal pancreático (PDAC) é um dos cânceres mais mortais, com uma taxa de sobrevida de 5 anos de <12%. A maior barreira à terapia é a densa matriz extracelular desmoplásica (MEC) que envolve o tumor e reduz a vascularização, geralmente denominada desmoplasia. Uma variedade de combinações e formulações de medicamentos foram testadas para tratar o câncer e, embora muitas delas mostrem sucesso pré-clínico, elas falham clinicamente. Portanto, torna-se importante ter um modelo clinicamente relevante disponível que possa prever a resposta do tumor à terapia. Este modelo foi previamente validado contra tumores clínicos ressecados. Aqui, é descrito um protocolo simples para o cultivo de esferoides de cocultura tridimensional (3D) desmoplásica que pode gerar naturalmente um ECM robusto e não requer nenhuma fonte de matriz externa ou andaime para suportar seu crescimento.
Resumidamente, células estreladas pancreáticas humanas (HPaSteC) e células PANC-1 são usadas para preparar uma suspensão contendo as células na proporção de 1:2, respectivamente. As células são revestidas em uma placa de poço em U de 96 poços revestida com poli-HEMA. A placa é centrifugada para permitir que as células formem um pellet inicial. A placa é armazenada na incubadora a 37 °C com 5% de CO2 e o meio é substituído a cada 3 dias. As placas podem ser visualizadas em intervalos designados para medir o volume esferoide. Após 14 dias de cultura, esferoides desmoplásicos maduros são formados (ou seja, volume médio de 0,048 + 0,012 mm3 (451 μm x 462,84 μm)) e podem ser utilizados para avaliação da terapia experimental. Os componentes maduros da MEC incluem colágeno-I, ácido hialurônico, fibronectina e laminina.
Introdução
O mau prognóstico do câncer de pâncreas está associado a uma variedade de razões, entre as quais a falta de biomarcadores facilmente detectáveis, levando a uma detecção tardia. Outra razão importante é o estroma espesso ao redor do tecido, o que leva à redução do suprimento de sangue. A deposição de grandes quantidades de matriz extracelular (MEC), interação célula-célula, células endoteliais, várias células imunes, pericitos, miofibroblastos proliferantes e população de fibroblastos, e a presença de células não neoplásicas (juntas constituindo a reação desmoplásica)1, constituem o estroma espesso responsável pela resistência quimioterápica e radioterapêutica doPDAC2. As células cancerígenas e estromais têm uma interação complexa, dinâmica e bidirecional. Embora alguns elementos atenuem ou acelerem a progressão da doença, a maioria dos processos é adaptativa durante o desenvolvimento do tumor1. Isso fornece um ambiente rico em fatores de crescimento, fatores pró-angiogênicos, proteases e moléculas de adesão. Esses fatores promovem angiogênese, proliferação celular, metástase e invasão 3,4. Juntos, eles são um santuário imunológico e privilegiado para o tumor, resultando em resistência aos medicamentos.
A desmoplasia é uma mistura complexa que consiste em várias proteínas da MEC, juntamente com células imunes e células estreladas pancreáticas (PSC). Juntos, eles tendem a formar um andaime para o crescimento das células. As CEPs são um dos maiores componentes do compartimento estromal5. Sua capacidade de produzir enzimas como metaloproteases de matriz (MMP), inibidores teciduais de metaloproteases de matriz (TIMP) e fibroblastos associados ao câncer (CAF)6 implica que eles provavelmente desempenham um papel crítico no desenvolvimento da reação desmoplásica. A MEC, os fibroblastos associados ao câncer (CAF) e a vasculatura são os aspectos cardeais do PDAC. Entre os CAFs, especula-se que os CAFs miofibroblastos e inflamatórios estejam envolvidos na diafonia ativa responsável pelas propriedades pró-tumorais7. Quanto mais extensas as formações fibroblásticas no tumor, pior o prognóstico 8,9,10.
A cultura de células em monocamada por meio de linhagens celulares estabelecidas continua sendo uma ferramenta útil para analisar a toxicidade de medicamentos e é um bom ponto de partida para estudos de prova de conceito e descoberta. As linhas de cultura de células estabelecidas, no entanto, carecem de DNA germinativo e relacionabilidade clínica11. Por serem cultivados em superfícies planas, passam por critérios de seleção in vitro diferentes em relação a quando fazem parte do tumor, dividem-se de forma anormal e perdem seu fenótipo diferenciado12. No geral, as culturas de células únicas limitam a heterogeneidade do tumor e, portanto, perdem relevância clínica. Eles são incapazes de representar com precisão a complexidade do microambiente do tumor (por exemplo, a MEC). A cultura 3D pode replicar mais de perto o complexo microambiente tumoral.
A cultura 3D foi introduzida na década de 1970 para células saudáveis e suas contrapartes neoplásicas13. Várias técnicas têm sido utilizadas para estudar a morfologia e a arquitetura dos tecidos malignos por meio de esferoides14. Co-culturas com células estromais podem modelar sinais de TME. Uma regulação positiva dos marcadores EMT foi observada quando as células foram co-cultivadas com células estreladas15. Os esferoides PDAC e sua interação com o estroma podem ser modelados por co-cultura com componentes ECM. Foi relatado que a co-cultura especificamente com PSCs produz dados de citotoxicidade de drogas clinicamente relevantes 16,17,18. As PSCs também ajudam na resistência aos medicamentos, evitando a apoptose e estimulando a proliferação de células cancerígenas por meio de vários fatores parácrinos19 e induzindo a transição EMT. Portanto, torna-se fundamental incluir as CEPs desde o estágio inicial nos critérios usados para avaliar o sucesso de um medicamento ou sistema de liberação de medicamentos. A capacidade do PSC de aumentar a proliferação e apoiar um crescimento mais rápido em combinação, em comparação com as células cancerígenas pancreáticas isoladas, também foi observada in vivo quando as injeções subcutâneas no flanco das duas linhagens celulares foram avaliadas em camundongos imunocomprometidos20.
A capacidade de um tipo de célula de interagir com os componentes da ECM também é fundamental a ser considerada ao cultivar esferoides co-cultivados. BxPC-3 e PANC-1 foram relatados como tendo afinidades iguais na ligação ao colágeno. As duas linhagens celulares também se ligam de forma equivalente à laminina, embora tenha havido relatos de que o BxPC-3 se liga melhor 21,22,23,24,25. Em termos de migração, Stahle et al.26 demonstraram uma motilidade 5x mais rápida para as células PANC-1 em comparação com as BxPC-3. As células PANC-1 também migram principalmente como células únicas, enquanto as células BxPC-3 migram como uma folha compactada. A escolha das células também afeta o tamanho do tumor25. Os tumores BxPC-3 mostraram-se maiores27,28 do que os obtidos com PANC-1, enquanto um estudo demonstrou o caso oposto29. Apesar de suas diferenças de tamanho e motilidade, ambas as células precisam de longos períodos de latência para formar tumores em camundongos. Essa duração pode ser especialmente longa para o BxPC-3, variando de 4 semanas a 4 meses25. No entanto, também há literatura em que as células-tronco cancerígenas BxPC-328 ou BxPC-330 formaram tumores visíveis mais rapidamente, o que implica que pode haver variação observada nas durações de crescimento do tumor. As durações aqui indicadas devem, portanto, servir apenas como uma diretriz inicial para as taxas de crescimento do tumor.
As células BxPC-3 formam esferóides com células soltas na superfície e núcleos densos, enquanto as células PANC-1 foram relatadas como formando esferóides porosos, mas robustos31 , bem como esferóides compactos. As células PANC-1 também foram relatadas como menos diferenciadas e mais agressivas32. Mantendo a natureza agressiva32 na vanguarda, combinada com a maior motilidade das células PANC-1, capacidade de formar esferóides compactos e capacidade de interagir com os componentes da MEC, as células PANC-1 foram escolhidas para estudos de esferoides.
Nos últimos anos, a cultura esferóide teve muito sucesso em demonstrar uma vantagem em sua relevância clínica em comparação com as culturas bidimensionais (2D). Sua relevância tem sido aproveitada no uso dessa técnica como substituta dos estudos em animais e para entender melhor a biologia dos tumores. A relevância clínica dos esferoides, especialmente quando co-cultivados com PSCs, permitiu seu uso para estudar várias funções do esferóide, como rigidez33, expressão de TGF-β 34,35,36,37,38, E-caderina, F-actina 18,34,36,37, α-SMA 34,35,37,38, lactato desidrogenase (LDHA)32, HIF-1α35,39, resistência a drogas 16,37,40, migração celular41, invasão celular37, fibrose35, resistência à radiação42, alterações fenotípicas18, heterogeneidade36, níveis celulares de interações39 e demonstram componentes da MEC37,38,39. Muitos dos protocolos usados para obter os dados descritos dependem do Matrigel, do método de gota suspensa, moldes impressos ou outros andaimes para ajudar a apoiar o crescimento de esferóides e ECM. Os estudos também geralmente envolvem o uso de células fibroblásticas não humanas ou células estreladas recém-isoladas de pacientes. Embora o uso de células estreladas seja fundamental para que os tumores se assemelhem a condições in vivo, a variabilidade entre pacientes associada a extrações frescas torna esses estudos difíceis de replicar.
Este protocolo visa demonstrar um modelo fácil de desenvolver, reprodutível, clinicamente relevante e livre de andaimes, contando exclusivamente com as habilidades das co-culturas para gerar naturalmente a MEC. Para fazer isso, foi escolhido um método simples de co-cultura envolvendo uma mistura de células PANC-1 (devido à sua tendência natural de migrar como células únicas) junto com células estreladas pancreáticas humanas (HPaSteC), devido à sua capacidade de se comportar como células-tronco e ser altamente resistente a medicamentos. Usando os estudos de Durymanov et al.38como linha de base, o protocolo detalhado abaixo foi estabelecido após otimizar ainda mais os parâmetros, como proporções celulares e durações entre as mudanças de meio. Os esferoides resultantes desse protocolo podem ser usados como um sistema modelo para avaliação de novos candidatos a medicamentos40.
Além disso, para usuários não familiarizados com a cultura esferoide, o trabalho Peirsman et al.43discutindo o desenvolvimento da base de conhecimento MISpheroID pode ser útil. Ele estabelece algumas diretrizes mínimas de informação que podem ajudar a lidar com a heterogeneidade entre os protocolos de laboratório. Embora com algumas limitações, o trabalho demonstrou que a escolha dos meios de cultura, linhagens celulares, método de formação de esferoides e o tamanho final do esferóide são críticos na determinação das propriedades fenotípicas dos esferoides.
Protocolo
1. Cultura de células 2D
- Cultive células PANC-1 no meio de águia modificado de Dulbecco (DMEM), suplementado com 10% de soro fetal bovino (FBS) em condições estéreis. Cresça até 70%-80% de confluência antes das passagens e não use além da20ª passagem. Consulte o processo descrito na etapa 4.2.1.
NOTA: Como ponto de referência, 1 x 106 células em 20 mL de meio precisam de cerca de 2-3 dias para atingir 70-80% de confluência. - Cultive células HPaSteC em meio de células estreladas suplementadas com 2% de FBS, 1% de PenStrep e 1% de Suplemento de Crescimento de Células Estreladas (SteCGS) usando o kit fornecido pelo fabricante em condições estéreis. Crescer de acordo com as instruções do fabricante (com algumas modificações), conforme indicado no passo 4.2.2, num balão revestido com Poli-L-lisina.
- Ignore a etapa de neutralização do FBS durante a tripsinização do protocolo do fabricante, pois a solução de neutralização de tripsina (TNS) é usada. Neutralize a suspensão celular com um volume total de 10 ml de TNS, conforme descrito no passo 4.2.2.2.
NOTA: Como ponto de referência, 0,5 x 106 células e 1 x 106 células em 20 mL de meio precisam de 3 dias e 2 dias, respectivamente, para atingir 90% de confluência. - Colha células com 90% de confluência. Não use células além da Passagem 7.
- Ignore a etapa de neutralização do FBS durante a tripsinização do protocolo do fabricante, pois a solução de neutralização de tripsina (TNS) é usada. Neutralize a suspensão celular com um volume total de 10 ml de TNS, conforme descrito no passo 4.2.2.2.
- Manter as células a 37 °C, com 5% de CO2, em incubadoras estéreis com umidade relativa de 90%-95%. Efectuar todos os estudos de cultura celular num balão T-75.
2. Revestimento de solução de poli (2 -hidroxietil metacrilato (poli-HEMA) para placa de 96 poços
- Prepare a solução de poli-HEMA a 5 mg / mL usando etanol a 95%, permitindo que seja misturada durante a noite usando um agitador aquecido a 37 ° C. (por exemplo, 500 mL de solução precisam de 2,5 g de poli-HEMA)
- Marque o local do volume inicial antes de adicionar o agitador. Use etanol a 95% para compensar qualquer perda na solução no dia seguinte.
- Filtrar a solução final numa coifa estéril utilizando um filtro de 0,22 μm e conservá-la no frigorífico a 4 °C.
NOTA: Poly-HEMA é usado para aumentar a hidrofobicidade de uma superfície, o que serve como um impedimento para as células se ligarem. Como este estudo exige que as células não se liguem aos poços e cresçam como uma monocamada, o poli-HEMA é usado como um impedimento adicional para o recurso natural de baixa fixação das placas, tornando-as placas de fixação ultrabaixas. - Adicione 50 μL da solução fria a cada poço de uma placa redonda de micropoços de fundo de poliestireno de 96 poços dentro de uma capa de cultura de células para revestir a placa.
- Deixe os poços com a tampa colocada em um forno de ar quente a 37 ° C por 3 dias para garantir que as placas estejam completamente secas.
- Esterilize as placas por UV por 30 min na capa de cultura de células antes da semeadura celular. Armazene em um zip lock bem fechado para armazenamento de longo prazo e esterilize antes de usar.
3. Planejamento de cultura de células 2D
- Cronometre o experimento para que as células PANC-1 estejam disponíveis em 70% -80% de confluência no mesmo dia em que as células HPaSteC atingem 90%.
NOTA: Frascos contendo cerca de 1 milhão de células de PANC-1 ou HPaSteC, quando levantados a partir de nitrogênio líquido no mesmo dia, com alguma variação, requerem 8 dias de cultura de PANC-1 e 6-7 dias de cultura de HPaSteC para ter ambas as linhas celulares prontas no mesmo dia.
4. 3D crescimento da cultura
- Consulte a visão geral de todo o processo na Figura 1 antes de iniciar o processo.
CUIDADO: Tanto o PANC-1 quanto o HPaSteC são de origem biológica. Manuseie PANC-1 (linha de células cancerígenas) com cuidado. - Tripsinização e contagem de células
- Tripsinzes e conte as células PANC-1:
- Descarte o sobrenadante e lave as células PANC-1 com 9 mL de HBSS (3 mL de cada vez). Descarte os reagentes usados no exaustor em uma solução de alvejante a 20-25% V/V para garantir a morte completa do material vivo/viável.
- Tripsinize as células com 2 mL de tripsina. Após quase 10 min (pode precisar de mais tempo), quando todas as células estiverem descoladas, neutralize a suspensão com 10 mL de DMEM + 10% de FBS. Comece com 3 mL e siga com as etapas de lavagem subsequentes usando 1 mL por lavagem (7 lavagens restantes) para garantir a coleta máxima de células tripsinizadas.
- Agrupe cada alíquota neutralizada no mesmo tubo de 15 mL. O volume final no tubo será próximo a 12 mL (~2 mL de tripsina que foi neutralizada com 10 mL de meio).
- Centrifugue a suspensão de células neutralizadas a 700 x g por 2 min e 30 s. Rejeitar o sobrenadante e ressuspender o sedimento obtido em 1 ml de DMEM +10% FBS. Pegue uma alíquota para contagem de células e rotule o valor obtido nesta seção como "Contagem A".
- Tripsinze e conte células HPaSteC.
- Descarte o sobrenadante e lave as células HPaSteC com 9 mL de HBSS (3 mL de cada vez).
- Tripsinize as células com 2 mL de tripsina. Após quase 10 min, quando todas as células estiverem descoladas, neutralizar a suspensão com 10 mL de solução de neutralização de tripsina. Comece com 3 mL e siga com as etapas de lavagem subsequentes usando 1 mL por lavagem (7 lavagens restantes) para garantir a coleta máxima de células tripsinizadas.
- Agrupe cada alíquota neutralizada no mesmo tubo de 15 mL. O volume final no tubo será próximo a 12 mL (~2 mL de tripsina que foi neutralizada com 10 mL de solução neutralizante).
- Centrifugue a suspensão de células neutralizadas a 700 x g por 2 min e 30 s. Rejeitar o sobrenadante e ressuspender o sedimento obtido em 1 ml do meio de células estreladas suplementado. Pegue uma alíquota para contagem de células e rotule o valor obtido nesta seção como "Contagem B".
- Tripsinzes e conte as células PANC-1:
- Diluição das suspensões celulares iniciais
- Faça uma pausa nesta etapa, se necessário (não mais de 0,5 h) por um curto período de tempo após obter as contagens A e B ou após tripsinizar e neutralizar PANC-1 e HPaSteC. Manter os meios de cultura não utilizados a 37 °C e as suspensões celulares à temperatura ambiente (RT; 25 ± 2 °C).
- Use a Contagem A e a Contagem B obtidas anteriormente, para tirar alíquotas e fazer as respectivas diluições (em tubos separados) de modo que o volume final seja de 1 mL (diluente: DMEM + 10% FBS para ambos os frascos) e a contagem final esteja entre 110.000-140.000 células para cada tipo de célula. Uma vez feita essa diluição, verifique a contagem de células para cada diluição para dar Contagem C (PANC-1) e Contagem D (HPaSteC).
- Faça uma pausa nesta etapa, se necessário (não mais de 15-30 min) após obter a Contagem C e a Contagem D. Não parar depois de efectuadas as diluições finais no passo 4.3.3.2; experimento para evitar a sedimentação celular. Manter os meios de cultura não utilizados a 37 °C e as suspensões celulares a RT (25 ± 2 °C).
- Manter o número final de células necessárias por poço no HPaSteC: PANC-1: 60:120. Use 110 poços para o cálculo para contabilizar o excesso. Calcule com um valor base de 100 μL de suspensão de células por poço (o volume total da suspensão é de 11 mL para 110 poços com HPaSteC: PANC-1: 60:120). Faça esta suspensão em um tubo de centrífuga estéril de 50 mL para facilitar a mistura.
- Use a Contagem C e a Contagem D e coloque suspensão celular suficiente em uma solução DMEM + FBS a 10% para ter HPaSteC: PANC-1: 60:120 em um volume final de 11 mL (6.600 células HPaSteC e 13.200 células PANC-1 em 11 mL). Misture bem a solução usando uma pipeta de 1 mL, agitando e pipetando para cima e para baixo. Evite a formação de espuma.
- Semeadura
- Use uma pipeta de 200 μL ou 100 μL para misturar a suspensão final (mexa movendo a ponta da pipeta combinada com a pipetagem para cima e para baixo) em cada etapa antes de adicionar 100 μL da suspensão por poço. Adicione os 100 μL suavemente ao longo do canto do poço.
- Reutilize a mesma ponta para vários poços, a menos que ela caia. Misture para frente e para trás e conte até 10 ou 15 (não segundos) entre as adições a cada poço para a primeira metade (aproximadamente os primeiros 43 poços) da placa. Reduza a contagem de mistura para 5-10 entre cada poço para a segunda metade (43 poços restantes), pois o volume da suspensão é menor e requer menos duração da mistura.
- Não use um pipetador de repetição, pois o revestimento poli-HEMA hidrofóbico fará com que a suspensão salte da placa, levando a uma distribuição desigual.
- Descarte qualquer excesso de suspensão depois que todos os poços estiverem cheios.
- Use uma pipeta de 200 μL ou 100 μL para misturar a suspensão final (mexa movendo a ponta da pipeta combinada com a pipetagem para cima e para baixo) em cada etapa antes de adicionar 100 μL da suspensão por poço. Adicione os 100 μL suavemente ao longo do canto do poço.
- Centrifugação
- Centrifugue a placa final contendo a suspensão celular para reunir todas as células como um pellet. Enrole cuidadosamente a placa com parafilme ao redor da borda da placa para evitar contaminação durante esta etapa. Após o embrulho, centrifugue a placa com um contrapeso a 1000 x g por 2 min.
- Leve a placa de volta para a coifa de cultura de células (use luvas pulverizadas com etanol para manusear), remova o parafilme e armazene as placas na incubadora a 37 ° C, com 5% de CO2. Não borrife a placa com mistura de etanol e água em nenhum momento.
- Manutenção da cultura
- Veja as células se unindo para formar esferoides sob um microscópio de luz com ampliação de 4x-5x no dia 3. Siga o protocolo de manutenção da cultura conforme descrito abaixo.
- No dia 3, meça 5-6 mL de DMEM + 10% de FBS e adicione 50 μL a cada poço ao longo da lateral do poço.
- Não misture ou agite o meio de forma alguma durante a adição, pois isso danificará o esferóide ou levará à remoção acidental do esferoide. O volume final por poço será de ~ 150 μL.
- Além do dia 3, consulte a Figura 2 para se familiarizar com a estrutura do poço e a localização do reflexo da luz (entre a porção cilíndrica e curva do poço) visto na mídia chamada de halo. Execute operações próximas ao halo com cuidado para garantir que os esferoides permaneçam intactos.
- No dia 6, meça 10-11 mL de DMEM + 10% FBS. Use uma pipeta de 1 mL para retirar a mídia a granel de vários poços, retirando a mídia até o halo. Faça isso para toda a placa, seguido pela substituição da mídia. Colete o sobrenadante a granel e descarte-o ou descarte-o à medida que for retirado.
- Substitua o meio descartado por um novo meio adicionando 100 μL de meio ao longo da lateral de cada poço. O volume final no poço será próximo a 200 μL.
- Não puxe a mídia além do halo, pois isso aumenta o risco de puxar acidentalmente o esferoide.
- No dia 10/11, meça 10-11 mL de DMEM + 10% de FBS. Use uma pipeta de 1 mL para retirar a mídia a granel de vários poços, retirando a mídia até o halo. Faça isso para toda a placa, seguido pela substituição da mídia. Colete o sobrenadante a granel e descarte-o ou descarte-o à medida que for retirado.
- Substitua o meio descartado por um novo meio adicionando 100 μL de meio ao longo da lateral de cada poço. O volume final no poço será próximo a 200 μL.
- No dia 3, meça 5-6 mL de DMEM + 10% de FBS e adicione 50 μL a cada poço ao longo da lateral do poço.
- Veja as células se unindo para formar esferoides sob um microscópio de luz com ampliação de 4x-5x no dia 3. Siga o protocolo de manutenção da cultura conforme descrito abaixo.
- Avaliação do último dia
- Realize o tratamento medicamentoso nos esferoides no dia 14. Visualize os esferoides antes do uso usando um microscópio invertido de campo claro sob uma objetiva de 4x para determinar o volume inicial do esferoide. Calcule o Volume (V) usando a seguinte fórmula:
V = 0,5 × L × W2 - Siga a equação para calcular os volumes esferóides descritos acima. Aqui L é o comprimento do eixo maior e W é a largura (linha mais longa perpendicular ao eixo maior). Converta todas as unidades originais de micrômetros para milímetros para obter um volume em milímetros cúbicos.
- O volume inicial em cada poço no dia 14 está entre 150-200 μL devido à evaporação. Para tratamentos medicamentosos, remova o meio até que o halo seja alcançado de cada poço e substitua-o por 100 μL da solução medicamentosa na força 2x, juntamente com uma mistura suave (misture o meio suavemente para frente e para trás enquanto conta até 2 entre cada poço).
- Use soluções de força 2x para permitir que a solução final do medicamento esteja em 1x e para evitar a remoção completa do meio antigo dos poços, caso contrário, os esferóides podem ser perturbados. Use os esferóides dentro de 3 dias a partir desse período.
- Realize o tratamento medicamentoso nos esferoides no dia 14. Visualize os esferoides antes do uso usando um microscópio invertido de campo claro sob uma objetiva de 4x para determinar o volume inicial do esferoide. Calcule o Volume (V) usando a seguinte fórmula:
- Coleção de esferóides
- Meça os volumes esferóides antes da coleta, conforme descrito na etapa 4.7.2.
- Colete os esferoides no dia 14 ou 17, dependendo das necessidades do experimento, removendo o meio de cada poço até que o halo seja alcançado.
- Use uma pipeta de 1 mL para remover o meio e coletar o sobrenadante em um tubo de centrífuga cônico de 15 mL de vários poços.
- Uma vez que todos os poços tenham meio no nível do halo, reduza a configuração na pipeta de 1 mL para entre 200-300 μL.
- Alinhe a placa contra o fundo do exaustor ou fundo escuro (por exemplo, um rack de tubo) para ver os esferóides assentados na parte inferior.
- Insira suavemente a ponta perto do esferóide (vá abaixo do halo) e pipete uma pequena quantidade de meio (por exemplo, uma estimativa visual de cerca de 50 μL) para frente e para trás para perturbar o esferoide. Não coloque a ponta diretamente sobre o esferóide, pois isso pode danificar sua estrutura.
- Não puxe toda a mídia para fora do poço nesta etapa. Controle o movimento do polegar firmemente no pistão da pipeta.
- Deslocar a mídia até que o esferóide não permaneça mais no centro e possa ser visto se movendo contra o fundo. Puxe mídia suficiente para sugar o esferóide e mova-o para o local desejado (por exemplo, agrupe-o com outros esferoides em um poço que faça parte do mesmo conjunto de tratamento).
- Eliminação de resíduos
- Descarte todas as amostras líquidas uma vez neutralizadas com alvejante de acordo com os protocolos do Departamento de Meio Ambiente e Segurança Sanitária dos respectivos laboratórios. Autoclave e descarte todas as pipetas e frascos usados com resíduos de risco biológico.
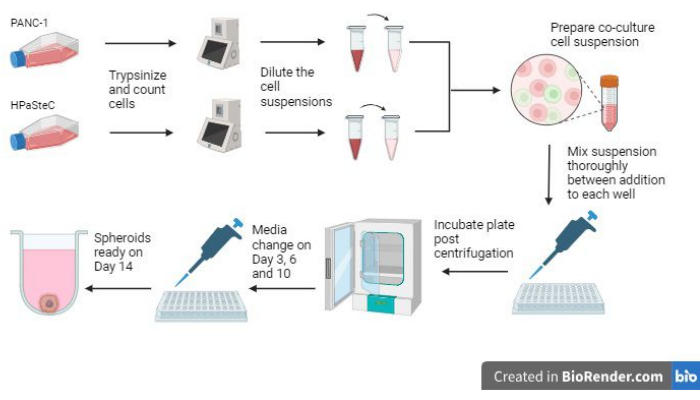
Figura 1: Visão geral do processo de cultivo de esferóides de câncer de pâncreas desmoplásicos 3D (gerado usando BioRender). A figura fornece uma visão geral dos processos básicos envolvidos; ou seja, células tripsinzadoras, usando a contagem inicial de células para fazer suspensões celulares diluídas, preparando uma co-cultura usando as suspensões celulares diluídas, adicionando suspensões celulares a cada poço, incubando as culturas, realizando manutenção do meio e formação final de esferóides conforme esperado no dia 14. Clique aqui para ver uma versão maior desta figura.

Figura 2: Estrutura do poço de fundo em U. A imagem da direita é uma forma exagerada para demonstrar a porção "halo" do poço. A figura visa definir onde está a parte do "halo" do poço, pois trabalhar acima do halo é fundamental para o crescimento dos esferoides e evitar perdas acidentais. Clique aqui para ver uma versão maior desta figura.
5. Avaliação dos componentes da ECM e microscopia confocal
- Utilizar imunomarcação para avaliar a resposta da MEC à terapia medicamentosa de acordo com o protocolo descrito por Durymanov et al.38.
- Agrupe os esferóides e lave duas vezes com 100 μL de PBS. Incorporar em meio de inclusão de tecido de temperatura de corte ideal (OCT), congelar e manter a -80 °C.
- Corte os blocos tumorais congelados em seções de 10 μm, fixe as seções na mistura de acetona-metanol (1: 1) por 15 min e deixe-as secar ao ar em RT.
- Para determinar os componentes da MEC, imunocorar as criossecções com anticorpos primários monoclonais antifibronectina de coelho, anticorpos policlonais de colágeno tipo I de coelho, anticorpos antilaminina policlonal de coelho e anticorpos antiácido hialurônico policlonal de ovelha.
- Use IgG anticoelho de cabra marcado com Alexa Fluor 488 ou anti-ovelha de burro conjugado com Alexa Fluor 568 como anticorpos secundários.
NOTA: Os anticorpos primários e secundários foram diluídos a 1:200 e 1:300, respectivamente. - Adquira imagens de todas as seções esferóides usando um microscópio confocal de varredura a laser equipado com lente objetiva de 20x/0,45.
Resultados
Três das etapas mais críticas envolvidas no crescimento dos esferoides são a contagem inicial de células, as etapas de mistura durante a semeadura dos esferoides e a realização de alterações oportunas no meio para permitir que os esferoides cresçam (Figura 1). Além disso, estar familiarizado com a Figura 2 sobre mudanças de mídia após o dia 3 é fundamental para permitir mudanças de mídia eficazes devido ao aumento do volume de mídia por poço. Quando todas essas etapas são executadas de acordo com as instruções fornecidas, os esferóides (Figura 3) crescem até um volume médio de 0,048 ± 0,012 mm3 (451 μm x 462,84 μm) (Figura 4). Foram encontrados casos em que as células podem crescer melhor, levando a maiores volumes médios iniciais de 0,096 ± 0,014 mm3 (611 μm x 560 μm) no dia 14. Uma variedade de razões pode levar os esferoides a terem volumes iniciais maiores, como a manutenção da temperatura e umidade da incubadora ou o uso de passagens celulares anteriores, que têm uma vitalidade ligeiramente melhorada em comparação com as passagens posteriores.
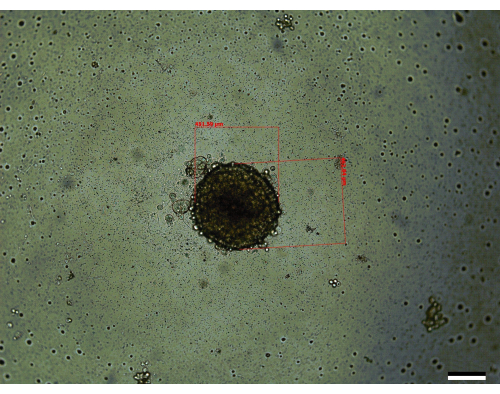
Figura 3: Um esferóide representativo visto no dia 14 (tamanho: 451,59 μm x 462,84 μm). Barra de escala = 200 μm. Cada esferóide é medido ao longo de seu eixo mais longo e mais curto, respectivamente, e usou a equação descrita na seção de métodos para calcular o volume. Clique aqui para ver uma versão maior desta figura.

Figura 4: Progresso do crescimento do esferóide ao longo de 17 dias. As placas 1 e 2 são réplicas. As barras de erro representam o desvio padrão. A figura pode ser usada como uma estimativa aproximada dos volumes esferóides que podem ser vistos nos dias 6, 10, 14 e 17. Clique aqui para ver uma versão maior desta figura.
No entanto, nos casos em que as células não são contadas corretamente ou a suspensão celular não é completamente misturada, ou a cultura final não é mantida regularmente, ou ocorre uma combinação desses erros, isso pode levar ao desenvolvimento de esferóides menores ou esferóides crescidos de forma incompleta. Esferoides com aparências semelhantes também foram observados quando os estudos iniciais de otimização apenas suplementaram o meio em poços ao redor da periferia da placa no Dia 3, em vez de toda a placa (Figura 5). Alternativamente, nos casos em que as células não estão bem misturadas, ou erros iniciais de contagem / diluição levam à semeadura de mais células por poço do que a recomendação, vários esferóides podem ser vistos por poço. Um achado semelhante foi observado quando as células PANC-1:HPaSteC foram usadas na proporção de 240:120 (Figura 6). Isso também pode ser visto ocasionalmente quando os esferoides são cultivados por direção, mas esses esferoides são em menor número (por exemplo, 4/96 poços podem conter dois esferoides por poço em vez de um). Nos casos em que vários esferoides são encontrados, evite usar os poços com vários esferoides ou faça anotações de mudanças nos volumes quando esses esferoides estiverem sendo tratados. Alterações inadequadas de meio onde a ponta da pipeta mergulha abaixo do halo (Figura 1) também podem levar à perda acidental dos esferoides.

Figura 5: Uma imagem representativa de um esferóide mal crescido no dia 14. Barra de escala = 200 μm. Aqui, as células não se agregaram bem, por isso torna-se difícil medir o comprimento e a largura do esferóide. Clique aqui para ver uma versão maior desta figura.
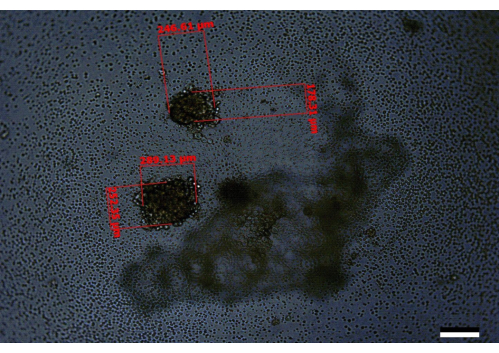
Figura 6: Uma imagem representativa de um poço contendo dois esferóides mal crescidos, como visto no dia 14. Barra de escala = 200 μm. Aqui, um dos esferóides tem um tamanho de 246,61 μm x 178,31 μm e o outro 289,13 μm x 252,35 μm. Este é um exemplo em que provavelmente há um problema com as diluições iniciais ou com a qualidade das células que foram usadas para iniciar o experimento. Clique aqui para ver uma versão maior desta figura.
Os esferoides também desenvolvem uma MEC com quatro dos componentes primários da MEC: colágeno-I, laminina, ácido hialurônico e fibronectina. Em estudos que o laboratório publicou anteriormente, a vantagem da co-cultura sobre o PANC-1 sozinho foi demonstrada em termos de esferóides homo PANC-1 exibindo colágeno difuso, sem fibronectina e menor deposição de ácido hialurônico.
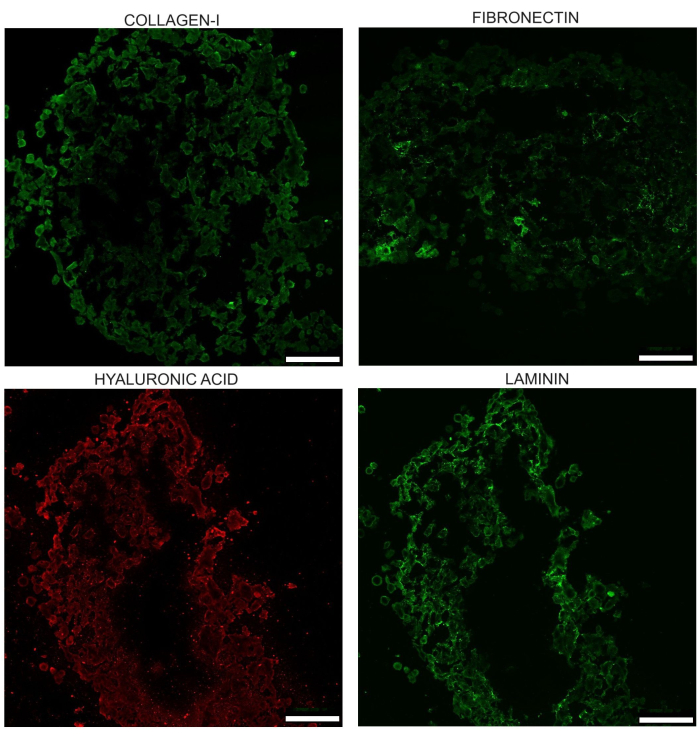
Figura 7: Imagem representativa dos quatro componentes primários da MEC, conforme visto no dia 17 em esferoides não tratados: colágeno I, laminina, ácido hialurônico e fibronectina. Essas imagens são obtidas após imunomarcação criosseccional do esferoide. O brilho dessas imagens foi aumentado uniformemente para ajudar a destacar as diferenças na aparência. As áreas onde o tecido está danificado ou ausente devem ser ajustadas enquanto as medições de intensidade estão sendo realizadas. Barras de escala = 100 μm. Clique aqui para ver uma versão maior desta figura.
Discussão
A duração e as proporções de células escolhidas para o crescimento dos esferoides foram baseadas em estudos relatados anteriormente38. Ao tentar otimizar esses estudos substituindo células NIH3T3 por células HPaSteC, descobriu-se que os volumes esferóides e os padrões de apoptose se assemelham muito aos parâmetros otimizados relatados (relatados para PANC-1: NIH3T3:: 120:12) quando as proporções PANC-1: HPaSteC estavam em 120: 60. Embora esses estudos meçam apenas a apoptose até o dia 14, o protocolo descrito neste processo continua a usar esferoides até o dia 17, uma vez que nenhum aumento visível na formação de detritos é observado entre o dia 14 e o dia 17. Como controle, todos os esferoides avaliados no dia 17 sempre incluem um braço não tratado para servir como linha de base para aumentos naturais no volume e apoptose dos esferoides.
O processo de semeadura e crescimento de esferoides tem 3 etapas críticas: contagem adequada, mistura antes da adição das células e manutenção das culturas. Como o processo depende do uso de um pequeno número de células PANC-1 e HPaSteC, ter a contagem certa e as diluições corretas torna-se crítico. Isso é particularmente importante para as células HPaSteC, pois essas células são menores que as células PANC-1 e é fácil subestimar o número de células. Portanto, é fundamental contar as células com cuidado. Subestimar a contagem resulta na formação de vários esferoides, enquanto superestimar pode levar a esferoides mal formados.
Também se torna fundamental misturar bem a suspensão em todas as etapas. Trabalhar com a expectativa de que as células possam se estabelecer ajuda a evitar a mistura insuficiente e garante uma distribuição celular uniforme. Ao preparar os esferoides para mais de uma placa (por exemplo, duas placas), recomenda-se que o número de misturas para frente e para trás (etapa 4.4.1) seja de pelo menos 20 entre cada poço. Isso pode ser reduzido para 15 quando a primeira placa estiver na metade, seguido por 10 ao iniciar a próxima placa e 5 à medida que o progresso for feito em direção à segunda metade da segunda placa. Realizar um movimento de agitação com a pipeta em paralelo à mistura para frente e para trás ajuda a melhorar a extensão da mistura. Uma ideia a considerar é envolver uma segunda pessoa ao preparar dois pratos, pois isso aumenta a velocidade e a eficiência da mistura. Nesse cenário, duas pessoas podem usar o capô ao mesmo tempo com suas suspensões e placas individuais, trabalhando nos cantos opostos do capô.
A manutenção das culturas de células é necessária para garantir que os esferoides sempre tenham um suprimento adequado de nutrientes. Os suplementos de mídia nos dias 3 e 6 são mais críticos, pois é onde as células estão crescendo e precisam ser bem alimentadas. As mudanças de mídia nos dias 6 e 10/11 também podem ser complicadas, pois envolvem a coleta de algum sobrenadante para descartar a mídia mais antiga. Esta etapa deve ser feita com cuidado, puxando suavemente a mídia para fora até o "halo" e nunca além. Isso ajuda a evitar a sucção do meio muito perto do esferóide e a perda não intencional de esferoides durante a troca do meio.
O método tem uma grande vantagem, pois é facilmente reprodutível e não requer nenhum molde ou material de andaime, ao contrário dos métodos que citamos anteriormente 32,34,35,36,37,39. Além disso, o meio usado é o meio de cultura celular padrão, que é relativamente barato em oposição ao meio EGM-239, misturas de meios de células estreladas e DMEM-FBS35ou qualquer um dos meios sozinhos, dependendo dos tipos de células34. Essa vantagem se torna crítica na traduzibilidade entre laboratórios e na facilidade de configuração. O processo também pode ser ampliado para várias placas, mas provavelmente exigiria uma pessoa para cada duas placas. A natureza robusta dos esferóides também permite que eles sejam avaliados em condições de agitação. Esta etapa é particularmente útil na realização de estudos farmacocinéticos celulares ou de liberação e absorção escavada onde os esferoides estão envolvidos.
Apesar de suas vantagens, uma limitação do método é que ele precisa de uma mistura muito completa durante a etapa de semeadura. Isso pode se tornar demorado e fisicamente extenuante. Uma possível maneira de contornar isso pode envolver o uso de um cordão magnético bem esterilizado para manter as condições de agitação constantes durante o processo de semeadura. Coletar os esferóides também é complicado e requer alguma prática. Os esferoides também precisam de tempo para crescer e, portanto, requerem um planejamento cuidadoso para garantir a disponibilidade de pessoal e suprimentos para mudanças de mídia.
Para concluir, foi desenvolvido um método simples e reprodutível para produzir esferoides 3D desmoplásicos clinicamente relevantes. Os esferoides são robustos e capazes de gerar componentes da MEC: colágeno I, laminina, ácido hialurônico e fibronectina. A simplicidade envolvida na geração desses esferoides traz uma vantagem única de ser facilmente reprodutível e facilmente adaptável a mudanças como a inclusão de uma terceira linhagem celular. Outra vantagem única do modelo é que ele é resistente à terapia40. Isso ajuda a aumentar sua relevância clínica e garante que apenas os medicamentos mais eficazes sejam escolhidos para avançar e ser utilizados no tratamento do câncer de pâncreas. Além disso, esses esferóides podem ser coletados e implantados em camundongos para fornecer tumores desmoplásicos reprodutíveis para análise in vivo 38e também usados para examinar a penetração de tamanhos variados de nanopartículas44conforme descrito anteriormente.
Divulgações
Os autores não têm nada a divulgar.
Agradecimentos
O trabalho descrito foi apoiado pelo Escritório de Desenvolvimento Econômico dos Governadores de Dakota do Sul, pelo Programa de Bolsas de Pesquisa Competitiva do Conselho de Regentes de Dakota do Sul (SD-BOR-CRGP) e pelo Departamento de Ciências Farmacêuticas da Universidade Estadual de Dakota do Sul por seu apoio.
Materiais
| Name | Company | Catalog Number | Comments |
| Axio Observer inverted microscope | Carl Zeiss | 0450-354 | |
| Cellometer Auto T4 | Nexcelom Bioscience LLC | Auto-T4 | |
| DMEM, powder, high glucose | Gibco | 12100046 | |
| Donkey anti-sheep conjugated with Alexa Fluor 568 | Abcam | ab175712 | |
| Fetal Bovine Serum | Cytiva | SH3091003HI | |
| Goat antirabbit IgG labeled with Alexa Fluor 488 | Abcam | ab150077 | |
| Hanks Balanced Salt Solution (HBSS) | Gibco | 14175145 | |
| Human Pancreatic Stellate Cells (HPaSteC) | ScienCell | 3830 | |
| Microscope Nikon | Nikon | Eclipse Ts 100 | |
| Nunc 96-Well Polystyrene Round Bottom Microwell Plates | Thermo Scientific | 12-565-331 | |
| Olympus Fluoview FV1200 confocal laser | Olympus | N/A | Discontinued product |
| PANC-1 | ATCC | CRL-1469 | |
| Poly-HEMA | Sigma | P3932 | |
| Rabbit polyclonal anti-laminin antibodies | Abcam | ab11575 | |
| Rabbit polyclonal anti-type I collagen antibodies | Abcam | ab34710 | |
| Sheep polyclonal anti-hyaluronic acid antibodies | Abcam | ab53842 | |
| Stellate cell media complete kit | ScienCell | 5301 | |
| Trypsin | MP Biomedicals, LLC | 153571 | Trypsin solution prepared according to manufacturers protocol and used at 0.25%w/v |
| Trypsin Neutralization Solution (TNS) | ScienCell | 103 |
Referências
- Hingorani, S. R. Epithelial and stromal co-evolution and complicity in pancreatic cancer. Nat Rev Cancer. 23 (2), 57-77 (2023).
- Laklai, H., et al. Genotype tunes pancreatic ductal adenocarcinoma tissue tension to induce matricellular fibrosis and tumor progression. Nat Med. 22 (5), 497-505 (2016).
- Binker, M. G., Binker-Cosen, M. J., Binker-Cosen, A. A., Cosen-Binker, L. I. Microenvironmental factors and extracellular matrix degradation in pancreatic cancer. J Pancreas. 15 (4), 280-285 (2014).
- Spano, D., Zollo, M. Tumor microenvironment: a main actor in the metastasis process. Clin Exp Metastasis. 29 (4), 381-395 (2012).
- Ware, M. J., et al. Generation of an in vitro 3D PDAC stroma rich spheroid model. Biomaterials. 108, 129-142 (2016).
- Sunami, Y., Häußler, J., Kleeff, J. Cellular heterogeneity of pancreatic stellate cells, mesenchymal stem cells, and cancer-associated fibroblasts in pancreatic cancer. Cancers. 12 (12), 3770 (2020).
- Öhlund, D., et al. Distinct populations of inflammatory fibroblasts and myofibroblasts in pancreatic cancer. J Exp Med. 214 (3), 579-596 (2017).
- Pandol, S., Edderkaoui, M., Gukovsky, I., Lugea, A., Gukovskaya, A. Desmoplasia of pancreatic ductal adenocarcinoma. Clin Gastroenterol Hepatol. 7 (11), S44-S47 (2009).
- Watanabe, I., et al. Advanced pancreatic ductal cancer: fibrotic focus and β-catenin expression correlate with outcome. Pancreas. 26 (4), 326-333 (2003).
- Hu, G., et al. Tumor-infiltrating podoplanin+ fibroblasts predict worse outcome in solid tumors. Cell Physiol Biochem. 51 (3), 1041-1050 (2018).
- Kapałczyńska, M., et al. 2D and 3D cell cultures-a comparison of different types of cancer cell cultures. Arch Med Sci. 14 (4), 910-919 (2018).
- Monberg, M. E., et al. Occult polyclonality of preclinical pancreatic cancer models drives in vitro evolution. Nat Commun. 13 (1), 3652 (2022).
- Emerman, J. T., Pitelka, D. R. Maintenance and induction of morphological differentiation in dissociated mammary epithelium on floating collagen membranes. In Vitro. 13 (5), 316-328 (1977).
- Kelm, J. M., Timmins, N. E., Brown, C. J., Fussenegger, M., Nielsen, L. K. Method for generation of homogeneous multicellular tumor spheroids applicable to a wide variety of cell types. Biotechnol Bioeng. 83 (2), 173-180 (2003).
- Kikuta, K., et al. Pancreatic stellate cells promote epithelial-mesenchymal transition in pancreatic cancer cells. Biochem Biophys Res Commun. 403 (3-4), 380-384 (2010).
- Lee, J. -. H., et al. Microfluidic co-culture of pancreatic tumor spheroids with stellate cells as a novel 3D model for investigation of stroma-mediated cell motility and drug resistance. J Exp Clin Cancer Res. 37 (1), 4 (2018).
- Wong, C. -. W., Han, H. -. W., Tien, Y. -. W., Hsu, S. -. H. Biomaterial substrate-derived compact cellular spheroids mimicking the behavior of pancreatic cancer and microenvironment. Biomaterials. 213, 119202 (2019).
- Liu, X., et al. 3D heterospecies spheroids of pancreatic stroma and cancer cells demonstrate key phenotypes of pancreatic ductal adenocarcinoma. Transl Oncol. 14 (7), 101107 (2021).
- Vonlaufen, A., et al. Pancreatic stellate cells: partners in crime with pancreatic cancer cells. Cancer Res. 68 (7), 2085-2093 (2008).
- Bachem, M. G., et al. Pancreatic carcinoma cells induce fibrosis by stimulating proliferation and matrix synthesis of stellate cells. Gastroenterology. 128 (4), 907-921 (2005).
- Greco, E., et al. Pancreatic cancer cells invasiveness is mainly affected by interleukin-1β not by transforming growth factor-β1. Int J Biol Markers. 20 (4), 235-241 (2005).
- Arao, S., Masumoto, A., Otsuki, M. β1 integrins play an essential role in adhesion and invasion of pancreatic carcinoma cells. Pancreas. 20 (2), 129-137 (2000).
- Sawai, H., Yamamoto, M., Okada, Y., Sato, M., Akamo, Y., Takeyama, H., Manabe, T. Alteration of integrins by Interleukin-1alpha in human pancreatic cancer cells. Pancreas. 23 (4), 399-405 (2001).
- Chen, J., et al. Expression and function of the epidermal growth factor receptor in physiology and disease. Physiol Rev. 96 (3), 1025-1069 (2016).
- Deer, E. L., et al. Phenotype and genotype of pancreatic cancer cell lines. Pancreas. 39 (4), 425 (2010).
- Stahle, M., et al. Mechanisms in LPA-induced tumor cell migration: critical role of phosphorylated ERK. J Cell Sci. 116, 3835-3846 (2003).
- Aubert, M., et al. Decrease of human pancreatic cancer cell tumorigenicity by α1, 3galactosyltransferase gene transfer. Int J Cancer. 107 (6), 910-918 (2003).
- Miknyoczki, S. J., Chang, H., Klein-Szanto, A., Dionne, C. A., Ruggeri, B. A. The Trk tyrosine kinase inhibitor CEP-701 (KT-5555) exhibits significant antitumor efficacy in preclinical xenograft modelsof human pancreatic ductal adenocarcinoma. Clin Cancer Res. 5 (8), 2205-2212 (1999).
- Fukasawa, M., Korc, M. Vascular endothelial growth factor-trap suppresses tumorigenicity of multiple pancreatic cancer cell lines. Clin Cancer Res. 10 (10), 3327-3332 (2004).
- Hernández-Camarero, P., et al. Pancreatic (pro) enzymes treatment suppresses BXPC-3 pancreatic Cancer Stem Cell subpopulation and impairs tumour engrafting. Sci Rep. 9 (1), 11359 (2019).
- Ware, M. J., et al. Generation of homogenous three-dimensional pancreatic cancer cell spheroids using an improved hanging drop technique. Tissue Eng Part C Methods. 22 (4), 312-321 (2016).
- Longati, P., et al. 3D pancreatic carcinoma spheroids induce a matrix-rich, chemoresistant phenotype offering a better model for drug testing. BMC Cancer. 13, 95 (2013).
- Kpeglo, D., et al. Modeling the mechanical stiffness of pancreatic ductal adenocarcinoma. Matrix Biol Plus. 14, 100109 (2022).
- Jang, S. -. D., et al. Anti-cancer activity profiling of chemotherapeutic agents in 3D co-cultures of pancreatic tumor spheroids with cancer-associated fibroblasts and macrophages. Cancers. 13 (23), 5955 (2021).
- Pednekar, K. P., Heinrich, M. A., van Baarlen, J., Prakash, J. Novel 3D µtissues mimicking the fibrotic stroma in pancreatic cancer to study cellular interactions and stroma-modulating therapeutics. Cancers. 13 (19), 5006 (2021).
- Kim, S. -. K., et al. Phenotypic heterogeneity and plasticity of cancer cell migration in a pancreatic tumor three-dimensional culture model. Cancers. 12 (5), 1305 (2020).
- Hwang, H. J., Oh, M. -. S., Lee, D. W., Kuh, H. -. J. Multiplex quantitative analysis of stroma-mediated cancer cell invasion, matrix remodeling, and drug response in a 3D co-culture model of pancreatic tumor spheroids and stellate cells. J Exp Clin Cancer Res. 38 (1), 258 (2019).
- Durymanov, M., et al. Subcutaneous inoculation of 3D pancreatic cancer spheroids results in development of reproducible stroma-rich tumors. Transl Oncol. 12 (1), 180-189 (2019).
- Giustarini, G., Teng, G., Pavesi, A., Adriani, G. Characterization of 3D heterocellular spheroids of pancreatic ductal adenocarcinoma for the study of cell interactions in the tumor immune microenvironment. Front Oncol. 13, 1156769 (2023).
- Alseud, K., et al. Synthesis and biological activity of 11-oxygenated and heterocyclic estrone analogs in pancreatic cancer monolayers and 3D spheroids. Bioorg Med Chem. , (2024).
- Fitzgerald, A. A., et al. Fibroblast activation protein regulates natural killer cell migration, extravasation and tumor infiltration. bioRxiv. , 429622 (2021).
- Wishart, G., Gupta, P., Schettino, G., Nisbet, A., Velliou, E. 3D tissue models as tools for radiotherapy screening for pancreatic cancer. Br J Radiol. 94 (1120), 20201397 (2021).
- Peirsman, A., et al. MISpheroID: a knowledgebase and transparency tool for minimum information in spheroid identity. Nat Methods. 18 (11), 1294-1303 (2021).
- Durymanov, M., Kroll, C., Permyakova, A., Reineke, J. Role of endocytosis in nanoparticle penetration of 3D pancreatic cancer spheroids. Mol Pharm. 16 (3), 1074-1082 (2019).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados