Method Article
通过共培养的 Desmoplastic 三维胰腺癌球状体
摘要
胰腺癌仍然是最难治疗的癌症之一。因此,评估治疗效果的临床前模型必须具有可重复性和临床相关性。该方案描述了一种简单的共培养程序,用于生成可重复的、临床相关的结缔组织增生性球体。
摘要
胰腺导管腺癌 (PDAC) 是最致命的癌症之一,5 年生存率为 <12%。治疗的最大障碍是围绕肿瘤并减少血管形成的致密结缔组织增生性细胞外基质 (ECM),通常称为结缔组织增生。已经测试了多种药物组合和制剂来治疗癌症,尽管其中许多在临床前显示出成功,但在临床上却失败了。因此,拥有一个可用的临床相关模型来预测肿瘤对治疗的反应变得很重要。该模型先前已针对切除的临床肿瘤进行了验证。这里描述了一种生长结缔组织增生性三维 (3D) 共培养球体的简单方案,它可以自然地产生强大的 ECM,并且不需要任何外部基质源或支架来支持它们的生长。
简而言之,人胰腺星状细胞(HPaSteC)和PANC-1细胞分别用于制备含有1:2比例细胞的悬浮液。将细胞接种在聚 HEMA 包被的 96 孔低附着 U 孔板中。将板离心以使细胞形成初始沉淀。将板储存在 37 °C 和 5% CO2 的培养箱中,每 3 天更换一次培养基。可以按指定的间隔对板进行成像以测量球状体体积。培养 14 天后,形成成熟的结缔组织增生性球体(即平均体积为 0.048 + 0.012 mm3 (451 μm x 462.84 μm)),可用于实验治疗评估。成熟的 ECM 成分包括 I.型胶原、透明质酸、纤连蛋白和层粘连蛋白。
引言
胰腺癌的不良预后与多种原因有关,其中之一是缺乏易于检测的生物标志物,导致发现较晚。另一个主要原因是组织周围较厚的基质,导致血液供应减少。大量细胞外基质 (ECM) 的沉积、细胞间相互作用、内皮细胞、各种免疫细胞、周细胞、增殖的肌成纤维细胞和成纤维细胞群,以及非肿瘤细胞的存在(共同构成结缔组织增生反应)1,构成了导致 PDAC 化疗和放疗耐药性的厚基质2.癌症细胞和基质细胞具有复杂的、动态的和双向的相互作用。尽管某些元素会减轻或加速疾病进展,但大多数过程在肿瘤发展过程中是适应性的1。这提供了一个富含生长因子、促血管生成因子、蛋白酶和粘附分子的环境。这些因子促进血管生成、细胞增殖、转移和侵袭 3,4。它们共同成为肿瘤的免疫和药物特权避难所,导致耐药性。
结纤维增生是一种复杂的混合物,由各种 ECM 蛋白以及免疫细胞和胰腺星状细胞 (PSC) 组成。这些物质一起往往会形成细胞生长的支架。PSC 是基质区室中最大的成分之一5。它们能够产生基质金属蛋白酶 (MMP)、基质金属蛋白酶组织抑制剂 (TIMP) 和癌症相关成纤维细胞 (CAF)6 等酶,这意味着它们可能在促组织增生反应的发展中发挥关键作用。ECM、癌症相关成纤维细胞 (CAF) 和脉管系统是 PDAC 的主要方面。在 CAF 中,肌成纤维细胞和炎性 CAF 被推测参与导致促肿瘤特性的活性串扰7。肿瘤上成纤维细胞的形成越广泛,预后越差 8,9,10。
通过已建立的细胞系进行单层细胞培养仍然是分析药物毒性的有用工具,并且是概念验证和发现研究的良好起点。然而,已建立的细胞培养系缺乏种系 DNA 和临床相关性11。由于它们在平坦的表面上生长,因此与它们作为肿瘤的一部分、异常分裂并失去分化表型12 时相比,它们经历了不同的体外选择标准。总体而言,单细胞培养限制了肿瘤的异质性,因此失去了临床相关性。它们无法准确表示肿瘤微环境(例如 ECM)的复杂性。3D 培养可以更紧密地复制复杂的肿瘤微环境。
3D 培养于 1970 年代被引入,用于健康细胞及其肿瘤对应物13。已使用多种技术通过球体研究恶性组织的形态和结构14。与基质细胞共培养可以模拟 TME 信号。当细胞与星状细胞共培养时,观察到 EMT 标志物上调15。PDAC 球体及其与基质的相互作用可以通过与 ECM 成分共培养来建模。据报道,专门与 PSC 共培养可产生临床相关的药物细胞毒性数据 16,17,18。PSC 还通过各种旁分泌因子19 逃避细胞凋亡和刺激癌细胞增殖,以及诱导 EMT 转换来帮助耐药性。因此,从早期阶段就将 PSC 纳入用于评估药物或药物递送系统成功的标准变得至关重要。在免疫功能低下小鼠中评估两种细胞系的皮下侧腹注射时,与单独的胰腺癌细胞相比,PSC 在体内增强增殖和支持更快生长的能力也在体内得到证实20.
在培养共培养的球状体时,细胞类型与 ECM 组分相互作用的能力也至关重要。据报道,BxPC-3 和 PANC-1 在与胶原蛋白结合方面具有相同的亲和力。这两种细胞系也与层粘连蛋白等效结合,尽管有报道称 BxPC-3 结合得更好 21,22,23,24,25。在迁移方面,Stahle 等人26 证明 PANC-1 细胞的运动速度比 BxPC-3 快 5 倍。据报道,PANC-1 细胞主要以单个细胞的形式迁移,而 BxPC-3 细胞以紧密堆积的片状形式迁移。细胞的选择也会影响肿瘤的大小25.BxPC-3 肿瘤显示比从 PANC-1 获得的肿瘤大27,28,而一项研究证明了相反的29 例。尽管它们的大小和运动性不同,但据报道,这两种细胞都需要长时间的潜伏期才能在小鼠中形成肿瘤。对于 BxPC-3,这个持续时间可能特别长,从 4 周到 4 个月不等25。然而,也有文献表明 BxPC-328 或 BxPC-3 癌症干细胞30 形成可见肿瘤的速度更快,这意味着肿瘤生长持续时间可能存在变化。因此,此处所述的持续时间应仅作为肿瘤生长速率的初始指南。
BxPC-3 细胞形成表面具有松散细胞和致密核心的球状体,而据报道 PANC-1 细胞既能形成多孔但坚固的球状体31 也能形成致密的球状体。据报道,PANC-1 细胞分化程度较低,侵袭性更强32。将 PANC-1 细胞的侵袭性32 放在首位,结合 PANC-1 细胞的较高运动性、形成致密球体的能力以及与 ECM 成分相互作用的能力,选择用于球体研究。
在过去的几年里,球状体培养在临床相关性方面取得了很大的成功,与二维 (2D) 培养相比,其临床相关性具有优势。它的相关性已被用于使用该技术作为动物研究的替代品,并更好地了解肿瘤的生物学特性。球体的临床相关性,特别是与 PSC 共培养时,使其可用于研究球体的各种功能,例如刚度33、TGF-β34、35、36、37、38、E-钙粘蛋白、F-肌动蛋白18、34、36、37、α-SMA34、35、37、38、乳酸脱氢酶 (LDHA)32、HIF-1α35、39、耐药性 16、37、40、细胞迁移41、细胞侵袭37、纤维化35、辐射抗性42、表型变化18、异质性36、细胞相互作用水平39 和显示 ECM 成分37,38,39.许多用于获取所述数据的方案依赖于 Matrigel、悬滴法、打印模具或其他支架来帮助支持球体和 ECM 生长。这些研究通常还涉及使用非人成纤维细胞或从患者身上新鲜分离的星状细胞。虽然使用星状细胞对于肿瘤类似于体内条件至关重要,但与新鲜提取相关的患者间差异使这些研究难以复制。
该协议旨在展示一种易于开发、可重复、临床相关且无支架的模型,从而完全依赖于共培养物自然产生 ECM 的能力。为此,选择了一种简单的共培养方法,该方法涉及 PANC-1 细胞(由于它们自然倾向于以单个细胞形式迁移)和人胰腺星状细胞 (HPaSteC) 的混合物,因为它们的行为类似于干细胞并且具有高度耐药性。以 Durymanov 等人 38的研究为基线,在进一步优化细胞比率和培养基变化之间的持续时间等参数后,建立了下面详述的方案。该方案产生的球体可用作新候选药物评估的模型系统40。
此外,对于不熟悉椭球体培养物的用户,Peirsman 等人43讨论 MISpheroID 知识库开发的工作可能会有所帮助。它建立了一些最低限度的信息指南,可以帮助应对实验室方案之间的异质性。尽管存在一些限制,但该工作表明,培养基、细胞系、球体形成方法和最终球体大小的选择对于确定球体的表型特性至关重要。
研究方案
1. 2D 细胞培养
- 在无菌条件下,在补充有 10% 胎牛血清 (FBS) 的 Dulbecco 改良 Eagle 培养基 (DMEM) 中培养 PANC-1 细胞。传代前长到 70%-80% 汇合,第 20次 传代后不要使用。请参阅步骤 4.2.1 中描述的过程。
注:作为参考点,20 mL 培养基中的 1 x 106 个细胞大约需要 2-3 天才能达到 70-80% 的汇合度。 - 在无菌条件下,使用制造商提供的试剂盒,在补充有 2% FBS、1% PenStrep 和 1% 星状细胞生长补充剂 (SteCGS) 的星状细胞培养基中培养 HPaSteC 细胞。按照制造商的说明(经过一些修改)在聚-L-赖氨酸包被的烧瓶中生长,如步骤 4.2.2 所示。
- 由于使用了胰蛋白酶中和溶液 (TNS),因此在胰蛋白酶消化过程中跳过制造商方案中的 FBS 中和步骤。如步骤 4.2.2.2 所述,用总体积为 10 mL TNS 中和细胞悬液。
注:作为参考点,20 mL 培养基中的 0.5 x 106 个细胞和 1 x 106 个细胞分别需要 3 天和 2 天才能达到 90% 汇合度。 - 以 90% 汇合度收获细胞。请勿使用第 7 代之后的细胞。
- 由于使用了胰蛋白酶中和溶液 (TNS),因此在胰蛋白酶消化过程中跳过制造商方案中的 FBS 中和步骤。如步骤 4.2.2.2 所述,用总体积为 10 mL TNS 中和细胞悬液。
- 将细胞保持在 37 °C,含 5% CO2 的无菌培养箱中,相对湿度为 90%-95%。在 T-75 培养瓶中进行所有细胞培养研究。
2. 用于 96 孔板的聚(2-甲基丙烯酸羟乙酯 (poly-HEMA) 溶液涂层
- 使用 95% 乙醇制备 5 mg/mL 的 Poly-HEMA 溶液,使其在 37 °C 下混合过夜(例如,500 mL 溶液需要 2.5 g Poly-HEMA)
- 在添加搅拌器之前标记起始体积位置。第二天用 95% 乙醇补足溶液中的任何损失。
- 使用 0.22 μm 过滤器在无菌罩中过滤最终溶液,并将其储存在 4 °C 的冰箱中。
注意:Poly-HEMA 用于增加表面的疏水性,从而阻止细胞附着。由于这项研究要求细胞不附着在孔上并以单层形式生长,因此 poly-HEMA 被用作对板的天然低附着特性的额外威慑,从而使它们成为超低附着板。 - 在细胞培养罩内的 96 孔圆形聚苯乙烯底部微孔板的每个孔中加入 50 μL 冷溶液,以涂覆板。
- 将带盖的孔放入 37 °C 的热风烘箱中 3 天,以确保板完全干燥。
- 在细胞接种前,在细胞培养罩中对板进行紫外线消毒 30 分钟。存放在密闭的拉链锁中,以便长期存放,并在使用前消毒。
3. 2D 细胞培养规划
- 安排实验时间,使 PANC-1 细胞在 HPaSteC 细胞达到 90% 的同一天以 70%-80% 的汇合度可用。
注:含有约 100 万个 PANC-1 或 HPaSteC 细胞的小瓶,当在同一天从液氮中培养时,有一些变化,需要 8 天的 PANC-1 培养和 6-7 天的 HPaSteC 培养才能在同一天准备好两种细胞系。
4. 3D 文化增长
- 在开始该过程之前,请参阅 图 1 中的整个过程概述。
注意:PANC-1 和 HPaSteC 都是生物来源的。小心处理 PANC-1(癌细胞系)。 - 胰蛋白酶处理和细胞计数
- 胰蛋白酶和计数 PANC-1 细胞:
- 弃去上清液,用 9 mL HBSS(一次 3 mL)洗涤 PANC-1 细胞。将通风橱中用过的试剂丢弃在 20-25% V/V 漂白剂溶液中,以确保活/活材料完全死亡。
- 用 2 mL 胰蛋白酶对细胞进行胰蛋白酶消化。近 10 分钟后(可能需要更多时间),当所有细胞都分离时,用 10 mL DMEM + 10% FBS 中和悬浮液。从 3 mL 开始,然后进行后续洗涤步骤,每次洗涤使用 1 mL(剩余 7 次洗涤),以确保最大限度地收集胰蛋白酶消化细胞。
- 将每个中和的等分试样汇集到同一个 15 mL 试管中。试管中的最终体积将接近 12 mL(~2 mL 已用 10 mL 培养基中和的胰蛋白酶)。
- 将中和的细胞悬液以 700 x g 离心 2 分钟和 30 秒。弃去上清液,重悬在 1 mL DMEM +10% FBS 中获得的沉淀。从中取出等分试样进行细胞计数,并将从本节获得的值标记为"计数 A"。
- 胰蛋白酶并计数 HPaSteC 细胞。
- 弃去上清液,用 9 mL HBSS(一次 3 mL)洗涤 HPaSteC 细胞。
- 用 2 mL 胰蛋白酶对细胞进行胰蛋白酶消化。近 10 分钟后,当所有细胞都分离时,用 10 mL 胰蛋白酶中和溶液中和悬浮液。从 3 mL 开始,然后进行后续洗涤步骤,每次洗涤使用 1 mL(剩余 7 次洗涤),以确保最大限度地收集胰蛋白酶消化细胞。
- 将每个中和的等分试样汇集到同一个 15 mL 试管中。试管中的最终体积将接近 12 mL(~2 mL 胰蛋白酶,已被 10 mL 中和溶液中和)。
- 将中和的细胞悬液以 700 x g 离心 2 分钟和 30 秒。弃去上清液,重悬在 1 mL 补充的星状细胞培养基中获得的沉淀。从中取出等分试样进行细胞计数,并将从该部分获得的值标记为"计数 B"。
- 胰蛋白酶和计数 PANC-1 细胞:
- 稀释初始细胞悬液
- 如果需要(不超过 0.5 小时),在获得计数 A 和 B 后或在胰蛋白酶消化和中和 PANC-1 和 HPaSteC 后短时间暂停此步骤。将未使用的培养基保持在 37 °C,将细胞悬液保持在室温 (RT; 25 ± 2 °C)。
- 使用先前获得的计数 A 和计数 B,取等分试样并进行相应的稀释(在单独的试管中),使最终体积为 1 mL(稀释剂:两个小瓶的 DMEM + 10% FBS),每种细胞类型的最终计数在 110,000-140,000 个细胞之间。稀释后,验证每次稀释的细胞计数,得到计数 C (PANC-1) 和计数 D (HPaSteC)。
- 如果需要(不超过 15-30 分钟),在获得计数 C 和计数 D 后,在此步骤中暂停。在步骤 4.3.3.2 中完成最终稀释后,不要停止;避免细胞沉降的实验。将未使用的培养基保持在 37 °C,将细胞悬液保持在 RT (25 ± 2 °C)。
- 在 HPaSteC:PANC-1:60:120 下保持每孔所需的最终细胞数。使用 110 个孔进行计算,以考虑超额。以每孔 100 μL 细胞悬液的基值计算(110 个孔的总悬浮液体积为 11 mL,HPaSteC:PANC-1:60:120)。将这种悬浮液放入无菌的 50 mL 离心管中,以便于混合。
- 使用计数 C 和计数 D,并将足够的细胞悬液加标到 DMEM + 10% FBS 溶液中,得到 HPaSteC:PANC-1:60:120,最终体积为 11 mL(11 mL 中有 6,600 个 HPaSteC 细胞和 13,200 个 PANC-1 细胞)。使用 1 mL 移液器通过上下搅拌和移液来充分混合溶液。避免泡沫形成。
- 播种
- 在每孔添加 100 μL 悬浮液之前,在每个步骤中使用 200 μL 或 100 μL 移液器混合最终的悬浮液(通过移动移液器吸头并上下移液来搅拌)。沿孔的一角轻轻加入 100 μL。
- 对多个孔重复使用相同的尖端,除非它脱落。来回混合,在板的前半部分(大约前 43 个孔)的每个孔中加入之间计数到 10 或 15(不是秒)。在下半场(剩余 43 个孔)中,将每个孔之间的混合计数降低到 5-10 个,因为悬浮液体积较小,需要的混合持续时间更短。
- 不要使用重复移液器,因为疏水性 poly-HEMA 涂层会导致悬浮液从板上弹起,导致分布不均匀。
- 填满所有孔后丢弃任何多余的悬浮液。
- 在每孔添加 100 μL 悬浮液之前,在每个步骤中使用 200 μL 或 100 μL 移液器混合最终的悬浮液(通过移动移液器吸头并上下移液来搅拌)。沿孔的一角轻轻加入 100 μL。
- 离心
- 离心含有细胞悬液的最终板,将所有细胞聚在一起形成沉淀。小心地用封口膜将板包裹在板的边缘,以防止在此步骤中受到污染。包装后,用平衡装置以 1000 x g 的速度离心板 2 分钟。
- 将板放回细胞培养罩中(使用乙醇喷雾手套处理),取下封口膜,并将板存放在 37 °C、5% CO2 的培养箱中。任何时候都不要用乙醇-水混合物喷洒板。
- 培养物维护
- 到第 3 天,在光学显微镜下以 4 倍-5 倍的放大倍率观察细胞聚集在一起形成球状体。遵循如下所述的培养维持方案。
- 第 3 天,量出 5-6 mL 的 DMEM + 10% FBS,并沿孔侧面向每个孔中加入 50 μL。
- 添加过程中,请勿以任何方式混合或搅动介质,因为这会损坏球体或导致球体意外去除。每孔的最终体积为 ~150 μL。
- 第 3 天之后,请参阅 图 2 以熟悉孔的结构以及在称为光晕的介质上看到的光反射位置(孔的圆柱形和弯曲部分之间)。在 halo 附近执行操作时要小心,以确保椭球体保持完好无损。
- 第 6 天,测量 10-11 mL 的 DMEM + 10% FBS。使用 1 mL 移液器从多个孔中批量拉出培养基,将培养基拉出直至出现光晕。对整个板执行此操作,然后更换培养基。收集大量上清液并丢弃,或在拉出时丢弃。
- 沿每个孔的侧面添加 100 μL 培养基,用新鲜培养基替换丢弃的培养基。孔中的最终体积将接近 200 μL。
- 请勿将介质拉出光晕,因为这会增加意外拉出椭球体的风险。
- 在第 10/11 天,测量 10-11 mL 的 DMEM + 10% FBS。使用 1 mL 移液器从多个孔中批量拉出培养基,将培养基拉出直至出现光晕。对整个板执行此操作,然后更换培养基。收集大量上清液并丢弃,或在拉出时丢弃。
- 沿每个孔的侧面添加 100 μL 培养基,用新鲜培养基替换丢弃的培养基。孔中的最终体积将接近 200 μL。
- 第 3 天,量出 5-6 mL 的 DMEM + 10% FBS,并沿孔侧面向每个孔中加入 50 μL。
- 到第 3 天,在光学显微镜下以 4 倍-5 倍的放大倍率观察细胞聚集在一起形成球状体。遵循如下所述的培养维持方案。
- 最后一天评估
- 在第 14 天对球体进行药物治疗。使用前在 4 倍物镜下使用明场倒置显微镜对球体进行成像,以确定球体的起始体积。使用以下公式计算体积 (V):
V = 0.5 × L × W2 - 按照上述公式计算球体体积。其中 L 是长轴的长度,W 是宽度(垂直于长轴的最长线)。将所有原始单位从微米转换为毫米,以获得以立方毫米为单位的体积。
- 由于蒸发,第 14 天每个孔的起始体积在 150-200 μL 之间。对于药物治疗,去除培养基,直到每个孔到达光晕,然后用 100 μL 2 倍强度的药物溶液替换,并轻轻混合(轻轻来回混合培养基,同时在每个孔之间计数到 2)。
- 使用 2 倍强度的溶液,使最终药物溶液为 1 倍,并避免从孔中完全去除旧介质,否则可能会干扰球体。在此时间范围的 3 天内使用椭球体。
- 在第 14 天对球体进行药物治疗。使用前在 4 倍物镜下使用明场倒置显微镜对球体进行成像,以确定球体的起始体积。使用以下公式计算体积 (V):
- Spheroid 集合
- 如步骤 4.7.2 中所述,在收集之前测量球体体积。
- 根据实验的需要,在第 14 天或第 17 天收集球状体,从每个孔中去除培养基,直到达到光晕。
- 使用 1 mL 移液器去除培养基,并从多个孔中收集 15 mL 锥形离心管中的上清液。
- 一旦所有孔的介质都处于光晕水平,将 1 mL 移液器的设置降低到 200-300 μL 之间。
- 将板与通风橱或深色背景(例如,试管架)的背景对齐,以查看球体位于底部。
- 轻轻地将吸头插入球体附近(位于光晕下方),并来回吸取少量培养基(例如,目测估计接近 50 μL)以干扰球体。不要将尖端直接放在球体上,因为这会损坏其结构。
- 在此步骤中,不要将所有介质从孔中拉出。牢牢控制拇指在移液器活塞上的移动。
- 置换介质,直到椭球体不再停留在中心,并且可以看到它与背景相反移动。拉起足够的介质以吸出球体并将其移动到所需位置(例如,将其与其他球体汇集在属于同一处理集的孔中)。
- 丢弃废物
- 根据相应实验室环境和健康安全部门的方案,用漂白剂中和后丢弃所有液体样品。高压灭菌并丢弃所有装有生物危害性废物的用过的移液器和烧瓶。
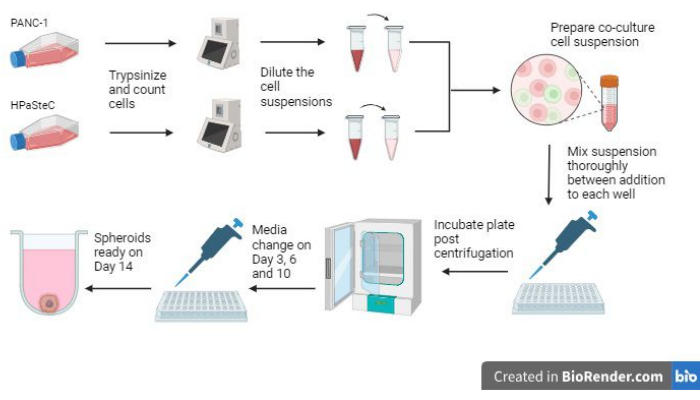
图 1:3D 结缔组织增生性胰腺癌球状体的生长过程概述 (使用 BioRender 生成)。该图概述了所涉及的基本过程;即,对细胞进行胰蛋白酶消化,使用初始细胞计数制备稀释的细胞悬液,使用稀释的细胞悬液制备共培养物,向每个孔中加入细胞悬液,孵育培养物,按照第 14 天的预期进行培养基维护和最终球状体形成。 请单击此处查看此图的较大版本。

图 2:U 形底井的结构。 右图是一个夸张的形状,用于展示井的"光晕"部分。该图旨在定义井的"晕"部分的位置,因为在晕圈上方工作对于球体的生长和避免意外损失至关重要。 请单击此处查看此图的较大版本。
5. ECM 组件和共聚焦显微镜的评估
- 根据 Durymanov 等人 38 描述的方案,使用免疫染色评估 ECM 对药物治疗的反应。
- 将球体汇集在一起,用 100 μL PBS 洗涤两次。包埋在最佳切割温度 (OCT) 组织包埋培养基中,冷冻并保持在 -80 °C。
- 将冷冻的肿瘤块切成 10 μm 切片,将切片固定在丙酮-甲醇 (1:1) 混合物中 15 分钟,并在室温下风干。
- 为了确定 ECM 成分,用兔单克隆抗纤连蛋白一抗、兔多克隆抗 I 型胶原抗体、兔多克隆抗层粘连蛋白抗体和绵羊多克隆抗透明质酸抗体对冷冻切片进行免疫染色。
- 使用用 Alexa Fluor 488 标记的山羊抗兔 IgG 或用 Alexa Fluor 568 偶联的驴抗绵羊作为二抗。
注:一抗和二抗分别以 1:200 和 1:300 稀释。 - 使用配备 20x/0.45 物镜的共聚焦激光扫描显微镜获取所有球状体切片的图像。
结果
培养球体涉及的三个最关键的步骤是初始细胞计数、接种球体时的混合步骤以及及时更换培养基以允许球体生长(图 1)。此外,由于每孔的培养基体积增加,熟悉 图 2 关于第 3 天后的培养基更换对于允许有效的培养基更换至关重要。当根据给定的方向执行所有这些步骤时,发现球体(图 3)的平均体积为 0.048 ± 0.012 mm3 (451 μm x 462.84 μm)(图 4)。已经遇到了细胞可能生长得更好的情况,导致第 14 天的初始平均体积更大,为 0.096 ± 0.014 mm3(611 μm x 560 μm)。多种原因可能导致球状体具有更大的初始体积,例如维持培养箱的温度和湿度或使用早期的细胞传代,与后期传代相比,其活力略有提高。
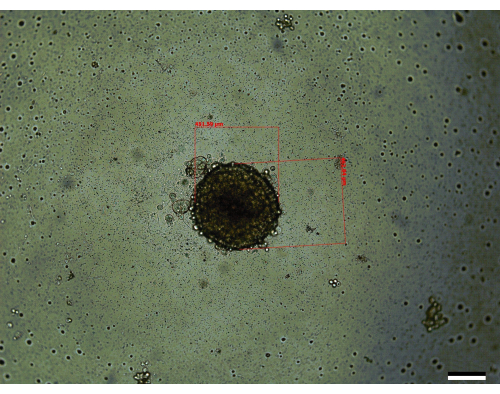
图 3:第 14 天看到的代表性球体(尺寸:451.59 μm x 462.84 μm)。 比例尺 = 200 μm。每个椭球体分别沿其最长轴和最短轴进行测量,并使用方法部分中描述的方程来计算体积。 请单击此处查看此图的较大版本。

图 4:球状体在 17 天内的生长进度。 板 1 和 2 是重复的。误差线表示标准差。该图可用作第 6 天、第 10 天、第 14 天和第 17 天可能看到的球状体体积的近似估计值。 请单击此处查看此图的较大版本。
然而,如果细胞计数不正确,或者细胞悬液没有充分混合,或者最终培养物没有定期维持,或者出现这些错误的组合,则可能导致产生更小的球状体或不完全生长的球状体。当初始优化研究在第 3 天仅在板外围的孔中补充培养基而不是整个板时,也观察到具有相似外观的球体(图 5)。或者,在细胞混合不充分,或者初始计数/稀释错误导致每孔接种的细胞数超过推荐值的情况下,每孔可能会看到多个球状体。当以 240:120 的比例使用 PANC-1:HPaSteC 细胞时,也看到了类似的发现(图 6)。当球体按方向生长时,也可能偶尔看到这种情况,但这种球体的数量较少(例如,4/96 孔可能每个孔包含两个球体,而不是一个)。在遇到多个球体的情况下,请避免使用具有多个球体的孔,或者在处理这些球体时记下体积的变化。移液器吸头浸入光晕以下的介质更换不当(图 1)也可能导致球体意外丢失。

图 5:第 14 天生长不良的球体的代表性图像。 比例尺 = 200 μm。在这里,细胞没有很好地聚集,因此很难测量球体的长度和宽度。 请单击此处查看此图的较大版本。
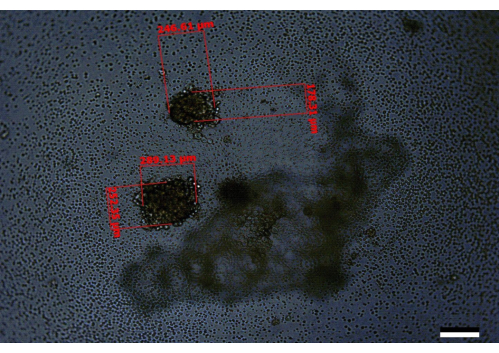
图 6:第 14 天看到的包含两个生长不良的球状体的孔的代表性图像。 比例尺 = 200 μm。在这里,其中一个球体的尺寸为 246.61 μm x 178.31 μm,另一个球体的尺寸为 289.13 μm x 252.35 μm。这是一个初始稀释或用于开始实验的细胞质量可能存在问题的示例。 请单击此处查看此图的较大版本。
球状体还发育出具有四种主要 ECM 成分的 ECM:胶原蛋白 I、层粘连蛋白、透明质酸和纤连蛋白。在实验室之前发表的研究中,共培养优于单独 PANC-1 的优势已经证明,同型 PANC-1 球体显示弥漫性胶原蛋白、无纤连蛋白和较少的透明质酸沉积。
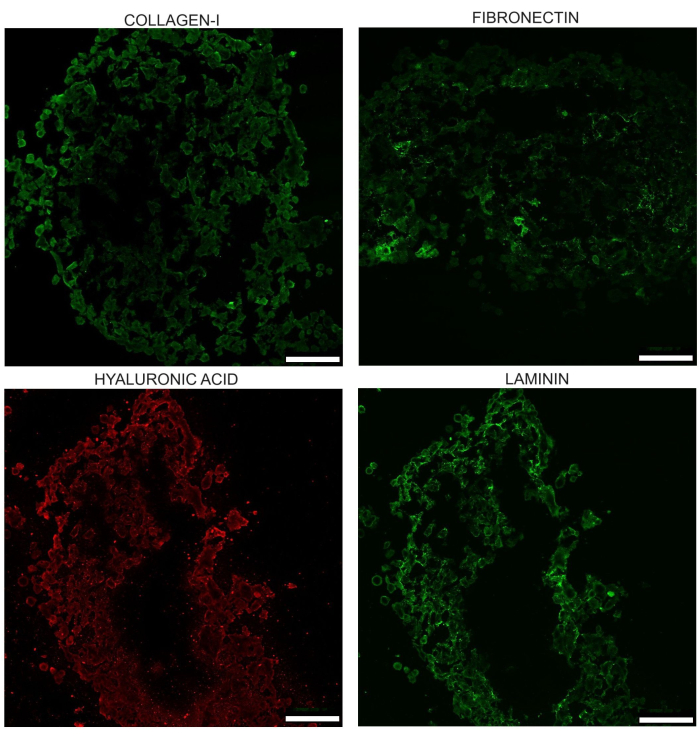
图 7:第 17 天在未经处理的球状体中观察到的四种主要 ECM 成分的代表性图像:I 型胶原、层粘连蛋白、透明质酸和纤连蛋白。 这些图像是在对球状体的冷冻切片进行免疫染色后获得的。这些图像的亮度已均匀增加,以帮助突出外观差异。在进行强度测量时,必须调整组织受损或缺失的区域。比例尺 = 100 μm。 请点击此处查看此图的较大版本。
讨论
选择用于生长球体的持续时间和细胞比率基于先前报道的研究38。当尝试通过用 NIH3T3 细胞代替 HPaSteC 细胞来优化这些研究时,发现球状体体积和细胞凋亡模式与报告的优化参数非常相似(PANC-1:NIH3T3:120:12),当 PANC-1:HPaSteC 比率为 120:60。尽管这些研究仅测量细胞凋亡至第 14 天,但在此过程中描述的方案继续使用球体直到第 17 天,因为在第 14 天和第 17 天之间没有观察到碎片形成的明显增加。作为对照,在第 17 天评估的所有球体始终包括一个未处理的臂,作为球体体积和细胞凋亡自然增加的基线。
接种和培养球体的过程有 3 个关键步骤:正确计数、添加细胞前混合以及维持培养物。由于该过程依赖于使用少量的 PANC-1 和 HPaSteC 细胞,因此拥有正确的计数和正确的稀释度变得至关重要。这对于 HPaSteC 细胞尤其重要,因为这些细胞比 PANC-1 细胞小,很容易低估细胞数量。因此,仔细计数细胞至关重要。低估计数会导致形成多个椭球体,而高估会导致椭球体形成不良。
在所有步骤中充分混合悬架也变得至关重要。在预期细胞可能会沉降的情况下工作有助于防止混入不足并确保细胞分布均匀。在为多个板(例如,两个板)准备球体时,建议每个孔之间的来回混合次数(步骤 4.4.1)至少为 20。当第一个板完成一半时,可以减少到 15,然后是 10,当开始下一个板时,可以减少到 5,随着第二个板的后半部分的进展,可以减少到 5。用移液器平行进行搅拌运动以来回混合有助于提高混合程度。可以考虑的一个想法是让第二个人在准备两个板子时参与进来,因为这可以提高速度和混合效率。在这种情况下,两个人可以通过在引擎盖的相对角落工作,同时使用引擎盖和他们各自的悬架和板。
维持细胞培养物对于确保球状体始终具有足够的营养供应是必要的。第 3 天和第 6 天的培养基补充剂最为关键,因为这是细胞生长的地方,需要充分喂养。第 6 天和第 10/11 天的培养基更换也可能很棘手,因为它们涉及收集一些上清液以丢弃旧的培养基。此步骤必须小心地完成,轻轻拉出介质直到 "光晕" ,切勿超过。这有助于避免介质吸入离球体太近,以及在更换介质期间球体的意外损失。
该方法具有很大的优势,因为它易于复制并且不需要任何模具或脚手架材料,这与我们之前引用的方法32、34、35、36、37、39 不同。此外,使用的培养基是标准细胞培养基,与 EGM-2 培养基39、星状细胞培养基和 DMEM-FBS35的混合物或单独的培养基相比,它相对便宜,具体取决于细胞类型34。这一优势对于实验室之间的可翻译性和易于设置变得至关重要。该工艺也可以扩大到多个板,但可能需要每两个板一个人。球体的稳健性也使其能够在搅拌条件下进行评估。此步骤在进行涉及球状体的细胞药代动力学或 dug 释放和吸收研究时特别有用。
尽管有其优点,但该方法的一个局限性是它在种子种植步骤中需要非常彻底的混合。这可能会变得耗时且耗费体力。绕过这种情况的一种可能方法包括使用经过充分消毒的磁珠,以在接种过程中保持恒定的搅拌条件。收集椭球体也很棘手,需要一些练习。球体也需要时间来生长,因此需要仔细规划,以确保人员和供应可用于介质更换。
总而言之,开发了一种简单且可重复的方法来生产临床相关的结缔组织增生性 3D 球体。球体很坚固,能够产生 ECM 成分:胶原蛋白 I、层粘连蛋白、透明质酸和纤连蛋白。生成这些球体的简单性具有独特的优势,即易于重现和易于适应变化,例如包括第三个细胞系。该模型的另一个独特优势是它对治疗40 具有抵抗力。这有助于增加其临床相关性,并确保只选择最有效的药物来推进并用于治疗胰腺癌。此外,这些球体可以收集并植入小鼠体内,以提供可重复的结纤维增生性肿瘤用于 体内 分析38,也可用于检查不同大小的纳米颗粒44的渗透性,如前所述。
披露声明
作者没有什么可披露的。
致谢
所描述的工作得到了南达科他州州长经济发展办公室、南达科他州董事会竞争研究资助计划 (SD-BOR-CRGP) 和南达科他州立大学药物科学系的支持。
材料
| Name | Company | Catalog Number | Comments |
| Axio Observer inverted microscope | Carl Zeiss | 0450-354 | |
| Cellometer Auto T4 | Nexcelom Bioscience LLC | Auto-T4 | |
| DMEM, powder, high glucose | Gibco | 12100046 | |
| Donkey anti-sheep conjugated with Alexa Fluor 568 | Abcam | ab175712 | |
| Fetal Bovine Serum | Cytiva | SH3091003HI | |
| Goat antirabbit IgG labeled with Alexa Fluor 488 | Abcam | ab150077 | |
| Hanks Balanced Salt Solution (HBSS) | Gibco | 14175145 | |
| Human Pancreatic Stellate Cells (HPaSteC) | ScienCell | 3830 | |
| Microscope Nikon | Nikon | Eclipse Ts 100 | |
| Nunc 96-Well Polystyrene Round Bottom Microwell Plates | Thermo Scientific | 12-565-331 | |
| Olympus Fluoview FV1200 confocal laser | Olympus | N/A | Discontinued product |
| PANC-1 | ATCC | CRL-1469 | |
| Poly-HEMA | Sigma | P3932 | |
| Rabbit polyclonal anti-laminin antibodies | Abcam | ab11575 | |
| Rabbit polyclonal anti-type I collagen antibodies | Abcam | ab34710 | |
| Sheep polyclonal anti-hyaluronic acid antibodies | Abcam | ab53842 | |
| Stellate cell media complete kit | ScienCell | 5301 | |
| Trypsin | MP Biomedicals, LLC | 153571 | Trypsin solution prepared according to manufacturers protocol and used at 0.25%w/v |
| Trypsin Neutralization Solution (TNS) | ScienCell | 103 |
参考文献
- Hingorani, S. R. Epithelial and stromal co-evolution and complicity in pancreatic cancer. Nat Rev Cancer. 23 (2), 57-77 (2023).
- Laklai, H., et al. Genotype tunes pancreatic ductal adenocarcinoma tissue tension to induce matricellular fibrosis and tumor progression. Nat Med. 22 (5), 497-505 (2016).
- Binker, M. G., Binker-Cosen, M. J., Binker-Cosen, A. A., Cosen-Binker, L. I. Microenvironmental factors and extracellular matrix degradation in pancreatic cancer. J Pancreas. 15 (4), 280-285 (2014).
- Spano, D., Zollo, M. Tumor microenvironment: a main actor in the metastasis process. Clin Exp Metastasis. 29 (4), 381-395 (2012).
- Ware, M. J., et al. Generation of an in vitro 3D PDAC stroma rich spheroid model. Biomaterials. 108, 129-142 (2016).
- Sunami, Y., Häußler, J., Kleeff, J. Cellular heterogeneity of pancreatic stellate cells, mesenchymal stem cells, and cancer-associated fibroblasts in pancreatic cancer. Cancers. 12 (12), 3770 (2020).
- Öhlund, D., et al. Distinct populations of inflammatory fibroblasts and myofibroblasts in pancreatic cancer. J Exp Med. 214 (3), 579-596 (2017).
- Pandol, S., Edderkaoui, M., Gukovsky, I., Lugea, A., Gukovskaya, A. Desmoplasia of pancreatic ductal adenocarcinoma. Clin Gastroenterol Hepatol. 7 (11), S44-S47 (2009).
- Watanabe, I., et al. Advanced pancreatic ductal cancer: fibrotic focus and β-catenin expression correlate with outcome. Pancreas. 26 (4), 326-333 (2003).
- Hu, G., et al. Tumor-infiltrating podoplanin+ fibroblasts predict worse outcome in solid tumors. Cell Physiol Biochem. 51 (3), 1041-1050 (2018).
- Kapałczyńska, M., et al. 2D and 3D cell cultures-a comparison of different types of cancer cell cultures. Arch Med Sci. 14 (4), 910-919 (2018).
- Monberg, M. E., et al. Occult polyclonality of preclinical pancreatic cancer models drives in vitro evolution. Nat Commun. 13 (1), 3652 (2022).
- Emerman, J. T., Pitelka, D. R. Maintenance and induction of morphological differentiation in dissociated mammary epithelium on floating collagen membranes. In Vitro. 13 (5), 316-328 (1977).
- Kelm, J. M., Timmins, N. E., Brown, C. J., Fussenegger, M., Nielsen, L. K. Method for generation of homogeneous multicellular tumor spheroids applicable to a wide variety of cell types. Biotechnol Bioeng. 83 (2), 173-180 (2003).
- Kikuta, K., et al. Pancreatic stellate cells promote epithelial-mesenchymal transition in pancreatic cancer cells. Biochem Biophys Res Commun. 403 (3-4), 380-384 (2010).
- Lee, J. -. H., et al. Microfluidic co-culture of pancreatic tumor spheroids with stellate cells as a novel 3D model for investigation of stroma-mediated cell motility and drug resistance. J Exp Clin Cancer Res. 37 (1), 4 (2018).
- Wong, C. -. W., Han, H. -. W., Tien, Y. -. W., Hsu, S. -. H. Biomaterial substrate-derived compact cellular spheroids mimicking the behavior of pancreatic cancer and microenvironment. Biomaterials. 213, 119202 (2019).
- Liu, X., et al. 3D heterospecies spheroids of pancreatic stroma and cancer cells demonstrate key phenotypes of pancreatic ductal adenocarcinoma. Transl Oncol. 14 (7), 101107 (2021).
- Vonlaufen, A., et al. Pancreatic stellate cells: partners in crime with pancreatic cancer cells. Cancer Res. 68 (7), 2085-2093 (2008).
- Bachem, M. G., et al. Pancreatic carcinoma cells induce fibrosis by stimulating proliferation and matrix synthesis of stellate cells. Gastroenterology. 128 (4), 907-921 (2005).
- Greco, E., et al. Pancreatic cancer cells invasiveness is mainly affected by interleukin-1β not by transforming growth factor-β1. Int J Biol Markers. 20 (4), 235-241 (2005).
- Arao, S., Masumoto, A., Otsuki, M. β1 integrins play an essential role in adhesion and invasion of pancreatic carcinoma cells. Pancreas. 20 (2), 129-137 (2000).
- Sawai, H., Yamamoto, M., Okada, Y., Sato, M., Akamo, Y., Takeyama, H., Manabe, T. Alteration of integrins by Interleukin-1alpha in human pancreatic cancer cells. Pancreas. 23 (4), 399-405 (2001).
- Chen, J., et al. Expression and function of the epidermal growth factor receptor in physiology and disease. Physiol Rev. 96 (3), 1025-1069 (2016).
- Deer, E. L., et al. Phenotype and genotype of pancreatic cancer cell lines. Pancreas. 39 (4), 425 (2010).
- Stahle, M., et al. Mechanisms in LPA-induced tumor cell migration: critical role of phosphorylated ERK. J Cell Sci. 116, 3835-3846 (2003).
- Aubert, M., et al. Decrease of human pancreatic cancer cell tumorigenicity by α1, 3galactosyltransferase gene transfer. Int J Cancer. 107 (6), 910-918 (2003).
- Miknyoczki, S. J., Chang, H., Klein-Szanto, A., Dionne, C. A., Ruggeri, B. A. The Trk tyrosine kinase inhibitor CEP-701 (KT-5555) exhibits significant antitumor efficacy in preclinical xenograft modelsof human pancreatic ductal adenocarcinoma. Clin Cancer Res. 5 (8), 2205-2212 (1999).
- Fukasawa, M., Korc, M. Vascular endothelial growth factor-trap suppresses tumorigenicity of multiple pancreatic cancer cell lines. Clin Cancer Res. 10 (10), 3327-3332 (2004).
- Hernández-Camarero, P., et al. Pancreatic (pro) enzymes treatment suppresses BXPC-3 pancreatic Cancer Stem Cell subpopulation and impairs tumour engrafting. Sci Rep. 9 (1), 11359 (2019).
- Ware, M. J., et al. Generation of homogenous three-dimensional pancreatic cancer cell spheroids using an improved hanging drop technique. Tissue Eng Part C Methods. 22 (4), 312-321 (2016).
- Longati, P., et al. 3D pancreatic carcinoma spheroids induce a matrix-rich, chemoresistant phenotype offering a better model for drug testing. BMC Cancer. 13, 95 (2013).
- Kpeglo, D., et al. Modeling the mechanical stiffness of pancreatic ductal adenocarcinoma. Matrix Biol Plus. 14, 100109 (2022).
- Jang, S. -. D., et al. Anti-cancer activity profiling of chemotherapeutic agents in 3D co-cultures of pancreatic tumor spheroids with cancer-associated fibroblasts and macrophages. Cancers. 13 (23), 5955 (2021).
- Pednekar, K. P., Heinrich, M. A., van Baarlen, J., Prakash, J. Novel 3D µtissues mimicking the fibrotic stroma in pancreatic cancer to study cellular interactions and stroma-modulating therapeutics. Cancers. 13 (19), 5006 (2021).
- Kim, S. -. K., et al. Phenotypic heterogeneity and plasticity of cancer cell migration in a pancreatic tumor three-dimensional culture model. Cancers. 12 (5), 1305 (2020).
- Hwang, H. J., Oh, M. -. S., Lee, D. W., Kuh, H. -. J. Multiplex quantitative analysis of stroma-mediated cancer cell invasion, matrix remodeling, and drug response in a 3D co-culture model of pancreatic tumor spheroids and stellate cells. J Exp Clin Cancer Res. 38 (1), 258 (2019).
- Durymanov, M., et al. Subcutaneous inoculation of 3D pancreatic cancer spheroids results in development of reproducible stroma-rich tumors. Transl Oncol. 12 (1), 180-189 (2019).
- Giustarini, G., Teng, G., Pavesi, A., Adriani, G. Characterization of 3D heterocellular spheroids of pancreatic ductal adenocarcinoma for the study of cell interactions in the tumor immune microenvironment. Front Oncol. 13, 1156769 (2023).
- Alseud, K., et al. Synthesis and biological activity of 11-oxygenated and heterocyclic estrone analogs in pancreatic cancer monolayers and 3D spheroids. Bioorg Med Chem. , (2024).
- Fitzgerald, A. A., et al. Fibroblast activation protein regulates natural killer cell migration, extravasation and tumor infiltration. bioRxiv. , 429622 (2021).
- Wishart, G., Gupta, P., Schettino, G., Nisbet, A., Velliou, E. 3D tissue models as tools for radiotherapy screening for pancreatic cancer. Br J Radiol. 94 (1120), 20201397 (2021).
- Peirsman, A., et al. MISpheroID: a knowledgebase and transparency tool for minimum information in spheroid identity. Nat Methods. 18 (11), 1294-1303 (2021).
- Durymanov, M., Kroll, C., Permyakova, A., Reineke, J. Role of endocytosis in nanoparticle penetration of 3D pancreatic cancer spheroids. Mol Pharm. 16 (3), 1074-1082 (2019).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。