Method Article
Croissance de sphéroïdes tridimensionnels desmoplastiques du cancer du pancréas à partir de la co-culture
Dans cet article
Résumé
Le cancer du pancréas reste l’un des cancers les plus difficiles à traiter. Par conséquent, il est essentiel que les modèles précliniques évaluant l’efficacité du traitement soient reproductibles et cliniquement pertinents. Ce protocole décrit une procédure simple de co-culture pour générer des sphéroïdes desmoplastiques reproductibles et cliniquement pertinents.
Résumé
L’adénocarcinome canalaire pancréatique (PDAC) est l’un des cancers les plus meurtriers avec un taux de survie à 5 ans de <12 %. Le plus grand obstacle au traitement est la matrice extracellulaire desmoplastique dense (MEC) qui entoure la tumeur et réduit la vascularisation, généralement appelée desmoplasie. Une variété de combinaisons et de formulations de médicaments ont été testées pour traiter le cancer, et bien que beaucoup d’entre eux montrent un succès préclinique, ils échouent cliniquement. Il devient donc important de disposer d’un modèle cliniquement pertinent capable de prédire la réponse de la tumeur au traitement. Ce modèle a déjà été validé contre des tumeurs cliniques réséquées. Ici, un protocole simple pour cultiver des sphéroïdes de coculture tridimensionnelle (3D) desmoplastiques est décrit qui peut générer naturellement une ECM robuste et ne nécessite aucune source matricielle externe ou échafaudage pour soutenir leur croissance.
En bref, les cellules stellaires pancréatiques humaines (HPaSteC) et les cellules PANC-1 sont utilisées pour préparer une suspension contenant les cellules dans un rapport de 1:2, respectivement. Les cellules sont plaquées dans une plaque en U à 96 puits à faible fixation recouverte de poly-HEMA. La plaque est centrifugée pour permettre aux cellules de former une première pastille. La plaque est stockée dans l’incubateur à 37 °C avec 5% de CO2, et le milieu est remplacé tous les 3 jours. Les plaques peuvent être imagées à des intervalles désignés pour mesurer le volume des sphéroïdes. Après 14 jours de culture, des sphéroïdes desmoplastiques matures se forment (c.-à-d. un volume moyen de 0,048 + 0,012 mm3 (451 μm x 462,84 μm)) et peuvent être utilisés pour l’évaluation du traitement expérimental. Les composants matures de la MEC comprennent le collagène-I, l’acide hyaluronique, la fibronectine et la laminine.
Introduction
Le mauvais pronostic du cancer du pancréas est associé à diverses raisons, parmi lesquelles son manque de biomarqueurs facilement détectables conduisant à une détection tardive. Une autre raison majeure est l’épais stroma entourant le tissu, ce qui entraîne une réduction de l’apport sanguin. Le dépôt de grandes quantités de matrice extracellulaire (MEC), l’interaction cellule-cellule, les cellules endothéliales, diverses cellules immunitaires, les péricytes, les myofibroblastes en prolifération et la population de fibroblastes, et la présence de cellules non néoplasiques (constituant ensemble la réaction desmoplastique)1, constituent le stroma épais responsable de la résistance à la chimiothérapie et à la radiothérapiedu PDAC2. Les cellules cancéreuses et stromales ont une interaction complexe, dynamique et bidirectionnelle. Bien que certains éléments atténuent ou accélèrent la progression de la maladie, la plupart des processus sont adaptatifs au cours du développement de la tumeur1. Cela fournit un environnement riche en facteurs de croissance, en facteurs proangiogéniques, en protéases et en molécules d’adhésion. Ces facteurs favorisent l’angiogenèse, la prolifération cellulaire, les métastases et l’invasion 3,4. Ensemble, ils constituent un sanctuaire immunitaire et médicamenteux privilégié pour la tumeur, ce qui entraîne une résistance aux médicaments.
La desmoplasie est un mélange complexe composé de diverses protéines ECM, ainsi que de cellules immunitaires et de cellules stellaires pancréatiques (PSC). Ensemble, ils ont tendance à former un échafaudage pour la croissance des cellules. Les CSP sont l’un des plus grands composants du compartiment stromal5. Leur capacité à produire des enzymes telles que les métalloprotéases matricielles (MMP), les inhibiteurs tissulaires des métalloprotéases matricielles (TIMP) et les fibroblastes associés au cancer (CAF)6 implique qu’ils sont susceptibles de jouer un rôle essentiel dans le développement de la réaction desmoplastique. L’ECM, les fibroblastes associés au cancer (CAF) et le système vasculaire sont les aspects cardinaux de la PDAC. Parmi les CAF, on suppose que les CAF, les myofibroblastes et les CAF inflammatoires sont impliqués dans la diaphonie active responsable des propriétés pro-tumorales7. Plus les formations fibroblastiques sur la tumeur sont étendues, plus le pronostic est sombre 8,9,10.
La culture cellulaire monocouche à travers des lignées cellulaires établies continue de rester un outil utile pour analyser la toxicité des médicaments et constitue un bon point de départ pour les études de preuve de concept et de découverte. Les lignées de culture cellulaire établies, cependant, manquent d’ADN germinal et de relatabilité clinique11. Comme ils sont cultivés sur des surfaces planes, ils subissent des critères de sélection in vitro différents par rapport à lorsqu’ils font partie de la tumeur, se divisent anormalement et perdent leur phénotypedifférencié 12. Dans l’ensemble, les cultures unicellulaires limitent l’hétérogénéité tumorale et perdent donc leur pertinence clinique. Ils sont incapables de représenter avec précision la complexité du microenvironnement de la tumeur (par exemple, l’ECM). La culture 3D peut reproduire plus fidèlement le microenvironnement tumoral complexe.
La culture 3D a été introduite dans les années 1970 pour les cellules saines et leurs homologues néoplasiques13. Plusieurs techniques ont été utilisées pour étudier la morphologie et l’architecture des tissus malins à travers les sphéroïdes14. Les co-cultures avec des cellules stromales peuvent modéliser les signaux TME. Une régulation à la hausse des marqueurs EMT a été observée lorsque les cellules ont été co-cultivées avec des cellules stellaires15. Les sphéroïdes PDAC et leur interaction avec le stroma peuvent être modélisés par co-culture avec des composants ECM. Il a été rapporté que la co-culture spécifique avec des CSP produisait des données cliniquement pertinentes sur la cytotoxicité des médicaments 16,17,18. Les CSP contribuent également à la résistance aux médicaments en échappant à l’apoptose et en stimulant la prolifération des cellules cancéreuses par le biais de divers facteurs paracrines19 et en induisant la transition de l’EMT. Il devient donc essentiel d’inclure les CSP dès les premiers stades dans les critères utilisés pour évaluer le succès d’un médicament ou d’un système d’administration de médicaments. La capacité de la CSP à améliorer la prolifération et à favoriser une croissance plus rapide en combinaison, par rapport aux cellules cancéreuses du pancréas seules, a également été observée in vivo lorsque des injections sous-cutanées du flanc des deux lignées cellulaires ont été évaluées chez des souris immunodéprimées20.
La capacité d’un type cellulaire à interagir avec les composants de la MEC est également essentielle à prendre en compte lors de la culture de sphéroïdes co-cultivés. Il a été rapporté que BxPC-3 et PANC-1 ont des affinités égales pour se lier au collagène. Les deux lignées cellulaires se lient également de manière équivalente à la laminine, bien qu’il ait été rapporté que BxPC-3 se lie mieux 21,22,23,24,25. En termes de migration, Stahle et al.26 ont démontré une motilité 5 fois plus rapide pour les cellules PANC-1 par rapport aux cellules BxPC-3. Il a également été rapporté que les cellules PANC-1 migrent principalement en tant que cellules uniques, tandis que les cellules BxPC-3 migrent en tant que feuille serrée. Le choix des cellules affecte également la taille de la tumeur25. Les tumeurs BxPC-3 se sont révélées être plus grandes27,28 que celles obtenues à partir de PANC-1, tandis qu’une étude a démontré le cas opposé29. Malgré leurs différences de taille et de motilité, il a été rapporté que les deux cellules ont besoin de longues périodes de latence pour former des tumeurs chez la souris. Cette durée peut être particulièrement longue pour BxPC-3, allant de 4 semaines à 4 mois25. Cependant, il existe également de la littérature où les cellules souches cancéreuses BxPC-328 ou BxPC-330 ont formé des tumeurs visibles plus rapidement, ce qui implique qu’il pourrait y avoir une variation observée dans les durées de croissance tumorale. Les durées indiquées ici ne doivent donc servir que de première indication pour les taux de croissance tumorale.
Les cellules BxPC-3 forment des sphéroïdes avec des cellules lâches à la surface et des noyaux denses, tandis que les cellules PANC-1 forment à la fois des sphéroïdes31 poreux mais robustes ainsi que des sphéroïdes compacts. Les cellules PANC-1 se sont également révélées moins différenciées et plus agressives32. En gardant la nature agressive32 à l’avant-plan, combinée à la motilité plus élevée des cellules PANC-1, à leur capacité à former des sphéroïdes compacts et à leur capacité à interagir avec les composants ECM, les cellules PANC-1 ont été choisies pour les études de sphéroïdes.
Au cours des dernières années, la culture de sphéroïdes a connu beaucoup de succès en démontrant un avantage dans sa pertinence clinique par rapport aux cultures bidimensionnelles (2D). Sa pertinence a été mise à profit pour utiliser cette technique comme substitut aux études animales et pour mieux comprendre la biologie des tumeurs. La pertinence clinique des sphéroïdes, en particulier lorsqu’ils sont co-cultivés avec des CSP, a permis leur utilisation pour étudier diverses fonctions du sphéroïde telles que la rigidité33, l’expression du TGF-β 34,35,36,37,38, l’E-cadhérine, l’actine F 18,34,36,37, la α-SMA 34,35,37,38, lactate déshydrogénase (LDHA)32, HIF-1α35,39, résistance aux médicaments 16,37,40, migration cellulaire41, invasion cellulaire37, fibrose 35, résistance aux radiations42, changements phénotypiques18, hétérogénéité36, niveaux cellulaires d’interactions39 et démontrer les composants ECM37,38,39. La plupart des protocoles utilisés pour obtenir les données décrites s’appuient sur Matrigel, la méthode de la goutte suspendue, des moules imprimés ou d’autres échafaudages pour aider à soutenir la croissance des sphéroïdes et de l’ECM. Les études impliquent également généralement l’utilisation de cellules fibroblastiques non humaines ou de cellules stellaires fraîchement isolées de patients. Bien que l’utilisation de cellules stellaires soit essentielle pour que les tumeurs ressemblent à des conditions in vivo, la variabilité inter-patients associée aux extractions récentes rend ces études difficiles à reproduire.
Ce protocole vise à démontrer un modèle facile à développer, reproductible, cliniquement pertinent et exempt d’échafaudage, s’appuyant ainsi exclusivement sur les capacités des co-cultures à générer naturellement l’ECM. Pour ce faire, une méthode de co-culture simple impliquant un mélange de cellules PANC-1 (en raison de leur tendance naturelle à migrer en tant que cellules uniques) et de cellules stellaires pancréatiques humaines (HPaSteC) a été choisie, en raison de leur capacité à se comporter comme des cellules souches et à être très résistantes aux médicaments. En utilisant les études de Durymanov et al.38comme référence, le protocole détaillé ci-dessous a été établi après avoir optimisé davantage de paramètres tels que les ratios cellulaires et les durées entre les changements de milieux. Les sphéroïdes issus de ce protocole peuvent être utilisés comme système modèle pour l’évaluation de nouveaux candidats médicaments40.
De plus, pour les utilisateurs qui ne sont pas familiers avec la culture des sphéroïdes, les travaux de Peirsman et al.43sur le développement de la base de connaissances MISpheroID peuvent être utiles. Il établit des lignes directrices minimales en matière d’information qui pourraient aider à faire face à l’hétérogénéité entre les protocoles de laboratoire. Bien qu’avec certaines limites, le travail a démontré que le choix des milieux de culture, des lignées cellulaires, de la méthode de formation des sphéroïdes et de la taille finale des sphéroïdes sont essentiels pour déterminer les propriétés phénotypiques des sphéroïdes.
Protocole
1. Culture cellulaire 2D
- Cultivez des cellules PANC-1 dans le milieu Eagle modifié de Dulbecco (DMEM), complété par 10 % de sérum de veau fœtal (FBS) dans des conditions stériles. Cultivez jusqu’à 70%-80% de confluence avant les passages, et ne pas utiliser au-delà du 20èmepassage. Reportez-vous au processus décrit à l’étape 4.2.1.
REMARQUE : À titre de référence, 1 x 106 cellules dans 20 ml de milieu a besoin d’environ 2 à 3 jours pour atteindre une confluence de 70 à 80 %. - Cultivez des cellules HPaSteC dans des milieux cellulaires étoilés complétés par 2 % de FBS, 1 % de PenStrep et 1 % de supplément de croissance cellulaire stellaire (SteCGS) à l’aide du kit fourni par le fabricant dans des conditions stériles. Cultiver selon les instructions du fabricant (avec quelques modifications) comme indiqué à l’étape 4.2.2 dans une fiole enrobée de poly-L-Lysine.
- Sautez l’étape de neutralisation du FBS pendant la trypsinisation du protocole du fabricant puisque la solution de neutralisation de la trypsine (TNS) est utilisée. Neutraliser la suspension cellulaire avec un volume global de 10 mL de TNS comme décrit à l’étape 4.2.2.2.
REMARQUE : À titre de référence, 0,5 x 106 cellules et 1 x 106 cellules dans 20 ml de milieu ont besoin de 3 jours et 2 jours, respectivement, pour atteindre une confluence de 90 %. - Récoltez les cellules à 90% de confluence. N’utilisez pas les cellules au-delà du passage 7.
- Sautez l’étape de neutralisation du FBS pendant la trypsinisation du protocole du fabricant puisque la solution de neutralisation de la trypsine (TNS) est utilisée. Neutraliser la suspension cellulaire avec un volume global de 10 mL de TNS comme décrit à l’étape 4.2.2.2.
- Maintenir les cellules à 37 °C, avec 5 % de CO2, dans des incubateurs stériles avec une humidité relative de 90 % à 95 %. Effectuer toutes les études de culture cellulaire dans une fiole T-75.
2. Revêtement en solution de poly(2-hydroxyéthylméthacrylate (poly-HEMA) pour plaque à 96 puits
- Préparez une solution de poly-HEMA à 5 mg/mL avec de l’éthanol à 95 % en la laissant mélanger toute la nuit à l’aide d’un agitateur chauffé à 37 °C. (par exemple, 500 mL de solution nécessitent 2,5 g de poly-HEMA)
- Marquez l’emplacement du volume de départ avant d’ajouter l’agitateur. Utilisez de l’éthanol à 95 % pour compenser toute perte dans la solution le lendemain.
- Filtrez la solution finale dans une hotte stérile à l’aide d’un filtre de 0,22 μm et conservez-la au réfrigérateur à 4 °C.
REMARQUE : Le poly-HEMA est utilisé pour augmenter l’hydrophobicité d’une surface, ce qui dissuade les cellules de s’y fixer. Comme cette étude exige que les cellules ne se fixent pas aux puits et ne se développent pas en monocouche, le poly-HEMA est utilisé comme moyen de dissuasion supplémentaire à la caractéristique naturelle de faible fixation des plaques, ce qui en fait des plaques de fixation ultra-basses. - Ajouter 50 μL de la solution froide dans chaque puits d’une plaque de micropuits ronde en polystyrène à fond de polystyrène de 96 puits à l’intérieur d’une hotte de culture cellulaire pour enrober la plaque.
- Laissez les puits avec le couvercle dans un four à air chaud à 37 °C pendant 3 jours pour vous assurer que les plaques sont complètement sèches.
- Stérilisez les plaques par UV pendant 30 min dans le capot de culture cellulaire avant l’ensemencement cellulaire. Rangez-le dans un verrou à fermeture éclair hermétiquement fermé pour un stockage à long terme et stérilisez-le avant utilisation.
3. Planification de la culture cellulaire 2D
- Chronométrez l’expérience de manière à ce que les cellules PANC-1 soient disponibles à 70 % à 80 % de confluence le même jour où les cellules HPaSteC atteignent 90 %.
REMARQUE : Les flacons contenant environ 1 million de cellules de PANC-1 ou de HPaSteC, lorsqu’ils sont extraits d’azote liquide le même jour, avec quelques variations, nécessitent 8 jours de culture de PANC-1 et 6 à 7 jours de culture HPaSteC pour que les deux lignées cellulaires soient prêtes le même jour.
4. 3D croissance de la culture
- Reportez-vous à la vue d’ensemble de l’ensemble du processus à la figure 1 avant de commencer le processus.
ATTENTION : PANC-1 et HPaSteC sont tous deux d’origine biologique. Manipulez PANC-1 (lignée cellulaire cancéreuse) avec précaution. - Trypsinzing et comptage des cellules
- Trypsinze et comptage des cellules PANC-1 :
- Jeter le surnageant et laver les cellules PANC-1 avec 9 mL de HBSS (3 mL à la fois). Jetez les réactifs usagés dans la hotte dans une solution d’eau de Javel à 20-25 % V/V pour assurer la mort complète du matériel vivant/viable.
- Trypsinisez les cellules avec 2 mL de trypsine. Après près de 10 minutes (peut nécessiter plus de temps), lorsque toutes les cellules sont détachées, neutralisez la suspension avec 10 ml de DMEM + 10% FBS. Commencer avec 3 mL et poursuivre avec les étapes de lavage subséquentes en utilisant 1 mL par lavage (7 lavages restants) pour assurer une collecte maximale de cellules trypsinisées.
- Déposer chaque aliquote neutralisée dans le même tube de 15 mL. Le volume final dans le tube sera proche de 12 mL (~2 mL de trypsine qui a été neutralisée avec un milieu de 10 mL).
- Centrifuger la suspension cellulaire neutralisée à 700 x g pendant 2 min et 30 s. Jeter le surnageant et remettre en suspension la pastille obtenue dans 1 mL de DMEM +10% FBS. Prenez une aliquote de cette section pour le comptage des cellules et étiquetez la valeur obtenue à partir de cette section comme « Compte A ».
- Trypsinze et compter les cellules HPaSteC.
- Jetez le surnageant et lavez les cellules HPaSteC avec 9 mL de HBSS (3 mL à la fois).
- Trypsinisez les cellules avec 2 mL de trypsine. Après près de 10 min, lorsque toutes les cellules sont détachées, neutralisez la suspension avec 10 ml de solution de neutralisation de la trypsine. Commencer avec 3 mL et poursuivre avec les étapes de lavage subséquentes en utilisant 1 mL par lavage (7 lavages restants) pour assurer une collecte maximale de cellules trypsinisées.
- Déposer chaque aliquote neutralisée dans le même tube de 15 mL. Le volume final dans le tube sera proche de 12 mL (~2 mL de trypsine qui a été neutralisée avec 10 mL de solution de neutralisation).
- Centrifuger la suspension cellulaire neutralisée à 700 x g pendant 2 min et 30 s. Jeter le surnageant et remettre en suspension la pastille obtenue dans 1 mL de milieu cellulaire stellaire supplémenté. Prenez une aliquote de cette section pour le comptage des cellules et étiquetez la valeur obtenue de cette section comme « Compte B ».
- Trypsinze et comptage des cellules PANC-1 :
- Diluation des suspensions cellulaires initiales
- Faites une pause à cette étape si nécessaire (pas plus de 0,5 h) pendant un court moment après avoir obtenu soit les deux comptages A et B, soit après avoir essayé et neutralisé PANC-1 et HPaSteC. Maintenir les milieux de culture inutilisés à 37 °C et les suspensions cellulaires à température ambiante (RT ; 25 ± 2 °C).
- Utilisez le comptage A et le comptage B obtenus précédemment, pour prélever des aliquotes et effectuer les dilutions respectives (dans des tubes séparés) de sorte que le volume final soit de 1 mL (diluant : DMEM + 10 % FBS pour les deux flacons) et que le comptage final soit compris entre 110 000 et 140 000 cellules pour chaque type de cellule. Une fois cette dilution effectuée, vérifiez le nombre de cellules pour chaque dilution afin d’obtenir le nombre C (PANC-1) et le nombre D (HPaSteC).
- Faites une pause à cette étape si nécessaire (pas plus de 15 à 30 minutes) après avoir obtenu le compte C et le compte D. Ne pas s’arrêter une fois que les dilutions finales sont effectuées à l’étape 4.3.3.2 ; Expérience pour éviter la sédimentation cellulaire. Maintenir les milieux de culture inutilisés à 37 °C et les suspensions cellulaires à RT (25 ± 2 °C).
- Maintenir le nombre final de cellules nécessaires par puits à HPaSteC : PANC-1 : 60:120. Utilisez 110 puits pour le calcul afin de tenir compte de l’excès. Calculer avec une valeur de base de 100 μL de suspension cellulaire par puits (le volume total de suspension est de 11 mL pour 110 puits avec HPaSteC : PANC-1 : 60:120). Préparez cette suspension dans un tube à centrifuger stérile de 50 ml pour faciliter le mélange.
- Utilisez le comptage C et le comptage D, et ajoutez suffisamment de suspension cellulaire dans une solution DMEM + 10 % FBS pour avoir HPaSteC : PANC-1 : 60:120 dans un volume final de 11 mL (6 600 cellules HPaSteC et 13 200 cellules PANC-1 dans 11 mL). Mélangez soigneusement la solution à l’aide d’une pipette de 1 mL en remuant et en pipetant de haut en bas. Évitez la formation de mousse.
- Semis
- À l’aide d’une pipette de 200 μL ou de 100 μL, mélangez la suspension finale (en remuant en déplaçant la pointe de la pipette combinée à un pipetage de haut en bas) à chaque étape avant d’ajouter 100 μL de suspension par puits. Ajouter doucement les 100 μL le long du coin du puits.
- Réutilisez la même pointe pour plusieurs puits à moins qu’elle ne tombe. Mélangez d’avant en arrière et comptez jusqu’à 10 ou 15 (pas quelques secondes) entre les ajouts à chaque puits pour la première moitié (environ les 43 premiers puits) de l’assiette. Réduire le nombre de mélanges à 5-10 entre chaque puits pour la seconde moitié (43 puits restants) car le volume de suspension est moindre et nécessite moins de temps de mélange.
- N’utilisez pas de pipette répétitive car le revêtement poly-HEMA hydrophobe fera rebondir la suspension sur la plaque, ce qui entraînera une répartition inégale.
- Jetez tout excès de suspension une fois que tous les puits sont remplis.
- À l’aide d’une pipette de 200 μL ou de 100 μL, mélangez la suspension finale (en remuant en déplaçant la pointe de la pipette combinée à un pipetage de haut en bas) à chaque étape avant d’ajouter 100 μL de suspension par puits. Ajouter doucement les 100 μL le long du coin du puits.
- Centrifugation
- Centrifugez la plaque finale contenant la suspension cellulaire pour rassembler toutes les cellules sous forme de pastille. Enroulez soigneusement la plaque avec du parafilm autour du bord de la plaque pour éviter toute contamination pendant cette étape. Après l’emballage, centrifuger la plaque avec un contrepoids à 1000 x g pendant 2 min.
- Remettez la plaque dans le capot de culture cellulaire (utilisez des gants pulvérisés à l’éthanol pour la manipuler), retirez le parafilm et stockez les plaques dans l’incubateur à 37 °C, avec 5 % de CO2. Ne vaporisez à aucun moment la plaque avec un mélange éthanol-eau.
- Entretien de la culture
- Observez les cellules se rassembler pour former des sphéroïdes au microscope optique à un grossissement de 4x-5x au jour 3. Suivez le protocole de maintenance de la culture décrit ci-dessous.
- Le jour 3, mesurez 5 à 6 ml de DMEM + 10 % de FBS et ajoutez-en 50 μL dans chaque puits sur le côté du puits.
- Ne mélangez pas ou n’agitez pas le média de quelque manière que ce soit pendant l’ajout, car cela endommagerait le sphéroïde ou entraînerait un retrait accidentel du sphéroïde. Le volume final par puits sera de ~150 μL.
- Au-delà du jour 3, reportez-vous à la figure 2 pour vous familiariser avec la structure du puits et l’emplacement de la réflexion de la lumière (entre la partie cylindrique et la partie incurvée du puits) visible sur le support appelé halo. Effectuez les opérations à proximité du halo avec prudence pour vous assurer que les sphéroïdes ne sont pas endommagés.
- Le jour 6, mesurez 10 à 11 ml de DMEM + 10 % de FBS. À l’aide d’une pipette de 1 ml, on peut extraire le support en vrac de plusieurs puits en le retirant jusqu’au halo. Faites cela pour l’ensemble de la plaque, puis remplacez le support. Récupérez le surnageant en vrac et jetez-le, ou jetez-le au fur et à mesure qu’il est retiré.
- Remplacez le support mis au rebut par un support frais en ajoutant 100 μL de support sur le côté de chaque puits. Le volume final dans le puits sera proche de 200 μL.
- Ne tirez pas le support au-delà du halo, car cela augmente le risque de retirer accidentellement le sphéroïde.
- Le jour 10/11, mesurez 10-11 mL de DMEM + 10% FBS. À l’aide d’une pipette de 1 ml, on peut extraire le support en vrac de plusieurs puits en le retirant jusqu’au halo. Faites cela pour l’ensemble de la plaque, puis remplacez le support. Récupérez le surnageant en vrac et jetez-le, ou jetez-le au fur et à mesure qu’il est retiré.
- Remplacez le support mis au rebut par un support frais en ajoutant 100 μL de support sur le côté de chaque puits. Le volume final dans le puits sera proche de 200 μL.
- Le jour 3, mesurez 5 à 6 ml de DMEM + 10 % de FBS et ajoutez-en 50 μL dans chaque puits sur le côté du puits.
- Observez les cellules se rassembler pour former des sphéroïdes au microscope optique à un grossissement de 4x-5x au jour 3. Suivez le protocole de maintenance de la culture décrit ci-dessous.
- Évaluation du dernier jour
- Effectuez un traitement médicamenteux sur les sphéroïdes le jour 14. Imagez les sphéroïdes avant de les utiliser à l’aide d’un microscope inversé à fond clair sous un objectif 4x pour déterminer le volume de départ du sphéroïde. Calculez le volume (V) à l’aide de la formule suivante :
V = 0,5 × L × W2 - Suivez l’équation pour calculer les volumes sphéroïdes décrite ci-dessus. Ici, L est la longueur de l’axe principal, et W est la largeur (la plus longue ligne perpendiculaire à l’axe principal). Convertissez toutes les unités d’origine de micromètres en millimètres pour obtenir un volume en millimètres cubes.
- Le volume de départ dans chaque puits le jour 14 se situe entre 150 et 200 μL en raison de l’évaporation. Pour les traitements médicamenteux, retirez le média jusqu’à ce que le halo soit atteint à partir de chaque puits et remplacez-le par 100 μL de la solution médicamenteuse à une concentration de 2x, associée à un mélange doux (mélangez doucement le média d’avant en arrière tout en comptant jusqu’à 2 entre chaque puits).
- Utilisez des solutions de concentration 2x pour permettre à la solution finale de médicament d’être à 1x et pour éviter d’éliminer complètement les vieux milieux des puits, faute de quoi les sphéroïdes peuvent être perturbés. Utilisez les sphéroïdes dans les 3 jours suivant cette période.
- Effectuez un traitement médicamenteux sur les sphéroïdes le jour 14. Imagez les sphéroïdes avant de les utiliser à l’aide d’un microscope inversé à fond clair sous un objectif 4x pour déterminer le volume de départ du sphéroïde. Calculez le volume (V) à l’aide de la formule suivante :
- Collection de sphéroïdes
- Mesurer les volumes de sphéroïdes avant le prélèvement, comme décrit à l’étape 4.7.2.
- Collectez les sphéroïdes le jour 14 ou 17, selon les besoins de l’expérience, en retirant le milieu de chaque puits jusqu’à ce que le halo soit atteint.
- À l’aide d’une pipette de 1 ml, prélever le milieu et recueillir le surnageant dans un tube à centrifuger conique de 15 ml à partir de plusieurs puits.
- Une fois que tous les puits ont un milieu au niveau du halo, réduisez le réglage de la pipette de 1 mL à entre 200 et 300 μL.
- Alignez la plaque sur le fond de la hotte ou sur un fond sombre (par exemple, un support de tubes) pour voir les sphéroïdes se déposer au fond.
- Insérez doucement l’embout près du sphéroïde (passez sous le halo) et pipetez une petite quantité de support (par exemple, une estimation visuelle de près de 50 μL) d’avant en arrière pour perturber le sphéroïde. Ne placez pas la pointe directement sur le sphéroïde, car cela pourrait endommager sa structure.
- Ne retirez pas tout le support du puits à cette étape. Contrôlez fermement le mouvement du pouce sur le piston de la pipette.
- Déplacez le média jusqu’à ce que le sphéroïde ne reste plus au centre et que l’on puisse le voir se déplacer sur l’arrière-plan. Tirez suffisamment de milieu pour aspirer le sphéroïde et déplacez-le à l’endroit souhaité (par exemple, mettez-le en pool avec d’autres sphéroïdes dans un puits qui fait partie du même ensemble de traitement).
- Élimination des déchets
- Jetez tous les échantillons de liquide une fois neutralisés avec de l’eau de Javel conformément aux protocoles du service de l’environnement et de la sécurité sanitaire des laboratoires respectifs. Autoclavez et jetez toutes les pipettes et flacons usagés contenant des déchets biologiques dangereux.
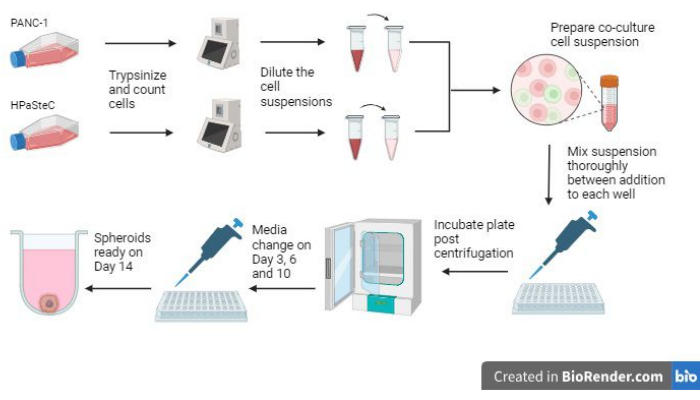
Figure 1 : Vue d’ensemble du processus de culture de sphéroïdes de cancer du pancréas desmoplastique en 3D (générée à l’aide de BioRender). La figure donne un aperçu des processus de base impliqués ; À savoir, trypsiniser les cellules, utiliser le nombre initial de cellules pour fabriquer des suspensions cellulaires diluées, préparer une co-culture à l’aide des suspensions cellulaires diluées, ajouter des suspensions cellulaires dans chaque puits, incuber les cultures, effectuer l’entretien des milieux et la formation finale des sphéroïdes comme prévu le jour 14. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : Structure du puits de fond en U. L’image de droite est une forme exagérée pour montrer la partie « halo » du puits. La figure vise à définir où se trouve la partie « halo » du puits, car le travail au-dessus du halo est essentiel pour faire croître les sphéroïdes et éviter les pertes accidentelles. Veuillez cliquer ici pour voir une version agrandie de cette figure.
5. Évaluation des composants ECM et microscopie confocale
- Utiliser l’immunomarquage pour évaluer la réponse de la MEC à la pharmacothérapie selon le protocole décrit par Durymanov et al.38.
- Regroupez les sphéroïdes et lavez-les deux fois avec 100 μL de PBS. Incorporer dans le milieu d’enrobage de tissu à température de coupe optimale (OCT), congeler et maintenir à -80 °C.
- Coupez les blocs tumoraux congelés en sections de 10 μm, fixez les sections dans un mélange d’acétone-méthanol (1:1) pendant 15 minutes et laissez-les sécher à l’air libre à RT.
- Pour déterminer les composants de la MEC, immunocolorez les cryosections avec des anticorps primaires anti-fibronectine monoclonaux de lapin, des anticorps anti-collagène polyclonaux de lapin, des anticorps anti-laminine polyclonaux de lapin et des anticorps anti-acide hyaluronique polyclonaux de mouton.
- Utilisez des IgG anti-lapin de chèvre marqués avec Alexa Fluor 488 ou des anti-moutons d’âne conjugués avec Alexa Fluor 568 comme anticorps secondaires.
REMARQUE : Les anticorps primaires et secondaires ont été dilués à 1:200 et 1:300, respectivement. - Acquérez des images de toutes les sections de sphéroïdes à l’aide d’un microscope confocal à balayage laser équipé d’un objectif 20x/0,45.
Résultats
Trois des étapes les plus critiques de la croissance des sphéroïdes sont le dénombrement initial des cellules, les étapes de mélange pendant l’ensemencement des sphéroïdes et l’exécution de changements de milieu en temps opportun pour permettre aux sphéroïdes de se développer (figure 1). De plus, il est essentiel de se familiariser avec la figure 2 sur les changements de supports après le jour 3 pour permettre des changements de supports efficaces en raison de l’augmentation du volume de supports par puits. Lorsque toutes ces étapes sont exécutées selon les instructions données, on constate que les sphéroïdes (figure 3) se développent jusqu’à un volume moyen de 0,048 ± 0,012 mm3 (451 μm x 462,84 μm) (figure 4). Dans certains cas, les cellules peuvent mieux se développer, ce qui a conduit à des volumes moyens initiaux plus importants de 0,096 ± 0,014 mm3 (611 μm x 560 μm) au jour 14. Diverses raisons peuvent conduire les sphéroïdes à avoir des volumes initiaux plus importants, tels que le maintien de la température et de l’humidité de l’incubateur ou l’utilisation de passages cellulaires plus précoces, qui ont une vitalité légèrement améliorée par rapport aux passages ultérieurs.
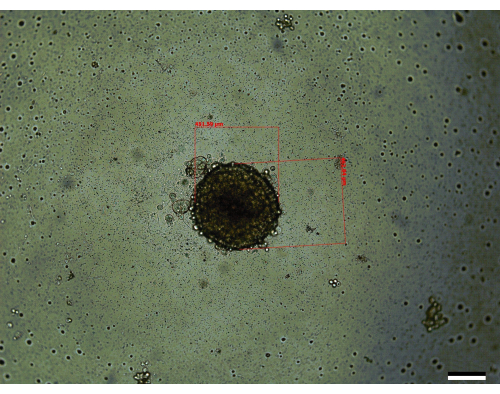
Figure 3 : Un sphéroïde représentatif vu au jour 14 (taille : 451,59 μm x 462,84 μm). Barre d’échelle = 200 μm. Chaque sphéroïde est mesuré le long de son axe le plus long et de son axe le plus court, respectivement, et utilisé l’équation décrite dans la section des méthodes pour calculer le volume. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 4 : Progression de la croissance des sphéroïdes sur 17 jours. Les planches 1 et 2 sont des répliques. Les barres d’erreur représentent l’écart type. Ce chiffre peut être utilisé comme une estimation approximative des volumes de sphéroïdes qui peuvent être observés les jours 6, 10, 14 et 17. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Cependant, dans les cas où les cellules ne sont pas comptées correctement ou que la suspension cellulaire n’est pas complètement mélangée, ou que la culture finale n’est pas régulièrement maintenue, ou qu’une combinaison de ces erreurs se produit, cela peut conduire au développement de sphéroïdes plus petits ou de sphéroïdes incomplètement développés. Des sphéroïdes d’apparence similaire ont également été observés lorsque les études d’optimisation initiales n’ont complété les milieux que dans les puits autour de la périphérie de la plaque le jour 3 au lieu de la plaque entière (Figure 5). Par ailleurs, dans les cas où les cellules ne sont pas bien mélangées, ou si des erreurs initiales de comptage/dilution conduisent à l’ensemencement de plus de cellules par puits que la recommandation, plusieurs sphéroïdes peuvent être observés par puits. Un résultat similaire a été observé lorsque les cellules PANC-1 :HPaSteC ont été utilisées à un rapport de 240:120 (Figure 6). Cela peut également être observé à l’occasion lorsque les sphéroïdes sont cultivés par direction, mais que ces sphéroïdes sont moins nombreux (p. ex., 4 puits sur 96 peuvent contenir deux sphéroïdes par puits au lieu d’un). Dans les cas où plusieurs sphéroïdes sont rencontrés, évitez d’utiliser les puits avec plusieurs sphéroïdes ou notez les changements de volume lorsque ces sphéroïdes sont traités. Des changements de support inappropriés où la pointe de la pipette plonge sous le halo (Figure 1) peuvent également entraîner une perte accidentelle des sphéroïdes.

Figure 5 : Une image représentative d’un sphéroïde mal développé au jour 14. Barre d’échelle = 200 μm. Ici, les cellules ne se sont pas bien agrégées, il devient donc difficile de mesurer la longueur et la largeur du sphéroïde. Veuillez cliquer ici pour voir une version agrandie de cette figure.
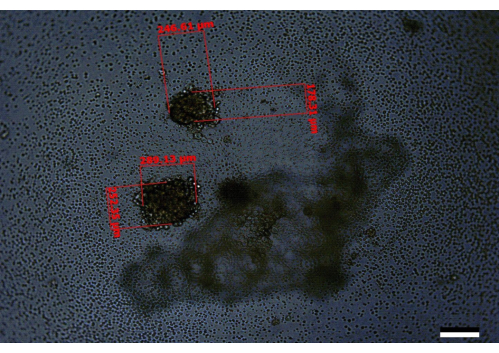
Figure 6 : Une image représentative d’un puits contenant deux sphéroïdes mal développés, comme on le voit au jour 14. Barre d’échelle = 200 μm. Ici, l’un des sphéroïdes a une taille de 246,61 μm x 178,31 μm et l’autre de 289,13 μm x 252,35 μm. Il s’agit d’un exemple où il y a probablement un problème avec les dilutions initiales ou la qualité des cellules qui ont été utilisées pour démarrer l’expérience. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Les sphéroïdes développent également une MEC avec quatre des principaux composants de la MEC : le collagène-I, la laminine, l’acide hyaluronique et la fibronectine. Dans des études publiées précédemment par le laboratoire, l’avantage de la co-culture par rapport à PANC-1 seul a été démontré en termes de sphéroïdes homo PANC-1 présentant du collagène diffus, pas de fibronectine et un dépôt d’acide hyaluronique moindre.
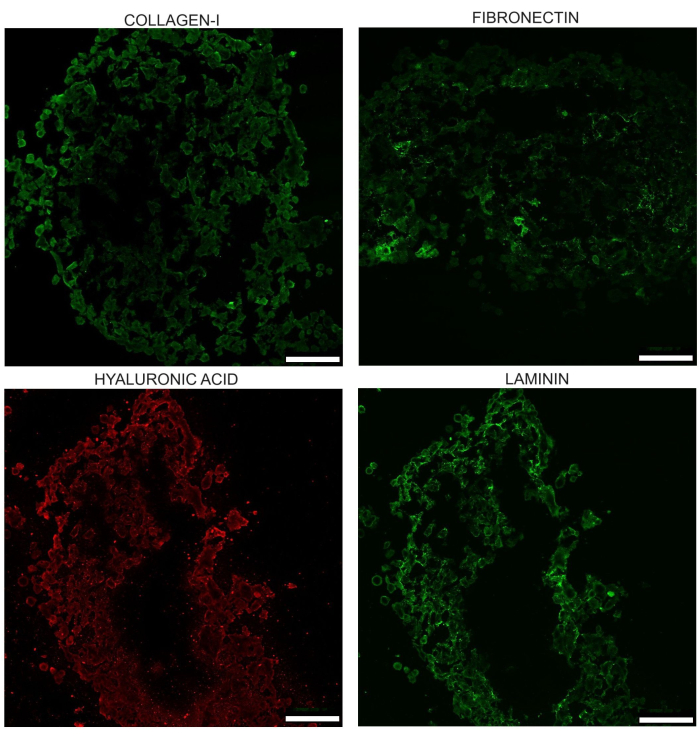
Figure 7 : Image représentative des quatre principaux composants de la MEC observés au jour 17 chez les sphéroïdes non traités : collagène I, laminine, acide hyaluronique et fibronectine. Ces images sont obtenues après cryocoupes d’immunomarquage du sphéroïde. La luminosité de ces images a été augmentée uniformément pour aider à mettre en évidence les différences d’apparence. Les zones où les tissus sont endommagés ou manquants doivent être ajustées pendant que les mesures d’intensité sont effectuées. Barres d’échelle = 100 μm. Veuillez cliquer ici pour voir une version plus grande de cette figure.
Discussion
La durée et les rapports cellulaires choisis pour faire pousser les sphéroïdes ont été basés sur des études comme indiqué précédemment38. En tentant d’optimiser ces études en substituant des cellules NIH3T3 aux cellules HPaSteC, on a constaté que les volumes sphéroïdes et les profils d’apoptose ressemblaient étroitement aux paramètres optimisés rapportés (rapportés pour PANC-1 : NIH3T3 : 120:12) lorsque les rapports PANC-1 : HPaSteC étaient de 120 : 60. Bien que ces études ne mesurent l’apoptose que jusqu’au 14e jour, le protocole décrit dans ce processus continue d’utiliser des sphéroïdes jusqu’au 17e jour, car aucune augmentation visible de la formation de débris n’est observée entre le 14e et le 17e jour. À titre de contrôle, tous les sphéroïdes évalués au jour 17 comprennent toujours un bras non traité pour servir de référence pour l’augmentation naturelle du volume et de l’apoptose des sphéroïdes.
Le processus d’ensemencement et de croissance des sphéroïdes comporte 3 étapes critiques : le comptage approprié, le mélange avant l’ajout des cellules et l’entretien des cultures. Étant donné que le processus repose sur l’utilisation d’un petit nombre de cellules PANC-1 et HPaSteC, il devient essentiel d’avoir le bon nombre et les bonnes dilutions. Ceci est particulièrement important pour les cellules HPaSteC, car ces cellules sont plus petites que les cellules PANC-1, et il est facile de sous-estimer le nombre de cellules. Par conséquent, il est essentiel de compter soigneusement les cellules. La sous-estimation du dénombrement entraîne la formation de plusieurs sphéroïdes, tandis qu’une surestimation peut conduire à des sphéroïdes mal formés.
Il devient également essentiel de bien mélanger la suspension à toutes les étapes. Travailler en s’attendant à ce que les cellules puissent se têtir aide à prévenir le sous-mélange et à assurer une distribution uniforme des cellules. Lors de la préparation des sphéroïdes pour plus d’une plaque (p. ex., deux plaques), il est recommandé que le nombre de mélanges aller-retour (étape 4.4.1) soit d’au moins 20 entre chaque puits. Ce nombre peut être réduit à 15 lorsque la première assiette est à mi-chemin, suivi de 10 au début de la plaque suivante et de 5 au fur et à mesure que l’on progresse vers la seconde moitié de la deuxième plaque. L’exécution d’un mouvement d’agitation avec la pipette en parallèle au mélange d’avant en arrière permet d’améliorer l’étendue du mélange. Une idée à considérer est d’impliquer une deuxième personne lors de la préparation de deux assiettes, car cela augmente la vitesse et l’efficacité du mélange. Dans ce scénario, deux personnes peuvent utiliser le capot en même temps avec leurs suspensions et plaques individuelles en travaillant sur les coins opposés du capot.
Le maintien des cultures cellulaires est nécessaire pour s’assurer que les sphéroïdes ont toujours un apport adéquat en nutriments. Les suppléments de milieux les jours 3 et 6 sont les plus critiques, car c’est là que les cellules se développent et doivent être bien nourries. Les changements de médias les jours 6 et 10/11 peuvent également être délicats car ils impliquent de collecter un surnageant pour se débarrasser des médias plus anciens. Cette étape doit être effectuée avec soin en tirant doucement le support jusqu’au « halo » et jamais au-delà. Cela permet d’éviter l’aspiration du média trop près du sphéroïde et la perte involontaire de sphéroïdes lors du changement de média.
La méthode présente un grand avantage en ce sens qu’elle est facilement reproductible et ne nécessite aucun moule ou matériau d’échafaudage, contrairement aux méthodes que nous avons citées précédemment 32,34,35,36,37,39. De plus, le milieu utilisé est un milieu de culture cellulaire standard, qui est relativement peu coûteux par rapport au milieu EGM-239, aux mélanges de milieux cellulaires étoilés et au DMEM-FBS35ou à l’un ou l’autre milieu seul, selon le type de cellule34. Cet avantage devient essentiel en termes de traduisibilité entre les laboratoires et de facilité de configuration. Le processus peut également être étendu à plusieurs plaques, mais nécessiterait probablement une personne pour deux plaques. La nature robuste des sphéroïdes permet également de les évaluer dans des conditions d’agitation. Cette étape est particulièrement utile pour réaliser des études de pharmacocinétique cellulaire ou de libération et d’absorption creusées où des sphéroïdes sont impliqués.
Malgré ses avantages, une limitation de la méthode est qu’elle nécessite un mélange très minutieux lors de l’étape de semis. Cela peut prendre du temps et devenir physiquement éprouvant. Une façon possible de contourner cela pourrait impliquer l’utilisation d’une bille magnétique bien stérilisée pour maintenir des conditions d’agitation constantes pendant le processus d’ensemencement. La collecte des sphéroïdes est également délicate et nécessite un peu de pratique. Les sphéroïdes ont également besoin de temps pour se développer et, par conséquent, nécessitent une planification minutieuse pour assurer la disponibilité du personnel et de l’approvisionnement pour les changements de support.
Pour conclure, une méthode simple et reproductible pour produire des sphéroïdes 3D desmoplastiques cliniquement pertinents a été développée. Les sphéroïdes sont robustes et capables de générer des composants ECM : collagène I, laminine, acide hyaluronique et fibronectine. La simplicité de la génération de ces sphéroïdes présente l’avantage unique d’être facilement reproductibles et adaptables à des changements tels que l’inclusion d’une troisième lignée cellulaire. Un autre avantage unique du modèle est qu’il est résistant à la thérapie40. Cela contribue à sa pertinence clinique et garantit que seuls les médicaments les plus efficaces sont choisis pour aller de l’avant et être utilisés pour traiter le cancer du pancréas. De plus, ces sphéroïdes peuvent être collectés et implantés chez la souris pour donner des tumeurs desmoplastiques reproductibles pour l’analyse in vivo 38et également utilisés pour examiner la pénétration de différentes tailles de nanoparticules44comme décrit précédemment.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Les travaux décrits ont été soutenus par le Bureau du développement économique des gouverneurs du Dakota du Sud, le Programme de subventions de recherche concurrentielle du Conseil des régents du Dakota du Sud (SD-BOR-CRGP) et le Département des sciences pharmaceutiques de l’Université d’État du Dakota du Sud.
matériels
| Name | Company | Catalog Number | Comments |
| Axio Observer inverted microscope | Carl Zeiss | 0450-354 | |
| Cellometer Auto T4 | Nexcelom Bioscience LLC | Auto-T4 | |
| DMEM, powder, high glucose | Gibco | 12100046 | |
| Donkey anti-sheep conjugated with Alexa Fluor 568 | Abcam | ab175712 | |
| Fetal Bovine Serum | Cytiva | SH3091003HI | |
| Goat antirabbit IgG labeled with Alexa Fluor 488 | Abcam | ab150077 | |
| Hanks Balanced Salt Solution (HBSS) | Gibco | 14175145 | |
| Human Pancreatic Stellate Cells (HPaSteC) | ScienCell | 3830 | |
| Microscope Nikon | Nikon | Eclipse Ts 100 | |
| Nunc 96-Well Polystyrene Round Bottom Microwell Plates | Thermo Scientific | 12-565-331 | |
| Olympus Fluoview FV1200 confocal laser | Olympus | N/A | Discontinued product |
| PANC-1 | ATCC | CRL-1469 | |
| Poly-HEMA | Sigma | P3932 | |
| Rabbit polyclonal anti-laminin antibodies | Abcam | ab11575 | |
| Rabbit polyclonal anti-type I collagen antibodies | Abcam | ab34710 | |
| Sheep polyclonal anti-hyaluronic acid antibodies | Abcam | ab53842 | |
| Stellate cell media complete kit | ScienCell | 5301 | |
| Trypsin | MP Biomedicals, LLC | 153571 | Trypsin solution prepared according to manufacturers protocol and used at 0.25%w/v |
| Trypsin Neutralization Solution (TNS) | ScienCell | 103 |
Références
- Hingorani, S. R. Epithelial and stromal co-evolution and complicity in pancreatic cancer. Nat Rev Cancer. 23 (2), 57-77 (2023).
- Laklai, H., et al. Genotype tunes pancreatic ductal adenocarcinoma tissue tension to induce matricellular fibrosis and tumor progression. Nat Med. 22 (5), 497-505 (2016).
- Binker, M. G., Binker-Cosen, M. J., Binker-Cosen, A. A., Cosen-Binker, L. I. Microenvironmental factors and extracellular matrix degradation in pancreatic cancer. J Pancreas. 15 (4), 280-285 (2014).
- Spano, D., Zollo, M. Tumor microenvironment: a main actor in the metastasis process. Clin Exp Metastasis. 29 (4), 381-395 (2012).
- Ware, M. J., et al. Generation of an in vitro 3D PDAC stroma rich spheroid model. Biomaterials. 108, 129-142 (2016).
- Sunami, Y., Häußler, J., Kleeff, J. Cellular heterogeneity of pancreatic stellate cells, mesenchymal stem cells, and cancer-associated fibroblasts in pancreatic cancer. Cancers. 12 (12), 3770 (2020).
- Öhlund, D., et al. Distinct populations of inflammatory fibroblasts and myofibroblasts in pancreatic cancer. J Exp Med. 214 (3), 579-596 (2017).
- Pandol, S., Edderkaoui, M., Gukovsky, I., Lugea, A., Gukovskaya, A. Desmoplasia of pancreatic ductal adenocarcinoma. Clin Gastroenterol Hepatol. 7 (11), S44-S47 (2009).
- Watanabe, I., et al. Advanced pancreatic ductal cancer: fibrotic focus and β-catenin expression correlate with outcome. Pancreas. 26 (4), 326-333 (2003).
- Hu, G., et al. Tumor-infiltrating podoplanin+ fibroblasts predict worse outcome in solid tumors. Cell Physiol Biochem. 51 (3), 1041-1050 (2018).
- Kapałczyńska, M., et al. 2D and 3D cell cultures-a comparison of different types of cancer cell cultures. Arch Med Sci. 14 (4), 910-919 (2018).
- Monberg, M. E., et al. Occult polyclonality of preclinical pancreatic cancer models drives in vitro evolution. Nat Commun. 13 (1), 3652 (2022).
- Emerman, J. T., Pitelka, D. R. Maintenance and induction of morphological differentiation in dissociated mammary epithelium on floating collagen membranes. In Vitro. 13 (5), 316-328 (1977).
- Kelm, J. M., Timmins, N. E., Brown, C. J., Fussenegger, M., Nielsen, L. K. Method for generation of homogeneous multicellular tumor spheroids applicable to a wide variety of cell types. Biotechnol Bioeng. 83 (2), 173-180 (2003).
- Kikuta, K., et al. Pancreatic stellate cells promote epithelial-mesenchymal transition in pancreatic cancer cells. Biochem Biophys Res Commun. 403 (3-4), 380-384 (2010).
- Lee, J. -. H., et al. Microfluidic co-culture of pancreatic tumor spheroids with stellate cells as a novel 3D model for investigation of stroma-mediated cell motility and drug resistance. J Exp Clin Cancer Res. 37 (1), 4 (2018).
- Wong, C. -. W., Han, H. -. W., Tien, Y. -. W., Hsu, S. -. H. Biomaterial substrate-derived compact cellular spheroids mimicking the behavior of pancreatic cancer and microenvironment. Biomaterials. 213, 119202 (2019).
- Liu, X., et al. 3D heterospecies spheroids of pancreatic stroma and cancer cells demonstrate key phenotypes of pancreatic ductal adenocarcinoma. Transl Oncol. 14 (7), 101107 (2021).
- Vonlaufen, A., et al. Pancreatic stellate cells: partners in crime with pancreatic cancer cells. Cancer Res. 68 (7), 2085-2093 (2008).
- Bachem, M. G., et al. Pancreatic carcinoma cells induce fibrosis by stimulating proliferation and matrix synthesis of stellate cells. Gastroenterology. 128 (4), 907-921 (2005).
- Greco, E., et al. Pancreatic cancer cells invasiveness is mainly affected by interleukin-1β not by transforming growth factor-β1. Int J Biol Markers. 20 (4), 235-241 (2005).
- Arao, S., Masumoto, A., Otsuki, M. β1 integrins play an essential role in adhesion and invasion of pancreatic carcinoma cells. Pancreas. 20 (2), 129-137 (2000).
- Sawai, H., Yamamoto, M., Okada, Y., Sato, M., Akamo, Y., Takeyama, H., Manabe, T. Alteration of integrins by Interleukin-1alpha in human pancreatic cancer cells. Pancreas. 23 (4), 399-405 (2001).
- Chen, J., et al. Expression and function of the epidermal growth factor receptor in physiology and disease. Physiol Rev. 96 (3), 1025-1069 (2016).
- Deer, E. L., et al. Phenotype and genotype of pancreatic cancer cell lines. Pancreas. 39 (4), 425 (2010).
- Stahle, M., et al. Mechanisms in LPA-induced tumor cell migration: critical role of phosphorylated ERK. J Cell Sci. 116, 3835-3846 (2003).
- Aubert, M., et al. Decrease of human pancreatic cancer cell tumorigenicity by α1, 3galactosyltransferase gene transfer. Int J Cancer. 107 (6), 910-918 (2003).
- Miknyoczki, S. J., Chang, H., Klein-Szanto, A., Dionne, C. A., Ruggeri, B. A. The Trk tyrosine kinase inhibitor CEP-701 (KT-5555) exhibits significant antitumor efficacy in preclinical xenograft modelsof human pancreatic ductal adenocarcinoma. Clin Cancer Res. 5 (8), 2205-2212 (1999).
- Fukasawa, M., Korc, M. Vascular endothelial growth factor-trap suppresses tumorigenicity of multiple pancreatic cancer cell lines. Clin Cancer Res. 10 (10), 3327-3332 (2004).
- Hernández-Camarero, P., et al. Pancreatic (pro) enzymes treatment suppresses BXPC-3 pancreatic Cancer Stem Cell subpopulation and impairs tumour engrafting. Sci Rep. 9 (1), 11359 (2019).
- Ware, M. J., et al. Generation of homogenous three-dimensional pancreatic cancer cell spheroids using an improved hanging drop technique. Tissue Eng Part C Methods. 22 (4), 312-321 (2016).
- Longati, P., et al. 3D pancreatic carcinoma spheroids induce a matrix-rich, chemoresistant phenotype offering a better model for drug testing. BMC Cancer. 13, 95 (2013).
- Kpeglo, D., et al. Modeling the mechanical stiffness of pancreatic ductal adenocarcinoma. Matrix Biol Plus. 14, 100109 (2022).
- Jang, S. -. D., et al. Anti-cancer activity profiling of chemotherapeutic agents in 3D co-cultures of pancreatic tumor spheroids with cancer-associated fibroblasts and macrophages. Cancers. 13 (23), 5955 (2021).
- Pednekar, K. P., Heinrich, M. A., van Baarlen, J., Prakash, J. Novel 3D µtissues mimicking the fibrotic stroma in pancreatic cancer to study cellular interactions and stroma-modulating therapeutics. Cancers. 13 (19), 5006 (2021).
- Kim, S. -. K., et al. Phenotypic heterogeneity and plasticity of cancer cell migration in a pancreatic tumor three-dimensional culture model. Cancers. 12 (5), 1305 (2020).
- Hwang, H. J., Oh, M. -. S., Lee, D. W., Kuh, H. -. J. Multiplex quantitative analysis of stroma-mediated cancer cell invasion, matrix remodeling, and drug response in a 3D co-culture model of pancreatic tumor spheroids and stellate cells. J Exp Clin Cancer Res. 38 (1), 258 (2019).
- Durymanov, M., et al. Subcutaneous inoculation of 3D pancreatic cancer spheroids results in development of reproducible stroma-rich tumors. Transl Oncol. 12 (1), 180-189 (2019).
- Giustarini, G., Teng, G., Pavesi, A., Adriani, G. Characterization of 3D heterocellular spheroids of pancreatic ductal adenocarcinoma for the study of cell interactions in the tumor immune microenvironment. Front Oncol. 13, 1156769 (2023).
- Alseud, K., et al. Synthesis and biological activity of 11-oxygenated and heterocyclic estrone analogs in pancreatic cancer monolayers and 3D spheroids. Bioorg Med Chem. , (2024).
- Fitzgerald, A. A., et al. Fibroblast activation protein regulates natural killer cell migration, extravasation and tumor infiltration. bioRxiv. , 429622 (2021).
- Wishart, G., Gupta, P., Schettino, G., Nisbet, A., Velliou, E. 3D tissue models as tools for radiotherapy screening for pancreatic cancer. Br J Radiol. 94 (1120), 20201397 (2021).
- Peirsman, A., et al. MISpheroID: a knowledgebase and transparency tool for minimum information in spheroid identity. Nat Methods. 18 (11), 1294-1303 (2021).
- Durymanov, M., Kroll, C., Permyakova, A., Reineke, J. Role of endocytosis in nanoparticle penetration of 3D pancreatic cancer spheroids. Mol Pharm. 16 (3), 1074-1082 (2019).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon