Method Article
גידול ספרואידים תלת מימדיים של סרטן הלבלב הדסמופלסטי מבית Co-Culture
In This Article
Summary
סרטן הלבלב נותר אחד מסוגי הסרטן הקשים ביותר לטיפול. לכן, קריטי שמודלים פרה-קליניים להערכת יעילות הטיפול יהיו ניתנים לשחזור ורלוונטיים קלינית. פרוטוקול זה מתאר הליך תרבית משותפת פשוט ליצירת ספרואידים דמופלסטיים הניתנים לשחזור, רלוונטיים קלינית.
Abstract
אדנוקרצינומה של צינור הלבלב (PDAC) הוא אחד מסוגי הסרטן הקטלניים ביותר עם שיעור הישרדות של 5 שנים של <12%. המחסום הגדול ביותר לטיפול הוא המטריצה החוץ תאית הדסמופלסטית הצפופה (ECM) המקיפה את הגידול ומפחיתה את כלי הדם, המכונה בדרך כלל דסמופלזיה. מגוון שילובי תרופות ופורמולציות נבדקו לטיפול בסרטן, ולמרות שרבים מהם מראים הצלחה טרום קלינית, הם נכשלים קלינית. לכן, חשוב שיהיה מודל רלוונטי מבחינה קלינית זמין שיכול לחזות את התגובה של הגידול לטיפול. מודל זה אומת בעבר כנגד גידולים קליניים שנכרתו. כאן מתואר פרוטוקול פשוט לגידול ספרואידים תלת-ממדיים (3D)-קו-תרבותיים דסמופלסטיים שיכולים לייצר באופן טבעי ECM חזק ואינם דורשים מקורות מטריצה חיצוניים או פיגומים כדי לתמוך בצמיחתם.
תאי סטלט לבלב אנושיים (HPaSteC) ותאי PANC-1 משמשים להכנת תרחיף המכיל את התאים ביחס של 1:2, בהתאמה. התאים מצופים בפלטת U-well מצופה פולי-HEMA, 96 בארות בעלות חיבור נמוך. הצלחת היא צנטריפוגה כדי לאפשר לתאים ליצור גלולה ראשונית. הצלחת מאוחסנת באינקובטור ב 37 ° C עם 5% CO2, ואת המדיה מוחלף כל 3 ימים. ניתן לצלם לוחות במרווחי זמן ייעודיים כדי למדוד נפח כדורי. לאחר 14 ימי תרבית, נוצרים ספרואידים דסמופלסטיים בוגרים (כלומר נפח ממוצע של 0.048 + 0.012 מ"מ3 (451 מיקרומטר x 462.84 מיקרומטר)) וניתן להשתמש בהם להערכת טיפול ניסיוני. רכיבי ECM בוגרים כוללים קולגן-I, חומצה היאלורונית, פיברונקטין ולמינין.
Introduction
הפרוגנוזה הגרועה של סרטן הלבלב קשורה למגוון סיבות, ביניהן היעדר סמנים ביולוגיים קלים לגילוי המובילים לגילוי מאוחר. סיבה מרכזית נוספת היא הסטרומה הסמיכה המקיפה את הרקמה, מה שמוביל לאספקת דם מופחתת. שקיעת כמויות גדולות של מטריצה חוץ-תאית (ECM), אינטראקציה בין תאים, תאי אנדותל, תאי חיסון שונים, פריציטים, אוכלוסיית מיופיברובלסטים מתרבים ופיברובלסטים, ונוכחותם של תאים לא-ניאופלסטיים (יחד מהווים את התגובה הדסמופלסטית)1, מהווים את הסטרומה העבה האחראית לעמידות הכימותרפית והרדיותרפית של PDAC2. לתאי סרטן וסטרומה יש אינטראקציה מורכבת, דינמית ודו-כיוונית. למרות שאלמנטים מסוימים מחלישים או מאיצים את התקדמות המחלה, רוב התהליכים הם אדפטיביים במהלך התפתחות הגידול1. זה מספק סביבה עשירה בגורמי גדילה, גורמים פרואנגיוגניים, פרוטאזות ומולקולות הידבקות. גורמים אלה מקדמים אנגיוגנזה, התפשטות תאים, גרורות ופלישה 3,4. יחד, הם מהווים מקלט חסין ומועדף לתרופות עבור הגידול, וכתוצאה מכך עמידות לסמים.
הדסמופלזיה היא תערובת מורכבת המורכבת מחלבוני ECM שונים, יחד עם תאי מערכת החיסון ותאי סטלט הלבלב (PSC). יחד, אלה נוטים ליצור פיגום עבור התאים לגדול. PSCs הם אחד המרכיבים הגדולים ביותר של תא סטרומה5. יכולתם לייצר אנזימים כמו מטלופרוטאזות מטריצה (MMP), מעכבי רקמות של מטלופרוטאזות מטריצה (TIMP) ופיברובלסטים הקשורים לסרטן (CAF)6 מרמזים על כך שהם עשויים למלא תפקיד קריטי בהתפתחות התגובה הדסמופלסטית. ECM, פיברובלסטים הקשורים לסרטן (CAF) וכלי דם הם ההיבטים הקרדינליים של PDAC. בקרב CAFs, מיופיברובלסטים ו-CAF דלקתיים משערים שהם מעורבים בקרוס-טוק פעיל האחראי לתכונות פרו-סרטניות7. ככל שהתצורות הפיברובלסטיות על הגידול נרחבות יותר, כך הפרוגנוזה 8,9,10 גרועה יותר.
תרבית תאים חד-שכבתית באמצעות קווי תאים מבוססים ממשיכה להישאר כלי שימושי לניתוח רעילות תרופות ומהווה נקודת התחלה טובה למחקרי הוכחת היתכנות וגילוי. קווי תרביות תאים מבוססים, לעומת זאת, חסרים דנ"א של קו הנבט ויחסיות קלינית11. מכיוון שהם גדלים על משטחים שטוחים, הם עוברים קריטריונים שונים לבחירת מבחנה בהשוואה למצב שבו הם חלק מהגידול, מתחלקים באופן חריג ומאבדים את הפנוטיפ המובחן שלהם12. באופן כללי, תרביות תאים בודדים מגבילות את הטרוגניות הגידול ולכן מאבדות רלוונטיות קלינית. הם אינם מסוגלים לייצג במדויק את המורכבות של המיקרו-סביבה של הגידול (למשל, ECM). תרבית תלת-ממדית יכולה לשכפל בצורה קרובה יותר את המיקרו-סביבה המורכבת של הגידול.
תרבית תלת-ממדית הוצגה בשנות ה-70 של המאה ה-20 עבור תאים בריאים ומקביליהם הניאופלסטיים13. מספר טכניקות שימשו לחקר המורפולוגיה והארכיטקטורה של רקמות ממאירות באמצעות ספרואידים14. תרביות משותפות עם תאי סטרומה יכולות למדל אותות TME. עלייה בוויסות של סמני EMT נצפתה כאשר תאים עברו תרבית משותפת עם תאי סטלט15. ספרואידים PDAC ואת האינטראקציה שלהם עם stroma ניתן למדל על ידי תרבית משותפת עם רכיבי ECM. תרבית משותפת במיוחד עם PSCs דווחה כמייצרת נתוני ציטוטוקסיות של תרופות רלוונטיות מבחינה קלינית 16,17,18. PSCs גם מסייעים לעמידות לתרופות על ידי התחמקות מאפופטוזיס וגירוי התפשטות של תאים סרטניים באמצעות גורמים פרקריניים שונים19 ועל ידי גרימת מעבר EMT. לכן, זה הופך להיות קריטי לכלול את PSCs משלב מוקדם בקריטריונים המשמשים להערכת ההצלחה של מערכת אספקת תרופות או תרופות. היכולת של PSC להגביר את ההתרבות ולתמוך בצמיחה מהירה יותר בשילוב, בהשוואה לתאי סרטן הלבלב בלבד, נצפתה גם היא in vivo כאשר זריקות תת-עוריות של שני קווי התאים הוערכו בעכברים מדוכאי חיסון20.
היכולת של סוג תא לקיים אינטראקציה עם רכיבי ECM היא גם קריטית שיש לקחת בחשבון בעת גידול ספרואידים בתרבית משותפת. דווח כי ל-BxPC-3 ול-PANC-1 יש זיקות שוות בקישור לקולגן. שני קווי התאים גם נקשרים באופן שווה ללמינין, אם כי היו דיווחים כי BxPC-3 נקשר טוב יותר 21,22,23,24,25. במונחים של הגירה, Stahle et al.26 הדגימו תנועתיות מהירה פי 5 עבור תאי PANC-1 בהשוואה ל- BxPC-3. דווח גם כי תאי PANC-1 נודדים בעיקר כתאים בודדים, בעוד שתאי BxPC-3 נודדים כיריעה צפופה היטב. בחירת התאים משפיעה גם על גודל הגידול25. גידולי BxPC-3 הוכחו כגדולים יותרב-27,28 מאלו שהתקבלו מ-PANC-1, בעוד שמחקר אחד הראה את המקרה ההפוךמ-29. למרות ההבדלים בגודל ובתנועתיות שלהם, דווח כי שני התאים זקוקים לתקופות ארוכות של חביון כדי ליצור גידולים בעכברים. משך זמן זה יכול להיות ארוך במיוחד עבור BxPC-3 החל 4 שבועות עד 4 חודשים25. עם זאת, יש גם ספרות שבה BxPC-328 או BxPC-3 תאי גזע סרטניים30 יצרו גידולים גלויים מהר יותר, מה שמרמז על כך שיכולה להיות שונות במשכי צמיחת הגידול. משכי הזמן האמורים כאן צריכים, אם כן, לשמש רק כקו מנחה ראשוני לקצב צמיחת הגידול.
תאי BxPC-3 יוצרים ספרואידים עם תאים רופפים על פני השטח וליבות צפופות, בעוד שתאי PANC-1 דווחו כיוצרים הן ספרואידים נקבוביים אך חזקים31 והן ספרואידים קומפקטיים. תאי PANC-1 דווחו גם כפחות ממוינים ויותר אגרסיביים32. תוך שמירה על האופי התוקפני32 בחזית, בשילוב עם התנועתיות הגבוהה יותר של תאי PANC-1, היכולת ליצור ספרואידים קומפקטיים והיכולת לתקשר עם רכיבי ECM, נבחרו תאי PANC-1 למחקרי ספרואידים.
בשנים האחרונות, תרבית ספרואידים ראתה הצלחה רבה בהפגנת יתרון ברלוונטיות הקלינית שלה בהשוואה לתרביות דו-ממדיות (2D). הרלוונטיות שלה מונפה בשימוש בטכניקה זו כתחליף למחקרים בבעלי חיים ולהבנה טובה יותר של הביולוגיה של הגידולים. הרלוונטיות הקלינית של ספרואידים, במיוחד כאשר הם משולבים עם PSC אפשרה את השימוש בהם כדי לחקור פונקציות שונות של הספרואיד כגון נוקשות33, ביטוי של TGF-β 34,35,36,37,38, E-cadherin, F-actin 18,34,36,37, α-SMA 34,35,37,38, לקטט דהידרוגנאז (LDHA)32, HIF-1α35,39, עמידות לתרופות 16,37,40, נדידת תאים41, פלישת תאים37, פיברוזיס35, עמידות לקרינה42, שינויים פנוטיפיים18, הטרוגניות36, רמות תאים של אינטראקציות39 והדגמת רכיבי ECM37,38,39. רבים מהפרוטוקולים ששימשו להשגת הנתונים המתוארים מסתמכים על Matrigel, שיטת הטיפה התלויה, תבניות מודפסות או פיגומים אחרים כדי לסייע בתמיכה בצמיחת ספרואידים ו- ECM. המחקרים כוללים גם בדרך כלל שימוש בתאים פיברובלסטיים שאינם אנושיים או בתאי סטלט טריים שבודדו מחולים. בעוד ששימוש בתאי סטלט הוא קריטי עבור הגידולים כדי להידמות לתנאי in-vivo, השונות הבין-מטופלת הקשורה למיצויים טריים מקשה על שכפול מחקרים אלה.
פרוטוקול זה נועד להדגים מודל קל לפיתוח, ניתן לשחזור, רלוונטי קלינית וללא פיגומים, ובכך להסתמך אך ורק על יכולות התרביות המשותפות ליצור באופן טבעי את ה- ECM. לשם כך נבחרה שיטת תרבית משותפת פשוטה הכוללת תערובת של תאי PANC-1 (בשל נטייתם הטבעית לנדוד כתאים בודדים) יחד עם תאי סטלט לבלב אנושיים (HPaSteC), בשל יכולתם להתנהג כמו תאי גזע ולהיות עמידים מאוד לתרופות. תוך שימוש במחקרים של Durymanov et al.38כנקודת בסיס, הפרוטוקול המפורט להלן נקבע לאחר אופטימיזציה נוספת של פרמטרים כגון יחסי תאים ומשכי זמן בין שינויי מדיה. הספרואידים הנובעים מפרוטוקול זה יכולים לשמש כמערכת מודל להערכת מועמדים חדשיםלתרופה 40.
בנוסף, עבור משתמשים שאינם מכירים את התרבות הספרואידית, העבודה Peirsman et al.43הדנה בפיתוח בסיס הידע של MISpheroID עשויה להיות מועילה. הוא קובע כמה הנחיות מידע מינימליות שיכולות לסייע בהתמודדות עם הטרוגניות בין פרוטוקולי מעבדה. למרות מגבלות מסוימות, העבודה הראתה כי הבחירה של מדיה תרבית, קווי תאים, שיטת היווצרות ספרואידים, ואת גודל הספרואיד הסופי הם קריטיים בקביעת התכונות הפנוטיפיות של spheroids.
Protocol
1. תרבית תאים דו-ממדית
- לגדל תאי PANC-1 בתווך הנשר המעובד של דולבקו (DMEM), בתוספת 10% נסיוב בקר עוברי (FBS) בתנאים סטריליים. יש לגדול עד 70%-80% מפגש לפני המעברים, ואין להשתמש מעבר לקטעה-20 . עיין בתהליך המתואר בשלב 4.2.1.
הערה: כנקודת התייחסות, 1 x 106 תאים ב 20 מ"ל של מדיה צריך בערך 2-3 ימים כדי להגיע 70-80% מפגש. - גדל תאי HPaSteC במצע תאי Stellate בתוספת 2% FBS, 1% PenStrep ו-1% תוסף צמיחת תאי Stellate (SteCGS) באמצעות הערכה שסופקה על ידי היצרן בתנאים סטריליים. גדל בהתאם להוראות היצרן (עם כמה שינויים) כפי שמוצג בשלב 4.2.2 בצלוחית מצופה פולי-L-ליזין.
- דלג על שלב נטרול FBS במהלך טריפסיניזציה מפרוטוקול היצרן מכיוון שנעשה שימוש בתמיסת נטרול טריפסין (TNS). נטרל את תרחיף התא עם נפח כולל של 10 מ"ל TNS כמתואר בשלב 4.2.2.2.
הערה: כנקודת התייחסות, 0.5 x 106 תאים ו- 1 x 106 תאים ב- 20 מ"ל של מדיה זקוקים ל- 3 ימים ויומיים, בהתאמה, כדי להשיג מפגש של 90%. - קציר תאים במפגש של 90%. אין להשתמש בתאים מעבר למעבר 7.
- דלג על שלב נטרול FBS במהלך טריפסיניזציה מפרוטוקול היצרן מכיוון שנעשה שימוש בתמיסת נטרול טריפסין (TNS). נטרל את תרחיף התא עם נפח כולל של 10 מ"ל TNS כמתואר בשלב 4.2.2.2.
- לשמור על תאים בטמפרטורה של 37°C, עם 5%CO2, באינקובטורים סטריליים עם לחות יחסית של 90%-95%. בצע את כל מחקרי תרבית התאים בצלוחית T-75.
2. ציפוי תמיסת פולי(2 -הידרוקסיאתיל מתקרילט (poly-HEMA) לצלחת באר 96
- הכינו תמיסת פולי-HEMA במינון של 5 מ"ג/מ"ל תוך שימוש באתנול 95% על ידי ערבוב למשך הלילה באמצעות מערבל מחומם בטמפרטורה של 37°C. (למשל, 500 מ"ל של תמיסה זקוקים ל-2.5 גרם פולי-HEMA)
- סמן את מיקום עוצמת הקול ההתחלתית לפני הוספת המערבל. השתמש 95% אתנול כדי לפצות על כל אובדן בתמיסה למחרת.
- סננו את התמיסה הסופית בקולט אדים סטרילי באמצעות מסנן 0.22 מיקרומטר ואחסנו אותה במקרר בטמפרטורה של 4°C.
הערה: Poly-HEMA משמש להגברת ההידרופוביות של משטח, המשמש כגורם מרתיע לתאים להיקשר. מכיוון שמחקר זה דורש מהתאים לא להיצמד לבארות ולגדול כחד-שכבתיים, פולי-HEMA משמש כגורם מרתיע נוסף לתכונת החיבור הנמוכה הטבעית של הלוחות, ובכך הופך אותם ללוחות חיבור נמוכים במיוחד. - הוסף 50 μL של תמיסה קרה לכל באר של צלחת microwell תחתית פוליסטירן עגול 96 באר בתוך מכסה מנוע תרבית תאים כדי לצפות את הצלחת.
- השאירו את הבארות עם המכסה דולק בתנור אוויר חם ב 37 מעלות צלזיוס במשך 3 ימים כדי להבטיח את הצלחות יבשות לחלוטין.
- UV לעקר את הצלחות במשך 30 דקות במכסה המנוע של תרבית התא לפני זריעת התא. יש לאחסן במנעול רוכסן סגור היטב לאחסון לטווח ארוך ולעקר לפני השימוש.
3. תכנון תרבית תאים דו-ממדית
- תזמן את הניסוי כך שתאי PANC-1 יהיו זמינים במפגש של 70%-80% באותו יום שבו תאי HPaSteC יגיעו ל-90%.
הערה: בקבוקונים המכילים כמיליון תאים של PANC-1 או HPaSteC, כאשר הם מועלים מחנקן נוזלי באותו יום, עם שונות מסוימת, דורשים 8 ימים של תרבית PANC-1 ו-6-7 ימים של תרבית HPaSteC כדי ששני קווי התאים יהיו מוכנים באותו יום.
צמיחת תרבות 4. 3D
- עיין בסקירה הכללית של התהליך כולו באיור 1 לפני תחילת התהליך.
התראה: הן PANC-1 והן HPaSteC מקורם ביולוגי. טפל ב-PANC-1 (קו תאים סרטניים) בזהירות. - טריפסינזינג וספירת תאים
- טריפסינזה וספירה של תאי PANC-1:
- השליכו את הסופרנאטנט ושטפו את תאי PANC-1 עם 9 מ"ל HBSS (3 מ"ל בכל פעם). יש להשליך ריאגנטים משומשים במכסה המנוע בתמיסת אקונומיקה V/V של 20-25% כדי להבטיח מוות מוחלט של חומר חי/בר קיימא.
- טריפסיניזציה של התאים עם 2 מ"ל של טריפסין. לאחר כמעט 10 דקות (ייתכן שיהיה צורך יותר זמן), כאשר כל התאים מנותקים, לנטרל את ההשעיה עם 10 מ"ל של DMEM + 10% FBS. יש להתחיל עם 3 מ"ל ולאחר מכן לבצע את שלבי השטיפה הבאים, תוך שימוש ב-1 מ"ל לכל שטיפה (נותרו 7 שטיפות) כדי להבטיח איסוף מרבי של תאים שעברו טריפסינה.
- יש לערבב כל אליקוט מנוטרל לתוך אותו צינור של 15 מ"ל. הנפח הסופי בצינור יהיה קרוב ל 12 מ"ל (~ 2 מ"ל טריפסין שנוטרל עם מדיה 10 מ"ל).
- צנטריפוגה את מתלה התא המנוטרל ב 700 x גרם במשך 2 דקות ו 30 שניות. השליכו את הסופרנאטנט והשעו מחדש את הגלולה המתקבלת ב 1 מ"ל של DMEM +10% FBS. קח aliquot מזה עבור ספירת תאים ותייג את הערך המתקבל מסעיף זה כ- "ספירה A".
- טריפסינזה וספירת תאי HPaSteC.
- השליכו את הסופרנאטנט ושטפו את תאי HPaSteC עם 9 מ"ל HBSS (3 מ"ל בכל פעם).
- טריפסיניזציה של התאים עם 2 מ"ל של טריפסין. לאחר כמעט 10 דקות, כאשר כל התאים מנותקים, נטרלו את התרחיף עם 10 מ"ל של תמיסת נטרול טריפסין. יש להתחיל עם 3 מ"ל ולאחר מכן לבצע את שלבי השטיפה הבאים, תוך שימוש ב-1 מ"ל לכל שטיפה (נותרו 7 שטיפות) כדי להבטיח איסוף מרבי של תאים שעברו טריפסינה.
- יש לערבב כל אליקוט מנוטרל לתוך אותו צינור של 15 מ"ל. הנפח הסופי בצינור יהיה קרוב ל-12 מ"ל (~2 מ"ל טריפסין שנוטרל עם 10 מ"ל תמיסת נטרול).
- צנטריפוגה את מתלה התא המנוטרל ב 700 x גרם במשך 2 דקות ו 30 שניות. יש להשליך את הסופרנאטנט ולהשהות מחדש את הגלולה המתקבלת ב-1 מ"ל של מצע תא הסטלט המושלם. קח aliquot מזה עבור ספירת תאים ותייג את הערך המתקבל מסעיף זה כ- "ספירה B".
- טריפסינזה וספירה של תאי PANC-1:
- דילול מתלי תאים ראשוניים
- השהה בשלב זה במידת הצורך (לא מעל 0.5 שעות) לזמן קצר לאחר קבלת שתי הספירות A ו- B או לאחר טריפסינציה ונטרול הן PANC-1 והן HPaSteC. יש לשמור על אמצעי תרבית שאינם בשימוש בטמפרטורה של 37°C ועל מתלי תאים בטמפרטורת החדר (RT; 25 ± 2°C).
- השתמש בספירה A ובספירה B שהושגו קודם לכן, כדי לקחת aliquots ולבצע דילולים בהתאמה (בצינורות נפרדים) כך שהנפח הסופי הוא 1 מ"ל (דילול: DMEM + 10% FBS עבור שני הבקבוקונים) והספירה הסופית היא בין 110,000-140,000 תאים עבור כל סוג תא. לאחר ביצוע דילול זה, ודא את ספירת התאים עבור כל דילול כדי לתת ספירה C (PANC-1) וספירה D (HPaSteC).
- השהה בשלב זה במידת הצורך (לא מעל 15-30 דקות) לאחר קבלת ספירה C וספירה D. אל תפסיק ברגע שהדילולים הסופיים נעשים בשלב 4.3.3.2; ניסוי כדי למנוע התיישבות תאים. שמור על מדיית תרבית שאינה בשימוש ב- 37 ° C ומתלי תאים ב- RT (25 ± 2 ° C).
- שמור על מספר התאים הסופי הדרוש לכל באר ב- HPaSteC: PANC-1: 60:120. השתמש 110 בארות עבור החישוב כדי להסביר עודף. חשב עם ערך בסיס של 100 μL של תרחיף תאים לכל באר (נפח ההשעיה הכולל הוא 11 מ"ל עבור 110 בארות עם HPaSteC: PANC-1: 60:120). הפוך את המתלה הזה בצינור צנטריפוגה סטרילי של 50 מ"ל לערבוב קל.
- השתמש בספירה C ובספירה D, והקפץ מספיק תרחיף תאים לתמיסת DMEM + 10% FBS כדי לקבל HPaSteC: PANC-1: 60:120 בנפח סופי של 11 מ"ל (6,600 תאי HPaSteC ו- 13,200 תאי PANC-1 ב- 11 מ"ל). מערבבים היטב את התמיסה באמצעות פיפטה 1 מ"ל על ידי ערבוב ו pipeting למעלה ולמטה. הימנעו מהיווצרות קצף.
- זריעה
- השתמש פיפטה 200 μL או 100 μL כדי לערבב את המתלה הסופי (ערבוב על ידי הזזת קצה פיפטה סביב בשילוב עם pipetting למעלה ולמטה) בכל שלב לפני הוספת 100 μL של המתלה לכל באר. מוסיפים את 100 μL בעדינות לאורך פינת הבאר.
- השתמש שוב באותו קצה עבור בארות מרובות, אלא אם כן הוא נופל. מערבבים קדימה ואחורה וסופרים עד 10 או 15 (לא שניות) בין התוספות לכל באר עבור המחצית הראשונה (בערך 43 הבארות הראשונות) של הצלחת. הנמיכו את מספר הערבוב ל-5-10 בין כל באר למחצית השנייה (43 הבארות הנותרות) מכיוון שנפח ההשעיה קטן יותר ודורש פחות משך ערבוב.
- אין להשתמש בפיפטטור חוזר מכיוון שציפוי פולי-HEMA הידרופובי יגרום למתלה לקפוץ מהצלחת, מה שיוביל לפיזור לא אחיד.
- השליכו את כל המתלים העודפים לאחר מילוי כל הבארות.
- השתמש פיפטה 200 μL או 100 μL כדי לערבב את המתלה הסופי (ערבוב על ידי הזזת קצה פיפטה סביב בשילוב עם pipetting למעלה ולמטה) בכל שלב לפני הוספת 100 μL של המתלה לכל באר. מוסיפים את 100 μL בעדינות לאורך פינת הבאר.
- צנטריפוגה
- צנטריפוגה את הצלחת הסופית המכילה את תרחיף התא כדי לאחד את כל התאים יחד כגלולה. בזהירות לעטוף את הצלחת עם parafilm סביב הגבול של הצלחת כדי למנוע זיהום במהלך שלב זה. לאחר העטיפה, צנטריפוגו את הצלחת עם איזון נגדי ב 1000 x גרם במשך 2 דקות.
- החזירו את הצלחת למכסה המנוע של תרבית התאים (השתמשו בכפפות המרוססות באתנול כדי לטפל), הסירו את הפרפילם ואחסנו את הצלחות באינקובטור בטמפרטורה של 37°C, עם 5% CO2. אין לרסס את הצלחת בתערובת אתנול-מים בשום שלב.
- תחזוקת תרבות
- צפו בתאים המתאחדים ליצירת ספרואידים תחת מיקרוסקופ אור בהגדלה של פי 4-5 עד היום השלישי. פעל בהתאם לפרוטוקול תחזוקת התרבית כמתואר להלן.
- ביום השלישי, למדוד 5-6 מ"ל של DMEM + 10% FBS ולהוסיף 50 μL ממנו לכל באר לאורך הצד של הבאר.
- אין לערבב או להתסיס את המדיה בכל דרך שהיא במהלך התוספת, מכיוון שהדבר יפגע בכדוריד או יוביל להסרת ספרואידים בשוגג. הנפח הסופי לכל באר יהיה ~ 150 μL.
- מעבר ליום 3, עיינו באיור 2 כדי להכיר את מבנה הבאר ואת מיקום השתקפות האור (בין החלק הגלילי לחלק המעוגל של הבאר) שנראה על המדיה המכונה הילה. בצע פעולות קרוב להילה בזהירות כדי להבטיח שהספרואידים לא ייפגעו.
- ביום 6, למדוד 10-11 מ"ל של DMEM + 10% FBS. השתמש פיפטה 1 מ"ל כדי לשלוף מדיה בכמויות גדולות מבארות מרובות על ידי משיכת מדיה החוצה עד הילה. עשו זאת עבור הצלחת כולה, ולאחר מכן החליפו את המדיה. לאסוף supernatant בכמויות גדולות ולהשליך, או להשליך אותו כפי שהוא נשלף החוצה.
- החלף את המדיה שהושלכה במדיה טרייה על ידי הוספת 100 μL של מדיה לאורך הצד של כל באר. הנפח הסופי בבאר יהיה קרוב ל -200 μL.
- אין למשוך מדיה מעבר להילה, מכיוון שהיא מגדילה את הסיכון לשליפת הספרואיד בטעות.
- ביום 10/11, למדוד 10-11 מ"ל של DMEM + 10% FBS. השתמש פיפטה 1 מ"ל כדי לשלוף מדיה בכמויות גדולות מבארות מרובות על ידי משיכת מדיה החוצה עד הילה. עשו זאת עבור הצלחת כולה, ולאחר מכן החליפו את המדיה. לאסוף supernatant בכמויות גדולות ולהשליך, או להשליך אותו כפי שהוא נשלף החוצה.
- החלף את המדיה שהושלכה במדיה טרייה על ידי הוספת 100 μL של מדיה לאורך הצד של כל באר. הנפח הסופי בבאר יהיה קרוב ל -200 μL.
- ביום השלישי, למדוד 5-6 מ"ל של DMEM + 10% FBS ולהוסיף 50 μL ממנו לכל באר לאורך הצד של הבאר.
- צפו בתאים המתאחדים ליצירת ספרואידים תחת מיקרוסקופ אור בהגדלה של פי 4-5 עד היום השלישי. פעל בהתאם לפרוטוקול תחזוקת התרבית כמתואר להלן.
- הערכת יום אחרון
- בצע טיפול תרופתי על הספרואידים ביום ה -14. דמיינו את הספרואידים לפני השימוש באמצעות מיקרוסקופ הפוך בעל שדה בהיר תחת מטרה 4x כדי לקבוע את נפח ההתחלה של הספרואידים. חשב את אמצעי האחסון (V) באמצעות הנוסחה הבאה:
V = 0.5 × L × W2 - עקוב אחר המשוואה כדי לחשב נפחים ספרואידים המתוארים לעיל. כאן L הוא אורך הציר הראשי, ו- W הוא הרוחב (הקו הארוך ביותר בניצב לציר הראשי). המר את כל היחידות המקוריות ממיקרומטרים למילימטרים כדי לקבל נפח במילימטר מעוקב.
- נפח ההתחלה בכל באר ביום ה -14 הוא בין 150-200 מיקרוליטר עקב אידוי. לטיפולים תרופתיים, הסירו את המדיה עד שההילה מגיעה מכל באר והחליפו אותה ב-100 מיקרוליטר של תמיסת התרופה בחוזק של פי 2, יחד עם ערבוב עדין (ערבבו את המדיה בעדינות קדימה ואחורה תוך כדי ספירה עד 2 בין כל באר).
- השתמש בתמיסות חוזק פי 2 כדי לאפשר לתמיסת התרופה הסופית להיות ב 1x ולהימנע לחלוטין מהסרה מוחלטת של מדיה ישנה מהבארות, כישלון אשר הספרואידים עלולים להיות מופרעים. השתמש בכדורידים תוך 3 ימים ממסגרת זמן זו.
- בצע טיפול תרופתי על הספרואידים ביום ה -14. דמיינו את הספרואידים לפני השימוש באמצעות מיקרוסקופ הפוך בעל שדה בהיר תחת מטרה 4x כדי לקבוע את נפח ההתחלה של הספרואידים. חשב את אמצעי האחסון (V) באמצעות הנוסחה הבאה:
- אוסף ספרואידים
- מדוד נפחים ספרואידים לפני האיסוף, כמתואר בשלב 4.7.2.
- אספו את הספרואידים ביום ה-14 או ה-17, בהתאם לצרכי הניסוי, על ידי הסרת מדיה מכל באר עד להגעה להילה.
- השתמש פיפטה 1 מ"ל כדי להסיר מדיה ולאסוף את supernatant בצינור צנטריפוגה חרוטי 15 מ"ל מבארות מרובות.
- ברגע שלכל הבארות יש מדיה ברמת ההילה, הפחיתו את ההגדרה על פיפטה של 1 מ"ל ל בין 200-300 מיקרוליטר.
- ישר את הצלחת על רקע מכסה המנוע או רקע כהה (למשל, מתלה צינורות) כדי לראות את הספרואידים מתיישבים בתחתית.
- הכניסו בעדינות את הקצה ליד הספרואיד (רדו מתחת להילה) ופיפטה כמות קטנה של מדיה (למשל, הערכה חזותית של קרוב ל-50 מיקרוליטר) קדימה ואחורה כדי להפריע לספרואיד. אל תניח את הקצה ישירות על הספרואידים, מכיוון שזה יכול לפגוע במבנה שלו.
- אל תוציא את כל התקשורת מהבאר בשלב זה. שלוט בתנועת האגודל בחוזקה על הבוכנה של הפיפטה.
- הזיזו את המדיה עד שהכדורית כבר לא נשארת במרכז וניתן לראות אותה נעה על הרקע. משכו מספיק מדיה כדי למצוץ את הספרואיד והעבירו אותו למיקום הרצוי (למשל, אגרו אותו עם ספרואידים אחרים בבאר שהיא חלק מאותה ערכת טיפול).
- השלכת פסולת
- יש להשליך את כל דגימות הנוזלים לאחר נטרולן עם אקונומיקה בהתאם לפרוטוקולים של מחלקת בטיחות הסביבה והבריאות של המעבדות המתאימות. Autoclave ולהשליך את כל פיפטות בשימוש צלוחיות עם פסולת מסוכנת ביולוגית.
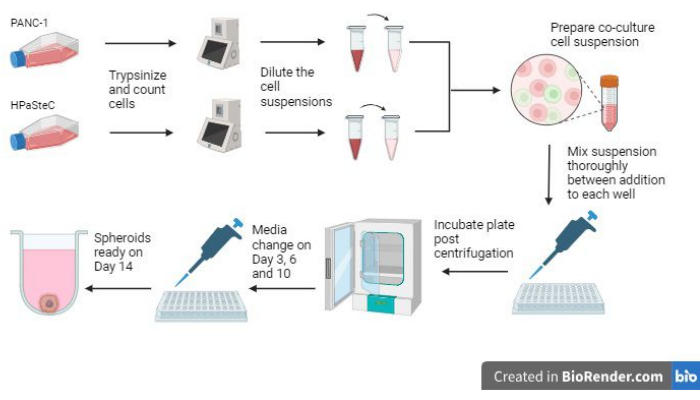
איור 1: סקירה כללית של התהליך לגידול ספרואידים תלת-ממדיים של סרטן לבלב דסמופלסטי (שנוצרו באמצעות BioRender). האיור נותן סקירה כללית של התהליכים הבסיסיים המעורבים; כלומר, טריפסינזינג תאים, שימוש בספירת התאים הראשונית כדי לבצע תרחיפים של תאים מדוללים, הכנת תרבית משותפת באמצעות מתלי התאים המדוללים, הוספת תרחיפים של תאים לכל באר, דגירה על התרביות, ביצוע תחזוקת מדיה והיווצרות ספרואידים סופית כצפוי ביום ה -14. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 2: מבנה באר תחתית U. התמונה הנכונה היא צורה מוגזמת כדי להדגים את החלק "הילה" של הבאר. מטרת האיור היא להגדיר היכן נמצא חלק ה"הילה" של הבאר, שכן עבודה מעל ההילה היא קריטית לגידול הספרואידים ולמניעת אובדן מקרי. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
5. הערכת רכיבי ECM ומיקרוסקופ קונפוקלי
- השתמש immunostaining כדי להעריך את התגובה של ECM לטיפול תרופתי על פי הפרוטוקול המתואר על ידי Durymanov et al.38.
- אגרו את הספרואידים יחד ושטפו פעמיים עם 100 מיקרוליטר של PBS. יש להטמיע בטמפרטורת חיתוך אופטימלית (OCT) רקמה המטמיעה מדיום, להקפיא ולשמור על טמפרטורה של -80°C.
- חותכים את גושי הגידול הקפואים למקטעים של 10 מיקרומטר, מקבעים את החלקים בתערובת אצטון-מתנול (1:1) למשך 15 דקות, ומאפשרים להם להתייבש באוויר ב-RT.
- כדי לקבוע רכיבי ECM, immunostain cryosections עם נוגדנים ראשוניים אנטי פיברונקטין חד שבטי ארנבת, נוגדנים קולגן רב שבטי ארנב סוג I, נוגדנים רב-שבטיים נגד למינין, ונוגדנים לחומצה היאלורונית רב-שבטית כבשים.
- השתמש נגד ארנב עיזים IgG מסומן עם Alexa Fluor 488 או חמור נגד כבשים מצומד עם Alexa Fluor 568 כנוגדנים משניים.
הערה: נוגדנים ראשוניים ומשניים דוללו ב-1:200 וב-1:300, בהתאמה. - קבל תמונות של כל קטעי הספרואידים באמצעות מיקרוסקופ סריקת לייזר קונפוקלי המצויד בעדשת 20x/0.45 אובייקטיבית.
תוצאות
שלושה מהשלבים הקריטיים ביותר שמעורבים בגידול הספרואידים הם ספירת התאים הראשונית, שלבי הערבוב בזמן זריעת הספרואידים, וביצוע שינויי מדיה בזמן כדי לאפשר לכדוריות לגדול (איור 1). נוסף על כך, היכרות עם איור 2 של שינויי המדיה לאחר היום השלישי היא קריטית כדי לאפשר שינויי מדיה אפקטיביים עקב הגידול בנפח המדיה בכל באר. כאשר כל השלבים האלה מבוצעים בהתאם להוראות שניתנו, נמצא שהספרואידים (איור 3) גדלים לנפח ממוצע של 0.048 ± 0.012 מ"מ3 (451 מיקרומטר x 462.84 מיקרומטר) (איור 4). נתקלו במקרים שבהם תאים עשויים לגדול טוב יותר, מה שהוביל לנפחים ממוצעים התחלתיים גדולים יותר של 0.096 ± 0.014 מ"מ3 (611 מיקרומטר x 560 מיקרומטר) ביום ה-14. מגוון סיבות עשויות להוביל לכך שהספרואידים יהיו בעלי נפחים התחלתיים גדולים יותר, כגון שמירה על הטמפרטורה והלחות של האינקובטור או שימוש במעברי תאים מוקדמים יותר, בעלי חיוניות משופרת מעט בהשוואה למעברים מאוחרים יותר.
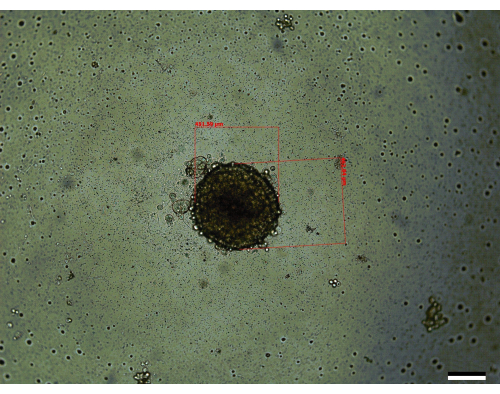
איור 3: ספרואיד מייצג כפי שנראה ביום ה-14 (גודל: 451.59 מיקרומטר x 462.84 מיקרומטר). סרגל קנה מידה = 200 מיקרומטר. כל ספרואיד נמדד לאורך צירו הארוך והקצר ביותר, בהתאמה, והשתמש במשוואה המתוארת בסעיף השיטות כדי לחשב את הנפח. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 4: התקדמות גדילה ספרואידית במשך 17 יום. לוחות 1 ו -2 משוכפלים. קווי השגיאה מייצגים את סטיית התקן. ניתן להשתמש באיור כהערכה משוערת של נפחי הספרואידים שניתן לראות בימים 6, 10, 14 ו-17. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
עם זאת, במקרים בהם התאים אינם נספרים כראוי או, תרחיף התא אינו מעורבב היטב, או התרבות הסופית אינה נשמרת באופן קבוע, או שילוב של שגיאות אלה להתרחש, זה עלול להוביל להתפתחות של ספרואידים קטנים יותר או spheroids גדל לחלוטין. ספרואידים בעלי מראה דומה נצפו גם כאשר מחקרי אופטימיזציה ראשוניים השלימו מדיה רק בבארות סביב שולי הצלחת ביום 3 במקום בצלחת כולה (איור 5). לחילופין, במקרים בהם התאים אינם מעורבבים היטב, או שטעויות ספירה/דילול ראשוניות מובילות לזריעת יותר תאים לבאר מההמלצה, ניתן לראות מספר ספרואידים בכל באר. ממצא דומה נצפה כאשר נעשה שימוש בתאי PANC-1:HPaSteC ביחס של 240:120 (איור 6). ניתן לראות זאת גם מדי פעם כאשר מגדלים ספרואידים לכל כיוון, אך מספרם של ספרואידים כאלה קטן יותר (למשל, בארות 4/96 עשויות להכיל שני ספרואידים לכל באר במקום אחת). במקרים בהם נתקלים במספר ספרואידים, הימנעו משימוש בבארות עם ספרואידים מרובים או רשמו הערות על שינויים בנפחים כאשר ספרואידים אלה מטופלים. שינויי מדיה לא נכונים במקום שבו קצה פיפטה יורד מתחת להילה (איור 1) עשויים גם להוביל לאובדן מקרי של הספרואידים.

איור 5: תמונה מייצגת של ספרואיד שגדל בצורה גרועה ביום ה-14. סרגל קנה מידה = 200 מיקרומטר. כאן, התאים לא צברו היטב, ולכן זה הופך להיות קשה למדוד את אורך ורוחב של spheroid. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
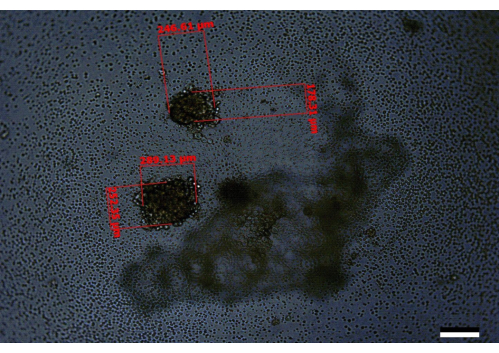
איור 6: תמונה מייצגת של באר המכילה שני ספרואידים שגדלו בצורה גרועה, כפי שניתן לראות ביום ה-14. סרגל קנה מידה = 200 מיקרומטר. כאן, אחד הספרואידים יש גודל של 246.61 מיקרומטר x 178.31 מיקרומטר והשני 289.13 מיקרומטר x 252.35 מיקרומטר. זוהי דוגמה שבה סביר להניח שיש בעיה עם דילולים ראשוניים או איכות התאים ששימשו כדי להתחיל את הניסוי. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
הספרואידים מפתחים גם ECM עם ארבעה מרכיבי ECM עיקריים: קולגן-I, למינין, חומצה היאלורונית ופיברונקטין . במחקרים שהמעבדה פרסמה בעבר, היתרון של התרבית המשותפת על פני PANC-1 לבדו הודגם במונחים של הומו PANC-1 ספרואידים המציגים קולגן מפוזר, ללא פיברונקטין ופחות שקיעת חומצה היאלורונית.
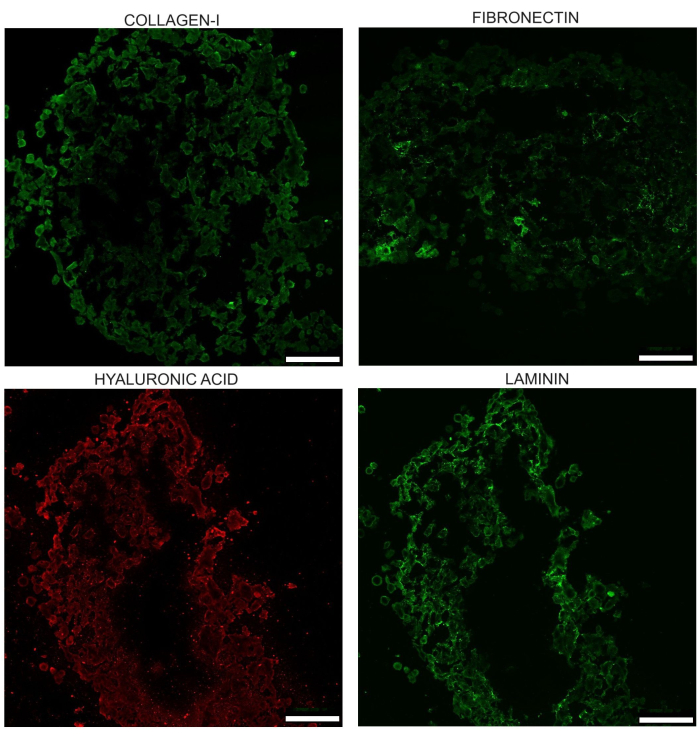
איור 7: תמונה מייצגת של ארבעת מרכיבי ה-ECM העיקריים כפי שנצפו ביום ה-17 בספרואידים שלא טופלו: קולגן I, למינין, חומצה היאלורונית ופיברונקטין (fibronectin). תמונות אלה מתקבלות לאחר cryosections immunostaining של spheroid. הבהירות של תמונות אלה הוגדלה באופן אחיד כדי לסייע בהדגשת הבדלים במראה. אזורים שבהם רקמה פגומה או חסרה חייבים להיות מותאמים בזמן ביצוע מדידות העוצמה. פסי קנה מידה = 100 מיקרומטר. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
Discussion
משך הזמן ויחסי התאים שנבחרו לגידול הספרואידים התבססו על מחקרים כפי שדווחו קודם לכן38. כאשר ניסו למטב מחקרים אלה על ידי החלפת תאי NIH3T3 בתאי HPaSteC, נפחי הספרואידים ודפוסי אפופטוזיס נמצאו דומים מאוד לפרמטרים הממוטבים שדווחו (דווח עבור PANC-1: NIH3T3:: 120:12) כאשר יחסי PANC-1: HPaSteC היו 120: 60. למרות שמחקרים אלה מודדים אפופטוזיס רק עד היום ה -14, הפרוטוקול המתואר בתהליך זה ממשיך להשתמש בספרואידים עד היום ה -17, שכן לא נצפתה עלייה נראית לעין בהיווצרות פסולת בין היום ה -14 ליום ה -17. כביקורת, כל הספרואידים המוערכים ביום ה -17 כוללים תמיד זרוע לא מטופלת כדי לשמש כבסיס לעלייה טבעית בנפח הספרואידים ובאפופטוזיס.
לתהליך הזריעה והגידול של הספרואידים יש 3 שלבים קריטיים: ספירה נכונה, ערבוב לפני הוספת התאים ותחזוקה לתרביות. מכיוון שהתהליך מסתמך על שימוש במספר קטן של תאי PANC-1 ו- HPaSteC, ספירה נכונה ודילולים נכונים הופכים קריטיים. זה חשוב במיוחד עבור תאי HPaSteC מכיוון שתאים אלה קטנים יותר מתאי PANC-1, וקל לזלזל במספר התא. לכן, קריטי לספור את התאים בזהירות. הערכת חסר של הספירה גורמת להיווצרות ספרואידים מרובים, בעוד שהערכת יתר עלולה להוביל לכדורידים שנוצרו בצורה גרועה.
זה גם הופך להיות קריטי לערבב היטב את המתלים בכל השלבים. עבודה עם הציפייה שתאים עשויים לשקוע מסייעת למנוע תת-ערבוב ומבטיחה פיזור תאים אחיד. בעת הכנת הספרואידים ליותר מצלחת אחת (למשל, שתי צלחות), מומלץ שמספר התערובות הלוך ושוב (שלב 4.4.1) יהיה לפחות 20 בין כל באר. ניתן לצמצם זאת ל-15 כאשר הצלחת הראשונה נמצאת באמצע הדרך, ואחריה 10 כאשר מתחילים את הצלחת הבאה, ו-5 כאשר מתקדמים לקראת המחצית השנייה של הצלחת השנייה. ביצוע תנועת ערבוב עם פיפטה במקביל לערבוב קדימה ואחורה מסייע לשפר את מידת הערבוב. רעיון שיש לשקול הוא לערב אדם שני בעת הכנת שתי צלחות, שכן זה מגביר את המהירות ואת יעילות הערבוב. בתרחיש זה, שני אנשים יכולים להשתמש במכסה המנוע בו זמנית עם המתלים והצלחות האישיים שלהם על ידי עבודה על הפינות הנגדיות של מכסה המנוע.
שמירה על תרביות התאים נחוצה כדי להבטיח שלספרואידים תמיד תהיה אספקת חומרים מזינים נאותה. תוספי מדיה בימים 3 ו -6 הם קריטיים ביותר, שכן זה המקום שבו התאים גדלים צריך להיות מוזן היטב. שינויים במדיה בימים 6 ו -10/11 יכולים גם להיות מסובכים מכיוון שהם כרוכים באיסוף סופרנאטנט כלשהו כדי להשליך מדיה ישנה. צעד זה חייב להיעשות בזהירות על ידי שליפה עדינה של המדיה החוצה עד "הילה" ולא מעבר. זה עוזר למנוע שאיבת מדיה מקרוב מדי לספרואיד ואובדן לא מכוון של ספרואידים במהלך שינוי התקשורת.
לשיטה יתרון גדול בכך שהיא ניתנת לשחזור בקלות ואינה דורשת כל עובש או חומר פיגומים, בניגוד לשיטות שהזכרנו קודם לכן 32,34,35,36,37,39. בנוסף, המדיה המשמשת היא מדיה סטנדרטית של תרביות תאים, שהיא זולה יחסית בניגוד למדיה EGM-239, תערובות של מדיה תאית כוכבית, ו- DMEM-FBS35או כל מדיה לבדה, תלוי בסוגי תאים34. יתרון זה הופך להיות קריטי ביכולת התרגום בין מעבדות ובקלות ההקמה. ניתן גם להגדיל את התהליך למספר צלחות, אך סביר להניח שידרוש אדם אחד לכל שתי צלחות. האופי החזק של הספרואידים מאפשר גם להעריך אותם בתנאי ערבוב. שלב זה מועיל במיוחד בביצוע מחקרי שחרור וספיגה תאיים פרמקוקינטיים או חפורים שבהם מעורבים ספרואידים.
למרות יתרונותיה, מגבלה של השיטה היא שהיא זקוקה לערבוב יסודי מאוד בשלב הזריעה. זה יכול להיות זמן רב ומאומץ פיזית. דרך אפשרית לעקוף זאת יכולה לכלול שימוש בחרוז מגנטי מעוקר היטב כדי לשמור על תנאי ערבוב קבועים במהלך תהליך הזריעה. איסוף הספרואידים הוא גם מסובך ודורש קצת תרגול. הספרואידים גם זקוקים לזמן כדי לגדול, ולכן דורשים תכנון קפדני כדי להבטיח זמינות כוח אדם ואספקה לשינויי מדיה.
לסיכום, פותחה שיטה פשוטה וניתנת לשחזור לייצור ספרואידים תלת-ממדיים דסמופלסטיים רלוונטיים מבחינה קלינית. הספרואידים חזקים ומסוגלים לייצר רכיבי ECM: קולגן I, למינין, חומצה היאלורונית ופיברונקטין . הפשטות הכרוכה ביצירת ספרואידים אלה נושאת יתרון ייחודי בכך שהם ניתנים לשחזור בקלות וניתנים להתאמה בקלות לשינויים כגון הכללת קו תאים שלישי. יתרון ייחודי נוסף של המודל הוא שהוא עמיד לטיפול40. זה עוזר להוסיף לרלוונטיות הקלינית שלה ומבטיח שרק התרופות היעילות ביותר ייבחרו להתקדם ולהיות מנוצלות לטיפול בסרטן הלבלב. יתר על כן, ניתן לאסוף ולהשתיל ספרואידים אלה בעכברים כדי לתת גידולים דסמופלסטיים הניתנים לשחזור עבור ניתוח in vivo 38ומשמשים גם לבחינת החדירה של גדלים שונים של ננו-חלקיקים44כפי שתואר קודם לכן.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
העבודה שתוארה נתמכה על ידי משרד מושלי דקוטה הדרומית לפיתוח כלכלי, תוכנית מענקי המחקר התחרותיים של מועצת העוצרים של דקוטה הדרומית (SD-BOR-CRGP) והמחלקה למדעי התרופות באוניברסיטת מדינת דקוטה הדרומית על תמיכתם.
Materials
| Name | Company | Catalog Number | Comments |
| Axio Observer inverted microscope | Carl Zeiss | 0450-354 | |
| Cellometer Auto T4 | Nexcelom Bioscience LLC | Auto-T4 | |
| DMEM, powder, high glucose | Gibco | 12100046 | |
| Donkey anti-sheep conjugated with Alexa Fluor 568 | Abcam | ab175712 | |
| Fetal Bovine Serum | Cytiva | SH3091003HI | |
| Goat antirabbit IgG labeled with Alexa Fluor 488 | Abcam | ab150077 | |
| Hanks Balanced Salt Solution (HBSS) | Gibco | 14175145 | |
| Human Pancreatic Stellate Cells (HPaSteC) | ScienCell | 3830 | |
| Microscope Nikon | Nikon | Eclipse Ts 100 | |
| Nunc 96-Well Polystyrene Round Bottom Microwell Plates | Thermo Scientific | 12-565-331 | |
| Olympus Fluoview FV1200 confocal laser | Olympus | N/A | Discontinued product |
| PANC-1 | ATCC | CRL-1469 | |
| Poly-HEMA | Sigma | P3932 | |
| Rabbit polyclonal anti-laminin antibodies | Abcam | ab11575 | |
| Rabbit polyclonal anti-type I collagen antibodies | Abcam | ab34710 | |
| Sheep polyclonal anti-hyaluronic acid antibodies | Abcam | ab53842 | |
| Stellate cell media complete kit | ScienCell | 5301 | |
| Trypsin | MP Biomedicals, LLC | 153571 | Trypsin solution prepared according to manufacturers protocol and used at 0.25%w/v |
| Trypsin Neutralization Solution (TNS) | ScienCell | 103 |
References
- Hingorani, S. R. Epithelial and stromal co-evolution and complicity in pancreatic cancer. Nat Rev Cancer. 23 (2), 57-77 (2023).
- Laklai, H., et al. Genotype tunes pancreatic ductal adenocarcinoma tissue tension to induce matricellular fibrosis and tumor progression. Nat Med. 22 (5), 497-505 (2016).
- Binker, M. G., Binker-Cosen, M. J., Binker-Cosen, A. A., Cosen-Binker, L. I. Microenvironmental factors and extracellular matrix degradation in pancreatic cancer. J Pancreas. 15 (4), 280-285 (2014).
- Spano, D., Zollo, M. Tumor microenvironment: a main actor in the metastasis process. Clin Exp Metastasis. 29 (4), 381-395 (2012).
- Ware, M. J., et al. Generation of an in vitro 3D PDAC stroma rich spheroid model. Biomaterials. 108, 129-142 (2016).
- Sunami, Y., Häußler, J., Kleeff, J. Cellular heterogeneity of pancreatic stellate cells, mesenchymal stem cells, and cancer-associated fibroblasts in pancreatic cancer. Cancers. 12 (12), 3770 (2020).
- Öhlund, D., et al. Distinct populations of inflammatory fibroblasts and myofibroblasts in pancreatic cancer. J Exp Med. 214 (3), 579-596 (2017).
- Pandol, S., Edderkaoui, M., Gukovsky, I., Lugea, A., Gukovskaya, A. Desmoplasia of pancreatic ductal adenocarcinoma. Clin Gastroenterol Hepatol. 7 (11), S44-S47 (2009).
- Watanabe, I., et al. Advanced pancreatic ductal cancer: fibrotic focus and β-catenin expression correlate with outcome. Pancreas. 26 (4), 326-333 (2003).
- Hu, G., et al. Tumor-infiltrating podoplanin+ fibroblasts predict worse outcome in solid tumors. Cell Physiol Biochem. 51 (3), 1041-1050 (2018).
- Kapałczyńska, M., et al. 2D and 3D cell cultures-a comparison of different types of cancer cell cultures. Arch Med Sci. 14 (4), 910-919 (2018).
- Monberg, M. E., et al. Occult polyclonality of preclinical pancreatic cancer models drives in vitro evolution. Nat Commun. 13 (1), 3652 (2022).
- Emerman, J. T., Pitelka, D. R. Maintenance and induction of morphological differentiation in dissociated mammary epithelium on floating collagen membranes. In Vitro. 13 (5), 316-328 (1977).
- Kelm, J. M., Timmins, N. E., Brown, C. J., Fussenegger, M., Nielsen, L. K. Method for generation of homogeneous multicellular tumor spheroids applicable to a wide variety of cell types. Biotechnol Bioeng. 83 (2), 173-180 (2003).
- Kikuta, K., et al. Pancreatic stellate cells promote epithelial-mesenchymal transition in pancreatic cancer cells. Biochem Biophys Res Commun. 403 (3-4), 380-384 (2010).
- Lee, J. -. H., et al. Microfluidic co-culture of pancreatic tumor spheroids with stellate cells as a novel 3D model for investigation of stroma-mediated cell motility and drug resistance. J Exp Clin Cancer Res. 37 (1), 4 (2018).
- Wong, C. -. W., Han, H. -. W., Tien, Y. -. W., Hsu, S. -. H. Biomaterial substrate-derived compact cellular spheroids mimicking the behavior of pancreatic cancer and microenvironment. Biomaterials. 213, 119202 (2019).
- Liu, X., et al. 3D heterospecies spheroids of pancreatic stroma and cancer cells demonstrate key phenotypes of pancreatic ductal adenocarcinoma. Transl Oncol. 14 (7), 101107 (2021).
- Vonlaufen, A., et al. Pancreatic stellate cells: partners in crime with pancreatic cancer cells. Cancer Res. 68 (7), 2085-2093 (2008).
- Bachem, M. G., et al. Pancreatic carcinoma cells induce fibrosis by stimulating proliferation and matrix synthesis of stellate cells. Gastroenterology. 128 (4), 907-921 (2005).
- Greco, E., et al. Pancreatic cancer cells invasiveness is mainly affected by interleukin-1β not by transforming growth factor-β1. Int J Biol Markers. 20 (4), 235-241 (2005).
- Arao, S., Masumoto, A., Otsuki, M. β1 integrins play an essential role in adhesion and invasion of pancreatic carcinoma cells. Pancreas. 20 (2), 129-137 (2000).
- Sawai, H., Yamamoto, M., Okada, Y., Sato, M., Akamo, Y., Takeyama, H., Manabe, T. Alteration of integrins by Interleukin-1alpha in human pancreatic cancer cells. Pancreas. 23 (4), 399-405 (2001).
- Chen, J., et al. Expression and function of the epidermal growth factor receptor in physiology and disease. Physiol Rev. 96 (3), 1025-1069 (2016).
- Deer, E. L., et al. Phenotype and genotype of pancreatic cancer cell lines. Pancreas. 39 (4), 425 (2010).
- Stahle, M., et al. Mechanisms in LPA-induced tumor cell migration: critical role of phosphorylated ERK. J Cell Sci. 116, 3835-3846 (2003).
- Aubert, M., et al. Decrease of human pancreatic cancer cell tumorigenicity by α1, 3galactosyltransferase gene transfer. Int J Cancer. 107 (6), 910-918 (2003).
- Miknyoczki, S. J., Chang, H., Klein-Szanto, A., Dionne, C. A., Ruggeri, B. A. The Trk tyrosine kinase inhibitor CEP-701 (KT-5555) exhibits significant antitumor efficacy in preclinical xenograft modelsof human pancreatic ductal adenocarcinoma. Clin Cancer Res. 5 (8), 2205-2212 (1999).
- Fukasawa, M., Korc, M. Vascular endothelial growth factor-trap suppresses tumorigenicity of multiple pancreatic cancer cell lines. Clin Cancer Res. 10 (10), 3327-3332 (2004).
- Hernández-Camarero, P., et al. Pancreatic (pro) enzymes treatment suppresses BXPC-3 pancreatic Cancer Stem Cell subpopulation and impairs tumour engrafting. Sci Rep. 9 (1), 11359 (2019).
- Ware, M. J., et al. Generation of homogenous three-dimensional pancreatic cancer cell spheroids using an improved hanging drop technique. Tissue Eng Part C Methods. 22 (4), 312-321 (2016).
- Longati, P., et al. 3D pancreatic carcinoma spheroids induce a matrix-rich, chemoresistant phenotype offering a better model for drug testing. BMC Cancer. 13, 95 (2013).
- Kpeglo, D., et al. Modeling the mechanical stiffness of pancreatic ductal adenocarcinoma. Matrix Biol Plus. 14, 100109 (2022).
- Jang, S. -. D., et al. Anti-cancer activity profiling of chemotherapeutic agents in 3D co-cultures of pancreatic tumor spheroids with cancer-associated fibroblasts and macrophages. Cancers. 13 (23), 5955 (2021).
- Pednekar, K. P., Heinrich, M. A., van Baarlen, J., Prakash, J. Novel 3D µtissues mimicking the fibrotic stroma in pancreatic cancer to study cellular interactions and stroma-modulating therapeutics. Cancers. 13 (19), 5006 (2021).
- Kim, S. -. K., et al. Phenotypic heterogeneity and plasticity of cancer cell migration in a pancreatic tumor three-dimensional culture model. Cancers. 12 (5), 1305 (2020).
- Hwang, H. J., Oh, M. -. S., Lee, D. W., Kuh, H. -. J. Multiplex quantitative analysis of stroma-mediated cancer cell invasion, matrix remodeling, and drug response in a 3D co-culture model of pancreatic tumor spheroids and stellate cells. J Exp Clin Cancer Res. 38 (1), 258 (2019).
- Durymanov, M., et al. Subcutaneous inoculation of 3D pancreatic cancer spheroids results in development of reproducible stroma-rich tumors. Transl Oncol. 12 (1), 180-189 (2019).
- Giustarini, G., Teng, G., Pavesi, A., Adriani, G. Characterization of 3D heterocellular spheroids of pancreatic ductal adenocarcinoma for the study of cell interactions in the tumor immune microenvironment. Front Oncol. 13, 1156769 (2023).
- Alseud, K., et al. Synthesis and biological activity of 11-oxygenated and heterocyclic estrone analogs in pancreatic cancer monolayers and 3D spheroids. Bioorg Med Chem. , (2024).
- Fitzgerald, A. A., et al. Fibroblast activation protein regulates natural killer cell migration, extravasation and tumor infiltration. bioRxiv. , 429622 (2021).
- Wishart, G., Gupta, P., Schettino, G., Nisbet, A., Velliou, E. 3D tissue models as tools for radiotherapy screening for pancreatic cancer. Br J Radiol. 94 (1120), 20201397 (2021).
- Peirsman, A., et al. MISpheroID: a knowledgebase and transparency tool for minimum information in spheroid identity. Nat Methods. 18 (11), 1294-1303 (2021).
- Durymanov, M., Kroll, C., Permyakova, A., Reineke, J. Role of endocytosis in nanoparticle penetration of 3D pancreatic cancer spheroids. Mol Pharm. 16 (3), 1074-1082 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved