Method Article
Cultivo de esferoides desmoplásicos tridimensionales de cáncer de páncreas a partir de cocultivo
En este artículo
Resumen
El cáncer de páncreas sigue siendo uno de los cánceres más difíciles de tratar. Por lo tanto, es fundamental que los modelos preclínicos que evalúan la eficacia del tratamiento sean reproducibles y clínicamente relevantes. Este protocolo describe un procedimiento simple de cocultivo para generar esferoides desmoplásticos reproducibles y clínicamente relevantes.
Resumen
El adenocarcinoma ductal de páncreas (PDAC) es uno de los cánceres más mortales, con una tasa de supervivencia a 5 años del <12%. El mayor obstáculo para la terapia es la densa matriz extracelular desmoplásica (MEC) que rodea el tumor y reduce la vascularización, generalmente denominada desmoplasia. Se han probado una variedad de combinaciones y formulaciones de medicamentos para tratar el cáncer, y aunque muchos de ellos muestran éxito preclínico, fracasan clínicamente. Por lo tanto, es importante disponer de un modelo clínicamente relevante que pueda predecir la respuesta del tumor a la terapia. Este modelo ha sido validado previamente frente a tumores clínicos resecados. Aquí se describe un protocolo simple para cultivar esferoides desmoplásicos tridimensionales (3D) de cocultivo que pueden generar naturalmente una ECM robusta y no requieren ninguna fuente de matriz externa o andamio para soportar su crecimiento.
En resumen, las células estrelladas pancreáticas humanas (HPaSteC) y las células PANC-1 se utilizan para preparar una suspensión que contiene las células en una proporción de 1:2, respectivamente. Las celdas están recubiertas en una placa U de baja fijación de 96 pocillos recubierta de poli-HEMA. La placa se centrifuga para permitir que las células formen un pellet inicial. La placa se almacena en la incubadora a 37 °C con 5% de CO2, y los medios se reemplazan cada 3 días. Las placas se pueden visualizar a intervalos designados para medir el volumen de esferoides. Después de 14 días de cultivo, se forman esferoides desmoplásicos maduros (es decir, un volumen promedio de 0,048 + 0,012mm3 (451 μm x 462,84 μm)) y se pueden utilizar para la evaluación de terapias experimentales. Los componentes maduros de la MEC incluyen colágeno-I, ácido hialurónico, fibronectina y laminina.
Introducción
El mal pronóstico del cáncer de páncreas se asocia a una variedad de razones, entre las que se encuentra la falta de biomarcadores fácilmente detectables que conduzcan a una detección tardía. Otra razón importante es el espeso estroma que rodea el tejido, lo que conduce a una reducción del suministro de sangre. El depósito de grandes cantidades de matriz extracelular (MEC), la interacción célula-célula, células endoteliales, diversas células inmunitarias, pericitos, miofibroblastos en proliferación y población de fibroblastos, y la presencia de células no neoplásicas (que juntas constituyen la reacción desmoplásica)1, constituyen el estroma espeso responsable de la resistencia a la quimioterapia y a la radioterapia de PDAC2. Las células cancerosas y estromales tienen una interacción compleja, dinámica y bidireccional. Aunque algunos elementos atenúan o aceleran la progresión de la enfermedad, la mayoría de los procesos son adaptativos durante el desarrollo del tumor1. Esto proporciona un entorno rico en factores de crecimiento, factores proangiogénicos, proteasas y moléculas de adhesión. Estos factores promueven la angiogénesis, la proliferación celular, la metástasis y la invasión 3,4. Juntos, son inmunes y santuarios privilegiados para el tumor, lo que resulta en resistencia a los medicamentos.
La desmoplasia es una mezcla compleja que consta de varias proteínas de la MEC, junto con células inmunitarias y células estrelladas pancreáticas (PSC). Juntos, tienden a formar un andamio para que crezcan las células. Las PSC son uno de los componentes más grandes del compartimento estromal5. Su capacidad para producir enzimas como las metaloproteasas de la matriz (MMP), los inhibidores tisulares de las metaloproteasas de la matriz (TIMP) y los fibroblastos asociados al cáncer (CAF)6 implican que es probable que desempeñen un papel fundamental en el desarrollo de la reacción desmoplástica. La MEC, los fibroblastos asociados al cáncer (CAF) y la vasculatura son los aspectos cardinales del PDAC. Entre los CAF, se especula que los miofibroblastos y los CAF inflamatorios están involucrados en la diafonía activa responsable de las propiedades protumorales7. Cuanto más extensas son las formaciones fibroblásicas en el tumor, peor pronóstico 8,9,10.
El cultivo de células monocapa a través de líneas celulares establecidas sigue siendo una herramienta útil para analizar la toxicidad de los fármacos y es un buen punto de partida para los estudios de prueba de concepto y descubrimiento. Sin embargo, las líneas de cultivo celular establecidas carecen de ADN de la línea germinal y de relatividad clínica11. Al crecer en superficies planas, se someten a diferentes criterios de selección in vitro en comparación con cuando forman parte del tumor, se dividen de forma anormal y pierden su fenotipo diferenciado12. En general, los cultivos unicelulares limitan la heterogeneidad tumoral y, por lo tanto, pierden relevancia clínica. Son incapaces de representar con precisión la complejidad del microambiente del tumor (por ejemplo, la MEC). El cultivo 3D puede replicar más de cerca el complejo microambiente tumoral.
El cultivo 3D se introdujo en la década de 1970 para células sanas y sus contrapartes neoplásicas13. Se han utilizado varias técnicas para estudiar la morfología y arquitectura de los tejidos malignos a través de esferoides14. Los cocultivos con células estromales pueden modelar señales de TME. Se observó una regulación positiva de los marcadores de EMT cuando las células se cocultivaron con células estrelladas15. Los esferoides PDAC y su interacción con el estroma pueden modelarse mediante el cocultivo con componentes de la MEC. Se ha reportado que el cocultivo específicamente con PSCs produce datos clínicamente relevantes sobre la citotoxicidad de fármacos 16,17,18. Las PSC también ayudan a la resistencia a los medicamentos al evadir la apoptosis y estimular la proliferación de células cancerosas a través de varios factores paracrinos19 e inducir la transición de EMT. Por lo tanto, se vuelve fundamental incluir las PSC desde una etapa temprana en los criterios utilizados para evaluar el éxito de un medicamento o sistema de administración de medicamentos. La capacidad de la PSC para mejorar la proliferación y apoyar un crecimiento más rápido en combinación, en comparación con las células de cáncer de páncreas solas, también se ha visto in vivo cuando se evaluaron las inyecciones subcutáneas en el flanco de las dos líneas celulares en ratones inmunocomprometidos20.
También es fundamental tener en cuenta la capacidad de un tipo de célula para interactuar con los componentes de la ECM cuando se cultivan esferoides cocultivados. Se ha informado que BxPC-3 y PANC-1 tienen afinidades iguales en la unión al colágeno. Las dos líneas celulares también se unen de manera equivalente a la laminina, aunque ha habido informes de que BxPC-3 se une mejor 21,22,23,24,25. En términos de migración, Stahle et al.26 demostraron una motilidad 5 veces más rápida para las células PANC-1 en comparación con BxPC-3. También se informó que las células PANC-1 migran principalmente como células individuales, mientras que las células BxPC-3 migran como una hoja compacta. La elección de las células también afecta al tamaño del tumor25. Se demostró que los tumores BxPC-3 eran más grandes27,28 que los obtenidos con PANC-1, mientras que un estudio demostró lo contrario29 casos. A pesar de sus diferencias de tamaño y motilidad, se ha informado que ambas células necesitan largos períodos de latencia para formar tumores en ratones. Esta duración puede ser especialmente larga para BxPC-3, oscilando entre 4 semanas y 4 meses25. Sin embargo, también hay literatura en la que las células madre cancerosas BxPC-328 o BxPC-330 han formado tumores visibles más rápido, lo que implica que podría observarse una variación en la duración del crecimiento tumoral. Por lo tanto, las duraciones indicadas aquí solo deberían servir como una guía inicial para las tasas de crecimiento tumoral.
Las células BxPC-3 forman esferoides con células sueltas en la superficie y núcleos densos, mientras que las células PANC-1 forman esferoides31 porosos pero robustos, así como esferoides compactos. También se ha reportado que las células PANC-1 son menos diferenciadas y más agresivas32. Manteniendo la naturaleza agresiva32 a la vanguardia, combinada con la mayor motilidad de las células PANC-1, la capacidad de formar esferoides compactos y la capacidad de interactuar con los componentes de la MEC, se eligieron las células PANC-1 para los estudios de esferoides.
En los últimos años, el cultivo de esferoides ha tenido mucho éxito al demostrar una ventaja en su relevancia clínica en comparación con los cultivos bidimensionales (2D). Su relevancia se ha aprovechado en el uso de esta técnica como sustituto de los estudios en animales y para comprender mejor la biología de los tumores. La relevancia clínica de los esferoides, especialmente cuando se cocultivan con PSC, ha permitido su uso para estudiar diversas funciones del esferoide, como la rigidez33, la expresión de TGF-β 34,35,36,37,38, E-cadherina, F-actina 18,34,36,37, α-SMA 34,35,37,38, lactato deshidrogenasa (LDHA)32, HIF-1α35,39, resistencia a fármacos 16,37,40, migración celular41, invasión celular37, fibrosis35, resistencia a la radiación42, cambios fenotípicos18, heterogeneidad36, niveles celulares de interacciones39 y demostrar componentes de ECM37,38,39. Muchos de los protocolos que se utilizaron para obtener los datos descritos se basan en Matrigel, el método de caída colgante, moldes impresos u otros andamios para ayudar a respaldar el crecimiento de esferoides y ECM. Los estudios también suelen implicar el uso de células fibroblásticas no humanas o células estrelladas recién aisladas de los pacientes. Si bien el uso de células estrelladas es fundamental para que los tumores se parezcan a las condiciones in vivo, la variabilidad entre pacientes asociada con las extracciones frescas hace que estos estudios sean difíciles de replicar.
Este protocolo tiene como objetivo demostrar un modelo que sea fácil de desarrollar, reproducible, clínicamente relevante y libre de andamios, confiando así exclusivamente en las capacidades de los cocultivos para generar naturalmente la MEC. Para ello, se optó por un método de cocultivo sencillo que involucra una mezcla de células PANC-1 (debido a su tendencia natural a migrar como células individuales) junto con células estrelladas pancreáticas humanas (HPaSteC), debido a su capacidad para comportarse como células madre y ser altamente resistentes a los medicamentos. Utilizando los estudios de Durymanov et al.38como línea base, se estableció el protocolo que se detalla a continuación después de optimizar aún más parámetros como las proporciones de celdas y las duraciones entre cambios de medios. Los esferoides resultantes de este protocolo pueden ser utilizados como sistema modelo para la evaluación de nuevos candidatos a fármacos40.
Además, para los usuarios que no están familiarizados con el cultivo de esferoides, puede ser útil el trabajo de Peirsman et al.43que analiza el desarrollo de la base de conocimientos MISpheroID. Establece algunas pautas mínimas de información que podrían ayudar a hacer frente a la heterogeneidad entre los protocolos de laboratorio. Aunque con algunas limitaciones, el trabajo demostró que la elección del medio de cultivo, las líneas celulares, el método de formación de esferoides y el tamaño final de los esferoides son fundamentales para determinar las propiedades fenotípicas de los esferoides.
Protocolo
1. Cultivo celular 2D
- Cultive células PANC-1 en el Medio Eagle Modificado (DMEM) de Dulbecco, complementado con un 10% de suero fetal bovino (FBS) en condiciones estériles. Crezca hasta un 70%-80% de confluencia antes de los pasajes, y no lo use más allá del20º paso. Consulte el proceso descrito en el paso 4.2.1.
NOTA: Como punto de referencia, 1 x 106 células en 20 mL de medio necesitan unos 2-3 días para alcanzar una confluencia del 70-80%. - Cultive células HPaSteC en medios de células estrelladas suplementadas con un 2 % de FBS, un 1 % de PenStrep y un 1 % de suplemento de crecimiento de células estrelladas (SteCGS) utilizando el kit suministrado por el fabricante en condiciones estériles. Crezca de acuerdo con las instrucciones del fabricante (con algunas modificaciones) como se muestra en el paso 4.2.2 en un matraz recubierto de Poly-L-Lisina.
- Omita el paso de neutralización de FBS durante la tripsinización del protocolo del fabricante, ya que se utiliza la solución de neutralización de tripsina (TNS). Neutralizar la suspensión celular con un volumen total de 10 mL de TNS, como se describe en el paso 4.2.2.2.
NOTA: Como punto de referencia, 0,5 x 106 células y 1 x 106 células en 20 mL de medio necesitan 3 días y 2 días, respectivamente, para alcanzar una confluencia del 90%. - Recolecta células al 90% de confluencia. No use celdas más allá del pasaje 7.
- Omita el paso de neutralización de FBS durante la tripsinización del protocolo del fabricante, ya que se utiliza la solución de neutralización de tripsina (TNS). Neutralizar la suspensión celular con un volumen total de 10 mL de TNS, como se describe en el paso 4.2.2.2.
- Mantener las células a 37 °C, con 5% de CO2, en incubadoras estériles con humedad relativa del 90%-95%. Realizar todos los estudios de cultivo celular en un matraz T-75.
2. Recubrimiento de solución de poli(2-hidroxietilato de metacrilato (poli-HEMA) para placa de 96 pocillos
- Prepare la solución de poli-HEMA a 5 mg/mL con etanol al 95% dejando que se mezcle durante la noche con un agitador calentado a 37 °C. (por ejemplo, 500 mL de solución necesitan 2,5 g de poly-HEMA)
- Marque la ubicación del volumen de inicio antes de agregar el agitador. Use etanol al 95% para compensar cualquier pérdida en la solución al día siguiente.
- Filtrar la solución final en una campana estéril con un filtro de 0,22 μm y guardarla en la nevera a 4 °C.
NOTA: Poly-HEMA se utiliza para aumentar la hidrofobicidad de una superficie, lo que sirve como elemento disuasorio para que las células se adhieran. Dado que este estudio requiere que las células no se adhieran a los pocillos y crezcan como una monocapa, el poli-HEMA se utiliza como un elemento disuasorio adicional a la característica natural de baja adherencia de las placas, lo que las convierte en placas de fijación ultrabaja. - Agregue 50 μL de la solución fría a cada pocillo de una placa de micropocillo redonda de poliestireno con fondo de 96 pocillos dentro de una campana de cultivo celular para recubrir la placa.
- Deje los pocillos con la tapa puesta en un horno de aire caliente a 37 °C durante 3 días para asegurarse de que las placas estén completamente secas.
- Esterilizar las placas con UV durante 30 min en la campana de cultivo celular antes de la siembra celular. Guárdelo en un cierre hermético para almacenamiento a largo plazo y esterilícelo antes de usarlo.
3. Planificación del cultivo celular en 2D
- Cronometre el experimento para que las células PANC-1 estén disponibles con una confluencia del 70%-80% el mismo día que las células HPaSteC alcancen el 90%.
NOTA: Los viales que contienen alrededor de 1 millón de células de PANC-1 o HPaSteC, cuando se elevan a partir de nitrógeno líquido el mismo día, con alguna variación, requieren 8 días de cultivo de PANC-1 y 6-7 días de cultivo de HPaSteC para tener ambas líneas celulares listas el mismo día.
4. 3D crecimiento de la cultura
- Consulte la descripción general de todo el proceso en la Figura 1 antes de iniciar el proceso.
ATENCIÓN: Tanto PANC-1 como HPaSteC son de origen biológico. Manipule PANC-1 (línea celular cancerosa) con cuidado. - Trypsinzing y recuento de células
- Tripsinze y recuento de células PANC-1:
- Deseche el sobrenadante y lave las células PANC-1 con 9 mL de HBSS (3 mL a la vez). Deseche los reactivos usados en la campana en una solución de lejía al 20-25% V/V para garantizar la muerte completa del material vivo/viable.
- Tripsinizar las células con 2 mL de tripsina. Después de casi 10 min (puede necesitar más tiempo), cuando todas las células estén separadas, neutralice la suspensión con 10 mL de DMEM + 10% de FBS. Comience con 3 ml y siga con los pasos de lavado posteriores usando 1 ml por lavado (7 lavados restantes) para garantizar la máxima recolección de células tripsinizadas.
- Agrupe cada alícuota neutralizada en el mismo tubo de 15 mL. El volumen final en el tubo estará cerca de 12 mL (~2 mL de tripsina que se ha neutralizado con un medio de 10 mL).
- Centrifugar la suspensión de celda neutralizada a 700 x g durante 2 min y 30 s. Desechar el sobrenadante y resuspender el pellet obtenido en 1 mL de DMEM +10% FBS. Tome una alícuota de esto para el recuento de celdas y etiquete el valor obtenido de esta sección como "Recuento A".
- Tripsinze y recuento de células HPaSteC.
- Deseche el sobrenadante y lave las células HPaSteC con 9 mL de HBSS (3 mL a la vez).
- Tripsinizar las células con 2 mL de tripsina. Después de casi 10 minutos, cuando todas las células estén desprendidas, neutralice la suspensión con 10 mL de solución de neutralización de tripsina. Comience con 3 ml y siga con los pasos de lavado posteriores usando 1 ml por lavado (7 lavados restantes) para garantizar la máxima recolección de células tripsinizadas.
- Agrupe cada alícuota neutralizada en el mismo tubo de 15 mL. El volumen final en el tubo estará cerca de 12 mL (~2 mL de tripsina que ha sido neutralizada con 10 mL de solución neutralizante).
- Centrifugar la suspensión de celda neutralizada a 700 x g durante 2 min y 30 s. Deseche el sobrenadante y vuelva a suspender el pellet obtenido en 1 mL del medio celular estrellado suplementado. Tome una alícuota de esto para el conteo de celdas y etiquete el valor obtenido de esta sección como "Recuento B".
- Tripsinze y recuento de células PANC-1:
- Dilución de suspensiones celulares iniciales
- Haga una pausa en este paso si es necesario (no más de 0,5 h) durante un breve período de tiempo después de obtener ambos recuentos A y B o después de intentar tripsinizar y neutralizar tanto PANC-1 como HPaSteC. Mantenga los medios de cultivo no utilizados a 37 °C y las suspensiones celulares a temperatura ambiente (RT; 25 ± 2 °C).
- Utilice el Recuento A y el Recuento B obtenidos anteriormente, para tomar alícuotas y realizar las diluciones respectivas (en tubos separados) de modo que el volumen final sea de 1 mL (diluyente: DMEM + 10% FBS para ambos viales) y el recuento final esté entre 110.000-140.000 células para cada tipo de célula. Una vez realizada esta dilución, se verifican los recuentos de células de cada dilución para dar el recuento C (PANC-1) y el recuento D (HPaSteC).
- Haga una pausa en este paso si es necesario (no más de 15-30 minutos) después de obtener el recuento C y el recuento D. No se detenga una vez que se hayan realizado las diluciones finales en el paso 4.3.3.2; Experimente para evitar la sedimentación de las células. Mantenga los medios de cultivo no utilizados a 37 °C y las suspensiones celulares a RT (25 ± 2 °C).
- Mantenga el número final de celdas necesarias por pocillo en HPaSteC: PANC-1: 60:120. Utilice 110 pozos para el cálculo a fin de tener en cuenta el exceso. Calcule con un valor base de 100 μL de suspensión de celda por pocillo (el volumen total de suspensión es de 11 mL para 110 pocillos con HPaSteC: PANC-1: 60:120). Prepare esta suspensión en un tubo de centrífuga estéril de 50 ml para facilitar la mezcla.
- Utilice el recuento C y el recuento D, y agregue suficiente suspensión celular en una solución DMEM + 10% FBS para tener HPaSteC: PANC-1: 60:120 en un volumen final de 11 mL (6.600 células HPaSteC y 13.200 células PANC-1 en 11 mL). Mezcle bien la solución con una pipeta de 1 ml agitando y pipeteando hacia arriba y hacia abajo. Evite la formación de espuma.
- Siembra
- Utilice una pipeta de 200 μL o 100 μL para mezclar la suspensión final (agite moviendo la punta de la pipeta combinada con el pipeteo hacia arriba y hacia abajo) en cada paso antes de añadir 100 μL de la suspensión por pocillo. Agregue los 100 μL suavemente a lo largo de la esquina del pocillo.
- Vuelva a utilizar la misma punta para varios pozos a menos que se caiga. Mezcle de un lado a otro y cuente hasta 10 o 15 (no segundos) entre las adiciones a cada pocillo para la primera mitad (aproximadamente los primeros 43 pocillos) del plato. Reduzca el conteo de mezcla a 5-10 entre cada pocillo para la segunda mitad (43 pocillos restantes) ya que el volumen de suspensión es menor y requiere menos duración de mezcla.
- No utilice una pipeta de repetición, ya que el recubrimiento hidrofóbico de poli-HEMA hará que la suspensión rebote en la placa, lo que provocará una distribución desigual.
- Deseche cualquier exceso de suspensión después de que se hayan llenado todos los pozos.
- Utilice una pipeta de 200 μL o 100 μL para mezclar la suspensión final (agite moviendo la punta de la pipeta combinada con el pipeteo hacia arriba y hacia abajo) en cada paso antes de añadir 100 μL de la suspensión por pocillo. Agregue los 100 μL suavemente a lo largo de la esquina del pocillo.
- Centrifugación
- Centrifugar la placa final que contiene la suspensión celular para juntar todas las celdas como un pellet. Envuelva cuidadosamente la placa con parafilm alrededor del borde de la placa para evitar la contaminación durante este paso. Después del envolteado, centrifugar la placa con un contrapeso a 1000 x g durante 2 min.
- Vuelva a colocar la placa en la campana de cultivo celular (use guantes rociados con etanol para manipularla), retire el parafilm y guarde las placas en la incubadora a 37 °C, con 5% de CO2. No rocíe la placa con una mezcla de etanol y agua en ningún momento.
- Mantenimiento de la cultura
- Observe las células que se unen para formar esferoides bajo un microscopio óptico con un aumento de 4x-5x en el día 3. Siga el protocolo de mantenimiento del cultivo como se describe a continuación.
- El día 3, mida 5-6 mL de DMEM + 10% de FBS y agregue 50 μL a cada pocillo a lo largo del costado del pocillo.
- No mezcle ni agite el medio de ninguna manera durante la adición, ya que esto dañará el esferoide o provocará una extracción accidental del esferoide. El volumen final por pocillo será de ~150 μL.
- Más allá del día 3, consulte la Figura 2 para familiarizarse con la estructura del pozo y la ubicación de la reflexión de la luz (entre la parte cilíndrica y curva del pozo) que se ve en el medio conocido como halo. Realice operaciones cerca del halo con precaución para asegurarse de que los esferoides permanezcan intactos.
- El día 6, mida 10-11 mL de DMEM + 10% FBS. Utilice una pipeta de 1 ml para extraer los medios a granel de varios pocillos extrayendo los medios hasta el halo. Haga esto para toda la placa, seguido de un reemplazo de medios. Recoja el sobrenadante a granel y deséchelo, o deséchelo a medida que lo extrae.
- Reemplace el medio desechado con medio nuevo agregando 100 μL de medio a lo largo del costado de cada pocillo. El volumen final en el pozo será cercano a los 200 μL.
- No tire de los medios más allá del halo, ya que aumenta el riesgo de extraer accidentalmente el esferoide.
- El día 10/11, mida 10-11 mL de DMEM + 10% FBS. Utilice una pipeta de 1 ml para extraer los medios a granel de varios pocillos extrayendo los medios hasta el halo. Haga esto para toda la placa, seguido de un reemplazo de medios. Recoja el sobrenadante a granel y deséchelo, o deséchelo a medida que lo extrae.
- Reemplace el medio desechado con medio nuevo agregando 100 μL de medio a lo largo del costado de cada pocillo. El volumen final en el pozo será cercano a los 200 μL.
- El día 3, mida 5-6 mL de DMEM + 10% de FBS y agregue 50 μL a cada pocillo a lo largo del costado del pocillo.
- Observe las células que se unen para formar esferoides bajo un microscopio óptico con un aumento de 4x-5x en el día 3. Siga el protocolo de mantenimiento del cultivo como se describe a continuación.
- Evaluación del último día
- Realizar un tratamiento farmacológico con los esferoides el día 14. Tome imágenes de los esferoides antes de su uso utilizando un microscopio invertido de campo claro bajo un objetivo 4x para determinar el volumen inicial del esferoide. Calcule el volumen (V) utilizando la siguiente fórmula:
V = 0,5 × L × W2 - Siga la ecuación para calcular los volúmenes de esferoides que se describe anteriormente. Aquí L es la longitud del eje mayor, y W es el ancho (la línea más larga perpendicular al eje mayor). Convierte todas las unidades originales de micrómetros a milímetros para obtener un volumen en milímetros cúbicos.
- El volumen inicial en cada pocillo en el día 14 está entre 150-200 μL debido a la evaporación. Para tratamientos farmacológicos, retire los medios hasta alcanzar el halo de cada pocillo y reemplácelos con 100 μL de la solución del fármaco con una concentración 2x, junto con una mezcla suave (mezcle los medios suavemente de un lado a otro mientras cuenta hasta 2 entre cada pocillo).
- Utilice soluciones de concentración 2x para permitir que la solución final del fármaco esté a 1x y para evitar eliminar completamente los medios viejos de los pocillos, de lo contrario, los esferoides pueden ser perturbados. Use los esferoides dentro de los 3 días posteriores a este período de tiempo.
- Realizar un tratamiento farmacológico con los esferoides el día 14. Tome imágenes de los esferoides antes de su uso utilizando un microscopio invertido de campo claro bajo un objetivo 4x para determinar el volumen inicial del esferoide. Calcule el volumen (V) utilizando la siguiente fórmula:
- Colección de esferoides
- Mida los volúmenes de esferoides antes de la recolección como se describe en el paso 4.7.2.
- Recoja los esferoides el día 14 o 17, dependiendo de las necesidades del experimento, retirando los medios de cada pocillo hasta alcanzar el halo.
- Utilice una pipeta de 1 mL para extraer el medio y recoger el sobrenadante en un tubo de centrífuga cónico de 15 mL de varios pocillos.
- Una vez que todos los pocillos tengan medios a nivel de halo, reduzca el ajuste de la pipeta de 1 ml a entre 200 y 300 μl.
- Alinee la placa contra el fondo de la campana o un fondo oscuro (por ejemplo, un bastidor de tubos) para ver los esferoides asentados en la parte inferior.
- Inserte suavemente la punta cerca del esferoide (vaya por debajo del halo) y pipetee una pequeña cantidad de medio (por ejemplo, una estimación visual de cerca de 50 μL) hacia adelante y hacia atrás para alterar el esferoide. No coloque la punta directamente sobre el esferoide, ya que esto puede dañar su estructura.
- No saque todos los medios del pozo en este paso. Controle firmemente el movimiento del pulgar en el pistón de la pipeta.
- Desplaza los medios hasta que el esferoide ya no permanezca en el centro y se pueda ver moviéndose contra el fondo. Levante suficiente medio para succionar el esferoide y moverlo a la ubicación deseada (p. ej., agruparlo con otros esferoides en un pozo que sea parte del mismo conjunto de tratamiento).
- Descarte de residuos
- Deseche todas las muestras líquidas una vez neutralizadas con lejía de acuerdo con los protocolos del Departamento de Medio Ambiente y Seguridad Sanitaria de los laboratorios respectivos. Esteriliza en autoclave y desecha todas las pipetas y matraces usados con residuos biopeligrosos.
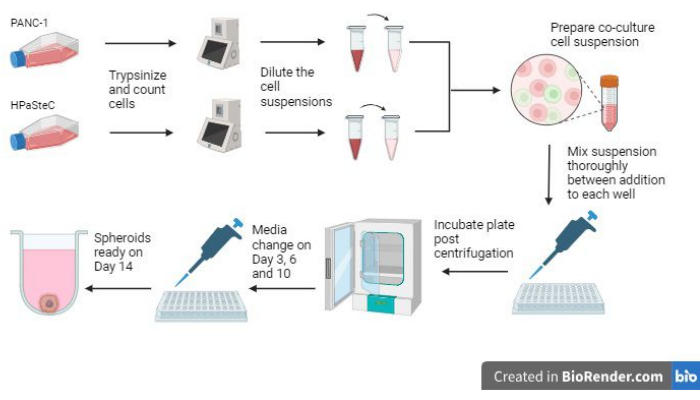
Figura 1: Descripción general del proceso para cultivar esferoides de cáncer de páncreas desmoplásicos en 3D (generado con BioRender). La figura ofrece una descripción general de los procesos básicos involucrados; Es decir, tripsinzar las células, utilizar el recuento inicial de células para hacer suspensiones celulares diluidas, preparar un cocultivo utilizando las suspensiones celulares diluidas, añadir suspensiones celulares a cada pocillo, incubar los cultivos, realizar el mantenimiento de los medios y la formación final de esferoides como se esperaba el día 14. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Estructura del pozo de fondo U. La imagen de la derecha es una forma exagerada para demostrar la parte del "halo" del pozo. La figura tiene como objetivo definir dónde se encuentra la parte del "halo" del pozo, ya que trabajar por encima del halo es fundamental para el crecimiento de los esferoides y evitar pérdidas accidentales. Haga clic aquí para ver una versión más grande de esta figura.
5. Evaluación de componentes de ECM y microscopía confocal
- Utilizar la inmunotinción para evaluar la respuesta de la MEC al tratamiento farmacológico según el protocolo descrito por Durymanov et al.38.
- Agrupar los esferoides y lavar dos veces con 100 μL de PBS. Incrustar en un medio de inclusión de tejido a temperatura óptima de corte (OCT), congelar y mantener a -80 °C.
- Corte los bloques tumorales congelados en secciones de 10 μm, fije las secciones en una mezcla de acetona y metanol (1:1) durante 15 minutos y deje que se sequen al aire en RT.
- Para determinar los componentes de la MEC, inmunotiñir las criosecciones con anticuerpos primarios monoclonales anti-fibronectina de conejo, anticuerpos policlonales de colágeno anti-tipo I de conejo, anticuerpos anti-laminina policlonales de conejo y anticuerpos policlonales anti-ácido hialurónico de oveja.
- Use IgG anticonejo de cabra marcada con Alexa Fluor 488 o anti-oveja de burro conjugada con Alexa Fluor 568 como anticuerpos secundarios.
NOTA: Los anticuerpos primarios y secundarios se diluyeron a 1:200 y 1:300, respectivamente. - Adquiera imágenes de todas las secciones de esferoides utilizando un microscopio de escaneo láser confocal equipado con una lente de objetivo de 20x/0,45.
Resultados
Tres de los pasos más críticos involucrados en el crecimiento de los esferoides son el recuento inicial de células, los pasos de mezcla durante la siembra de los esferoides y la realización de cambios oportunos en los medios para permitir que los esferoides crezcan (Figura 1). Además, es fundamental estar familiarizado con la Figura 2 sobre los cambios de medios después del día 3 para permitir cambios de medios efectivos debido al aumento del volumen de medios por pocillo. Cuando todos estos pasos se realizan de acuerdo con las instrucciones dadas, se encuentra que los esferoides (Figura 3) crecen hasta un volumen promedio de 0,048 ± 0,012mm3 (451 μm x 462,84 μm) (Figura 4). Se han encontrado casos en los que las células pueden crecer mejor, lo que lleva a volúmenes promedio iniciales más grandes de 0,096 ± 0,014 mm3 (611 μm x 560 μm) en el día 14. Una variedad de razones pueden llevar a que los esferoides tengan volúmenes iniciales más grandes, como el mantenimiento de la temperatura y la humedad de la incubadora o el uso de pasajes celulares más tempranos, que tienen una vitalidad ligeramente mejorada en comparación con los pasajes posteriores.
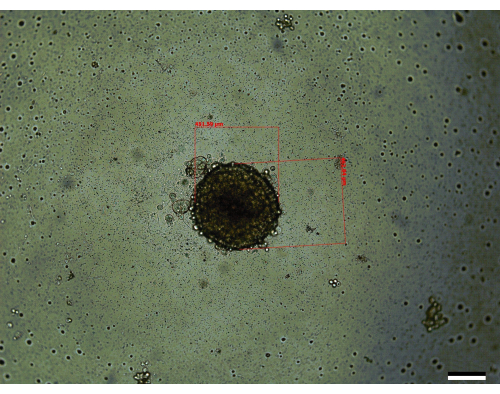
Figura 3: Un esferoide representativo visto en el día 14 (tamaño: 451,59 μm x 462,84 μm). Barra de escala = 200 μm. Cada esferoide se mide a lo largo de su eje más largo y más corto, respectivamente, y se utiliza la ecuación descrita en la sección de métodos para calcular el volumen. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: Progreso del crecimiento de los esferoides a lo largo de 17 días. Las placas 1 y 2 son réplicas. Las barras de error representan la desviación estándar. La figura se puede utilizar como una estimación aproximada de los volúmenes de esferoides que se pueden ver en los días 6, 10, 14 y 17. Haga clic aquí para ver una versión más grande de esta figura.
Sin embargo, en los casos en que las células no se cuentan correctamente o cuando la suspensión celular no se mezcla completamente, o el cultivo final no se mantiene regularmente, o se produce una combinación de estos errores, puede conducir al desarrollo de esferoides más pequeños o esferoides incompletamente desarrollados. También se observaron esferoides con apariencias similares cuando los estudios iniciales de optimización solo complementaron los medios en los pozos alrededor de la periferia de la placa en el día 3 en lugar de toda la placa (Figura 5). Alternativamente, en los casos en que las células no se mezclan bien, o los errores iniciales de conteo/dilución conducen a la siembra de más células por pocillo de lo recomendado, se pueden observar múltiples esferoides por pocillo. Un hallazgo similar se observó cuando se utilizaron células PANC-1:HPaSteC en una proporción de 240:120 (Figura 6). Esto también se puede ver ocasionalmente cuando los esferoides crecen en cada dirección, pero tales esferoides son menos en número (por ejemplo, 4/96 pocillos pueden contener dos esferoides por pocillo en lugar de uno). En los casos en que se encuentren múltiples esferoides, evite usar los pozos con múltiples esferoides o tome notas de los cambios en los volúmenes cuando se traten estos esferoides. Los cambios de medio inadecuados en los que la punta de la pipeta se sumerge por debajo del halo (Figura 1) también pueden provocar la pérdida accidental de los esferoides.

Figura 5: Una imagen representativa de un esferoide mal crecido en el día 14. Barra de escala = 200 μm. Aquí, las celdas no se han agregado bien, por lo que se vuelve difícil medir la longitud y el ancho del esferoide. Haga clic aquí para ver una versión más grande de esta figura.
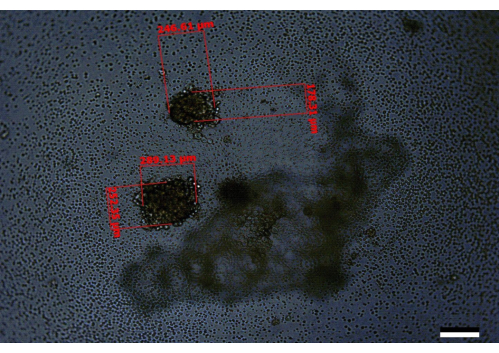
Figura 6: Una imagen representativa de un pozo que contiene dos esferoides mal desarrollados, como se ve el día 14. Barra de escala = 200 μm. Aquí, uno de los esferoides tiene un tamaño de 246,61 μm x 178,31 μm y el otro de 289,13 μm x 252,35 μm. Este es un ejemplo en el que es probable que haya un problema con las diluciones iniciales o con la calidad de las células que se utilizaron para iniciar el experimento. Haga clic aquí para ver una versión más grande de esta figura.
Los esferoides también desarrollan una MEC con cuatro de los componentes primarios de la MEC: colágeno-I, laminina, ácido hialurónico y fibronectina. En estudios que el laboratorio ha publicado anteriormente, se ha demostrado la ventaja del cocultivo sobre PANC-1 solo en términos de esferoides de homo PANC-1 que muestran colágeno difuso, sin fibronectina y con menor deposición de ácido hialurónico.
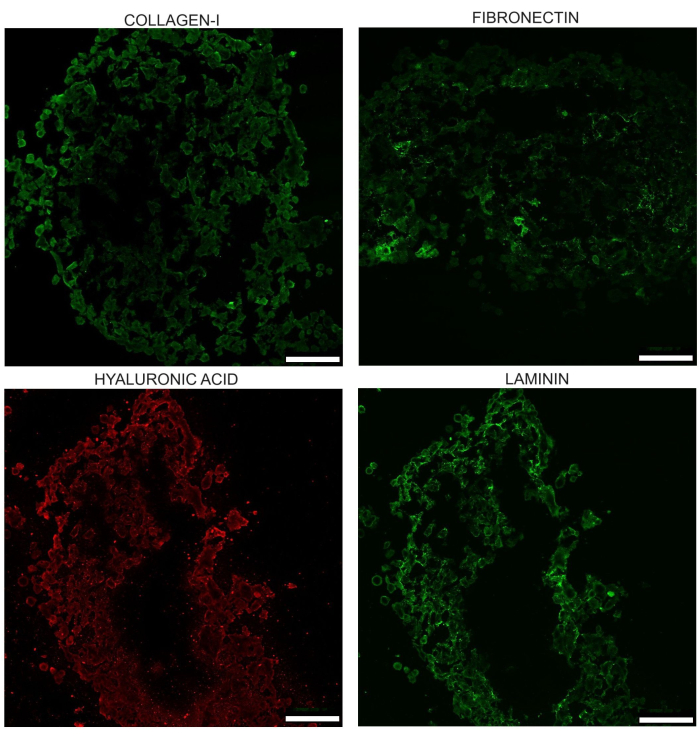
Figura 7: Imagen representativa de los cuatro componentes primarios de la MEC vistos en el día 17 en esferoides no tratados: colágeno I, laminina, ácido hialurónico y fibronectina. Estas imágenes se obtienen después de la inmunotinción de criosecciones del esferoide. El brillo de estas imágenes se ha incrementado uniformemente para ayudar a resaltar las diferencias en la apariencia. Las áreas donde el tejido está dañado o faltante deben ajustarse mientras se realizan las mediciones de intensidad. Barras de escala = 100 μm. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
La duración y las proporciones celulares elegidas para cultivar los esferoides se basaron en estudios como se informó anteriormente38. Al intentar optimizar estos estudios mediante la sustitución de células HPaSteC por células NIH3T3, se encontró que los volúmenes de esferoides y los patrones de apoptosis se parecían mucho a los parámetros optimizados informados (informados para PANC-1: NIH3T3:: 120:12) cuando las proporciones PANC-1: HPaSteC estaban en 120: 60. Aunque estos estudios solo miden la apoptosis hasta el día 14, el protocolo descrito en este proceso sigue utilizando esferoides hasta el día 17, ya que no se observa un aumento visible en la formación de residuos entre el día 14 y el día 17. Como control, todos los esferoides evaluados en el día 17 siempre incluyen un brazo no tratado para servir como referencia para los aumentos naturales en el volumen y la apoptosis de los esferoides.
El proceso de siembra y cultivo de esferoides tiene 3 pasos críticos: conteo adecuado, mezcla antes de la adición de las células y mantenimiento de los cultivos. Dado que el proceso se basa en el uso de un pequeño número de células PANC-1 y HPaSteC, es fundamental contar con el recuento correcto y las diluciones correctas. Esto es particularmente importante para las células HPaSteC, ya que estas células son más pequeñas que las células PANC-1 y es fácil subestimar el número de células. Por lo tanto, es fundamental contar las células con cuidado. La subestimación del recuento da lugar a la formación de múltiples esferoides, mientras que la sobreestimación puede dar lugar a esferoides mal formados.
También se vuelve crítico mezclar bien la suspensión en todos los pasos. Trabajar con la expectativa de que las células puedan asentarse ayuda a evitar la mezcla insuficiente y garantiza una distribución celular uniforme. Al preparar los esferoides para más de una placa (por ejemplo, dos placas), se recomienda que el número de mezclas de ida y vuelta (paso 4.4.1) sea de al menos 20 entre cada pocillo. Esto se puede reducir a 15 cuando la primera placa está a mitad de camino, seguida de 10 al comenzar la siguiente placa y 5 a medida que se avanza hacia la segunda mitad de la segunda placa. Realizar un movimiento de agitación con la pipeta en paralelo a la mezcla de ida y vuelta ayuda a mejorar el grado de mezcla. Una idea a tener en cuenta es involucrar a una segunda persona mientras prepara dos platos, ya que esto aumenta la velocidad y la eficiencia de la mezcla. En este escenario, dos personas pueden usar el capó al mismo tiempo con sus suspensiones y placas individuales trabajando en las esquinas opuestas del capó.
El mantenimiento de los cultivos celulares es necesario para garantizar que los esferoides siempre tengan un suministro adecuado de nutrientes. Los suplementos de medios en los días 3 y 6 son los más críticos, ya que aquí es donde las células están creciendo y necesitan estar bien alimentadas. Los cambios de medios en los días 6 y 10/11 también pueden ser complicados, ya que implican recolectar algo de sobrenadante para descartar los medios más antiguos. Este paso debe realizarse con cuidado tirando suavemente de los medios hacia afuera hasta el "halo" y nunca más allá. Esto ayuda a evitar la succión del medio desde demasiado cerca del esferoide y la pérdida involuntaria de esferoides durante el cambio de medio.
El método tiene una gran ventaja en que es fácilmente reproducible y no requiere ningún molde o material de andamio, a diferencia de los métodos que hemos citado anteriormente 32,34,35,36,37,39. Además, los medios utilizados son los medios de cultivo celular estándar, que son relativamente baratos en comparación con los medios EGM-239, las mezclas de medios celulares estrellados y DMEM-FBS35o los medios solos, dependiendo de los tipos de células34. Esta ventaja se vuelve fundamental en la traducibilidad entre laboratorios y la facilidad de configuración. El proceso también se puede ampliar para varias placas, pero probablemente requeriría una persona por cada dos placas. La naturaleza robusta de los esferoides también permite que se evalúen en condiciones de agitación. Este paso es particularmente útil en la realización de estudios de farmacocinética celular o de liberación y absorción excavados donde están involucrados esferoides.
A pesar de sus ventajas, una limitación del método es que necesita una mezcla muy completa durante la etapa de siembra. Esto puede llevar mucho tiempo y ser físicamente agotador. Una posible forma de evitar esto podría implicar el uso de una cuenta magnética bien esterilizada para mantener condiciones de agitación constantes durante el proceso de siembra. Recolectar los esferoides también es complicado y requiere algo de práctica. Los esferoides también necesitan tiempo para crecer y, por lo tanto, requieren una planificación cuidadosa para garantizar la disponibilidad de personal y suministros para los cambios de medios.
Para concluir, se desarrolló un método simple y reproducible para producir esferoides desmoplásticos 3D clínicamente relevantes. Los esferoides son robustos y capaces de generar componentes de la MEC: colágeno I, laminina, ácido hialurónico y fibronectina. La simplicidad involucrada en la generación de estos esferoides conlleva una ventaja única al ser fácilmente reproducibles y fácilmente adaptables a cambios como la inclusión de una tercera línea celular. Otra ventaja única del modelo es que es resistente a la terapia40. Esto ayuda a aumentar su relevancia clínica y garantiza que solo se elijan los medicamentos más eficaces para avanzar y utilizarse en el tratamiento del cáncer de páncreas. Además, estos esferoides pueden recogerse e implantarse en ratones para dar lugar a tumores desmoplásicos reproducibles para su análisis in vivo 38y también utilizarse para examinar la penetración de diferentes tamaños de nanopartículas44como se ha descrito anteriormente.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
El trabajo descrito contó con el apoyo de la Oficina de Desarrollo Económico de los Gobernadores de Dakota del Sur, el Programa de Subvenciones de Investigación Competitiva de la Junta de Regentes de Dakota del Sur (SD-BOR-CRGP) y el Departamento de Ciencias Farmacéuticas de la Universidad Estatal de Dakota del Sur.
Materiales
| Name | Company | Catalog Number | Comments |
| Axio Observer inverted microscope | Carl Zeiss | 0450-354 | |
| Cellometer Auto T4 | Nexcelom Bioscience LLC | Auto-T4 | |
| DMEM, powder, high glucose | Gibco | 12100046 | |
| Donkey anti-sheep conjugated with Alexa Fluor 568 | Abcam | ab175712 | |
| Fetal Bovine Serum | Cytiva | SH3091003HI | |
| Goat antirabbit IgG labeled with Alexa Fluor 488 | Abcam | ab150077 | |
| Hanks Balanced Salt Solution (HBSS) | Gibco | 14175145 | |
| Human Pancreatic Stellate Cells (HPaSteC) | ScienCell | 3830 | |
| Microscope Nikon | Nikon | Eclipse Ts 100 | |
| Nunc 96-Well Polystyrene Round Bottom Microwell Plates | Thermo Scientific | 12-565-331 | |
| Olympus Fluoview FV1200 confocal laser | Olympus | N/A | Discontinued product |
| PANC-1 | ATCC | CRL-1469 | |
| Poly-HEMA | Sigma | P3932 | |
| Rabbit polyclonal anti-laminin antibodies | Abcam | ab11575 | |
| Rabbit polyclonal anti-type I collagen antibodies | Abcam | ab34710 | |
| Sheep polyclonal anti-hyaluronic acid antibodies | Abcam | ab53842 | |
| Stellate cell media complete kit | ScienCell | 5301 | |
| Trypsin | MP Biomedicals, LLC | 153571 | Trypsin solution prepared according to manufacturers protocol and used at 0.25%w/v |
| Trypsin Neutralization Solution (TNS) | ScienCell | 103 |
Referencias
- Hingorani, S. R. Epithelial and stromal co-evolution and complicity in pancreatic cancer. Nat Rev Cancer. 23 (2), 57-77 (2023).
- Laklai, H., et al. Genotype tunes pancreatic ductal adenocarcinoma tissue tension to induce matricellular fibrosis and tumor progression. Nat Med. 22 (5), 497-505 (2016).
- Binker, M. G., Binker-Cosen, M. J., Binker-Cosen, A. A., Cosen-Binker, L. I. Microenvironmental factors and extracellular matrix degradation in pancreatic cancer. J Pancreas. 15 (4), 280-285 (2014).
- Spano, D., Zollo, M. Tumor microenvironment: a main actor in the metastasis process. Clin Exp Metastasis. 29 (4), 381-395 (2012).
- Ware, M. J., et al. Generation of an in vitro 3D PDAC stroma rich spheroid model. Biomaterials. 108, 129-142 (2016).
- Sunami, Y., Häußler, J., Kleeff, J. Cellular heterogeneity of pancreatic stellate cells, mesenchymal stem cells, and cancer-associated fibroblasts in pancreatic cancer. Cancers. 12 (12), 3770 (2020).
- Öhlund, D., et al. Distinct populations of inflammatory fibroblasts and myofibroblasts in pancreatic cancer. J Exp Med. 214 (3), 579-596 (2017).
- Pandol, S., Edderkaoui, M., Gukovsky, I., Lugea, A., Gukovskaya, A. Desmoplasia of pancreatic ductal adenocarcinoma. Clin Gastroenterol Hepatol. 7 (11), S44-S47 (2009).
- Watanabe, I., et al. Advanced pancreatic ductal cancer: fibrotic focus and β-catenin expression correlate with outcome. Pancreas. 26 (4), 326-333 (2003).
- Hu, G., et al. Tumor-infiltrating podoplanin+ fibroblasts predict worse outcome in solid tumors. Cell Physiol Biochem. 51 (3), 1041-1050 (2018).
- Kapałczyńska, M., et al. 2D and 3D cell cultures-a comparison of different types of cancer cell cultures. Arch Med Sci. 14 (4), 910-919 (2018).
- Monberg, M. E., et al. Occult polyclonality of preclinical pancreatic cancer models drives in vitro evolution. Nat Commun. 13 (1), 3652 (2022).
- Emerman, J. T., Pitelka, D. R. Maintenance and induction of morphological differentiation in dissociated mammary epithelium on floating collagen membranes. In Vitro. 13 (5), 316-328 (1977).
- Kelm, J. M., Timmins, N. E., Brown, C. J., Fussenegger, M., Nielsen, L. K. Method for generation of homogeneous multicellular tumor spheroids applicable to a wide variety of cell types. Biotechnol Bioeng. 83 (2), 173-180 (2003).
- Kikuta, K., et al. Pancreatic stellate cells promote epithelial-mesenchymal transition in pancreatic cancer cells. Biochem Biophys Res Commun. 403 (3-4), 380-384 (2010).
- Lee, J. -. H., et al. Microfluidic co-culture of pancreatic tumor spheroids with stellate cells as a novel 3D model for investigation of stroma-mediated cell motility and drug resistance. J Exp Clin Cancer Res. 37 (1), 4 (2018).
- Wong, C. -. W., Han, H. -. W., Tien, Y. -. W., Hsu, S. -. H. Biomaterial substrate-derived compact cellular spheroids mimicking the behavior of pancreatic cancer and microenvironment. Biomaterials. 213, 119202 (2019).
- Liu, X., et al. 3D heterospecies spheroids of pancreatic stroma and cancer cells demonstrate key phenotypes of pancreatic ductal adenocarcinoma. Transl Oncol. 14 (7), 101107 (2021).
- Vonlaufen, A., et al. Pancreatic stellate cells: partners in crime with pancreatic cancer cells. Cancer Res. 68 (7), 2085-2093 (2008).
- Bachem, M. G., et al. Pancreatic carcinoma cells induce fibrosis by stimulating proliferation and matrix synthesis of stellate cells. Gastroenterology. 128 (4), 907-921 (2005).
- Greco, E., et al. Pancreatic cancer cells invasiveness is mainly affected by interleukin-1β not by transforming growth factor-β1. Int J Biol Markers. 20 (4), 235-241 (2005).
- Arao, S., Masumoto, A., Otsuki, M. β1 integrins play an essential role in adhesion and invasion of pancreatic carcinoma cells. Pancreas. 20 (2), 129-137 (2000).
- Sawai, H., Yamamoto, M., Okada, Y., Sato, M., Akamo, Y., Takeyama, H., Manabe, T. Alteration of integrins by Interleukin-1alpha in human pancreatic cancer cells. Pancreas. 23 (4), 399-405 (2001).
- Chen, J., et al. Expression and function of the epidermal growth factor receptor in physiology and disease. Physiol Rev. 96 (3), 1025-1069 (2016).
- Deer, E. L., et al. Phenotype and genotype of pancreatic cancer cell lines. Pancreas. 39 (4), 425 (2010).
- Stahle, M., et al. Mechanisms in LPA-induced tumor cell migration: critical role of phosphorylated ERK. J Cell Sci. 116, 3835-3846 (2003).
- Aubert, M., et al. Decrease of human pancreatic cancer cell tumorigenicity by α1, 3galactosyltransferase gene transfer. Int J Cancer. 107 (6), 910-918 (2003).
- Miknyoczki, S. J., Chang, H., Klein-Szanto, A., Dionne, C. A., Ruggeri, B. A. The Trk tyrosine kinase inhibitor CEP-701 (KT-5555) exhibits significant antitumor efficacy in preclinical xenograft modelsof human pancreatic ductal adenocarcinoma. Clin Cancer Res. 5 (8), 2205-2212 (1999).
- Fukasawa, M., Korc, M. Vascular endothelial growth factor-trap suppresses tumorigenicity of multiple pancreatic cancer cell lines. Clin Cancer Res. 10 (10), 3327-3332 (2004).
- Hernández-Camarero, P., et al. Pancreatic (pro) enzymes treatment suppresses BXPC-3 pancreatic Cancer Stem Cell subpopulation and impairs tumour engrafting. Sci Rep. 9 (1), 11359 (2019).
- Ware, M. J., et al. Generation of homogenous three-dimensional pancreatic cancer cell spheroids using an improved hanging drop technique. Tissue Eng Part C Methods. 22 (4), 312-321 (2016).
- Longati, P., et al. 3D pancreatic carcinoma spheroids induce a matrix-rich, chemoresistant phenotype offering a better model for drug testing. BMC Cancer. 13, 95 (2013).
- Kpeglo, D., et al. Modeling the mechanical stiffness of pancreatic ductal adenocarcinoma. Matrix Biol Plus. 14, 100109 (2022).
- Jang, S. -. D., et al. Anti-cancer activity profiling of chemotherapeutic agents in 3D co-cultures of pancreatic tumor spheroids with cancer-associated fibroblasts and macrophages. Cancers. 13 (23), 5955 (2021).
- Pednekar, K. P., Heinrich, M. A., van Baarlen, J., Prakash, J. Novel 3D µtissues mimicking the fibrotic stroma in pancreatic cancer to study cellular interactions and stroma-modulating therapeutics. Cancers. 13 (19), 5006 (2021).
- Kim, S. -. K., et al. Phenotypic heterogeneity and plasticity of cancer cell migration in a pancreatic tumor three-dimensional culture model. Cancers. 12 (5), 1305 (2020).
- Hwang, H. J., Oh, M. -. S., Lee, D. W., Kuh, H. -. J. Multiplex quantitative analysis of stroma-mediated cancer cell invasion, matrix remodeling, and drug response in a 3D co-culture model of pancreatic tumor spheroids and stellate cells. J Exp Clin Cancer Res. 38 (1), 258 (2019).
- Durymanov, M., et al. Subcutaneous inoculation of 3D pancreatic cancer spheroids results in development of reproducible stroma-rich tumors. Transl Oncol. 12 (1), 180-189 (2019).
- Giustarini, G., Teng, G., Pavesi, A., Adriani, G. Characterization of 3D heterocellular spheroids of pancreatic ductal adenocarcinoma for the study of cell interactions in the tumor immune microenvironment. Front Oncol. 13, 1156769 (2023).
- Alseud, K., et al. Synthesis and biological activity of 11-oxygenated and heterocyclic estrone analogs in pancreatic cancer monolayers and 3D spheroids. Bioorg Med Chem. , (2024).
- Fitzgerald, A. A., et al. Fibroblast activation protein regulates natural killer cell migration, extravasation and tumor infiltration. bioRxiv. , 429622 (2021).
- Wishart, G., Gupta, P., Schettino, G., Nisbet, A., Velliou, E. 3D tissue models as tools for radiotherapy screening for pancreatic cancer. Br J Radiol. 94 (1120), 20201397 (2021).
- Peirsman, A., et al. MISpheroID: a knowledgebase and transparency tool for minimum information in spheroid identity. Nat Methods. 18 (11), 1294-1303 (2021).
- Durymanov, M., Kroll, C., Permyakova, A., Reineke, J. Role of endocytosis in nanoparticle penetration of 3D pancreatic cancer spheroids. Mol Pharm. 16 (3), 1074-1082 (2019).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados