Method Article
Isolamento de Células com Informações Morfológicas e Espaciais de Amostras de Fibrose Submucosa Oral por Microdissecção por Captura a Laser
Neste Artigo
Resumo
A microdissecção por captura a laser de tecidos de fibrose submucosa oral permite a extração precisa de células de regiões histológicas de interesse para a análise de dados multi-ômicos com informações morfológicas e espaciais.
Resumo
A fibrose submucosa oral (FSO) é um tipo comum de doença potencialmente maligna na cavidade oral. A atrofia do epitélio e a fibrose da lâmina própria e da submucosa são frequentemente encontradas nas lâminas histopatológicas. Displasia epitelial, atrofia epitelial e fibroblastos senescentes têm sido propostos como associados à transformação maligna da FSO. No entanto, devido à heterogeneidade de doenças orais potencialmente malignas e carcinoma epidermóide oral, é difícil identificar os mecanismos moleculares específicos de transformação maligna em FSO. Apresentamos um método para obter um pequeno número de células epiteliais ou mesenquimais carregando dados morfológicos e informações espaciais por microdissecção por captura a laser em lâminas de tecido fixadas em formalina e emblocadas em parafina. Usando um microscópio, podemos capturar precisamente em microescala (~500 células) tecido epitelial displásico ou atrófico e tecido subepitelial fibrótico. As células extraídas podem ser avaliadas por sequenciamento genômico ou transcriptoma para aquisição de dados genômicos e transcriptômicos com informações morfológicas e espaciais. Essa abordagem elimina a heterogeneidade do sequenciamento tecidual de OSF em massa e a interferência causada por células em áreas não lesionadas, permitindo uma análise espacial-ômica precisa do tecido OSF.
Introdução
A fibrose submucosa oral (FSO) é uma doença crônica e insidiosa que se desenvolve principalmente na mucosa bucal e resulta em restrição da aberturabucal1. Enquanto a FSO é uma doença multifatorial, a mastigação da noz de areca ou noz de betel é a principal causa de FSO 2,3. Devido a esse hábito geograficamente específico, a FSO está predominantemente concentrada em populações do Sudeste e Sul da Ásia3. As características histológicas comuns da FSO incluem deposição anormal de colágeno no tecido conjuntivo abaixo do epitélio da mucosa oral, estenose vascular e oclusão1. O tecido epitelial da FSO pode apresentar manifestações de atrofia ou hiperplasia e até displasia quando concomitante à leucoplasiaoral4,5.
A FSO é definida pela Organização Mundial da Saúde como uma doença oral comum potencialmente maligna (DMOP) que apresenta potencial para evoluir para carcinoma epidermóide oral com taxa de transformação maligna de 4%-6%6,7,8,9. O mecanismo subjacente à transformação maligna da FSO é complexo10. O crescimento anormal do epitélio, incluindo tanto displasia quanto atrofia, aumenta o potencial de carcinogênese, e fibroblastos senescentes no estroma podem estar envolvidos na progressão maligna da FSO por induzir a transição epitélio-mesenquimal (TEM) através de espécies reativas de oxigênio (EROs) e outras moléculas10.
Tecnologias para análises espaço-ômicas geraram dados multi-ômicos com informações morfológicas e espaciais que forneceram informações sobre os mecanismos do câncer11,12,13. Aqui, apresentamos um protocolo para capturar populações celulares relacionadas à morfologia de tecido OSF fixado em formalina e embebido em parafina por microdissecção a laser. Análises multi-ômicas dessas amostras podem superar desafios com heterogeneidade intratecidual e aumentar a compreensão da patologia molecular e dos mecanismos de transformação maligna em FSO14.
Protocolo
Este estudo foi aprovado pelo comitê de ética em pesquisa da Escola e Hospital da Universidade de Pequim. Os pacientes assinaram o termo de consentimento livre e esclarecido. As amostras de tecido utilizadas neste estudo foram desidentificadas. O esquema do estudo é mostrado na Figura 1.
1. Preparação da amostra
- Corte tecidos de fibrose oral submucosa fixados em formalina e fixados em parafina em cortes contínuos de 3 μm e 10 μm de espessura em micrótomo.
- Desdobre as seções na água e, em seguida, pesque nos escorregadores. Fixar os cortes de 3 μM e 10 μm nas lâminas do microscópio de adesão (lâmina A) e PEN-membrana (lâmina B), respectivamente.
- Coloque as lâminas numa placa quente a 60 °C durante 2 horas.
2. Coloração hematoxilina-eosina
- Coloque as lâminas A e B em xileno (CUIDADO) por 10 min e repita esta etapa três vezes.
- Hidratar as lâminas A e B em soluções graduadas de etanol da ordem de 100%, 100%, 90%, 80% e 70% por 1 min em cada concentração.
- Coloque as corrediças A e B em água destilada ultrapura por 30 s
- Colocar as lâminas A e B em solução corante de hematoxilina Harris por 90 s.
- Coloque as lâminas A e B em água destilada ultrapura por 30 s e repita esta etapa três vezes.
- Coloque as lâminas A e B em solução de div-hematoxilina (CUIDADO) por 2 s.
- Coloque as lâminas A e B em água destilada ultrapura por 30 s e repita esta etapa três vezes.
- Coloque as lâminas em A e B em solução reazul a 1% por 2 s.
- Coloque as lâminas A e B em água destilada ultrapura por 30 s e repita esta etapa três vezes.
- Coloque as lâminas em solução de eosina por 2 s.
- Coloque as lâminas A e B em água destilada ultrapura por 30 s e repita esta etapa três vezes.
- Desidratar as lâminas em soluções graduadas de etanol da ordem de 70%, 80%, 90%, 100% e 100% por 2 s em cada concentração.
- Coloque o slide A em xileno por 3 min e repita este passo duas vezes.
- Adicione uma gota de meio de montagem (CUIDADO) ao slide A e cubra com um vidro de cobertura.
3. Observação da morfologia histológica e microdissecção por captura a laser
- Iniciar o sistema de microdissecção a laser e o software (Figura 2).
- Coloque a lâmina A no palco da lâmina e observe a morfologia histológica para identificar a área de interesse para microdissecção a laser.
- Remova o slide A e coloque o slide B inversamente no palco do slide.
- Clique no botão Unload (Figura 2) para enviar o dispositivo de coleta. Insira um tubo de reação em cadeia da polimerase (PCR) no dispositivo de coleta e certifique-se de que o tubo seja mantido fixo. Clique no botão OK (Figura 3).
- Selecione uma tampa clicando no círculo vermelho correspondente marcando o Dispositivo coletor: tampas de tubo. O círculo selecionado ficará verde.
- Clique no botão Desenhar e no botão Desenhar + Recortar e use o mouse para esboçar a área de interesse.
- Clique no botão Iniciar Recorte para capturar a área de interesse; a amostra capturada será coletada pela tampa (Figura 4).
- Clique no botão Inferior para garantir que a amostra capturada seja coletada (Figura 5).
- Clique no botão Amostra para capturar a próxima amostra.
- Clique no botão Descarregar para descarregar o tubo de PCR com a amostra capturada.
Resultados
Através da microdissecção a laser dos tecidos da OSF, foram capturadas amostras de epitélio displásico, estroma abaixo do epitélio displásico, epitélio atrófico e estroma abaixo do tecido epitelial atrófico (Figura 1). Através da extração de DNA e sequenciamento do genoma completo em baixa profundidade, pudemos analisar as alterações no número de cópias relacionadas à morfologia (CNA)15. O CNA é uma forma comum de instabilidade genômica associada a um risco aumentado de transformação maligna na DMOP15,16. Foram detectados diferentes padrões de CNA entre quatro tipos de amostras. Como mostrado na Figura 6, o CNA estava presente nas amostras epiteliais, mas não nas amostras do estroma. Embora as amostras tenham sido originadas do mesmo paciente, o padrão do CNA no epitélio displásico não foi o mesmo do epitélio atrófico. O CNA nos cromossomos 3 e 8 foi detectado no epitélio displásico, enquanto o CNA foi detectado em menor frequência no cromossomo 8 no epitélio atrófico.
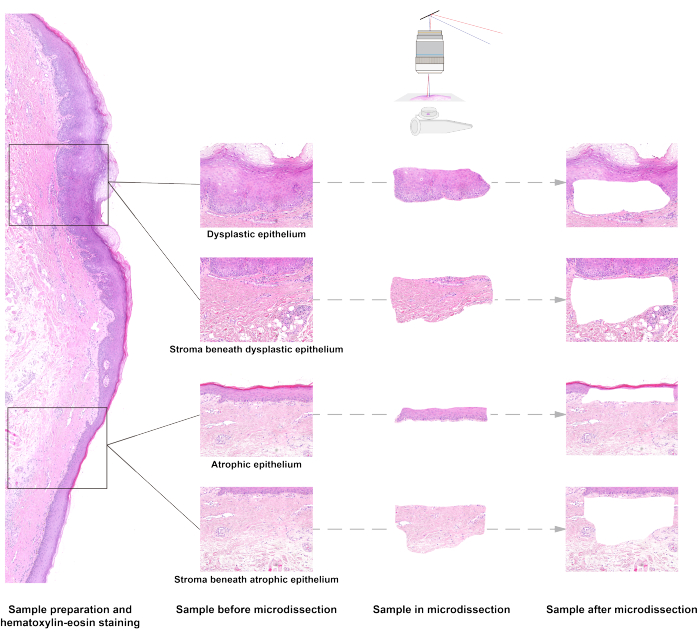
Figura 1: Esquema de microdissecção por captura a laser de amostras de fibrose submucosa oral. Os tecidos de epitélio e estroma com diferentes padrões são captados a laser ao microscópio. Clique aqui para ver uma versão maior desta figura.

Figura 2: Software de microdissecção a laser. Uma captura de tela do software mostrando o painel ao vivo. Clique aqui para ver uma versão maior desta figura.

Figura 3: Janela do dispositivo do coletor. Uma captura de tela do software mostrando a janela do dispositivo coletor para selecionar o dispositivo de coleta. Clique aqui para ver uma versão maior desta figura.

Figura 4: Captura da amostra na área de interesse. Clicar no botão Start Cut permitirá capturar a área de interesse. Clique aqui para ver uma versão maior desta figura.

Figura 5: Amostra capturada. A amostra capturada pode ser vista na tampa do tubo de PCR. Clique aqui para ver uma versão maior desta figura.

Figura 6: Alterações no número da cópia. Os resultados representativos de diferentes padrões de alterações no número de cópias entre várias amostras. Existem diferentes alterações no número de cópias entre o epitélio displásico e o epitélio atrófico. Clique aqui para ver uma versão maior desta figura.
Discussão
Este protocolo relatou um pipeline para capturar amostras de tecido OSF com informações morfológicas e espaciais para análises espaço-ômicas adicionais através de microdissecção a laser. A partir dos resultados representativos, identificamos diferentes padrões de CNA entre várias amostras relacionadas à morfologia.
OSF, um tipo de DMOP, é uma condição pré-cancerosa comum do carcinoma epidermóide oral6. A instabilidade genômica tem sido relatada como associada ao desenvolvimento e transformação maligna da DMOP17,18. Múltiplos estudos têm relatado alterações cromossômicas, expressão gênica diferencial e variações epigenéticas associadas à progressão e transformação maligna da FSO a partir de dados genômicos, transcriptômicos e proteômicos19,20,21,22,23,24. Os componentes carcinogênicos da noz de areca, como a arecolina, não só levaram ao desenvolvimento da FSO, mas a estimulação a longo prazo também induziu a senescência de fibroblastos e EMT e a produção contínua de espécies reativas de oxigênio (EROs), resultando em transformação maligna pela regulação do microambiente imune e vias de sinalização como os sinais TGF-β e NF-κB5, 10,21. No entanto, alterações histológicas epiteliais e estromais anormais estão presentes nos tecidos da FSO, e quais alterações teciduais ou celulares conduzem a transformação maligna na FSO ainda não estão claras. Estudos anteriores utilizaram principalmente análises de sequenciamento em massa, nas quais o DNA ou RNA foi extraído de um bloco de tecido para analisar melhor a expressão molecular e as vias envolvidas. No entanto, essa análise não teve correlação morfológica com a histologia e ignorou a heterogeneidade intratecidual; Além disso, essa abordagem não pode identificar se há alterações moleculares diferenciais em diferentes áreas histológicas.
Estudos recentes têm relatado análise espacial-ômica em diversas doenças11,13,25. Através de análises espaço-ômicas precisas, um número crescente de moléculas e alvos está sendo descoberto e interações celulares e agrupamento estão sendo elucidados11,12,13. No entanto, ainda há uma falta de análise ômica espacialmente resolvida da OSF. As amostras de FSO foram geralmente retiradas de biópsias da mucosa oral e preparadas como pequenos volumes de amostras fixadas em formalina e incluídas em parafina, dificultando a realização do sequenciamento espacial de célula única, que necessita de grandes amostras. Portanto, o desenvolvimento de métodos com resolução espacial utilizando amostras fixadas em formalina e incluídas em parafina pode ser um benefício significativo. Esperamos que o protocolo atual beneficie os pesquisadores que trabalham com OSF e outros tipos de OPMD e contribua para a compreensão dos mecanismos de desenvolvimento e transformação maligna do OPMD.
Este método tem algumas limitações. Primeiramente, o protocolo foi realizado com amostras fixadas em formalina e incluídas em parafina, dificultando a extração de RNA para análise em sequenciamento; no entanto, a análise de sequenciamento de RNA relacionado à morfologia pode ser realizada quando se utiliza coloração violeta cristalina e manutenção de práticas assépticas15,26. As amostras atualmente capturadas não podem atingir o nível de resolução de célula única porque quando o número de células é muito pequeno, as células podem ser quebradas pelo feixe de laser, afetando a extração de DNA.
Divulgações
Os autores declaram a inexistência de conflitos de interesse.
Agradecimentos
Este trabalho foi apoiado por bolsas de pesquisa da National Nature Science Foundation of China (81671006, 81300894), CAMS Innovation Fund for Medical Sciences (2019-I2M-5-038), National clinical key discipline construction project (PKUSSNKP-202102), Innovation Fund for Outstanding Doctoral Candidates of Peking University Health Science Center (BMU2022BSS001).
Materiais
| Name | Company | Catalog Number | Comments |
| Adhesion microscope slides | CITOTEST | REF.188105 | |
| Div-haematoxylin | YiLi | 20230326 | |
| Eosin solution | BASO | BA4098 | |
| Ethanol | PEKING REAGENT | No.32061 | |
| Harris hematoxylin dye solution | YiLi | 20230326 | |
| Hot plate | LEICA | HI1220 | |
| Laser capture microdissection system | LEICA | LMD7 | Machine |
| Laser microdissection microsystem | LEICA | 8.2.3.7603 | Software |
| Micromount mounting medium | LEICA | REF.3801731 | |
| Microscope cover glass | CITOTEST | REF.10212450C | |
| Microtome | LEICA | RM2235 | |
| PCR tubes | AXYGEN | 16421959 | |
| PEN-membrane slides | LEICA | No.11505158 | |
| Re-blue solution | YiLi | 20230326 | |
| Ultrapure distilled water | Invitrogen | REF.10977-015 | |
| Xylene | PEKING REAGENT | No.33535 |
Referências
- Cai, X., et al. Oral submucous fibrosis: A clinicopathological study of 674 cases in China. Journal of Oral Pathology & Medicine. 48 (4), 321-325 (2019).
- Cai, X., Huang, J. Clinicopathological factors associated with progression of oral submucous fibrosis: A population-based retrospective study. Oral Oncology. 130, 105949(2022).
- Ray, J. G., Chatterjee, R., Chaudhuri, K. Oral submucous fibrosis: A global challenge. Rising incidence, risk factors, management, and research priorities. Periodontology 2000. 80 (1), 200-212 (2019).
- Shih, Y. H., Wang, T. H., Shieh, T. M., Tseng, Y. H. Oral submucous fibrosis: A Review on etiopathogenesis, diagnosis, and therapy. International Journal of Molecular Sciences. 20 (12), 2940(2019).
- Cai, X., et al. The preliminary exploration of immune microenvironment in oral leukoplakia concomitant with oral submucosal fibrosis: A comparative immunohistochemical study. Journal of Oral Pathology & Medicine. , (2023).
- Warnakulasuriya, S., et al. Oral potentially malignant disorders: A consensus report from an international seminar on nomenclature and classification, convened by the WHO Collaborating Centre for Oral Cancer. Oral Diseases. 27 (8), 1862-1880 (2021).
- Cai, X., et al. Development and validation of a nomogram prediction model for malignant transformation of oral potentially malignant disorders. Oral Oncology. 123, 105619(2021).
- Murthy, V., et al. Malignant transformation rate of oral submucous fibrosis: A systematic review and meta-analysis. Journal of Clinical Medicine. 11 (7), 1793(2022).
- Kujan, O., Mello, F. W., Warnakulasuriya, S. Malignant transformation of oral submucous fibrosis: A systematic review and meta-analysis. Oral Diseases. 27 (8), 1936-1946 (2020).
- Qin, X., Ning, Y., Zhou, L., Zhu, Y. Oral submucous fibrosis: Etiological mechanism, malignant transformation, therapeutic approaches and targets. International Journal of Molecular Sciences. 24 (5), 4992(2023).
- Sun, L., et al. Single-cell and spatial dissection of precancerous lesions underlying the initiation process of oral squamous cell carcinoma. Cell Discovery. 9 (1), 28(2023).
- Zhu, J., et al. Delineating the dynamic evolution from preneoplasia to invasive lung adenocarcinoma by integrating single-cell RNA sequencing and spatial transcriptomics. Experimental & Molecular Medicine. 54 (11), 2060-2076 (2022).
- Ji, A. L., et al. Multimodal analysis of composition and spatial architecture in human squamous cell carcinoma. Cell. 182 (2), 497-514 (2020).
- Van den Bossche, V., et al. Microenvironment-driven intratumoral heterogeneity in head and neck cancers: clinical challenges and opportunities for precision medicine. Drug Resistance Updates. 60, 100806(2022).
- Li, X., et al. Improvement in the risk assessment of oral leukoplakia through morphology-related copy number analysis. Science China. Life sciences. 64 (9), 1379-1391 (2021).
- Watkins, T. B. K., et al. Pervasive chromosomal instability and karyotype order in tumour evolution. Nature. 587 (7832), 126-132 (2020).
- Odell, E. W. Aneuploidy and loss of heterozygosity as risk markers for malignant transformation in oral mucosa. Oral Diseases. 27 (8), 1993-2007 (2021).
- Wood, H. M., et al. The genomic road to invasion-examining the similarities and differences in the genomes of associated oral pre-cancer and cancer samples. Genome Medicine. 9 (1), 53(2017).
- Venugopal, D. C., et al. Integrated proteomics based on 2D gel electrophoresis and mass spectrometry with validations: Identification of a biomarker compendium for oral submucous fibrosis-An indian study. Journal of Personalized Medicine. 12 (2), 208(2022).
- Kundu, P., Pant, I., Jain, R., Rao, S. G., Kondaiah, P. Genome-wide DNA methylation changes in oral submucous fibrosis. Oral Diseases. 28 (4), 1094-1103 (2022).
- Cai, X., Zhang, H., Li, T. Multi-target pharmacological mechanisms of Salvia miltiorrhiza against oral submucous fibrosis: A network pharmacology approach. Archives of Oral Biology. 126, 105131(2021).
- Xiao, X., Hu, Y., Li, C., Shi, L., Liu, W. DNA content abnormality in oral submucous fibrosis concomitant leukoplakia: A preliminary evaluation of the diagnostic and clinical implications. Diagnostic Cytopathology. 48 (11), 1111-1114 (2020).
- Zhou, S., et al. Long non-coding RNA expression profile associated with malignant progression of oral submucous fibrosis. Journal of Oncology. 2019, 6835176(2019).
- Lunde, M. L., et al. Profiling of chromosomal changes in potentially malignant and malignant oral mucosal lesions from South and Southeast Asia using array-comparative genomic hybridization. Cancer Genomics & Proteomics. 11 (3), 127-140 (2014).
- Sun, C., et al. Spatially resolved metabolomics to discover tumor-associated metabolic alterations. Proceedings of the National Academy of Sciences of the United States of America. 116 (1), 52-57 (2019).
- Ma, M., et al. Copy number alteration profiling facilitates differential diagnosis between ossifying fibroma and fibrous dysplasia of the jaws. International Journal of Oral Science. 13 (1), 21(2021).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados