Method Article
Isolierung von Zellen mit morphologischen und räumlichen Informationen aus oralen submukösen Fibroseproben mittels Laser-Capture-Mikrodissektion
In diesem Artikel
Zusammenfassung
Die Laser-Capture-Mikrodissektion von oralem submukösem Fibrosegewebe ermöglicht die präzise Extraktion von Zellen aus histologischen Regionen von Interesse für die Analyse von Multi-Omics-Daten mit morphologischen und räumlichen Informationen.
Zusammenfassung
Die orale submuköse Fibrose (OSF) ist eine häufige Form einer potenziell bösartigen Erkrankung in der Mundhöhle. Die Atrophie des Epithels und die Fibrose der Lamina propria und der Submukosa sind häufig auf histopathologischen Objektträgern zu finden. Es wurde vorgeschlagen, dass epitheliale Dysplasie, epitheliale Atrophie und seneszente Fibroblasten mit der malignen Transformation von OSF assoziiert sind. Aufgrund der Heterogenität von potentiell malignen oralen Erkrankungen und oralen Plattenepithelkarzinomen ist es jedoch schwierig, die spezifischen molekularen Mechanismen der malignen Transformation bei OSF zu identifizieren. In dieser Arbeit stellen wir eine Methode vor, um eine kleine Anzahl von Epithel- oder Mesenchymzellen, die morphologische Daten und räumliche Informationen tragen, durch Laser-Capture-Mikrodissektion auf formalinfixierten, in Paraffin eingebetteten Gewebeobjektträgern zu erhalten. Mit einem Mikroskop können wir mikroskaliges (~500 Zellen) dysplastisches oder atrophisches Epithelgewebe und fibrotisches subepitheliales Gewebe präzise erfassen. Die extrahierten Zellen können durch Genom- oder Transkriptomsequenzierung ausgewertet werden, um genomische und transkriptomische Daten mit morphologischen und räumlichen Informationen zu erhalten. Dieser Ansatz beseitigt die Heterogenität der Massensequenzierung von OSF-Gewebe und die Interferenz, die durch Zellen in nicht läsionierten Bereichen verursacht wird, und ermöglicht eine präzise Spatial-Omics-Analyse von OSF-Gewebe.
Einleitung
Die orale submuköse Fibrose (OSF) ist eine chronische, schleichende Erkrankung, die sich vor allem in der Wangenschleimhaut entwickelt und zu einer eingeschränkten Mundöffnung führt1. Während OSF eine multifaktorielle Erkrankung ist, ist das Kauen von Arekanüssen oder Betelnüssen die Hauptursache für OSF 2,3. Aufgrund dieser geographisch spezifischen Gewohnheit ist OSF überwiegend in Populationen in Südost- und Südasien konzentriert3. Zu den häufigsten histologischen Merkmalen der OSF gehören abnorme Kollagenablagerungen im Bindegewebe unter dem oralen Schleimhautepithel, Gefäßstenose und Okklusion1. OSF-Epithelgewebe kann mit Manifestationen von Atrophie oder Hyperplasie und sogar Dysplasie auftreten, wenn es mit oraler Leukoplakie einhergeht 4,5.
OSF wird von der Weltgesundheitsorganisation als eine häufige orale potenziell maligne Erkrankung (OPMD) definiert, die das Potenzial aufweist, zu einem oralen Plattenepithelkarzinom mit einer malignen Transformationsrate von 4%-6% fortzuschreiten6,7,8,9. Der Mechanismus, der der malignen Transformation von OSF zugrunde liegt, ist komplex10. Abnormales Wachstum des Epithels, einschließlich Dysplasie und Atrophie, erhöht das Potenzial für die Karzinogenese, und seneszente Fibroblasten im Stroma können an der malignen Progression von OSF beteiligt sein, indem sie den epithelial-mesenchymalen Übergang (EMT) durch reaktive Sauerstoffspezies (ROS) und andere Moleküle induzieren10.
Technologien für räumlich-omische Analysen generierten multi-omische Daten mit morphologischen und räumlichen Informationen, die Einblicke in Krebsmechanismen lieferten11,12,13. In dieser Arbeit stellen wir ein Protokoll vor, mit dem morphologiebezogene Zellpopulationen aus formalinfixiertem, paraffineingebettetem OSF-Gewebe mittels Lasermikrodissektion erfasst werden können. Multi-omic-Analysen dieser Proben können Herausforderungen in Bezug auf die Heterogenität innerhalb des Gewebes überwinden und das Verständnis der molekularen Pathologie und der Mechanismen der malignen Transformation bei OSF14 verbessern.
Protokoll
Diese Studie wurde vom institutionellen Prüfungsausschuss der Peking University School and Hospital genehmigt. Von den Patienten wurde eine Einverständniserklärung eingeholt. Die in dieser Studie verwendeten Gewebeproben wurden deidentifiziert. Das Studienschema ist in Abbildung 1 dargestellt.
1. Vorbereitung der Probe
- Schneiden Sie formalinfixiertes, paraffineingebettetes orales submuköses Fibrosegewebe in kontinuierliche Abschnitte von 3 μm und 10 μm Dicke auf einem Mikrotom.
- Klappen Sie die Abschnitte im Wasser auf und fischen Sie dann auf die Rutschen. Befestigen Sie die 3 μM- und 10 μm-Schnitte auf Adhäsionsobjektträgern (Objektträger A) bzw. PEN-Membranobjektträgern (Objektträger B).
- Legen Sie die Objektträger für 2 h bei 60 °C auf eine heiße Platte.
2. Hämatoxylin-Eosin-Färbung
- Objektträger A und B für 10 Minuten in Xylol legen (VORSICHT) und diesen Schritt dreimal wiederholen.
- Hydratobjektträger A und B in abgestuften Ethanollösungen in der Größenordnung von 100 %, 100 %, 90 %, 80 % und 70 % für 1 Minute in jeder Konzentration.
- Objektträger A und B für 30 s in hochreines destilliertes Wasser legen
- Objektträger A und B für 90 s in Harris-Hämatoxylin-Farbstofflösung legen.
- Objektträger A und B für 30 s in hochreines destilliertes Wasser legen und diesen Schritt dreimal wiederholen.
- Objektträger A und B 2 s lang in div-Hämatoxylin-Lösung legen (VORSICHT).
- Objektträger A und B für 30 s in hochreines destilliertes Wasser legen und diesen Schritt dreimal wiederholen.
- Objektträger in A und B 2 s lang in 1%ige Re-Blue-Lösung legen.
- Objektträger A und B für 30 s in hochreines destilliertes Wasser legen und diesen Schritt dreimal wiederholen.
- Objektträger für 2 s in Eosinlösung legen.
- Objektträger A und B für 30 s in hochreines destilliertes Wasser legen und diesen Schritt dreimal wiederholen.
- Dehydrieren Sie die Objektträger in abgestuften Ethanollösungen in der Größenordnung von 70 %, 80 %, 90 %, 100 % und 100 % für 2 s in jeder Konzentration.
- Objektträger A für 3 Minuten in Xylol legen und diesen Schritt zweimal wiederholen.
- Geben Sie einen Tropfen Eindeckmedium (VORSICHT) auf den Objektträger A und decken Sie ihn mit einem Deckglas ab.
3. Beobachtung der histologischen Morphologie und Laser-Capture-Mikrodissektion
- Initiieren Sie das Laser-Mikrodissektionssystem und die Software (Abbildung 2).
- Platzieren Sie Objektträger A auf dem Objektträgertisch und beobachten Sie die histologische Morphologie, um den für die Lasermikrodissektion interessierenden Bereich zu identifizieren.
- Entfernen Sie den Objektträger A und platzieren Sie den Objektträger B umgekehrt auf dem Objektträgertisch.
- Klicken Sie auf die Schaltfläche Entladen (Abbildung 2), um das Sammelgerät zu verschieben. Führen Sie ein PCR-Röhrchen (Polymerase-Kettenreaktion) in das Sammelgerät ein und stellen Sie sicher, dass das Röhrchen fixiert ist. Klicken Sie auf die Schaltfläche OK (Abbildung 3).
- Wählen Sie eine Kappe aus, indem Sie auf den entsprechenden roten Kreis klicken, der das Kollektorgerät: Röhrchenkappen markiert. Der ausgewählte Kreis wird grün.
- Klicken Sie auf die Schaltflächen Zeichnen und Zeichnen + Ausschneiden und skizzieren Sie mit der Maus den gewünschten Bereich.
- Klicken Sie auf die Schaltfläche "Schnitt starten ", um den gewünschten Bereich zu erfassen. Die aufgefangene Probe wird von der Kappe aufgefangen (Abbildung 4).
- Klicken Sie auf die Schaltfläche Unter, um sicherzustellen, dass die erfasste Probe entnommen wird (Abbildung 5).
- Klicken Sie auf die Schaltfläche Probe, um die nächste Probe zu erfassen.
- Klicken Sie auf die Schaltfläche Entladen, um das PCR-Röhrchen mit der entnommenen Probe zu entladen .
Ergebnisse
Durch die Lasermikrodissektion von OSF-Geweben haben wir Proben von dysplastischem Epithel, Stroma unter dem dysplastischen Epithel, atrophischem Epithel und Stroma unter atrophischem Epithelgewebe entnommen (Abbildung 1). Durch die Extraktion von DNA und die Sequenzierung des gesamten Genoms mit geringer Tiefe waren wir in der Lage, morphologiebedingte Kopienzahlveränderungen (CNA) zu analysieren15. CNA ist eine häufige Form der genomischen Instabilität, die mit einem erhöhten Risiko für eine maligne Transformation bei OPMD15,16 einhergeht. Wir konnten unterschiedliche CNA-Muster in vier Arten von Proben nachweisen. Wie in Abbildung 6 gezeigt, war CNA in Epithelproben, aber nicht in Stromaproben vorhanden. Obwohl die Proben vom selben Patienten stammten, war das CNA-Muster im dysplastischen Epithel nicht dasselbe wie im atrophischen Epithel. CNA in den Chromosomen 3 und 8 wurden im dysplastischen Epithel nachgewiesen, während CNA in Chromosom 8 im atrophischen Epithel mit geringerer Frequenz nachgewiesen wurde.
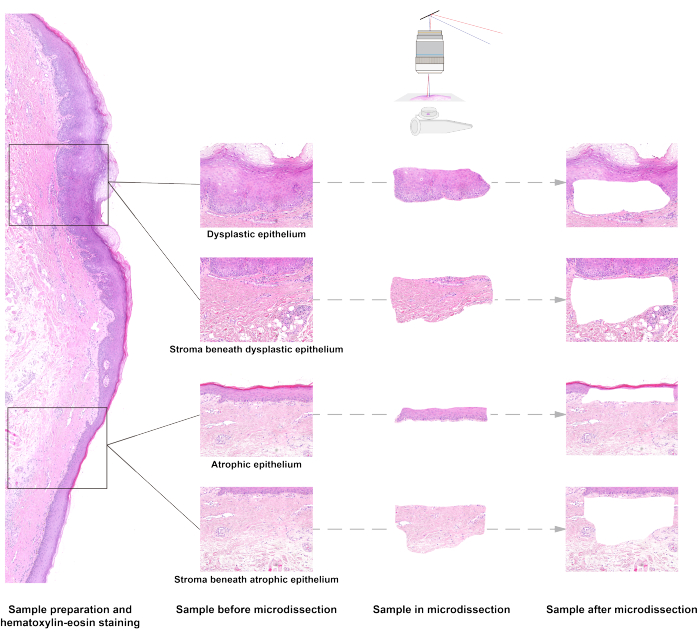
Abbildung 1: Das Schema der Laser-Capture-Mikrodissektion von oralen submukösen Fibroseproben. Die Gewebe von Epithel und Stroma mit unterschiedlichen Mustern werden mit einem Laser unter dem Mikroskop erfasst. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Software für die Lasermikrodissektion. Ein Screenshot der Software, der das Live-Panel zeigt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 3: Fenster des Collector-Geräts. Ein Screenshot der Software, der das Fenster des Sammlergeräts zur Auswahl des Sammelgeräts zeigt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 4: Erfassen der Probe im Interessenbereich. Wenn Sie auf die Schaltfläche "Schnitt starten " klicken, können Sie den gewünschten Bereich erfassen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 5: Erfasste Probe. Die entnommene Probe ist in der Kappe des PCR-Röhrchens zu sehen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 6: Änderungen der Kopiennummer. Die repräsentativen Ergebnisse unterschiedlicher Muster von Kopienzahländerungen in verschiedenen Proben. Es gibt unterschiedliche Kopienzahlveränderungen zwischen dysplastischem Epithel und atrophischem Epithel. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Dieses Protokoll berichtete über eine Pipeline zur Erfassung von OSF-Gewebeproben mit morphologischen und räumlichen Informationen für weitere räumlich-omische Analysen durch Lasermikrodissektion. Aus den repräsentativen Ergebnissen identifizierten wir unterschiedliche CNA-Muster in verschiedenen morphologiebezogenen Proben.
OSF, eine Form der OPMD, ist eine häufige Krebsvorstufe des oralen Plattenepithelkarzinoms6. Es wurde berichtet, dass genomische Instabilität mit der Entwicklung und malignen Transformation von OPMD17,18 assoziiert ist. Mehrere Studien haben über Chromosomenveränderungen, differentielle Genexpression und epigenetische Variationen berichtet, die mit dem Fortschreiten und der malignen Transformation von OSF aus Genomik-, Transkriptomik- und Proteomik-Daten in Verbindung stehen 19,20,21,22,23,24. Die krebserregenden Bestandteile der Arekanuss, wie z. B. Arecolin, führten nicht nur zur Entwicklung von OSF, sondern die langfristige Stimulation induzierte auch die Seneszenz von Fibroblasten und EMT und die kontinuierliche Produktion von reaktiven Sauerstoffspezies (ROS), was zu einer bösartigen Transformation durch Regulierung der Immunmikroumgebung und Signalwege wie TGF-β- und NF-κB-Signale führte5, 10,21. Allerdings sind sowohl abnorme epitheliale als auch stromale histologische Veränderungen in OSF-Geweben vorhanden, und welche Gewebe- oder Zellveränderungen die maligne Transformation bei OSF antreiben, bleibt unklar. Frühere Studien haben meist Massensequenzierungsanalysen verwendet, bei denen DNA oder RNA aus einem Gewebeblock extrahiert wurde, um die molekulare Expression und die beteiligten Signalwege weiter zu analysieren. Dieser Analyse fehlte jedoch eine morphologische Korrelation mit der Histologie und die intragewebliche Heterogenität wurde ignoriert; Darüber hinaus kann mit diesem Ansatz nicht festgestellt werden, ob es unterschiedliche molekulare Veränderungen in verschiedenen histologischen Bereichen gibt.
Neuere Studien haben über die räumliche Omics-Analyse bei vielen Krankheiten berichtet11,13,25. Durch präzise Spatial-Omics-Analysen werden immer mehr Moleküle und Targets entdeckt und zelluläre Wechselwirkungen und Clusterbildung aufgeklärt11,12,13. Es fehlt jedoch noch an einer räumlich aufgelösten Omics-Analyse von OSF. OSF-Proben wurden in der Regel aus Biopsien der Mundschleimhaut entnommen und als kleine Volumina formalinfixierter, in Paraffin eingebetteter Proben hergestellt, was die Durchführung einer Einzelzell-Sequenzierung mit räumlichen Omics, die große Proben erfordert, erschwert. Daher könnte die Entwicklung von Methoden mit räumlicher Auflösung unter Verwendung von formalinfixierten, in Paraffin eingebetteten Proben ein erheblicher Vorteil sein. Wir gehen davon aus, dass das derzeitige Protokoll Forschern zugute kommen wird, die an OSF und anderen Arten von OPMD arbeiten, und zum Verständnis der Mechanismen der Entwicklung und malignen Transformation von OPMD beitragen wird.
Diese Methode weist einige Einschränkungen auf. Zunächst wurde das Protokoll mit formalinfixierten, in Paraffin eingebetteten Proben durchgeführt, was die Extraktion von RNA für die Sequenzierungsanalyse erschwerte. Eine morphologiebezogene RNA-Sequenzierungsanalyse kann jedoch durchgeführt werden, wenn die kristalline violette Färbung verwendet wird und aseptische Verfahren beibehaltenwerden 15,26. Die derzeit erfassten Proben konnten die Einzelzellauflösung nicht erreichen, da bei einer zu geringen Anzahl von Zellen die Zellen durch den Laserstrahl aufgebrochen werden könnten, was die DNA-Extraktion beeinträchtigen würde.
Offenlegungen
Die Autoren erklären, dass kein Interessenkonflikt besteht.
Danksagungen
Diese Arbeit wurde durch Forschungsstipendien der National Nature Science Foundation of China (81671006, 81300894), des CAMS Innovation Fund for Medical Sciences (2019-I2M-5-038), des National Clinical Key Discipline Construction Project (PKUSSNKP-202102) und des Innovation Fund for Outstanding Doctoral Candidates des Peking University Health Science Center (BMU2022BSS001) unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Adhesion microscope slides | CITOTEST | REF.188105 | |
| Div-haematoxylin | YiLi | 20230326 | |
| Eosin solution | BASO | BA4098 | |
| Ethanol | PEKING REAGENT | No.32061 | |
| Harris hematoxylin dye solution | YiLi | 20230326 | |
| Hot plate | LEICA | HI1220 | |
| Laser capture microdissection system | LEICA | LMD7 | Machine |
| Laser microdissection microsystem | LEICA | 8.2.3.7603 | Software |
| Micromount mounting medium | LEICA | REF.3801731 | |
| Microscope cover glass | CITOTEST | REF.10212450C | |
| Microtome | LEICA | RM2235 | |
| PCR tubes | AXYGEN | 16421959 | |
| PEN-membrane slides | LEICA | No.11505158 | |
| Re-blue solution | YiLi | 20230326 | |
| Ultrapure distilled water | Invitrogen | REF.10977-015 | |
| Xylene | PEKING REAGENT | No.33535 |
Referenzen
- Cai, X., et al. Oral submucous fibrosis: A clinicopathological study of 674 cases in China. Journal of Oral Pathology & Medicine. 48 (4), 321-325 (2019).
- Cai, X., Huang, J. Clinicopathological factors associated with progression of oral submucous fibrosis: A population-based retrospective study. Oral Oncology. 130, 105949(2022).
- Ray, J. G., Chatterjee, R., Chaudhuri, K. Oral submucous fibrosis: A global challenge. Rising incidence, risk factors, management, and research priorities. Periodontology 2000. 80 (1), 200-212 (2019).
- Shih, Y. H., Wang, T. H., Shieh, T. M., Tseng, Y. H. Oral submucous fibrosis: A Review on etiopathogenesis, diagnosis, and therapy. International Journal of Molecular Sciences. 20 (12), 2940(2019).
- Cai, X., et al. The preliminary exploration of immune microenvironment in oral leukoplakia concomitant with oral submucosal fibrosis: A comparative immunohistochemical study. Journal of Oral Pathology & Medicine. , (2023).
- Warnakulasuriya, S., et al. Oral potentially malignant disorders: A consensus report from an international seminar on nomenclature and classification, convened by the WHO Collaborating Centre for Oral Cancer. Oral Diseases. 27 (8), 1862-1880 (2021).
- Cai, X., et al. Development and validation of a nomogram prediction model for malignant transformation of oral potentially malignant disorders. Oral Oncology. 123, 105619(2021).
- Murthy, V., et al. Malignant transformation rate of oral submucous fibrosis: A systematic review and meta-analysis. Journal of Clinical Medicine. 11 (7), 1793(2022).
- Kujan, O., Mello, F. W., Warnakulasuriya, S. Malignant transformation of oral submucous fibrosis: A systematic review and meta-analysis. Oral Diseases. 27 (8), 1936-1946 (2020).
- Qin, X., Ning, Y., Zhou, L., Zhu, Y. Oral submucous fibrosis: Etiological mechanism, malignant transformation, therapeutic approaches and targets. International Journal of Molecular Sciences. 24 (5), 4992(2023).
- Sun, L., et al. Single-cell and spatial dissection of precancerous lesions underlying the initiation process of oral squamous cell carcinoma. Cell Discovery. 9 (1), 28(2023).
- Zhu, J., et al. Delineating the dynamic evolution from preneoplasia to invasive lung adenocarcinoma by integrating single-cell RNA sequencing and spatial transcriptomics. Experimental & Molecular Medicine. 54 (11), 2060-2076 (2022).
- Ji, A. L., et al. Multimodal analysis of composition and spatial architecture in human squamous cell carcinoma. Cell. 182 (2), 497-514 (2020).
- Van den Bossche, V., et al. Microenvironment-driven intratumoral heterogeneity in head and neck cancers: clinical challenges and opportunities for precision medicine. Drug Resistance Updates. 60, 100806(2022).
- Li, X., et al. Improvement in the risk assessment of oral leukoplakia through morphology-related copy number analysis. Science China. Life sciences. 64 (9), 1379-1391 (2021).
- Watkins, T. B. K., et al. Pervasive chromosomal instability and karyotype order in tumour evolution. Nature. 587 (7832), 126-132 (2020).
- Odell, E. W. Aneuploidy and loss of heterozygosity as risk markers for malignant transformation in oral mucosa. Oral Diseases. 27 (8), 1993-2007 (2021).
- Wood, H. M., et al. The genomic road to invasion-examining the similarities and differences in the genomes of associated oral pre-cancer and cancer samples. Genome Medicine. 9 (1), 53(2017).
- Venugopal, D. C., et al. Integrated proteomics based on 2D gel electrophoresis and mass spectrometry with validations: Identification of a biomarker compendium for oral submucous fibrosis-An indian study. Journal of Personalized Medicine. 12 (2), 208(2022).
- Kundu, P., Pant, I., Jain, R., Rao, S. G., Kondaiah, P. Genome-wide DNA methylation changes in oral submucous fibrosis. Oral Diseases. 28 (4), 1094-1103 (2022).
- Cai, X., Zhang, H., Li, T. Multi-target pharmacological mechanisms of Salvia miltiorrhiza against oral submucous fibrosis: A network pharmacology approach. Archives of Oral Biology. 126, 105131(2021).
- Xiao, X., Hu, Y., Li, C., Shi, L., Liu, W. DNA content abnormality in oral submucous fibrosis concomitant leukoplakia: A preliminary evaluation of the diagnostic and clinical implications. Diagnostic Cytopathology. 48 (11), 1111-1114 (2020).
- Zhou, S., et al. Long non-coding RNA expression profile associated with malignant progression of oral submucous fibrosis. Journal of Oncology. 2019, 6835176(2019).
- Lunde, M. L., et al. Profiling of chromosomal changes in potentially malignant and malignant oral mucosal lesions from South and Southeast Asia using array-comparative genomic hybridization. Cancer Genomics & Proteomics. 11 (3), 127-140 (2014).
- Sun, C., et al. Spatially resolved metabolomics to discover tumor-associated metabolic alterations. Proceedings of the National Academy of Sciences of the United States of America. 116 (1), 52-57 (2019).
- Ma, M., et al. Copy number alteration profiling facilitates differential diagnosis between ossifying fibroma and fibrous dysplasia of the jaws. International Journal of Oral Science. 13 (1), 21(2021).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten