Method Article
Determinação quantitativa da síntese de novos ácidos graxos em tecido adiposo marrom utilizando óxido de deutério
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Apresentamos um método quantitativo de baixo custo utilizando óxido de deutério e cromatografia gasosa acoplada à espectrometria de massas (GCMS) para a análise da lipogênese de novo de ácidos graxos totais em tecido adiposo marrom in vivo.
Resumo
A síntese de ácidos graxos é uma via metabólica complexa e altamente exigente em energia, com importantes papéis funcionais no controle da homeostase metabólica de todo o corpo e de outros processos fisiológicos e patológicos. Ao contrário de outras vias metabólicas importantes, como o descarte de glicose, a síntese de ácidos graxos não é rotineiramente avaliada funcionalmente, levando a interpretações incompletas do estado metabólico. Além disso, há uma falta de protocolos detalhados disponíveis publicamente adequados para os recém-chegados no campo. Aqui, descrevemos um método quantitativo de baixo custo utilizando óxido de deutério e cromatografia gasosa acoplada à espectrometria de massas (GCMS) para a análise da síntese de novos ácidos graxos totais em tecido adiposo marrom in vivo. Este método mede a síntese dos produtos da sintase de ácidos graxos independentemente de uma fonte de carbono, e é potencialmente útil para praticamente qualquer tecido, em qualquer modelo de camundongo e sob qualquer perturbação externa. São fornecidos detalhes sobre a preparação da amostra para o GCMS e os cálculos a jusante. Nós nos concentramos na análise da gordura marrom devido aos seus altos níveis de síntese de novos ácidos graxos e papéis críticos na manutenção da homeostase metabólica.
Introdução
A obesidade e as doenças metabólicas associadas constituem uma pandemia que coloca em risco as gerações presentes e futuras 1,2. Comumente simplificada como consequência do desequilíbrio entre ingestão e gasto energético, a desregulação metabólica associada à obesidade afeta um grande número de vias metabólicas controladas por fatores ambientais eendógenos3. No entanto, apenas algumas vias são rotineiramente testadas em modelos animais de desregulação metabólica.
Como exemplo, a disponibilidade de glicose é rotineiramente medida por testes de tolerância à glicose e à insulina, provavelmente devido à simplicidade do uso de monitores portáteis de glicose4. As taxas relativas de glicose de corpo inteiro e oxidação lipídica também são rotineiramente estimadas com base na razão de troca respiratória de ensaios de calorimetria indireta 5,6. No entanto, a maioria de todos os outros aspectos do metabolismo não é rotineiramente avaliada funcionalmente. Isso leva a interpretações incompletas do estado metabólico e opções terapêuticas perdidas. Uma das principais vias é a lipogênese de novo.
A lipogênese de novo (DNL) é o processo pelo qual novos ácidos graxos são gerados a partir de precursores. A glicose é considerada o principal precursor que contribui para o DNL7 de corpo inteiro, porém outros precursores, como acetato, frutose, lactato e aminoácidos de cadeia ramificada, têm se mostrado fontes relevantes de carbono de forma espacial e dependente da condição 8,9,10,11,12. A DNL é um importante contribuinte para a homeostase metabólica e é essencial para o desenvolvimento normal13. Além disso, alterações no DNL têm sido associadas a câncer14,15 e metabólicos16,17,18 e doenças cardiovasculares19,20.
A via DNL é composta pelos componentes enzimáticos centrais ATP citrato liase (ACLY), acetil-CoA carboxilase (ACC1/2) e ácido graxo sintase (FAS) que produzem principalmente palmitato, um ácido graxo saturado de 16 carbonos. No entanto, ácidos graxos de cadeia ímpar e cadeia ramificada também podem ser produzidos em taxas mais baixas9. Elongases e desaturases modificam ainda mais esses ácidos graxos, criando uma gama diversificada de espécies de ácidos graxos úteis para uma variedade de funções (por exemplo, armazenamento de energia a longo prazo e manipulação da fluidez da membrana).
A expressão da maquinaria enzimática DNL é controlada por um pequeno número de fatores de transcrição. Os mais bem descritos até o momento incluem a família de proteínas ligadoras de elementos regulatórios esteróis (SREBP), proteínas ligadoras de elementos de resposta a carboidratos (ChREBP) e receptores X hepáticos (LXR)21,22,23,24,25,26. Apesar de uma aparente sobreposição em suas funções, regulações individuais baseadas na dominância do tipo celular e condições fisiológicas ou patológicas têm sido relatadas21,22,27,28.
Notavelmente, vários inibidores para etapas selecionadas da via DNL foram aprovados para uso clínico ou estão nos estágios pré-clínicos ou clínicos de desenvolvimento para uma série de doenças, incluindo obesidade, doença hepática gordurosa não alcoólica/esteatohepatite não alcoólica (DHGNA/EHNA) e doença cardiovascular29. Esses esforços destacam a relevância da DNL na saúde e na doença.
Nos últimos anos, o emprego de métodos para avaliar quantitativamente a síntese de novos ácidos graxos tem aumentado30. O método mais comum para avaliar isso é o uso de água marcada pesada (D2O), onde o hidrogênio marcado pesado é incorporado às cadeias acilas durante a síntese direta e indiretamente, via troca de deutério com os hidrogênios dos substratos DNL NAPDH, acetil-CoA e malonil-CoA. Embora essa abordagem esteja ganhando popularidade, há uma falta de protocolos detalhados disponíveis publicamente adequados para recém-chegados no campo. Aqui, delineamos um método para avaliar quantitativamente a síntese de novo de produtos de FAS usando D2O e cromatografia gasosa acoplada à espectrometria de massas (GCMS), com cálculos previamente desenvolvidos por Lee et al.31. Este método mede a síntese de novos ácidos graxos independentemente de uma fonte de carbono, e é potencialmente útil para praticamente qualquer tecido, em qualquer modelo de camundongo e sob qualquer perturbação externa. Aqui, nos concentramos na análise do tecido adiposo marrom (BAT) devido aos seus altos níveis de DNL e papéis críticos na manutenção da homeostase metabólica.
Protocolo
Todos os experimentos foram aprovados pelo Comitê Institucional de Cuidados e Uso de Animais do Cincinnati Children's Hospital Medical Center.
1. Preparação de D2O
NOTA: Para evitar variações experimentais, prepare solução/água potável suficiente para todos os ratos durante a duração do experimento.
- Para injeção intraperitoneal: gerar 0,9% p/v de solução salina D 2 O dissolvendo 9 g de NaCl por litro de D 2O. Filtrar através de um filtro não pirogênico de0,2μm para esterilizar.
- Para beber D 2 O-água: gerar 8% v/v D 2água enriquecida com O para ser usada como água potável misturando 80 mL de D2O por 920 mL de água potável regular. A água potável regular pode ser obtida a partir da instalação do rato. Filtrar através de um filtro não pirogênico de 0,2 μm para esterilizar.
2. Modulação da atividade das MTD por aclimatação à temperatura
- Separe os ratos para que haja dois ratos por gaiola 2 semanas antes do início da aclimatação da temperatura. Mude o fornecimento de água para garrafas de água para que os ratos se adaptem e mantenham todas as gaiolas a 22 °C.
- Preparar as câmaras ambientais do rato 1 semana antes de iniciar a aclimatação da temperatura, definindo as temperaturas adequadas: 30 °C para a termoneutralidade, 22 °C para a temperatura ambiente e 18 °C para a exposição ao frio.
- No início da aclimatação da temperatura, substitua as gaiolas por novas sem enriquecimento ambiental (para evitar ninhos). Mova as gaiolas para suas respectivas temperaturas.
NOTA: As gaiolas atribuídas à termoneutralidade permanecerão a 30 °C durante 4 semanas. As gaiolas atribuídas à temperatura ambiente permanecerão a 22 °C durante 4 semanas. As gaiolas atribuídas à exposição ao frio tornar-se-ão progressivamente mais frias numa programação semanal: 18 °C na primeira semana, 14 °C na segunda semana, 10 °C na terceira semana e 6 °C na quarta semana. - Troque gaiolas sujas semanalmente para todas as condições. Além disso, substitua garrafas de alimentos e água por novas pré-adaptadas na temperatura adequada por pelo menos 24 h.
NOTA: Esteja atento às quantidades de alimentos adicionados a cada semana, especialmente para ratos no frio, uma vez que eles consumirão uma quantidade significativamente maior de alimentos em comparação com condições normais. Fornecer alimentos ad libitum.
3. Administração de D2O
- Injetar cada animal com solução fisiológica 0,9% p/v de solução fisiológica D2O a 35 μL/g de peso corporal, 12 h-3 dias antes da coleta do tecido, por injeção intraperitoneal, utilizando-se seringa de 1 mL e agulha de 26 G.
NOTA: Consulte a seção de discussão para obter mais informações sobre como selecionar um tempo de rotulagem apropriado. - Troque as garrafas de água por garrafas contendo 8% v/v D2de água potável enriquecida com O.
4. Coleta, processamento e armazenamento de plasma e tecidos
- No final do experimento, sacrifique os camundongos usando metodologias aprovadas (por exemplo, overdose de dióxido de carbono seguida de deslocamento cervical).
- Use almofadas de calor/resfriamento ou outros métodos para evitar mudanças bruscas de temperatura antes da eutanásia que possam afetar os resultados. Eutanasiar os camundongos seguindo metodologias aprovadas. Proceder imediatamente à coleta de sangue e tecidos.
- Coletar sangue por punção cardíaca usando uma agulha 26 G e armazenar em um tubo de coleta de sangue de ácido etilenodiaminotetracético. Mantenha o sangue no gelo até processamento posterior.
- Abra a pele ao longo da linha média da parte de trás do rato desde a área inferior da cavidade torácica até à área superior do pescoço, enquanto puxa a pele para cima para evitar afetar os tecidos abaixo da pele. A MTD interescapular localiza-se entre as omoplatas, sob uma fina camada de tecido adiposo branco, e é composta por dois lóbulos piramidais.
- Limpe o tecido lavando em solução salina tamponada com fosfato gelado (PBS). Passe em um papel toalha para eliminar o excesso de líquido, pese em uma balança analítica e colete em um microtubo.
- Congele imediatamente o tecido usando nitrogênio líquido. Outros depósitos BAT também podem ser recolhidos.
- Centrifugar as amostras de sangue a 10.000 x g durante 10 min a 4 °C. Após a centrifugação, colete cuidadosamente o plasma sem perturbar a pelota de glóbulos vermelhos. Transfira para um novo microtubo gelado e congele rapidamente em nitrogênio líquido.
- Conservar as amostras de gordura castanha e plasma a -80 °C até à utilização.
5. Extração lipídica do tecido adiposo
- Antes de iniciar a extração
- Preparar uma solução de 1 mM de ácido hexadecenóico-d31 em metanol num frasco para injetáveis de vidro. Isso servirá como o padrão interno de ácidos graxos.
- Pré-resfriar a quantidade necessária de clorofórmio (CHCl 3) e metanol (CH3 OH) em um freezer de -80 °C ou em gelo seco.
NOTA: O antioxidante di-terc-butil-4-metilfenol (BHT) pode ser adicionado ao CHCl3 a uma concentração de 0,01% p/v (2,5 mg/25 mL) para evitar a oxidação das ligações duplas em ácidos graxos insaturados. - Tubos de microcentrífuga pré-rotulados para cada amostra de tecido e um tubo extra a ser usado para uma extração em branco.
CUIDADO: CH 3 OHe CHCl3 são altamente voláteis e tóxicos se inalados. Use apenas em exaustores.
NOTA: Diferentes marcas de tubos de microcentrífuga têm diferentes níveis de palmitato de fundo e capacidades em termos de prevenção de vazamento de solvente. Recomendamos que uma variedade de tubos seja testada primeiro, para garantir que o vazamento de solvente seja evitado e que os tubos tenham níveis mínimos de contaminação do palmitato. Por favor, veja Yao et al.32 para uma discussão mais aprofundada.
- Retire as amostras do congelador e coloque no gelo seco.
- Coloque o tubo de microcentrífuga pré-marcado em uma balança analítica e amarre a balança. Coloque uma pinça e uma lâmina de barbear de bisturi/aço no gelo seco por 10-20 s para esfriar.
- Use a pinça para retirar a amostra de tecido congelado do tubo e colocar em um barco de pesagem de plástico. O barco de pesagem pode ser colocado em um bloco plano de gelo seco ou outra superfície pré-resfriada.
- Usando o bisturi ou lâmina de barbear de aço, dissecar uma pequena porção do tecido, equivalente a 5-15 mg de peso. Coloque no tubo da microcentrífuga e registre o peso exato. Repita para cada amostra. As amostras podem ser armazenadas no freezer neste ponto ou podem ser avançadas para as etapas abaixo para extração de lipídios.
NOTA: Certifique-se de que o bisturi é devidamente limpo com etanol 70% entre as amostras e um barco de pesagem fresco é usado entre cada amostra.
- Adicionar 1 μL/mg de ácido hexadecenóico-d31(C16:0-d31) 10 mM a cada amostra.
CUIDADO: As seguintes etapas (5.4 a 5.8) devem ser realizadas sob um exaustor devido ao risco de inalação dos solventes. - Adicionar 250 μL de CH 3 OH, 250 μL de H2O e 500 μL de CHCl3a cada amostra com três esferas de aço inoxidável de 5 mm. Coloque os tubos em um bloco pré-resfriado de um moinho e misture as amostras a uma frequência vibracional de 25 Hz por 5 min, ou use as diretrizes recomendadas pelo fabricante para amostras de tecido. Remova as contas usando um ímã.
- Centrifugar as amostras a 12.000 x g durante 10 min a 4 °C.
NOTA: Após a centrifugação, uma separação bifásica clara deve ser observada com a fase aquosa superior contendo metabólitos polares e a fase orgânica inferior contendo lipídios e ácidos graxos. Se não houver separação, adicionar 250 μL de H2O e repetir as etapas de vórtice e centrifugação. - Usando uma micropipeta, pegue um volume fixo da fase inferior de cada amostra em tubos de microcentrífuga correspondentemente marcados.
- Adicionar 500 μL de CHCl3 à amostra restante e repetir os passos 5.6-5.7.
- Colocar as amostras sob gás azotado ou num vácuo centrífugo refrigerado resistente a CHCl3 a 4 °C até secar completamente. As amostras secas podem ser armazenadas a -20 °C até estarem prontas para derivatização.
NOTA: A camada superior de cada amostra também pode ser coletada neste ponto e seca como na etapa 5.9 para analisar metabólitos polares.
6. Preparação de ésteres metílicos de ácidos graxos (FAMEs) e análise GCMS
- Esterificação e transesterificação catalisadas por ácido para preparar FAMEs
CUIDADO: As seguintes etapas devem ser realizadas sob um exaustor devido ao risco de inalação dos solventes.- Se as amostras tiverem sido armazenadas em congelador, seque sob azoto durante 5 minutos para garantir que não há água.
- Usando solventes de grau MS, pipetar 98 mL de CH3OH anidro em um frasco de meio de vidro. Adicionar lentamente 2 mL de ácido sulfúrico anidro no exaustor para fazer 2% H2SO4 em CH3OH. Misture girando o frasco fechado.
- Adicionar 500 μL de 2% H2SO4 em solução CH3OH a cada amostra e vórtice brevemente.
- Incubar as amostras num bloco térmico a 50 °C durante 2 h.
- Retirar as amostras do bloco térmico e adicionar 100 μL de solução saturada de NaCl e 500 μL de hexano a cada amostra.
- Vórtice as amostras vigorosamente à temperatura ambiente durante 1 min. Deixe as amostras descansar por 1 min; Duas fases devem ser aparentes depois disso.
- Recolher a fase superior num tubo de microcentrífuga fresco (ver nota no ponto 5.1.3 para a selecção adequada do tubo de microcentrífuga).
- Para maximizar o rendimento, repita os passos 6.1.5-6.1.7, recolhendo a segunda amostra nos mesmos tubos marcados.
- Secar as amostras à temperatura ambiente sob gás azoto.
- Ressuspender as amostras em 20 μL/mg de hexano, em relação ao peso original do tecido, e transferir imediatamente para o frasco para injetáveis de vidro GC com uma inserção de vidro.
NOTA: Trabalhe rapidamente durante a transferência de amostras para minimizar a evaporação.
- Análise GCMS
- Para determinar a abundância de isotopólogos FAME, injetar as amostras em um único espectrômetro de massas por cromatografia gasosa quadrupolo (GCMS).
NOTA: Embora muitos tipos de coluna possam ser usados para detectar palmitato, o seguinte programa de temperatura foi estabelecido para uma coluna GCMS que foi desenvolvida para a separação de isômeros cis/trans de ácidos graxos, conforme detalhado na Tabela de Materiais. Esta coluna tem um comprimento de 50 m com um diâmetro interno de 0,25 mm. - Injectar 1 μL de amostra numa entrada split/splitless a uma temperatura de entrada de 270 °C, utilizando hélio como gás de transporte, fluindo a 1 ml/min. Use uma injeção splitless para ácidos graxos pouco abundantes com um fluxo total de 19 mL/min, uma purga septal de 3 mL/min e um fluxo de purga para fracionamento de 15 mL/min a 0,75 min. Use uma proporção dividida de 10:1-40:1 para ácidos graxos altamente abundantes, como palmitato e oleato.
- Use os seguintes parâmetros do forno: temperatura inicial de 80 °C; aumentar em incrementos de 20 °C/min para 170 °C; aumentar em incrementos de 1 °C/min para 204 °C; aumentar em incrementos de 20 °C/min para 250 °C; e, em seguida, segure a 250 °C por 10 min.
- Use os seguintes parâmetros de detector seletivo de massa (MSD): um modo de ionização por impacto de elétrons de 70 eV e varredura na faixa de 50-400 m/z com uma velocidade de varredura de 1.562 (u/s) e uma frequência de 4,1 varreduras/s. Use uma linha de transferência a 280 °C, uma fonte de íons a 230 °C e um quadrupolo a 150 °C.
Observação : outras colunas podem ser usadas, mas o programa de temperatura irá variar. - Sequência da amostra: Aleatorizar a ordem de injeção da amostra e injetar pelo menos dois ou três espaços em branco de hexano no início da sequência, após cada cinco amostras dentro da sequência, e duas ou três no final da sequência.
- Use software específico para instrumentos, ou software livre de acesso aberto, como o Metabolite-Detector33, para integrar os íons da Tabela 1 para cada éster metílico de ácido graxo.
NOTA: Descrevemos íons que cobrem isotopólogos M1-M5 na Tabela 1 que encontramos cobre a quantidade de incorporação de deutério com esta janela de rotulagem. No entanto, este montante poderá ter de ser alargado se o fluxo de novo for significativamente mais elevado e/ou se for utilizado um tempo de rotulagem mais longo. - Use a abundância de cada íon integrado para gerar uma distribuição isotopómera de massa, onde as intensidades de íons podem ser convertidas em abundância fracionária de modo que a soma da distribuição do isotopômero de massa seja igual a um. Consulte a planilha de exemplo no Arquivo Suplementar.
NOTA: A fim de determinar com precisão a incorporação de deutério, a correção da abundância natural de isótopos deve ser empregada para permitir a presença de isótopos naturais como 13C, 15N e 2H. Isso é realizado aplicando-se uma matriz de correção como delineado por Fernandez et al.34,35, e não pode ser realizado subtraindo-se a DMI de um metabólito medido não marcado de um metabólito marcado. Na prática, recomendamos o uso de softwares disponíveis gratuitamente como fluxfix 36, polyMID37 ou IsoCor38 para transformar dados brutos em MIDs fracionários, e fornecemos a fórmula para correção isotópica para os produtos de éster metílico de FAS na Tabela 1. - Para determinar a quantidade de palmitato presente, utilize a seguinte fórmula:

onde contagem de íons refere-se à soma de todos os isotopólogos palmitados integrados na Tabela 1 e C16:0-d 31 refere-se ao padrão interno hexadecenóico-d31. O padrão interno forma um pico separado do palmitato endógeno. A abundância relativa de outros ácidos graxos também pode ser determinada, mas padrões internos de isótopos específicos de ácidos graxos (com deslocamentos de massa maiores do que os observados a partir da incorporação de D2O) ou curvas de padrão externo podem precisar ser empregados para a quantificação completa. Use a amostra extraída em branco para determinar a quantidade de palmitato de fundo e subtraí-la do valor final do tecido. - Calcular o enriquecimento molar (EM) do palmitato pela seguinte equação:

onde Mi é a abundância fracionada normalizada de um isotólogo palmitato e n é o número de possíveis isotopólogos palmitados. Por exemplo, o ME de uma molécula de palmitato com a seguinte distribuição fracionária, M1 = 0,25, M2 = 0,08, M3 = 0,02, é: (0,025*1) + (0,08*2) + (0,02*3) = 0,245 (Ver Arquivo Suplementar).
- Para determinar a abundância de isotopólogos FAME, injetar as amostras em um único espectrômetro de massas por cromatografia gasosa quadrupolo (GCMS).
7. Troca de acetona de deutério de amostras de plasma para determinar o enriquecimento de água corporal
- Reação
- Prepare 10 padrões de deutério em água, variando de 0-9% v/v.
- Preparar uma solução de acetona/acetonitrila a 5% v/v, permitindo 4 μL por amostra, incluindo as normas do passo 5.1.1.
- Em tubos de microcentrífuga marcados e com fecho seguro, combinar 10 μL de cada amostra de plasma ou padrão, 4 μL de NaOH 10 M e 4 μL de acetona/acetonitrila a 5%. Execute isso em triplicata para cada amostra.
- Misture as amostras suavemente por pipetagem. Deixe as amostras incubarem à temperatura ambiente durante a noite.
- Extração
- Após a incubação, adicionar 450-550 mg de Na2SO4 a cada amostra.
- No exaustor, adicionar 600 μL de CHCl3 a cada tubo e agitar vigorosamente por 15 s.
- Centrifugar as amostras a 300 x g durante 2 min.
- Sob um exaustor, transfira a triplicata de 80 μL de alíquotas do sobrenadante de cada amostra para frascos de vidro GCMS rotulados com inserções de vidro e tampa firmes.
- Análise GCMS
- Separe as amostras em uma coluna (30 m, 0,25 mm i.d, Agilent DB-35MS) e analise no espectrômetro de massa acoplado.
- Injectar 1 μL de amostra numa entrada split/splitless, com uma relação de divisão de 40:1, um fluxo de hélio de 1 mL/min e uma temperatura de entrada de 270 °C.
- Use os seguintes parâmetros do forno: uma temperatura inicial de 60 °C, aumentar em incrementos de 20 °C/min para 100 °C, aumentar em incrementos de 50 °C/min para 220 °C e, em seguida, manter a 220 °C por 1 min.
- Use os seguintes parâmetros do detector seletivo de massa (MSD): modo de ionização por impacto de elétrons a 70 eV com monitoramento de íons de seleção de 58 e 59 m/z. Use uma linha de transferência a 280 °C, uma fonte de íons a 230 °C e um quadrupolo a 150 °C.
NOTA: Outras colunas de baixa sangria, ligadas, reticuladas e de polaridade média podem ser usadas, mas o programa de temperatura varia.
- Defina o método do amostrador de líquido para começar com uma lavagem CHCl 3 e, em seguida, uma sequência aleatória das amostras, incluindo etapas adicionais de lavagem CHCl3 a cada seis amostras.
NOTA: Se a acetona for utilizada como lavagem por agulha para o amostrador automático, substitua por CHCl 3 ou hexano e injecte várias amostras de CHCl3 em branco até que qualquer pico de acetona contaminante deixe de ser evidente no cromatograma. - Usando este método, um pico de acetona elui em torno de 1,25 min. Integrar os dados e calcular a abundância fracionada de enriquecimento de acetona seguindo as etapas 6.2.6-6.2.7, com um ajuste para analisar picos contendo uma relação m/z de 58-60 conforme indicado na Tabela 1.
- Utilizar os padrões para gerar uma curva padrão para determinar a porcentagem de enriquecimento de água corporal (p) das amostras de teste, com base no enriquecimento fracionado de acetona.
- Separe as amostras em uma coluna (30 m, 0,25 mm i.d, Agilent DB-35MS) e analise no espectrômetro de massa acoplado.
8. Cálculos in vivo de nova lipogênese
- Calcule a fração de ácidos graxos recém-sintetizados (FNS) que são produtos diretos do FAS (ou seja, palmitato, ácidos graxos de cadeia ímpar e mmBCFAs) em cada amostra com a seguinte equação:
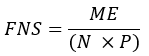
onde ME é o enriquecimento molar médio de uma molécula de palmitato (passo 6.2.9), p é o enriquecimento de deutério em água da amostra de plasma correspondente (passo 7.3.4), e N é o número de átomos de hidrogênio trocáveis no palmitato onde um deutério pode ser incorporado. - Determine N usando a equação abaixo que foi estabelecida por Lee et al.31:
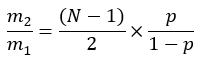
- Determinar a quantidade molar de ácidos gordos recém-sintetizados (MNS) por:
MNS = ENF x quantidade total de ácidos graxos (nmol/mg tecido).
NOTA: Por exemplo, se se obtiver um enriquecimento molar palmitato (EM) de 0,245, um enriquecimento de deutério em água corporal (p) de 0,045 e um número N calculado de 22, a síntese fracionada de palmitato é de 0,247. Se a quantidade de palmitato presente no tecido for de 2 mmol/mg, então o mmol de palmitato recém-sintetizado é de 0,494 mmol/mg (ver Arquivo Suplementar).
Resultados
Com base na dosagem de D 2 O descrita na etapa 1, tipicamente descobrimos que a água corporal é enriquecida na faixa de2,5% a 6%, e que um nível basal de enriquecimento de deutério em água corporal é rapidamente alcançado em 1 h e mantido durante o estudo por meio de 8% de água potável enriquecida (Figura 1). O enriquecimento contínuo de água corporal em estado estacionário é uma suposição dos cálculos utilizados na etapa 6, e por isso recomendamos a validação experimental da cinética de enriquecimento de água corporal em novos modelos experimentais.
Verificamos que a quantidade de ácidos graxos sintetizados de novo está aumentada à temperatura ambiente, em relação àquelas em termoneutralidade nas MTD (Figura 2). A distribuição isotopológica de massa de palmitato em MTD de camundongos em termoneutralidade e temperatura ambiente após 3 dias de administração de D2O mostra um maior enriquecimento de deutério M1 e M2 encontrado à temperatura ambiente (Figura 2A). Esse enriquecimento de temperatura mais fria não ocorre apenas no palmitato, mas também em uma ampla gama de ácidos graxos nas MTD (Figura 2B). A abundância total de palmitato também está aumentada nas MTD de camundongos à temperatura ambiente, e combinando a taxa de síntese fracionada com os níveis de palmitato total, descobrimos que a síntese total de palmitato foi aumentada em camundongos à temperatura ambiente (Figura 2C,D). Notavelmente, o enriquecimento de ácidos graxos totais plasmáticos não segue a mesma tendência que a BAT, mas o enriquecimento de ácidos graxos é aumentado com a termoneutralidade (Figura 2E). A absorção potencial deconvolunte da síntese endógena não é possível com uma abordagem de ponto de tempo único D2O, como descrito aqui, mas essas tendências opostas indicam que o padrão de enriquecimento de ácidos graxos nas MTD não está sendo impulsionado pela absorção de ácidos graxos.

Figura 1: Percentagem de enriquecimento de D 2 O no plasma de ratinhos ao longo de vários pontos de tempo, após injeção com 0,035 ml/g de peso corporal 0,9% NaCl D 2 O e substituição da água potável por 8%de água enriquecida com D2O. Os gráficos de barras representam a média ± DP, n = 9. Clique aqui para ver uma versão maior desta figura.

Figura 2: Resultados representativos em tecido adiposo marrom de camundongos após 3 dias da administração de D 2 O. (A) Distribuição isotopológica em massa de palmitato em MTD após 3 dias de administração de D2O à temperatura ambiente (TR) e termoneutralidade (NT). B) Enriquecimento molar MTD de uma gama de ácidos gordos após 3 dias de administração de D2O à temperatura ambiente e termoneutralidade. (C) Abundância total e o palmitato (D) de novo sintetizado no tecido adiposo marrom após 3 dias de administração de D 2O à temperatura ambiente e termoneutralidade. (E) Enriquecimento molar plasmático de uma gama de ácidos gordos após 3 dias de administração de D2O à temperatura ambiente e termoneutralidade. Os gráficos de barras representam a média ± DP.*p < 0,05, **p < 0,01, ***p < 0,001. n = 6. A análise estatística foi determinada pelo teste t de Student bicaudal. Clique aqui para ver uma versão maior desta figura.
| Composto | Íons | Tempo estimado de eluição (minutos) | Fórmula para correção de isótopos |
| C16:0 | 270-275 | 20 | C17H34O2 |
| C14:0 | 242-247 | 16.5 | C15H30O2 |
| C15:0 | 256-261 | 18 | C16H32O2 |
| Iso-C16:0 | 270-275 | 18.9 | C17H34O2 |
| Iso-C17:0 | 284-289 | 21 | C18H36O2 |
| Anteiso-C17:0 | 284-289 | 21.5 | C18H36O2 |
| C16 D31 | 301 | 19.2 | ~ |
| Acetona | 58-59 | 1.5 | C3H6O |
Tabela 1: Íons de fragmentos compostos do GCMS para integrar. Esta tabela abrange uma gama de ácidos gordos produzidos pela sintase de ácidos gordos de mamíferos, mas C16:0 é o produto primário. Todos os tempos de retenção são para o método GCMS detalhado na etapa 6, exceto acetona, que é detalhada na etapa 7.
Arquivo suplementar: Exemplo de cálculo de planilha. Clique aqui para baixar este arquivo.
Discussão
A compreensão do equilíbrio e da interação entre vias metabólicas complexas é um passo indispensável para a compreensão das bases biológicas das doenças relacionadas ao metabolismo. Aqui, mostramos uma metodologia não invasiva e de baixo custo para determinar alterações na síntese de novos ácidos graxos. Este método é adaptado de métodos publicados anteriormente que desenvolveram cálculos para estimar o fluxo de síntese de novo a partir do enriquecimento de deutério com ácidos graxos31 e para usar a troca deutério-acetona para determinar a porcentagem relativa de D2O em água corporal39. Nos últimos anos, utilizamos o método aqui descrito e o aplicamos para descobrir alterações na síntese de diversos ácidos graxos em depósitos adiposos, cérebro, fígado e tumores9,22,40. Há uma série de etapas críticas e aspectos modificáveis desse protocolo. Estes estão relacionados ao planejamento experimental global, bem como à abordagem analítica e aos cálculos utilizados neste método. Abordagens alternativas para calcular a síntese de novos ácidos graxos a partir de traçadores de isótopos estáveis também são amplamente utilizadas. Estes incluem a abordagem de análise de distribuição de isotoâmeros de massa alternativa (MIDA) desenvolvida por Hellerstein et al.41,42, a análise espectral de isotopômeros (ISA) desenvolvida por Kelleher et al.43,44 e abordagens mais recentes que foram desenvolvidas para modelar a síntese de ácidos graxos de cadeia mais longa, como a análise de fontes de ácidos graxos (FASA)45. O benefício do método aqui é que ele é facilmente implementável com software disponível gratuitamente e o uso de uma planilha. No entanto, é limitado pela necessidade de o enriquecimento de água corporal (BWE) estar em estado estacionário, ressalvas associadas à utilização do parâmetro N (discutido abaixo), e que só é aplicável a produtos diretos de FAS, que é primariamente palmitato.
Gordura marrom DNL e aclimatação à temperatura
A DNL tem surgido como principal nódulo de regulação metabólica de todo o corpo e é essencial para o desenvolvimento normal13,29. A deleção tecidual direcionada e a análise metabolômica identificaram vários fatores enzimáticos e transcricionais importantes que controlam a DNL no tecido adiposo, e como ela controla a acreção de gordura corporal total e a homeostase metabólica normal 21,28,46,47,48,49. Embora menos apreciado, o BAT é um tecido altamente ativo na DNL, com maior expressão da maquinaria enzimática do corpo central do DNL (acly, acaca, fasn) do que a maioria dos outros tecidos e maior atividade lipogênica 22,50,51,52,53,54,55. No entanto, a MTD é única, no sentido de que a aclimatação a temperaturas sub-termoneutras induz simultaneamente DNL e atividade de oxidação de ácidos graxos na MTD 22,54,56. Embora os mecanismos associados não estejam totalmente esclarecidos, aceita-se que as MTD sejam um sumidouro metabólico de nutrientes, incluindo aqueles destinados à DNL para síntese lipídica, que são essenciais para a atividade normal das MTD53,55. Como tal, é relevante ser capaz de contabilizar todos os rendimentos metabólicos e resultados das MTD para avaliar os seus níveis de atividade. No entanto, o DNL geralmente só é medido com base na expressão gênica e avaliado funcionalmente em ocasiões contadas. O protocolo aqui proposto permite a avaliação funcional do DNL, permitindo uma interpretação mais completa do estado metabólico.
D2O dose, tempo e medição do enriquecimento de água corporal
Uma das principais etapas críticas no projeto é a dose e o tempo de administração do D2O. Neste protocolo, empregamos uma abordagem de dose e administração (injeção em bolus seguida de enriquecimento de água potável) que descobrimos que leva à rápida obtenção e manutenção da WEB em estado estacionário. Os cálculos usados para determinar a síntese de ácidos graxos são baseados na suposição de BWE em estado estacionário; portanto, é crucial que isso seja validado em novos modelos experimentais. Se o enriquecimento em estado estacionário não for possível devido a problemas com o uso dessa abordagem de dosagem combinada, o leitor é encaminhado para outras publicações onde alterações nos cálculos permitem isso39. O grau de variação do estado estacionário que pode ser tolerado, ao empregar uma abordagem de dosagem que visa a obtenção rápida deste depende de muitos fatores. Se o BWE for aumentado em picos sustentados acima do valor usado para cálculo, então, usando a abordagem aqui, o DNL será superestimado. Se o BWE for significativamente menor do que o valor usado para o cálculo de quantidades sustentadas de tempo, o DNL será subestimado. Embora alguma pequena variação em torno da média seja esperada, o fator mais crítico é que a BWE não varia mais em um grupo experimental do que no outro, o que poderia levar a diferenças no DNL calculado sendo impulsionadas pela variação na BWE. Se ambos os grupos experimentais apresentarem alguma variação ligeira, mas semelhante ao longo do tempo, a tolerância dependerá da exatidão e precisão com que o examinador necessita da medida para realizar, bem como das diferenças esperadas entre os grupos experimentais. Por exemplo, no caso do tecido adiposo marrom exposto à termoneutralidade versus temperatura ambiente, que foi dado como exemplo aqui, a diferença na quantidade de ácido graxo sintetizado de novo presente é superior a 50%; portanto, é improvável que pequenas variações na BSB obscureçam os resultados.
Além da consideração do estado estacionário, outro aspecto modificável desse protocolo é o nível de WE. O aumento do BWE potencialmente permite uma maior transferência de rótulos para ácidos graxos e, portanto, pools de ácidos graxos com menor turnover podem ser mais facilmente detectáveis em um curto período de tempo. Isso poderia ser uma vantagem em situações em que o pesquisador está interessado em respostas agudas em DNL. No entanto, níveis aumentados de D2O na água corporal podem causar efeitos fisiológicos indesejados, devendo, portanto, ser tomada cautela57. A administração de níveis mais baixos de D 2 O para atingir níveis de BWE tipicamente em torno de 0,5% é comumente empregada em estudos em humanos devidoao custo associado à administração de D2O. Nesse caso, métodos com sensibilidade aumentada podem ser necessários para quantificar a WEB e o enriquecimento com ácidos graxos. Para BWE, isso pode ser obtido por espectrometria de massa de razão iônica58 ou um protocolo modificado de troca de acetona59. Para a análise de ácidos graxos, o uso de um instrumento GCMS de alta resolução demonstrou recentemente aumentar a sensibilidade da medição de deutério em ácidos graxos e, assim, permitir a quantificação de DNL após períodos de tempo muito curtos e/ou BWE60 baixo. Métodos alternativos também podem ser usados para aumentar o rendimento com o qual o BWE é medido, utilizando análises de headspace da acetona gerada na etapa 7.1.5 em vez de extraí-la com CHCl3 e realizar injeção de líquido. Isso diminui o tempo de execução do método e evita várias etapas de transferência, reduzindo assim o tempo de preparação da amostra. Se o acesso a um injetor de headspace estiver disponível, este método é altamente recomendado61.
Escolha do pool de ácidos graxos para quantificação e abordagem analítica
Neste protocolo, o método é projetado para medir o pool total de ácidos graxos no tecido ou plasma, independentemente da classe lipídica. No entanto, as classes lipídicas podem ser separadas antes da geração de FAME, através de métodos como cromatografia em camada delgada ou cromatografia líquida. Além disso, ao analisar soro ou plasma, lipídios de frações lipoprotéicas específicas, como a lipoproteína de muito baixa densidade (VLDL), podem ser isolados por ultracentrifugação58. Este método é comumente empregado em estudos em humanos, a fim de determinar DNL hepático, que é provável ser a fonte primária de novos ácidos graxos produzidos em VLDL. O protocolo de extração e derivatização de lipídios também pode ser modificado para melhorar o isolamento de classes específicas62. Finalmente, o enriquecimento de deutério de hidrogênios lipídicos também pode ser medido usando espectroscopia de RMN de 2 H em vez de espectrometria demassa. Embora esse método seja menos sensível que o MS e, portanto, necessite de maior quantidade de material, sua vantagem é fornecer informações de enriquecimento posicional, que podem ser usadas para melhor estimar as taxas de alongamento e dessaturação63.
Cálculo
Os cálculos deste protocolo são baseados em cálculos prévios que levam em conta o BWE em estado estacionário, o enriquecimento de ácidos graxos e o número de hidrogênios trocáveis nos ácidos graxos31. Como acontece com qualquer cálculo, há uma série de limitações e suposições que devem ser consideradas ao aplicar e interpretar os resultados dessa abordagem. Uma das principais considerações é o valor usado para N na seção 8 do método. Durante a síntese de ácidos graxos, 2 Hde D 2O são incorporados à cadeia acila, bem como indiretamente via troca com hidrogênios em NADPH, acetil-CoA e malonil-CoA64,65. Estudos prévios mostraram que essa troca é incompleta31,66; assim, o cálculo incorpora um fator de correção (N) para permitir esse65. Um N de 22 é comumente usado para muitos estudos, pois já foi encontrado que este é apropriado para uma variedade de tecidos usando a equação descrita no passo 631,66. No entanto, isso pode variar de acordo com a perturbação experimental e o modelo animal65; portanto, instamos os pesquisadores a levar isso em consideração. Um N menor aumenta o fluxo total de síntese, e o valor empregado para esse parâmetro deve ser considerado ao comparar medidas entre estudos ou laboratórios. Uma limitação da abordagem aqui utilizada é que ela só é relevante para a análise de produtos diretos de FAS, que é primariamente palmitato, com quantidades muito menores de ácidos graxos de cadeia ímpar e ácidos graxos de cadeia ramificada monometil9. Embora o enriquecimento com deutério de todos os ácidos graxos possa ser detectado, a fórmula aqui utilizada não é apropriada para determinar a síntese de ácidos graxos de cadeia mais longa, como C18:0, pois não permite a absorção de ácidos graxos não marcados e o alongamento destes67. Da mesma forma, as taxas de dessaturação também podem estar subestimadas.
Limitações gerais
Embora o uso de D2O para medir ácidos graxos tenha gerado informações cruciais sobre a importância da DNL na homeostase fisiológica, há uma série de limitações associadas a essa metodologia. Primeiro, com base no tempo descrito aqui, não é possível estar completamente confiante no tecido de origem dos ácidos graxos recém-sintetizados. É fácil imaginar um cenário em que um determinado tecido gera ácidos graxos a partir do DNL, e então estes são transportados para outros tecidos. Experimentos de curso de tempo fino após o tratamento com D2O podem aumentar a resolução do tecido de origem para ácidos graxos recém-sintetizados, diminuindo a contaminação entre tecidos. O ponto de tempo de 3 dias que foi utilizado para os resultados representativos foi projetado para detectar o enriquecimento de deutério em uma faixa de ácidos graxos tanto na termoneutralidade (quando o fluxo é menor) quanto à temperatura ambiente. Tempos mais curtos após a administração de D2O, em que o palmitato é o alvo primário, minimizam o transporte de ácidos graxos entre tecidos e, portanto, podem ser vantajosos. Pontos de tempo muito mais curtos (por exemplo, 12 h) seriam ideais ao considerar camundongos em condições frias e quando a termoneutralidade não está incluída no planejamento experimental. Em segundo lugar, este método não fornece informações sobre o substrato de origem dos novos ácidos graxos. A identificação dos substratos específicos utilizados em circunstâncias particulares pode ser uma camada adicional de informação necessária para a compreensão completa do mapa regulatório da DNL. Isso pode ser feito com substratos marcados com isótopos estáveis.
Benefícios
Um benefício particular desta metodologia é que os animais são desenfreados (exceto para a injeção inicial de D2O) e conscientes durante o procedimento, promovendo um ambiente de baixo estresse para que os animais se comportem naturalmente, incluindo deambulação desejada e um padrão e quantidade de alimentação que permita um tratamento dietético específico, se necessário. D2O também é notavelmente fácil de administrar. Ao contrário das soluções líquidas de outros traçadores (por exemplo, 13C-U-glicose), D2O não tem características palatáveis distintas que possam afetar o consumo de água. Além dos traçadores de isótopos estáveis, o outro método mais comumente usado são os radioisótopos. A vantagem potencial dos radioisótopos é a escolha do equipamento para detecção. Um espectrômetro de massa é necessário para isótopos estáveis, enquanto radioisótopos podem ser detectados usando um contador de cintilação, que pode ser mais facilmente acessível. No entanto, há uma série de desvantagens associadas aos radioisótopos devido a questões éticas e de segurança. Além disso, o radioisótopo geralmente está sobre a glicose e, portanto, não reflete apenas alterações no DNL, mas sim alterações no DNL derivado da glicose. Além disso, a determinação da síntese de ácidos graxos individuais não é possível. D2O equilibra-se mais rapidamente em todos os tecidos em comparação com substratos específicos com rótulos de isótopos68.
DNL é um componente-chave da homeostase metabólica controlada por um número de enzimas e fatores de transcrição que afetam independentemente o desenvolvimento, metabolismo e estados de doença. Assim, DNL está fadado a ser uma importante via metabólica, que precisará ser interrogada mais amplamente na pesquisa e desenvolvimento de terapias. Este protocolo pode ser usado como um primeiro passo para incorporar a análise de DNL rotineiramente na fenotipagem metabólica.
Divulgações
Os autores não têm nada a divulgar.
Agradecimentos
Agradecemos aos membros do laboratório Sanchez-Gurmaches e Wallace pelas valiosas discussões. Este trabalho foi apoiado por subsídios da American Heart Association (18CDA34080527 para JSG e 19POST34380545 para RM), do NIH (R21OD031907 para JSG), um CCHMC Trustee Award, um CCHMC Center for Pediatric Genomics Award e um CCHMC Center for Mendelian Genomics & Therapeutics Award. Este trabalho foi apoiado em parte pelo NIH P30 DK078392 do Digestive Diseases Research Core Center em Cincinnati. O conteúdo é de responsabilidade exclusiva dos autores e não representa necessariamente a opinião oficial do National Institutes of Health. RT e MW foram apoiados por uma UCD Ad Astra Fellowship.
Materiais
| Name | Company | Catalog Number | Comments |
| 4 mL Glass Vials | Fisher Scientific | 14-955-334 | |
| 0.2 µm filter | Olympus Plastic | 25-244 | |
| 26G needeled syringes | BD | 309597 | |
| Acetone | Merck | 34850 | |
| Acetonitrile | Merck | 900667 | |
| Blue GC screw cap with septa | Agilent | 5190-1599 | |
| Centrifuge | Eppendorf | 5424R | |
| Chloroform | Sigma | 366927 | |
| Deuterium oxide | Sigma | 151882 | |
| Di-tert-butyl-4-methylphenol (BHT) Select FAME Column | Merck | B1378 | |
| Di-tert-butyl-4-methylphenol (BHT) Select FAME Column | Agilent | CP7419 | |
| EDTA tube | Sarstedt | 411395105 | |
| Ethanol | Merck | 51976 | |
| Hexadecenoic-d31 Acid | Larodan | 71-1631 | |
| Hexane | Merck | 34859 | |
| Methanol | Merck | 34860 | |
| Microcentrifuge tube | Olympus Plastic | 24-282 | |
| Mouse environmental chamber | Caron | Caron 7001-33 | |
| Potasium Chloride | Fisher Bioreagents | BP366-500 | |
| Potasium Phosphate | MP Biomedicals | 194727 | |
| SafeLock microcentrifuge tubes | Eppendorf | 30120086 | |
| Screw top amber GC vial | Agilent | 5182-0716 | |
| Sodium Chloride | Fisher Bioreagents | BP358-212 | |
| Sodium Hydroxide | Merck | S5881 | |
| Sodium Phosphate, dibasic | Fisher Bioreagents | BP332-500 | |
| Sodium Sulfate | Merck | 239313 | |
| Sulfuric Acid | Merck | 258105 | |
| Vial insert | Agilent | 5183-2088 |
Referências
- The Lancet, Diabetes Endocrinology. Childhood obesity: a growing pandemic. The Lancet. Diabetes & Endocrinology. 10 (1), 1(2022).
- Gonzalez-Muniesa, P., et al. Obesity. Nature Reviews Disease Primers. 3, 17034(2017).
- Müller, T. D., Blüher, M., Tschöp, M. H., DiMarchi, R. D. Anti-obesity drug discovery: advances and challenges. Nature Reviews Drug Discovery. 21 (3), 201-223 (2021).
- Virtue, S., Vidal-Puig, A. GTTs and ITTs in mice: simple tests, complex answers. Nature Metabolism. 3 (7), 883-886 (2021).
- Müller, T. D., Klingenspor, M., Tschöp, M. H. Revisiting energy expenditure: how to correct mouse metabolic rate for body mass. Nature Metabolism. 3 (9), 1134-1136 (2021).
- Virtue, S., Lelliott, C. J., Vidal-Puig, A. What is the most appropriate covariate in ANCOVA when analysing metabolic rate. Nature Metabolism. 3 (12), 1585(2021).
- Hellerstein, M. K. De novo lipogenesis in humans: metabolic and regulatory aspects. European Journal of Clinical Nutrition. 53 Suppl 1, S53-S65 (1999).
- Zhao, S., et al. Dietary fructose feeds hepatic lipogenesis via microbiota-derived acetate. Nature. 579 (7800), 586-591 (2020).
- Wallace, M., et al. Enzyme promiscuity drives branched-chain fatty acid synthesis in adipose tissues. Nature Chemical Biology. 14 (11), 1021-1031 (2018).
- Zhao, S., et al. ATP-citrate lyase controls a glucose-to-acetate metabolic switch. Cell Reports. 17 (4), 1037-1052 (2016).
- Green, C. R., et al. Branched-chain amino acid catabolism fuels adipocyte differentiation and lipogenesis. Nature Chemical Biology. 12 (1), 15-21 (2016).
- Zhang, Z., et al. Serine catabolism generates liver NADPH and supports hepatic lipogenesis. Nature Metabolism. 3 (12), 1608-1620 (2021).
- Chirala, S. S., et al. Fatty acid synthesis is essential in embryonic development: fatty acid synthase null mutants and most of the heterozygotes die in utero. Proceedings of the National Academy of Sciences. 100 (11), 6358-6363 (2003).
- Icard, P., et al. ATP citrate lyase: A central metabolic enzyme in cancer. Cancer Letters. 471, 125-134 (2020).
- Fhu, C. W., Ali, A. Fatty acid synthase: an emerging target in cancer. Molecules. 25 (17), 3935(2020).
- Lawitz, E. J., et al. Acetyl-CoA carboxylase inhibitor GS-0976 for 12 weeks reduces hepatic de novo lipogenesis and steatosis in patients with nonalcoholic steatohepatitis. Clinical Gastroenterology and Hepatology. 16 (12), 1983e3-1991e3 (2018).
- Smith, G. I., et al. Insulin resistance drives hepatic de novo lipogenesis in nonalcoholic fatty liver disease. The Journal of Clinical Investigation. 130 (3), 1453-1460 (2020).
- Imamura, F., et al. Fatty acids in the de novo lipogenesis pathway and incidence of type 2 diabetes: A pooled analysis of prospective cohort studies. PLoS Medicine. 17 (6), e1003102(2020).
- Lai, H. T. M., et al. Serial plasma phospholipid fatty acids in the de novo lipogenesis pathway and total mortality, cause-specific mortality, and cardiovascular diseases in the cardiovascular health study. Journal of the American Heart Association. 8 (22), e012881(2019).
- Ference, B. A., et al. Mendelian randomization study of ACLY and cardiovascular disease. The New England Journal of Medicine. 380 (11), 1033-1042 (2019).
- Herman, M. A., et al. A novel ChREBP isoform in adipose tissue regulates systemic glucose metabolism. Nature. 484 (7394), 333-338 (2012).
- Sanchez-Gurmaches, J., et al. Brown fat AKT2 Is a cold-induced kinase that stimulates ChREBP-mediated de novo lipogenesis to optimize fuel storage and thermogenesis. Cell Metabolism. 27 (1), 195e6-209e6 (2018).
- Wang, X., et al. Nuclear protein that binds sterol regulatory element of low density lipoprotein receptor promoter. II. Purification and characterization. The Journal of Biological Chemistry. 268 (19), 14497-14504 (1993).
- Briggs, M. R., Yokoyama, C., Wang, X., Brown, M. S., Goldstein, J. L. Nuclear protein that binds sterol regulatory element of low density lipoprotein receptor promoter. I. Identification of the protein and delineation of its target nucleotide sequence. The Journal of Biological Chemistry. 268 (19), 14490-14496 (1993).
- Yokoyama, C., et al. SREBP-1, a basic-helix-loop-helix-leucine zipper protein that controls transcription of the low density lipoprotein receptor gene. Cell. 75 (1), 187-197 (1993).
- Chen, G., Liang, G., Ou, J., Goldstein, J. L., Brown, M. S. Central role for liver X receptor in insulin-mediated activation of Srebp-1c transcription and stimulation of fatty acid synthesis in liver. Proceedings of the National Academy of Sciences. 101 (31), 11245-11250 (2004).
- Denechaud, P. D., et al. ChREBP, but not LXRs, is required for the induction of glucose-regulated genes in mouse liver. The Journal of Clinical Investigation. 118 (3), 956-964 (2008).
- Crewe, C., et al. SREBP-regulated adipocyte lipogenesis is dependent on substrate availability and redox modulation of mTORC1. JCI Insight. 5 (15), e129397(2019).
- Batchuluun, B., Pinkosky, S. L., Steinberg, G. R. Lipogenesis inhibitors: therapeutic opportunities and challenges. Nature Reviews Drug Discovery. 21 (4), 283-305 (2022).
- Wallace, M., Metallo, C. M. Tracing insights into de novo lipogenesis in liver and adipose tissues. Seminars in Cell & Developmental Biology. 108, 65-71 (2020).
- Lee, W. N., et al. In vivo measurement of fatty acids and cholesterol synthesis using D2O and mass isotopomer analysis. The American Journal of Physiology. 266 (5 Pt 1), E699-E708 (1994).
- Yao, C. H., Liu, G. Y., Yang, K., Gross, R. W., Patti, G. J. Inaccurate quantitation of palmitate in metabolomics and isotope tracer studies due to plastics. Metabolomics. 12, 143(2016).
- Hiller, K., et al. MetaboliteDetector: comprehensive analysis tool for targeted and nontargeted GC/MS based metabolome analysis. Analytical Chemistry. 81 (9), 3429-3439 (2009).
- Fernandez, C. A., Des Rosiers, C., Previs, S. F., David, F., Brunengraber, H. Correction of 13C mass isotopomer distributions for natural stable isotope abundance. Journal of Mass Spectrometry. 31 (3), 255-262 (1996).
- Midani, F. S., Wynn, M. L., Schnell, S. The importance of accurately correcting for the natural abundance of stable isotopes. Analytical Biochemistry. 520, 27-43 (2017).
- Trefely, S., Ashwell, P., Snyder, N. W. FluxFix: automatic isotopologue normalization for metabolic tracer analysis. BMC Bioinformatics. 17 (1), 485(2016).
- Jeong, H., et al. Correcting for naturally occurring mass isotopologue abundances in stable-isotope tracing experiments with PolyMID. Metabolites. 11 (5), 310(2021).
- Millard, P., et al. IsoCor: isotope correction for high-resolution MS labeling experiments. Bioinformatics. 35 (21), 4484-4487 (2019).
- Brunengraber, D. Z., et al. Influence of diet on the modeling of adipose tissue triglycerides during growth. American Journal of Physiology. Endocrinology and Metabolsim. 285 (4), E917-E925 (2003).
- Svensson, R. U., et al. Inhibition of acetyl-CoA carboxylase suppresses fatty acid synthesis and tumor growth of non-small-cell lung cancer in preclinical models. Nature Medicine. 22 (10), 1108-1119 (2016).
- Hellerstein, M. K., Neese, R. A. Mass isotopomer distribution analysis: a technique for measuring biosynthesis and turnover of polymers. The American Journal of Physiology. 263 (5 Pt 1), E988-E1001 (1992).
- Hellerstein, M. K., Neese, R. A. Mass isotopomer distribution analysis at eight years: theoretical, analytic, and experimental considerations. The American Journal of Physiology. 276 (6), E1146-E1170 (1999).
- Kelleher, J. K., Masterson, T. M. Model equations for condensation biosynthesis using stable isotopes and radioisotopes. The American Journal of Physiology. 262 (1 Pt 1), E118-E125 (1992).
- Kelleher, J. K., Nickol, G. B. Isotopomer spectral analysis: utilizing nonlinear models in isotopic flux studies. Methods in Enzymology. 561, 303-330 (2015).
- Argus, J. P., et al. Development and application of FASA, a model for quantifying fatty acid metabolism using stable isotope labeling. Cell Reports. 25 (10), 2919.e8-2934.e8 (2018).
- Guilherme, A., et al. Control of adipocyte thermogenesis and lipogenesis through β3-adrenergic and thyroid hormone signal integration. Cell Reports. 31 (5), 107598(2020).
- Guilherme, A., et al. Neuronal modulation of brown adipose activity through perturbation of white adipocyte lipogenesis. Molecular Metabolism. 16, 116-125 (2018).
- Guilherme, A., et al. Adipocyte lipid synthesis coupled to neuronal control of thermogenic programming. Molecular Metabolism. 6 (8), 781-796 (2017).
- Lodhi, I. J., et al. Inhibiting adipose tissue lipogenesis reprograms thermogenesis and PPARgamma activation to decrease diet-induced obesity. Cell Metabolism. 16 (2), 189-201 (2012).
- McCormack, J. G., Denton, R. M. Evidence that fatty acid synthesis in the interscapular brown adipose tissue of cold-adapted rats is increased in vivo by insulin by mechanisms involving parallel activation of pyruvate dehydrogenase and acetyl-coenzyme A carboxylase. The Biochemistry Journal. 166 (3), 627-630 (1977).
- Trayhurn, P. Fatty acid synthesis in vivo in brown adipose tissue, liver and white adipose tissue of the cold-acclimated rat. FEBS Letters. 104 (1), 13-16 (1979).
- Negron, S. G., Ercan-Sencicek, A. G., Freed, J., Walters, M., Lin, Z. Both proliferation and lipogenesis of brown adipocytes contribute to postnatal brown adipose tissue growth in mice. Science Reports. 10 (1), 20335(2020).
- Schlein, C., et al. Endogenous fatty acid synthesis drives brown adipose tissue involution. Cell Reports. 34 (2), 108624(2021).
- Mottillo, E. P., et al. Coupling of lipolysis and de novo lipogenesis in brown, beige, and white adipose tissues during chronic beta3-adrenergic receptor activation. Journal of Lipid Research. 55 (11), 2276-2286 (2014).
- Adlanmerini, M., et al. Circadian lipid synthesis in brown fat maintains murine body temperature during chronic cold. Proceedings of the National Academy of Sciences. 116 (37), 18691-18699 (2019).
- Yu, X. X., Lewin, D. A., Forrest, W., Adams, S. H. Cold elicits the simultaneous induction of fatty acid synthesis and beta-oxidation in murine brown adipose tissue: prediction from differential gene expression and confirmation in vivo. FASEB Journal. 16 (2), 155-168 (2002).
- Kushner, D. J., Baker, A., Dunstall, T. G. Pharmacological uses and perspectives of heavy water and deuterated compounds. Canadian Journal of Physiology and Pharmacology. 77 (2), 79-88 (1999).
- Diraison, F., Pachiaudi, C., Beylot, M. Measuring lipogenesis and cholesterol synthesis in humans with deuterated water: use of simple gas chromatographic/mass spectrometric techniques. Journal of Mass Spectrometry. 32 (1), 81-86 (1997).
- Yang, D., et al. Assay of low deuterium enrichment of water by isotopic exchange with [U-13C3]acetone and gas chromatography-mass spectrometry. Analytical Biochemistry. 258 (2), 315-321 (1998).
- Fu, X., et al. Measurement of lipogenic flux by deuterium resolved mass spectrometry. Nature Communications. 12 (1), 3756(2021).
- Shah, V., Herath, K., Previs, S. F., Hubbard, B. K., Roddy, T. P. Headspace analyses of acetone: a rapid method for measuring the 2H-labeling of water. Analytical Biochemistry. 404 (2), 235-237 (2010).
- Argus, J. P., Yu, A. K., Wang, E. S., Williams, K. J., Bensinger, S. J. An optimized method for measuring fatty acids and cholesterol in stable isotope-labeled cells. Journal of Lipid Research. 58 (2), 460-468 (2017).
- Belew, G. D., Jones, J. G. De novo lipogenesis in non-alcoholic fatty liver disease: Quantification with stable isotope tracers. European Journal of Clinical Investigation. 52 (3), e13733(2022).
- Zhang, Z., Chen, L., Liu, L., Su, X., Rabinowitz, J. D. Chemical basis for deuterium labeling of fat and NADPH. Journal of the American Chemical Society. 139 (41), 14368-14371 (2017).
- Belew, G. D., et al. Transfer of glucose hydrogens via acetyl-CoA, malonyl-CoA, and NADPH to fatty acids during de novo lipogenesis. Journal of Lipid Research. 60 (12), 2050-2056 (2019).
- Diraison, F., Pachiaudi, C., Beylot, M. In vivo measurement of plasma cholesterol and fatty acid synthesis with deuterated water: determination of the average number of deuterium atoms incorporated. Metabolism. 45 (7), 817-821 (1996).
- Ajie, H. O., et al. In vivo study of the biosynthesis of long-chain fatty acids using deuterated water. The American Journal of Physiology. 269 (2 Pt 1), E247-E252 (1995).
- Schloerb, P. R., Friis-Hansen, B. J., Edelman, I. S., Solomon, A. K., Moore, F. D. The measurement of total body water in the human subject by deuterium oxide dilution; with a consideration of the dynamics of deuterium distribution. The Journal of Clinical Investigation. 29 (10), 1296-1310 (1950).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados