Method Article
酸化重水素を用いた褐色脂肪組織における de novo 脂肪酸合成の定量的測定(英語)
* これらの著者は同等に貢献しました
要約
ここでは、in vivoで褐色脂肪組織における全脂肪酸de novo脂肪生成を分析するために、酸化重水素とガスクロマトグラフィー質量分析(GCMS)を利用した安価な定量法を紹介します。
要約
脂肪酸合成は、全身代謝ホメオスタシスやその他の生理学的および病理学的プロセスの制御において重要な機能的役割を果たす、複雑でエネルギーを必要とする代謝経路です。グルコース処理などの他の主要な代謝経路とは対照的に、脂肪酸合成は日常的に機能的に評価されていないため、代謝状態の解釈が不完全です。さらに、この分野の新規参入者に適した公開されている詳細なプロトコルが不足しています。ここでは、in vivoでの褐色脂肪組織における全脂肪酸de novo合成の分析のために、酸化重水素とガスクロマトグラフィー質量分析(GCMS)を利用した安価な定量法について説明します。この方法は、炭素源とは無関係に脂肪酸合成酵素の生成物の合成を測定するものであり、事実上すべての組織、任意のマウスモデル、および外部摂動下で潜在的に有用です。GCMSのサンプル調製とダウンストリーム計算の詳細が記載されています。褐色脂肪は、高レベルのde novo脂肪酸合成と代謝恒常性の維持に重要な役割を果たすため、分析に焦点を当てています。
概要
肥満とそれに関連する代謝性疾患は、現在および将来の世代を危険にさらすパンデミックです1,2。肥満に関連する代謝調節不全は、エネルギー摂取量と消費の不均衡の結果として一般的に単純化されますが、環境因子および内因性因子によって制御される多数の代謝経路に影響を与えます3。しかし、代謝調節不全の動物モデルで日常的に検査されている経路はごくわずかです。
一例として、グルコース廃棄は、おそらくポータブルグルコースモニターの使用が簡単であるため、グルコースおよびインスリン負荷試験によって日常的に測定されます4。全身のグルコースと脂質の酸化相対速度も、間接熱量測定アッセイからの呼吸交換比に基づいて日常的に推定されます5,6。しかし、代謝の他のすべての側面の大部分は、日常的に機能的に評価されていません。.これにより、代謝状態の解釈が不完全になり、治療の選択肢が失われます。そのような主な経路の1つは、de novo脂肪形成です。
de novo脂肪生成(DNL)は、前駆体から新しい脂肪酸を生成するプロセスです。グルコースは全身DNLに寄与する主要な前駆体であると考えられています7が、酢酸、果糖、乳酸、分岐鎖アミノ酸などの他の前駆体は、空間的および条件依存的に関連する炭素源であることが示されています8,9,10,11,12。DNLは代謝ホメオスタシスに大きく貢献し、正常な発達に不可欠です13。さらに、DNLの変化は、癌14,15および代謝16,17,18および心血管疾患19,20に関連しています。
DNL経路は、コア酵素成分であるATPクエン酸リアーゼ(ACLY)、アセチルCoAカルボキシラーゼ(ACC1/2)、および脂肪酸合成酵素(FAS)で構成されており、主に炭素数16の飽和脂肪酸であるパルミチン酸を生成します。しかし、奇数鎖脂肪酸や分岐鎖脂肪酸もより低い速度で生産することができる9。伸長酵素と脱酸酵素は、これらの脂肪酸をさらに修飾し、さまざまな機能(例えば、長期のエネルギー貯蔵や膜流動性の操作)に有用な多様な脂肪酸種を作り出します。
DNL酵素機構の発現は、少数の転写因子によって制御されています。これまでに最もよく報告されたのは、ステロール調節要素結合タンパク質(SREBP)ファミリー、炭水化物応答要素結合タンパク質(ChREBP)、および肝臓X受容体(LXR)21,22,23,24,25,26です。それらの機能は明らかに重複しているにもかかわらず、細胞型の優勢と生理学的または病理学的状態に基づく個々の調節が報告されています21,22,27,28。
驚くべきことに、DNL経路の選択されたステップに対する多くの阻害剤は、肥満、非アルコール性脂肪性肝疾患/非アルコール性脂肪性肝炎(NAFLD/NASH)、および心血管疾患を含む多くの疾患に対して臨床使用が承認されているか、前臨床または臨床開発段階にあります29。これらの取り組みは、健康と病気におけるDNLの関連性を強調しています。
近年、de novo脂肪酸合成を定量的に評価する方法の採用が増加しています30。これを評価するための最も一般的な方法は、重標識水(D2O)の使用であり、重標識水素は、DNL基質NAPDH、アセチルCoA、およびマロニルCoAの水素との重水素交換を介して、合成中に直接的および間接的にアシル鎖に取り込まれます。このアプローチは人気が高まっていますが、この分野の新規参入者に適した公開されている詳細なプロトコルが不足しています。ここでは、Lee et al.31 によって以前に開発された計算を使用して、D2O およびガスクロマトグラフィー質量分析法 (GCMS) を使用して、FAS の生成物の de novo 合成を定量的に評価する方法を概説します。この方法は、炭素源とは無関係にde novo脂肪酸合成を測定するため、ほぼすべての組織、あらゆるマウスモデル、および外部摂動下で役立つ可能性があります。ここでは、DNLのレベルが高く、代謝恒常性の維持に重要な役割を果たす褐色脂肪組織(BAT)の分析に焦点を当てています。
プロトコル
すべての実験は、シンシナティ小児病院医療センターの動物管理および使用委員会によって承認されました。
1. D2Oの調製
注:実験のばらつきを避けるために、実験期間中、すべてのマウスに十分な溶液/飲料水を準備してください。
- 腹腔内注射の場合:D 2 Oのリットルあたり9 gのNaClを溶解することにより、0.9%w / v生理食塩水D 2 Oを生成し、非発熱性0.2μmフィルターでろ過して滅菌します。
- 飲用D2O水の場合:通常の飲料水920mLあたり80mLのD2Oを混合することにより、飲料水として使用する8%v/vD2O濃縮水を生成します。通常の飲料水はマウス施設から入手できます。非発熱性0.2μmフィルターでろ過して滅菌します。
2. 温度順応によるBAT活性の調節
- 温度順応開始の2週間前にケージごとに2匹のマウスがいるようにマウスを分離します。マウスがすべてのケージに適応できるように給水をウォーターボトルに変更し、22°Cに維持します。
- 温度順応を開始する1週間前に、適切な温度(熱中性の場合は30°C、室温の場合は22°C、低温暴露の場合は18°C)を設定して、マウスの環境チャンバーを準備します。
- 温度順応の開始時に、ケージを環境エンリッチメントのない新しいものと交換します(巣を避けるため)。ケージをそれぞれの温度に移動します。
注:熱中性に割り当てられたケージは、30°Cで4週間滞在します。室温に割り当てられたケージは、22°Cで4週間滞在します。低温曝露に割り当てられたケージは、1週目は18°C、2週目は14°C、3週目は10°C、4週目は6°Cと、週単位で徐々に寒くなります。 - 汚れたケージは、すべての条件で毎週交換してください。さらに、食品と水のボトルを、適切な温度で少なくとも24時間事前に調整された新しいボトルと交換します。
注:特に寒いネズミの場合、通常の状態に比べてかなり多くの量の餌を消費するため、毎週追加される餌の量に注意してください。食べ物を 自由に提供します。
3. D2Oの投与
- 組織採取の12時間〜3日前に、1 mLのシリンジと26 Gの針を使用して腹腔内注射を行い、各動物に0.9%w / v生理食塩水-D2Oを35 μL / g体重で注射します。.
注:適切なラベリング時間の選択の詳細については、ディスカッションセクションを参照してください。 - ウォーターボトルを、8%v / v D2O濃縮飲料水を含むボトルに変更します。
4. 血漿および組織の収集、処理、および保存
- 実験の最後に、承認された方法論を使用してマウスを犠牲にします(例:二酸化炭素の過剰摂取とそれに続く子宮頸部脱臼)。
- 結果に影響を与える可能性のある安楽死の前の急激な温度変化を避けるために、加熱/冷却パッドまたはその他の方法を使用してください。承認された方法論に従ってマウスを安楽死させます。すぐに血液と組織の採取に進みます。
- 26Gの針を使用して心臓穿刺で血液を採取し、エチレンジアミン四酢酸採血管に保管します。さらに処理するまで、血液を氷上に保管してください。
- 胸腔の下部から首の上部まで、マウスの背中の中央線に沿って皮膚を切り開き、皮膚の下の組織に影響を与えないように皮膚を引き上げます。肩甲骨間BATは、白い脂肪組織の薄い層の下の肩甲骨の間にあり、2つのピラミッド型の葉で構成されています。
- 氷冷したリン酸緩衝生理食塩水(PBS)で洗浄して組織を洗浄します。ペーパータオルを軽くたたいて余分な液体を取り除き、分析スケールで計量し、マイクロチューブに集めます。
- 直ちに液体窒素を使用して組織を瞬間凍結します。他のBATデポも収集できます。
- 血液サンプルを10,000 x g で4°Cで10分間遠心分離します。 遠心分離後、赤血球ペレットを乱すことなく血漿を慎重に回収します。それを新しい氷冷マイクロチューブに移し、液体窒素で瞬間凍結します。
- 褐色脂肪および血漿サンプルは、使用するまで-80°Cで保管してください。
5. 脂肪組織からの脂質抽出
- 抽出を開始する前に
- ガラスバイアルにメタノール中のヘキサデセン酸-d31 1 mM溶液を調製します。これは、内部脂肪酸の標準として機能します。
- 必要量のクロロホルム(CHCl 3)とメタノール(CH3OH)を-80°Cの冷凍庫またはドライアイスで予冷します。
注:酸化防止剤ジ-tert-ブチル-4-メチルフェノール(BHT)は、不飽和脂肪酸の二重結合の酸化を防ぐために、0.01%w / v(2.5 mg / 25 mL)の濃度でCHCl3 に添加できます。 - 各組織サンプル用の微量遠心チューブと、ブランク抽出に使用する追加のチューブを事前にラベル付けします。
注意:CH3OHおよびCHCl3 は、吸入すると揮発性が高く、有毒です。ドラフトでのみ使用してください。
注:微量遠心チューブのブランドが異なれば、溶媒漏れを防ぐという点で、バックグラウンドパルミチン酸のレベルと機能も異なります。溶媒の漏れを防ぎ、チューブの汚染パルミチン酸のレベルが最小限に抑えられていることを確認するために、最初にさまざまなチューブをテストすることをお勧めします。さらなる議論については、Yao et al.32 を参照してください。
- サンプルを冷凍庫から取り出し、ドライアイスの上に置きます。
- 事前にラベル付けされた微量遠心チューブを分析天びんの上に置き、天びんを風袋引きします。ピンセットとメス/スチールカミソリの刃をドライアイスの上に10〜20秒間置き、冷まします。
- ピンセットを使用して凍結組織サンプルをチューブから取り出し、プラスチック製の計量ボートに置きます。計量ボートは、ドライアイスの平らなブロックまたは別の予冷された表面に置くことができます。
- メスまたは鋼のかみそりの刃を使用して、重量5〜15mgに相当する組織のごく一部を解剖します。微量遠心チューブに入れ、正確な重量を記録します。各試験片について繰り返します。サンプルは、この時点で冷凍庫に保存するか、脂質抽出のために以下のステップに進めることができます。
注意: メスがサンプル間で70%エタノールで適切に洗浄され、各サンプル間で新しい計量ボートが使用されていることを確認してください。
- 各サンプルに10 mM hexadecenoic-d 31(C16:0-d31)酸 1 μL/mg を添加します。
注意: 次の手順(5.4〜5.8)は、溶剤を吸入する危険性があるため、ドラフト内で実行する必要があります。 - 250μLのCH3OH、250 μLのH2O、および500 μLのCHCl 3を、3 つの5 mmステンレス鋼ビーズで各サンプルに加えます。チューブを粉砕機の予冷ブロックに入れ、25Hzの振動周波数でサンプルを5分間混合するか、組織サンプルについてメーカーが推奨するガイドラインを使用します。マグネットを使ってビーズを取り除きます。
- サンプルを12,000 x g で4°Cで10分間遠心分離します。
注:遠心分離後、極性代謝物を含む上部水相と脂質および脂肪酸を含む下部有機相で、明確な二相分離が観察されるはずです。分離が見られない場合は、250μLのH2Oを添加し、ボルテックスおよび遠心分離のステップを繰り返す。 - マイクロピペットを使用して、各サンプルの底相から一定量の微量を、対応するラベルの付いた微量遠心チューブに入れます。
- 残りのサンプルに500 μLのCHCl3 を加え、ステップ5.6〜5.7を繰り返します。
- サンプルを窒素ガス下に置くか、CHCl3耐性の冷蔵遠心真空に4°Cで完全に乾くまで置きます。乾燥したサンプルは、誘導体化の準備が整うまで-20°Cで保存できます。
注:極性代謝物を分析するために、各サンプルの最上層をこの時点で収集し、ステップ5.9のように乾燥させることもできます。
6. 脂肪酸メチルエステル(FAME)の調製とGCMS分析
- FAMEを調製するための酸触媒によるエステル化およびエステル交換反応
注意: 次の手順は、溶剤を吸入する危険性があるため、ドラフトの下で実行する必要があります。- サンプルを冷凍庫に保管している場合は、窒素下で5分間乾燥させて、水が存在しないことを確認します。
- MS グレードの溶媒を使用して、98 mL の無水 CH3OH をガラス培地ボトルにピペットで移します。ドラフトに2mLの無水硫酸をゆっくりと加えて、CH3OHで2%H2SO4を作ります。閉じたボトルをくるくる回して混ぜます。
- CH3OH溶液中の2%H2SO4 500 μLを各サンプルに加え、短時間ボルテックスします。
- サンプルをヒートブロック上で50°Cで2時間インキュベートします。
- ヒートブロックからサンプルを取り出し、各サンプルに100 μLの飽和NaCl溶液と500 μLのヘキサンを加えます。
- サンプルを室温で1分間激しくボルテックスします。サンプルを1分間放置します。この後、2つのフェーズが明らかになるはずです。
- 上相を新しい微量遠心チューブに集めます(微量遠心チューブの適切な選択については、セクション5.1.3の注を参照してください)。
- 収率を最大化するには、手順6.1.5〜6.1.7を繰り返して、2番目のサンプルを同じラベル付きチューブに収集します。
- サンプルを窒素ガス下で室温で乾燥させます。
- サンプルを元の組織重量に対して 20 μL/mg のヘキサンに再懸濁し、ガラスインサートを使用してガラス製 GC バイアルに直ちに移します。
注:蒸発を最小限に抑えるために、サンプルを移送する際に迅速に作業します。
- GCMS分析
- FAME 同位体の存在量を測定するには、単一の四重極ガスクロマトグラフィー質量分析計(GCMS)にサンプルを注入します。
注:パルミチン酸の検出には多くのカラムタイプを使用できますが、 材料表に詳述されているように、脂肪酸シス/トランス異性体の分離用に開発されたGCMSカラムでは、以下の温度プログラムが確立されています。このカラムの長さは50m、内径は0.25mmです。 - ヘリウムをキャリアガスとして、1 mL/分で流す、270°Cのインレット温度でスプリット/スプリットレスインレットに1 μLのサンプルを注入します。低存在量の脂肪酸には、総流量 19 mL/分、セプタムパージ 3 mL/分、パージフロー 15 mL/分(0.75 分)のスプリットレス注入を使用します。パルミチン酸やオレイン酸などの高脂肪酸には、10:1〜40:1の分割比を使用します。
- 次のオーブンパラメータを使用します:80°Cの初期温度。170°Cまで20°C/分刻みで増加します。204°Cまで1°C/分刻みで増加します。250°Cまで20°C/分刻みで増加します。その後、250°Cで10分間保持します。
- 質量選択検出器(MSD)パラメータは、電子衝突イオン化モードを70 eV、スキャン速度1,562(u/s)、周波数4.1スキャン/秒で50-400 m/zの範囲でスキャンします。トランスファーラインは280°C、イオン源は230°C、四重極は150°Cで使用します。
注:他のカラムを使用することもできますが、温度プログラムは異なります。 - サンプルシーケンス:注入のサンプル順序をランダム化し、シーケンス内の 5 サンプルごとに、シーケンスの最初に少なくとも 2 つまたは 3 つのヘキサンブランクを注入し、シーケンスの最後に 2 つまたは 3 つを注入します。
- 装置固有のソフトウェア、またはMetabolite-Detector33などの無料のオープンアクセスソフトウェアを使用して、各脂肪酸メチルエステルについて 表1 のイオンを積分します。
注: 表 1 に M1-M5 同位体をカバーするイオンの概要を示しており、このラベリングウィンドウで重水素の取り込み量をカバーしていることがわかりました。ただし、 de novo フラックスが著しく高い場合や、より長い標識時間が使用される場合は、これを拡張する必要があるかもしれません。 - 各積分イオンの存在量を使用して質量同位体分布を生成し、イオン強度を分数存在量に変換して、質量同位体分布の合計が 1 になるようにします。 補足ファイルのスプレッドシートの例を参照してください。
注:重水素の取り込みを正確に決定するには、天然同位体の存在量を補正して、13C、15N、2Hなどの天然に存在する同位体の存在を可能にする必要があります。これは、Fernandez et al.34,35 によって概説されているように補正マトリックスを適用することによって実行され、標識代謝物から標識されていない測定代謝物の MID を差し引くことによって実行することはできません。実際には、fluxfix 36、polyMID37、IsoCor38 などの無料で入手できるソフトウェアを使用して、生データを分別 MID に変換することを推奨しており、FAS のメチルエステル生成物の同位体補正の式を表 1 に示しました。 - 存在するパルミチン酸の量を決定するには、次の式を利用します。

ここで、イオンカウントは表 1 に示したすべてのパルミチン酸同位体の合計を示し、C16:0-d 31 は内部標準ヘキサデセン酸-d31 を示す。内部標準は、内因性パルミチン酸のピークとは別のピークを形成します。他の脂肪酸の相対存在量も決定できますが、脂肪酸特異的同位体内部標準(D2Oの取り込みから観察されるものよりも大きい質量シフトを有する)または外部標準曲線を完全な定量のために採用する必要がある場合があります。ブランク抽出サンプルを使用してバックグラウンドパルミチン酸の量を決定し、これを最終的な組織値から差し引きます。 - パルミチン酸のモル濃縮度(ME)は、次の式で計算します。

ここで、Mi はパルミチン酸同位体の正規化された分数存在量であり、nは可能なパルミチン酸同位体の数である。例えば、分数分布がM1 = 0.25、M2 = 0.08、M3 = 0.02のパルミチン酸分子のMEは、(0.025*1)+(0.08*2)+(0.02*3)=0.245となります( 補足ファイル参照)。
- FAME 同位体の存在量を測定するには、単一の四重極ガスクロマトグラフィー質量分析計(GCMS)にサンプルを注入します。
7.体内水分濃縮を決定するための血漿サンプルの重水素アセトン交換
- 反応
- 0〜9%v / vの範囲の水中重水素の10の基準を準備します。
- ステップ 5.1.1 の標準試料を含め、サンプルあたり 4 μL になるように 5% v/v アセトン/アセトニトリル溶液を調製します。
- 標識されたセーフロック微量遠心チューブに、各血漿サンプルまたは標準液10 μL、10 M NaOH4 μL、5%アセトン/アセトニトリル4 μLを混ぜ合わせます。これをサンプルごとに 3 回に分けて実行します。
- ピペッティングでサンプルを穏やかに混合します。サンプルを室温で一晩インキュベートします。
- 抽出
- インキュベーション後、各サンプルに450〜550mgのNa2SO4 を添加する。
- ドラフト内で、600 μL の CHCl3 を各チューブに加え、15 秒間激しくボルテックスします。
- サンプルを 300 x g で 2 分間遠心分離します。
- ドラフト内で、各サンプルの上清の 80 μL アリコートを 3 回、ガラスインサートとキャップ付きの標識付きガラス製 GCMS バイアルに移します。
- GCMS分析
- カラム(内径 30 m、内径 0.25 mm、Agilent DB-35MS)でサンプルを分離し、付属の質量分析計で分析します。
- スプリット/スプリットレスインレットに、スプリット比 40:1、ヘリウム流量 1 mL/分、インレット温度 270 °C のサンプル 1 μL を注入します。
- オーブンのパラメータは、初期温度を60°Cとし、100°Cまで20°C/分刻みで昇温し、220°Cまで50°C/分刻みで昇温し、220°Cで1分間保持します。
- 質量選択検出器(MSD)パラメータは、70 eV の電子衝撃イオン化モード、58 m/z および 59 m/z の選択イオンモニタリングを使用します。トランスファーラインは280°C、イオン源は230°C、四重極は150°Cで使用します。
注:他の低ブリード、結合、架橋、中極性のカラムを使用できますが、温度プログラムは異なります。
- 液体サンプラー法を CHCl 3 洗浄で開始し、次に 6 サンプルごとに追加の CHCl3 洗浄ステップを含むサンプルのランダム化されたシーケンスを設定します。
注:アセトンをオートサンプラーのニードル洗浄として使用する場合は、CHCl 3 またはヘキサンと交換し、クロマトグラムに汚染されたアセトンピークが明らかでなくなるまで、複数のブランク CHCl3 サンプルを注入します。 - この分析法では、アセトンピークは約 1.25 分で溶出します。 表 1 に示すように、ステップ 6.2.6-6.2.7 に従ってデータを統合し、アセトン濃縮の分画存在量を計算し、m/z 比が 58-60 のピークを分析するように調整します。
- 標準試料を使用して検量線を生成し、アセトンの分別濃縮に基づいて、試験サンプルの体水分濃縮(p)の割合を決定します。
- カラム(内径 30 m、内径 0.25 mm、Agilent DB-35MS)でサンプルを分離し、付属の質量分析計で分析します。
8. in vivo de novo 脂肪生成計算
- 各検体中のFASの直接生成物である新規合成脂肪酸(FNS)の割合(パルミチン酸、奇数鎖脂肪酸、mmBCFAなど)を、次の式で計算します。
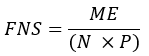
ここで、MEはパルミチン酸分子の平均モル濃縮度(ステップ6.2.9)、pは対応する血漿サンプルからの水中の重水素濃縮度(ステップ7.3.4)、Nは重水素を取り込むことができるパルミチン酸上の交換可能な水素原子の数です。 - Lee et al.31 によって確立された以下の式を使用して N を決定します。
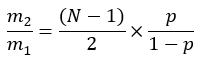
- 新しく合成された脂肪酸(MNS)のモル量は、次の方法で決定します。
MNS = FNS x 総脂肪酸量 (nmol/mg 組織)。
注:例えば、パルミチン酸モル濃縮度(ME)が0.245、体内水中の重水素濃縮度(p)が0.045、計算されたN数が22の場合、パルミチン酸の分別合成は0.247です。組織中に存在するパルミチン酸の量が2 mmol / mgの場合、新しく合成されたパルミチン酸のmmolは0.494 mmol / mgです( 補足ファイルを参照)。
結果
ステップ1で説明したD2O投与量に基づいて、我々は典型的に、体内水分が2.5%から6%の範囲で濃縮され、体内水分中の重水素濃縮のベースラインレベルが1時間で急速に達成され、8%濃縮飲料水 を介して 研究期間中維持されることを見出す(図1)。継続的な定常状態の体内水分濃縮は、ステップ 6 で使用される計算の仮定であるため、新しい実験モデルで体内水分濃縮の動態を実験的に検証することをお勧めします。
BATでは、 de novo で合成された脂肪酸の量が、熱中性脂肪酸に比べて室温で増加することを発見しました(図2)。D2O投与の3日後の熱中性および室温でのマウスのBAT中のパルミチン酸の質量同位体分布は、室温でより高いM1およびM2重水素濃縮を示しています(図2A)。この低温濃縮は、パルミチン酸だけでなく、BAT中の幅広い脂肪酸でも起こります(図2B)。また、室温ではマウスのBATでは総パルミチン酸存在量が増加しており、分別合成速度と総パルミチン酸レベルを組み合わせると、室温でマウスの総パルミチン酸合成が増加することがわかりました(図2C、D)。注目すべきは、血漿中の全脂肪酸濃縮はBATと同じ傾向をたどらず、代わりに脂肪酸濃縮が熱中性とともに増加することです(図2E)。内因性合成からの潜在的な取り込みをデコンボリューションすることは、ここで説明するように、D2O単一時点アプローチでは不可能ですが、これらの相反する傾向は、BATの脂肪酸濃縮パターンが脂肪酸の取り込みによって駆動されていないことを示しています。

図1:0.035 ml / g体重0.9%NaCl D 2 Oを注射し、飲料水を8%D2O濃縮水に置き換えた後の、複数の時点でのマウスの血漿中のD2O濃縮の割合。棒グラフは平均± SD を表します。 n = 9。この図の拡大版をご覧になるには、ここをクリックしてください。

図2:D2O投与3日後のマウスの褐色脂肪組織の代表的な結果。 (A)室温(RT)および熱中性(TN)でのD2O投与の3日間の後のBAT中のパルミチン酸の質量同位体分布。(b)室温および熱中性でD2Oを3日間投与した後の一連の脂肪酸のBATモル濃縮。(c)室温および熱中性でD2O投与の3日後の褐色脂肪組織中の総存在量および(D)de novo合成パルミチン酸。(e)室温および熱中性で3日間のD2O投与後の一連の脂肪酸の血漿モル濃縮。棒グラフは平均± SD を表します。 *p < 0.05、**p < 0.01、***p < 0.001。n = 6 です。統計分析は、両側スチューデントのt検定によって決定されました。この図の拡大版をご覧になるには、ここをクリックしてください。
| 化合物 | イオン | 溶出時間の目安(分) | 同位体補正の式 |
| C16:0 | 270-275 | 20 | 広17H34O2 |
| C14:0 | 242-247 | 16.5 | 広15H30O2 |
| C15:0 | 256-261 | 18 | C16H32O2 |
| ISO-C16:0認証取得 | 270-275 | 18.9 | 広17H34O2 |
| ISO-C17:0認証取得 | 284-289 | 21 | 広18H36O2 |
| アンテイソ-C17:0 | 284-289 | 21.5 | 広18H36O2 |
| C16のD31 | 301 | 19.2 | ~ |
| アセトン | 58-59 | 1.5 | 広3H6O |
表 1:積分する GCMS 化合物フラグメントイオン。 この表は、哺乳類の脂肪酸合成酵素によって産生されるさまざまな脂肪酸をカバーしていますが、C16:0が主な生成物です。保持時間はすべてステップ 6 で詳述した GCMS 分析法の場合ですが、ステップ 7 で詳述したアセトンは除きます。
補足ファイル: スプレッドシートの計算例。このファイルをダウンロードするには、ここをクリックしてください。
ディスカッション
複雑な代謝経路間のバランスと相互作用を理解することは、代謝関連疾患の生物学的基盤を理解する上で不可欠なステップです。ここでは、de novo脂肪酸合成の変化を決定するための非侵襲的で安価な方法論を示します。この方法は、脂肪酸重水素濃縮31からのde novo合成フラックスを推定し、体内水中のD2Oの相対的な割合を決定するために重水素−アセトン交換を使用するための計算を開発した以前に発表された方法39から適応されている。近年、我々はここで説明した方法を採用し、それを応用して、脂肪貯蔵所、脳、肝臓、および腫瘍における多様な脂肪酸の合成の変化を明らかにしました9,22,40。このプロトコルには、いくつかの重要なステップと変更可能な側面があります。これらは、全体的な実験計画、およびこの方法で使用される分析アプローチと計算に関連しています。安定同位体トレーサーからde novo脂肪酸合成を計算するための代替アプローチも広く利用されています。これらには、Hellersteinらによって開発された代替質量同位体分布分析(MIDA)アプローチ41,42、Kelleherらによって開発された同位体スペクトル分析(ISA)43,44、および脂肪酸源分析(FASA)などの長鎖脂肪酸の合成をモデル化するために開発された新しいアプローチが含まれます45.ここでの方法の利点は、無料で入手できるソフトウェアとスプレッドシートを使用して簡単に実装できることです。ただし、体水分濃縮(BWE)が定常状態にある必要があること、Nパラメータの利用に関連する注意点(以下で説明)、および主にパルミチン酸であるFASの直接生成物にのみ適用できることによって制限されます。
褐色脂肪のDNLと温度順応
DNLは、全身の代謝調節の主要な結節として急増しており、正常な発達に不可欠です13,29。組織標的欠失とメタボロミクス解析により、脂肪組織のDNLを制御するいくつかの重要な酵素および転写プレーヤー、および全身脂肪の付着と正常な代謝恒常性を制御する方法が特定されました21,28,46,47,48,49。あまり評価されていませんが、BATはDNLの非常に活性な組織であり、他のほとんどの組織よりもコアボディDNL酵素機構(acly、acaca、fasn)の発現が高く、脂肪生成活性が高い22,50,51,52,53,54,55 .しかし、BATは、中性以下の温度への順応がBAT 22,54,56においてDNLと脂肪酸の酸化活性を同時に誘導するという意味でユニークである。関連するメカニズムは完全には明らかではないが、BATは、通常のBAT活性に不可欠な脂質合成のためにDNLに送られるものを含む栄養素の代謝シンクであることが認められている53,55。そのため、BATのすべての代謝収入と結果を説明して、その活動レベルを評価できることが適切です。ただし、DNLは通常、遺伝子発現に基づいてのみ測定され、カウントされた機会に機能的に評価されます。ここで提案されているプロトコルは、DNLの機能評価を可能にし、代謝状態のより完全な解釈を可能にします。
D2Oの投与量、タイミング、および体内水分濃縮の測定
設計における主要な重要なステップの1つは、D2O投与の用量およびタイミングである。このプロトコルでは、用量と投与のアプローチを採用しています (ボーラス注射とそれに続く飲料水の濃縮)は、定常状態のBWEの迅速な達成と維持につながることがわかりました。脂肪酸合成を決定するために使用される計算は、定常状態BWEの仮定に基づいています。したがって、これが新しい実験モデルで検証されることが重要です。この複合投与アプローチの使用に問題があるために定常状態の濃縮が不可能な場合、読者は、計算の変更がこれを可能にする他の出版物を参照されます39。これを迅速に達成することを目的とした投与アプローチを採用する場合、許容できる定常状態からの変動の程度は、多くの要因に依存する。BWEが計算に使用した値を超えて持続的にスパイクで増加した場合、ここでのアプローチを使用すると、DNLが過大評価されます。BWEが持続時間の計算に使用される値よりも大幅に低い場合、DNLは過小評価されます。平均の周りのわずかな変動が予想されますが、最も重要な要因は、BWEが一方の実験グループで他の実験グループよりも大きく変化しないことであり、これはBWEの変動によって引き起こされる計算されたDNLの違いにつながる可能性があります。両方の実験グループが時間の経過とともにわずかではあるが類似した変動を示す場合、これの許容範囲は、研究者が測定を実行する必要がある精度と精度、および実験グループ間で予想される違いによって異なります。例えば、ここで例として挙げた、室温に対して熱中性に曝露された褐色脂肪組織の場合、存在する de novo 合成脂肪酸の量の差は50%を超え、したがって、BWEの小さな変動が結果を不明瞭にする可能性は低いです。
定常状態の考慮に加えて、このプロトコルの別の変更可能な側面は、BWEのレベルです。BWEの増加により、脂肪酸への標識転写が増加する可能性があるため、代謝回転率の低い脂肪酸プールは、より短時間でより簡単に検出できる可能性があります。これは、研究者がDNLの急性反応に関心がある状況で有利になる可能性があります。しかし、体内の水分中のD2Oレベルの上昇は、望ましくない生理学的影響を引き起こす可能性があるため、注意が必要です57。BWEレベルを達成するための低レベルのD2Oの投与は、典型的には0.5%前後であり、D2O投与に関連するコストのために、ヒト研究において一般的に採用されている。この場合、BWEおよび脂肪酸濃縮を定量するために、感度を高めた分析法が必要になることがあります。BWEの場合、これは、イオン比質量分析58または修正アセトン交換プロトコル59を介して達成され得る。脂肪酸分析では、高分解能GCMS装置を使用することで、脂肪酸中の重水素の測定感度が向上し、非常に短い時間および/または低いBWE60後のDNLの定量が可能になることが最近示されています。また、CHCl3で抽出して液体注入を行う代わりに、ステップ7.1.5で生成したアセトンのヘッドスペース分析を利用することにより、BWEを測定するスループットを向上させるために別の方法を使用することもできます。これにより、分析法の実行時間が短縮され、複数の転写ステップが回避されるため、サンプル調製時間が短縮されます。ヘッドスペースインジェクターへのアクセスが利用可能な場合は、この方法を強くお勧めします61。
定量化のための脂肪酸プールの選択と分析アプローチ
このプロトコルでは、方法は脂質のクラスにもかかわらずティッシュまたは血しょうの総脂肪酸のプールを、測定するように設計されている。ただし、脂質クラスは、FAME生成前に、薄層クロマトグラフィーや液体クロマトグラフィーなどの方法 によって 分離することができます。さらに、血清または血漿を分析する場合、超低密度リポタンパク質(VLDL)などの特定のリポタンパク質画分からの脂質は、超遠心分離 によって 単離されてもよい58。この方法は、VLDL中の de novo 産生脂肪酸の主要な供給源である可能性が高い肝臓のDNLを確認するために、ヒトで一般的に使用されています。脂質抽出および誘導体化プロトコルは、特定のクラス62の単離を強化するために修正することもできる。最後に、脂質水素の重水素濃縮は、質量分析ではなく 2時間NMR分光法を使用して測定することもできます。この方法はMSよりも感度が低いため、より多くの材料を必要とするが、その利点は、伸長率と非飽和率をよりよく推定するために使用できる位置濃縮情報が得られることである63。
計算
このプロトコルにおける計算は、定常状態BWE、脂肪酸濃縮、および脂肪酸上の交換可能な水素の数を考慮に入れた以前の計算に基づいている31。他の計算と同様に、このアプローチの結果を適用および解釈する際に考慮する必要がある多くの制限と仮定があります。主な考慮事項の 1 つは、メソッドのセクション 8 で N に使用される値です。脂肪酸合成中、D2Oからの2Hは、NADPH、アセチルCoA、およびマロニルCoA上の水素との交換を介して間接的にアシル鎖に取り込まれます64,65。以前の研究では、この交換は不完全であることが示されています31,66。したがって、計算には、この65を可能にするための補正係数(N)が組み込まれています。22のNは、ステップ6で概説した式を用いて、組織の範囲に適切であることが以前に発見されたため、多くの研究で一般的に使用される31,66。しかしながら、これは、実験的摂動および動物モデル65に基づいて変化し得る。したがって、調査員にはこれを考慮に入れることを強くお勧めします。Nが低いほど総合成フラックスが増加するため、研究やラボ間で測定値を比較する際には、このパラメータに用いる値を考慮する必要があります。ここで用いるアプローチの限界は、奇数鎖脂肪酸とモノメチル分岐鎖脂肪酸の量がはるかに少ない、主にパルミチン酸であるFASの直接生成物の分析にのみ関連していることです9。すべての脂肪酸の重水素濃縮を検出することができるが、ここで用いる式は、標識されていない脂肪酸の取り込みとこれらの67の伸長を許容しないため、C18:0などの長鎖脂肪酸の合成を決定するのには適していない。同様に、非飽和率も過小評価されている可能性があります。
一般的な制限事項
脂肪酸の測定のためのD2Oの使用は、生理学的恒常性におけるDNLの重要性に関する重要な洞察を生み出したが、この方法論に関連する多くの制限がある。第一に、ここで概説したタイミングに基づいて、新たに合成された脂肪酸の起源組織を完全に確信することは不可能です。ある組織がDNLから脂肪酸を生成し、それが他の組織に運ばれるというシナリオは容易に想像できます。D2O処理後の微細な経時的実験は、新たに合成された脂肪酸の起源組織の分離能を高め、組織間の汚染を減少させる可能性がある。代表的な結果に利用された3日間の時点は、熱中性度(フラックスが低い場合)と室温の両方で、さまざまな脂肪酸の重水素濃縮を検出するように設計されました。パルミチン酸が主要な標的であるD2O投与後のより短い時間点は、組織間脂肪酸輸送を最小化するので、有利であり得る。はるかに短い時間点(例えば、12時間)は、低温条件でマウスを検討する場合や、熱中性が実験計画に含まれていない場合に理想的です。第二に、この方法では、新しい脂肪酸の起源基質に関する情報が得られません。特定の状況で使用される特定の基質を特定することは、DNLの規制マップを完全に理解するために必要な追加の情報層となり得る。これは、安定同位体で標識された基質で行うことができます。
利点
この方法論の特定の利点は、動物が拘束されず(D2Oの最初の注射を除く)、処置中に意識があり、望ましい歩行および必要に応じて特定の食事治療を可能にする摂餌パターンおよび量を含む、動物が自然に行動するための低ストレス環境を促進することである。D2Oはまた、投与が著しく容易である。他のトレーサーの液体溶液(例えば、 13C-U-グルコース)とは対照的に、D2Oは、水の消費に影響を与える可能性のある明確な嗜好性の特徴を有しない。安定同位体トレーサーの他に、最も一般的に使用される方法は放射性同位元素です。放射性同位元素の潜在的な利点は、検出のための機器の選択です。安定同位体には質量分析計が必要ですが、放射性同位体はシンチレーションカウンターを使用して検出できます。しかし、放射性同位元素には、安全性や倫理的な問題から多くのデメリットがあります。さらに、放射性同位元素は一般にグルコース上にあるため、DNLの変化だけでなく、グルコース由来のDNLの変化も反映しています。さらに、個々の脂肪酸の合成の決定は不可能である。D2Oは、同位体標識を有する特定の基質と比較して、すべての組織にわたってより迅速に平衡化する68。
DNLは、代謝ホメオスタシスの重要な要素であり、それぞれが独立して発達、代謝、および病態に影響を与える多くの酵素と転写因子によって制御されています。したがって、DNLは主要な代謝経路であるに違いなく、研究や治療法開発においてより広く調査する必要があります。このプロトコルは、DNL分析を代謝表現型に日常的に組み込むための第一歩として使用できます。
開示事項
著者は開示するものは何もありません。
謝辞
貴重な議論をしてくれたSanchez-Gurmacches氏とWallace氏の研究室メンバーに感謝します。この研究は、米国心臓協会(18CDA34080527 から JSG に、19POST34380545 から RM に)、NIH (R21OD031907 JSG )、CCHMC Trustee Award、CCHMC Center for Pediatric Genomics Award、CCHMC Center for Mendelian Genomics & Therapeutics Award からの助成金によって支援されました。この研究は、シンシナティの消化器疾患研究コアセンターのNIH P30 DK078392によって部分的に支援されました。内容は著者の責任であり、必ずしも米国国立衛生研究所の公式見解を表すものではありません。RTとMWは、UCD Ad Astra Fellowshipの支援を受けました。
資料
| Name | Company | Catalog Number | Comments |
| 4 mL Glass Vials | Fisher Scientific | 14-955-334 | |
| 0.2 µm filter | Olympus Plastic | 25-244 | |
| 26G needeled syringes | BD | 309597 | |
| Acetone | Merck | 34850 | |
| Acetonitrile | Merck | 900667 | |
| Blue GC screw cap with septa | Agilent | 5190-1599 | |
| Centrifuge | Eppendorf | 5424R | |
| Chloroform | Sigma | 366927 | |
| Deuterium oxide | Sigma | 151882 | |
| Di-tert-butyl-4-methylphenol (BHT) Select FAME Column | Merck | B1378 | |
| Di-tert-butyl-4-methylphenol (BHT) Select FAME Column | Agilent | CP7419 | |
| EDTA tube | Sarstedt | 411395105 | |
| Ethanol | Merck | 51976 | |
| Hexadecenoic-d31 Acid | Larodan | 71-1631 | |
| Hexane | Merck | 34859 | |
| Methanol | Merck | 34860 | |
| Microcentrifuge tube | Olympus Plastic | 24-282 | |
| Mouse environmental chamber | Caron | Caron 7001-33 | |
| Potasium Chloride | Fisher Bioreagents | BP366-500 | |
| Potasium Phosphate | MP Biomedicals | 194727 | |
| SafeLock microcentrifuge tubes | Eppendorf | 30120086 | |
| Screw top amber GC vial | Agilent | 5182-0716 | |
| Sodium Chloride | Fisher Bioreagents | BP358-212 | |
| Sodium Hydroxide | Merck | S5881 | |
| Sodium Phosphate, dibasic | Fisher Bioreagents | BP332-500 | |
| Sodium Sulfate | Merck | 239313 | |
| Sulfuric Acid | Merck | 258105 | |
| Vial insert | Agilent | 5183-2088 |
参考文献
- The Lancet, Diabetes Endocrinology. Childhood obesity: a growing pandemic. The Lancet. Diabetes & Endocrinology. 10 (1), 1(2022).
- Gonzalez-Muniesa, P., et al. Obesity. Nature Reviews Disease Primers. 3, 17034(2017).
- Müller, T. D., Blüher, M., Tschöp, M. H., DiMarchi, R. D. Anti-obesity drug discovery: advances and challenges. Nature Reviews Drug Discovery. 21 (3), 201-223 (2021).
- Virtue, S., Vidal-Puig, A. GTTs and ITTs in mice: simple tests, complex answers. Nature Metabolism. 3 (7), 883-886 (2021).
- Müller, T. D., Klingenspor, M., Tschöp, M. H. Revisiting energy expenditure: how to correct mouse metabolic rate for body mass. Nature Metabolism. 3 (9), 1134-1136 (2021).
- Virtue, S., Lelliott, C. J., Vidal-Puig, A. What is the most appropriate covariate in ANCOVA when analysing metabolic rate. Nature Metabolism. 3 (12), 1585(2021).
- Hellerstein, M. K. De novo lipogenesis in humans: metabolic and regulatory aspects. European Journal of Clinical Nutrition. 53 Suppl 1, S53-S65 (1999).
- Zhao, S., et al. Dietary fructose feeds hepatic lipogenesis via microbiota-derived acetate. Nature. 579 (7800), 586-591 (2020).
- Wallace, M., et al. Enzyme promiscuity drives branched-chain fatty acid synthesis in adipose tissues. Nature Chemical Biology. 14 (11), 1021-1031 (2018).
- Zhao, S., et al. ATP-citrate lyase controls a glucose-to-acetate metabolic switch. Cell Reports. 17 (4), 1037-1052 (2016).
- Green, C. R., et al. Branched-chain amino acid catabolism fuels adipocyte differentiation and lipogenesis. Nature Chemical Biology. 12 (1), 15-21 (2016).
- Zhang, Z., et al. Serine catabolism generates liver NADPH and supports hepatic lipogenesis. Nature Metabolism. 3 (12), 1608-1620 (2021).
- Chirala, S. S., et al. Fatty acid synthesis is essential in embryonic development: fatty acid synthase null mutants and most of the heterozygotes die in utero. Proceedings of the National Academy of Sciences. 100 (11), 6358-6363 (2003).
- Icard, P., et al. ATP citrate lyase: A central metabolic enzyme in cancer. Cancer Letters. 471, 125-134 (2020).
- Fhu, C. W., Ali, A. Fatty acid synthase: an emerging target in cancer. Molecules. 25 (17), 3935(2020).
- Lawitz, E. J., et al. Acetyl-CoA carboxylase inhibitor GS-0976 for 12 weeks reduces hepatic de novo lipogenesis and steatosis in patients with nonalcoholic steatohepatitis. Clinical Gastroenterology and Hepatology. 16 (12), 1983e3-1991e3 (2018).
- Smith, G. I., et al. Insulin resistance drives hepatic de novo lipogenesis in nonalcoholic fatty liver disease. The Journal of Clinical Investigation. 130 (3), 1453-1460 (2020).
- Imamura, F., et al. Fatty acids in the de novo lipogenesis pathway and incidence of type 2 diabetes: A pooled analysis of prospective cohort studies. PLoS Medicine. 17 (6), e1003102(2020).
- Lai, H. T. M., et al. Serial plasma phospholipid fatty acids in the de novo lipogenesis pathway and total mortality, cause-specific mortality, and cardiovascular diseases in the cardiovascular health study. Journal of the American Heart Association. 8 (22), e012881(2019).
- Ference, B. A., et al. Mendelian randomization study of ACLY and cardiovascular disease. The New England Journal of Medicine. 380 (11), 1033-1042 (2019).
- Herman, M. A., et al. A novel ChREBP isoform in adipose tissue regulates systemic glucose metabolism. Nature. 484 (7394), 333-338 (2012).
- Sanchez-Gurmaches, J., et al. Brown fat AKT2 Is a cold-induced kinase that stimulates ChREBP-mediated de novo lipogenesis to optimize fuel storage and thermogenesis. Cell Metabolism. 27 (1), 195e6-209e6 (2018).
- Wang, X., et al. Nuclear protein that binds sterol regulatory element of low density lipoprotein receptor promoter. II. Purification and characterization. The Journal of Biological Chemistry. 268 (19), 14497-14504 (1993).
- Briggs, M. R., Yokoyama, C., Wang, X., Brown, M. S., Goldstein, J. L. Nuclear protein that binds sterol regulatory element of low density lipoprotein receptor promoter. I. Identification of the protein and delineation of its target nucleotide sequence. The Journal of Biological Chemistry. 268 (19), 14490-14496 (1993).
- Yokoyama, C., et al. SREBP-1, a basic-helix-loop-helix-leucine zipper protein that controls transcription of the low density lipoprotein receptor gene. Cell. 75 (1), 187-197 (1993).
- Chen, G., Liang, G., Ou, J., Goldstein, J. L., Brown, M. S. Central role for liver X receptor in insulin-mediated activation of Srebp-1c transcription and stimulation of fatty acid synthesis in liver. Proceedings of the National Academy of Sciences. 101 (31), 11245-11250 (2004).
- Denechaud, P. D., et al. ChREBP, but not LXRs, is required for the induction of glucose-regulated genes in mouse liver. The Journal of Clinical Investigation. 118 (3), 956-964 (2008).
- Crewe, C., et al. SREBP-regulated adipocyte lipogenesis is dependent on substrate availability and redox modulation of mTORC1. JCI Insight. 5 (15), e129397(2019).
- Batchuluun, B., Pinkosky, S. L., Steinberg, G. R. Lipogenesis inhibitors: therapeutic opportunities and challenges. Nature Reviews Drug Discovery. 21 (4), 283-305 (2022).
- Wallace, M., Metallo, C. M. Tracing insights into de novo lipogenesis in liver and adipose tissues. Seminars in Cell & Developmental Biology. 108, 65-71 (2020).
- Lee, W. N., et al. In vivo measurement of fatty acids and cholesterol synthesis using D2O and mass isotopomer analysis. The American Journal of Physiology. 266 (5 Pt 1), E699-E708 (1994).
- Yao, C. H., Liu, G. Y., Yang, K., Gross, R. W., Patti, G. J. Inaccurate quantitation of palmitate in metabolomics and isotope tracer studies due to plastics. Metabolomics. 12, 143(2016).
- Hiller, K., et al. MetaboliteDetector: comprehensive analysis tool for targeted and nontargeted GC/MS based metabolome analysis. Analytical Chemistry. 81 (9), 3429-3439 (2009).
- Fernandez, C. A., Des Rosiers, C., Previs, S. F., David, F., Brunengraber, H. Correction of 13C mass isotopomer distributions for natural stable isotope abundance. Journal of Mass Spectrometry. 31 (3), 255-262 (1996).
- Midani, F. S., Wynn, M. L., Schnell, S. The importance of accurately correcting for the natural abundance of stable isotopes. Analytical Biochemistry. 520, 27-43 (2017).
- Trefely, S., Ashwell, P., Snyder, N. W. FluxFix: automatic isotopologue normalization for metabolic tracer analysis. BMC Bioinformatics. 17 (1), 485(2016).
- Jeong, H., et al. Correcting for naturally occurring mass isotopologue abundances in stable-isotope tracing experiments with PolyMID. Metabolites. 11 (5), 310(2021).
- Millard, P., et al. IsoCor: isotope correction for high-resolution MS labeling experiments. Bioinformatics. 35 (21), 4484-4487 (2019).
- Brunengraber, D. Z., et al. Influence of diet on the modeling of adipose tissue triglycerides during growth. American Journal of Physiology. Endocrinology and Metabolsim. 285 (4), E917-E925 (2003).
- Svensson, R. U., et al. Inhibition of acetyl-CoA carboxylase suppresses fatty acid synthesis and tumor growth of non-small-cell lung cancer in preclinical models. Nature Medicine. 22 (10), 1108-1119 (2016).
- Hellerstein, M. K., Neese, R. A. Mass isotopomer distribution analysis: a technique for measuring biosynthesis and turnover of polymers. The American Journal of Physiology. 263 (5 Pt 1), E988-E1001 (1992).
- Hellerstein, M. K., Neese, R. A. Mass isotopomer distribution analysis at eight years: theoretical, analytic, and experimental considerations. The American Journal of Physiology. 276 (6), E1146-E1170 (1999).
- Kelleher, J. K., Masterson, T. M. Model equations for condensation biosynthesis using stable isotopes and radioisotopes. The American Journal of Physiology. 262 (1 Pt 1), E118-E125 (1992).
- Kelleher, J. K., Nickol, G. B. Isotopomer spectral analysis: utilizing nonlinear models in isotopic flux studies. Methods in Enzymology. 561, 303-330 (2015).
- Argus, J. P., et al. Development and application of FASA, a model for quantifying fatty acid metabolism using stable isotope labeling. Cell Reports. 25 (10), 2919.e8-2934.e8 (2018).
- Guilherme, A., et al. Control of adipocyte thermogenesis and lipogenesis through β3-adrenergic and thyroid hormone signal integration. Cell Reports. 31 (5), 107598(2020).
- Guilherme, A., et al. Neuronal modulation of brown adipose activity through perturbation of white adipocyte lipogenesis. Molecular Metabolism. 16, 116-125 (2018).
- Guilherme, A., et al. Adipocyte lipid synthesis coupled to neuronal control of thermogenic programming. Molecular Metabolism. 6 (8), 781-796 (2017).
- Lodhi, I. J., et al. Inhibiting adipose tissue lipogenesis reprograms thermogenesis and PPARgamma activation to decrease diet-induced obesity. Cell Metabolism. 16 (2), 189-201 (2012).
- McCormack, J. G., Denton, R. M. Evidence that fatty acid synthesis in the interscapular brown adipose tissue of cold-adapted rats is increased in vivo by insulin by mechanisms involving parallel activation of pyruvate dehydrogenase and acetyl-coenzyme A carboxylase. The Biochemistry Journal. 166 (3), 627-630 (1977).
- Trayhurn, P. Fatty acid synthesis in vivo in brown adipose tissue, liver and white adipose tissue of the cold-acclimated rat. FEBS Letters. 104 (1), 13-16 (1979).
- Negron, S. G., Ercan-Sencicek, A. G., Freed, J., Walters, M., Lin, Z. Both proliferation and lipogenesis of brown adipocytes contribute to postnatal brown adipose tissue growth in mice. Science Reports. 10 (1), 20335(2020).
- Schlein, C., et al. Endogenous fatty acid synthesis drives brown adipose tissue involution. Cell Reports. 34 (2), 108624(2021).
- Mottillo, E. P., et al. Coupling of lipolysis and de novo lipogenesis in brown, beige, and white adipose tissues during chronic beta3-adrenergic receptor activation. Journal of Lipid Research. 55 (11), 2276-2286 (2014).
- Adlanmerini, M., et al. Circadian lipid synthesis in brown fat maintains murine body temperature during chronic cold. Proceedings of the National Academy of Sciences. 116 (37), 18691-18699 (2019).
- Yu, X. X., Lewin, D. A., Forrest, W., Adams, S. H. Cold elicits the simultaneous induction of fatty acid synthesis and beta-oxidation in murine brown adipose tissue: prediction from differential gene expression and confirmation in vivo. FASEB Journal. 16 (2), 155-168 (2002).
- Kushner, D. J., Baker, A., Dunstall, T. G. Pharmacological uses and perspectives of heavy water and deuterated compounds. Canadian Journal of Physiology and Pharmacology. 77 (2), 79-88 (1999).
- Diraison, F., Pachiaudi, C., Beylot, M. Measuring lipogenesis and cholesterol synthesis in humans with deuterated water: use of simple gas chromatographic/mass spectrometric techniques. Journal of Mass Spectrometry. 32 (1), 81-86 (1997).
- Yang, D., et al. Assay of low deuterium enrichment of water by isotopic exchange with [U-13C3]acetone and gas chromatography-mass spectrometry. Analytical Biochemistry. 258 (2), 315-321 (1998).
- Fu, X., et al. Measurement of lipogenic flux by deuterium resolved mass spectrometry. Nature Communications. 12 (1), 3756(2021).
- Shah, V., Herath, K., Previs, S. F., Hubbard, B. K., Roddy, T. P. Headspace analyses of acetone: a rapid method for measuring the 2H-labeling of water. Analytical Biochemistry. 404 (2), 235-237 (2010).
- Argus, J. P., Yu, A. K., Wang, E. S., Williams, K. J., Bensinger, S. J. An optimized method for measuring fatty acids and cholesterol in stable isotope-labeled cells. Journal of Lipid Research. 58 (2), 460-468 (2017).
- Belew, G. D., Jones, J. G. De novo lipogenesis in non-alcoholic fatty liver disease: Quantification with stable isotope tracers. European Journal of Clinical Investigation. 52 (3), e13733(2022).
- Zhang, Z., Chen, L., Liu, L., Su, X., Rabinowitz, J. D. Chemical basis for deuterium labeling of fat and NADPH. Journal of the American Chemical Society. 139 (41), 14368-14371 (2017).
- Belew, G. D., et al. Transfer of glucose hydrogens via acetyl-CoA, malonyl-CoA, and NADPH to fatty acids during de novo lipogenesis. Journal of Lipid Research. 60 (12), 2050-2056 (2019).
- Diraison, F., Pachiaudi, C., Beylot, M. In vivo measurement of plasma cholesterol and fatty acid synthesis with deuterated water: determination of the average number of deuterium atoms incorporated. Metabolism. 45 (7), 817-821 (1996).
- Ajie, H. O., et al. In vivo study of the biosynthesis of long-chain fatty acids using deuterated water. The American Journal of Physiology. 269 (2 Pt 1), E247-E252 (1995).
- Schloerb, P. R., Friis-Hansen, B. J., Edelman, I. S., Solomon, A. K., Moore, F. D. The measurement of total body water in the human subject by deuterium oxide dilution; with a consideration of the dynamics of deuterium distribution. The Journal of Clinical Investigation. 29 (10), 1296-1310 (1950).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved