Method Article
Visualização de Pseudomonas aeruginosa no Escarro de Pacientes com Fibrose Cística
Neste Artigo
Resumo
Este protocolo fornece métodos para visualização de células bacterianas e polissacarídeos do lócus de síntese de polissacarídeos (Psl) no escarro de pacientes com fibrose cística.
Resumo
A detecção precoce e a erradicação de Pseudomonas aeruginosa nos pulmões de pacientes com fibrose cística podem reduzir a chance de desenvolver infecção crônica. O desenvolvimento de infecções crônicas por P. aeruginosa está associado a um declínio na função pulmonar e aumento da morbidade. Portanto, há um grande interesse em elucidar as razões para a falha na erradicação da P. aeruginosa com antibioticoterapia, que ocorre em aproximadamente 10-40% dos pacientes pediátricos. Um dos muitos fatores que podem afetar a depuração de P. aeruginosa e a suscetibilidade a antibióticos pelo hospedeiro são variações na organização espacial (como agregação ou formação de biofilme) e produção de polissacarídeos. Portanto, estávamos interessados em visualizar as características in situ da P. aeruginosa no escarro de pacientes com FC. Uma técnica de limpeza tecidual foi aplicada às amostras de escarro após a incorporação das amostras em uma matriz de hidrogel para reter as estruturas 3D em relação às células hospedeiras. Após a limpeza do tecido, etiquetas fluorescentes e corantes foram adicionados para permitir a visualização. Hibridização in situ fluorescente foi realizada para a visualização das células bacterianas, ligação de anticorpos anti-Psl marcados fluorescentemente para a visualização do exopolissacarídeo e coloração DAPI para corar células hospedeiras para obter insight estrutural. Esses métodos permitiram a obtenção de imagens de alta resolução da P. aeruginosa no escarro de pacientes com FC por meio de microscopia confocal de varredura a laser.
Introdução
Neste estudo, experimentos foram delineados para visualizar a estrutura in vivo de Pseudomonas aeruginosa no escarro de pacientes pediátricos com fibrose cística (FC). As infecções por P. aeruginosa tornam-se crônicas em 30-40% da população pediátrica com FC; Uma vez estabelecidas, as infecções crônicas são quase impossíveis de serem eliminadas1. Isolados de P. aeruginosa de pacientes com infecção precoce são geralmente mais suscetíveis aos antimicrobianos, portanto, estes são tratados com antibióticos anti-pseudomonas para prevenir o estabelecimento de infecção crônica2. Infelizmente, nem todos os isolados de P. aeruginosa são efetivamente eliminados do pulmão após a antibioticoterapia. Os mecanismos precisos associados à falha antibiótica ainda não foram totalmente elucidados. Estudos prévios demonstraram que variações na densidade celular, agregação e produção de polissacarídeos podem afetar a eficácia dos antibióticos3. P. aeruginosa produz três polissacarídeos extracelulares: Pel, Psl ealginato 4. A maioria das cepas de P. aeruginosa tem a capacidade genética de expressar cada um dos exopolissacarídeos, embora frequentemente um tipo de polissacarídeo seja expresso predominantemente5. O alginato de exopolissacarídeo está associado a infecções crônicas no pulmão da FC, resultando em um fenótipo mucoide 6,7. Os polissacarídeos Pel e Psl têm múltiplas funções, incluindo auxiliar a fixação inicial e a manutenção da estrutura do biofilme, conferindo resistência aos antibióticos8.
Métodos com o objetivo de visualizar in vivo estruturas de tecidos têm sido desenvolvidos para uma variedade de tipos de amostras9,10,11. Mais recentemente, eles foram adaptados para visualizar comunidades microbianas in vivo dentro do escarro de pacientes com FC12. A otimização de um protocolo de limpeza tecidual específico para a identificação de comunidades microbianas dentro do escarro foi desenvolvida por DePas et al., 201612. O termo MiPACT, que significa microbial identification after Passive CLARITY technique foi cunhado para a depuração do escarro de FC11,12. Para as técnicas de limpeza de tecidos, os espécimes são primeiramente fixados, depois tornados transparentes, deixando intacta sua arquitetura inerente para coloração e visualização microscópica11. A fixação e a limpeza de amostras de escarro de FC permitem que os pesquisadores respondam a perguntas relacionadas à estrutura do biofilme, densidade celular bacteriana, associações polimicrobianas e associações entre patógenos e células hospedeiras. A vantagem de examinar diretamente as bactérias que foram preservadas no escarro é que elas podem ser analisadas e visualizadas em um contexto específico do hospedeiro. Embora o crescimento in vitro de isolados clínicos em laboratório para experimentação possa ser muito informativo, tais métodos são incapazes de recriar completamente o ambiente pulmonar da FC, resultando em uma desconexão entre os resultados laboratoriais e os desfechos dos pacientes.
Os métodos aqui apresentados podem ser usados para fixar e limpar o escarro para visualizar bactérias, seja de pacientes com FC ou de pacientes com outras infecções respiratórias. O tipo específico de coloração e análise microscópica aqui descrita é a hibridização in situ fluorescente (FISH), seguida pela ligação de anticorpos anti-PSL dentro do hidrogel e subsequente análise via microscopia confocal de varredura a laser (CLSM). Após a limpeza tecidual, outros métodos de imunohistoquímica e microscopia também podem ser aplicados.
Protocolo
A aprovação do Conselho de Ética em Pesquisa (CEP) é necessária para coletar e armazenar amostras de escarro de seres humanos. Os estudos aqui apresentados foram aprovados pelo Hospital for Sick Children REB#1000058579.
1. Coleta de Escarro
- Armazenar o escarro expectorado em um copo de coleta estéril e armazenar imediatamente a 4 °C por um máximo de 24 h antes da fixação.
NOTA: Deixar o escarro demasiado tempo a 4 °C sem fixação pode levar à degradação celular, particularmente degradação dos glóbulos brancos. A fixação o mais rápido possível é preferível. - Transferir as amostras de escarro para um tubo estéril de 15 mL.
- Adicionar um volume igual de paraformaldeído (PFA) a 4% às amostras de escarro. Por exemplo, se a amostra de escarro for de 0,5 mL, adicionar 0,5 mL de PFA a 4%. Misture por inversão suave.
- Incubar o escarro durante a noite a 4 °C.
- Lavar a amostra adicionando 5 mL de solução salina tamponada com fosfato (PBS) a cada 2 mL de escarro fixo.
NOTA: Não é necessária centrifugação para esta etapa de lavagem. - Retire cuidadosamente o sobrenadante com uma pipeta.
NOTA: Evite sugar o escarro com a pipeta, apontando a ponta para longe do escarro e aspirar muito lentamente o líquido da superfície. A etapa de lavagem não envolve centrifugação para não perturbar a integridade estrutural dos tampões de escarro. - Repita as etapas 1.6-1.7 mais duas vezes.
- Ressuspender o pellet em 2x o volume de PBS com azida sódica a 0,01 % (p/v).
- Conservar o escarro a 4 °C.
2. MiPACT (técnica de limpeza de tecidos) processamento de escarro
- Desgaseifique os componentes do hidrogel (30% 29:1 acrilamida:bis-acrilamida, hardner e PBS) em um recipiente selado contendo uma embalagem anaeróbia antes por 72 h.
NOTA: A embalagem anaeróbia e o recipiente selado são necessários porque o oxigênio inibe a polimerização da acrilamida. Alternativamente, o oxigênio pode ser removido realizando esta etapa em um exaustor anaeróbico, aplicando um vácuo em um recipiente selado ou borbulhando gás N2 através da mistura de acrilamida.- Adicionar 2 ml de uma solução de acrilamida:bis-acrilamida a 30% 29:1 a um tubo de 15 ml com a tampa desligada no interior do recipiente anaeróbio selado.
- Faça um estoque concentrado de 10% (p/v) de endurecedor adicionando 0,5 g de endurecedor a 5 mL de PBS em um tubo de 15 mL. Deixe a tampa fora do tubo e guarde no recipiente anaeróbio selado.
- Deixe alguns mL de PBS estéril em um tubo, com a tampa desligada, dentro do recipiente anaeróbio.
- Completar 5 mL de solução de hidrogel com concentração final de endurecedor a 0,2% e acrilamida:bis-acrilamida a 29:1 a 4% em PBS em tubo de 15 mL. Misture por inversão e filtre esterilizar.
- Retire as amostras de escarro do frigorífico e, em seguida, corte em pequenas secções (cerca de 5 mm de diâmetro) em condições estéreis com um bisturi.
NOTA: Se o escarro é bastante fluido, então esta etapa ainda pode ser realizada, no entanto, é preciso mais paciência e prática para remover o escarro da solução de armazenamento com pinça antes de usar o bisturi para separar as frações desejadas. - Coloque as amostras de escarro cortadas dentro de um poço de uma lâmina de vidro de cobertura de 8 câmaras.
- Adicionar 300 μL de solução de hidrogel esterilizada por filtro a partir do passo 2.2 a cada um dos orifícios que contêm escarro.
- Colocar o vidro de cobertura de 8 câmaras dentro de um recipiente selado contendo uma embalagem anaeróbia durante 3 h a 37 °C.
OBS: Uma vez polimerizado o hidrogel com escarro embutido deve ser a consistência de gel firme. - Transferir as amostras de escarro de hidrogel solidificado para um tubo de cultura de 15 mL contendo 5 mL de dodecil sulfato de sódio (SDS) a 8%, pH 8, e deixar as amostras limparem por 3-14 dias a 37 °C (com ou sem agitação), até que o escarro fique transparente.
NOTA: Os tempos de clareamento dependem da composição do escarro e geralmente podem ser diminuídos com a agitação. No entanto, tome cuidado para não aumentar a velocidade de agitação a ponto de interromper a integridade da amostra. Mais amostras ricas em DNA levam mais tempo para limpar em comparação com amostras ricas em muco. - Decantar a solução de SDS a 8% para um recipiente de recolha de resíduos. Usando pinças estéreis, transfira cada amostra embebida em hidrogel para um tubo cônico estéril de 50 mL. Adicionar 10 mL de PBS a cada um dos tubos cônicos de 50 mL para lavar os hidrogéis e deixar a solução descansar por 30 min a 1 h antes da decantação. Repita isso 2x mais vezes.
NOTA: Esta etapa de lavagem não envolve centrifugação. O excesso de líquido e sobrenadante são cuidadosamente removidos com uma pipeta. - Armazenar as amostras lavadas em PBS com azida sódica a 0,01% (p/v) e inibidor de RNase 1x a 4 °C.
3. Protocolo de hibridização in situ fluorescente de hidrogel (FISH)
- Retire as amostras de hidrogel de sua solução de armazenamento usando pinças estéreis e coloque as amostras em uma superfície estéril (como uma lâmina de vidro ou placa de Petri).
- Usando um bisturi estéril corte os hidrogéis em fatias de ~ 1 mm de espessura.
- Coloque as secções de 1 mm de hidrogel dentro de tubos estéreis de 1,5 ml.
- Preparar 1 mL de tampão de hibridização (formamida 25%, NaCl 0,9M, Tris-HCl 20 mM [pH 7,6], SDS 0,01%, H2Opurificado e deionizado) em tubo de 1,5 mL.
- Adicione a sonda PseaerA fluorescentemente marcada (150,7 nM12) ao tampão de hibridização e misture por inversão.
NOTA: A solução de formalina deve ser mantida longe de uma chama aberta. O tampão de hibridização pode ser preparado em avançado e armazenado em alíquotas a -20 °C13. - Adicione 200-500 μL de tampão de hibridização a cada seção de ~1 mm de hidrogel e certifique-se de que toda a amostra de hidrogel esteja submersa.
- Permitir que a sonda PseaerA hibridize com as amostras de hidrogel, colocando-as no escuro por ~ 18-24 h, a 46 °C, sem agitar.
- Decantar o tampão de hibridização em um recipiente de coleta de resíduos.
- Enxaguar as amostras uma vez com tampão de lavagem esterilizado por filtro (NaCl 337,5 mM, Tris-HCl 20 mM, EDTA (ácido etilenodiaminotetracético) 5 mM [pH 7,2], SDS 0,01% e H2O purificado e deionizado) adicionando 1 mL de tampão de lavagem a cada um dos tubos de 1,5 mL e, em seguida, removê-lo.
NOTA: O tampão de lavagem pode ser feito com antecedência e armazenado à temperatura ambiente (RT). - Adicionar 1 ml de tampão de lavagem fresco aos tubos e, em seguida, incubar as amostras no escuro durante 6 h a 48 °C, sem agitar.
4. Ligação de anticorpos Hydrogel e Psl0096
- Remova estérilmente o tampão de lavagem usando um pipetador de 1 mL.
- Enxaguar as amostras com uma solução de BSA a 2% (p/v) em PBS, adicionando e removendo 1 ml da solução de BSA a 2%.
- Adicionar 500 μL da solução de BSA/PBS a 2% às amostras de hidrogel para bloquear a ligação proteica não específica. Em seguida, incube as amostras durante a noite, no escuro, em RT, sem agitar.
- Remover estérilmente a solução de bloqueio utilizando uma pipeta de 1 ml.
- Preparar a solução de anticorpos Psl0096-Texas Red diluindo o anticorpo para uma concentração final de 0,112 μg/mL em 500 μL de BSA/PBS fresco a 2%.
- Adicionar a solução de 500 μL de anticorpos às amostras de hidrogel e incubá-las em RT por 6 h, protegidas da luz, sem agitar.
5. Coloração DAPI (4′,6′-diamidino-2-fenilindol)
- Preparar a solução de correspondência do índice de refração (RIMS) adicionando 40 g de meio de gradiente de densidade não iónico, 30 μL de Tween20, 3 μg de azida sódica e 30 ml de PBS a um balão contendo uma barra de agitação magnética. Agite a solução durante 15 minutos num agitador magnético ou até dissolver completamente.
- Filtrar esterilizar a solução num tubo cónico de 50 ml utilizando uma seringa de 10 ml e um filtro estéril de 0,2 μm.
NOTA: A solução pode ser armazenada a 4 °C durante vários meses. - Remova a solução de anticorpos Psl0096-Texas Red com uma pipeta estéril de 1 mL.
- Enxaguar as amostras de hidrogel adicionando e removendo 1 mL de PBS.
- Incubar as amostras de hidrogel com 250 μL de solução de RIMS e 10 μg/mL de DAPI em TR com agitação suave, no escuro, durante a noite.
- Antes da aquisição de imagens confocais, monte as amostras em câmaras de perfusão de 0,9 mm ou 1,7 mm e sele com uma lamínula de vidro.
OBS: Após FISH e/ou imunohistoquímica e antes da imersão em RIMS, a coloração fluorescente de lectinas pode ser aplicada se a visualização da mucosa do escarro for desejada12.
6. Exames por imagem
- Realize imagens confocais de microscopia de varredura a laser usando técnicas padrão em aumentos de 25x, 40x, 63x ou 100x.
Resultados
O planejamento geral do experimento está resumido na Figura 1 e na Figura 2. A Figura 1 apresenta um resumo dos protocolos de processamento e desobstrução de escarro. O processamento e a depuração do escarro podem levar até 17 dias. No entanto, o protocolo pode ser interrompido, e as amostras podem ser armazenadas após a fixação com PFA (dia 2) ou após a limpeza do tecido (dias 5-17, dependendo do tempo de clareamento). Na Figura 2, os protocolos de ligação de FISH e anticorpos estão resumidos. Os protocolos de coloração de FISH e anticorpos levam 4 dias para serem concluídos, mas devem ser concluídos e as imagens confocais devem ser feitas uma vez iniciadas. Usando os protocolos acima, imagens 3D de alta resolução de células de P. aeruginosa podem ser obtidas com sua estrutura in situ dentro do escarro visualizada.
A limpeza do escarro e a posterior aplicação das colorações fluorescentes utilizadas neste protocolo permitem a visualização detalhada da P. aeruginosa dentro das amostras. As amostras de escarro mostradas nas Figuras 3 e 4 foram coletadas de um paciente pediátrico com FC (17 anos) com infecção por P. aeruginosa de início recente. Na Figura 3A, um agregado de células foi visto dentro de uma amostra de escarro; O aparecimento de bastonetes verde-amarelados deveu-se à sobreposição dos três fluoróforos. Embora não tenhamos contagem de células para esta amostra de escarro, encontramos o limite de detecção da sonda de 10a 4 células/mL (ver Figura 1 suplementar). Na Figura 3B, as formas individuais dos bastonetes foram vistas em verde a partir da ligação espécie-específica da sonda PseaerA-488 às células de P. aeruginosa. O anticorpo Psl0096-Texas Red visto em vermelho ilustra onde o exopolissacarídeo pseudomonal estava localizado dentro do escarro; neste caso, o anticorpo Psl0096 pareceu sobrepor-se principalmente às células de P. aeruginosa (Figura 3C). Este método também permitiu a visualização de células pseudomonas dentro do escarro em relação a outras células bacterianas e estruturas do hospedeiro. Na Figura 4, um aglomerado de células de P. aeruginosa foi visto fagocitado dentro de uma célula eucariótica e outros pequenos aglomerados de células cócicas foram observados nas proximidades. Foi demonstrado que o anticorpo Psl0096 também pode se ligar à P. aeruginosa planctônica produzida por Psl (ver Figura 2 Suplementar).
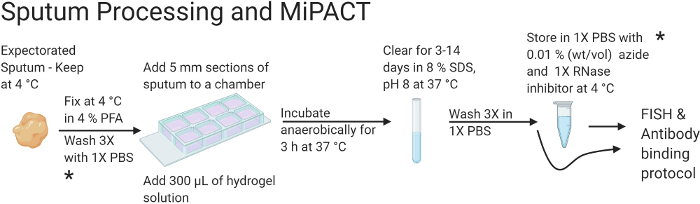
Figura 1: Fluxograma ilustrando o processamento do escarro e os protocolos MiPACT.
Em resumo, o escarro é fixado antes de ser incluído em uma solução de poliacrilamida. Uma vez limpo, o hidrogel pode ser armazenado a 4 °C ou usado com o protocolo de ligação de FISH e anticorpos. Esta imagem foi criada com BioRender.com. Clique aqui para ver uma versão maior desta figura.
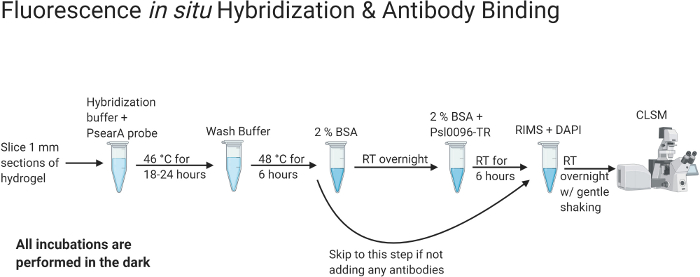
Figura 2: Fluxograma denotando os protocolos de hibridização in situ fluorescente e coloração de anticorpos.
Uma vez que o escarro tenha completamente limpo dentro da matriz de hidrogel, métodos de coloração podem ser aplicados. Esta imagem foi criada com BioRender.com. Clique aqui para ver uma versão maior desta figura.

Figura 3: Imagem de imunofluorescência de uma amostra de escarro coletada de um paciente com infecção precoce por P. aeruginosa embebida em uma matriz de hidrogel.
A amostra de hidrogel foi hibridizada com uma sonda PsearA-Alexa488 (verde), um anticorpo Psl0096-Texas Red (vermelho) e DAPI (azul). (A) amostra de escarro visualizada sob todos os 3 canais, (B) escarro sob apenas o canal verde indicando onde a sonda PseaerA-488 se ligou, e (C) escarro sob apenas o canal vermelho onde ocorreu a ligação Psl0096-Texas red. As imagens foram obtidas em aumento de 100x. Clique aqui para ver uma versão maior desta figura.

Figura 4: Imagem de imunofluorescência de uma amostra de escarro coletada de um paciente com infecção precoce por P. aeruginosa embebida em uma matriz de hidrogel.
A amostra de hidrogel foi hibridizada com uma sonda PsearA-Alexa488 (verde), um anticorpo Psl0096-Texas Red (vermelho) e DAPI (azul). Clique aqui para ver uma versão maior desta figura.
Figura suplementar 1: Hibridação in situ fluorescente de uma cultura planctônica de PAO1 com a sonda PseaerA-488. Clique aqui para baixar esta figura.
Figura suplementar 2: P. aeruginosa corada com DAPI e o anticorpo Psl0096-Texas Red. (A) cepa PAO1-Δpsl e (B) cepa PAO1. Clique aqui para baixar esta figura.
Discussão
O objetivo deste protocolo é permitir vislumbrar a organização in situ das células de P. aeruginosa no escarro de pacientes com FC. As amostras de escarro devem ser armazenadas a 4 °C até serem processadas, se não puderem ser imediatamente fixadas. Foi demonstrado que o número de células de P. aeruginosa no escarro não muda significativamente se processado em 1 h, 24 h ou 48 h, quando armazenado a 4 °C, embora se deixado a 25 °C por 24 ou 48 h, a contagem de células bacterianas aumentará significativamente como resultado do crescimento bacteriano14. Para este estudo, as amostras de escarro foram armazenadas a 4 °C até um máximo de 24 h após a expectoração. Deve-se notar que a contagem de células inflamatórias diminuiu no escarro se deixada a 4 °C e processada mais de 9 h depois15. Portanto, é importante considerar as células e marcadores específicos que se deseja visualizar no escarro ao decidir por um tempo de corte para o processamento da amostra.
O processamento das amostras neste método inicia-se com a fixação das amostras de escarro em PFA a 4%. O paraformaldeído fará a ligação cruzada entre as células bacterianas e sua matriz extracelular, preservando suas estruturas para visualização e análise microscópica11,16. Infelizmente, se o objetivo é obter a contagem total de células em certas células inflamatórias no escarro, foi demonstrado que o PFA diminui a contagem dessas células, portanto, outros fixadores devem ser considerados17. Outra limitação deste estudo é que ele pode ser demorado e levar mais de duas semanas para ser realizado. Assim, pode não ser adequado para o desenvolvimento de um método diagnóstico que exija decisões de tratamento sensíveis ao tempo. Além disso, para entender a diversidade microbiana total dentro de amostras de escarro, este método não seria adequado, mas poderia ser pareado com outros métodos de detecção microbiana de alto rendimento, como a qPCR.
A composição do hidrogel de acrilamida pode ser alterada dependendo do tipo de tecido e da aplicação11. Para espécimes instáveis como o escarro de FC, é necessário fornecer suporte estrutural com uma mistura de 29:1 acrilamida:bis-acrilamida (em vez de apenas acrilamida). A inclusão de paraformaldeído no hidrogel pode estabilizar ainda mais a estrutura, com o trade-off de tempos de incubação mais longos para permitir a difusão de sondas e anticorpos9. A adição de formaldeído ao hidrogel também pode prevenir o inchaço tecidual durante o processo de clareamento, se esse efeito for indesejável11.
O método atual tem como alvo específico as células de P. aeruginosa no escarro de pacientes com FC. Métodos alternativos e modificações a este protocolo podem ser considerados para orientar a otimização da visualização de outras bactérias. Através da aplicação de sondas de FISH e reação em cadeia de hibridização (HCR) espécie-específicas e gênero-específicas, outros patógenos da FC, como Staphylococcus aureus, Streptococcus sp e Achromobacter xylosoxidans, podem ser identificados12. Em nosso estudo, visamos o exopolissacarídeo pseudomonal Psl. Outros alvos, incluindo alginato ou Pel, podem ser examinados com anticorpos fluorescentes específicos para esses exopolissacarídeos em experimentos futuros. A aplicação do método MiPACT juntamente com FISH e coloração de anticorpos para CLSM leva algumas semanas para ser concluída. Se a questão de pesquisa não diz respeito à visualização espacial tridimensional do escarro, existem métodos mais rápidos para visualizar as bactérias presentes. Métodos anteriores utilizados para visualizar bactérias em amostras de escarro utilizam cortes finos ou esfregaços e incluem: FISH18, coloração de Gram e técnicas de imunohistoquímica que aplicam anticorpos primários e contracolorações para permitir a visualização de exopolissacarídeos de biofilme e células bacterianas 19,20.
Existem várias aplicações futuras potenciais desses tipos de técnicas de imagem. A capacidade de visualizar diferentes organismos bacterianos e sua interação com células hospedeiras, como fagócitos, pode aprofundar nossa compreensão de por que algumas cepas de P. aeruginosa são efetivamente eliminadas das vias aéreas da FC, enquanto outras cepas não o são. Bactérias de imagem dentro de espécimes respiratórios também podem ser usadas como medida de eficácia antimicrobiana e como resultado de estudo para novos fármacos antibiofilme21. Além disso, a visualização da relação espacial entre P. aeruginosa e outros organismos do microbioma pulmonar da FC, como Staphylococcus aureus, pode ajudar a elucidar o papel da coinfecção/colonização na patogênese das exacerbações pulmonares e sua resposta ao tratamento com antibióticos. A imagem in vivo de bactérias também pode ser aplicada a outras infecções, incluindo aquelas com pneumonias associadas à ventilação mecânica ou infecções crônicas de feridas22. Os conhecimentos obtidos podem, assim, ser utilizados para orientar o desenvolvimento terapêutico futuro.
Divulgações
Nenhum.
Agradecimentos
Os autores gostariam de agradecer à Cystic Fibrosis Foundation que forneceu financiamento para esta pesquisa e à MedImmune por sua generosa doação de anticorpos anti-Psl0096. Para este estudo, as imagens foram realizadas no centro de imagens CAMiLoD da Universidade de Toronto.
Materiais
| Name | Company | Catalog Number | Comments |
| 29:1 acrylamide bisacrylamide, 30 % solution | BioRad | 161-0146 | |
| 8-Chambered Coverglass Nunc Lab-Tek | ThermoFischer Scientific | 155411 | |
| Anaerogen2.5L | Oxid Inc. | 35108 | |
| Coverwell perfusion chambers | Electron Microscopry Sciences | 70326 -12/-14 | |
| HistoDenz | Sigma | D2158 | |
| Protect RNA Rnase Inhibitor | Sigma | R7387 | |
| PseaerA - GGTAACCGTCCCCCTTGC | Eurofins | Order Details: Product: Modified DNA Oligo; Name: PseaerA; Sequence: [Alexa488]GGTAACCGTCCCCCTTGC; Synthesis: 50 nmol; Purification: HPLC; Ship state: Full yield (dry) | |
| Psl0096-Texas Red | Medimmune | The Psl0096-Texas red antibodies were a gift kindly provided by Medimmune and the company should be contacted for order inquiries. | |
| VA-044 Hardener | Wako | 27776-21-21 |
Referências
- Banerjee, D., Stableforth, D. The treatment of respiratory pseudomonas infection in cystic fibrosis: What drug and which way. Drugs. 60 (5), 1053-1064 (2000).
- Rosenfeld, M., Ramsey, B. W., Gibson, R. L. Pseudomonas acquisition in young patients with cystic fibrosis: Pathophysiology, diagnosis, and management. Current Opinion in Pulmonary Medicine. 9 (6), 492-497 (2003).
- Ciofu, O., Tolker-Nielsen, T. Tolerance and Resistance of Pseudomonas aeruginosa Biofilms to Antimicrobial Agents-How P. aeruginosa Can Escape Antibiotics. Frontiers in Microbiology. 10, 913 (2019).
- Billings, N., et al. The Extracellular Matrix Component Psl Provides Fast-Acting Antibiotic Defense in Pseudomonas aeruginosa Biofilms. PLoS Pathogens. 9 (8), 1003526 (2013).
- Franklin, M. J., Nivens, D. E., Weadge, J. T., Lynne Howell, P. Biosynthesis of the Pseudomonas aeruginosa extracellular polysaccharides, alginate, Pel, and Psl. Frontiers in Microbiology. 2, 167 (2011).
- Yang, L., et al. Polysaccharides serve as scaffold of biofilms formed by mucoid Pseudomonas aeruginosa. FEMS Immunology and Medical Microbiology. 65 (2), 366-376 (2012).
- Wozniak, D. J., et al. Alginate is not a significant component of the extracellular polysaccharide matrix of PA14 and PAO1 Pseudomonas aeruginosa biofilms. Proceedings of the National Academy of Sciences of the United States of America. 100 (13), 7907-7912 (2003).
- Baker, P., et al. Exopolysaccharide biosynthetic glycoside hydrolases can be utilized to disrupt and prevent Pseudomonas aeruginosa biofilms. Science Advances. 2 (5), 1-9 (2016).
- Yang, B., et al. Single-cell phenotyping within transparent intact tissue through whole-body clearing. Cell. 158 (4), 945-958 (2014).
- Chung, K., et al. Structural and molecular interrogation of intact biological systems. Nature. 497 (7449), 332-337 (2013).
- Treweek, J. B., et al. Whole-body tissue stabilization and selective extractions via tissue-hydrogel hybrids for high-resolution intact circuit mapping and phenotyping. Nature Protocols. 10 (11), 1860-1896 (2015).
- DePas, W. H., et al. Exposing the three-dimensional biogeography and metabolic states of pathogens in cystic fibrosis sputum via hydrogel embedding, clearing, and rRNA labeling. mBio. 7 (5), 1-11 (2016).
- Murray, M. P., Doherty, C. J., Govan, J. R. W., Hill, A. T. Do processing time and storage of sputum influence quantitative bacteriology in bronchiectasis. Journal of Medical Microbiology. 59 (7), 829-833 (2010).
- Efthimiadis, A., Jayaram, L., Weston, S., Carruthers, S., Hargreave, F. E. Induced sputum: Time from expectoration to processing. European Respiratory Journal. 19 (4), 706-708 (2002).
- Chao, Y., Zhang, T. Optimization of fixation methods for observation of bacterial cell morphology and surface ultrastructures by atomic force microscopy. Applied Microbiology and Biotechnology. 92 (2), 381-392 (2011).
- St-Laurent, J., Boulay, M. E., Prince, P., Bissonnette, E., Boulet, L. P. Comparison of cell fixation methods of induced sputum specimens: An immunocytochemical analysis. Journal of Immunological Methods. 308 (1-2), 36-42 (2006).
- Hogardt, M., et al. Specific and rapid detection by fluorescent situ hybridization of bacteria in clinical samples obtained from cystic fibrosis patients. Journal of Clinical Microbiology. 38 (2), 818-825 (2000).
- Hoffmann, N., et al. Erratum: Novel mouse model of chronic Pseudomonas aeruginosa lung infection mimicking cystic fibrosis. Infection and Immunity. 73 (8), 5290 (2005).
- Nair, B., et al. Utility of Gram staining for evaluation of the quality of cystic fibrosis sputum samples. Journal of Clinical Microbiology. 40 (8), 2791-2794 (2002).
- Howlin, R. P., et al. Low-Dose Nitric Oxide as Targeted Anti-biofilm Adjunctive Therapy to Treat Chronic Pseudomonas aeruginosa Infection in Cystic Fibrosis. Molecular Therapy. 25 (9), 2104-2116 (2017).
- Pestrak, M. J., et al. Treatment with the Pseudomonas aeruginosa glycoside hydrolase PslG combats wound infection by improving antibiotic efficacy and host innate immune activity. Antimicrobial Agents and Chemotherapy. 63 (6), 00234 (2019).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados