Method Article
囊性纤维化患者痰液中 铜绿假单胞菌 的可视化
摘要
该方案提供了囊性纤维化患者痰液中细菌细胞和多糖合成位点(Psl)多糖的可视化方法。
摘要
及早发现和根除囊性纤维化患者肺部的铜绿假单胞菌可以减少发生慢性感染的机会。慢性铜绿假单胞菌感染的发展与肺功能下降和发病率增加有关。因此,对阐明抗生素治疗未能根除铜绿假单胞菌的原因非常感兴趣,铜绿假单胞菌发生在大约 10-40% 的儿科患者中。可能影响宿主对铜绿假单胞菌清除和抗生素敏感性的众多因素之一是空间组织(如聚集或生物膜形成)和多糖产生的变化。因此,我们有兴趣可视化CF患者痰液中铜绿假单胞菌的原位特征。将痰液样品包埋到水凝胶基质中后,将组织透明化技术应用于痰液样品,以保留相对于宿主细胞的 3D 结构。组织清除后,添加荧光标记物和染料以允许可视化。荧光原位杂交用于细菌细胞的可视化,荧光标记的抗Psl抗体的结合用于胞外多糖的可视化和DAPI染色对宿主细胞的染色以获得结构见解。这些方法允许通过共聚焦激光扫描显微镜对CF患者痰中的铜绿假单胞菌进行高分辨率成像。
引言
在这项研究中,设计了实验来可视化小儿囊性纤维化 (CF) 患者痰液中铜绿假单胞菌的体内结构。铜绿假单胞菌感染在 30-40% 的儿科 CF 人群中发展为慢性;慢性感染一旦形成,几乎不可能消除1.来自早期感染患者的铜绿假单胞菌分离株通常更易受到抗菌药物的影响,因此,这些药物用抗假单胞菌抗生素治疗,以防止慢性感染的建立2。不幸的是,并非所有铜绿假单胞菌分离株在抗生素治疗后都能从肺部有效清除。与抗生素失败相关的确切机制尚未完全阐明。先前的研究表明,生物膜细胞密度、聚集和多糖产生的变化会影响抗生素疗效3。铜绿假单胞菌产生三种细胞外多糖:Pel、Psl 和海藻酸盐4。大多数铜绿假单胞菌菌株具有表达每种胞外多糖的遗传能力,尽管通常一种多糖主要表达5.海藻酸外多糖与CF肺的慢性感染有关,导致粘液样表型6,7。多糖 Pel 和 Psl 具有多种功能,包括帮助初始附着和维持生物膜结构,以及赋予抗生素耐药性8。
已经为各种样品类型开发了旨在可视化组织体内结构的方法9,10,11。最近,它们被定制用于可视化 CF 患者痰液中的体内微生物群落12。DePas等人,2016年12开发了专门用于鉴定痰中微生物群落的组织清除方案的优化。术语 MiPACT 代表 Passive CLARITY technique 之后的 microbial i识别,用于清除 CF 痰液11,12。对于组织透明化技术,首先将标本固定,然后使其透明,同时保持其固有结构完好无损,以便进行染色和显微观察11。固定和清除CF痰液样本使研究人员能够回答与生物膜结构、细菌细胞密度、多种微生物关联以及病原体与宿主细胞之间的关联相关的问题。直接检查保存在痰液中的细菌的优点是可以在宿主特定的环境中对其进行分析和可视化。尽管在实验室中用于实验的临床分离株的体外生长可以提供非常丰富的信息,但这些方法无法完全重建CF肺环境,导致实验室结果与患者结果脱节。
这里介绍的方法可用于固定和清除痰液以可视化细菌,无论是来自 CF 患者还是患有其他呼吸道感染的患者。本文描述的染色和显微分析的具体类型是荧光 原位 杂交(FISH),然后在水凝胶内进行抗Psl抗体结合,然后通过共聚焦激光扫描显微镜(CLSM)进行分析。组织清除后,也可以应用其他免疫组化和显微镜方法。
研究方案
收集和储存人类受试者的痰液样本需要获得研究伦理委员会 (REB) 的批准。本文介绍的研究已获得病童医院 REB#1000058579 的批准。
1. 痰液收集
- 将咳出的痰液储存在无菌收集杯中,并在固定前立即在4°C下储存最多24小时。
注意:痰液在4°C下放置时间过长而不固定会导致细胞降解,特别是白细胞降解。最好尽快固定。 - 将痰液样本转移到无菌的 15 mL 管中。
- 向痰液样本中加入等体积的 4% 多聚甲醛 (PFA)。例如,如果痰液样本为 0.5 mL,则添加 0.5 mL 的 4% PFA。通过轻轻倒置混合。
- 将痰液在4°C孵育过夜。
- 通过向每 2 mL 固定痰液中加入 5 mL 磷酸盐缓冲盐水 (PBS) 来洗涤样品。
注意:此洗涤步骤不需要离心。 - 用移液管小心地除去上清液。
注意: 避免用移液器吸痰,将尖端远离痰液,然后非常缓慢地吸出表面液体。洗涤步骤不涉及离心,以免干扰痰塞的结构完整性。 - 再重复步骤 1.6-1.7 两次。
- 将沉淀重悬于含有0.01%(w / v)叠氮化钠的PBS体积的2倍中。
- 将痰液储存在4°C。
2. MiPACT痰液的处理
- 将水凝胶组分(30%29:1丙烯酰胺:双丙烯酰胺,硬化剂和PBS)在含有厌氧包装的密封容器中脱气72小时。
注意:厌氧包装和密封容器是必要的,因为氧气会抑制丙烯酰胺聚合。或者,可以通过在厌氧罩中执行此步骤、对密封容器施加真空或通过丙烯酰胺混合物鼓泡 N2 气体来去除氧气。- 将 2 mL 的 30% 29:1 丙烯酰胺:双丙烯酰胺溶液加入 15 mL 试管中,在密封的厌氧容器内取下盖子。
- 在 15 mL 试管中向 5 mL PBS 中加入 0.5 g 固化剂,制成 10% (w/v) 固化剂的浓缩原液。将盖子从管子上取下,存放在密封的厌氧容器中。
- 将几毫升无菌 PBS 留在厌氧容器内的试管中,盖上盖子。
- 在 15 mL 试管中制备 5 mL 水凝胶溶液,终浓度为 0.2% 固化剂和 4% 29:1 丙烯酰胺:双丙烯酰胺的 PBS 溶液。倒置混合并过滤灭菌。
- 从冰箱中取出痰液样本,然后在无菌条件下用手术刀切成小段(直径约5毫米)。
注意:如果痰液非常流动,那么仍然可以执行此步骤,但是,在使用手术刀分离所需部分之前,需要增加耐心和练习,用镊子从储存溶液中取出痰液。 - 将切割的痰液样品放入8室盖玻片的孔中。
- 将步骤2.2中的300μL过滤灭菌水凝胶溶液加入到每个含有痰液的孔中。
- 将8室盖玻片置于装有厌氧包的密封容器内,在37°C下放置3小时。
注:一旦聚合,嵌入痰液的水凝胶应为坚硬凝胶的稠度。 - 将固化的水凝胶痰液样品转移到含有5mL的8%十二烷基硫酸钠(SDS),pH 8的15mL培养管中,并让样品在37°C下清除3-14天(有或没有摇动),直到痰液变得透明。
注意:清除时间取决于痰液成分,通常可以通过摇晃来减少。但是,请注意不要将振荡速度提高到破坏样品完整性的程度。与富含粘液的样品相比,富含 DNA 的样品需要更长的时间才能清除。 - 将 8% SDS 溶液倒入废物收集容器中。使用无菌镊子将每个水凝胶包埋的样品转移到无菌 50 mL 锥形管中。向50mL锥形管中的每个管中加入10mL PBS以洗涤水凝胶,并在倾析前让溶液静置30分钟至1小时。重复此操作 2 次以上。
注意:此洗涤步骤不涉及离心。用移液管小心除去多余的液体和上清液。 - 将洗涤的样品储存在含有0.01%(w / v)叠氮化钠和1x RNase抑制剂的PBS中,温度为4°C。
3. 水凝胶荧光 原 位杂交(FISH)方案
- 使用无菌镊子从其储存溶液中取出水凝胶样品,并将样品放在无菌表面(如载玻片或培养皿)上。
- 使用无菌手术刀将水凝胶切成~1毫米厚的切片。
- 将 1 mm 水凝胶切片放入无菌 1.5 mL 管内。
- 在 1.5 mL 试管中制备 1 mL 杂交缓冲液(25% 甲酰胺、0.9 M NaCl、20 mM Tris-HCl [pH 7.6]、0.01% SDS、纯化和去离子化 H2O)。
- 将荧光标记的PseaerA探针(150.7nM12)加入杂交缓冲液中,并通过倒置混合。
注意:福尔马林溶液应远离明火。杂交缓冲液可以预先制备,并在-20°C13下以等分试样储存。 - 向每个~1mm水凝胶切片中加入200-500μL杂交缓冲液,并确保整个水凝胶样品浸没。
- 通过将PseaerA探针置于黑暗中~18-24小时,在46°C下不摇晃,使PseaerA探针与水凝胶样品杂交。
- 将杂交缓冲液倒入废物收集容器中。
- 通过向每个 1.5 mL 试管中加入 1 mL 洗涤缓冲液,然后将其取出,用过滤灭菌的洗涤缓冲液(337.5 mM NaCl、20 mM Tris-HCl、5 mM EDTA(乙二胺四乙酸)[pH 7.2]、0.01% SDS 和纯化和去离子的 H2O)冲洗样品一次。
注意:洗涤缓冲液可以提前制备并在室温 (RT) 下储存。 - 向试管中加入1mL新鲜洗涤缓冲液,然后将样品在48°C下在黑暗中孵育6小时,不要摇晃。
4. 水凝胶与Psl0096抗体结合
- 使用 1 mL 移液器无菌除去洗涤缓冲液。
- 通过加入和除去 1 mL 的 2% BSA 溶液,用 PBS 溶液中的 2% BSA (w/v) 冲洗样品。
- 向水凝胶样品中加入 500 μL 2% BSA/PBS 溶液以阻断非特异性蛋白结合。然后将样品在黑暗中在室温下孵育过夜,不要摇晃。
- 使用 1 mL 移液管无菌除去封闭溶液。
- 通过在 500 μL 新鲜的 2% BSA/PBS 中将抗体稀释至 0.112 μg/mL 的终浓度来制备 Psl0096-Texas Red 抗体溶液。
- 将 500 μL 抗体溶液加入水凝胶样品中,并在室温下孵育 6 小时,避光,不要摇晃。
5. DAPI(4′,6′-二脒基-2-苯基吲哚)染色
- 通过将 40 g 非离子密度梯度培养基、30 μL 吐温 20、3 μg 叠氮化钠和 30 mL PBS 加入到含有磁力搅拌棒的烧瓶中来制备折射率匹配溶液 (RIMS)。在磁力搅拌器上搅拌溶液15分钟,或直至完全溶解。
- 过滤 使用 10 mL 注射器和无菌 0.2 μm 过滤器将溶液灭菌到 50 mL 锥形管中。
注意:溶液可以在4°C下储存数月。 - 用无菌 1 mL 移液管取出 Psl0096-Texas Red 抗体溶液。
- 通过加入然后除去 1 mL PBS 冲洗水凝胶样品。
- 将水凝胶样品与 250 μL RIMS 溶液和 10 μg/mL DAPI 在室温下在室温下孵育,并在黑暗中轻轻摇动过夜。
- 在进行共聚焦成像之前,将样品安装到0.9 mm或1.7 mm灌注室上,并用玻璃盖玻片密封。
注:在 FISH 和/或免疫组化之后以及浸入 RIMS 之前,如果需要痰粘液的可视化,可以应用荧光凝集素染色12。
6. 影像学检查
- 使用标准技术以 25 倍、40 倍、63 倍或 100 倍放大倍率进行共聚焦激光扫描显微镜成像。
结果
实验的整体设计总结在图 1 和 图2中。 图 1 总结了痰液处理和痰液清除方案。痰液处理和清除可能需要长达 17 天的时间。但是,该方案可以停止,并且可以在用PFA固定(第2天)或组织清除后(第5-17天,取决于清除时间)后储存样品。 在图2中,总结了FISH和抗体结合方案。FISH 和抗体染色方案需要 4 天才能完成,但应在开始后完成并拍摄共聚焦图像。使用上述方案,可以获得 铜绿假单胞 菌细胞的高分辨率3D图像,并在痰液中可视化其原位结构。
清除痰液并随后应用该方案中使用的荧光染色剂允许在样品中详细观察 铜绿假单胞菌 。图 3 和 图 4 所示的痰液样本是从一名新发铜 绿假单胞 菌感染的小儿 CF 患者(17 岁)身上采集的。 在图3A中,在痰液样本中观察到细胞聚集体;黄绿色棒状物的出现是由于所有三个荧光团的重叠。虽然我们没有该痰液样本的细胞计数,但我们发现探针检测限为 104 个细胞/mL(参见 补充图 1)。 在图3B中,PseaerA-488探针与 铜绿假单胞菌 细胞的物种特异性结合以绿色显示单个杆状。红色显示的 Psl0096-Texas Red 抗体说明了假单胞菌胞外多糖在痰液中的位置;在这种情况下,Psl0096抗体似乎主要与 铜绿假单胞 菌细胞重叠(图3C)。该方法还允许可视化痰液中的假单胞菌细胞与其他细菌细胞和宿主结构的关系。 在图 4 中,可以看到一簇 铜绿假单 胞菌细胞在真核细胞内被吞噬,并在附近观察到其他小球菌细胞簇。已经证明,Psl0096抗体还可以与浮游铜 绿假单胞 菌产生的Psl结合(见 补充图2)。
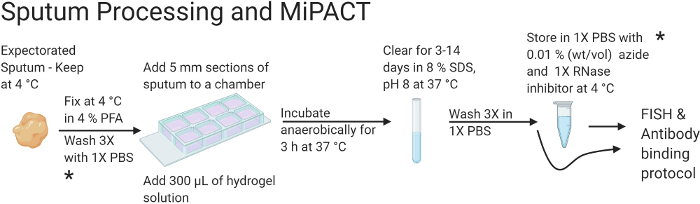
图 1:说明痰液处理和 MiPACT 协议的流程图。
总之,痰液在包埋在聚丙烯酰胺溶液中之前是固定的。清除后,水凝胶可以储存在4 °C或与FISH和抗体结合方案一起使用。本矢量图使用 BioRender.com 创作。 请点击这里查看此图的较大版本.
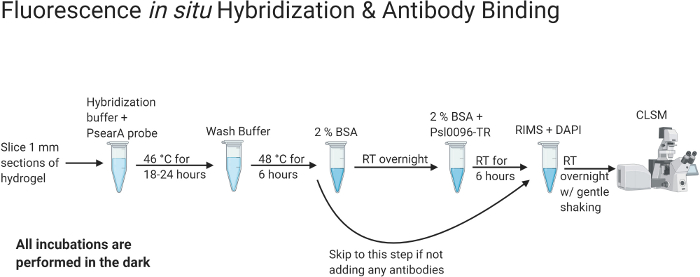
图 2:表示荧光 原 位杂交和抗体染色方案的流程图。
一旦痰液在水凝胶基质中完全清除,就可以应用染色方法。本矢量图使用 BioRender.com 创作。 请点击这里查看此图的较大版本.

图 3:从嵌入水凝胶基质的早期 铜绿假单胞菌 感染患者身上采集的痰液样本的免疫荧光图像。
将水凝胶样品与 PsearA-Alexa488 探针(绿色)、Psl0096-Texas Red 抗体(红色)和 DAPI(蓝色)杂交。(A) 在所有 3 个通道下观察的痰液样本,(B) 仅在指示 PseaerA-488 探针结合位置的绿色通道下观察痰液,以及 (C) 仅在发生 Psl0096-Texas 红色结合的红色通道下的痰液。图像以 100 倍放大倍率拍摄。 请点击这里查看此图的较大版本.

图 4:从嵌入水凝胶基质的早期 铜绿假单胞菌 感染患者身上采集的痰液样本的免疫荧光图像。
将水凝胶样品与 PsearA-Alexa488 探针(绿色)、Psl0096-Texas Red 抗体(红色)和 DAPI(蓝色)杂交。 请点击这里查看此图的较大版本.
补充图 1:PAO1 浮游培养物与 PseaerA-488 探针的荧光原位杂交。请点击这里下载此图。
补充图2:用DAPI和Psl0096-Texas Red抗体染色的铜绿假单胞菌。(A)菌株PAO1-Δpsl和(B)菌株PAO1。请点击这里下载此图。
讨论
该协议的目的是了解CF患者痰液中 铜绿假单胞菌 细胞的原位组织。痰液样本应储存在4°C,如果不能立即固定,则应进行处理。已经证明,如果在4°C下储存1小时,24小时或48小时处理,痰中的 铜绿假单胞菌 细胞数量不会显着变化,但如果在25°C下放置24或48小时,细菌细胞计数将由于细菌生长而显着增加14。对于这项研究,痰液样本在4°C下储存,吐痰后最多24小时。应该注意的是,如果保持在4°C并在9小时后处理超过15,则痰液中的炎症细胞计数已被证明会降低。因此,在决定样品处理的截止时间时,重要的是要考虑希望在痰液中可视化的特定细胞和标志物。
该方法中的样品处理始于将痰液样品固定在4%PFA中。多聚甲醛将交联细菌细胞及其细胞外基质,保留其结构以用于显微可视化和分析11,16。不幸的是,如果目的是获得痰液中某些炎症细胞的总细胞计数,PFA 已被证明会降低这些细胞的计数,因此应考虑使用其他固定剂17.这项研究的另一个局限性是它可能很耗时,可能需要两周以上的时间才能完成。因此,它可能不适合发展成一种需要时间敏感的治疗决策的诊断方法。此外,为了了解痰液样本中的总微生物多样性,该方法不适合,但可以与其他高通量微生物检测方法(如qPCR)配对使用。
丙烯酰胺水凝胶的组成可以根据组织类型和应用11而改变。对于不稳定的标本,如CF痰液,有必要用29:1的丙烯酰胺:双丙烯酰胺混合物(而不仅仅是丙烯酰胺)提供结构支撑。在水凝胶中加入多聚甲醛可以进一步稳定结构,但需要权衡更长的孵育时间,以允许探针和抗体扩散9。在水凝胶中添加甲醛还可以防止组织在清除过程中肿胀,如果这种效果是不希望的11.
目前的方法专门针对CF患者痰液中的铜绿假单胞菌细胞。可以考虑对该协议的替代方法和修改来指导其他细菌可视化的优化。通过应用物种和属特异性 FISH 和杂交链式反应 (HCR) 探针,可以鉴定其他 CF 病原体,例如金黄色葡萄球菌、链球菌属和木糖氧化无色杆菌12。在我们的研究中,我们靶向假单胞菌胞外多糖Psl。在未来的实验中,可以使用对这些胞外多糖具有特异性的荧光抗体来检查其他靶标,包括海藻酸盐或Pel。将 MiPACT 方法与 FISH 和抗体染色一起应用于 CLSM 需要几周时间才能完成。如果研究问题不涉及痰液的三维空间可视化,则有更快速的方法来可视化存在的细菌。以前用于可视化痰液样本中细菌的方法利用薄切片或涂片,包括:FISH18、革兰氏染色和免疫组织化学技术,这些技术应用一抗和复染剂来可视化生物膜胞外多糖和细菌细胞19,20。
这些类型的成像技术在未来有几种潜在的应用。可视化不同细菌生物体及其与宿主细胞(如吞噬细胞)相互作用的能力可能会进一步理解为什么某些 铜绿假单胞 菌菌株可以有效地从CF气道中清除,而其他菌株则不能。呼吸道标本中的细菌成像也可用作抗菌功效的衡量标准和新型抗生物膜药物的研究结果21。此外,可视化 铜绿假单胞菌 与CF肺微生物组内其他生物体(如 金黄色葡萄球菌)之间的空间关系可能有助于阐明合并感染/定植在肺部恶化发病机制中的作用,以及它们对抗生素治疗的反应。细菌的 体内 成像也可以应用于其他感染,包括呼吸机相关性肺炎或慢性伤口感染22。因此,所获得的见解可用于指导未来的治疗开发。
披露声明
没有。
致谢
作者要感谢为这项研究提供资金的囊性纤维化基金会和MedImmune慷慨捐赠的抗Psl0096抗体。在这项研究中,成像是在多伦多大学的CAMiLoD成像设施进行的。
材料
| Name | Company | Catalog Number | Comments |
| 29:1 acrylamide bisacrylamide, 30 % solution | BioRad | 161-0146 | |
| 8-Chambered Coverglass Nunc Lab-Tek | ThermoFischer Scientific | 155411 | |
| Anaerogen2.5L | Oxid Inc. | 35108 | |
| Coverwell perfusion chambers | Electron Microscopry Sciences | 70326 -12/-14 | |
| HistoDenz | Sigma | D2158 | |
| Protect RNA Rnase Inhibitor | Sigma | R7387 | |
| PseaerA - GGTAACCGTCCCCCTTGC | Eurofins | Order Details: Product: Modified DNA Oligo; Name: PseaerA; Sequence: [Alexa488]GGTAACCGTCCCCCTTGC; Synthesis: 50 nmol; Purification: HPLC; Ship state: Full yield (dry) | |
| Psl0096-Texas Red | Medimmune | The Psl0096-Texas red antibodies were a gift kindly provided by Medimmune and the company should be contacted for order inquiries. | |
| VA-044 Hardener | Wako | 27776-21-21 |
参考文献
- Banerjee, D., Stableforth, D. The treatment of respiratory pseudomonas infection in cystic fibrosis: What drug and which way. Drugs. 60 (5), 1053-1064 (2000).
- Rosenfeld, M., Ramsey, B. W., Gibson, R. L. Pseudomonas acquisition in young patients with cystic fibrosis: Pathophysiology, diagnosis, and management. Current Opinion in Pulmonary Medicine. 9 (6), 492-497 (2003).
- Ciofu, O., Tolker-Nielsen, T. Tolerance and Resistance of Pseudomonas aeruginosa Biofilms to Antimicrobial Agents-How P. aeruginosa Can Escape Antibiotics. Frontiers in Microbiology. 10, 913 (2019).
- Billings, N., et al. The Extracellular Matrix Component Psl Provides Fast-Acting Antibiotic Defense in Pseudomonas aeruginosa Biofilms. PLoS Pathogens. 9 (8), 1003526 (2013).
- Franklin, M. J., Nivens, D. E., Weadge, J. T., Lynne Howell, P. Biosynthesis of the Pseudomonas aeruginosa extracellular polysaccharides, alginate, Pel, and Psl. Frontiers in Microbiology. 2, 167 (2011).
- Yang, L., et al. Polysaccharides serve as scaffold of biofilms formed by mucoid Pseudomonas aeruginosa. FEMS Immunology and Medical Microbiology. 65 (2), 366-376 (2012).
- Wozniak, D. J., et al. Alginate is not a significant component of the extracellular polysaccharide matrix of PA14 and PAO1 Pseudomonas aeruginosa biofilms. Proceedings of the National Academy of Sciences of the United States of America. 100 (13), 7907-7912 (2003).
- Baker, P., et al. Exopolysaccharide biosynthetic glycoside hydrolases can be utilized to disrupt and prevent Pseudomonas aeruginosa biofilms. Science Advances. 2 (5), 1-9 (2016).
- Yang, B., et al. Single-cell phenotyping within transparent intact tissue through whole-body clearing. Cell. 158 (4), 945-958 (2014).
- Chung, K., et al. Structural and molecular interrogation of intact biological systems. Nature. 497 (7449), 332-337 (2013).
- Treweek, J. B., et al. Whole-body tissue stabilization and selective extractions via tissue-hydrogel hybrids for high-resolution intact circuit mapping and phenotyping. Nature Protocols. 10 (11), 1860-1896 (2015).
- DePas, W. H., et al. Exposing the three-dimensional biogeography and metabolic states of pathogens in cystic fibrosis sputum via hydrogel embedding, clearing, and rRNA labeling. mBio. 7 (5), 1-11 (2016).
- Murray, M. P., Doherty, C. J., Govan, J. R. W., Hill, A. T. Do processing time and storage of sputum influence quantitative bacteriology in bronchiectasis. Journal of Medical Microbiology. 59 (7), 829-833 (2010).
- Efthimiadis, A., Jayaram, L., Weston, S., Carruthers, S., Hargreave, F. E. Induced sputum: Time from expectoration to processing. European Respiratory Journal. 19 (4), 706-708 (2002).
- Chao, Y., Zhang, T. Optimization of fixation methods for observation of bacterial cell morphology and surface ultrastructures by atomic force microscopy. Applied Microbiology and Biotechnology. 92 (2), 381-392 (2011).
- St-Laurent, J., Boulay, M. E., Prince, P., Bissonnette, E., Boulet, L. P. Comparison of cell fixation methods of induced sputum specimens: An immunocytochemical analysis. Journal of Immunological Methods. 308 (1-2), 36-42 (2006).
- Hogardt, M., et al. Specific and rapid detection by fluorescent situ hybridization of bacteria in clinical samples obtained from cystic fibrosis patients. Journal of Clinical Microbiology. 38 (2), 818-825 (2000).
- Hoffmann, N., et al. Erratum: Novel mouse model of chronic Pseudomonas aeruginosa lung infection mimicking cystic fibrosis. Infection and Immunity. 73 (8), 5290 (2005).
- Nair, B., et al. Utility of Gram staining for evaluation of the quality of cystic fibrosis sputum samples. Journal of Clinical Microbiology. 40 (8), 2791-2794 (2002).
- Howlin, R. P., et al. Low-Dose Nitric Oxide as Targeted Anti-biofilm Adjunctive Therapy to Treat Chronic Pseudomonas aeruginosa Infection in Cystic Fibrosis. Molecular Therapy. 25 (9), 2104-2116 (2017).
- Pestrak, M. J., et al. Treatment with the Pseudomonas aeruginosa glycoside hydrolase PslG combats wound infection by improving antibiotic efficacy and host innate immune activity. Antimicrobial Agents and Chemotherapy. 63 (6), 00234 (2019).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。