Method Article
Visualizzazione di Pseudomonas aeruginosa all'interno dell'espettorato di pazienti affetti da fibrosi cistica
In questo articolo
Riepilogo
Questo protocollo fornisce metodi per la visualizzazione delle cellule batteriche e del polisaccaride del locus di sintesi dei polisaccaridi (Psl) all'interno dell'espettorato di pazienti affetti da fibrosi cistica.
Abstract
La diagnosi precoce e l'eradicazione di Pseudomonas aeruginosa nei polmoni dei pazienti affetti da fibrosi cistica possono ridurre la possibilità di sviluppare un'infezione cronica. Lo sviluppo di infezioni croniche da P. aeruginosa è associato a un declino della funzione polmonare e a un aumento della morbilità. Pertanto, c'è un grande interesse a chiarire le ragioni della mancata eradicazione di P. aeruginosa con la terapia antibiotica che si verifica in circa il 10-40% dei pazienti pediatrici. Uno dei molti fattori che possono influenzare la clearance dell'ospite di P. aeruginosa e la suscettibilità agli antibiotici sono le variazioni nell'organizzazione spaziale (come l'aggregazione o la formazione di biofilm) e nella produzione di polisaccaridi. Pertanto, eravamo interessati a visualizzare le caratteristiche in situ di P. aeruginosa all'interno dell'espettorato di pazienti con FC. Una tecnica di pulizia dei tessuti è stata applicata ai campioni di espettorato dopo aver incorporato i campioni in una matrice di idrogel per mantenere le strutture 3D relative alle cellule ospiti. Dopo la pulizia dei tessuti, sono state aggiunte etichette fluorescenti e coloranti per consentire la visualizzazione. L'ibridazione fluorescente in situ è stata eseguita per la visualizzazione di cellule batteriche, il legame di anticorpi anti-Psl marcati in modo fluorescente per la visualizzazione dell'esopolisaccaride e la colorazione DAPI per colorare le cellule ospiti per ottenere informazioni strutturali. Questi metodi hanno permesso l'imaging ad alta risoluzione di P. aeruginosa all'interno dell'espettorato di pazienti affetti da FC tramite microscopia confocale a scansione laser.
Introduzione
In questo studio, gli esperimenti sono stati progettati per visualizzare la struttura in vivo di Pseudomonas aeruginosa all'interno dell'espettorato di pazienti pediatrici affetti da fibrosi cistica (FC). Le infezioni da P. aeruginosa diventano croniche nel 30-40% della popolazione pediatrica FC; Una volta che le infezioni croniche si sono stabilite, sono quasi impossibili da eliminare1. Gli isolati di P. aeruginosa provenienti da pazienti con infezione precoce sono generalmente più suscettibili agli antimicrobici, pertanto vengono trattati con antibiotici anti-pseudomonali per prevenire l'instaurarsi di infezioni croniche2. Sfortunatamente, non tutti gli isolati di P. aeruginosa vengono eliminati efficacemente dal polmone dopo la terapia antibiotica. I meccanismi precisi associati al fallimento degli antibiotici non sono stati completamente chiariti. Studi precedenti hanno dimostrato che le variazioni nella densità cellulare del biofilm, nell'aggregazione e nella produzione di polisaccaridi possono influenzare l'efficacia degli antibiotici3. P. aeruginosa produce tre polisaccaridi extracellulari: Pel, Psl e alginato4. La maggior parte dei ceppi di P. aeruginosa ha la capacità genetica di esprimere ciascuno degli esopolisaccaridi, anche se spesso un tipo di polisaccaride è espresso prevalentemente5. L'alginato di esopolisaccaride è associato a infezioni croniche nel polmone FC, con conseguente fenotipomucoide 6,7. I polisaccaridi Pel e Psl hanno molteplici funzioni, tra cui aiutare l'attacco iniziale e il mantenimento della struttura del biofilm e conferire resistenza agli antibiotici8.
Sono stati sviluppati metodi volti a visualizzare in vivo le strutture dei tessuti per una varietà di tipi di campioni 9,10,11. Più recentemente, sono stati adattati per visualizzare le comunità microbiche in vivo all'interno dell'espettorato di pazienti con FC12. L'ottimizzazione di un protocollo di pulizia tissutale specifico per l'identificazione delle comunità microbiche all'interno dell'espettorato è stata sviluppata da DePas et al., 201612. Il termine MiPACT, che sta per identificazione microbiale dopo la tecnica di Passive CLARITY, è stato coniato per la rimozione dell'espettorato FC11,12. Per le tecniche di purificazione dei tessuti, i campioni vengono prima fissati, quindi resi trasparenti, lasciando intatta la loro architettura intrinseca per la colorazione e la visualizzazione microscopica11. La fissazione e la cancellazione dei campioni di espettorato FC consentono ai ricercatori di rispondere a domande relative alla struttura del biofilm, alla densità delle cellule batteriche, alle associazioni polimicrobiche e alle associazioni tra agenti patogeni e cellule ospiti. Il vantaggio di esaminare direttamente i batteri che sono stati conservati all'interno dell'espettorato è che possono essere analizzati e visualizzati in un contesto specifico dell'ospite. Sebbene la crescita in vitro di isolati clinici in laboratorio per la sperimentazione possa essere molto istruttiva, tali metodi non sono in grado di ricreare completamente l'ambiente polmonare della fibrosi cistica, con conseguente disconnessione tra i risultati di laboratorio e gli esiti dei pazienti.
I metodi qui presentati possono essere utilizzati per fissare e liberare l'espettorato per visualizzare i batteri, sia di pazienti FC che di pazienti con altre infezioni respiratorie. Il tipo specifico di colorazione e analisi microscopica qui descritto è l'ibridazione fluorescente in situ (FISH), seguita dal legame anti-Psl-anticorpo all'interno dell'idrogel e dalla successiva analisi tramite microscopia a scansione laser confocale (CLSM). Dopo la pulizia dei tessuti, possono essere applicati anche altri metodi di immunoistochimica e microscopia.
Protocollo
Per raccogliere e conservare campioni di espettorato da soggetti umani è necessaria l'approvazione del Research Ethics Board (REB). Gli studi qui presentati sono stati approvati dall'Hospital for Sick Children REB#1000058579.
1. Raccolta dell'espettorato
- Conservare l'espettorato espettorato in una coppetta sterile e conservare immediatamente a 4 °C per un massimo di 24 ore prima della fissazione.
NOTA: Lasciare l'espettorato troppo a lungo a 4 °C senza fissazione può portare alla degradazione cellulare, in particolare alla degradazione dei globuli bianchi. È preferibile fissarlo il prima possibile. - Trasferire i campioni di espettorato in una provetta sterile da 15 ml.
- Aggiungere un volume uguale di paraformaldeide (PFA) al 4% ai campioni di espettorato. Ad esempio, se il campione di espettorato è di 0,5 mL, aggiungere 0,5 mL di PFA al 4%. Mescolare con leggera inversione.
- Incubare l'espettorato per una notte a 4 °C.
- Lavare il campione aggiungendo 5 mL di soluzione salina tamponata con fosfato (PBS) a ogni 2 mL di espettorato fisso.
NOTA: Non è necessaria alcuna centrifugazione per questa fase di lavaggio. - Rimuovere con cautela il surnatante con una pipetta.
NOTA: Evitare di aspirare l'espettorato con la pipetta puntando la punta lontano dall'espettorato e aspirare molto lentamente il liquido superficiale. La fase di lavaggio non prevede centrifugazione per non disturbare l'integrità strutturale dei tappi di espettorato. - Ripetere i passaggi 1.6-1.7 altre due volte.
- Risospendere il pellet in 2 volte il volume del PBS con lo 0,01 % (p/v) di sodio azide.
- Conservare l'espettorato a 4 °C.
2. MiPACT (tecnica di pulizia dei tessuti) trattamento dell'espettorato
- Degassare i componenti dell'idrogel (30% acrilammide 29:1: bis-acrilammide, indurente e PBS) in un contenitore sigillato contenente un impacco anaerobico prima per 72 ore.
NOTA: Il pacchetto anaerobico e il contenitore sigillato sono necessari perché l'ossigeno inibisce la polimerizzazione dell'acrilammide. In alternativa, l'ossigeno può essere rimosso eseguendo questo passaggio in una cappa anaerobica, applicando un vuoto a un contenitore sigillato o facendo gorgogliare il gas N2 attraverso la miscela di acrilammide.- Aggiungere 2 mL di una soluzione di acrilammide:bis-acrilammide 29:1 al 30% in una provetta da 15 mL senza tappo all'interno del contenitore anaerobico sigillato.
- Preparare un impasto concentrato di indurente al 10% (p/v) aggiungendo 0,5 g di indurente a 5 mL di PBS in una provetta da 15 mL. Lasciare il tappo staccato dal tubo e conservare nel contenitore anaerobico sigillato.
- Lasciare alcuni ml di PBS sterile in una provetta, senza tappo, all'interno del contenitore anaerobico.
- Preparare una soluzione di 5 mL di idrogel con una concentrazione finale di indurente allo 0,2% e 4% di acrilammide:bis-acrilammide 29:1 in PBS in una provetta da 15 mL. Miscelare per inversione e sterilizzare con filtro.
- Rimuovere i campioni di espettorato dal frigorifero, quindi tagliarli in piccole sezioni (circa 5 mm di diametro) in condizioni sterili con un bisturi.
NOTA: Se l'espettorato è abbastanza fluido, questo passaggio può ancora essere eseguito, tuttavia, ci vuole maggiore pazienza e pratica per rimuovere l'espettorato dalla soluzione di conservazione con una pinzetta prima di utilizzare il bisturi per separare le frazioni desiderate. - Posizionare i campioni di espettorato tagliati all'interno di un pozzetto di un vetrino di copertura a 8 camere.
- Aggiungere 300 μL di soluzione di idrogel sterilizzata con filtro della fase 2.2 a ciascuno dei pozzetti che contengono espettorato.
- Collocare il coperchio a 8 camere all'interno di un contenitore sigillato contenente un impacco anaerobico per 3 ore a 37 °C.
NOTA: Una volta polimerizzato, l'idrogel con l'espettorato incorporato dovrebbe avere la consistenza di un gel solido. - Trasferire i campioni di espettorato di idrogel solidificato in una provetta di coltura da 15 mL contenente 5 mL di sodio dodecil solfato (SDS) all'8%, pH 8, e lasciare che i campioni si chiariscano per 3-14 giorni a 37 °C (con o senza agitazione), fino a quando l'espettorato diventa trasparente.
NOTA: I tempi di pulizia dipendono dalla composizione dell'espettorato e generalmente possono essere ridotti con l'agitazione. Tuttavia, fare attenzione a non aumentare la velocità di agitazione fino al punto di interrompere l'integrità del campione. I campioni più ricchi di DNA richiedono più tempo per essere eliminati rispetto ai campioni ricchi di muco. - Travasare la soluzione SDS all'8% in un contenitore per la raccolta dei rifiuti. Utilizzando una pinzetta sterile, trasferire ogni campione incorporato in idrogel in una provetta conica sterile da 50 ml. Aggiungere 10 mL di PBS a ciascuna delle provette coniche da 50 mL per lavare gli idrogel e lasciare riposare la soluzione per 30 minuti a 1 ora prima di travasare. Ripeti l'operazione altre 2 volte.
NOTA: Questa fase di lavaggio non prevede centrifugazione. Il liquido in eccesso e il surnatante vengono accuratamente rimossi con una pipetta. - Conservare i campioni lavati in PBS con sodio azide allo 0,01% (p/v) e 1x inibitore della RNasi a 4 °C.
3. Protocollo di ibridazione in situ fluorescente idrogel (FISH)
- Rimuovere i campioni di idrogel dalla soluzione di conservazione utilizzando una pinzetta sterile e posizionare i campioni su una superficie sterile (come un vetrino o una capsula di Petri).
- Utilizzando un bisturi sterile, tagliare gli idrogel in fette spesse ~ 1 mm.
- Posizionare le sezioni di idrogel da 1 mm all'interno di provette sterili da 1,5 mL.
- Preparare 1 mL di tampone di ibridazione (25% di formammide, 0,9 M NaCl, 20 mM di Tris-HCl [pH 7,6], 0,01% di SDS, H2O purificato e deionizzato) in una provetta da 1,5 mL.
- Aggiungere la sonda PseaerA marcata con fluorescenza (150,7 nM12) al tampone di ibridazione e miscelare per inversione.
NOTA: La soluzione di formalina deve essere tenuta lontana da fiamme libere. Il tampone di ibridazione può essere preparato in anticipo e conservato in aliquote a -20 °C13. - Aggiungere 200-500 μL di tampone di ibridazione a ciascuna sezione di ~1 mm di idrogel e assicurarsi che l'intero campione di idrogel sia immerso.
- Consentire alla sonda PseaerA di ibridarsi con i campioni di idrogel mettendoli al buio per ~ 18-24 h, a 46 °C, senza agitare.
- Travasare il tampone di ibridazione in un contenitore per la raccolta dei rifiuti.
- Sciacquare i campioni una volta con tampone di lavaggio sterilizzato con filtro (337,5 mM NaCl, 20 mM Tris-HCl, 5 mM EDTA (acido etilendiamminotetraacetico) [pH 7,2], 0,01% SDS e H2O purificato e deionizzato) aggiungendo 1 mL di tampone di lavaggio a ciascuna delle provette da 1,5 mL e quindi rimuoverlo.
NOTA: Il tampone di lavaggio può essere preparato in anticipo e conservato a temperatura ambiente (RT). - Aggiungere 1 mL di tampone di lavaggio fresco alle provette, quindi incubare i campioni al buio per 6 ore a 48 °C, senza agitare.
4. Idrogel e legame anticorpale Psl0096
- Rimuovere sterilmente il tampone di lavaggio utilizzando un pipettitore da 1 ml.
- Sciacquare i campioni con una soluzione di BSA al 2% (p/v) in PBS aggiungendo e rimuovendo 1 mL di soluzione di BSA al 2%.
- Aggiungere 500 μL della soluzione BSA/PBS al 2% ai campioni di idrogel per bloccare il legame proteico non specifico. Quindi incubare i campioni per una notte, al buio, a RT, senza agitare.
- Rimuovere sterilmente la soluzione bloccante utilizzando una pipetta da 1 ml.
- Preparare la soluzione di anticorpi Psl0096-Texas Red diluendo l'anticorpo a una concentrazione finale di 0,112 μg/mL in 500 μL di BSA/PBS fresco al 2%.
- Aggiungere la soluzione anticorpale da 500 μL ai campioni di idrogel e incubarli a RT per 6 ore, al riparo dalla luce, senza agitare.
5. Colorazione DAPI (4′,6′-diamidino-2-fenilindolo)
- Preparare la soluzione di corrispondenza dell'indice di rifrazione (RIMS) aggiungendo 40 g di mezzo a gradiente di densità non ionica, 30 μL di Tween20, 3 μg di sodio azide e 30 mL di PBS a un matraccio contenente un'ancoretta magnetica. Agitare la soluzione per 15 minuti su un agitatore magnetico o fino a completa dissoluzione.
- Filtro: sterilizzare la soluzione in una provetta conica da 50 mL utilizzando una siringa da 10 mL e un filtro sterile da 0,2 μm.
NOTA: La soluzione può essere conservata a 4 °C per diversi mesi. - Rimuovere la soluzione di anticorpi Psl0096-Texas Red con una pipetta sterile da 1 mL.
- Sciacquare i campioni di idrogel aggiungendo e rimuovendo 1 ml di PBS.
- Incubare i campioni di idrogel con 250 μL di soluzione RIMS e 10 μg/mL di DAPI a RT agitando delicatamente, al buio, durante la notte.
- Prima dell'imaging confocale, montare i campioni su camere di perfusione da 0,9 mm o 1,7 mm e sigillare con un vetrino coprioggetto.
NOTA: Dopo la FISH e/o l'immunoistochimica e prima dell'immersione in RIMS, è possibile applicare colorazioni fluorescenti di lectina se si desidera visualizzare la mucosa dell'espettorato12.
6. Imaging
- Eseguire l'imaging al microscopio a scansione laser confocale utilizzando tecniche standard con ingrandimenti 25x, 40x, 63x o 100x.
Risultati
Il disegno generale dell'esperimento è riassunto nella Figura 1 e nella Figura 2. La Figura 1 fornisce un riepilogo dei protocolli di elaborazione e di eliminazione dell'espettorato. L'elaborazione e la rimozione dell'espettorato possono richiedere fino a 17 giorni. Tuttavia, il protocollo può essere interrotto e i campioni possono essere conservati dopo la fissazione con PFA (giorno 2) o dopo la pulizia dei tessuti (giorni 5-17 a seconda del tempo di eliminazione). Nella Figura 2 sono riassunti i protocolli di FISH e di legame degli anticorpi. I protocolli di colorazione FISH e anticorpale richiedono 4 giorni per essere completati, ma dovrebbero essere completati e le immagini confocali acquisite una volta avviate. Utilizzando i protocolli di cui sopra, è possibile ottenere immagini 3D ad alta risoluzione delle cellule di P. aeruginosa con la loro struttura in situ all'interno dell'espettorato visualizzata.
La rimozione dell'espettorato e la successiva applicazione dei coloranti fluorescenti utilizzati in questo protocollo consentono una visualizzazione dettagliata di P. aeruginosa all'interno dei campioni. I campioni di espettorato mostrati nella Figura 3 e nella Figura 4 sono stati raccolti da un paziente pediatrico FC (17 anni) con un'infezione da P. aeruginosa di nuova insorgenza. Nella Figura 3A, è stato osservato un aggregato di cellule all'interno di un campione di espettorato; L'aspetto dei bastoncelli verde-giallastri era dovuto alla sovrapposizione di tutti e tre i fluorofori. Sebbene non disponiamo di conta cellulare per questo campione di espettorato, abbiamo riscontrato che il limite di rilevamento della sonda è di 104 cellule/mL (vedere la Figura 1 supplementare). Nella Figura 3B, le singole forme dei bastoncelli sono state osservate in verde dal legame specie-specifico della sonda PseaerA-488 alle cellule di P. aeruginosa. L'anticorpo Psl0096-Texas Red visto in rosso illustra dove si trovava l'esopolisaccaride pseudomonale all'interno dell'espettorato; in questo caso l'anticorpo Psl0096 sembrava sovrapporsi principalmente alle cellule di P. aeruginosa (Figura 3C). Questo metodo ha anche permesso la visualizzazione delle cellule pseudomonali all'interno dell'espettorato in relazione ad altre cellule batteriche e strutture ospiti. Nella Figura 4, un gruppo di cellule di P. aeruginosa è stato visto fagocitosa all'interno di una cellula eucariotica e altri piccoli gruppi di cellule cocciche sono stati osservati nelle vicinanze. È stato dimostrato che l'anticorpo Psl0096 può anche legarsi alla Psl prodotta da P. aeruginosa planctonica (vedi Figura 2 supplementare).
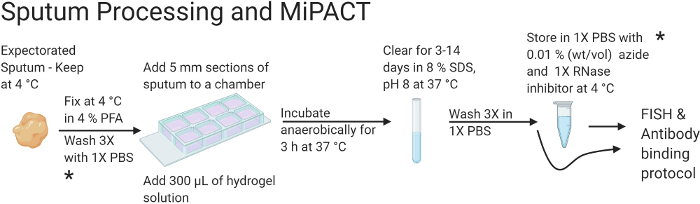
Figura 1: Diagramma di flusso che illustra il trattamento dell'espettorato e i protocolli MiPACT.
In sintesi, l'espettorato viene fissato prima di essere incorporato in una soluzione di poliacrilammide. Una volta eliminato, l'idrogel può essere conservato a 4 °C o utilizzato con il protocollo FISH e di legame degli anticorpi. Questa immagine è stata creata con BioRender.com. Fare clic qui per visualizzare una versione più grande di questa figura.
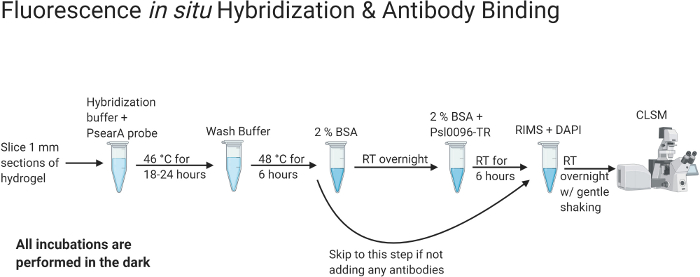
Figura 2: Diagramma di flusso che indica i protocolli di ibridazione fluorescente in situ e colorazione degli anticorpi.
Una volta che l'espettorato si è completamente eliminato all'interno della matrice di idrogel, è possibile applicare metodi di colorazione. Questa immagine è stata creata con BioRender.com. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 3: Immagine in immunofluorescenza di un campione di espettorato raccolto da un paziente con un'infezione precoce da P. aeruginosa incorporata in una matrice di idrogel.
Il campione di idrogel è stato ibridato con una sonda PsearA-Alexa488 (verde), un anticorpo Psl0096-Texas Red (rosso) e DAPI (blu). (A) campione di espettorato visualizzato sotto tutti e 3 i canali, (B) espettorato solo sotto il canale verde che indica dove si è legata la sonda PseaerA-488 e (C) espettorato solo sotto il canale rosso dove si è verificato il legame rosso Psl0096-Texas. Le immagini sono state scattate con un ingrandimento di 100x. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 4: Immagine a immunofluorescenza di un campione di espettorato raccolto da un paziente con un'infezione precoce da P. aeruginosa incorporata in una matrice di idrogel.
Il campione di idrogel è stato ibridato con una sonda PsearA-Alexa488 (verde), un anticorpo Psl0096-Texas Red (rosso) e DAPI (blu). Fare clic qui per visualizzare una versione più grande di questa figura.
Figura supplementare 1: Ibridazione in situ a fluorescenza di una coltura planctonica di PAO1 con la sonda PseaerA-488. Clicca qui per scaricare questa figura.
Figura 2 supplementare: P. aeruginosa colorata con DAPI e l'anticorpo Psl0096-Texas Red. (A) ceppo PAO1-Δpsl e (B) ceppo PAO1. Clicca qui per scaricare questa figura.
Discussione
Lo scopo di questo protocollo è quello di consentire uno sguardo sull'organizzazione in situ delle cellule di P. aeruginosa nell'espettorato di pazienti con fibrosi cistica. I campioni di espettorato devono essere conservati a 4 °C fino al momento dell'elaborazione, se non possono essere fissati immediatamente. È stato dimostrato che il numero di cellule di P. aeruginosa nell'espettorato non cambia in modo significativo se processato a 1 ora, 24 ore o 48 ore, se conservato a 4 °C, anche se lasciato a 25 °C per 24 o 48 ore, la conta delle cellule batteriche aumenterà significativamente a seguito della crescita batterica14. Per questo studio, i campioni di espettorato sono stati conservati a 4 °C fino a un massimo di 24 ore dopo l'espettorazione. Va notato che è stato dimostrato che la conta delle cellule infiammatorie diminuisce nell'espettorato se lasciata a 4 °C ed elaborata più di 9 ore dopo15. Pertanto, è importante considerare le cellule e i marcatori specifici che si desidera visualizzare nell'espettorato quando si decide un tempo limite per l'elaborazione del campione.
L'elaborazione dei campioni con questo metodo inizia con la fissazione dei campioni di espettorato in PFA al 4 %. La paraformaldeide reticolerà le cellule batteriche e la loro matrice extracellulare, preservando le loro strutture per la visualizzazione e l'analisi microscopica11,16. Sfortunatamente, se l'obiettivo è quello di ottenere la conta cellulare totale su alcune cellule infiammatorie nell'espettorato, è stato dimostrato che la PFA riduce la conta di queste cellule, quindi dovrebbero essere presi in considerazione altri fissativi17. Un'altra limitazione di questo studio è che può richiedere molto tempo e può richiedere più di due settimane per essere eseguito. Pertanto, potrebbe non essere adatto per lo sviluppo in un metodo diagnostico che richiede decisioni terapeutiche sensibili al fattore tempo. Inoltre, per comprendere la diversità microbica totale all'interno dei campioni di espettorato, questo metodo non sarebbe adatto, ma potrebbe essere abbinato ad altri metodi di rilevamento microbico ad alto rendimento come la qPCR.
La composizione dell'idrogel di acrilammide può essere modificata a seconda del tipo di tessuto e dell'applicazione11. Per campioni instabili come l'espettorato CF, è necessario fornire un supporto strutturale con una miscela acrilammide:bis-acrilammide 29:1 (invece della sola acrilammide). L'inclusione di paraformaldeide nell'idrogel può stabilizzare ulteriormente la struttura, con il compromesso di tempi di incubazione più lunghi per consentire la diffusione di sonde e anticorpi9. L'aggiunta di formaldeide all'idrogel può anche prevenire il gonfiore dei tessuti durante il processo di purificazione se tale effetto è indesiderato11.
Il metodo attuale si rivolge specificamente alle cellule di P. aeruginosa all'interno dell'espettorato dei pazienti affetti da fibrosi cistica. Metodi alternativi e modifiche a questo protocollo possono essere presi in considerazione per guidare l'ottimizzazione della visualizzazione di altri batteri. Applicando FISH e sonde di reazione a catena di ibridazione (HCR) specifiche per specie e genere, è possibile identificare altri patogeni FC come Staphylococcus aureus, Streptococcus sp. e Achromobacter xilosoxidans 12. Nel nostro studio, abbiamo preso di mira l'esopolisaccaride pseudomonale Psl. Altri bersagli, tra cui l'alginato o il Pel, possono essere esaminati con anticorpi fluorescenti specifici per questi esopolisaccaridi in esperimenti futuri. L'applicazione del metodo MiPACT insieme alla FISH e alla colorazione degli anticorpi per il CLSM richiede un paio di settimane per essere completata. Se la domanda di ricerca non riguarda la visualizzazione spaziale tridimensionale dell'espettorato, esistono metodi più rapidi per visualizzare i batteri presenti. I metodi precedenti utilizzati per visualizzare i batteri all'interno dei campioni di espettorato utilizzano il sezionamento sottile o lo striscio e includono: FISH18, colorazione di Gram e tecniche di immunoistochimica che applicano anticorpi primari e controcolorazioni per consentire la visualizzazione di esopolisaccaridi del biofilm e cellule batteriche 19,20.
Ci sono diverse potenziali applicazioni future di questi tipi di tecniche di imaging. La capacità di visualizzare diversi organismi batterici e la loro interazione con le cellule ospiti, come i fagociti, può migliorare la nostra comprensione del motivo per cui alcuni ceppi di P. aeruginosa vengono efficacemente eliminati dalle vie aeree della fibrosi cistica, mentre altri ceppi non lo sono. L'imaging dei batteri all'interno di campioni respiratori può anche essere utilizzato come misura dell'efficacia antimicrobica e come risultato di uno studio per nuovi farmaci anti-biofilm21. Inoltre, la visualizzazione della relazione spaziale tra P. aeruginosa e altri organismi all'interno del microbioma polmonare FC, come lo Staphylococcus aureus, può aiutare a chiarire il ruolo della co-infezione/colonizzazione nella patogenesi delle esacerbazioni polmonari e la loro risposta al trattamento antibiotico. L'imaging in vivo dei batteri può essere applicato anche ad altre infezioni, comprese quelle con polmonite associata al ventilatore o infezioni cronichedelle ferite 22. Le conoscenze acquisite possono quindi essere utilizzate per guidare lo sviluppo terapeutico futuro.
Divulgazioni
Nessuno.
Riconoscimenti
Gli autori desiderano ringraziare la Cystic Fibrosis Foundation che ha finanziato questa ricerca e MedImmune per la loro generosa donazione di anticorpi anti-Psl0096. Per questo studio l'imaging è stato eseguito presso la struttura di imaging CAMiLoD dell'Università di Toronto.
Materiali
| Name | Company | Catalog Number | Comments |
| 29:1 acrylamide bisacrylamide, 30 % solution | BioRad | 161-0146 | |
| 8-Chambered Coverglass Nunc Lab-Tek | ThermoFischer Scientific | 155411 | |
| Anaerogen2.5L | Oxid Inc. | 35108 | |
| Coverwell perfusion chambers | Electron Microscopry Sciences | 70326 -12/-14 | |
| HistoDenz | Sigma | D2158 | |
| Protect RNA Rnase Inhibitor | Sigma | R7387 | |
| PseaerA - GGTAACCGTCCCCCTTGC | Eurofins | Order Details: Product: Modified DNA Oligo; Name: PseaerA; Sequence: [Alexa488]GGTAACCGTCCCCCTTGC; Synthesis: 50 nmol; Purification: HPLC; Ship state: Full yield (dry) | |
| Psl0096-Texas Red | Medimmune | The Psl0096-Texas red antibodies were a gift kindly provided by Medimmune and the company should be contacted for order inquiries. | |
| VA-044 Hardener | Wako | 27776-21-21 |
Riferimenti
- Banerjee, D., Stableforth, D. The treatment of respiratory pseudomonas infection in cystic fibrosis: What drug and which way. Drugs. 60 (5), 1053-1064 (2000).
- Rosenfeld, M., Ramsey, B. W., Gibson, R. L. Pseudomonas acquisition in young patients with cystic fibrosis: Pathophysiology, diagnosis, and management. Current Opinion in Pulmonary Medicine. 9 (6), 492-497 (2003).
- Ciofu, O., Tolker-Nielsen, T. Tolerance and Resistance of Pseudomonas aeruginosa Biofilms to Antimicrobial Agents-How P. aeruginosa Can Escape Antibiotics. Frontiers in Microbiology. 10, 913(2019).
- Billings, N., et al. The Extracellular Matrix Component Psl Provides Fast-Acting Antibiotic Defense in Pseudomonas aeruginosa Biofilms. PLoS Pathogens. 9 (8), 1003526(2013).
- Franklin, M. J., Nivens, D. E., Weadge, J. T., Lynne Howell, P. Biosynthesis of the Pseudomonas aeruginosa extracellular polysaccharides, alginate, Pel, and Psl. Frontiers in Microbiology. 2, 167(2011).
- Yang, L., et al. Polysaccharides serve as scaffold of biofilms formed by mucoid Pseudomonas aeruginosa. FEMS Immunology and Medical Microbiology. 65 (2), 366-376 (2012).
- Wozniak, D. J., et al. Alginate is not a significant component of the extracellular polysaccharide matrix of PA14 and PAO1 Pseudomonas aeruginosa biofilms. Proceedings of the National Academy of Sciences of the United States of America. 100 (13), 7907-7912 (2003).
- Baker, P., et al. Exopolysaccharide biosynthetic glycoside hydrolases can be utilized to disrupt and prevent Pseudomonas aeruginosa biofilms. Science Advances. 2 (5), 1-9 (2016).
- Yang, B., et al. Single-cell phenotyping within transparent intact tissue through whole-body clearing. Cell. 158 (4), 945-958 (2014).
- Chung, K., et al. Structural and molecular interrogation of intact biological systems. Nature. 497 (7449), 332-337 (2013).
- Treweek, J. B., et al. Whole-body tissue stabilization and selective extractions via tissue-hydrogel hybrids for high-resolution intact circuit mapping and phenotyping. Nature Protocols. 10 (11), 1860-1896 (2015).
- DePas, W. H., et al. Exposing the three-dimensional biogeography and metabolic states of pathogens in cystic fibrosis sputum via hydrogel embedding, clearing, and rRNA labeling. mBio. 7 (5), 1-11 (2016).
- Molecular Instruments HCR v3.0 protocol for bacteria in suspension. , Available from: www.molecularinstruments.com 1-6 (2019).
- Murray, M. P., Doherty, C. J., Govan, J. R. W., Hill, A. T. Do processing time and storage of sputum influence quantitative bacteriology in bronchiectasis. Journal of Medical Microbiology. 59 (7), 829-833 (2010).
- Efthimiadis, A., Jayaram, L., Weston, S., Carruthers, S., Hargreave, F. E. Induced sputum: Time from expectoration to processing. European Respiratory Journal. 19 (4), 706-708 (2002).
- Chao, Y., Zhang, T. Optimization of fixation methods for observation of bacterial cell morphology and surface ultrastructures by atomic force microscopy. Applied Microbiology and Biotechnology. 92 (2), 381-392 (2011).
- St-Laurent, J., Boulay, M. E., Prince, P., Bissonnette, E., Boulet, L. P. Comparison of cell fixation methods of induced sputum specimens: An immunocytochemical analysis. Journal of Immunological Methods. 308 (1-2), 36-42 (2006).
- Hogardt, M., et al. Specific and rapid detection by fluorescent situ hybridization of bacteria in clinical samples obtained from cystic fibrosis patients. Journal of Clinical Microbiology. 38 (2), 818-825 (2000).
- Hoffmann, N., et al. Erratum: Novel mouse model of chronic Pseudomonas aeruginosa lung infection mimicking cystic fibrosis. Infection and Immunity. 73 (8), 5290(2005).
- Nair, B., et al. Utility of Gram staining for evaluation of the quality of cystic fibrosis sputum samples. Journal of Clinical Microbiology. 40 (8), 2791-2794 (2002).
- Howlin, R. P., et al. Low-Dose Nitric Oxide as Targeted Anti-biofilm Adjunctive Therapy to Treat Chronic Pseudomonas aeruginosa Infection in Cystic Fibrosis. Molecular Therapy. 25 (9), 2104-2116 (2017).
- Pestrak, M. J., et al. Treatment with the Pseudomonas aeruginosa glycoside hydrolase PslG combats wound infection by improving antibiotic efficacy and host innate immune activity. Antimicrobial Agents and Chemotherapy. 63 (6), 00234(2019).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon