Method Article
Em Utero Eletroporation de Marcadores de Cor Multiaddressable (MAGIC) para Individualizar Astrócitos de Ratos Cortical
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Os astrócitos ladrilho o córtex cerebral uniformemente, tornando a análise de sua morfologia complexa desafiadora a nível celular. O protocolo aqui fornecido usa rotulagem multicolorida baseada na eletroporação uterónica para destacar os astrócitos corticais e analisar seu volume e morfologia com um pipeline de análise de imagem fácil de usar.
Resumo
Os astrócitos protoplasmáticos (ARP) localizados no córtex cerebral do rato são fortemente justtaposed, formando uma matriz tridimensional aparentemente contínua em estágios adultos. Até agora, nenhuma estratégia de imunossuagem pode desopara-los e segmentar sua morfologia em animais maduros e ao longo da corticogênese. A PrA cortical é originária de progenitores localizados no pálio dorsal e pode ser facilmente direcionada usando na eletroporação uterótica de vetores integrativos. Um protocolo é apresentado aqui para rotular essas células com a estratégia de marcadores de cor multiadaturar genomas (MAGIC), que conta com transposição piggyBac/Tol2 e recombinaçãocre/lox para expressar estochasticamente proteínas fluorescentes distintas (azul, ciano, amarelo e vermelho) dirigidas a compartimentos subcelulares específicos. Esta estratégia de mapeamento de destino multicolorido permite marcar em locais progenitores cortical próximos com combinações de marcadores de cor antes do início da gliogênese e rastrear seus descendentes, incluindo astrócitos, de estágios embrionários a adultos no nível celular individual. A rotulagem semi-esparsa obtida pelo ajuste da concentração de vetores eletroporados e contrastes de cores fornecidos pelos Marcadores de Cores Multiadutáveis (Marcadores MÁGICOs ou MM) permitem individualizar os astrócitos e destacar seu território e morfologia complexa, apesar de seu denso arranjo anatômico. Apresentado aqui está um fluxo de trabalho experimental abrangente, incluindo os detalhes do procedimento de eletroporação, aquisição de pilhas de imagens multicanais por microscopia confocal e segmentação tridimensional assistida por computador que permitirá ao experimentador avaliar o volume e a morfologia individuais da RPA. Em resumo, a eletroporação de Marcadores MÁGICOs fornece um método conveniente para rotular individualmente numerosos astrócitos e ter acesso às suas características anatômicas em diferentes estágios de desenvolvimento. Esta técnica será útil para analisar propriedades morfológicas de astrócito cortical em vários modelos de camundongos sem recorrer a cruzes complexas com linhas de repórter transgênicas.
Introdução
Os astrócitos desempenham inúmeras funções vitais no desenvolvimento cerebral e fisiologia1. Além de seu papel na barreira hemencefálica onde regulam a absorção de nutrientes e o fluxo sanguíneo, eles contribuem ativamente para a formação e função da sinapse, produzindo neuromoduladores que podem alterar a atividade neuronal e o comportamento2. Além disso, a disfunção astrócito contribui para uma variedade de distúrbios neurológicos3. Astrócitos localizados no córtex cerebral exibem uma morfologia elaborada permitindo um contato extensivo com processos neuronais. Esses contatos, essenciais para a função do circuito, também controlam morfogênese de astrócito e sinápgeno através das proteínas de adesão celular4. Neurocientistas precisam de ferramentas convenientes e robustas para investigar o desenvolvimento de astrócitos e morfogênese em seus modelos neurológicos de interesse. No entanto, devido à aposição próxima de astrócitos aos seus vizinhos e seu uniforme azulejo tridimensional, é desafiador destacar os astrócitos corticais e avaliar integralmente sua morfologia usando imunomarcadores.
Atualmente, duas principais estratégias de engenharia genética permitem a rotulagem e individualização de astrócitos corticais in situ: ativação esparsa de repórteres em linhas de camundongos transgênicos ou transgênese somática usando eletroporação de plasmídeos repórteres. A primeira estratégia conta com a criação de uma linha de rato repórter floxed com camundongos expressando uma forma indutível de recombinase cre ativada especificamente em astrócitos após a entrega de tamoxifen (por exemplo, Aldh1l1-CreERT25). Várias desvantagens estão associadas a essa estratégia. Em primeiro lugar, a criação de camundongos transgênicos requer um grande número de animais e vários ensaios são tipicamente necessários para determinar a dose adequada de tamoxifen para fornecer rotulagem adequadamente escassa de astrócitos corticais. Analisar fenótipos de astrócitos cortical em um modelo genético de interesse do rato exigirá ainda mais reprodução e consumo de camundongos. Além disso, na injeção de tamoxifen uterina é conhecida por interferir na parturição, dificultando a aplicação dessa estratégia ao estudo dos estágios iniciais do desenvolvimento de astrócitos. A eletroporação in vivo de DNA é uma estratégia alternativa livre de tamoxifen que conta com um número mínimo de animais6. Realizada em estágios embrionários ou pós-natais, esta abordagem consiste em injetar plasmídeos repórteres nos ventrículos laterais de roedores seguidos por pulsos elétricos que criam poros na membrana celular, permitindo assim que o DNA entre células progenitoras que revestem o ventrículo. Posteriormente, os transgênicos repórteres transportados pelos plasmídeos eletroporados são processados pelo maquinário celular alvo e expressos7. Dois métodos de eletroporação foram descritos anteriormente para rotular os astrócitos cortical do rato: 1) Rotulagem de Astrocitos Pós-Natais por Eletroporação (PALE), que se baseia na eletroporação de plasmídeos epismídeos episômicos de 1 a 2 no estágio pós-natal4; 2) A estratégia StarTrack baseada na eletroporação utero (IUE) de múltiplos plasmídeos integrativos de cor única plasmids8,9,10. Embora essas duas técnicas rotulem eficientemente a A PR no córtex cerebral, elas também apresentam algumas limitações. Em sua versão inicial, ambos os métodos contam com um promotor de proteína ácida fibrilar gliarial (GFAP) para conduzir a expressão em astrócitos, o que pode influenciar a rotulagem em direção à glia radial, bem como astrócitos pial e reativos que expressam GFAP mais fortemente do que o repouso normal pra11,12. Em relação ao PALE, outras desvantagens são o estágio tardio da eletroporação, que impede a rotulagem de PrA (ou aqueles originários de progenitores delatórios precoces) e análise dos estágios iniciais do desenvolvimento da astroglia, e o uso de vetores episomais que se diluem através de sucessivas divisões durante a proliferação maciça que a A PR sofre durante a primeira semana pós-natal13,14. Em contraste com o PALE, StarTrack é baseado na eletroporação embrionária de plasmídeos integrativos repórteres que permitem rastrear a contribuição de progenitores embrionários e pós-natais para a PrA. Um esquema startrack atualizado que conta com o promotor ubiquitina C (UbC-StarTrack) alcança uma expressão mais ampla de repórteres fluorescentes tanto na descida neuronal quanto gliana (astrócitos incluídos) dos progenitores neurais15,16,17. No entanto, em sua versão atual, a implementação dessa abordagem é complexa, pois conta com uma mistura equimolar de 12 plasmídeos distintos expressando seis proteínas fluorescentes (FP) com excitação parcial e emissão de espectros sobrepostos.
Apresentado aqui é um método simples de rotulagem multicolorida baseada em eletroporação utero usando construções integrativas de repórteres impulsionadas por um promotor forte e amplamente ativo para destacar osstrócitos cortical14. Além disso, um fácil pipeline de análise de imagem utilizando tanto o software de análise de imagens licenciado (por exemplo, Imaris) quanto o acesso aberto (Vaa3D18,19,20) software de análise de imagens é fornecido para segmentar volume territorial de astrócito e arborização, respectivamente. Em comparação com os métodos descritos anteriormente, esta estratégia se baseia unicamente em transgênicos integrativos multicoloridos Marcadores de cores multiaddressáveis (Marcadores MÁGICOs ou MM21) direcionados ao compartimento celular citoplasmável e (opcionalmente) cuja expressão é impulsionada por um promotor de CAG sintético composto por um intensificador de cytomegalovirus, promotor de β-actina de coelho e β-globina-globinadecoelho Isso permite rotular e rastrear os astrócitos corticais, desde estágios embrionários até estágios pós-natais tardios, independente da expressão GFAP14,23. Cada um desses transgenes possui os seguintes quatro FP distintos: eBFP, mTurquoise2/mCerulean, EYFP e tdTomato/mCherry, que exibem sobreposição espectral mínima que pode ser facilmente contornada com 1) Aquisição de canais sequenciais; 2) Poder de excitação otimizado e ganho de arrecadação; e 3) Filtrosdicróicos específicos para coletar janelas estreitas de emissão de FP. A estratégia MM usa a recombinaçãocre/lox com uma recombinase Cre auto-excisível (seCre) para conduzir a expressão estocástica de FP em uma população celular. Uma única cópia de MM transgene expressa FP de forma mutuamente exclusiva, enquanto vários transgenes dão origem a combinações fp, criando dezenas de matizes distintos. A integração genômica dos transgênicos é impulsionada pelo sistema de transposição piggyBac (PB) ou Tol224,25,26. Portanto, através da eletroporação utero, o kit de ferramentas MM e o 'mosaico' multicolorido que ele gera permitem a marcação simultânea de múltiplos progenitores cortical adjacentes e o rastreamento de sua descida gliana, incluindo astrócitos corticais, por longos períodos. Contrastes de cor resultantes da expressão de delineamento distinto da licença FP do contorno da Af e, posteriormente, extraem informações-chave sobre seu volume territorial (usando IMARIS) e morfologia complexa (usando Vaa3D). A estratégia multicolorida apresentada em detalhes aqui é um método conveniente e robusto que dá acesso rápido e fácil à superfície do astrócito cortical e à morfologia em camundongos do tipo selvagem em vários estágios de desenvolvimento, e é facilmente adaptável para investigar características anatômicas de astrócitos em modelos de camundongos de doenças neurológicas sem o uso de linhas de repórter transgênicas.
Protocolo
Todos os procedimentos animais descritos aqui foram realizados de acordo com as diretrizes institucionais. Os protocolos animais foram aprovados pelo conselho ético de experimentação animal de Charles Darwin (CEEACD/N°5).
1. Preparação de plasmídeos livres de endotoxinas para marcadores MÁGICOS na eletroporação uteral
- Transformação bacteriana
- No gelo, descongele células competentes dh5 alfa armazenadas a -70 °C.
- Aqueça as placas de ágar contendo o antibiótico apropriado (100 μg/mL ampicillin ou 50 μg/mL kanamycin) a 37 °C.
- Adicione 1 μL de 5-50 ng de MAGIC Markers plasmid DNA em 10 μL de células competentes DH5 alfa descongeladas e incubar no gelo por 10 minutos sem misturar.
- Para a transformação do choque térmico, coloque a alíquota em um banho de água de 42 °C para 45 s, depois coloque imediatamente no gelo e espere de 3 a 5 minutos.
- Em condições estéreis, adicione 230 μL de soc médio e incubar por 1h a 37 °C.
- Espalhe o conteúdo da alíquota sobre a placa de ágar e incubar durante a noite a 37 °C.
- Cultura plasmida
- Na manhã seguinte, em condições estéreis, pegue uma colônia da placa de ágar e coloque-a em um tubo de 14 mL contendo 2 mL de meio LB com antibiótico apropriado. Deixe-o incubar durante o dia a 37 °C em uma incubadora de agitação a 300 rpm.
- No final do dia, semente 300 mL de LB com antibiótico usando a cultura inicial de 2 mL a partir do passo 1.2.1 e incubar durante a noite a 37 °C em uma incubadora de agitação a 300 rpm.
- Preparação de DNA plasmídeo
- Na manhã seguinte proceder com a purificação de marcadores mágicos plasmídeos DNA (i.e., PB-CAG-Cytbow e Tol2-CAG-Nucbow, bem como plasmídeos orientados pelo CAG expressando transposases PB e Tol2 e Cre recombinase) usando um kit maxiprep livre de endotoxinas seguindo o protocolo do fabricante.
- Elute o DNA em 200 μL de água estéril e estima sua concentração usando um espectrofotômetro antes do armazenamento a -20 °C.
2. Preparação para marcadores MÁGICOS na eletroporação uteral (MM IUE)
- Preparação da solução
- Aqueça 30 mL de solução salina de 0,9% a 37 °C em banho-maria e mantenha aquecido durante toda a duração da cirurgia.
- Prepare uma mistura de plasmídeo contendo PB-CAG-Cytbow e Tol2-CAG-Nucbow (concentração final, 0,8 μg/μL cada), transposas de PB e Tol2 (concentração final, 0,4 μg/μL cada), CAG-seCre (concentração final, 0,16 μg/μL) e corante verde rápido de 0,01% em PBS sem Ca2+ e Mg2+.
NOTA: Para fins de reconstrução anatômica de astrócitos, a construção de Tol2-CAG-Nucbow pode ser omitida. No entanto, este plasmídeo é útil para distinguir duplos de astrócitos intimamente justtapostos e ao usar marcadores MÁGICOS para sondar relações clonais entre os astrócitos14. - Prepare a solução anestésico contendo 100 μL de cetamina (100 mg/mL) e 100 μL de xilazina (20 mg/mL) diluída em 2 mL de solução salina.
- Prepare a solução analgésica diluindo 0,3 mg/mL solução de estoque de buprenorfina 1:10 em solução salina.
- Preparação do material cirúrgico
- Esterilize as ferramentas cirúrgicas (ver Tabela de Materiais) em alta temperatura em um esterilizador de contas de vidro ou equivalente.
- Coloque uma gota de gel de eletrodo em um prato de 35 mm.
- Insira a micropipette no suporte do microinjetor, quebre a ponta da micropipette e aspire a solução de DNA.
- Coloque uma queda de 1 μL da solução Fast Green (0,01%) na tampa de um prato de 3 cm e, usando-o como referência, ajuste o diâmetro da ponta da micropipette quebrando sua ponta com fórceps finos. Ajuste o parâmetro de pressão para que as gotas de tamanho equivalente sejam produzidas pelo microinjetor, permitindo assim a entrega de aproximadamente 1 μL de solução de DNA por injeção.
- Preparação do rato fêmea grávida
- Pese o rato grávido rjorl:swiss.
- Realize uma injeção intraperitoneal com 12,5 μL por grama de peso corporal (BW) de solução anestésico. Aguarde 5 minutos e verifique se o mouse está dormindo beliscando o dedo do dedo do dedo.
- Uma vez que o animal não responda para beliscar, injete-o subcutâneamente com 1,6 μL/g BW de solução analgésica.
- Adicione uma gota de gel ocular em cada olho para evitar a secagem durante a cirurgia e coloque a barriga do animal na almofada de aquecimento.
- Raspe suavemente o abdômen, limpe-o com uma almofada encharcada de iodo e higienize a área raspada com uma almofada de álcool.
- Organize um campo de operação colocando compressas estéreis ao redor da área raspada, limpa e higienizada.
3. Na eletroporação uterótera (IUE)
- Injeção intraventricular
- Corte uma incisão vertical de 2 cm ao longo da linha média começando na parte inferior do abdômen, através da pele, e depois através do músculo subjacente. Exponha os chifres uterinos manipulando suavemente os sacos embrionários e avalie a localização do colo uterino e o número de sacos embrionários em cada lado do colo do útero.
- Oriente o cérebro do embrião E15.5 a ser eletroporado para ver o bregma, facilmente reconhecido como sua localização combina com a junção dos três principais vasos sanguíneos que correm ao longo das fissuras cerebrais.
- Imagine uma linha virtual entre o bregma (visível através do crânio) e o olho; introduzir a micropipette entre a linha virtual e a fissura longitudinal, em seguida, pressione o pedal do pé do injetor para entregar 1 μL de solução de DNA no ventrículo lateral do hemisfério alvo.
NOTA: Quando injetado no local adequado, o ventrículo lateral preenchido parece azul, indicando que foi preenchido com a solução de DNA.
- Electroporation
- Aplique os eletrodos (ver Tabela de Materiais),previamente mergulhados em gel de eletrodo, em ambos os lados do embrião injetado com o ânodo cobrindo o hemisfério injetado. Pressione o pedal do pé do eletroporador para entregar uma série de quatro pulsos de 50 ms de 35 V, cada um separado por um intervalo de 950 ms.
- Umedeça o embrião com solução salina aquecida.
NOTA: Os embriões devem ser mantidos úmidos usando solução salina aquecida durante toda a operação cirúrgica e o útero não deve secar. - Repita as etapas 3.1.2-3.2.2 para cada embrião.
- Uma vez que todos os embriões alvos tenham sido eletroporados, substitua os chifres uterinos no abdômen empurrando-os suavemente com fórceps de volta à sua posição original. Encha a cavidade abdominal com solução salina aquecida para evitar que o útero seque enquanto as suturas são feitas.
- Primeiro feche o músculo abdominal com uma sutura absorvível contínua, e depois a pele com vários pontos individuais (~10) usando sutura 4-0.
- Coloque o animal em uma gaiola limpa, deitado de lado em uma toalha de papel limpa e vire o animal para o outro lado a cada 5 a 10 minutos até que ele acorde e comece a se mover por conta própria.
- Avalie o estado do animal no dia seguinte, especialmente se um ninho foi feito.
NOTA: Não é necessário tratamento pós-cirurgia. Na ausência de um ninho, qualquer sinal de dor (por exemplo, prostração, pele desgrenhada) e/ou sangramento pesado, o animal deve ser eutanizado sem demora.
4. Colheita e secção de tecidos
- Coleta de tecidos
- Injete fenobarbital (100 mg/kg BW) intraperitoneally para anestesia terminal no tempo de colheita desejado. Neste caso, os horários de colheita foram nos dias pós-natal (P4, P7 e P21).
- Realize a perfusão intracardiac usando uma solução baseada em paraformaldeído pré-fabricado a frio.
- Disseque o cérebro e coloque-o durante a noite a 4 °C na solução baseada em paraformaldeído para pós-fixação.
- Histologia
- Na manhã seguinte enxágue o cérebro 3x por 10 min com 1x PBS.
- Incorporar o cérebro em 3% de agarose dissolvida em 1x PBS.
- Corte seções de 80 μm usando um microtome de lâmina vibratória.
- Colete seções em uma placa de 24 poços pré-preenchida com 1x PBS.
- Montar seções no meio de montagem (ver Tabela de Materiais) entre o deslizamento e a mancha de cobertura. Mantenha os slides montados a -20 °C para uma preservação ideal da proteína fluorescente e armazenamento a longo prazo.
5. Imagem confocícal multicanal
- Configurações de microscópio
- Configure a configuração do microscópio confocal para excitar separadamente as linhas de laser mCerulean/mTurquoise2, EYFP, tdTomato/mCherry usando linhas laser de 440, 515 e 559 nm, respectivamente.
- Use um objetivo 20x 0.8 NA (ou na superior) e ajuste a amostragem XY e o tamanho da etapa Z de acordo com os critérios de Nyquist.
NOTA: Imagens adquiridas com maior resolução (por exemplo, 60x 1.4 NA oil objective) e algoritmos de desconvolução permitirão a reconstrução dos detalhes mais finos dos arbordos de astrócitos. No entanto, o experimentador deve ter em mente que os melhores processos de astrócito podem não ser resolvidos por imagens ópticas convencionais.
- Aquisição de imagens
- Encontre os astrócitos mais brilhantes na área eletroporada.
- Como as células rotuladas localizadas perto da superfície podem parecer mais brilhantes do que as mais profundas da fatia, ajuste as configurações de aquisição nas células superficiais para evitar saturar as imagens.
- Ajuste as configurações de aquisição separadamente para cada um dos três canais, certificando-se de evitar a saturação de pixels usando o HiLo LUT, que exibe valores zero como valores azuis e máximos de pixels como vermelho.
NOTA: Uma imagem adequadamente equilibrada deve exibir apenas alguns pixels azuis e quase nenhum vermelho. - Adquira pilhas Z de 1.024 x 1.024 pixels usando o estágio motorizado do microscópio, com uma sobreposição de 10% entre pilhas adjacentes para posteriormente permitir reconstruções de mosaicos da área eletroporada ou da zona de interesse.
6. Segmentação de volume territorial de Astrócito
NOTA: Isso é realizado por meio de um programa de software comercial (por exemplo, IMARIS).
-
Elaboração do conjunto de dados
- Crop os astrócitos rotulados dentro da reconstrução 3D (250 x 250 pixels) selecionando células inteiramente fechadas na seção de tecidos imagem.
NOTA: Também é possível trabalhar diretamente em volumes maiores se o computador usado puder manuseá-los. - Clique no botão Superfície Azul na barra de ferramentas Objeto da exibição Superar para criar uma nova Superfície para cada astrócito.
- Para obter melhor contraste de visualização, primeiro ajuste os valores mínimos e máximos de contraste de cores clicando em Editar | Mostrar a opção de ajuste de exibição e arrastar ambas as alças. Se necessário, altere a cor do canal clicando diretamente no nome do canal na janela Ajuste de exibição para selecionar uma nova cor.
NOTA: Preferencialmente sempre trabalhe com a mesma tela colorida para evitar viés visual. - Clique em Editar | Propriedades da imagem para indicar manualmente o tamanho do voxel em micrômetros. Se o tamanho do voxel não for preciso, os cálculos de volume estarão incorretos.
- Salve as novas configurações.
- Crop os astrócitos rotulados dentro da reconstrução 3D (250 x 250 pixels) selecionando células inteiramente fechadas na seção de tecidos imagem.
-
Segmentação de superfície
- Use o Ícone Azul para introduzir uma superfície. Um ícone e uma caixa de superfície aparecerão na lista Cena. Uma caixa de volume permite ver/ocultar o conjunto de dados.
- Selecione a linha de superfície e clique em Pular criação automática | Editar manualmente.
- Clique em | de Contorno Visibilidade e clique em Nenhum. Em seguida, mova-se para a exibição Selecionar e clique no botão Desenhar.
- Clique no Modo para selecionar o modo de desenho.
- Use a ferramenta de desenho semiatomado Isoline rápida e eficiente. Defina o contorno da célula movendo o ponteiro do mouse sobre ele. Se a visualização isolina não corresponder ao contorno de astrócito, ajuste a posição do ponteiro do mouse. Para validar a visualização, clique na seleção. Para corrigir possíveis erros, use a janela Placa para excluir o contorno atual do plano Z ou pressionar Ctrl + Z.
- Usando slice | Posicione-se para navegar pelos planos Z, mova-se para o próximo plano alterando o número do plano Z e inicie um novo contorno. Preferencialmente começar do meio da célula e depois mover-se para as extremidades.
- Quando os contornos tiverem sido desenhados em todos os z-planes contendo o astrócito, clique em Criar superfície. Antes de criar uma superfície, verifique se todos os componentes estão conectados. Se não, selecione os maiores ou conecte os relevantes antes de exportar dados de volume.
- Verifique os dados quantitativos exibidos no Painel de Dados e as estatísticas de exportação em formato de planilha, economizando valor de volume e unidade.
- Salve a superfície sob um novo nome para acessá-la mais tarde.
7. Traçando arborização de astrócitos
NOTA: Isso é feito usando o programa de software de acesso aberto Vaa3D.
- Elaboração do conjunto de dados
- Carregue a pilha de imagens e procure por astrócitos isolados ou astrócitos próximos exibindo cores distintas.
NOTA: A resolução da reconstrução pode ser melhorada aumentando o na e amostragem objetivo. Em última análise, no entanto, devido ao limite de resolução da microscopia confocal, os melhores processos de astrócito não podem ser rastreados com precisão. Deve-se tomar cuidado para evitar o excesso deegmentação além da resolução das imagens adquiridas. - Usando Fiji, a cultura de imagem de 250 x 250 pixels empilha em torno de cada astrócito.
- Como o rastreamento Vaa3D é realizado em apenas uma cor, selecione um canal e desative os outros canais.
- Converta a imagem em RGB e salve-a em formato .tiff.
- Carregue a pilha de imagens e procure por astrócitos isolados ou astrócitos próximos exibindo cores distintas.
- Rastreamento de arbor
- Abra a imagem RGB em Vaa3D. Vá para | de Imagem | de dados Geometria, em seguida, resamplagem de imagem, e ajustar valores de tamanho de voxel X/Y e Z.
NOTA: Ao reconstruir as arborhas de astrócitos, deve-se tomar cuidado para não traçar detalhes mais finos do que a resolução fornecida pelas imagens. - Abra uma janela 3D clicando no Visualizar | visualizador 3D para toda a imagem. Clique com o botão direito do mouse em uma imagem 3D e escolha 1 clique com o botão direito do mouse para definir o marcador. Aponte com o cursor o centro do astrócito e, em seguida, clique com o botão direito do mouse para definir um marcador.
NOTA: Clique em Escape para ter acesso à visualização 3D novamente. - Vá para advanced | | de rastreamento 3D Vaa3D-Neuron2-auto-rastreamento.
- Na janela recém-aberta, selecione o canal no qual aplicar o plug-in.
- Escolha um limiar de fundo (muitas vezes entre 30 e 90). Adapte este valor para cada astrócito, se necessário.
- Desmarque o raio de 2D e mantenha a amostra automática e a resample automática verificada.
- Set cnn_type em 3, length_thresh em 1, e SR_ratio em 0.1.
- Depois de clicar em ok,certifique-se de que o plug-in gere automaticamente dois arquivos com base no nome original. O sufixo -ini.swc e -coordinateX -coordinateY-coordinateZ-app2.swc serão adicionados. Adicione manualmente um rótulo distinto a esses arquivos de nome, a fim de não substituí-los demais enquanto continua a executar o plug-in.
- Open Object Manager, vá para Neuron | Estrutura delinha, selecione o astrócito traçado, clique no Modo de Exibiçãoe selecione Modo de linha Always.
- Volte para a janela 3D, onde aparece um esqueleto do astrócito.
NOTA: Se a segmentação e o sinal não coincidirem, repita as etapas 7.2.3-7.2.10 e ajuste o limiar até que o faça. Certifique-se de reinserir os outros parâmetros à medida que forem reiniciados quando o plug-in for reiniciado. - Clique com o botão direito do mouse no esqueleto e selecione neurônio de primeira escolha | linha #1... APP2_Tracing para acessar medições quantitativas que aparecerão em uma nova janela Surface| Anotação de objetos.
NOTA: Devido à resolução limitada da microscopia de luz, as medições exibidas sob os itens listados Número de filiais e número de bifurcações fornecem apenas uma estimativa aproximada da complexidade da árvore de astrócito.
- Abra a imagem RGB em Vaa3D. Vá para | de Imagem | de dados Geometria, em seguida, resamplagem de imagem, e ajustar valores de tamanho de voxel X/Y e Z.
Resultados
Eletroporação de marcadores MÁGICOS em progenitores cortical embrionários permite a rotulagem de astrócitos desde estágios iniciais até os estágios finais do desenvolvimento do córtex cerebral(Figura 1). Estes astrócitos foram encontrados em todas as camadas corticais em vários estágios pós-natais (P4, P7, P21) enquanto se dispersavam amplamente em todo o córtex cerebral. Foram avaliadas com imagens confocal adquiridas com um objetivo 20x 0.8 NA (ou superior NA) e montadas como reconstruções de pilha de Z(Figura 2). Mágica Marcadores de rotulagem combinatória permitiram a individualização de astrócitos cortical e a extração de informações sobre seu volume e morfologia. Utilizando o software de análise de imagens comerciais, o contorno dos astrócitos individuais foi delineado em cada seção óptica individual das pilhas de imagens confocal para segmentar e reconstruir o domínio territorial ocupado por cada astrócito(Figura 3). A partir das mesmas pilhas de imagem Z, a morfologia ramificada dos astrócitos cortical escolhidos foi segmentada utilizando-se o software de acesso aberto que permite a extração do esqueleto dos principais processos de astrócitos(Figura 4). Essas ferramentas de segmentação e rastreamento forneceram uma avaliação semiquantitativa do aumento do volume territorial (Figura 3) e da complexidade morfológica(Figura 4) que ocorreu para os astrócitos cortical individuais dos estágios pós-natal14. Essas abordagens também revelaram a heterogeneidade do volume e da morfologia exibida por distintos astrócitos cortical no mesmo estágio de desenvolvimento, como ilustrado na Figura 2, Figura 3e Figura 4.

Figura 1: Representação esquemática de Marcadores MÁGICOS (MM) na eletroporação uteral (IUE) para rotular progenitores corticais e sua descida durante o desenvolvimento cerebral. (A) O kit de ferramentas MM compreende vários plasmídeos codificando PB-Cytbow, Tol2-Nucbow, PB e Tol2 transposases, e auto-excisável Cre recombinase (seCre). Em construções MM, três pares de sites lox incompatíveis (loxN, lox2272e loxP) flanqueiam quatro sequências distintas de codificação FP (EBFP2, mTurquoise2/mCerulean, EYFP, tdTomato/mCherry) e criam possibilidades mutuamente exclusivas de excisão sobre a recombinação da Cre. Antes da ação da Cre, apenas o primeiro gene (EBFP2) é expresso. Após a excisão mediada por Cre induzida pelo seCre, é expressado tdTomato/mCherry (FP vermelho), EYFP (FP verde) ou mTurquoise2/mCerulean (cyan FP). A co-expressão de FP a partir de várias cópias de marcadores MÁGICOs produz combinações de cores no citoplasma (PB-CAG-Cytbow) ou núcleo (Tol2-CAG-Nucbow) de células rotuladas. Pb e Tol2 transposição endfeet enquadrando as fitas MM permitem sua integração no genoma de progenitores corticais quando construções MM são coeletrizadas juntamente com pb e tol2 transposas codificadores plasmídeos de codificação. (B-G) Ilustração gráfica da IUE sucessivos passos, incluindo a laparotomia de camundongos gestantes anestesiados(B),injeção da mistura de plasmídeos MM(C)nos ventrículos laterais dos embriões(D),entrega de pulsos elétricos através de pinças cuidadosamente posicionadas(E)para atingir progenitores corticais em um dos dois hemisférios cerebrais(F),e suturação de abdômen de rato gestante(G). Clique aqui para ver uma versão maior desta figura.
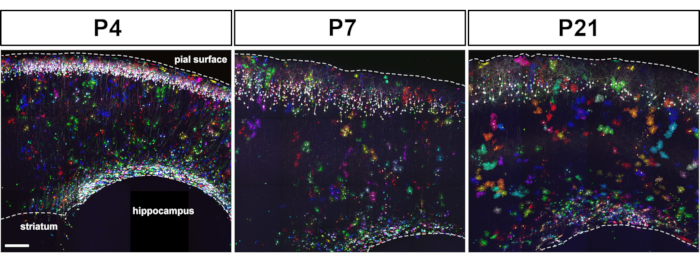
Figura 2: Seguindo na eletroporação uteral do kit de ferramentas magic markers, astrócitos multicoloridos foram encontrados espalhados em todo o córtex cerebral em estágios pós-natais. IUE de plasmídeos dirigindo mm, seCre, PB e tol2 transposas expressão em progenitores cortical de mouse E15.5 resultou na rotulagem de neurônios e astrócitos de camada 2-3 em P4, P7 e P21. O nível de expressão e a paleta de cores dependiam do número de transgênicos MM integrados no genoma dos progenitores corticais. Montagem de projeções de intensidade máxima de pilhas de imagens confocal de ladrilhos adquiridas em seções cerebrais sagitas de 80 μm. Barra de escala: 200 μm. Clique aqui para ver uma versão maior desta figura.

Figura 3: Segmentação do domínio territorial de astrócito cortical em diferentes estágios de desenvolvimento. Projeções de intensidade máxima de z-stack confocal cropped enquadrando astrócitos individuais(A-F) e seu domínio territorial associado segmentados com o software comercial (A'-F)em três estágios distintos de desenvolvimento: P4 (A-B, A'-B'), P7(C-D, C'-D)) e P21(E-F, E'-F),respectivamente. Barra de escala: 20 μm. Clique aqui para ver uma versão maior desta figura.
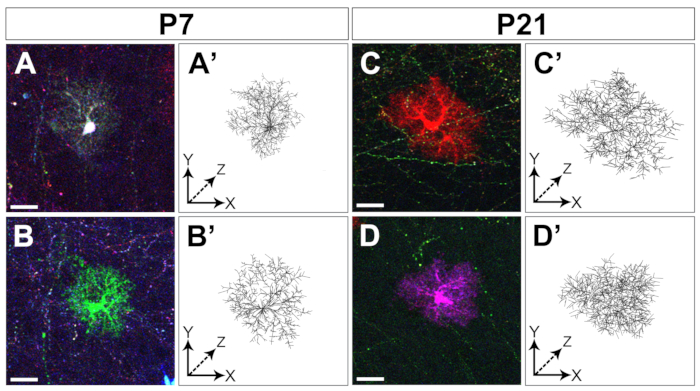
Figura 4: Rastreamento da arborização de astrócito cortical. Exemplos de dois astrócitos distintos cortados de pilhas Z confocal(A-D) e reconstrução de sua arborização grosseiramente segmentada com Vaa3D(A'-D)coletados em dois estágios distintos de desenvolvimento: P7 (A-B, A'-B)e P21(C-D, C'-D),respectivamente. Barra de escala: 20 μm. Clique aqui para ver uma versão maior desta figura.
Discussão
No ute eletroporation (IUE) de marcadores MÁGICOS em progenitores corticais(Figura 1) permitiram a rotulagem de astrócitos em todo o córtex cerebral pós-natal em diferentes estágios pós-natais (P4-P7-P21, Figura 2). Curiosamente, o estágio da IUE não é crítico, pois a eletroporação realizada de E13,5 a E15,5 produz padrões de rotulagem semelhantes em relação aos astrócitos cortical14. No entanto, a localização de neurônios piramidais rotulados no parenchyma cortical varia com o estágio de eletroporação. De fato, a IUE realizada em E15 marca a camada 2-3 neurônios, enquanto a IUE realizada no E13 rotula neurônios piramiptários em todas as camadas corticais, da camada 5 à camada 2-36,27. Esta rotulagem articular de neurônios cortical piramifetal após a IUE MM é a principal limitação deste método, pois impede a segmentação semiautomada da morfologia de astrócito em camadas onde a rotulagem neuronal densa interfere no reconhecimento de processos astrócitos. Se isso for um problema, o MM pode ser eletroporado em estágios pós-natal como em PALE. Na P4, a rotulagem de fibras radiais glia ainda presentes nessa fase também pode interferir na segmentação de arborização Vaa3D. Embora complicado, uma solução se quiser prosseguir com a reconstrução da árvore de astrócito nesta fase é remover manualmente fibras gliais radiais, substituindo progressivamente o sinal de fibra radial por pixels pretos ao redor do astrócito de interesse usando o Adobe Photoshop.
Apesar dessa limitação, a IUE MM é uma técnica poderosa quando adequadamente realizada. Algumas etapas críticas precisam ser tratadas com cuidado: 1) os embriões devem ser mantidos úmidos durante todo o procedimento cirúrgico e cuidadosamente manipulados para aumentar sua sobrevivência; 2) o uso de capilares de vidro com um diâmetro grande ou sacos embrionários muito apertados pode levar à ruptura do saco e, portanto, à morte dos embriões; 3) durante a injeção de DNA, os vasos sanguíneos devem ser evitados para evitar sangramento; 4) todo o procedimento não deve durar mais de 40 minutos da anestesia à sutura, a fim de maximizar a sobrevivência dos embriões; 5) o estresse desempenha um papel crítico no sucesso da IUE e, portanto, fontes extras de estresse, como mudança de gaiola, transporte, ruídos e vibração devem ser evitadas de 5 dias antes da cirurgia até 7 dias após o nascimento, a fim de prevenir o aborto e o canibalismo.
Note-se que os experimentadores que desejam segmentar especificamente células nascidas em um determinado estágio podem usar o kit de ferramentas MM sem adicionar os transposases de piggyBac e Tol2, de tal forma que apenas as células nascidas no momento da eletroporação expressam os rótulos combinatórios. Outra vantagem do método é a flexibilidade que confere em termos da densidade de células rotuladas e sua localização em várias regiões cerebrais. De fato, a rotulagem mais densa de astrócitos cortical pode ser alcançada aumentando a concentração total de transgênicos MM, mantendo a proporção de plasmídeos constante (proporção de 1:10 para construtos de recombinase/MM de Cre e proporção de 1:2 para construtos transposases/MM). Ao contrário de abordagens monocromáticas, como a eletroporação de transposons de cor única ou eletroporação de Cre em camundongos Ai9, onde a capacidade de destacar astrócitos individuais requer rotulagem esparsa, contrastes de cores oferecidos pela estratégia MAGIC Markers permitem a individualização de astrócitos sobre uma ampla gama de densidades de rótulos. Além disso, o posicionamento das sondas de eletrodos em orientações distintas permite atingir regiões cerebrais distintas, como o estriado prospectivo (ânodo na posição ventral, oposto à posição dorsal necessária para alcançar eletroporação no córtex cerebral), ou hipocampo (ânodo em posição medial)28. Finalmente, a IUE pode ser realizada em diferentes cepas de camundongos, como os camundongos de raça outbred (OF1, suíço) e inbred (C57BL/6J ou N), o que abre caminho para o uso do kit de ferramentas MM em modelos de doenças animais transgênicas. No entanto, para alcançar com sucesso iUE em camundongos de raça, deve-se adaptar o número de pulsos (três pulsos para C57BL/6 camundongos versus cinco pulsos em suíço), tensão (30 V em vez de 35 V) e dose analgésico (0,15 mg/mL buprenorphine stock solução e um volume injetado de 0,8 μL/g BW).
Em comparação com a criação de animais transgênicos ou as abordagens PALE e StarTrack, este método oferece várias vantagens. Para começar, ao contrário da estratégia de reprodução, utiliza poucos animais. Também permite a rotulagem de astrócitos corticais desde os estágios iniciais de seu desenvolvimento, incluindo estágios embrionários, ao contrário do PALE4, que conta com a eletroporação pós-natal. Além disso, em comparação com as doze construções de repórteres utilizadas na abordagem StarTrack 8 , essa estratégia conta comapenasdois transgênicos multicoloridos, tornando a preparação e a imagem da mistura de DNA mais simples. Além disso, o equilíbrio entre as diferentes cores estochasticamente expressas pelo MM é intrinsecamente determinado pela estrutura dos transgenes e não depende da mistura de diferentes componentes pelo experimentador. Além disso, essa estratégia pode ir além da simples consideração anatômica e pode ser aplicada com sucesso para análise multiclonal do desenvolvimento de astrócitos, como demonstrado no trabalho publicado anteriormente14. Este trabalho, utilizando raras combinações de cores de marcadores citoplasmáticos e nucleares para definir clones de astrócitos corticais, demonstrou que eles exibem ampla variabilidade em termos de distribuição espacial, organização estrutural, número e subtipo de células geradas.
Os astrócitos cortical nascidos de progenitores cortical rotulados por MM apresentaram contraste de cor significativo e se dispersaram amplamente por todo o córtex cerebral(Figura 2). Aquisições simples de pilha Z multicanal usando microscopia confocal foram utilizadas para acessar características-chave de astrócito, como seu volume territorial (Figura 3) e sua complexidade morfológica(Figura 4) em vários estágios pós-natais. Além dos astrócitos, essa metodologia pode ser adaptada para estudar a morfologia de outras células gliais, como os oligodendrócitos. No entanto, deve-se ter em mente que a resolução limitada oferecida pela microscopia confocal só pode fornecer uma renderização parcial da complexidade morfológica de astrócito. Enquanto imagens obtidas com maior resolução (por exemplo, 63x 1.4 NA oil objective) e algoritmos de desconvolução podem ser usados para reconstruir detalhes mais finos das arbordas de astrócitos14, os melhores processos não podem ser resolvidos com imagens ópticas convencionais. No entanto, a estratégia aqui apresentada será de interesse para a triagem eficiente para um potencial fenótipo que afeta o volume de astrócito cortical ou morfologia em modelos de camundongos de doenças neurológicas.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Agradecemos a S. Fouquet e as instalações de imagem e núcleo animal do Institut de la Vision e Institut des Neurosciences de Montpellier (RM e RAM) pela assistência técnica. Este trabalho foi apoiado por bolsas de Estudos de Région Ile-de-France e Fondation ARC pour la Recherche sur le Cancer to S.C, e da Université Paris-Saclay (Iniciativas Doutores Interdisciplinares) a L.A., por meio de financiamento do European Research Council (ERC-SG 336331, PI J. Valette) para E.H., pela Agence Nationale de la Recherche sob contratos ANR-10-LABX-65 (LabEx LifeSenses), ANR-11-EQPX-0029 (Equipex Morphoscope2), ANR-10-INBS-04 (France BioImaging) , por Fondation pour la Recherche Médicale (Ref. DBI20141231328), pelo Conselho Europeu de Pesquisa (ERC-CoG 649117, PI J. Livet) e pelo programa ATIP-Avenir (PI K. Loulier).
Materiais
| Name | Company | Catalog Number | Comments |
| 1.1 Bacteria transformation | |||
| Ampicillin | Euromedex | EU0400-C | |
| DH5 alpha competent cells | Fisher Scientitic | 11563117 | |
| Ice box | Dutscher | 139959 | |
| Kanamycin | Sigma | 60615 | |
| LB Agar | Sigma | L2897 | |
| SOC medium | Fisher Scientitic | 11563117 | |
| Sterile petri dish- 10 cm | Thermo Fisher | 150350 | |
| Water bath | VWR | 462-0556H | |
| 1.2 Plasmid culture | |||
| 14 ml culture tube | Dutscher | 187262 | |
| Glass erlenmeyer- 2L | Fisher Scientitic | 11383454 | |
| LB medium | Sigma | L3522 | |
| 1.3 Plasmid DNA preparation | |||
| NucleoBond Xtra Maxi Plus EF | Macherey-Nagel | 740426.10 | |
| 2.1 Preparation of the solutions | |||
| 26 G x 1/2 needle | Terumo | 8AN2613R1 | |
| 30 G x 1/2 needle | Terumo | 8AN3013R1 | |
| Fast Green | Sigma Aldrich | F7272 | |
| NaCl | VWR | 27810.295 | |
| Single-use polypropylene syringe, 1 mL | Dutscher | 50002 | |
| 2.2 Preparation of the surgery material | |||
| Adson Forceps - DeBakey Pattern- 12.5 cm | FST | 11617-12 | |
| Arched tip Forceps- 10 cm | FST | 11071-10 | |
| Glass bead sterilizer Steri 250 | Sigma | Z378569 | |
| Glass micropipette 1 mm diameter | FHC | 10-10-L | |
| Graefe Forceps - Titanium 1 mm Tips Slight Curve- 10 cm | FST | 11651-10 | |
| Graefe Forceps - Titanium 1 mm Tips Straight- 10 cm | FST | 11650-10 | |
| Iris Scissors - Delicate Straight- 9 cm | FST | 14060-09 | |
| Laboratory tape | Fisher Scientitic | 11730454 | |
| Microinjector | INJECT+MATIC | No catalog number | |
| Olsen-Hegar Needle Holder - 12 cm | FST | 12002-12 | |
| Optical fiber | VWR | 631-1806 | |
| Plastic-coated white paper | Distrimed | 700103 | |
| Signagel electrode gel | Free-Med | 15-60 | |
| Sterile Petri dish- 35 mm | Dutscher | 056714 | |
| Sterilizer, glass dry bead, Steri 250 | Sigma | Z378569 | |
| 2.3 Preparation of the pregnant female mouse | |||
| Alcohol pad | Alcomed | 1731000 | |
| Buprecare | Axience | 0.3 mg/ml | |
| Compress | tRAFFIN | 70189 | |
| Ketamine | Merial | Imalgene 1000 | |
| Ocular gel | tvm lab | Ocry-gel | |
| RjOrl:SWISS mice | Janvier Labs | ||
| Vetadine, 10% solution | Vetoquinol | 4337400113B | |
| Warming pad | Harvard Apparatus | 72-0493 | |
| Xylazine | Bayer | Rompun 2% | |
| 3.2 Electroporation | |||
| Absorbable suture Size 4-0 45 cm Suture 1-Needle 19 mm Length 3/8 Circle Reverse | Novosyn | C0068220 | |
| Electroporateur Sonidel | Sonidel | NEPA 21 | |
| Sterile transfer pipets (individually wrapped) | Dutscher | 043202S | |
| Tweezers with 3 mm platinium disk electrodes | Sonidel | CUY650P3 | |
| 4.1 Tissue harvesting and sectioning | |||
| 24-well plate | Falcon | 353047 | |
| Agarose | Lonza | 50004 | |
| Antigenfix | Microm Microtech | U/P0014 | |
| Coverslip | Dutscher | 100266 | |
| Dolethal | Vetoquinol | DOL202 | |
| DPBS (10X), no calcium, no magnesium | Fisher Scientific | 11540486 | |
| Nail polish | EMS | 72180 | |
| Slide | Dutscher | 100001 | |
| Vectashield | Vectorlabs | H-1000 | |
| Vibratome | Leica | VT1000S | |
| 5. Multichannel confocal imaging | |||
| 20X oil NA 0.85 | Olympus | ||
| Confocal Laser Scanning Microscope | Carl Zeiss | LSM880 | |
| Confocal Laser Scanning Microscope | Olympus | FV1000 | |
| Plan Apochromat 20x/0.8 M27 | Carl Zeiss | ||
| 6. Astrocyte territorial volume segmentation | |||
| IMARIS 8.3 and later versions | Bitplane | ||
| 7. Astrocyte arborization tracing | |||
| 3D Visualization-Assisted Analysis software suite (Vaa3D) | HHMI - Janelia Research Campus /Allen Institute for Brain Science |
Referências
- Clarke, L. E., Barres, B. A. Emerging roles of astrocytes in neural circuit development. Nature Reviews Neuroscience. 14 (5), 311-321 (2013).
- Ma, Z., Stork, T., Bergles, D. E., Freeman, M. R. Neuromodulators signal through astrocytes to alter neural circuit activity and behaviour. Nature. 539 (7629), 428-432 (2016).
- Blanco-Suárez, E., Caldwell, A. L. M., Allen, N. J. Role of astrocyte-synapse interactions in CNS disorders: Astrocyte-synapse disease. The Journal of Physiology. 595 (6), 1903-1916 (2017).
- Stogsdill, J. A., et al. Astrocytic neuroligins control astrocyte morphogenesis and synaptogenesis. Nature. 551 (7679), 192-197 (2017).
- Srinivasan, R., et al. New Transgenic Mouse Lines for Selectively Targeting Astrocytes and Studying Calcium Signals in Astrocyte Processes in Situ and In Vivo. Neuron. 92 (6), 1181-1195 (2016).
- Tabata, H., Nakajima, K. Efficient in utero gene transfer system to the developing mouse brain using electroporation: visualization of neuronal migration in the developing cortex. Neuroscience. 103 (4), 865-872 (2001).
- Shimogori, T., Ogawa, M. Gene application with in utero electroporation in mouse embryonic brain. Development, Growth & Differentiation. 50 (6), 499-506 (2008).
- García-Marqués, J., López-Mascaraque, L. Clonal Identity Determines Astrocyte Cortical Heterogeneity. Cerebral Cortex. 23 (6), 1463-1472 (2013).
- Martín-López, E., García-Marques, J., Núñez-Llaves, R., López-Mascaraque, L. Clonal Astrocytic Response to Cortical Injury. PLoS ONE. 8 (9), 74039(2013).
- Gutiérrez, Y., et al. Sibling astrocytes share preferential coupling via gap junctions. Glia. 67 (10), 1852-1858 (2019).
- Lee, Y., Messing, A., Su, M., Brenner, M. GFAP promoter elements required for region-specific and astrocyte-specific expression. Glia. 56 (5), 481-493 (2008).
- Yoon, H., Walters, G., Paulsen, A. R., Scarisbrick, I. A. Astrocyte heterogeneity across the brain and spinal cord occurs developmentally, in adulthood and in response to demyelination. PloS One. 12 (7), 0180697(2017).
- Ge, W. P., Miyawaki, A., Gage, F. H., Jan, Y. N., Jan, L. Y. Local generation of glia is a major astrocyte source in postnatal cortex. Nature. 484 (7394), 376-380 (2012).
- Clavreul, S., et al. Cortical astrocytes develop in a plastic manner at both clonal and cellular levels. Nature Communications. 10 (1), 4884(2019).
- Figueres-Oñate, M., García-Marqués, J., López-Mascaraque, L. UbC-StarTrack, a clonal method to target the entire progeny of individual progenitors. Scientific Reports. 6 (1), 33896(2016).
- Figueres-Oñate, M., García-Marqués, J., Pedraza, M., De Carlos, J. A., López-Mascaraque, L. Spatiotemporal analyses of neural lineages after embryonic and postnatal progenitor targeting combining different reporters. Frontiers in Neuroscience. 9, 87(2015).
- Figueres-Oñate, M., Sánchez-Villalón, M., Sánchez-González, R., López-Mascaraque, L. Lineage Tracing and Cell Potential of Postnatal Single Progenitor Cells In Vivo. Stem Cell Reports. 13 (4), 700-712 (2019).
- Peng, H., Ruan, Z., Long, F., Simpson, J. H., Myers, E. W. V3D enables real-time 3D visualization and quantitative analysis of large-scale biological image data sets. Nature Biotechnology. 28 (4), 348-353 (2010).
- Peng, H., Bria, A., Zhou, Z., Iannello, G., Long, F. Extensible visualization and analysis for multidimensional images using Vaa3D. Nature Protocols. 9 (1), 193-208 (2014).
- Peng, H., et al. Virtual finger boosts three-dimensional imaging and microsurgery as well as terabyte volume image visualization and analysis. Nature Communications. 5 (1), 4342(2014).
- Loulier, K., et al. Multiplex Cell and Lineage Tracking with Combinatorial Labels. Neuron. 81 (3), 505-520 (2014).
- Niwa, H., Yamamura, K., Miyazaki, J. Efficient selection for high-expression transfectants with a novel eukaryotic vector. Gene. 108 (2), 193-199 (1991).
- Abdeladim, L., et al. Multicolor multiscale brain imaging with chromatic multiphoton serial microscopy. Nature Communications. 10 (1), 1662(2019).
- Chen, F., LoTurco, J. A method for stable transgenesis of radial glia lineage in rat neocortex by piggyBac mediated transposition. Journal of Neuroscience Methods. 207 (2), 172-180 (2012).
- Siddiqi, F., et al. Fate Mapping by PiggyBac Transposase Reveals That Neocortical GLAST+ Progenitors Generate More Astrocytes Than Nestin+ Progenitors in Rat Neocortex. Cerebral Cortex. 24 (2), 508-520 (2014).
- Yoshida, A., et al. Simultaneous expression of different transgenes in neurons and glia by combining in utero electroporation with the Tol2 transposon-mediated gene transfer system. Genes to Cells. 15 (5), 501-502 (2010).
- LoTurco, J., Manent, J. B., Sidiqi, F. New and Improved Tools for In Utero Electroporation Studies of Developing Cerebral Cortex. Cerebral Cortex. 19, suppl 1 120-125 (2009).
- Pacary, E., et al. Visualization and Genetic Manipulation of Dendrites and Spines in the Mouse Cerebral Cortex and Hippocampus using in utero Electroporation. Journal of Visualized Experiments. (65), e4163(2012).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados