Method Article
In Utero Elektroporation von Multiadressierbaren Genom-integrierenden Farbe (MAGIC) Marker zur Individualisierung kortikaler Maus-Astrozyten
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Astrozyten kacheln die Großhirnrinde gleichmäßig, was die Analyse ihrer komplexen Morphologie auf zellulärer Ebene schwierig macht. Das hier bereitgestellte Protokoll verwendet eine mehrfarbige Etikettierung basierend auf der in utero Elektroporation, um kortikale Astrozyten herauszuarbeiten und deren Volumen und Morphologie mit einer benutzerfreundlichen Bildanalyse-Pipeline zu analysieren.
Zusammenfassung
Protoplasmatische Astrozyten (PrA) in der Maus großhirnrinde sind eng nebeneinander gestellt, bilden eine scheinbar kontinuierliche dreidimensionale Matrix in Erwachsenenstadien. Bisher kann keine Immunfleckenstrategie sie herausgreifen und ihre Morphologie in reife Tiere und im Laufe der Kortikogenese segmentieren. Cortical PrA stammen von Vorläufern, die sich im dorsalen Pallium befinden und können leicht mit der Utero-Elektroporation integrativer Vektoren gezielt werden. Hier wird ein Protokoll vorgestellt, um diese Zellen mit der multiadressierbaren genomintegrierenden Farbe (MAGIC) Markers-Strategie zu kennzeichnen, die auf piggyBac/Tol2-Transposition undCre/lox-Rekombination beruht, um stochastisch unterschiedliche fluoreszierende Proteine (blau, cyan, gelb und rot) auszudrücken, die an bestimmte subzelluläre Kompartimente adressiert sind. Diese mehrfarbige Schicksalskartierungsstrategie ermöglicht es, in situ nahe gelegenen kortikalen Vorläufern vor Beginn der Gliogenese Kombinationen zu markieren und ihre Nachkommen, einschließlich Astrozyten, von embryonalen bis erwachsenen Stadien auf der Ebene der einzelnen Zellen zu verfolgen. Die halbkarsische Beschriftung, die durch die Anpassung der Konzentration von elektroporated Vektoren und Farbkontrasten erreicht wird, die von den Multiaddressable Genome-Integrating Color Markers (MAGIC Markers oder MM) bereitgestellt werden, ermöglichen es, Astrozyten zu individualisieren und ihr Territorium und ihre komplexe Morphologie trotz ihrer dichten anatomischen Anordnung herauszuarbeiten. Hier wird ein umfassender experimenteller Workflow vorgestellt, der die Details des Elektroporationsverfahrens, die Erfassung von Mehrkanal-Bildstapeln durch konfokale Mikroskopie und die computergestützte dreidimensionale Segmentierung enthält, die es dem Experimentator ermöglicht, einzelne PrA-Volumen und Morphologie zu bewerten. Zusammenfassend lässt sich sagen, dass die Elektroporation von MAGIC Markern eine bequeme Methode bietet, um zahlreiche Astrozyten einzeln zu beschriften und in verschiedenen Entwicklungsstadien Zugang zu ihren anatomischen Merkmalen zu erhalten. Diese Technik wird nützlich sein, um kortikale astrozyte morphologische Eigenschaften in verschiedenen Mausmodellen zu analysieren, ohne auf komplexe Kreuze mit transgenen Reporterlinien zurückzugreifen.
Einleitung
Astrozyten spielen zahlreiche wichtige Funktionen in der Gehirnentwicklung und Physiologie1. Neben ihrer Rolle an der Blut - Hirn-Schranke, wo sie die Nährstoffaufnahme und den Blutfluss regulieren, tragen sie aktiv zur Synapsenbildung und -funktion bei und produzieren Neuromodulatoren, die die neuronale Aktivität und das Verhalten verändern können2. Darüber hinaus trägt Astrozytendysfunktion zu einer Vielzahl von neurologischen Erkrankungen3. Astrozyten in der Großhirnrinde zeigen eine ausgeklügelte Morphologie, die einen umfassenden Kontakt mit neuronalen Prozessen ermöglicht. Diese Kontakte, die für die Schaltungsfunktion unerlässlich sind, steuern auch die Astrozytenmorphogenese und Synaptogenese durch Zelladhäianionsproteine4. Neurowissenschaftler benötigen bequeme und robuste Werkzeuge, um die Entwicklung von Astrozyten und die Morphogenese in ihren neurologischen Modellen von Interesse zu untersuchen. Aufgrund der engen Aneignung von Astrozyten an ihre Nachbarn und ihrer einheitlichen dreidimensionalen Fliesen ist es jedoch schwierig, kortikale Astrozyten herauszuarbeiten und ihre Morphologie mit Immunmarkern umfassend zu bewerten.
Derzeit ermöglichen zwei hauptgenetische Strategien die Kennzeichnung und Individualisierung kortikaler Astrozyten in situ: spärliche Reporteraktivierung in transgenen Mauslinien oder somatische Transgenese mittels Elektroporation von Reporterplasmiden. Die erste Strategie beruht auf der Züchtung einer floxierten Reporter-Mauslinie mit Mäusen, die eine induzierbare Form der Cre-Rekombimeinase ausdrücken, die speziell in Astrozyten bei Dertoxifen-Lieferung aktiviert wird (z. B. Aldh1l1-CreERT25). Mit dieser Strategie sind mehrere Nachteile verbunden. Erstens erfordert die Zucht von transgenen Mäusen eine große Anzahl von Tieren und mehrere Tests sind in der Regel erforderlich, um die richtige Dosis von Tamoxifen zu bestimmen, um eine ausreichend spärliche Kennzeichnung kortikaler Astrozyten zu ermöglichen. Die Analyse kortikaler Astrozytenphänotypen in einem genetischen Mausmodell von Interesse erfordert noch mehr Züchtung und Mauskonsum. Darüber hinaus ist bei der Utero-Tamoxifen-Injektion bekannt, die mit der Parturtion zu stören, was diese Strategie schwierig macht, auf die Untersuchung der frühesten Stadien der Astrozytenentwicklung anzuwenden. In vivo DNA Elektroporation ist eine alternative tamoxifenfreie Strategie, die auf einer Minimalanzahl von Tieren beruht6. Dieser Ansatz, der entweder in embryonalen oder postnatalen Stadien durchgeführt wird, besteht darin, Reporterplasmide in die seitlichen Ventrikel von Nagetieren zu injizieren, gefolgt von elektrischen Impulsen, die Poren in der Zellmembran erzeugen, wodurch DIE DNA in Vorläuferzellen eindringen kann, die den Ventrikel aussäumen. Anschließend werden die von den elektroporated Plasmiden getragenen Reportertransgene von der Zielzellmaschinerie verarbeitet und7ausgedrückt. Zwei Elektroporationsmethoden wurden zuvor beschrieben, um kortikale Astrozyten der Maus zu kennzeichnen: 1) Postnatale Astrozytenkennzeichnung durch Elektroporation (PALE), die auf der Elektroporation von 1-2 einfarbigen episomalen Reporterplasmiden in frühen postnatalen Stadien4beruht; 2) Die StarTrack-Strategie basiert auf der in utero Elektroporation (IUE) von mehreren einfarbigen integrativen Reporterplasmiden8,9,10. Obwohl diese beiden Techniken PrA in der Großhirnrinde effizient kennzeichnen, stellen sie auch einige Einschränkungen dar. In ihrer ursprünglichen Version stützen sich beide Methoden auf einen glialfibrillären sauren Protein (GFAP) Promotor, um die Expression in Astrozyten anzutreiben, was die Kennzeichnung in Richtung radialer Glia sowie pialer und reaktiver Astrozyten verzerrt, die GFAP stärker ausdrücken als normale ruhende PrA11,12. In Bezug auf PALE sind andere Nachteile das späte Stadium der Elektroporation, das die Kennzeichnung von frühgeborener PrA (oder solche, die von frühen delainierenden Vorläufern stammen) und die Analyse der frühen Stadien der Astrogliaentwicklung verhindert, und die Verwendung von episomalen Vektoren, die durch aufeinander folgende Divisionen während der massiven Proliferation, die PrA während der ersten postnatalen Woche13,14durch sich verdünnt, verhindert. Im Gegensatz zu PALE basiert StarTrack auf der embryonalen Elektroporation integrativer Reporterplasmide, die es ermöglichen, den Beitrag embryonaler und postnataler Vorfahren zu PrA zu verfolgen. Ein aktualisiertes StarTrack-Schema, das sich auf den Ubiquitin C-Promoter (UbC-StarTrack) stützt, erreicht eine breitere Expression fluoreszierender Reporter sowohl im neuronalen als auch im glialischen Abstieg (einschließlich Astrozyten) der neuronalen Vorläufer15,16,17. In seiner aktuellen Fassung ist die Umsetzung dieses Ansatzes jedoch komplex, da er auf einer äquimolaren Mischung von 12 verschiedenen Plasmiden beruht, die sechs fluoreszierende Proteine (FP) mit teilweiser Anregung und Emissionsspektren überlappen.
Präsentiert wird hier eine einfache in utero Elektroporation-basierte Multicolor-Etikettierungsmethode mit integrativen Reporterkonstrukten, die von einem starken und breit aktiven Promotor angetrieben werden, um kortikale Astrozyten herauszuarbeiten14. Darüber hinaus wird eine einfache Bildanalyse-Pipeline mit lizenzierten (z.B. Imaris) und Open Access (Vaa3D18,19,20) Bildanalyse-Software zur Segmentierung von Astrozyten-Territorialvolumen bzw. Arborisierung zur Verfügung gestellt. Im Vergleich zu den zuvor beschriebenen Methoden stützt sich diese Strategie ausschließlich auf 1–2 mehrfarbige integrative Transgene Multiaddressable Genome-Integrating Color Markers (MAGIC Markers oder MM21), die auf das zytoplasmatische und (optional) Kernzellkompartiment gerichtet sind, dessen Expression von einem synthetischen CAG-Promotor angetrieben wird, der aus einem Cytomegalievirus-Enhancer, einem Huhn-β-Aktin-Promotor und einem Kaninchen-β-Globin-Spleis-Akzeptier-Site besteht. Dies ermöglicht die Kennzeichnung und Verfolgung kortikaler Astrozyten, von embryonalen bis spät postnatalen Stadien, unabhängig von GFAP-Expression14,23. Jedes dieser Transgene trägt die folgenden vier unterschiedlichen FP: eBFP, mTurquoise2/mCerulean, EYFP und tdTomato/mCherry, die minimale spektrale Überlappung anzeigen, die leicht mit 1) Sequential Channel Acquisition umgangen werden kann; 2) Optimierte Anregungsleistung und Sammelgewinn; und 3) Spezifische dichroitische Filter zur Erfassung schmaler FP-Emissionsfenster. Die MM-Strategie verwendet Cre/lox Rekombination mit einer selbstexzisierbaren Cre Recombinase (seCre), um den stochastischen Ausdruck von FP in einer zellulären Population zu fördern. Eine einzige Kopie des MM-Transgens drückt FP auf sich gegenseitig ausschließende Weise aus, während mehrere Transgene FP-Kombinationen hervorrufen und Dutzende von unterschiedlichen Farbtönen erzeugen. Die genomische Integration der Transgene wird durch das PiggyBac (PB) oder Tol2 Transposition System24,25,26angetrieben. Daher ermöglichen das MM-Toolkit und das von ihm erzeugte mehrfarbige "Mosaik" durch die Utero-Elektroporation die gleichzeitige Markierung mehrerer benachbarter kortikaler Vorläufer und die Verfolgung ihres gliakalen Abstiegs, einschließlich kortikaler Astrozyten, über lange Zeiträume. Farbkontraste, die sich aus der Expression einer deutlichen FP-Abgrenzung der Kontur von PrA ergeben, und extrahieren anschließend wichtige Informationen über ihr territoriales Volumen (mit IMARIS) und komplexe Morphologie (mit Vaa3D). Die hier vorgestellte Multicolor-Strategie ist eine praktische und robuste Methode, die einen schnellen und einfachen Zugriff auf die kortikale Astrozytenoberfläche und Morphologie bei Wildtypmäusen in verschiedenen Entwicklungsstadien ermöglicht und leicht anpassungsfähig ist, um astrozyte anatomische Merkmale in Mausmodellen neurologischer Erkrankungen zu untersuchen, ohne transgene Reporterlinien zu verwenden.
Protokoll
Alle hier beschriebenen tierischen Verfahren wurden in Übereinstimmung mit den institutionellen Leitlinien durchgeführt. Tierprotokolle wurden von der Charles Darwin Animal Experimentation Ethical Board (CEEACD/N°5) zugelassen.
1. Herstellung von Endotoxinfreien Plasmiden für MAGIC Marker in der Utero-Elektroporation
- Bakterielle Transformation
- Auf Eis auftauen DH5 alpha-kompetente Zellen bei -70 °C gelagert.
- Erwärmen Sie die Agarplatten, die das entsprechende Antibiotikum enthalten (100 g/ml Ampicillin oder 50 g/ml Kanamycin) bei 37 °C.
- Fügen Sie 1 l von 5–50 ng MAGIC Markers Plasmid-DNA in 10 l aufgetauten DH5 alpha-fähigen Zellen hinzu und brüten auf Eis für 10 min ohne Mischen.
- Für die Wärmeschock-Transformation, legen Sie das Aliquot in einem 42 °C Wasserbad für 45 s, dann legen Sie sofort auf Eis und warten Sie 3-5 min.
- Unter sterilen Bedingungen 230 L SOC-Medium hinzufügen und 1 h bei 37 °C inkubieren.
- Den Gehalt des Aliquots über die Agarplatte verteilen und über Nacht bei 37 °C brüten.
- Plasmidkultur
- Am nächsten Morgen, unter sterilen Bedingungen, nehmen Sie eine Kolonie von der Agarplatte und legen Sie es in einem 14 ml Rohr mit 2 ml LB Medium mit entsprechendem Antibiotikum. Lassen Sie es für den Tag bei 37 °C in einem Schüttelinkubator bei 300 Rpm inkubieren.
- Am Ende des Tages 300 ml LB mit Antibiotikum mit der 2 ml Starterkultur ab Schritt 1.2.1 aussaat enden und über Nacht bei 37 °C in einem Schüttelinkubator bei 300 Rpm inkubieren.
- Plasmid-DNA-Präparation
- Am nächsten Morgen wird die Plasmid-DNA der MAGIC Marker (d.h. PB-CAG-Cytbow und Tol2-CAG-Nucbow sowie CAG-gesteuerte Plasmide, die PB- und Tol2-Transposasen und Cre-Rekombinantase exemiten, mit einem endotoxinfreien Maxiprep-Kit nach dem Herstellerprotokoll gereinigt.
- Elute die DNA in 200 l sterilem Wasser und schätzen Sie ihre Konzentration mit einem Spektralphotometer vor der Lagerung bei -20 °C.
2. Vorbereitung für MAGIC Marker in der Utero-Elektroporation (MM IUE)
- Lösungsvorbereitung
- 30 ml mit 0,9% Salzlösung bei 37 °C in einem Wasserbad erwärmen und während der gesamten Dauer der Operation warm halten.
- Bereiten Sie eine Plasmidmischung vor, die PB-CAG-Cytbow und Tol2-CAG-Nucbow (Endkonzentration, je 0,8 g/l), PB- und Tol2-Transposasen (Endkonzentration, je 0,4 g/l), CAG-seCre (Endkonzentration, 0,16 g/l) und 0,01 % Schnell-Grünfarbstoff in PBS ohne Ca2+ und2+mg enthält.
HINWEIS: Für astrozyte anatomische Rekonstruktionszwecke kann das Tol2-CAG-Nucbow-Konstrukt weggelassen werden. Dieses Plasmid ist jedoch nützlich, um Doublets von eng nebeneinander liegenden Astrozyten zu unterscheiden und bei der Verwendung von MAGIC Markern klonale Beziehungen zwischen Astrozyten zu sonieren14. - Bereiten Sie eine Anästhesielösung vor, die 100 l Ketamin (100 mg/ml) und 100 l Xylazin (20 mg/ml) enthält, die in 2 ml Salinelösung verdünnt sind.
- Bereiten Sie die schmerzstillende Lösung vor, indem Sie 0,3 mg/ml Buprenorphin-Stammlösung 1:10 in Einer Salinelösung verdünnen.
- Vorbereitung des Operationsmaterials
- Sterilisieren Sie die chirurgischen Werkzeuge (siehe Tabelle der Materialien) bei hoher Temperatur in einem Glasperlensterilisator oder gleichwertig.
- Legen Sie einen Tropfen Elektrodengel in eine 35 mm Schale.
- Setzen Sie die Mikropipette in den Mikroinjektorhalter ein, brechen Sie die Spitze der Mikropipette und streben Sie die DNA-Lösung an.
- Platzieren Sie einen Tropfen Fast Green (0,01 %) mit einem Tropfen von 1 L im Deckel einer 3 cm Schale und, mit ihm als Referenz, stellen Sie den Durchmesser der Mikropipette Spitze, indem Sie seine Spitze mit feinen Zangen brechen. Stellen Sie den Druckparameter so ein, dass der Mikroinjektor eine äquivalente Größe von Tropfen erzeugt, wodurch die Lieferung von ca. 1 l DNA-Lösung pro Injektion ermöglicht wird.
- Zubereitung der schwangeren weiblichen Maus
- Wiegen Sie die RjOrl:SWISS schwangere Maus.
- Führen Sie eine intraperitoneale Injektion mit 12,5 l pro Gramm Körpergewicht (BW) der Anästhesielösung durch. Warten Sie 5 min und stellen Sie sicher, dass die Maus schläft, indem Sie ihre Zehen kneifen.
- Sobald das Tier nicht zu kneifen reagiert, injizieren Sie es subkutan mit 1,6 l/g BW analgetischer Lösung.
- Fügen Sie einen Tropfen Augengel auf jedes Auge, um das Trocknen während der Operation zu verhindern und legen Sie den Tierbauch auf das wärmende Pad.
- Rasieren Sie vorsichtig seinen Bauch, reinigen Sie ihn mit einem pad mit Jod getränkt, und desinitiieren Sie den rasierten Bereich mit einem Alkoholpad.
- Ordnen Sie ein Operationsfeld an, indem Sie sterile Kompressen um den rasierten, gereinigten und desinfizierten Bereich legen.
3. In der Utero-Elektroporation (IUE)
- Intraventrikuläre Injektion
- Schneiden Sie einen 2 cm-vertikalen Schnitt entlang der Mittellinie ab dem unteren Teil des Bauches, durch die Haut und dann durch den darunter liegenden Muskel. Setzen Sie die Gebärmutterhörner aus, indem Sie die embryonalen Beutel sanft manipulieren und die Lage des Gebärmutterhalses und die Anzahl der embryonalen Beutel auf jeder Seite des Gebärmutterhalses bewerten.
- Richten Sie das Gehirn des E15.5-Embryos aus, um elektroporating zu werden, um das Bregma zu sehen, das leicht erkannt wird, da sein Standort mit der Kreuzung der drei Hauptblutgefäße übereinstimmt, die entlang der Zerebralpisser verlaufen.
- Stellen Sie sich eine virtuelle Linie zwischen dem Bregma (sichtbar durch den Schädel) und dem Auge vor; die Mikropipette zwischen der virtuellen Linie und der Längsspalte einführen und dann das Fußpedal des Injektors drücken, um 1 L DNA-Lösung in den seitlichen Ventrikel der Zielhalbkugel zu liefern.
HINWEIS: Wenn der gefüllte seitliche Ventrikel an der richtigen Stelle injiziert wird, erscheint er blau, was darauf hinweist, dass er mit der DNA-Lösung gefüllt wurde.
- Electroporation
- Tragen Sie die Elektroden (siehe Tabelle der Materialien), die zuvor in Elektrodengel getaucht wurden, auf beiden Seiten des injizierten Embryos mit der Anode auf, die die injizierte Hemisphäre bedeckt. Drücken Sie das Fußpedal des Elektroporators, um eine Reihe von vier 50 ms Impulsen von 35 V zu liefern, die jeweils durch ein Intervall von 950 ms getrennt sind.
- Den Embryo mit erwärmter Herz-Saline-Lösung dämpfen.
HINWEIS: Die Embryonen sollten während des gesamten chirurgischen Eingriffs mit erwärmter Herz-A-Lösung feucht gehalten werden und die Gebärmutter sollte nicht austrocknen. - Wiederholen Sie die Schritte 3.1.2–3.2.2 für jeden Embryo.
- Sobald alle gezielten Embryonen elektroporating wurden, ersetzen Sie die Uterushörner im Bauch, indem Sie sie sanft mit Zangen zurück in ihre ursprüngliche Position schieben. Füllen Sie die Bauchhöhle mit erwärmter Herz-Säure-Lösung, um zu verhindern, dass die Gebärmutter austrocknet, während Nähte gemacht werden.
- Schließen Sie zuerst den Bauchmuskel mit einer kontinuierlichen resorbierbaren Naht, und dann die Haut mit mehreren einzelnen Stichen (10) mit 4-0 Naht.
- Legen Sie das Tier in einen sauberen Käfig, liegen auf der Seite auf einem sauberen Papiertuch und drehen Sie das Tier auf die andere Seite alle 5–10 min, bis es aufwacht und beginnt, sich von selbst zu bewegen.
- Bewerten Sie den Zustand des Tieres am nächsten Tag, insbesondere wenn ein Nest gemacht wurde.
HINWEIS: Es ist keine postsurgeryische Behandlung erforderlich. In Ermangelung eines Nestes, jedes Anzeichen von Schmerzen (z. B. Prostration, zotteliges Fell) und/oder starke Blutungen sollte das Tier unverzüglich eingeschläfert werden.
4. Gewebeernte und -schnitt
- Gewebesammlung
- Injizieren Sie Phenobarbital (100 mg/kg BW) intraperitoneal zur Endanästhesie zur gewünschten Erntezeit. In diesem Fall lagen die Erntezeiten an den postnatalen (P) Tagen P4, P7 und P21.
- Führen Sie eine intrakardiale Perfusion mit kaltvorgefertigter Paraformaldehyd-Lösung durch.
- Sezieren Sie das Gehirn aus und legen Sie es über Nacht bei 4 °C in der paraformaldehydbasierten Lösung für die Postfixierung.
- Histologie
- Am nächsten Morgen spülen Sie das Gehirn 3x für 10 min mit 1x PBS.
- Einbetten des Gehirns in 3% Agarose in 1x PBS gelöst.
- Schneiden Sie 80 m Abschnitte mit einem Vibrierenden-Blatt-Mikrotom.
- Sammeln Sie Abschnitte in einer 24 Wellplatte, die mit 1x PBS vorgefüllt ist.
- Montieren Sie Abschnitte im Montagemedium (siehe Materialtabelle) zwischen Dem Schlitten und dem Deckblatt. Halten Sie die montierten Dias bei -20 °C für eine optimale Fluoreszenz-Proteinkonservierung und Langzeitlagerung.
5. Mehrkanal-konfokale Bildgebung
- Mikroskopeinstellungen
- Richten Sie die Konfiguration des konfokalen Mikroskops ein, um mCerulean/mTurquoise2, EYFP, tdTomato/mCherry mit 440, 515 bzw. 559 nm Laserlinien separat zu erregen.
- Verwenden Sie ein 20x 0.8 NA (oder höher NA) Objektiv und passen Sie XY-Probenahme und Z-Schritt-Größe nach Nyquist-Kriterien an.
HINWEIS: Bilder, die mit höherer Auflösung (z. B. 60x 1,4 NA-Ölobjektiv) und Dekonvolution-Algorithmen aufgenommen wurden, ermöglichen die Rekonstruktion der feineren Details von Astrozyten-Arbors. Der Experimentator sollte jedoch bedenken, dass die besten Astrozytenprozesse nicht durch herkömmliche optische Bildgebung gelöst werden können.
- Bildaufnahme
- Finden Sie die hellsten Astrozyten im elektropolierten Bereich.
- Da beschriftete Zellen, die sich in der Nähe der Oberfläche befinden, heller erscheinen als die tieferen im Schnitt, passen Sie die Erfassungseinstellungen für die Oberflächenzellen an, um eine Sättigung der Bilder zu vermeiden.
- Passen Sie die Erfassungseinstellungen für jeden der drei Kanäle separat an, und stellen Sie sicher, dass die Pixelsättigung mit HiLo LUT vermieden wird, das Nullwerte als blau und maximale Pixelwerte als rot anzeigt.
HINWEIS: Ein ausreichend ausgewogenes Bild sollte nur wenige blaue und fast keine roten Pixel anzeigen. - Erwerben Sie geflieste 1.024 x 1.024 Pixel Z-Stacks mit der motorisierten Stufe des Mikroskops, mit einer 10%igen Überlappung zwischen benachbarten Stapeln, um anschließend Mosaikrekonstruktionen des elektropolierten Bereichs oder der Interessenzone zu ermöglichen.
6. Astrozyten-Gebietsvolumensegmentierung
HINWEIS: Dies wird mit einem kommerziellen Softwareprogramm (z. B. IMARIS) durchgeführt.
-
Erstellung des Datensatzes
- Schneiden Sie die beschrifteten Astrozyten innerhalb der 3D-Rekonstruktion (250 x 250 Pixel) an, indem Sie Zellen auswählen, die vollständig im bildten Gewebeabschnitt eingeschlossen sind.
HINWEIS: Es ist auch möglich, direkt auf größeren Volumes zu arbeiten, wenn der verwendete Computer sie verarbeiten kann. - Klicken Sie auf die Schaltfläche Blaue Oberfläche in der Objektsymbolleiste der Surpass-Ansicht, um eine neue Oberfläche für jede Astrozytenzulage zu erstellen.
- Um einen besseren Visualisierungskontrast zu erzielen, passen Sie zunächst die minimalen und maximalen Farbkontrastwerte an, indem Sie auf Bearbeiten | Anzeigeeinstellungsoption anzeigen und beide Ziehpunkte ziehen. Ändern Sie bei Bedarf die Kanalfarbe, indem Sie direkt auf den Kanalnamen im Fenster Anzeigeanpassung klicken, um eine neue Farbe auszuwählen.
HINWEIS: Bevorzugt immer mit der gleichen Farbanzeige arbeiten, um visuelle Verzerrung zu verhindern. - Klicken Sie auf Bearbeiten | Bildeigenschaften, um die Voxelgröße in Mikrometern manuell anzugeben. Wenn die Voxelgröße nicht korrekt ist, sind die Volumenberechnungen falsch.
- Speichern Sie die neuen Einstellungen.
- Schneiden Sie die beschrifteten Astrozyten innerhalb der 3D-Rekonstruktion (250 x 250 Pixel) an, indem Sie Zellen auswählen, die vollständig im bildten Gewebeabschnitt eingeschlossen sind.
-
Oberflächensegmentierung
- Verwenden Sie das Blaue Symbol, um eine Oberfläche einzuführen. In der Liste Szene werden ein Surface-Symbol und ein Feld angezeigt. Ein Volume-Feld ermöglicht das Anzeigen/Ausblenden des Datasets.
- Wählen Sie die Oberflächenlinie aus und klicken Sie auf Automatische Erstellung überspringen | Manuell bearbeiten.
- Klicken Sie auf Contour | Sichtbarkeit und klicken Sie auf Keine. Wechseln Sie dann zur Select-Ansicht und klicken Sie auf die Schaltfläche Zeichnen.
- Klicken Sie auf Modus, um den Zeichnungsmodus auszuwählen.
- Verwenden Sie das schnelle und effiziente halbautomatische Zeichenwerkzeug Isoline. Definieren Sie die Zellumrisslinie, indem Sie den Mauszeiger darauf bewegen. Wenn die Isolinienvorschau nicht mit der Astrozytenumrisslinie übereinstimmt, passen Sie die Mauszeigerposition an. Um die Vorschau zu überprüfen, klicken Sie mit der linken Maustaste auf die Auswahl. Um mögliche Fehler zu korrigieren, verwenden Sie das Fenster Board, um die aktuelle Z-Ebenenkontur zu löschen, oder drücken Sie Strg + Z.
- Verwenden von Slice-| Positionieren Sie sich, um durch die Z-Ebenen zu navigieren, bewegen Sie sich zur nächsten Ebene, indem Sie die Z-Ebenennummer ändern und eine neue Kontur starten. Beginnen Sie bevorzugt in der Mitte der Zelle und bewegen Sie sich dann zu den Extremitäten.
- Wenn Konturen in allen Z-Ebenen gezeichnet wurden, die die Astrozyten enthalten, klicken Sie auf Oberfläche erstellen. Bevor Sie eine Oberfläche erstellen, überprüfen Sie, ob alle Komponenten verbunden sind. Wenn dies nicht der Fall ist, wählen Sie die größten aus, oder verbinden Sie die relevanten, bevor Sie Volumedaten exportieren.
- Überprüfen Sie die im Datenbereich angezeigten quantitativen Daten und exportieren Sie Statistiken im Tabellenformat, wodurch Volumenwert und Einheit gespart werden.
- Speichern Sie die Oberfläche unter einem neuen Namen, um später darauf zuzugreifen.
7. Aufspüren der Astrozyten-Arborisierung
HINWEIS: Dies geschieht mit open access Software-Programm Vaa3D.
- Erstellung des Datensatzes
- Laden Sie den Bildstapel und suchen Sie nach isolierten Astrozyten oder astrozyten in der Nähe, die unterschiedliche Farben anzeigen.
ANMERKUNG: Die Auflösung der Rekonstruktion kann durch Erhöhung der objektiven NA und Probenahme verbessert werden. Letztlich können jedoch aufgrund der Auflösungsgrenze der konfokalen Mikroskopie die besten Astrozytenprozesse nicht genau nachverfolgt werden. Es sollte darauf geachtet werden, dass über die Auflösung der aufgenommenen Bilder hinaus keine Übersegmentierung erfolgt. - Mit Fidschi, Schneiden Sie 250 x 250 Pixel Bildstapel um jede Astrozyten.
- Da die Vaa3D-Ablaufverfolgung nur für eine Farbe durchgeführt wird, wählen Sie einen Kanal aus und deaktivieren Sie die anderen Kanäle.
- Konvertieren Sie das Bild in RGB und speichern Sie es im .tiff Format.
- Laden Sie den Bildstapel und suchen Sie nach isolierten Astrozyten oder astrozyten in der Nähe, die unterschiedliche Farben anzeigen.
- Arbor-Ablaufverfolgung
- Öffnen Sie das RGB-Bild in Vaa3D. Weiter zu Bild | Daten | Geometrie dann Bild Resampling, und passen Sie X / Y und Z voxel Größenwerte.
HINWEIS: Bei der Rekonstruktion von Astrozytenlauben sollte darauf geachtet werden, Details nicht feiner zu verfolgen als die Auflösung, die von den Bildern bereitgestellt wird. - Öffnen Sie ein 3D-Fenster, indem Sie auf Visualize | 3D-Viewer für das gesamte Bild klicken. Klicken Sie mit der rechten Maustaste auf ein 3D-Bild und wählen Sie 1-Rechtsklick, um Marker zu definieren. Zeigen Sie mit dem Cursor auf die Mitte der Astrozytentaste, und klicken Sie dann mit der rechten Maustaste, um einen Marker festzulegen.
HINWEIS: Klicken Sie auf Flucht, um erneut auf die 3D-Ansicht zuzugreifen. - Wechseln Sie zu Advanced | 3D-| Vaa3D-Neuron2-auto-tracing.
- Wählen Sie im neu geöffneten Fenster den Kanal aus, auf den das Plug-In angewendet werden soll.
- Wählen Sie einen Hintergrundschwellenwert (häufig zwischen 30 und 90). Passen Sie diesen Wert bei Bedarf für jeden Astrozyten an.
- Deaktivieren Sie Radius von 2D, und halten Sie Auto-Down-Beispiel und Auto-Resample aktiviert.
- Setzen Sie cnn_type auf 3, length_thresh auf 1 und SR_ratio auf 0,1.
- Stellen Sie nach dem Klicken auf OKsicher, dass das Plug-In automatisch zwei Dateien basierend auf dem ursprünglichen Namen generiert. Das Suffix –ini.swc und -coordinateX–coordinateY-coordinateZ-app2.swc wird hinzugefügt. Fügen Sie diesen Namensdateien manuell eine eindeutige Bezeichnung hinzu, um sie nicht zu überschreiben, während Sie das Plug-In fortsetzen.
- Öffnen Sie Object Manager, wechseln Sie zu Neuron | Linienstruktur, wählen Sie die verfolgte Astrozyten, klicken Sie auf Anzeigemodus, und wählen Sie Always line mode.
- Gehen Sie zurück zum 3D-Fenster, wo ein Skelett der Astrozyten erscheint.
HINWEIS: Wenn Segmentierung und Signal nicht übereinstimmen, wiederholen Sie die Schritte 7.2.3–7.2.10, und passen Sie den Schwellenwert an, bis sie dies tun. Stellen Sie sicher, dass Sie die anderen Parameter beim Zurücksetzen beim Neustart des Plug-Ins erneut eingeben. - Klicken Sie mit der rechten Maustaste auf das Skelett und wählen Sie die erste Wahl Neuron | Linie 1... APP2_Tracing, auf quantitative Messungen zuzugreifen, die auf einem neuen Fenster Surface angezeigt werden| Objektanmerkung.
HINWEIS: Aufgrund der begrenzten Auflösung der Lichtmikroskopie liefern die unter den aufgeführten Positionen angezeigten Messungen Anzahl der Zweige und anzahl der Bifurkationen nur eine grobe Schätzung der Komplexität der Astrozytenlaube.
- Öffnen Sie das RGB-Bild in Vaa3D. Weiter zu Bild | Daten | Geometrie dann Bild Resampling, und passen Sie X / Y und Z voxel Größenwerte.
Ergebnisse
Die Elektroporation von MAGIC-Markern in embryonalen kortikalen Vorläufern ermöglicht die Kennzeichnung von Astrozyten von frühen bis späten Stadien der Zerebralparese der Großhirnrindeentwicklung (Abbildung 1). Diese Astrozyten wurden in allen kortikalen Schichten in verschiedenen postnatalen Stadien (P4, P7, P21) gefunden, da sie sich weit in die gesamte Großhirnrinde verteilten. Sie wurden mit gefliesten konfokalen Bildern bewertet, die mit einem 20x 0,8 NA (oder höher NA) Objektiv aufgenommen und als Z-Stack-Rekonstruktionen zusammengesetzt wurden (Abbildung 2). MAGIC Markers kombinatorische Etikettierung ermöglichte die Individualisierung von kortikalen Astrozyten und extraktionen Informationen über ihr Volumen und ihre Morphologie. Mit Hilfe der kommerziellen Bildanalyse-Software wurde die Kontur der einzelnen Astrozyten auf jedem einzelnen optischen Abschnitt von konfokalen Bildstapeln abgegrenzt, um die territoriale Domäne, die von jedem Astrozyten besetzt ist, zu segmentieren und zu rekonstruieren (Abbildung 3). Aus den gleichen Z-Bild-Stacks wurde die verzweigte Morphologie einzelner kortikaler Astrozyten mit der Open-Access-Software segmentiert, die die Extraktion des Skeletts der wichtigsten Astrozytenprozesse ermöglicht (Abbildung 4). Diese Segmentierungs- und Rückverfolgungswerkzeuge lieferten eine semiquantitative Bewertung des Anstiegs des territorialen Volumens (Abbildung 3) und der morphologischen Komplexität (Abbildung 4), die für einzelne kortikale Astrozyten von frühen bis späten postnatalen Stadien14aufgetreten ist. Diese Ansätze zeigten auch die Heterogenität von Volumen und Morphologie, die von verschiedenen kortikalen Astrozyten im gleichen Entwicklungsstadium gezeigt wird, wie in Abbildung 2, Abbildung 3und Abbildung 4dargestellt.

Abbildung 1: Schematische Darstellung von MAGIC Markern (MM) in der Uteroelektroporation (IUE), um kortikale Vorläufer und deren Abstieg während der Gehirnentwicklung zu kennzeichnen. (A) Das MM-Toolkit besteht aus mehreren Plasmiden, die PB-Cytbow, Tol2-Nucbow, PB- und Tol2-Transposasen kodieren, sowie selbstexzisierbare Cre-Rekombinatase (seCre). In MM-Konstrukten flankieren drei Paare inkompatibler Lox-Sites (loxN, lox2272und loxP) vier unterschiedliche FP-Codierungssequenzen (EBFP2, mTurquoise2/mCerulean, EYFP, tdTomato/mCherry) und schaffen sich gegenseitig ausschließende Möglichkeiten der Exzisionskombination bei Cre-Rekombination. Vor der Cre-Aktion wird nur das erste Gen (EBFP2) exprimiert. Nach der durch seCre induzierten cre-vermittelten Exzision wird entweder tdTomato/mCherry (rotes FP), EYFP (grünes FP) oder mTurquoise2/mCerulean (Cyan FP) ausgedrückt. Die Co-Expression von FP aus mehreren MAGIC Markern ergibt Farbkombinationen im Zytoplasma (PB-CAG-Cytbow) oder im Kern (Tol2-CAG-Nucbow) markierter Zellen. PB- und Tol2-Transpositionsendfüße, die die MM-Kassetten rahmen, ermöglichen ihre Integration in das Genom kortikaler Vorläufer, wenn MM-Konstrukte zusammen mit PB- und Tol2-Transposasen koalierenden Plasmiden koelektrotisiert werden. (B–G) Grafische Darstellung der aufeinanderfolgenden Schritte der IUE einschließlich der Laparotomie von anästhesierten trächtigen Mäusen (B), Injektion des MM-Plasmidmixes (C) in die seitlichen Ventrikel der Embryonen (D), Abgabe elektrischer Impulse durch sorgfältig positionierte Pinzetten (E), um kortikale Vorläufer in einer der beiden Gehirnhälften ( F ) und das Ai0um von schwangeren Mausadels ( G ) zu zielen, um kortikale Vorläufer in eine der beiden Gehirnhälften (F) und das Saaten von schwangeren Mausagen (G) zu zielen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
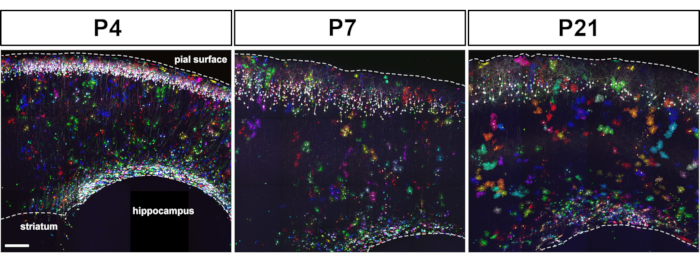
Abbildung 2: Nach der Utero-Elektroporation des MAGIC Markers-Toolkits wurden mehrfarbige Astrozyten in der gesamten Großhirnrinde in postnatalen Stadien verstreut gefunden. IUE von Plasmiden, die die Expression von MM-, SeCre-, PB- und Tol2-Transposasen in E15.5-Maus-Kortika-Vorläufern antreiben, führten zur Kennzeichnung von Schicht 2–3-Neuronen und Astrozyten bei P4, P7 und P21. Expressionsniveau und Farbpalette hing von der Anzahl der MM-Transgene ab, die in das Genom kortikaler Vorläufer integriert sind. Montage von maximalintensiven Projektionen aus gekachelten konfokalen Bildstapeln, die auf 80 'm sagittalen Gehirnabschnitten erworben wurden. Maßstabsleiste: 200 m. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 3: Segmentierung der kortikalen astrozytenterritorialen Domäne in unterschiedlichen Entwicklungsstadien. Maximale Intensitätsprojektionen von beschnittenen konfokalen Z-Stack- und Farbtaten (A-F) und ihrer zugehörigen territorialen Domäne, segmentiert mit der kommerziellen Software (A'-F') in drei unterschiedlichen Entwicklungsstadien: P4 (A-B, A'-B'),P7 (C-D, C'-D') bzw. P21 (E-F, E'-F'). Maßstabsleiste: 20 m. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
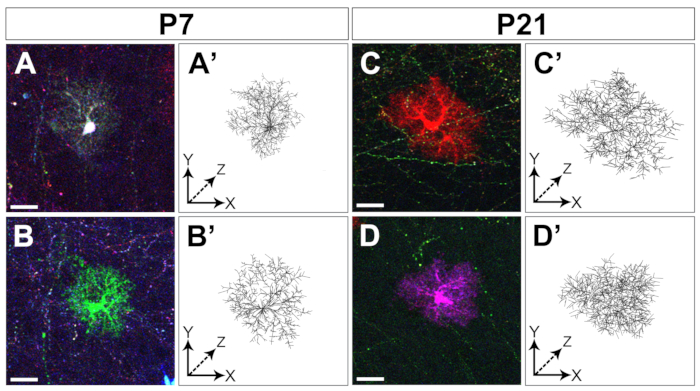
Abbildung 4: Nachverfolgung der kortikalen Astrozytenarborisierung. Beispiele für zwei unterschiedliche Astrozyten, die aus konfokalen Z-Stacks (A-D) und der Rekonstruktion ihrer grob mit Vaa3D ( A'-D' segmentierten Arborisierung (A'-D') stammen, die in zwei unterschiedlichen Entwicklungsstadien gesammelt wurden: P7 (A-B, A'-B') bzw. P21 (C-D, C'-D'). Maßstabsleiste: 20 m. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
In der Utero-Elektroporation (IUE) von MAGIC-Markern in kortikalen Vorläufern (Abbildung 1) ermöglichte die Kennzeichnung von Astrozyten in der gesamten postnatalen Großhirnrinde in verschiedenen postnatalen Stadien (P4-P7-P21, Abbildung 2). Interessanterweise ist das Stadium von IUE nicht kritisch, da die Elektroporation von E13.5 bis E15.5 ähnliche Beschriftungsmuster in Bezug auf kortikale Astrozyten14ergibt. Die Lage der markierten pyramidenförmigen Neuronen im kortikalen Parenchym variiert jedoch mit dem Elektroporationsstadium. Tatsächlich trat IUE bei E15-Markierungen der Schicht 2–3-Neuronen auf, während IUE bei E13-Etiketten pyramidale Neuronen in allen kortikalen Schichten von Schicht 5 bis Schicht 2–36,27. Diese gemeinsame Kennzeichnung kortikaler pyramidaler Neuronen nach MM IUE ist die Hauptbeschränkung dieser Methode, da sie die halbautomatische Segmentierung der Astrozytenmorphologie in Schichten verhindert, in denen eine dichte neuronale Etikettierung die Erkennung von Astrozytenprozessen beeinträchtigt. Sollte dies ein Problem sein, könnte MM in postnatalen Stadien wie in PALE elektropoiert werden. Bei P4 kann die Kennzeichnung von radialen Gliafasern, die in diesem Stadium noch vorhanden sind, auch die Segmentierung der Vaa3D-Arbor beeinträchtigen. Während umständlich, eine Lösung, wenn man mit Astrozyten Lauben Rekonstruktion in diesem Stadium gehen will, ist manuell radiale Gliafasern zu entfernen, indem sie schrittweise ersetzen das radiale Fasersignal mit schwarzen Pixeln um die Astrozyten von Interesse mit Adobe Photoshop.
Trotz dieser Einschränkung ist MM IUE eine leistungsstarke Technik, wenn sie angemessen ausgeführt wird. Einige kritische Schritte müssen mit Vorsicht behandelt werden: 1) Embryonen müssen während des gesamten Operationsvorgangs feucht gehalten und sorgfältig manipuliert werden, um ihr Überleben zu erhöhen; 2) die Verwendung von Glaskapillaren mit einem großen Durchmesser oder zu eng verquetschenden embryonalen Beuteln kann zu Beutelbrüchen und damit zum Tod von Embryonen führen; 3) während der DNA-Injektion müssen Blutgefäße vermieden werden, um Blutungen zu verhindern; 4) das gesamte Verfahren sollte nicht länger als 40 Minuten von der Anästhesie bis zur Naht dauern, um das Überleben des Embryos zu maximieren; 5) Stress spielt eine entscheidende Rolle für den IUE-Erfolg und daher zusätzliche Stressquellen wie Käfigwechsel, Transport, Geräusche und Vibrationen müssen von 5 Tagen vor der Operation bis 7 Tage nach der Geburt vermieden werden, um Abtreibung und Kannibalismus zu verhindern.
Bemerkenswert ist, dass Experimentatoren, die gezielt auf Zellen abzielen möchten, die in einem bestimmten Stadium geboren wurden, das MM-Toolkit verwenden können, ohne die PiggyBac- und Tol2-Transposasen hinzuzufügen, so dass nur die Zellen, die zum Zeitpunkt der Elektroporation geboren wurden, die kombinatorischen Etiketten ausdrücken. Ein weiterer Vorteil der Methode ist die Flexibilität, die sie in Bezug auf die Dichte der markierten Zellen und ihre Position in verschiedenen Hirnregionen verleiht. Tatsächlich kann eine dichtere Etikettierung kortikaler Astrozyten erreicht werden, indem die Gesamtkonzentration von MM-Transgenen erhöht wird, während das Verhältnis der Plasmide konstant bleibt (1:10 Verhältnis für Cre-Rekombinatog/MM-Konstrukte und 1:2-Verhältnis für Transposasen/MM-Konstrukte). Im Gegensatz zu monochromen Ansätzen wie der Elektroporation von einfarbigen Transposons oder der Cre-Elektroporation bei Ai9-Mäusen, bei denen die Fähigkeit, einzelne Astrozyten herauszuarbeiten, eine spärliche Beschriftung erfordert, ermöglichen Farbkontraste, die die MAGIC Markers-Strategie bietet, die Individualisierung von Astrozyten über eine breite Palette von Beschriftungsdichten. Darüber hinaus ermöglicht die Positionierung der Elektrodensonden in unterschiedlichen Ausrichtungen das Targeting verschiedener Hirnregionen wie das prospektive Striatum (Anode in der ventralen Position, gegenüber der dorsalen Position, die erforderlich ist, um Elektroporation in der Großhirnrinde zu erreichen) oder Hippocampus (Anode in medialer Position)28. Schließlich kann IUE in verschiedenen Mäusen wie Outbred (OF1, Swiss) und Inzuchtmäusen (C57BL/6J oder N) durchgeführt werden, was den Weg für den Einsatz des MM-Toolkits in transgenen Tierseuchenmodellen ebnet. Um IUE bei inbrünstigen Mäusen erfolgreich zu erreichen, sollte man jedoch die Anzahl der Impulse (drei Impulse für C57BL/6-Mäuse gegenüber fünf Impulsen in der Schweiz), Spannung (30 V statt 35 V) und die analgetische Dosis (0,15 mg/ml Buprenorphin-Stammlösung und ein injiziertes Volumen von 0,8 l/g BW) anpassen.
Im Vergleich zur transgenen Tierzucht oder den PALE- und StarTrack-Ansätzen bietet diese Methode mehrere Vorteile. Zunächst verwendet es im Gegensatz zur Zuchtstrategie nur wenige Tiere. Es ermöglicht auch die Kennzeichnung von kortikalen Astrozyten seit den frühesten Stadien ihrer Entwicklung, einschließlich embryonaler Stadien, im Gegensatz zu PALE4, das auf postnataler Elektroporation beruht. Darüber hinaus beruht diese Strategie im Vergleich zu den zwölf Reporterkonstrukten, die im StarTrack-Ansatz8verwendet werden, auf nur zwei mehrfarbigen Transgenen, wodurch die Vorbereitung und Bildgebung von DNA-Mischungen vereinfacht wird. Darüber hinaus wird das Gleichgewicht zwischen den verschiedenen Farben, die von MM stochastisch ausgedrückt werden, an sich durch die Struktur der Transgene bestimmt und hängt nicht von der Vermischung verschiedener Komponenten durch den Experimentator ab. Darüber hinaus kann diese Strategie über einfache anatomische Überlegungen hinausgehen und erfolgreich für die multiklonale Analyse der Astrozytenentwicklung angewendet werden, wie in der zuvor veröffentlichten Arbeit14gezeigt. Diese Arbeit, die seltene Farbkombinationen von zytoplasmatischen und nuklearen Markern verwendet, um kortikale Astrozytenklone zu definieren, zeigte, dass sie eine große Variabilität in Bezug auf räumliche Verteilung, strukturelle Organisation, Anzahl und Subtyp der erzeugten Zellen aufweisen.
Kortikale Astrozyten, die aus MM-markierten kortikalen Vorläufern geboren wurden, zeigten einen signifikanten Farbkontrast und verteilten sich weit über die gesamte Großhirnrinde (Abbildung 2). Einfache Mehrkanal-Z-Stack-Erfassungen mittels konfokaler Mikroskopie wurden verwendet, um in mehreren postnatalen Stadien auf wichtige Astrozytenmerkmale wie ihr territoriales Volumen (Abbildung 3) und ihre morphologische Komplexität (Abbildung 4) zuzugreifen. Jenseits von Astrozyten kann diese Methode angepasst werden, um die Morphologie anderer Gliazellen wie Oligodendrozyten zu untersuchen. Es sollte jedoch nicht vergessen werden, dass die begrenzte Auflösung, die durch konfokale Mikroskopie angeboten wird, nur eine partielle Darstellung der astrozytenmorphologischen Komplexität bieten kann. Während Bilder mit höherer Auflösung (z. B. 63x 1,4 NA-Ölobjektiv) und Dekonvolution-Algorithmen verwendet werden können, um feinere Details von Astrozyten-Arbors14zu rekonstruieren, können feinste Prozesse nicht mit konventioneller optischer Bildgebung gelöst werden. Nichtsdestotrotz wird die hier vorgestellte Strategie von Interesse sein, um effizient auf einen potenziellen Phänotyp zu untersuchen, der das kortikale Astrozytenvolumen oder die Morphologie in Mausmodellen neurologischer Erkrankungen beeinflusst.
Offenlegungen
Die Autoren haben nichts zu verraten.
Danksagungen
Wir danken S. Fouquet und den bildgebenden und tierischen Kerneinrichtungen des Institut de la Vision und des Institut des Neurosciences de Montpellier (MRT und RAM) für die technische Unterstützung. Diese Arbeit wurde unterstützt durch Stipendien der Région Ile-de-France und der Fondation ARC pour la Recherche sur le Cancer bis S.C und der Université Paris-Saclay (Initiatives Doctorales Interdisciplinaires) nach L.A., durch Finanzierung durch den Europäischen Forschungsrat (ERC-SG 336331, PI J. Valette) an E.H., durch Agence Nationale de la Recherche im Rahmen der Verträge ANR-10-LABX-65 (LabEx LifeSenses), ANR-11-EQPX-0029 (Equipex Morphoscope2), ANR-10-INBS-04 (France BioImagings) , von Fondation pour la Recherche Médicale (Ref. DBI20141231328), vom European Research Council (ERC-CoG 649117, PI J. Livet) und vom ATIP-Avenir-Programm (PI K. Loulier).
Materialien
| Name | Company | Catalog Number | Comments |
| 1.1 Bacteria transformation | |||
| Ampicillin | Euromedex | EU0400-C | |
| DH5 alpha competent cells | Fisher Scientitic | 11563117 | |
| Ice box | Dutscher | 139959 | |
| Kanamycin | Sigma | 60615 | |
| LB Agar | Sigma | L2897 | |
| SOC medium | Fisher Scientitic | 11563117 | |
| Sterile petri dish- 10 cm | Thermo Fisher | 150350 | |
| Water bath | VWR | 462-0556H | |
| 1.2 Plasmid culture | |||
| 14 ml culture tube | Dutscher | 187262 | |
| Glass erlenmeyer- 2L | Fisher Scientitic | 11383454 | |
| LB medium | Sigma | L3522 | |
| 1.3 Plasmid DNA preparation | |||
| NucleoBond Xtra Maxi Plus EF | Macherey-Nagel | 740426.10 | |
| 2.1 Preparation of the solutions | |||
| 26 G x 1/2 needle | Terumo | 8AN2613R1 | |
| 30 G x 1/2 needle | Terumo | 8AN3013R1 | |
| Fast Green | Sigma Aldrich | F7272 | |
| NaCl | VWR | 27810.295 | |
| Single-use polypropylene syringe, 1 mL | Dutscher | 50002 | |
| 2.2 Preparation of the surgery material | |||
| Adson Forceps - DeBakey Pattern- 12.5 cm | FST | 11617-12 | |
| Arched tip Forceps- 10 cm | FST | 11071-10 | |
| Glass bead sterilizer Steri 250 | Sigma | Z378569 | |
| Glass micropipette 1 mm diameter | FHC | 10-10-L | |
| Graefe Forceps - Titanium 1 mm Tips Slight Curve- 10 cm | FST | 11651-10 | |
| Graefe Forceps - Titanium 1 mm Tips Straight- 10 cm | FST | 11650-10 | |
| Iris Scissors - Delicate Straight- 9 cm | FST | 14060-09 | |
| Laboratory tape | Fisher Scientitic | 11730454 | |
| Microinjector | INJECT+MATIC | No catalog number | |
| Olsen-Hegar Needle Holder - 12 cm | FST | 12002-12 | |
| Optical fiber | VWR | 631-1806 | |
| Plastic-coated white paper | Distrimed | 700103 | |
| Signagel electrode gel | Free-Med | 15-60 | |
| Sterile Petri dish- 35 mm | Dutscher | 056714 | |
| Sterilizer, glass dry bead, Steri 250 | Sigma | Z378569 | |
| 2.3 Preparation of the pregnant female mouse | |||
| Alcohol pad | Alcomed | 1731000 | |
| Buprecare | Axience | 0.3 mg/ml | |
| Compress | tRAFFIN | 70189 | |
| Ketamine | Merial | Imalgene 1000 | |
| Ocular gel | tvm lab | Ocry-gel | |
| RjOrl:SWISS mice | Janvier Labs | ||
| Vetadine, 10% solution | Vetoquinol | 4337400113B | |
| Warming pad | Harvard Apparatus | 72-0493 | |
| Xylazine | Bayer | Rompun 2% | |
| 3.2 Electroporation | |||
| Absorbable suture Size 4-0 45 cm Suture 1-Needle 19 mm Length 3/8 Circle Reverse | Novosyn | C0068220 | |
| Electroporateur Sonidel | Sonidel | NEPA 21 | |
| Sterile transfer pipets (individually wrapped) | Dutscher | 043202S | |
| Tweezers with 3 mm platinium disk electrodes | Sonidel | CUY650P3 | |
| 4.1 Tissue harvesting and sectioning | |||
| 24-well plate | Falcon | 353047 | |
| Agarose | Lonza | 50004 | |
| Antigenfix | Microm Microtech | U/P0014 | |
| Coverslip | Dutscher | 100266 | |
| Dolethal | Vetoquinol | DOL202 | |
| DPBS (10X), no calcium, no magnesium | Fisher Scientific | 11540486 | |
| Nail polish | EMS | 72180 | |
| Slide | Dutscher | 100001 | |
| Vectashield | Vectorlabs | H-1000 | |
| Vibratome | Leica | VT1000S | |
| 5. Multichannel confocal imaging | |||
| 20X oil NA 0.85 | Olympus | ||
| Confocal Laser Scanning Microscope | Carl Zeiss | LSM880 | |
| Confocal Laser Scanning Microscope | Olympus | FV1000 | |
| Plan Apochromat 20x/0.8 M27 | Carl Zeiss | ||
| 6. Astrocyte territorial volume segmentation | |||
| IMARIS 8.3 and later versions | Bitplane | ||
| 7. Astrocyte arborization tracing | |||
| 3D Visualization-Assisted Analysis software suite (Vaa3D) | HHMI - Janelia Research Campus /Allen Institute for Brain Science |
Referenzen
- Clarke, L. E., Barres, B. A. Emerging roles of astrocytes in neural circuit development. Nature Reviews Neuroscience. 14 (5), 311-321 (2013).
- Ma, Z., Stork, T., Bergles, D. E., Freeman, M. R. Neuromodulators signal through astrocytes to alter neural circuit activity and behaviour. Nature. 539 (7629), 428-432 (2016).
- Blanco-Suárez, E., Caldwell, A. L. M., Allen, N. J. Role of astrocyte-synapse interactions in CNS disorders: Astrocyte-synapse disease. The Journal of Physiology. 595 (6), 1903-1916 (2017).
- Stogsdill, J. A., et al. Astrocytic neuroligins control astrocyte morphogenesis and synaptogenesis. Nature. 551 (7679), 192-197 (2017).
- Srinivasan, R., et al. New Transgenic Mouse Lines for Selectively Targeting Astrocytes and Studying Calcium Signals in Astrocyte Processes in Situ and In Vivo. Neuron. 92 (6), 1181-1195 (2016).
- Tabata, H., Nakajima, K. Efficient in utero gene transfer system to the developing mouse brain using electroporation: visualization of neuronal migration in the developing cortex. Neuroscience. 103 (4), 865-872 (2001).
- Shimogori, T., Ogawa, M. Gene application with in utero electroporation in mouse embryonic brain. Development, Growth & Differentiation. 50 (6), 499-506 (2008).
- García-Marqués, J., López-Mascaraque, L. Clonal Identity Determines Astrocyte Cortical Heterogeneity. Cerebral Cortex. 23 (6), 1463-1472 (2013).
- Martín-López, E., García-Marques, J., Núñez-Llaves, R., López-Mascaraque, L. Clonal Astrocytic Response to Cortical Injury. PLoS ONE. 8 (9), 74039(2013).
- Gutiérrez, Y., et al. Sibling astrocytes share preferential coupling via gap junctions. Glia. 67 (10), 1852-1858 (2019).
- Lee, Y., Messing, A., Su, M., Brenner, M. GFAP promoter elements required for region-specific and astrocyte-specific expression. Glia. 56 (5), 481-493 (2008).
- Yoon, H., Walters, G., Paulsen, A. R., Scarisbrick, I. A. Astrocyte heterogeneity across the brain and spinal cord occurs developmentally, in adulthood and in response to demyelination. PloS One. 12 (7), 0180697(2017).
- Ge, W. P., Miyawaki, A., Gage, F. H., Jan, Y. N., Jan, L. Y. Local generation of glia is a major astrocyte source in postnatal cortex. Nature. 484 (7394), 376-380 (2012).
- Clavreul, S., et al. Cortical astrocytes develop in a plastic manner at both clonal and cellular levels. Nature Communications. 10 (1), 4884(2019).
- Figueres-Oñate, M., García-Marqués, J., López-Mascaraque, L. UbC-StarTrack, a clonal method to target the entire progeny of individual progenitors. Scientific Reports. 6 (1), 33896(2016).
- Figueres-Oñate, M., García-Marqués, J., Pedraza, M., De Carlos, J. A., López-Mascaraque, L. Spatiotemporal analyses of neural lineages after embryonic and postnatal progenitor targeting combining different reporters. Frontiers in Neuroscience. 9, 87(2015).
- Figueres-Oñate, M., Sánchez-Villalón, M., Sánchez-González, R., López-Mascaraque, L. Lineage Tracing and Cell Potential of Postnatal Single Progenitor Cells In Vivo. Stem Cell Reports. 13 (4), 700-712 (2019).
- Peng, H., Ruan, Z., Long, F., Simpson, J. H., Myers, E. W. V3D enables real-time 3D visualization and quantitative analysis of large-scale biological image data sets. Nature Biotechnology. 28 (4), 348-353 (2010).
- Peng, H., Bria, A., Zhou, Z., Iannello, G., Long, F. Extensible visualization and analysis for multidimensional images using Vaa3D. Nature Protocols. 9 (1), 193-208 (2014).
- Peng, H., et al. Virtual finger boosts three-dimensional imaging and microsurgery as well as terabyte volume image visualization and analysis. Nature Communications. 5 (1), 4342(2014).
- Loulier, K., et al. Multiplex Cell and Lineage Tracking with Combinatorial Labels. Neuron. 81 (3), 505-520 (2014).
- Niwa, H., Yamamura, K., Miyazaki, J. Efficient selection for high-expression transfectants with a novel eukaryotic vector. Gene. 108 (2), 193-199 (1991).
- Abdeladim, L., et al. Multicolor multiscale brain imaging with chromatic multiphoton serial microscopy. Nature Communications. 10 (1), 1662(2019).
- Chen, F., LoTurco, J. A method for stable transgenesis of radial glia lineage in rat neocortex by piggyBac mediated transposition. Journal of Neuroscience Methods. 207 (2), 172-180 (2012).
- Siddiqi, F., et al. Fate Mapping by PiggyBac Transposase Reveals That Neocortical GLAST+ Progenitors Generate More Astrocytes Than Nestin+ Progenitors in Rat Neocortex. Cerebral Cortex. 24 (2), 508-520 (2014).
- Yoshida, A., et al. Simultaneous expression of different transgenes in neurons and glia by combining in utero electroporation with the Tol2 transposon-mediated gene transfer system. Genes to Cells. 15 (5), 501-502 (2010).
- LoTurco, J., Manent, J. B., Sidiqi, F. New and Improved Tools for In Utero Electroporation Studies of Developing Cerebral Cortex. Cerebral Cortex. 19, suppl 1 120-125 (2009).
- Pacary, E., et al. Visualization and Genetic Manipulation of Dendrites and Spines in the Mouse Cerebral Cortex and Hippocampus using in utero Electroporation. Journal of Visualized Experiments. (65), e4163(2012).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten