Method Article
多アドレス可能なゲノム積分色(MAGIC)マーカーを皮質マウスアストロサイトに個別化する子宮内電気的
* これらの著者は同等に貢献しました
要約
アストロサイトは大脳皮質を均一にタイル化し、複雑な形態の分析を細胞レベルで困難にします。ここで提供されるプロトコルは、子宮内のエレクトロポレーションに基づく多色標識を使用して、皮質アストロサイトを単一にし、ユーザーフレンドリーな画像解析パイプラインでボリュームと形態を分析します。
要約
マウス大脳皮質に位置する原質星血球(PrA)は、しっかりと並置され、成人期に明らかに連続した三次元マトリックスを形成する。これまでのところ、免疫染色戦略はそれらを選び出して、成熟した動物および皮質形成の過程でそれらの形態をセグメント化することはできません。皮質PrAは、後側のパリウムに位置する前駆物質に由来し、統合ベクターの子宮エレクトロポレーションで容易に標的化することができる。これらの細胞に対して、ピギーバク/Tol2転位とCre/lox の組み換えによって特定の細胞内区画に対処された明確な蛍光タンパク質(青、シアン、黄、赤)を表すマルチアドレス可能なゲノム統合色(MAGIC)マーカー戦略でこれらの細胞にラベルを付けるプロトコルが提示されます。この多色の運命マッピング戦略は、神経新生の開始前にカラーマーカーの組み合わせを持つその場で近くの皮質前駆物質をマークし、個々の細胞レベルで胚性から成体段階まで、アストロサイトを含む子孫を追跡することを可能にする。マルチアドレス可能なゲノム積分カラーマーカー(MAGICマーカーまたはMM)によって提供される電気ポレートベクターと色コントラストの濃度を調整することによって達成される半スパース標識は、アストロサイトを個別化し、その緻密な解剖学的配置にもかかわらず、その領土と複雑な形態を選び出すことを可能にする。ここでは、エレクトロポレーション手順の詳細、共焦点顕微鏡によるマルチチャネル画像スタックの取得、および実験者が個々のPrA量と形態を評価することを可能にするコンピュータ支援3次元セグメンテーションを含む包括的な実験ワークフローを提示します。要約すると、MAGICマーカーのエレクトロポレーションは、多数のアストロサイトを個別にラベル付けし、異なる発達段階で解剖学的特徴にアクセスするための便利な方法を提供します。この技術は、トランスジェニックレポーターラインを持つ複雑な十字に頼ることなく、様々なマウスモデルにおける皮質アストロサイト形態学的特性を分析するのに有用である。
概要
アストロサイトは脳の発達と生理学の中で多くの重要な機能を果たします。栄養摂取や血流を調節する血液脳関門での役割のほかに、ニューロンの活動や行動を変えることができる神経調節薬を産生しながら、シナプス形成と機能に積極的に寄与する。さらに、アストロサイト機能障害は、様々な神経障害3に寄与する。大脳皮質に位置するアストロサイトは、神経細胞プロセスとの広範な接触を可能にする精巧な形態を示す。これらの接触は、回路機能に必須であり、また、細胞接着タンパク質4を介してアストロサイト形態形成およびシナプト生成を制御する。神経科学者は、関心のある神経学的モデルにおけるアストロサイトの発達と形態形成を調査するための便利で堅牢なツールを必要としています。しかし、近隣に対するアストロサイトの接近と均一な三次元タイリングにより、皮質アストロサイトを単一にし、免疫マーカーを使用してその形態を包括的に評価することは困難です。
現在、2つの主要な遺伝子工学戦略は、その際の皮質アストロサイトの標識と個別化を可能にする:トランスジェニックマウスラインでのまばらなレポーター活性化またはレポータープラスミドのエレクトロポレーションを用いた体細胞トランスジェネシス。最初の戦略は、タモキシフェン送達時にアストロサイトで特異的に活性化されたクレリコンビナーゼの誘導可能な形態を発現するマウスでフロクスされたレポーターマウスラインを繁殖させることに依存する(例えば、Aldh1l1-CreERT25)。この戦略には、いくつかの欠点があります。まず、トランスジェニックマウスの繁殖には多数の動物が必要であり、多重アッセイは典型的には、皮質アストロサイトの十分にまばらな標識を提供するためにタモキシフェンの適切な用量を決定するために必要である。目的の遺伝的マウスモデルで皮質アストロサイト表現型を分析するには、さらに多くの繁殖とマウスの消費が必要になります。さらに、子宮タモキシフェン注射では分化を妨げることが知られており、この戦略はアストロサイトの初期段階の研究に適用することが困難である。インビボDNAエレクトロポレーションは、動物の最小数6に依存する代替タモキシフェンフリー戦略である。胚期または出生後の段階で行われるこのアプローチは、げっ歯類の側腹腔にレポータープラスミドを注入し、続いて細胞膜に毛穴を作る電気パルスを注入することで構成され、DNAが心室を裏打ちする前駆細胞に入ることを可能にする。続いて、電気ポレートされたプラスミドによって運ばれるレポータートランスジーンは、標的細胞機械によって処理され、7を発現する。2つのエレクトロポレーション方法は、以前にマウス皮質アストロサイトにラベルを付けるために説明されている:1)早期出生後段階で1-2単色エピソードレポータープラスミドのエレクトロポレーションに依存するエレクトロポレーション(PALE)による出生後アストロサイトラベリング。2)複数の単色統合レポータープラスミド8、9、10の子宮エレクトロポレーション(IUE)に基づくStarTrack戦略。これら2つの技術は、効率的に大脳皮質にPrAを標識するが、彼らはまた、いくつかの制限を提示する。それらの初期バージョンでは、両方の方法は、アストロサイトの発現を駆動するためにグリア線維性酸性タンパク質(GFAP)プロモーターに依存しており、これは、通常の安静時PrA11,12よりも強くGFAPを発現するピアルおよび反応性アストロサイトに対してラベリングを偏らせる可能性がある。PALEに関しては、早期生まれのPrA(または初期の剥離前駆体から生じるもの)の標識を防ぐエレクトロポレーションの後期段階と、アストログリア開発の初期段階の分析、およびPrAが出生後13週目の間に受ける大規模な分裂の間に連続した分裂を通じて希釈されるエピソームベクターの使用である。PALEとは対照的に、StarTrackは、PrAへの胚性および出生後前駆物質の両方の寄与を追跡することを可能にする統合レポータープラスミドの胚エレクトロポレーションに基づいています。ユビキチンCプロモーター(UbC-StarTrack)に依存する更新されたStarTrackスキームは、神経前駆物質15、16、17の神経およびグリア降下(アストロサイトを含む)の両方における蛍光レポーターのより広い発現を達成する。しかし、現在のバージョンでは、このアプローチの実装は、部分的な励起および発光スペクトルの重複を有する6つの蛍光タンパク質(FP)を発現する12の異なるプラスミドの等モル混合物に依存するため、複雑である。
ここで提示される、強力で広く活性なプロモーターによって駆動される統合レポーター構築物を用いた子宮エレクトロポレーションベースの多色ラベリング法における簡単な表題は、皮質アストロサイト14を単一化する。また、ライセンス(例えば、イマリス)とオープンアクセス(Vaa3D18、19、20)の両方を使用した容易な画像解析パイプラインが、それぞれアストロサイトの領土容積と樹状化をセグメント化するために提供される。前述の方法と比較して、この戦略は、細胞質に向けられた1〜2色の多色積分性遺伝子多アドレス組み込み色マーカー(MAGICマーカーまたはMM21)と、細胞メガロウイルスエンハンサー、ニワトリβアクチンプロモーター、ウサギβ-globinsplicesを含む合成CAGプロモーターによって発現が駆動される核細胞コンパートメントのみに依存する。これにより、胚性から出生後後期までの皮質アストロサイトの標識および追跡が可能となり、GFAP発現14,23とは無関係である。これらのトランス遺伝子のそれぞれは、次の4つの異なるFPを有する:eBFP、mTurquoise2/mCerulean、EYFP、およびtdTomato / mCherryは、1)シーケンシャルチャネル取得で簡単に回避できる最小限のスペクトル重複を表示する;2)最適化された励起力とコレクションのゲイン。3)狭いFP放出窓を収集するために特定の二色フィルタ。MM戦略は、細胞集団におけるFPの確率発現を駆動するために、自己切除可能なCreリコンビナーゼ(seCre)とCre/loxの再結合を使用する。MMトランスジーンの単一のコピーは、相互に排他的な方法でFPを発現し、複数の遺伝子がFPの組み合わせを生み出し、数十の異なる色合いを生み出します。遺伝子導入のゲノム積分は、ピギーバク(PB)またはTol2転置システム24、25、26によって駆動される。したがって、子宮エレクトロポレーションを通して、MMツールキットとそれが生成する多色の「モザイク」は、複数の隣接する皮質前駆物質の同時マーキングと、皮質アストロサイトを含むそれらのグリア降下の追跡を長期間にわたって可能にする。色のコントラストは、PrAの輪郭の明確なFPの表現から生じるコントラストを許可し、その後、その領土容積(IMARISを使用)と複雑な形態(Vaa3Dを使用)に関する重要な情報を抽出します。ここで詳しく示される多色戦略は、様々な発達段階で野生型マウスの皮質アストロサイト表面および形態に迅速かつ容易にアクセスできる便利で堅牢な方法であり、トランスジェニックレポーターラインを使用することなく、神経疾患のマウスモデルにおけるアストロサイト解剖学的特徴を調査するために容易に適応可能である。
プロトコル
ここに記載されているすべての動物の手順は、制度上のガイドラインに従って行われました。動物の議定書はチャールズ・ダーウィンの動物実験倫理委員会(CEEACD/N°5)によって承認された。
1. 子宮内のマジックマーカー用の内毒素フリープラスミドの調製
- 細菌変換
- 氷上で、-70°Cで保存されたDH5アルファの有数の細胞を解凍する。
- 適切な抗生物質(100μg/mLアンピシリンまたは50μg/mLカナマイシン)を含む寒天プレートを37°Cで温めます。
- DH5アルファのコンピテント細胞の10 μLにマジックマーカープラスミドDNAの1 μLを加え、混合せずに10分間氷上でインキュベートします。
- 熱衝撃変換のために、アリコートを45sの42°Cの水浴に入れ、すぐに氷の上に置き、3〜5分待ちます。
- 滅菌条件下では、SOC培地を230μL加え、37°Cで1時間インキュベートします。
- アリコートの含有量を寒天プレートに広げ、37°Cで一晩インキュベートする。
- プラスミド文化
- 翌朝、無菌状態で、寒天プレートからコロニーを拾い、適切な抗生物質で2mLのLB培地を含む14mLチューブに入れる。300rpmで振るインキュベーターで37°Cで1日のインキュベートを行います。
- 一日の終わりに、ステップ1.2.1から2mLスターター培養を使用して抗生物質を用いたLBの種子300mLを、300rpmで振度インキュベーターで37°Cで一晩インキュベートする。
- プラスミドDNA調製
- 翌朝、メーカーのプロトコルに従って、ENDOTOキシンフリーのマキシプレップキットを使用して、MAGICマーカープラスミドDNA(すなわち 、PB-CAG-Cytbow および Tol2-CAG-Nucbow) とPBおよびTol2トランスポザーゼおよびクレコンビナーゼを発現するCAG駆動プラスミドの精製を進める。
- DNAを200μLの無菌水で溶出し、-20°Cで保存する前に分光光度計を使用してその濃度を推定します。
2. 子宮内電散(MM IUE)におけるマジックマーカーの準備
- ソリューションの準備
- 水浴中の37°Cで0.9%の生理食液の30mLを温め、手術の全期間を保ちます。
- PB-CAG-CytbowとTol2-CAG-Nucbow(最終濃度、それぞれ0.8 μg/μL)、PBおよびTol2トランスポーゼ(最終濃度、0.4 μg/μLそれぞれ)、CAG-seCre(最終濃度、0.16 μg/μL)、および0.01%高速グリーンダイを含むプラスミドミックスを準備します。
注: アストロサイト解剖学的再建のために 、Tol2-CAG-Nucbow コンストラクトは省略できます。しかし、このプラスミドは、密接に並置されたアストロサイトの二重を区別するのに有用であり、またMAGICマーカーを使用してアストロサイト14間のクローン関係を探査する場合である。 - 100 μLのケタミン(100 mg/mL)と100 μLのキシラジン(20 mg/mL)を2 mLの生理食塩水で希釈した麻酔液を調製します。
- 生理食前の溶液に0.3 mg/mLブプレノルフィンストック溶液を希釈して鎮痛液を調製。
- 手術材料の準備
- ガラスビーズの殺菌器または同等の温度で外科用具( 材料表を参照)を殺菌する。
- 35mm皿に電極ゲルを1滴入れます。
- マイクロインジェクターホルダーにマイクロピペットを挿入し、マイクロピペットの先端を壊し、DNA溶液を熱望します。
- ファストグリーンソリューションの1μLドロップ(0.01%)を配置する3cm皿の蓋で、それを基準として使用して、細かい鉗子で先端を壊すことによってマイクロピペットの先端の直径を調節する。マイクロインジェクターで同等のサイズの低下が発生するように圧力パラメータを調整し、1回のインジェクションにつき約1μLのDNA溶液を送達できるようにします。
- 妊娠中の女性マウスの準備
- RjOrl:SWISS妊娠中のマウスの重量を量る。
- 麻酔液の体重1グラム当たり12.5μL(BW)で腹腔内注射を行います。5分間待ち、つまんでマウスが眠っていることを確認します。
- 動物がピンチに反応しなくなったら、1.6 μL/g BWの鎮痛液で皮下に注入します。
- 手術中の乾燥を防ぐために、各目に眼ゲルの滴を追加し、動物の腹を暖かいパッドの上に置きます。
- 腹部を軽く剃り、ヨウ素を浸したパッドできれいにし、かき領域をアルコールパッドで消毒します。
- 剃った、きれいにし、消毒された区域のまわりで無菌の圧縮を置くことによって作動の分野を置く。
3. 子宮エレクトロポレーション(IUE)
- 心室内注射
- 腹部の下部から皮膚を通り抜け、次に下層筋を通して、正中線に沿って2cmの垂直切開を切る。胚袋を穏やかに操作して子宮の角を露出させ、子宮頸部の位置と子宮頸部の両側の胚袋の数を評価する。
- E15.5胚の脳を電気電解してブレグマを見るために向き、その位置が脳裂け目に沿って走る3つの主要血管の接合部と一致すると容易に認識される。
- ブレグマ(頭蓋骨を通して見える)と目の間の仮想線を想像してみてください。仮想線と縦裂の間にマイクロピペットを導入し、インジェクタのフットペダルを押して、標的となる半球の側心室に1μLのDNA溶液を送達します。
注:適切な場所に注入すると、充填された側心室が青色に表示され、DNA溶液で満たされていることを示します。
- エレクトロポレーション
- 注入された胚の両側に、注入された半球を覆う陽極を用いて、電極を塗布する( 材料表を参照)。電極ゲルに浸した。エレクトロポレーターのフットペダルを押して、35 Vの50 msパルスを4個ずつ、それぞれ950 ms間隔で分けます。
- 温めた生理液で胚を湿らせる。
注:胚は、手術全体の間に温めた生理液を使用して湿気を保つべきであり、子宮は乾燥してはいけません。 - 各胚について、ステップ 3.1.2 ~ 3.2.2 を繰り返します。
- すべての標的胚が電気ポポレートされたら、腹部の子宮の角を鉗子で優しく押し戻して元の位置に戻します。縫合糸が行われている間、子宮が乾燥するのを防ぐために、腹腔に温めた生理液を充填します。
- まず、連続吸収性縫合糸で腹筋を閉じ、次に4-0縫合を使用して複数の個々のステッチ(〜10)で皮膚を閉じます。
- きれいなケージに動物を入れ、きれいなペーパータオルの上に横たわり、目を覚まして自分で動き始めるまで5〜10分ごとに動物を反対側に向けます。
- 特に巣が作られた場合は、翌日の動物の状態を評価します。
注意:手術後の治療は必要ありません。巣がない場合、痛みの兆候(例えば、プロストレーション、シャギーファー)、および/または大量の出血は、動物を遅滞なく安楽死させるべきです。
4. 組織の収穫と切除
- 組織コレクション
- 所望の収穫時間に終末麻酔のために腹腔内にフェノバルビタール(100mg/kg BW)を注入する。この場合、収穫時間は出生後(P)日P4、P7、およびP21であった。
- 冷たくプレメイドパラホルムアルデヒドベースの溶液を用いて心臓内灌流を行う。
- 脳を解剖し、パラホルムアルデヒドベースの溶液で4°Cで一晩置き、後置きを行います。
- 組織
- 翌朝、1x PBSで脳3xを10分間洗いすがします。
- 1x PBSに溶解した3%アガロースに脳を埋め込む。
- 振動刃のミクロトームを使用して80μmのセクションをカットします。
- 1x PBSであらかじめ充填された24ウェルプレートにセクションを収集します。
- スライドとカバースリップの間に取り付け媒体のセクションを取り付けます( 材料表を参照)。最適な蛍光タンパク質の保存と長期保存のために-20 °Cで取り付けたスライドを保ちます。
5. マルチチャンネル共焦点イメージング
- 顕微鏡の設定
- 440、515、559 nmレーザーラインを使用して、mCerulean/mTurquoise2、EYFP、tdTomato/mCherryを個別に励起するように共焦点顕微鏡の構成を設定します。
- 20x 0.8 NA (またはそれ以上の NA) の目的を使用し、ナイキスト基準に従って XY サンプリングと Z ステップ サイズを調整します。
注:高解像度(例えば、60x 1.4 NA油の目的)とデコンボリューションアルゴリズムで取得した画像は、アストロサイトアーバーのより細かい詳細の再構築を可能にします。しかし、実験者は、最高級のアストロサイトプロセスが従来の光学イメージングによって解決されない可能性があることを覚えておいてください。
- 画像取得
- 電気泳動領域で最も明るいアストロサイトを見つけます。
- サーフェスの近くに配置されたラベル付きセルは、スライスの奥深くにあるセルよりも明るく表示される場合があるため、画像が飽和しないようにサーフェス セルの取得設定を調整します。
- 3 つのチャンネルごとに取得設定を個別に調整し、ゼロ値を青で、最大ピクセル値を赤で表示する HiLo LUT を使用してピクセルの飽和を避けるようにします。
注: バランスの取れた画像には、青と赤のピクセルはほとんど表示されません。 - 顕微鏡の電動ステージを使用してタイル化された1,024 x 1,024ピクセルZスタックを取得し、隣接するスタック間で10%のオーバーラップを行い、その後、電気ポレートされた領域または対象ゾーンのモザイク再構築を可能にします。
6. アストロサイトの領土容積のセグメンテーション
メモ:これは商用ソフトウェアプログラム(例えば、IMARIS)を使用して実行されます。
-
データセットの準備
- 画像化した組織セクションに完全に同封された細胞を選択して、3D再構成(250 x 250ピクセル)内の標識されたアストロサイトをトリミングします。
メモ: 使用するコンピュータがそれらを処理できる場合は、より大きなボリュームで直接作業することもできます。 - 「昇天」ビューの「オブジェクト」ツールバーにある「青い表面」ボタンをクリックして、各アストロサイトに新しいサーフェスを作成します。
- より良いビジュアライゼーションのコントラストを得るために、まず [編集] をクリックして、最小および最大の色コントラスト値を調整| [表示の調整] オプションを表示し、両方のハンドルをドラッグします。必要に応じて、[ 表示調整 ]ウィンドウでチャンネル名を直接クリックしてチャンネルの色を変更し、新しい色を選択します。
注: 常に同じカラー ディスプレイを使用して、視覚的なバイアスを防ぎます。 - [ 編集] をクリック|画像プロパティ を手動でマイクロメートル単位でボクセルサイズを示します。ボクセルのサイズが正確でない場合、ボリュームの計算は不正確になります。
- 新しい設定を保存します。
- 画像化した組織セクションに完全に同封された細胞を選択して、3D再構成(250 x 250ピクセル)内の標識されたアストロサイトをトリミングします。
-
サーフェスセグメンテーション
- 青いアイコンを使用してサーフェスを導入します。[サーフェス]アイコンとボックスがシーンリストに表示されます。[ボリューム] ボックスを使用すると、データセットを表示/非表示にできます。
- サーフェスラインを選択し、[自動作成をスキップ]をクリック |手動で編集する :
- [等高線]をクリック|表示設定をクリックし、[なし] をクリックします。次に、選択ビューに移動し、[描画]ボタンをクリックします。
- [ モード ]をクリックして、描画モードを選択します。
- 高速かつ効率的な アイソライン 半自動描画ツールを使用します。セルのアウトラインを定義するために、マウス ポインタをその上に移動します。 アイソライン のプレビューがアストロサイトのアウトラインと一致しない場合は、マウスポインタの位置を調整します。プレビューを検証するには、選択項目を左クリックします。潜在的な間違いを修正するには、 ボード ウィンドウを使用して現在の Z 平面の輪郭線を削除するか 、Ctrl + Zキーを押します。
- スライス|の使用Z 平面をナビゲートする位置で、Z 平面の番号を変更して次の平面に移動し、新しい輪郭を開始します。セルの中央から優先的に開始し、四肢に移動します。
- アストロサイトを含むすべての Z 平面に等高線が描画されたら、[ サーフェスを作成]をクリックします。サーフェスを作成する前に、すべてのコンポーネントが接続されていることを確認します。ない場合は、ボリュームデータをエクスポートする前に、最大のものを選択するか、関連するデータを接続します。
- データパネルに表示される定量的データを確認し、統計をスプレッドシート形式でエクスポートして、ボリューム値と単位を節約します。
- 後でアクセスするには、サーフェスを新しい名前で保存します。
7. アストロサイトの樹状化をトレースする
注:これはオープンアクセスソフトウェアプログラムVaa3Dを使用して行われます。
- データセットの準備
- イメージ スタックを読み込み、分離したアストロサイトまたは別の色を表示する近くのアストロサイトを検索します。
注: 目的 NA とサンプリングを増やすことで、再構築の解像度を改善できます。しかし、最終的には、共焦点顕微鏡の分解能限界により、最高級のアストロサイトプロセスを正確に追跡することはできません。取得した画像の解像度を超えて過剰にセグメント化しないように注意してください。 - フィジーを使用して、各アストロサイトの周りに250 x 250ピクセルの画像スタックをトリミングします。
- Vaa3D トレースは 1 つのカラーでのみ実行するので、1 つのチャンネルを選択して他のチャンネルを非アクティブ化します。
- 画像を RGB に変換し 、.tiff 形式で保存します。
- イメージ スタックを読み込み、分離したアストロサイトまたは別の色を表示する近くのアストロサイトを検索します。
- アーバートレース
- VAA3D で RGB 画像を開きます。イメージ|に移動データ|ジオメトリは次にイメージの再サンプリングを行い、X/Y および Z ボクセル サイズの値を調整します。
注:アストロサイトアーバーを再構築する際は、画像によって提供される解像度よりも細かい詳細を追跡しないように注意する必要があります。 - [ 画像全体の3Dビューアを視覚化|をクリックして、3Dウィンドウを開きます。3D 画像を右クリックし 、1-右クリックを選択してマーカーを定義します。カーソルを使用してアストロサイトの中心をポイントし、右クリックしてマーカーを設定します。
注 :3D ビューに再度アクセスするには、[エスケープ] をクリックします。 - 高度な| 3D トレース |に移動します。Vaa3D-ニューロン2-オートトレース.
- 新しく開いたウィンドウで、プラグインを適用するチャンネルを選択します。
- 背景のしきい値を選択します (多くの場合、30 ~ 90)。必要に応じて、各アストロサイトにこの値を適合させます。
- [2Dからの半径]をオフにし、自動ダウン サンプルと自動リサンプルをオンのままにします。
- cnn_typeを3 に設定し、length_threshを 1 に、SR_ratioを 0.1 に設定します。
- [OK]をクリックした後、プラグインが元の名前に基づいて 2 つのファイルを自動的に生成することを確認します。サフィックス -ini.swc と -coordinateX-座標Y-座標Z-app2.swc が追加されます。プラグインの実行を継続しながら上書きしないように、これらの名前ファイルに独自のラベルを手動で追加します。
- オブジェクト マネージャを開く 、 ニューロン|に移動します 。[線の構造] でトレースされたアストロサイトを選択し、[ 表示モード] をクリックして、[ 常に行モード] を選択します。
- 3D ウィンドウに戻り、そこでアストロサイトのスケルトンが表示されます。
注: セグメンテーションと信号が一致しない場合は、ステップ 7.2.3 ~ 7.2.10 を繰り返し、しきい値を調整します。プラグインの再起動時にリセットされる他のパラメーターを再入力してください。 - スケルトンを右クリックし、第一選択ニューロン|ライン#1.を選択します。新しいウィンドウ Surface に表示される定量的な測定値にアクセスするには、APP2_Tracingします|オブジェクトの注釈。
注:光顕微鏡の解像度が限られているため、リストされた項目の下に表示される測定値 分岐の数 と 分岐の数 は、アストロサイトアーバーの複雑さの概算のみを提供します。
- VAA3D で RGB 画像を開きます。イメージ|に移動データ|ジオメトリは次にイメージの再サンプリングを行い、X/Y および Z ボクセル サイズの値を調整します。
結果
胚皮質前駆物質におけるMAGICマーカーのエレクトロポレーションにより、大脳皮質の初期から後期までの天体の標識が可能になります(図1)。これらのアストロサイトは、大脳皮質全体に広く分散した様々な出生後段階(P4、P7、P21)ですべての皮質層で発見された。それらは、20x 0.8 NA(またはそれ以上のNA)目的で取得したタイル化された共焦点画像で評価され、Zスタック再構築として組み立てられた(図2)。MAGICマーカーの組み合わせ標識により、皮質アストロサイトの個別化と、その容積および形態に関する情報の抽出が可能になりました。市販の画像解析ソフトウェアを用いて、個々のアストロサイトの輪郭を共焦点画像スタックの個々の光学部分に分線化し、各アストロサイトが占める領域を分割して再構築した(図3)。同じZ-imageスタックから、シングルアウト皮質アストロサイトの分岐形態を、主なアストロサイトプロセスの骨格の抽出を可能にするオープンアクセスソフトウェアを使用してセグメント化した(図4)。これらのセグメンテーションおよびトレースツールは、出生後初期段階から後期段階14までの個々の皮質アストロサイトに対して発生した領土容積の増加(図3)および形態学的複雑性(図4)の半定量的評価を提供した。これらのアプローチはまた、図2、図3、および図4に示すように、開発の同じ段階で異なる皮質アストロサイトによって表示される体積および形態の不均一性を明らかにした。

図1:脳の発達中に皮質前駆物質とその降下を標識する子宮エレクトロポレーション(IUE)におけるMAGICマーカー(MM)の模式図表()MMツールキットはPB-Cytbow、Tol2-Nucbow、PBおよびTol2トランスポサーゼ、および自己切除性クレコンビナーゼ(seCre)をコードするいくつかのプラスミドから構成される。MMコンストラクトでは、互換性のないロックスサイト(loxN、lox2272、およびloxP)の3組が4つの異なるFPコーディングシーケンス(EBFP2、mTurquoise2/mCerulean、EYFP、tdTomato/mCherry)に隣接し、クレインコンビネーション時に切除の相互排他的な可能性を作り出します。 Cre作用の前に、第1の遺伝子(EBFP2)のみが発現される。セクレによって誘発されるクレ媒介切除後、tdTomato/mCherry(赤色FP)、EYFP(緑色FP)、またはmTurquoise2/mCerulean(シアンFP)のいずれかが発現する。複数のMAGICマーカーコピーからのFPの共同発現は、細胞質(PB-CAG-Cytbow)または細胞核(Tol2-CAG-Nucbow)の標識細胞の色の組み合わせを生み出す。MMカセットをフレーミングするPBおよびTol2転置エンドフィートは、MM構築物がPBおよびTol2トランスポーゼコーディングプラスミドと共に共に共に集結される場合、皮質前駆細胞のゲノムへの統合を可能にする。(B – G)IUE連続したステップの図は、麻酔を行った妊娠マウスの開腹術(B)、胚の側心室におけるMMプラスミドミックス(C)の注入(D)、慎重に配置されたピンセットローデス(E)を介した電気パルスの送達を含む2つの脳半球(F)および妊娠中のマウスの両側の縫合を含む。この図の大きなバージョンを表示するには、ここをクリックしてください。
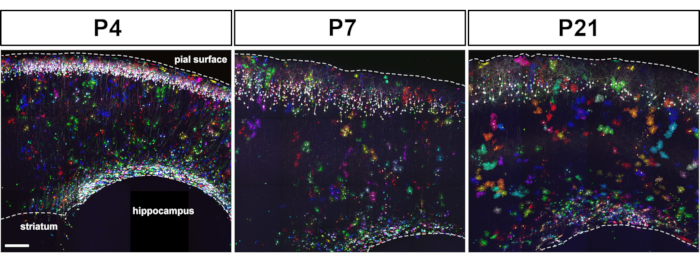
図2:MAGICマーカーツールキットの子宮エレクトロポレーションに続いて、多色アストロサイトが出生後の段階で大脳皮質全体に散在していることが判明した。P4、P7、P21では、マウス皮質前駆物質におけるMM、セクレ、PB、およびTol2トランスポーゼ発現を駆動するプラスミドのIUEが、2~3個のニューロンとアストロサイトの標識をもたらした。発現量とカラーパレットは、皮質前駆細胞のゲノムに組み込まれたMMトランス遺伝子の数に依存していた。80 μmの矢状脳部で獲得したタイル状の共焦点画像スタックからの最大強度投影のモンタージュ。スケールバー:200 μm. この図の大きなバージョンを表示するには、ここをクリックしてください。

図3:異なる発達段階における皮質アストロサイト領域の区分化クロップド共焦点Zスタックフレーミング個々のアストロサイト(A-F)と、商業ソフトウェア(A'-F')でセグメント化された関連する領有領域の最大強度予測:P4(A-B、A'-B')、P7(C-D、C'-D')、P21(E-F、E-F))。スケールバー:20 μm.この図の大きなバージョンを表示するには、ここをクリックしてください。
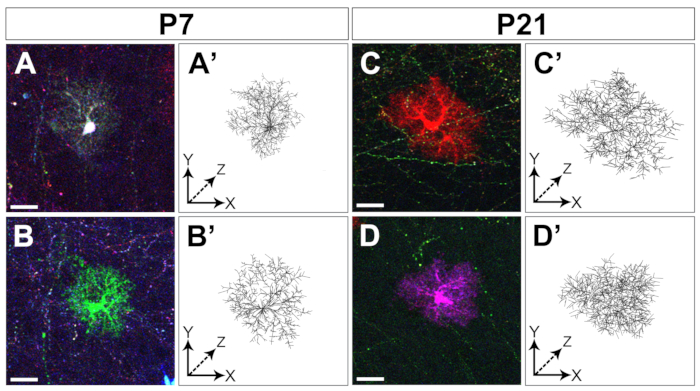
図4:皮質アストロサイトの樹型化のトレース。共焦点Z-スタックから切り取られた2つの異なるアストロサイト(A-D)と、それらの樹状化の再構築の例は、それぞれP7(A-B、A'-B')とP21(C-D、C'-D')の2つの異なる発達段階で収集されたVaa3D(A'-D')で粗くセグメント化された。スケールバー:20 μm.この図の大きなバージョンを表示するには、ここをクリックしてください。
ディスカッション
皮質前駆体中のMAGICマーカーの子宮エレクトロポレーション(IUE)では(図1)出生後異なる段階で出生後大脳皮質全体のアストロサイトの標識が可能になった(P4-P7-P21、図2)。興味深いことに、E13.5からE15.5に行われるエレクトロポレーションは皮質アストロサイト14に関する同様の標識パターンをもたらすので、IUEの段階は重要ではない。しかし、皮質のパレンチマにおける標識された錐体ニューロンの位置は、エレクトロポレーション段階によって変化する。実際、E15で行われたIUEは、層2〜3ニューロンをマークし、E13で行われたIUEは、層5から層2〜36、27まで、すべての皮質層のピラミッド型ニューロンを標識する。MM IUEに続く皮質錐体ニューロンのこの関節標識は、緻密なニューロン標識がアストロサイトプロセス認識を妨げる層におけるアストロサイト形態の半自動セグメンテーションを防ぐので、この方法の主な制限である。問題が発生した場合、MMはPALEのように出生後の段階で電気電解される可能性があります。P4では、その段階でまだ存在する放射状グリア繊維の標識もVaa3Dアーバーセグメンテーションを妨げる可能性がある。面倒ながらも、この段階でアストロサイトアーバー再構成を進めたいなら、Adobe Photoshopを使用して目的のアストロサイトの周りに徐々にラジアルファイバー信号を黒いピクセルで置換して、ラジアルグリア繊維を手動で除去するソリューションです。
この制限にもかかわらず、MM IUEは、適切に実行された場合の強力な技術です。いくつかの重要なステップは注意して処理する必要があります:1)胚は手術手順全体の間に湿気を保ち、生存率を高めるために慎重に操作する必要があります。2)大口径のガラス毛細血管を使用するか、あまりにもしっかりと胚袋を絞ると、袋の破裂、したがって胚の死につながる可能性があります。3)DNA注射中、血管は出血を防ぐために避けなければなりません。4)全体の手順は、胚の生存を最大化するために麻酔から縫合まで40分以上続くべきではありません。5)ストレスはIUEの成功に重要な役割を果たすため、中絶やカニバリズムを防ぐために、ケージ、輸送、騒音、振動などのストレスの余分な原因を手術の5日前から生後7日まで避ける必要があります。
なお、特定の段階で生まれた細胞を特異的に標的化したい実験者は、ピギーバクとTol2トランスポサーゼを添加せずにMMツールキットを使用することができ、エレクトロポレーション時に生まれた細胞だけがコンビナトリアルラベルを発現する。この方法のもう一つの利点は、標識された細胞の密度および様々な脳領域におけるそれらの位置の点で与える柔軟性である。実際、プラスミド比を一定に保ちながらMMトランスジネスの総濃度を増加させることによって、皮質アストロサイトの緻密な標識を達成することができる(Creリコンビナーゼ/MM構築物の1:10比およびトランスポザーゼ/MM構築物の1:2比)。単色トランスポゾンのエレクトロポレーションやAi9マウスのクレポレーションなどのモノクロアプローチとは対照的に、個々のアストロサイトを単一化する能力はまばらな標識を必要とするが、MAGICマーカー戦略によって提供される色コントラストは、幅広い標識密度にわたってアストロサイトの個別化を可能にする。また、電極プローブを異なる向きに配置すると、前向きの線条体(腹側位置の陽節、大脳皮質のエレクトロポレーションを達成するために必要な側側位置とは反対)、または海馬(内側位置の陽極)28などの異なる脳領域を標的とすることが可能になる。最後に、IUEは、異血種(OF1、スイス)および近親交配(C57BL / 6JまたはN)マウスなどの異なるマウス株で行うことができるため、トランスジェニック動物疾患モデルにおけるMMツールキットの使用の道が開かれます。しかし、近血球マウスでIUEを正常に達成するには、パルス数(C57BL/6マウスの3パルス対スイスの5パルス)、電圧(35Vではなく30V)、鎮痛用量(0.15mg/mLブプレノルフィンストック溶液および注入体積0.8μL/g BW)を適応させる必要があります。
トランスジェニック動物の繁殖またはPALEおよびStarTrackアプローチと比較して、この方法はいくつかの利点を提供する。まず、繁殖戦略とは対照的に、動物をほとんど使用しません。また、出生後のエレクトロポレーションに依存するPALE4とは異なり、胚性段階を含む発達の初期段階以降の皮質アストロサイトの標識も可能である。さらに、StarTrackアプローチ8で使用される12のレポーター構築物と比較して、この戦略は2つの多色トランス遺伝子のみに依存するため、DNAミックス調製とイメージングが容易になります。さらに、MMによってストカスト的に発現される異なる色のバランスは、本質的にトランス遺伝子の構造によって決定され、実験者による異なる成分の混合に依存しない。さらに、この戦略は、単純な解剖学的考察を超えて拡張することができ、以前に出版された作品14で示されるように、アストロサイト開発の多重クローナル分析にうまく適用することができます。この研究は、細胞質マーカーと核マーカーの希少な色組み合わせを用いて皮質アストロサイトクローンを定義し、生成細胞の空間分布、構造組織、数、およびサブタイプの点で広範な変動性を示すことを実証した。
MM標識皮質前駆細胞から生まれた皮質アストロサイトは、有意な色コントラストを示し、大脳皮質全体に広く分散した(図2)。共焦点顕微鏡を用いた単純なマルチチャンネルZスタックの取得は、いくつかの出生後の段階で、その領土容積(図3)などの主要なアストロサイト機能(図3)とその形態学的複雑性(図4)にアクセスするために使用された。アストロサイトを超えて、この方法論は、オリゴデンドロサイトのような他のグリア細胞の形態を研究するために適応され得る。しかし、共焦点顕微鏡によって提供される限られた解像度は、アストロサイト形態学的複雑さの部分的なレンダリングしか提供できないということを念頭に置く必要があります。高分解能(例えば、63x 1.4 NA油の目的)とデコンボリューションアルゴリズムで得られた画像は、アストロサイトアーバー14のより細かい細部を再構築するために使用することができますが、最高級のプロセスは、従来の光学イメージングでは解決できません。しかし、ここで提示される戦略は、神経疾患のマウスモデルにおける皮質アストロサイトの体積または形態に影響を与える潜在的な表現型を効率的にスクリーニングすることが興味深いだろう。
開示事項
著者らは開示するものは何もない。
謝辞
S.フーケと、モンペリエ研究所とニューロサイエンス・ド・モンペリエ研究所(MRIおよびRAM)のイメージングおよび動物のコア施設に感謝します。この作品は、レギオン・イル=ド・フランスとフォンダシオンARCのフェローシップが、スラ・レシェルシュ・シュル・ル・ガンをS.Cに注ぎ、パリ・サクレー大学(イニシアチブ・ドクナール・ディスクリネール)からL.A.に支援されました。 欧州研究評議会(ERC-SG 336331、PI J.ヴァレット)からE.H.への資金援助により、ANR-10-LABX-65(LabEx LifeSenses)、ANR-11-EQPX-0029(イキペックス・モルホスコープ2)、ANR-10-IN-04、フォンダシオンは、ラ・レシェルシュ・メディカル(Ref. DBI2014123328)、欧州研究評議会(ERC-CoG 649117、PI J.リベット)、およびATIP-Avenirプログラム(PI K.ルーリエ)を注ぎます。
資料
| Name | Company | Catalog Number | Comments |
| 1.1 Bacteria transformation | |||
| Ampicillin | Euromedex | EU0400-C | |
| DH5 alpha competent cells | Fisher Scientitic | 11563117 | |
| Ice box | Dutscher | 139959 | |
| Kanamycin | Sigma | 60615 | |
| LB Agar | Sigma | L2897 | |
| SOC medium | Fisher Scientitic | 11563117 | |
| Sterile petri dish- 10 cm | Thermo Fisher | 150350 | |
| Water bath | VWR | 462-0556H | |
| 1.2 Plasmid culture | |||
| 14 ml culture tube | Dutscher | 187262 | |
| Glass erlenmeyer- 2L | Fisher Scientitic | 11383454 | |
| LB medium | Sigma | L3522 | |
| 1.3 Plasmid DNA preparation | |||
| NucleoBond Xtra Maxi Plus EF | Macherey-Nagel | 740426.10 | |
| 2.1 Preparation of the solutions | |||
| 26 G x 1/2 needle | Terumo | 8AN2613R1 | |
| 30 G x 1/2 needle | Terumo | 8AN3013R1 | |
| Fast Green | Sigma Aldrich | F7272 | |
| NaCl | VWR | 27810.295 | |
| Single-use polypropylene syringe, 1 mL | Dutscher | 50002 | |
| 2.2 Preparation of the surgery material | |||
| Adson Forceps - DeBakey Pattern- 12.5 cm | FST | 11617-12 | |
| Arched tip Forceps- 10 cm | FST | 11071-10 | |
| Glass bead sterilizer Steri 250 | Sigma | Z378569 | |
| Glass micropipette 1 mm diameter | FHC | 10-10-L | |
| Graefe Forceps - Titanium 1 mm Tips Slight Curve- 10 cm | FST | 11651-10 | |
| Graefe Forceps - Titanium 1 mm Tips Straight- 10 cm | FST | 11650-10 | |
| Iris Scissors - Delicate Straight- 9 cm | FST | 14060-09 | |
| Laboratory tape | Fisher Scientitic | 11730454 | |
| Microinjector | INJECT+MATIC | No catalog number | |
| Olsen-Hegar Needle Holder - 12 cm | FST | 12002-12 | |
| Optical fiber | VWR | 631-1806 | |
| Plastic-coated white paper | Distrimed | 700103 | |
| Signagel electrode gel | Free-Med | 15-60 | |
| Sterile Petri dish- 35 mm | Dutscher | 056714 | |
| Sterilizer, glass dry bead, Steri 250 | Sigma | Z378569 | |
| 2.3 Preparation of the pregnant female mouse | |||
| Alcohol pad | Alcomed | 1731000 | |
| Buprecare | Axience | 0.3 mg/ml | |
| Compress | tRAFFIN | 70189 | |
| Ketamine | Merial | Imalgene 1000 | |
| Ocular gel | tvm lab | Ocry-gel | |
| RjOrl:SWISS mice | Janvier Labs | ||
| Vetadine, 10% solution | Vetoquinol | 4337400113B | |
| Warming pad | Harvard Apparatus | 72-0493 | |
| Xylazine | Bayer | Rompun 2% | |
| 3.2 Electroporation | |||
| Absorbable suture Size 4-0 45 cm Suture 1-Needle 19 mm Length 3/8 Circle Reverse | Novosyn | C0068220 | |
| Electroporateur Sonidel | Sonidel | NEPA 21 | |
| Sterile transfer pipets (individually wrapped) | Dutscher | 043202S | |
| Tweezers with 3 mm platinium disk electrodes | Sonidel | CUY650P3 | |
| 4.1 Tissue harvesting and sectioning | |||
| 24-well plate | Falcon | 353047 | |
| Agarose | Lonza | 50004 | |
| Antigenfix | Microm Microtech | U/P0014 | |
| Coverslip | Dutscher | 100266 | |
| Dolethal | Vetoquinol | DOL202 | |
| DPBS (10X), no calcium, no magnesium | Fisher Scientific | 11540486 | |
| Nail polish | EMS | 72180 | |
| Slide | Dutscher | 100001 | |
| Vectashield | Vectorlabs | H-1000 | |
| Vibratome | Leica | VT1000S | |
| 5. Multichannel confocal imaging | |||
| 20X oil NA 0.85 | Olympus | ||
| Confocal Laser Scanning Microscope | Carl Zeiss | LSM880 | |
| Confocal Laser Scanning Microscope | Olympus | FV1000 | |
| Plan Apochromat 20x/0.8 M27 | Carl Zeiss | ||
| 6. Astrocyte territorial volume segmentation | |||
| IMARIS 8.3 and later versions | Bitplane | ||
| 7. Astrocyte arborization tracing | |||
| 3D Visualization-Assisted Analysis software suite (Vaa3D) | HHMI - Janelia Research Campus /Allen Institute for Brain Science |
参考文献
- Clarke, L. E., Barres, B. A. Emerging roles of astrocytes in neural circuit development. Nature Reviews Neuroscience. 14 (5), 311-321 (2013).
- Ma, Z., Stork, T., Bergles, D. E., Freeman, M. R. Neuromodulators signal through astrocytes to alter neural circuit activity and behaviour. Nature. 539 (7629), 428-432 (2016).
- Blanco-Suárez, E., Caldwell, A. L. M., Allen, N. J. Role of astrocyte-synapse interactions in CNS disorders: Astrocyte-synapse disease. The Journal of Physiology. 595 (6), 1903-1916 (2017).
- Stogsdill, J. A., et al. Astrocytic neuroligins control astrocyte morphogenesis and synaptogenesis. Nature. 551 (7679), 192-197 (2017).
- Srinivasan, R., et al. New Transgenic Mouse Lines for Selectively Targeting Astrocytes and Studying Calcium Signals in Astrocyte Processes in Situ and In Vivo. Neuron. 92 (6), 1181-1195 (2016).
- Tabata, H., Nakajima, K. Efficient in utero gene transfer system to the developing mouse brain using electroporation: visualization of neuronal migration in the developing cortex. Neuroscience. 103 (4), 865-872 (2001).
- Shimogori, T., Ogawa, M. Gene application with in utero electroporation in mouse embryonic brain. Development, Growth & Differentiation. 50 (6), 499-506 (2008).
- García-Marqués, J., López-Mascaraque, L. Clonal Identity Determines Astrocyte Cortical Heterogeneity. Cerebral Cortex. 23 (6), 1463-1472 (2013).
- Martín-López, E., García-Marques, J., Núñez-Llaves, R., López-Mascaraque, L. Clonal Astrocytic Response to Cortical Injury. PLoS ONE. 8 (9), 74039(2013).
- Gutiérrez, Y., et al. Sibling astrocytes share preferential coupling via gap junctions. Glia. 67 (10), 1852-1858 (2019).
- Lee, Y., Messing, A., Su, M., Brenner, M. GFAP promoter elements required for region-specific and astrocyte-specific expression. Glia. 56 (5), 481-493 (2008).
- Yoon, H., Walters, G., Paulsen, A. R., Scarisbrick, I. A. Astrocyte heterogeneity across the brain and spinal cord occurs developmentally, in adulthood and in response to demyelination. PloS One. 12 (7), 0180697(2017).
- Ge, W. P., Miyawaki, A., Gage, F. H., Jan, Y. N., Jan, L. Y. Local generation of glia is a major astrocyte source in postnatal cortex. Nature. 484 (7394), 376-380 (2012).
- Clavreul, S., et al. Cortical astrocytes develop in a plastic manner at both clonal and cellular levels. Nature Communications. 10 (1), 4884(2019).
- Figueres-Oñate, M., García-Marqués, J., López-Mascaraque, L. UbC-StarTrack, a clonal method to target the entire progeny of individual progenitors. Scientific Reports. 6 (1), 33896(2016).
- Figueres-Oñate, M., García-Marqués, J., Pedraza, M., De Carlos, J. A., López-Mascaraque, L. Spatiotemporal analyses of neural lineages after embryonic and postnatal progenitor targeting combining different reporters. Frontiers in Neuroscience. 9, 87(2015).
- Figueres-Oñate, M., Sánchez-Villalón, M., Sánchez-González, R., López-Mascaraque, L. Lineage Tracing and Cell Potential of Postnatal Single Progenitor Cells In Vivo. Stem Cell Reports. 13 (4), 700-712 (2019).
- Peng, H., Ruan, Z., Long, F., Simpson, J. H., Myers, E. W. V3D enables real-time 3D visualization and quantitative analysis of large-scale biological image data sets. Nature Biotechnology. 28 (4), 348-353 (2010).
- Peng, H., Bria, A., Zhou, Z., Iannello, G., Long, F. Extensible visualization and analysis for multidimensional images using Vaa3D. Nature Protocols. 9 (1), 193-208 (2014).
- Peng, H., et al. Virtual finger boosts three-dimensional imaging and microsurgery as well as terabyte volume image visualization and analysis. Nature Communications. 5 (1), 4342(2014).
- Loulier, K., et al. Multiplex Cell and Lineage Tracking with Combinatorial Labels. Neuron. 81 (3), 505-520 (2014).
- Niwa, H., Yamamura, K., Miyazaki, J. Efficient selection for high-expression transfectants with a novel eukaryotic vector. Gene. 108 (2), 193-199 (1991).
- Abdeladim, L., et al. Multicolor multiscale brain imaging with chromatic multiphoton serial microscopy. Nature Communications. 10 (1), 1662(2019).
- Chen, F., LoTurco, J. A method for stable transgenesis of radial glia lineage in rat neocortex by piggyBac mediated transposition. Journal of Neuroscience Methods. 207 (2), 172-180 (2012).
- Siddiqi, F., et al. Fate Mapping by PiggyBac Transposase Reveals That Neocortical GLAST+ Progenitors Generate More Astrocytes Than Nestin+ Progenitors in Rat Neocortex. Cerebral Cortex. 24 (2), 508-520 (2014).
- Yoshida, A., et al. Simultaneous expression of different transgenes in neurons and glia by combining in utero electroporation with the Tol2 transposon-mediated gene transfer system. Genes to Cells. 15 (5), 501-502 (2010).
- LoTurco, J., Manent, J. B., Sidiqi, F. New and Improved Tools for In Utero Electroporation Studies of Developing Cerebral Cortex. Cerebral Cortex. 19, suppl 1 120-125 (2009).
- Pacary, E., et al. Visualization and Genetic Manipulation of Dendrites and Spines in the Mouse Cerebral Cortex and Hippocampus using in utero Electroporation. Journal of Visualized Experiments. (65), e4163(2012).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved